Method Article
In Vitro Колонии Assays Характеризуя Tri-сильнодействующие прогениторных клеток , выделенных из мышиной поджелудочной железы для взрослых
* Эти авторы внесли равный вклад
В этой статье
Резюме
В пробирке колонии анализов для выявления самообновления и дифференцировки клеток - предшественников , выделенных из взрослых мышиных поджелудочной железы разработаны. В этих анализах, панкреатические клетки-предшественники вызывают клеточных колоний в 3-мерном пространстве в метилцеллюлозы, содержащей полутвердой среде. Протоколы для обработки отдельных клеток и определение характеристик отдельных колоний описаны.
Аннотация
Стволовые и клетки-предшественники из взрослых поджелудочной железы может быть потенциальным источником терапевтических бета-подобных клеток для лечения пациентов с сахарным диабетом 1 типа. Тем не менее, до сих пор неизвестно, существуют ли стволовые клетки и клетки-предшественники во взрослой поджелудочной железы. Стратегии исследований с использованием Cre-LOX родословная-трассировку у взрослых мышей, дали результаты, которые поддерживают или опровергают идею, что бета-клетки могут быть получены из каналов, предполагаемого места, где взрослые панкреатические клетки-предшественники могут постоянно находиться. Эти в естественных условиях CRE-LOX LINEAGE-трассировку методы, однако, не может ответить на вопросы самообновлению и мульти-линии дифференцировки дифференциацию двух критериев , необходимых для определения стволовых клеток. Для того, чтобы приступить к решению этого технического разрыва, мы разработали 3-мерные колонии анализов для панкреатических клеток-предшественников. Вскоре после нашей первой публикации, другие лаборатории, независимо друг от друга разработали аналогичный, но не идентичный, метод называется Органоид анализа. По сравнению с Органоид анализа, наш метод используетметилцеллюлоза, которая образует вязкие растворы, которые позволяют включение белков внеклеточного матрикса при низких концентрациях. Метилцеллюлоза, содержащие анализы позволяют более легкого обнаружения и анализа клеток-предшественников на уровне одной клетки, которые имеют решающее значение, когда клетки-предшественники представляют собой небольшую субпопуляцию, как это имеет место для многих взрослых стволовых клеток органа. Вместе результаты нескольких лабораторий демонстрируют в пробирке самообновлению и мульти-клонального дифференциации панкреатических клеток- предшественников-подобных клеток мышей. Существующие протоколы описывают два метилцеллюлозы на основе колонии анализов для характеризации мыши панкреатических клеток-предшественников; одна из них содержит промышленный препарат мышиных белков внеклеточного матрикса, а другой искусственный внеклеточного матрикса белок, известный как ламинин гидрогеля. Методы , представленные здесь , являются : 1) диссоциация поджелудочной железы и сортировки CD133 + Sox9 / EGFP + протоковой клетки из взрослых мышей, 2) манипуляция одноклеточ- сorted клетки, 3) одну колонию анализа с использованием микрожидкостных QRT-PCR и целом монтажа иммуноокрашивания и 4) диссоциации первичных колоний в одноклеточных суспензий и повторное покрытие во вторичные колонии анализов для оценки самообновления или дифференцировки.
Введение
Поджелудочная железа состоит из трех основных клеточных линий; ацинарных клетки секретируют пищеварительные ферменты, протоки секретируют муцин, чтобы парировать патогены и транспортировать пищеварительные ферменты в кишечнике, и эндокринные клетки секретируют гормоны, включая инсулин и глюкагон, которые поддерживают гомеостаз глюкозы. Во время эмбрионального развития поджелудочной железы, ранние протоковой клетки являются источником тримарана сильнодействующим клеток - предшественников , способных привести к трем родословных в поджелудочных желез у взрослых животных 1,2. Потому что взрослые стволовые клетки и клетки - предшественники, такие как стволовые клетки костного мозга, которые уже успешно используются для лечения различных заболеваний 3, есть повышенный интерес в поиске стволовых клеток и клеток - предшественников во взрослой поджелудочной железы. Если изоляция и манипулирование взрослыми панкреатических стволовых клеток и клеток-предшественников, было возможно, эти клетки могут быть использованы для лечения заболеваний, таких как сахарный диабет типа 1, в котором секретирующих инсулин клетки разрушаются аутоиммунной реакцией.
Является ли три- сильнодействующих клетки-предшественники до сих пор существуют у взрослых протоков поджелудочной железы после завершения эмбрионального развития является вопрос, который сильно обсуждается в научном сообществе. В этой дискуссии, и используя в естественных условиях CRE-LOX родословная трассировки методов, Inada и его коллеги показали , что взрослые мышиные протоковой клетки , меченные маркером, карбоангидразы II, может привести ко всем трем панкреатических родословных 4. Тем не менее, с помощью других протоков маркеры, такие как HNF1b 5 и Sox9 2, был сделан вывод о том , что протоковой клетки не являются основным источником бета - клеток у взрослых мышей.
Несколько лет назад, мы предположили , что причиной вышеупомянутой дискуссии может быть связано с отсутствием в области 6,7, соответствующих аналитических инструментов , которые могут быть использованы для измерения самообновление и мульти-родословие дифференцировку два критерия , необходимые для определяют стволовой клетки. В естественных условиях CRE-LOX родословная-трассировку техника упоминалосьвыше может предоставить доказательства взаимосвязи прародитель-потомка на уровне населения. Тем не менее, этот метод трассировки родословная ограничен в его силах, чтобы различить ли отдельные клетки-предшественники могут самообновлению и дифференцировке в множественные клоны. Анализ Одноклеточный важно, потому что если несколько моно-сильнодействующим клетки-предшественники, каждый с разным фамилиям потенциалом, были проанализированы вместе, они могут в совокупности по всей видимости, имеют мульти-клональные дифференциации способностей. Кроме того, стволовые клетки, как правило, незначительная популяция взрослого органа. Деятельность незначительной популяции клеток может быть замаскирован основным населением. Таким образом, отрицательный результат из исследования населения не обязательно указывает на отсутствие стволовых клеток. И, наконец, трассировка CRE-LOX родословная в настоящее время не позволяют измерять самообновлению.
Для того, чтобы приступить к решению технического разрыва в области поджелудочной предшественников клеточной биологии, колонии или 7-11 Органоид 12-15 анализы с использованием 3D-систем культуры были разработаны. Две колонии анализы для панкреатических клеток - предшественников были разработаны в нашей лаборатории: одна из них содержит промышленный препарат мышиных белков внеклеточного матрикса (ECM) (см методы и оборудование таблицу), а другой содержит ламинин гидрогель, определенный искусственный ECM белок 7-11. Клетки-предшественники смешиваются в полу-твердой среде, содержащей метилцеллюлозу. Метилцеллюлоза является биологически инертным и вязкий материал , полученный из древесных волокон, и постоянно используется в гемопоэтические колонии анализов 16. Метилцеллюлозы, содержащей полутвердую среду ограничивает движение отдельных клеток-предшественников, так что они не могут повторно агрегат. Тем не менее, среда достаточно мягким, чтобы позволить клетки-предшественника, чтобы расти и дифференцироваться в колонию клеток в 3D-пространстве. Следуя традициям гематологов, панкреатический клеток-предшественников, которые были способны дать начало колонии клеток была пAMED панкреатический колониеобразующих единицы (PCFU). PCFUs, при выращивании в анализе колонии мышиного ECM-содержащие, приводят к кистозной колоний, которые называются "Кольцо" 7 колоний. При добавлении агониста Wnt, R-spondin1, в мышиной ECM-содержащие культуры, некоторые колонии кольца превращаются в "Плотная" колонии 7. В этой статье, эти два типа колоний, выращенных в мышиной ECM культуры совместно именуются как "Ring / Плотные" колоний. Когда кольцо / Плотные колонии диссоциируют на одной клеточной суспензии и повторно высевали в культурах, содержащих ламинина гидрогель, "Эндокринные / Железистый" колонии образуются 7.
Используя одну колонию анализа, было установлено , что большинство Ring / Плотные и эндокринная / ацинарными колоний, либо из взрослых (2-4 месяца назад) 7,11 или молодой (1-недельных) 9 мышиной поджелудочной железы, выразить все три линии преемственности маркеров. Это говорит о том, что большинство происходящих PCFUs являются три-сильнодействующим, В анализе колонии мышиного ECM-содержащий, взрослый мышиный PCFUs робастно самообновлению и расширить примерно 500000 раз за 11 недель в культуре 7. Мышиные ECM преимущественно поддерживает дифференциацию клеток протоков над эндокринных и ацинарных родословных, в то время как в присутствии ламинина гидрогеля, мышиные PCFUs предлагается дифференцировать преимущественно в эндокринных и ацинарных клеток и в меньшей степени к протоковой линии 7,9,11. Важно отметить, что инсулин + Глюкагон - моно-гормональный клетки образуются в ламининовым гидрогеля культуры и секреции инсулина в ответ на глюкозу стимуляции в пробирке 7,9, предполагая функциональную зрелость. Дифференциация три- родословная потенциал и 7,9 самообновление 11 индивидуальных PCFUs подтверждаются одноклеточного микроманипуляций, т.е. культивировании одну клетку на лунку для образования колоний. Вместе эти результаты свидетельствуют о том, что существуют самообновлению, три-POTENт, прогениторные-подобные клетки в послеродовом мышиной поджелудочной железы, которые показывают деятельность в 3D культуры.
Мышиные PCFU анализов , описанных в этой статье , получены из анализа предварительного колонии , предназначенной для клеток - предшественников дифференцируются из мышиных эмбриональных стволовых клеток (mESCs) 17. Этот протокол подробно задокументированы в другой публикации Jove 18. Компоненты и методы , необходимые для выполнения мышиный ECM-содержащий анализ колонии для взрослых PCFUs культуры такие же , как для MESC-производных клеток - предшественников 17,18. Таким образом, не будет повторяться здесь эти аспекты анализа; вместо того, чтобы следующие процедуры будут рассмотрены: 1) диссоциация взрослого поджелудочной железы и сортировки CD133 + Sox9 / EGFP + протоков клетки, которые обогащают PCFUs от взрослых мышей 7, 2) манипуляции с одноклеточного отсортированного клеток, 3) одной колонии анализ с использованием микрожидкостных QRT-PCR и целом монтажа иммуноокрашивания и 4) диссоциации Colonies в суспензию одноклеточных и повторно металлизированный в мышиной ECM или ламинина гидрогель колонии анализов.
протокол
Этическое заявление: Мы придерживаемся общепринятых этических норм при проведении исследований с целью обеспечения качества и целостности результатов. экспериментирование животных проводится в соответствии с протоколами, утвержденными Institutional уходу и использованию животных комитета в городе Хоуп.
1. Подготовить одноклеточные подвески от взрослых мышиных поджелудочных желез
Примечание: В предыдущих публикациях 7,11, использовались CD-1 или B6 фоновых мышей; оба фона дали сходные результаты. Трансгенное линии мыши (обозначенный Sox9 / EGFP) с улучшенным зеленым флуоресцентным белком движимый Sox9 локусы 19,20, был создан в фоновом режиме CD-1.
- Эвтаназии от 3 до 5 взрослых мышей с использованием газообразного СО 2 в течение 1-2 мин или до остановки дыхания. Затем выполняют шейки дислокации на каждой мыши.
- Проанализируйте и Готовят поджелудочных желез.
Примечание: Рассеките мышей как можно скорее после эвтаназии. Это важно, чтобы избежать автоматического пищеварения поджелудочной железы из-зак изменениям посмертных.- Сделайте вертикальный разрез по средней линии брюшной стенки мыши с помощью ножниц и откройте брюшной полости. Найти селезенку и использовать пинцет, чтобы осторожно поднимите его. Разрежьте соединительную ткань между селезенкой и селезеночной доли поджелудочной железы с помощью ножниц.
- Повторите эту практику для желудка и двенадцатиперстной долей поджелудочной железы. Поместите панкреатические ткани в чашке Петри на льду, содержащей модифицированный раствор холодной Дульбекко фосфатного буфера (ДЗФР), 0,1% бычьего сывороточного альбумина (БСА), и пенициллин и стрептомицин (P / S; комплексное решение обозначается как PBS / БСА).
- Удалить жировые ткани из поджелудочной железы под рассекает микроскопом с помощью тонкой кончик пинцетом.
ПРИМЕЧАНИЕ: Это очень важно для здоровья диссоциированных клеток поджелудочной железы в следующих шагах.- (Необязательно) Проверьте поджелудочных желез для зеленой флуоресценции под флуоресцентным стереомикроскопа с использованием 488-509 нм возбуждение, чтобы обеспечитьEGFP выражение.
- В капот культуре ткани, полоскание ткани, трижды, в трех 100 мм чашки Петри, содержащие 10 мл холодного PBS / БСА.
- Сделайте вертикальный разрез по средней линии брюшной стенки мыши с помощью ножниц и откройте брюшной полости. Найти селезенку и использовать пинцет, чтобы осторожно поднимите его. Разрежьте соединительную ткань между селезенкой и селезеночной доли поджелудочной железы с помощью ножниц.
- Сформировать небольшие кусочки ткани.
- Передача расчлененный поджелудочных желез на сухую стерильную чашку Петри, чтобы удалить как можно больше PBS / БСА, насколько это возможно, и перенести их на другой сухой чашке Петри на льду.
- Подготовьте PBS / BSA, содержащий ДНКазы I путем добавления 2 мкл ДНКазы I исходного раствора (1 миллион единиц [MU] / мл) на 1 мл PBS / BSA.
Примечание: Это решение предназначено PBS / БСА / ДНКазы I. Сделать ~ 200 мл этого раствора сразу, который будет охватывать один эксперимент сортировки. - Фарш поджелудочных желез с помощью пружинных ножниц в течение 2-3 мин или пока ткань в мелкие кусочки. Добавить 2-3 мл холодного PBS / БСА / ДНКазы I на кусочки ткани в чашке Петри, чтобы приостановить их.
- Перенесите куски ткани на коническую пробирку емкостью 50 мл, на льду с 10 мл пипетки. Довести общий объем до 10 мл PBS / BSA / ДНКазы л после восстановления как можно больше ткани, как это возможно.
- Дайджест панкреатического пьесы в основном одиночные клетки.
- Добавить коллагеназы B (100 мг / мл маточного) при 350-450 мкл / 10 мл на кусочки ткани и инкубировать ткани при 37 ° С в водяной бане в течение 8 мин, закрученного через каждые 3-4 мин. Используйте 10 мл шприц с иглой 16 G ½, чтобы разработать и затем распылить раствор ткани вниз стенки 50 мл трубки при комнатной температуре. Повторите это семь раз.
Примечание: Используйте достаточно силы, чтобы разбить кластеры клеток, но избежать образования пузырьков, которые могут убить клетки. - Возврат трубки на водяной бане при температуре 37 ° С в течение 8 минут и перемешать с помощью закрученного каждые 3-4 мин. Шприц ткани вверх и вниз в семь раз, как упоминалось выше, и помещают образец (10 мкл) раствора ткани на сухой чашке Петри. Обратите внимание на решение ткани под инвертированным, фазового контраста, световой микроскоп с 10-кратным объективом. Ожидать отдельные клетки и некоторые малогабаритный грELL кластеры присутствовать.
- Обрабатывать клетки на льду с этого момента, чтобы замедлить или остановить активность коллагеназы. Отрегулируйте громкость до 50 мл с использованием холодного PBS / BSA / ДНКазы I. Центрифуга клетки при 400 мкг в течение 5 мин при 4 ° С и ресуспендируют в 5 мл холодного PBS / БСА / ДНКазы I с использованием P1000 дозаторов.
- Добавить коллагеназы B (100 мг / мл маточного) при 350-450 мкл / 10 мл на кусочки ткани и инкубировать ткани при 37 ° С в водяной бане в течение 8 мин, закрученного через каждые 3-4 мин. Используйте 10 мл шприц с иглой 16 G ½, чтобы разработать и затем распылить раствор ткани вниз стенки 50 мл трубки при комнатной температуре. Повторите это семь раз.
- Фильтр для Выход одноклеточных суспензий и мыть.
- Фильтр клетки через 70 мкм нейлоновый сетчатый фильтр в чашку, а затем через 40 мкм нейлоновый сетчатый фильтр в чашку.
- Ресуспендируют клетки в 5 мл холодного PBS / БСА / ДНКазы I и подсчет клеток.
ПРИМЕЧАНИЕ: Для 2-4 месячных В6 или мышей CD-1, каждая из поджелудочной железы может дать ~ 5 или 10 миллионов клеток, соответственно. Эти цифры могут меняться в зависимости от различных экспериментаторов. Если чрезмерное остатков клеток обнаруживается при подсчете, довести объем до 50 мл холодного PBS / БСА / ДНКазы I и центрифугировать клетки при 400 мкг в течение 5 мин при температуре 4 ° С. - Регулировка громкости клеточной суспензии в концентрации 2 х 107 клеток / мл с использованием холодного PBS / БСА / ДНКазы I.
2. Сортировка клеток к Пополните поджелудочной колониеобразующих прародителей
Примечание: Из мышей В6, CD133 + , но не CD133 - клетки обогащены PCFUs 7,9,11. CD133 + клетки представляют ~ 13% от общего количества диссоциированных клеток поджелудочной железы после того, как все параметры стробирования применяются 11. Из CD-1 мышей, CD133 + Sox9-EGFP + клетки обычно представляют ~ 4% от общего количества клеток поджелудочной железы, и эта популяция клеток обогащена PCFUs 7. Сортировка / EGFP + клеток CD133 + Sox9 описано здесь.
- Пятно клетки Диссошиэйтед поджелудочной.
- Блокировать всю панкреатический подвеску одного элемента для уменьшения неспецифического связывания путем инкубирования приостановку одноклеточного с анти-CD16 мыши / 32 в количестве 10 мкг / мл конечной концентрации в течение 5 минут на льду.
- Удалить аликвоты 1 × 10 6 клеток (50 &# 181; л), чтобы окрасить с контрольным антителом изотипа, биотин-конъюгированные IgG1 крысы при концентрации 5 мкг / мл конечной концентрации, в течение 20 мин на льду, закрученного каждые 5-7 мин.
- Удалить аликвоту 1 х 10 6 клеток (50 мкл) и держать на льду в качестве неокрашенной контроля.
- Пятно оставшуюся часть клеток с биотин-конъюгированными анти-мышиного CD133 первичным антителом, при концентрации 5 мкг / мл конечной концентрации, в течение 20 мин на льду, закрученного каждые 5-7 мин.
- Стиральные клетки.
- Вымойте контроль изотипа и первичные образцы антител окрашенных путем доведения объема до 1 мл PBS / БСА / ДНКазы I и центрифуге при 400 мкг в течение 5 мин при 4 ° С. Повторите этот шаг стирки.
- Ресуспендируют контроль изотипа и первичные образцы антител окрашенных в PBS / БСА / ДНКазы I, так что конечная концентрация составляет 2 х 10 7 клеток / мл.
- Пятно контроль изотипа и первичные образцы антител окрашенных с стрептавидином (СТВ) меченных аллофикоцианин (APC) на 2 & #181 г / мл конечная концентрация. Инкубировать в течение 15 мин на льду, закрученного каждые 5-7 мин.
- Промывка ячеек и 4 ', 6-диамидино-2-фенилиндола (DAPI) окрашивание.
- Вымойте контроль изотипа и первичные образцы антител окрашенных в два раза с PBS / БСА / ДНКазы I, как и в шаге 2.2. Ресуспендируют клеток в PBS / БСА / ДНКазы I с использованием DAPI (0,2 мкг / мл конечной концентрации). Конечный объем образца контрольного изотипа должен составлять 0,5 мл.
ПРИМЕЧАНИЕ: Убедитесь в том, что конечная плотность первичного образца антитела окрашивали подходит для сортировщик для использования. В концентрации 5 × 10 6 клеток / мл обычно используется для сортировки. - Регулировка громкости неокрашенных клеток на 0,5 мл с PBS / БСА / PS / ДНКазы I. Фильтр все клетки через сито 20 мкм до сортировки и сохранить клетки на льду в темноте.
- Вымойте контроль изотипа и первичные образцы антител окрашенных в два раза с PBS / БСА / ДНКазы I, как и в шаге 2.2. Ресуспендируют клеток в PBS / БСА / ДНКазы I с использованием DAPI (0,2 мкг / мл конечной концентрации). Конечный объем образца контрольного изотипа должен составлять 0,5 мл.
- Сортировка клеток.
- Используйте сопло 80 мкм или больше для сортировки.
ПРИМЕЧАНИЕ: Мышиные панкреатических эндокринные клетки склонны к физическим нагрузкам. эйWever, мышиные PCFUs не по всей видимости, зависит от стресса , вызванного проходя через сортировщик 7. - Приобретать события ячейки и параметры анализа на сортировщик. Ворота ячейки для прямого и бокового рассеяния области , чтобы исключить остатков клеток 7. Ворота для ширины переднего и бокового рассеяния для исключения клеточных дублеты. Ворота , чтобы исключить DAPI + мертвые клетки 7. Выберите стробирования параметры для сигналов EGFP и CD133-APC на основе значений из контрольных изотипическим клеток (рисунок 1).
- Сбор отсортированных клеток в 5 мл полистирольные пробирки, содержащие 1,5 мл DMEM / F12, дополненной 5% фетальной сыворотки теленка (FCS). Центрифуга отсортированные популяции при 400 мкг в течение 5 мин и ресуспендируют в небольшом объеме (~ 200 мкл), либо DMEM / F12 или PBS / БСА / ДНКазы I с добавлением 5% FCS. Держите клетки на льду до использования.
- Используйте сопло 80 мкм или больше для сортировки.
- Подсчитайте количество клеток CD133 + Sox9-EGFP + , полученных из сортировщика. принимать10 мкл пробы клеток и подсчета клеток с гемоцитометра, чтобы определить плотность клеток.
Примечание: использование гематоцитометре рекомендуется, так как машина ведет отсчет от сортировщика часто ненадежны.
3. Тарелка отсортированного клеток в колонии Пробирной Содержащие мышиных белков ЕСМ
Примечание: Пожалуйста , обратитесь к подробным протоколам для покрытия клеток в анализе колонии мышиного ECM-содержащий в другой публикации Jove 18.
- Приготовьте медиакультуры.
- Подготовка культуральной среды, содержащей DMEM / F12, 1% (вес / объем) метилцеллюлоза, 5% (об / об) мышиных белков ЕСМ, 50% (об / об) кондиционированной среде от МЕСК полученных из панкреатических-подобных клеток, 5% (об / об) FCS, 10 ммоль / л никотинамида, 10 нг / мл человеческого рекомбинантного активин В, 0,1 нмоль / л эксендина-4, и 1 нг / мл сосудистый эндотелиальный фактор роста-а. Способы получения кондиционированной среды подробно описаны в другом месте 18.
- Добавить 750 нг / мл RSPO-1 к средеесли образование Плотные колонии желательно.
- Выдержите в мышиную культуру ЕСМ белка при температуре 37 ° С и 5% СО 2 в течение 3 -х недель.
4. Культура отсортированного Клетки в 1 клеток на лунку
Примечание: Следующие процедуры применяются к манипуляции отдельных клеток с помощью рук и рта пипеток. Альтернативный подход заключается в покупке микроманипулятора. Типичная микроманипулятор включает инвертированный микроскоп с джойстиком управлением, моторизованной платформы.
- Подготовить стекло пипетки Пастера.
- С помощью горелки Бунзена, вытянуть кончик стеклянной пипетки Пастера к кончику (~ 30 мкм при открытии). Стеклянные пипетки Пастера должны иметь хлопковую пробку, чтобы создать барьер для воздушного потока от оператора.
- Автоклав Flamed пипеток стекла Пастера при 121 ° С в течение 20 мин для стерилизации.
- Подготовка 96-луночные планшеты для культуры.
- Приготовьте холодный полутвердой согласие культуральной средыИнг ранее описанному протоколу 18.
- Разливают среду во внутренние лунки низкого связывающего с плоским дном 96-луночного планшета в количестве 100 мкл / лунку с использованием 1 мл шприца. Заполните внешние лунки стерильной водой для поддержания влажности.
- Поместите культуры блюдо на льду до использования.
- Приготовьте отсортированного клетки.
- Добавить ~ 6000 клеток, собранных из сортировщика до 2,5 мл конечного объема DMEM / F12 / PS, содержащей 10% FCS и 1% метилцеллюлозы в 5 мл полистирола трубки. Встряхивать смешать компоненты. Подождите в течение 5 минут или пока пузырьки всплывают на верхней части трубки. Этот шаг не должен выполняться на льду.
- Разливают раствора клеточного до двух 35-мм чашках в количестве 1 мл / чашку с использованием 1 мл шприц с иглой 18 G ½.
- Распределите раствор клеток в блюдо, осторожно покачивая блюдо вручную. Не допускать полутвердый среда для достижения запас 35 мм блюдо, как отдельные клетки на краю Cann скважиныВЗ наблюдать ясно с использованием инвертированного светового микроскопа.
- Подготовьте рабочую область вокруг микроскопа.
- Приготовьте раствор, содержащий DMEM / F-12 среду, и 1% метилцеллюлозы без каких-либо клеток (среда "в настоящее время не-элементный '), и поместили полученный раствор (как описано в разделе 4.3.2) на две 35-мм чашки Петри (1 мл на чашку) ,
- Очистите и протереть рабочую зону вокруг перевернутой фазового контрастного микроскопа с 70% -ным раствором спирта.
- Соберите пипетка с гути.
- Возьмите стерильную стеклянную пипетку Пастера, который был подготовлен в шаге 4.1. Приложить большой конец 1 мл пластикового наконечника пипетки к верхней части стеклянной пипетки Пастера. Закрепить малый конец 1 мл пластикового наконечника пипетки к одному концу тонкостенной резиновой трубкой и мундштуком на другом конце трубы. Используйте ту же стеклянную пипетку для получения нескольких ячеек той же группы.
- Оформите, путем всасывания рта, небольшой объем (~ 10 до 50 мкл)"Не-клетка" полутвердый раствор на шаге 4.4.1 со стеклянной пипетки Пастера.
ПРИМЕЧАНИЕ: полутвердый раствор в узкое отверстие стеклянной пипетки Пастера создает сопротивление потоку и обеспечивает барьер для предотвращения загрязнения клеток ковыряться.
- Выберите одну ячейку.
- Поместите 35 мм блюдо, содержащее отсортированных клеток на столике микроскопа и снимите крышку.
- Найти клетки, используя 10х объектив и фокус на подходящую клетку, чтобы быть выбранным.
- Найдите и поместите отверстие наконечника пипетки рядом с клеткой, представляющей интерес. Применяют отсасывание через рот.
Примечание: Движение клетки должно быть достаточно медленным, так что не существует никакого риска потерять клетки в процессе последующего. Движение клетки, поступающего в отверстие пипетки должны быть видны. Если поток движется слишком быстро, чтобы изменить пипеткой с более узким отверстием.
- Депозит одной клетки в лунке с культурой.
- После того, как ячейка находится в пипетку, использовать язык, чтобы остановить поток, блокируя отверстие рта кусок. короткую паузу до снятия наконечника с полутвердой среде, чтобы гарантировать, что полутвердый среда прекратила течь.
- Поместите кончик пипетки в колодец в 96-луночный планшет, полученного на стадии 4.2. Нажмите на ячейку медленно, осторожно дует в рот кусок. Марк хорошо после того, как клетка осаждается, чтобы избежать металлизированный две ячейки в скважину.
- Убедитесь в том, что одна ячейка помещена в лунке с культурой.
- Поместите кончик пипетки в «не-клетки» среде, приготовленной на этапе 4.4.1. Наблюдая отверстие наконечника под микроскопом, вытолкнуть оставшуюся полу-твердого раствора. Ожидать никакая клетка не вытекать из кончика пипетки.
- Перепроверить, найти место в культуре скважины, где была пересажена единичную ячейку.
- Культура отдельные клетки при 37 ° С в 5% CO 2 в течениедо 3-х недель.
5. Выберите из отдельных колоний Полу-твердое тело культуры для анализа Микрожидкостных QRT-PCR
Примечание: Через три недели после того, как металлизированный сортируется CD133 + Sox9 / EGFP + клеток в колонии анализа мышиного ECM-содержащие, кольцо или Плотные колонии образуются 7 (рисунок 2). Когда кольцо / Плотные колонии диссоциируют на одной клеточной суспензии и повторно высевали в ламининовым гидрогеля культуры, Эндокринные / Железистый колонии формируются приблизительно через одну неделю 7 (рисунок 2). Для того, чтобы определить , родословная состав каждой колонии, Микрожидкостных анализ QRT-ПЦР используют для определения экспрессии маркеров линии дифференцировки 7. Для предварительной амплификации, колонией смешивают в мастер - смеси , содержащей зонд смесь TaqMan, реакционного буфера, и выносные III 21. Чип 48.48 массив впоследствии используется для микрофлюидальных ПЦР - реакций 21.
- Подготовка предварительной ПЦР-амплификациисмесь, содержащую 48 зондов.
- Пипетка 1,5 мкл каждого зонда TaqMan (20x поголовье) в 1,5 мл трубки. Добавить 78 мкл ТЕ-буфера для регулировки громкости до 150 мкл.
- Подготовка мастер - микс, следуя протоколам от производителя 21.
- Поместите 9 мкл мастер смеси в 0,2 мл каждого тонкостенный реакционной трубки, подходящие для ПЦР, и повторить этот шаг до 48 трубок.
- Собрали одну из колоний полутвердой культуры.
Примечание: Кольцо / Плотные колонии больше , чем Эндокринные / ацинарными колоний, диаметром от ~ 50 до 400 мкм 9,11. Таким образом, с одним кольцом / Плотные колонии собирают с помощью P10 дозаторов снабжен оборудованием с 10 мкл кончика пипетки, который согнут в криволинейной форме. Для получения небольшой эндокринные / Железистый колонии (рисунок 2), обратитесь к шагу 4.- Найдите колонию интерес при большом увеличении (например, 20X линзы объектива), уменьшить масштаб, и aspiratе колонию. (Необязательно) Возьмите фазового контраста изображения колонии на данном этапе, чтобы документировать видимые характеристики колонии.
- Перенести колонию в ПЦР-пробирку, содержащую 9 мкл мастер смеси.
- Выберите следующую колонию. До 45 колоний в общей сложности могут быть проанализированы в ПЦР перспективе, оставляя 3 места для контроля.
- Выделение РНК и синтез кДНК с предварительной амплификации.
- Vortex образцы энергично перед проведением термической реакции.
- Выполните реакции Амплифицируйте в соответствии с инструкциями изготовителя 21. Ring / Плотные колонии требуют 14 циклов, Эндокринные / Железистый колонии требуют 16-20 циклов, а также отдельные клетки требуют 22 циклов.
Примечание: Предварительное усиление кДНК можно хранить при -20 ° С перед микрожидком ПЦР-анализа.
- Выполнение последующих ПЦР - реакций с использованием микрожидком микросхемы, в соответствии с инструкциями изготовителя 21.
- Урожай и Fix колониями.
- Возьмите колонии под микроскопом, как и в пунктах 4 или 5.4, и добавить их к 4% -ного раствора параформальдегида. Выдержите O / N при температуре 4 ° С при осторожном встряхивании.
- Вымойте колонии с 1X PBS дважды в течение 10-30 мин при комнатной температуре. Хранить неподвижные колонии при температуре 4 ° С в 1,5 мл пробирки запечатанных парафином.
- Пятно Колонии с антителами.
- Передача колоний одну лунку 96-луночного черной пластины с прозрачным дном, содержащей 200 мкл блокирующего буфера (5% осла и / или козьей сывороткой, 0,1% Тритон Х-100 в 1x PBS). Выдержите O / N при температуре 4 ° С при осторожном встряхивании.
- Развести первичное антитело к заранее определенной концентрации (например, 1: 500 для хомяка анти-муцин 1 антитело) с использованием блокирующего буфера. Передача колоний на чистую хорошо с 200 мкл первичного антитела и инкубировать O / N при температуре 4 ° С при осторожном встряхивании. Wпепел колониям 3 раза ФБР, содержащим 0,1% Tween 20. Передача колониям в новую лунку с 200 мкл 1х PBS / 0,1% Tween 20 в течение 10 мин при комнатной температуре в течение каждой стирки.
- Разведите вторичные антитела к заранее определенной концентрации (например, 1: 2000 для козьего антиармянскому хомячка антитела) с использованием блокирующего буфера. Храните раствор в темноте. Перенесите колонии для очистки лунки, содержащие 200 мкл вторичного антитела, и инкубируют в течение 2 ч при комнатной температуре. Промыть колониям 3 раза PBS / 0,1% твин-20, как на этапе 6.2.2.
- Встречное окрашивают колонии с DAPI и визуализации с конфокальной микроскопии.
- Передача колоний в лунках с PBS, содержащий 300 нМ DAPI и инкубировать в течение 5 мин при комнатной температуре.
- Передача DAPI-окрашенных колоний на 35 мм со стеклянным дном чашки Петри для визуализации. Поместите крышку скольжения поверх колоний, чтобы предотвратить испарение.
- С помощью конфокальной микроскопии для захвата изображения. Для визуализации DAPI staininг, используют двухфотонную длину волны возбуждения 730-950 нм. Использование аргонового лазера с длиной волны 458 нм для возбуждения флуорохромии с длинами волн излучения 519 и 561 нм. Используйте гелий-неоновый лазер с длиной волны 633 нм для возбуждения флуорохромии с длиной волны излучения 665 нм.
7. диссоциируют и Re-пластины первичного кольца / Плотные Колонии в вторичных колоний Assays
Примечание: Все процедуры должны выполняться в стерильных условиях. Избегайте холодового шока к клеткам в этой процедуре как можно больше, например, поставив клетки на льду или промывки клеток с холодным PBS / BSA. Такая практика снижают жизнеспособность повторно высевают клеток.
- Подготовка решения.
- Предварительно теплый промывочный буфер (DMEM / F12, P / S; 0,1% БСА) на водяной бане 37 ° C.
- Предварительно нагреть 96-луночного планшета (плоский нижний, низкий связывание) в 37 ° С инкубатор. Добавьте 100 мкл 100% FCS в одну лунку планшета и 100 мкл 0,25% раствора трипсина-ЭДТА в секундуЧто ж.
- Сбор колоний.
- Комплектование и бассейн в общей сложности 20 или более кольца / Плотные колонии в первичных культурах с использованием 10 мкл наконечников, как описано в пункте 5.4.
- Поместите колонии в теплой (по крайней мере, RT) промывочного буфера (~ 1000 мкл) в 1,5 мл трубки и спина при 400 х г в течение 5 мин. Удалить супернатант.
- Диссоциируют Колонии Into подвесов одноклеточные Использование трипсина.
- Переносят оставшийся объем (20 мкл или меньше), который содержит колонии, в колодец, который содержит теплый раствор трипсина (полученного в 7.1).
- Инкубируйте планшет в инкубаторе C 37 ° (а не водяной бане) в течение 1,5 мин. Снимите пластину и пипетки колоний в несколько раз. Инкубируют при 37 ° С в течение еще 1,5 мин.
- Снимите пластину и пипетки вверх и вниз несколько раз больше, чтобы разбить колонии. Проверьте под микроскопом, чтобы увидеть, были ли эти колонии были разогнаны преимущественно в одной клеточной суспензии.Избегайте чрезмерной переваривание колоний.
- Остановить реакцию трипсин путем добавления FCS.
- Передача 100 мкл теплой FCS в колодец, который содержит клетки. Пипетка вверх и вниз несколько раз. Передача клеток в 1,5 мл пробирку, содержащую 1,000 мкл теплой промывочного буфера. Центрифуга при 400 мкг в течение 5 мин при комнатной температуре.
- Промыть дважды с теплым буфером.
- Повторное приостановить клеток в ~ 200 мкл буферного раствора или культуральной среды.
- Подсчитайте число клеток с использованием гемоцитометра. Держите клеточной суспензии при комнатной температуре.
- Повторно пластины диссоциируют клеток во вторичные колониеобразующих анализы , содержащие либо мышиным белкам ЕСМ (5% об / об) или ламинин гидрогель (100 мкг / мл) и инкубируют клетки при 37 ° С с 5% CO 2.
Примечание: Для повторного посева клеток в мышиных белков ЕСМ, использовать 2500-5000 клеток на лунку и культуры в течение 2-3 недель. Для повторной стием в ламининовым гидрогеля культуры, использовать 10,000-25,000 клеток на лунку и культуре в течение 7-12 дней.
Результаты
Взрослые панкреатические клетки - предшественники могут быть обогащены с помощью флуоресцентной активированный сортировки клеток (рисунок 1). Линия трансгенной мыши Sox9 / EGFP , используемый здесь , был впервые генерироваться в результате GENSAT Brain Atlas Project 19, а EGFP репортер находится под контролем бактериальной искусственной хромосомы , содержащей ~ 75 т.п.н. слева и ~ 150 кб ниже по течению последовательности Sox9 20 , У этих мышей , EGFP эффективно и специфически 22 этикетки панкреатических протоков. Поджелудочная было закуплено и диссоциированных в одной клеточной суспензии и окрашивали анти-CD133 антител, конъюгированных с биотином, с последующим окрашиванием вторичными антителами, конъюгированными с STV-APC. Полученные клетки анализировали с помощью проточной цитометрии с соответствующими параметрами стробирующих (рисунок 1). Клетки, полученные с использованием различных параметров литниковых могут быть отсортированы и высевали в метилцеллюлозы, содержащих колонии анализахобразование колоний. В предыдущих исследованиях было отмечено , что формирование способности колонии можно найти только в отсортированном CD133 + Sox9 / EGFP + протоковых клеток 7.
Колонии , образовавшиеся в метилцеллюлозы , содержащих колонии анализов были классифицированы в соответствии с их морфологией, как это наблюдалось с использованием инвертированного, фазового контраста, светового микроскопа (рисунок 2). Впоследствии отдельные колонии были вручную и анализировали с помощью анализа микрожидком QRT-PCR для экспрессии генов (рис 3) , или в целом смонтировать иммунным для экспрессии белка (рис 4). В опубликованных исследованиях 7,9,11, было обнаружено , что многие отдельные колонии выражены маркеры клональные для трубы (муцин-1), ацинозной (амилазы) и эндокринных (инсулин) клеток, что указывает на то , что большинство из инициирующих PCFUs для этих колоний три-сильным. Доля трех клеточных клонов в каждой колонии Однако, под влиянием типов и концентраций ECM белков , присутствующих в метилцеллюлозы , содержащих колонии анализах 7,9. Мышиные ECM белки стимулируются самообновление PCFUs и протоковой дифференцировки клеток , тогда как ламининовым гидрогеля предпочтительно поддерживается дифференцировку эндокринных и ацинарных клеточных клонов 7,9,11.
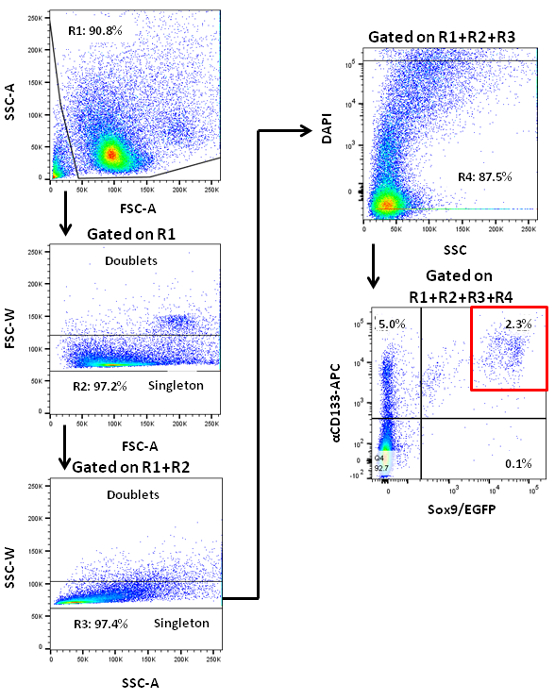
Рисунок 1. Проточная цитометрия анализ диссоциированных клеток поджелудочной железы от взрослых мышей , показывающих образцы окрашивания по двум протоковых клеточных маркеров, CD133 и Sox9. Sox9 / EGFP трансгенных мышей , которая содержала Sox9 локусы управляемых EGFP репортер были использованы. Представитель ворота сортировки (красная коробка) для поджелудочной железы CD133 + / EGFP + клеток Sox9 показано. / EGFP + клетки CD133 + Sox9 обогащены PCFUs 7.ле / ftp_upload / 54016 / 54016fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
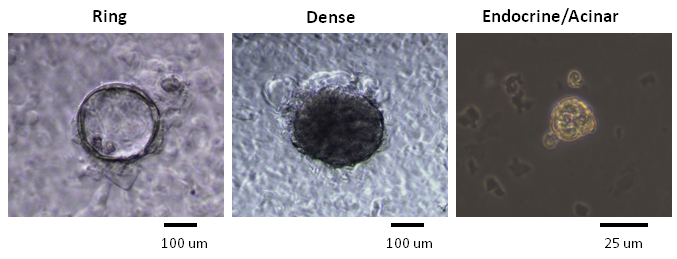
Генерировались Рисунок 2. Колонии с различными морфологией в метилцеллюлозы , содержащих колонии анализов. Представительные микрофотографии кольца, Плотные и эндокринная / Железистый колонии от фазового контрастного микроскопа , освещенного видимым светом показаны. Кольцо и Плотные колонии образуются при свеже отсортированные PCFUs высевают в питательной среде , содержащей мышиных белков ЕСМ и культивировали в течение 3 -х недель 7. Эндокринные / Железистый колонии образуются после повторного посева диссоциированной кольцо или сжатая колониеобразующих клеток в культуральной среде , содержащей ламинина гидрогель и культивировали в течение ~ 1 неделя 7. Масштабные шестов для кольца и плотных колоний = 100 мкм. Шкала бар для Эндо / ацинарными колоний = 25 мкм; м . Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
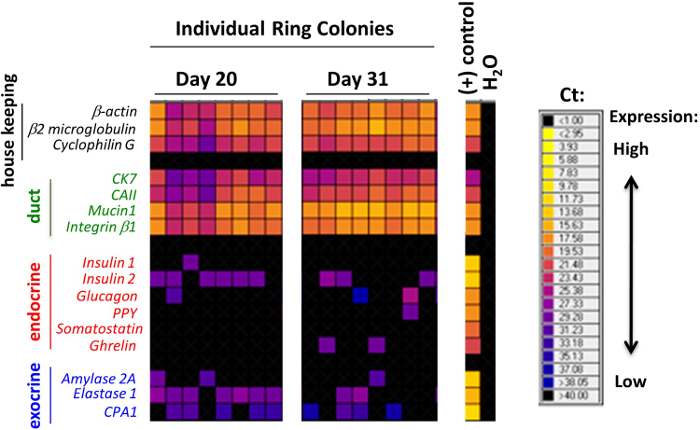
Рисунок 3. Отдельные колонии , выращенные в мышиных белков ЕСМ , выраженные маркеры для протоковых, ацинарными и эндокринных клеток. Репрезентативные результаты анализа микрожидком QRT-PCR отдельных колоний кольца. Каждый столбец представляет собой одну колонию. Уровни экспрессии генов выражены как плавки- карту здесь, с более теплыми цветами указывает на более высокое выражение и более холодных цветов, указывающих на более низкой экспрессии. Многие из отдельных колоний экспрессируют по меньшей мере один из генов в каждой панели для маркеров, которые указывают протоков, эндокринных или ацинарных клеток линии. Эти данные свидетельствуют о том, что многие из отдельных колоний выражают маркеры три-клональные, и предполагают, что большинствопроисходящих PCFUs являются три-сильным. Эта цифра изменяется от ранее опубликованной рисунке 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. Две колонии кольца выразили протокового маркерный белок муцин 1. Типичные результаты целом монтажа иммунное колоний кольца, показывая экспрессию белка в протоковой маркера муцин 1 (зеленый цвет). Ядра противопоказаны окрашивали DAPI (синий цвет). Многие клетки в этих колониях кольцо выразить муцина 1 белок. Это согласуется с результатами микрофлюидальных QRT-PCR , показывающие , что кольцо колоний , выросших в мышиных белков ЕСМ экспрессируют высокие уровни (более теплые цвета на рисунке 3) mucin1 и других маркеров протоковых клеток. Шкалы представляютS 50 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
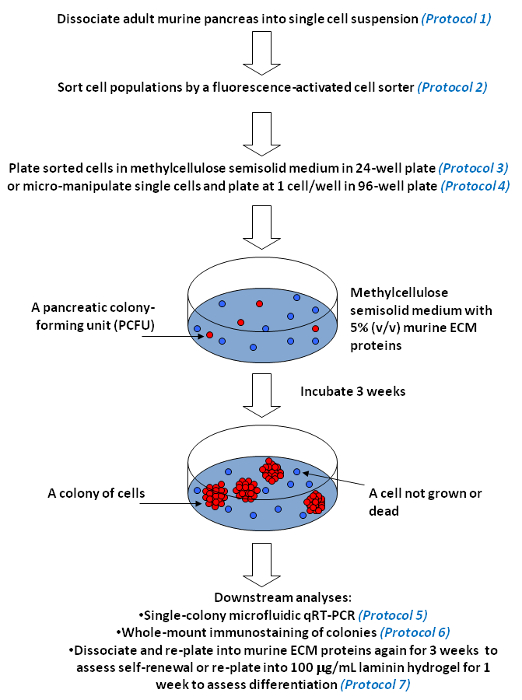
Рисунок 5. панкреатических колонии анализы для измерения самообновлению и мульти-клонального дифференцировки отдельных клеток - предшественников в культуре. Представитель рабочего процесса представлена. Наши панкреатические колониеобразующих анализы содержат вязкий материал, метилцеллюлозы, так что культуральная среда становится полутвердым. Полутвердые среда ограничивает движение и препятствует агрегации отдельных клеток-предшественников (обозначено красным цветом). Тем не менее, среда достаточно мягким, чтобы позволить одному клеток-предшественников к самообновлению и / или дифференциации, и расти в колонию клеток (в лице нескольких красными кругами). В отличие от этого, отдельные клетки, которые не имеют колониеобразующих способности, т.е. не прогениторных клеток (выделены синим цветом), остаются в виде отдельных клеток или умереть с течением времени в культуре. Метилцеллюлоза также позволяет включение ECM белков при низких концентрациях, таких как 5% мышиного белков ЕСМ или 100 мкг / мл ламинина гидрогеля. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В панкреатических колонии анализы и одну колонию анализов , описанных здесь , были вдохновлены метилцеллюлозы содержащих гемопоэтические колонии анализов , которые сыграли важную роль в расшифровке биологии гемопоэтических клеток - предшественников в последние десятилетия 23. В этих анализах (Рисунок 5), диссоциируют панкреатические клетки высевают в метилцеллюлозы содержащих полутвердой носитель с соответствующими факторами роста и ECM белков , которые поддерживают образование кольца, густая или Эндокринные / ацинарными колоний 7. Один клеток-предшественников, которые способна породить колонию клеток, называется PCFU. Характеризуя отдельных колоний с использованием микрожидкостных QRT-PCR и целом монтажа иммуноокрашивания, родословная потенциалы происходящих PCFUs можно вывести. Было установлено , что большинство взрослых мышиных PCFUs являются три сильнодействующих, способных привести к протоков, ацинарных и эндокринные линии дифференцировки клеток в пробирке 7,9-. В то время как мурECM белки ап пара та стимулировать дифференцировку три-сильнодействующего PCFU к линии канала, ламинина гидрогель позволяет надежную эндокринных и ацинарных клеточной линии дифференцировки 7,9. Для того, чтобы оценить в пробирке самообновлению потенциала PCFUs, кольцо или Плотные колоний , выросших в анализе первичного мышиного ЕСМ колонии может быть отделено в суспензии одноклеточных и повторно засевали на вторичную мышиный ЕСМ колонии анализа 7. Было установлено , что PCFUs расширен ~ 500000 раз в мышиных белков ЕСМ в течение 11 недель , 7. Критические шаги включают в себя удаление жировой ткани из рассеченного поджелудочных желез, избегая чрезмерной переваривания клеток поджелудочной железы с помощью коллагеназы, и сводя к минимуму холодный шок диссоциированных Ring / Плотные колонии клеток перед повторным покрытием. Овладение микроманипуляции отдельных клеток может занять некоторое время; терпения и практики необходимы.
По сравнению с другими панкреатических анализов клеток - предшественников, в том числе 2D - культуры 24, в сuspension "pancreasphere" 25 и Органоид анализы 12-15, основные преимущества метилцеллюлозы , содержащих колонии анализов , описанных здесь , являются следующие. Во-первых, добавление и настройка белков ЕСМ в широком диапазоне концентраций, может быть легко достигнуто. Это происходит потому, что метилцеллюлоза является веществом, которое придает 3D-характер полутвердой среде. В противоположность этому, Органоид способы культивирования зависят от застывании мышиными белков ЕСМ, которые присутствуют в 33% об / об и выше. Следует отметить , что всего лишь 1% белка мышиного ЕСМ может ингибировать дифференцировку эндокринных клеток 9, что подчеркивает важность концентрации белка ЕСМ в анализе клеток - предшественников. Во-вторых, колонии равномерно распределены по всей культуре хорошо и могут быть подсчитаны точно. В-третьих, отдельные колонии могут быть легко отобран для последующего анализа. В-четвертых, метилцеллюлозы, содержащей полутвердый продукт среда не легко поддерживать, и ни одна средаизменение необходимо в процессе культивирования. Наконец, большое количество клеток (до 25000 клеток на 24-луночный планшет) можно высевать и исследовали в этих анализах колонии, что делает их эффективными для обнаружения деятельности клеток-предшественников, даже если они являются незначительное население среди посеянных клеток.
Панкреатические анализы клеток-предшественников, описанные здесь, основаны на функциональных, но не маркер на основе анализа панкреатических клеток-предшественников. Это означает, что панкреатические клетки-предшественники могут быть изучены, не зная, что они выражают маркеры. Это очень важно, потому что мало знаний о том, какие конкретные маркеры взрослые панкреатические клетки-предшественники могут выразить. Кроме того, маркеры для эмбриональных панкреатических клеток-предшественников не может быть достаточным для изучения взрослых клеток-предшественников. Используя функциональный анализ, можно приступить к определению специфических маркеров клеток - предшественников сначала определения субпопуляции , которая имеет PCFU активность, такие как CD133 + </ SUP> Sox9 / EGFP + клетки показано здесь. Это может сопровождаться идентификацией, используя Секвенирование РНК, генов, которые дифференциально экспрессируются в PCFU содержащих населения. Маркеры кандидаты затем могут быть испытаны и проверены с помощью анализов , таких , как в пробирке и в естественных условиях отслеживания линии преемственности методов , которые позволяют отслеживать дифференциации способности клеток - предшественников.
Ограничения в пробирке из метилцеллюлозы , содержащих колонии количественных анализов в три раза. Во- первых, хотя анализы имитируют микросреду в естественных условиях поджелудочной железы, обеспечивая белков ЕСМ и факторы роста в панкреатических клеток - предшественников в 3D - пространстве в культуре, условия не идентичны. Кроме того, структуры эпителиальных клеток в естественных условиях разрушаются в результате диссоциации на отдельные клетки, которые могут иметь серьезные последствия. Таким образом, это будет важно , чтобы проверить , клеток - предшественников в исследованиях последующих с использованием в естественных условиях Анализы. Во- вторых, компоненты культуры содержат неопределенные реагенты, такие как мышиных белков ЕСМ, FCS и кондиционированной среды 18. Эти неопределенные компоненты могут влиять на функцию специфических факторов роста на клетки-предшественники косвенно и больше работы требуется, чтобы создать полностью определенный набор условий культивирования. Наконец, линии преемственности трассировки эксперименты продемонстрировали ацинарной-к-бета - клетками 26,27 или альфа - клетки-к-бета - клеток 28 переходов в естественных условиях у взрослых мышей. Условия метилцеллюлоза культуры, описанные здесь, могут быть специфическими только для преобразования клеток протоков-к-бета. могут быть необходимы другие неизвестные условия культивирования для не проток клетки для преобразования в бета-клеток в культуре.
Есть несколько случаев, когда поиск и устранение неисправностей могут быть необходимы. Например, если диссоциированные клетки слипаются вместе, используют более высокие дозы ДНКазы I в растворах. ДНКазы I важно предотвратить спутывание диссоциированных клеток поджелудочной железы, вызванных Мо ДНКlecules выпущенный мертвых клеток (см шаг 1.3.2).
В качестве альтернативы, если фарша ткани придерживаться в 10 мл пипетки, рубите ткани на более мелкие куски. Открытие 10 мл пипетки должна быть достаточно широкой для кусочки ткани, чтобы пройти через после коллагеназы. Если кусочки застревают на кончике 10 мл пипетку, это указывает на то, что мясорубки ткани пружинного ножниц не достаточно (этап 1.3.4).
Еще одна проблема , которая может возникнуть никакого роста колонии в мышиных белков ЕСМ из диссоциированных клеток поджелудочной железы (т.е. несортированные клетки). Если это произойдет, не пытайтесь разорвать все кластеры в одиночные клетки во время стадии диссоциации поджелудочной железы, так как это может привести к overdigestion и гибели клеток. Если есть большие куски, возвращают трубку до 37 ° С в течение нескольких (4) мин и шприцем 7 раз или меньше. Перепроверьте клетки под микроскопом. Максимальное время для лечения коллагеназы B составляет 30 мин. Depending на коллагеназы используется, оптимальное время для пищеварения может отличаться (см шаг 1.4.2).
Кроме того, можно наблюдать комки мышиных белков внеклеточного матрикса в культуре лунках после инкубации. Чтобы избежать этого, убедитесь, что все компоненты культуры, которые вступают в контакт с мышиными белками внеклеточного матрикса держат в холоде на льду во избежание преждевременного затвердевания до инкубации в 37 ° C (см шаг 3).
Кроме того, это может быть трудно в собирании одной ячейки в то время, в стеклянной пипетки Пастера. Решение этой проблемы заключается в снижении плотности свеже отсортированных клеток высевали в полутвердой среде, чтобы убедиться, что клетка имеет достаточное расстояние от других клеток. Это позволит избежать собирание нескольких ячеек одновременно. Кроме того, это лучше расположить фокус микроскопа вблизи дна полутвердой среде, так как легче подобрать отдельные клетки вручную вблизи этой плоскости без микроМанипулятор (см шаг 4.6.2).
Кроме того, оно может быть неясно, является ли успешна одной манипуляции клеток. Решение состоит в том, чтобы практиковать одноклеточной микроманипуляции до фактического эксперимента. После того, как клетка улавливается в стеклянной пипетки Пастера, перевести ячейку в 35 мм чашки Петри, содержащий 1 мл 1% раствора метилцеллюлозы без клеток ( «не-клетки» среде, приготовленной на этапе 4.4.1). Визуализируйте и поместите отверстие кончика пипетки Пастера в фокусе под микроскопом, и толкать клетки медленно. Ожидать единичную ячейку медленно появляются вокруг кончика пипетки, а затем перейти в среду "нет клеток" (этап 4.8.2).
Наконец, ни рост колоний не может происходить во вторичных культурах от диссоциированных первичного кольца / Плотные колонии. Для устранения неполадок, убедитесь, что клетки из первичных диссоциированных колоний сохраняются в РТ, прежде чем металлизированный во вторичные культуры. Для культивирования в мышиных белков ЕСМ, добавьтеклетки последних в пробирку , содержащую питательную среду холодной перед смешиванием 18, тем самым сводя к минимуму экспозицию клеток к холодной температуре, что может убить Диссоцииро- клетки , полученные из первичных колоний. Тем не менее, повторное покрытие клеток в ламининовым гидрогеля не требуется производить на льду до 37 ° C Инкубационный (этап 7).
Таким образом, два метилцеллюлоза , содержащих колонии анализы были использованы для характеристики прогениторных-подобных клеток из поджелудочных желез взрослого 7,11 и постнатального молодых мышей 9,10, а также из печени молодых мышей 10. Будущие приложения будут направлены на выявление и характеристика человеческих колониеобразующих клеток-предшественников из трупной поджелудочной органов.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Люси Браун и Александр Спалла из аналитической цитометрии Ядро в Город надежды на помощь в сортировке. Эта работа частично поддержана Национальным институтом здравоохранения (NIH) предоставляет R01DK081587 и R01DK099734 к HTK и U01DK089533 к ДОПОГ, а также Институтом Национального научного фонда грант NSF-DMR-1206121 и California для регенеративной медицины грант RB5-07398 для DAT Supports от Джозефа Дж Jacobs Института молекулярной инженерии для медицины Калифорнийского технологического института в DAT, а также тех, кто из Окснард Фонда и Эллы Фицджеральд Фонда к HTK также с благодарностью.
Финансирование: Эта работа частично поддержана Национальным институтом здравоохранения (NIH) гранты R01DK081587 и R01DK099734 к HTK и U01DK089533 к ДОПОГ, и Институтом Национального научного фонда грант NSF-DMR-1206121 и California для регенеративной медицины грант RB5-07398 в Поддержка DAT от Joseph J. JacobsИнститут молекулярной инженерии для медицины Калифорнийского технологического института в DAT, а те из Окснард Фонда и Эллы Фицджеральд Фонда к HTK также с благодарностью. В исследовании, опубликованном в данной публикации, включены работы, выполненные в аналитической цитометрии ядра и световой микроскопии Digital Imaging Ядро при поддержке Национального института рака Национального института здоровья под номером награду P30CA33572.
Исследование спонсор: Спонсор не принимал участия в исследовании разработки, сбора, анализа или интерпретации данных.
Материалы
| Name | Company | Catalog Number | Comments |
| Murine ECM proteins (Matrigel) | Becton Dickson (Franklin Lakes, NJ, USA) | 354230 | Stock kept at -20oC |
| Laminin Hydrogel | Provided by David Tirrell (Pasadena, CA USA) | Stock kept at -20oC | |
| Methylcellulose | Shinetsu Chemical (Tokyo, Japan) | 1500 centipoise (dynamic viscosity unit equal to 15g/cm/s) (high viscosity) | |
| Dulbecco's Phosphate-Buffered Saline | Mediatech (Manassas, VA, USA) | 21-031-CV | |
| Phosphate Buffered Saline | Gibco (Grand Island, NY, USA) | 15070-063 | |
| 50mL Flacon Conical vial | Corning Inc. (Corning, NY, USA) | 352070 | |
| 100mmx20mm Suspension culture dish | Corning Inc. (Corning, NY, USA) | 430591 | |
| Bovine Serum Albumin | Sigma (St. Louis, MO, USA) | A8412 | |
| Penicillin/Streptomycin | Gibco (Grand Island, NY, USA) | 15070-063 | |
| DNase1 | Calbiochem (Darmstadt, Germany) | 260913 | |
| Collagenase B | Roche (CH-4070, Basel, Schweiz, Switzerland) | 11088831001 | Stock kept at -20oC |
| Anti-mouse CD16/32 | Biolegend (San Diego, CA, USA) | 101310 | low endotoxin, azide free |
| PE-Cy7 Rat IgG2a κ Isotype Control | Biolegend (San Diego, CA, USA) | 400522 | |
| Rat IgG1 κ Isotype Control | eBioscience (San Diego, CA, USA) | 13-4301-82 | |
| Anti-CD133-Biotin | eBioscience (San Diego, CA, USA) | 13-1331-82 | |
| Anti-CD71-PE-Cy7 | Biolegend (San Diego, CA, USA) | 113812 | |
| Streptavidin-Allophycocyanin | Biolegend (San Diego, CA, USA) | 405207 | |
| 4',6-Diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | 3571 | Stock kept at -20oC |
| Anti-mucin 1 | Thermo Fisher Scientific (Waltham, MA USA) | HM-1630-P1 | |
| Dylight 649 Goat anti-Armenian Hamster | Jackson Immuno (West Grove, PA, USA) | 127-495-160 | |
| Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 | Mediatech(Manassas, VA, USA) | 10-092-CV | |
| Fetal Bovine Serum | Tissure Culture Biologicals (Long Beach, CA, USA) | 101 | Stock kept at -20oC |
| Tris Ethylenediaminetetraacetic acid | TEKnova (Hollister, CA, USA) | T0221 | |
| Rneasy Micro Kit | Qiagen (Venlo, Netherlands) | 74004 | |
| QuantiTec Reverse Transcription Kit | Qiagen (Venlo, Netherlands) | 205310 | |
| CellsDirect One-Step qRT-PCR Kit | Ambion/Invitrogen(Grand Island, NY, USA) | 11753-100 | |
| Paraformaldehyde | Santa Cruz Bio (Santa Cruz, CA, USA) | SC-281692 | |
| Goat serum | Jackson Immuno (West Grove, PA, USA) | 005-000-121 | Stock kept at -20oC |
| Donkey serum | Jackson Immuno (West Grove, PA, USA) | 0017-000-121 | Stock kept at -20oC |
| Triton X-100 | Sigma (St. Louis, MO, USA) | T9284 | |
| Trypsin | Sigma (St. Louis, MO, USA) | T-4799 | |
| Ethylenediaminetetraacetic acid | Invitrogen (Waltham, MA, USA) | 15575-020 | |
| Trypsin-EDTA | Life Technologies (Waltham, MA, USA) | 25200-056 | |
| Sterile Water | Gibco (Grand Island, NY, USA) | 15230-147 | Molecular biology grade |
| Pasteur Pipette | Fisher Scientific (Pittsburgh, PA , USA) | 13-678-8B | |
| 40um Filter Mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-1 | |
| 70 um filter mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-2 | |
| TC Plate 96 Well Suspension | Sarstedt | 83.3924 (Previously 83.1835) | |
| 1cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 309659 | |
| 10cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 301604 | |
| 48.48 Dyanmic Array Chip | Fluidigm (San Francisco, CA, USA) | BMK-M-48.48 | |
| Fluidigm GE 48.48 Dynamic Array Sample & Assay Loading Reagent Kit | Fluidigm (San Francisco, CA, USA) | 85000800 | |
| TaqMan Universal PCR Master Mix | Applied Biosystems (Grand Island, NY, USA) | 4304437 | |
| Polyethylene glycol sorbitan monolaurate | Sigma (St. Louis, MO, USA) | P7949 | |
| Glass Bottom Dish | MatTek (Ashland, MA, USA) | P35G-1.5-14-C | 35 mm petri dish with glass bottom |
| Mouth Piece/ Rubber Tubing | Renova Life Inc. (College Park, MD, USA) | MP-SET | |
| Nicotinamide | Sigma (St. Louis, MO, USA) | N0636 | Stock kept at -20oC |
| Vascular Endothelial Growth Factor | R&D Systems (Minneapolis, MN, USA) | 293-VE | Stock kept at -80oC |
| Activin B | R&D Systems (Minneapolis, MN, USA) | 659-AB | Stock kept at -80oC |
| Extendin 4 | Sigma (St. Louis, MO, USA) | E7144 | Stock kept at -20oC |
| Rspondin-1 | R&D Systems (Minneapolis, MN, USA) | 3474-RS | Stock kept at -80oC |
| Falcon 5mL Polystyrene Round-Bottom Tube | Corning Inc. (Corning, NY, USA) | 352054 | |
| PrecisionGlide Needle 18Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305196 | |
| PrecisionGlide Needle 16Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305198 | |
| Costar Ultra-Low Attachment Surface 24 well flat bottom plate | Corning Inc. (Corning, NY, USA) | 3473 | |
| Costar 96 Black Well Plate | Corning Inc. (Corning, NY, USA) | 3603 | Flat, clear bottom with lid. Black polystyrene TC-treated microplates |
| Zeiss LSM510 META NLO Axiovert 200M Inverted Microscope | Carl Zeiss AG (Oberkochen, Germany) | ||
| Biomark HD | Fluidigm (San Francisco, CA, USA) | ||
| Aria Special Order Research Product Cell Sorter | Becton Dickson (Franklin Lakes, NJ, USA) |
Ссылки
- Gu, G., Brown, J. R., Melton, D. A. Direct lineage tracing reveals the ontogeny of pancreatic cell fates during mouse embryogenesis. Mech Dev. 120, 35-43 (2003).
- Kopp, J. L., et al. Sox9+ ductal cells are multipotent progenitors throughout development but do not produce new endocrine cells in the normal or injured adult pancreas. Development. 138, 653-665 (2011).
- DiGiusto, D. L., et al. RNA-based gene therapy for HIV with lentiviral vector-modified CD34(+) cells in patients undergoing transplantation for AIDS-related lymphoma. Science translational medicine. 2, 36-43 (2010).
- Inada, A., et al. Carbonic anhydrase II-positive pancreatic cells are progenitors for both endocrine and exocrine pancreas after birth. Proc Natl Acad Sci U S A. 105, 19915-19919 (2008).
- Solar, M., et al. Pancreatic exocrine duct cells give rise to insulin-producing beta cells during embryogenesis but not after birth. Dev Cell. 17, 849-860 (2009).
- Ku, H. T. Minireview: pancreatic progenitor cells--recent studies. Endocrinology. 149, 4312-4316 (2008).
- Jin, L., et al. Colony-forming cells in the adult mouse pancreas are expandable in Matrigel and form endocrine/acinar colonies in laminin hydrogel. Proc Natl Acad Sci U S A. 110, 3907-3912 (2013).
- Fu, X., et al. MicroRNA-26a targets ten eleven translocation enzymes and is regulated during pancreatic cell differentiation. Proc Natl Acad Sci U S A. 110, 17892-17897 (2013).
- Ghazalli, N., et al. Postnatal Pancreas of Mice Contains Tripotent Progenitors Capable of Giving Rise to Duct, Acinar, and Endocrine Cells In Vitro. Stem Cells Dev. , (2015).
- Jin, L., et al. Colony-forming progenitor cells in the postnatal mouse liver and pancreas give rise to morphologically distinct insulin-expressing colonies in 3D cultures. Rev Diabet Stud. 11, 35-50 (2014).
- Jin, L., et al. In Vitro Multilineage Differentiation and Self-Renewal of Single Pancreatic Colony-Forming Cells from Adult C57Bl/6 Mice. Stem Cells Dev. , (2014).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. Embo J. 32, 2708-2721 (2013).
- Greggio, C., et al. Artificial three-dimensional niches deconstruct pancreas development in vitro. Development. 140, 4452-4462 (2013).
- Lee, J., et al. Expansion and conversion of human pancreatic ductal cells into insulin-secreting endocrine cells. Elife. 2, e00940 (2013).
- Dorrell, C., et al. The organoid-initiating cells in mouse pancreas and liver are phenotypically and functionally similar. Stem Cell Res. 13, 275-283 (2014).
- Ku, H., Yonemura, Y., Kaushansky, K., Ogawa, M. Thrombopoietin, the ligand for the Mpl receptor, synergizes with steel factor and other early acting cytokines in supporting proliferation of primitive hematopoietic progenitors of mice. Blood. 87, 4544-4551 (1996).
- Ku, H. T., et al. Insulin-expressing colonies developed from murine embryonic stem cell-derived progenitors. Diabetes. 56, 921-929 (2007).
- Winkler, M., et al. A quantitative assay for insulin-expressing colony-forming progenitors. J Vis Exp. , e3148 (2011).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Formeister, E. J., et al. Distinct SOX9 levels differentially mark stem/progenitor populations and enteroendocrine cells of the small intestine epithelium. Am J Physiol Gastrointest Liver Physiol. 296, G1108-G1118 (2009).
- Seymour, P. A., et al. A dosage-dependent requirement for Sox9 in pancreatic endocrine cell formation. Dev Biol. 323, 19-30 (2008).
- Ogawa, M. Differentiation and proliferation of hematopoietic stem cells. Blood. 81, 2844-2853 (1993).
- Suzuki, A., Nakauchi, H., Taniguchi, H. Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting. Diabetes. 53, 2143-2152 (2004).
- Seaberg, R. M., et al. Clonal identification of multipotent precursors from adult mouse pancreas that generate neural and pancreatic lineages. Nat Biotechnol. 22, 1115-1124 (2004).
- Zhou, Q., Brown, J., Kanarek, A., Rajagopal, J., Melton, D. A. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 455, 627-632 (2008).
- Baeyens, L., et al. Transient cytokine treatment induces acinar cell reprogramming and regenerates functional beta cell mass in diabetic mice. Nat Biotechnol. 32, 76-83 (2014).
- Thorel, F., et al. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature. 464, 1149-1154 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены