Method Article
In Vitro Colony saggi per Caratterizzazione Tri-potenti cellule progenitrici isolato dal adulti murini Pancreas
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Nei saggi di colonie in vitro per rilevare auto-rinnovamento e la differenziazione delle cellule progenitrici isolate dal pancreas di topo adulti sono messo a punto. In questi saggi, progenitori pancreatici danno origine a colonie di cellule nello spazio 3-dimensionale in terreno semisolido contenente metilcellulosa. I protocolli per la gestione di singole cellule e caratterizzazione delle singole colonie sono descritti.
Abstract
Staminali e cellule progenitrici da parte del pancreas adulti potrebbero essere una potenziale fonte di cellule beta-come terapeutici per il trattamento di pazienti affetti da diabete di tipo 1. Tuttavia, non è ancora noto se le cellule staminali e progenitrici esistono nel pancreas adulto. strategie di ricerca utilizzando cre-lox lineage tracing in topi adulti hanno dato risultati che sostenere o confutare l'idea che le cellule beta possono essere generati dai condotti, il luogo in cui si presume adulte progenitrici del pancreas possono risiedere. Questi metodi lineage tracing in vivo cre-LOX, tuttavia, non possono rispondere alle domande di auto-rinnovamento e multi-lignaggio differenziazione-due criteri necessari per definire una cellula staminale. Per iniziare affrontare questa lacuna tecnica, abbiamo ideato saggi di colonia 3-dimensionali per progenitori pancreatici. Poco dopo la nostra pubblicazione iniziale, altri laboratori hanno sviluppato in modo indipendente una simile, ma non identica, metodo chiamato il test organoide. Rispetto al dosaggio organoide, il nostro metodo impiegametilcellulosa, che forma soluzioni viscose che consentono l'inserimento di proteine della matrice extracellulare a basse concentrazioni. I saggi metilcellulosa contenenti consentono una facile individuazione e analisi di cellule progenitrici a livello di singola cellula, che sono fondamentali quando progenitori costituiscono una piccola sotto-popolazione, come è il caso per molti cellule staminali adulte di organi. Insieme, i risultati di diversi laboratori dimostrano in vitro auto-rinnovamento e multi-lignaggio differenziazione delle cellule progenitrici simili pancreatiche da topi. I protocolli attuali descrivono due saggi di colonia metilcellulosa-based per caratterizzare i progenitori del mouse del pancreas; uno contiene una preparazione commerciale di proteine della matrice extracellulare murine e l'altra una proteina della matrice extracellulare artificiale conosciuto come un idrogel laminina. Le tecniche qui riportate sono 1) la dissociazione del pancreas e smistamento di CD133 + Sox9 / EGFP + cellule duttali da topi adulti, 2) la manipolazione singola cellula dei scellule orted, 3) singola colonia analisi utilizzando microfluidica qRT-PCR e tutto il montaggio immunostaining, e 4) la dissociazione di colonie primarie in cella singola sospensioni e ri-placcatura in saggi di colonia secondari per valutare il self-renewal o differenziazione.
Introduzione
Il pancreas è composto da tre principali linee cellulari; cellule acinose secernono enzimi digestivi, condotti secernere mucina per respingere gli agenti patogeni e il trasporto di enzimi digestivi per l'intestino e le cellule endocrine secernono ormoni, tra cui l'insulina e il glucagone, che mantengono l'omeostasi del glucosio. Durante lo sviluppo embrionale del pancreas, i primi cellule duttali sono la fonte delle cellule progenitrici tri-potenti in grado di dare origine a tre linee nel pancreas di animali adulti 1,2. Poiché le cellule staminali e progenitrici adulte, come le cellule staminali del midollo osseo, sono già utilizzati con successo per il trattamento di varie malattie 3, vi è intenso interesse nel trovare le cellule staminali e progenitrici nel pancreas adulto. Se l'isolamento e la manipolazione delle cellule staminali e progenitrici pancreatiche adulte erano possibili, queste cellule potrebbero essere utilizzate per il trattamento di malattie come il diabete di tipo 1, in cui le cellule che secernono insulina vengono distrutte da autoimmunità.
Sia che ancora esistono cellule progenitrici tri-potenti in dotti pancreatici adulti dopo il completamento dello sviluppo embrionale è una domanda che è fortemente dibattuto nella comunità scientifica. In questo dibattito, e l'utilizzo in vivo cre-lox lineage tracing tecniche, Inada e colleghi hanno dimostrato che le cellule adulte duttale murine etichettati con un pennarello, carbonica II, potrebbero dare origine a tutte e tre le linee del pancreas 4. Tuttavia, utilizzando altri marcatori duttali, come HNF1B era 5 e Sox9 2, si è concluso che le cellule duttali non sono la principale fonte di cellule beta topi adulti.
Molti anni fa, abbiamo proposto che la causa della discussione suddetto può essere dovuto alla mancanza, nel campo 6,7, di strumenti analitici adeguati che possono essere utilizzati per misurare auto-rinnovamento e multi-lineage differenziazione-due criteri necessario definire una cellula staminale. L'in vivo cre-lox tecnica lineage tracing menzionatosopra può fornire prove per la relazione progenitore-progenie a livello di popolazione. Tuttavia, questa tecnica tracciando lignaggio è limitata nel suo potere di discernere se le cellule progenitrici singoli possono auto-rinnovarsi e di differenziarsi in molteplici linee. analisi singola cella è importante perché se diversi progenitori mono-potente, ognuno con un diverso potenziale stirpe, sono stati analizzati insieme, possono apparire collettivamente avere multi-lignaggio capacità di differenziazione. Inoltre, le cellule staminali sono di solito una frazione minore di un organo adulto. Le attività di una popolazione di cellule minore potrebbe essere mascherati dalla popolazione principale. Pertanto, un risultato negativo da uno studio di popolazione non indica necessariamente l'assenza di cellule staminali. Infine, cre-lox lignaggio tracciamento attualmente non consentono di misurare la auto-rinnovamento.
Per iniziare affrontando il divario tecnico nel campo della biologia delle cellule progenitrici del pancreas, colonia 7-11 o 12-15 organoide saggi che utilizzano sistemi di coltura 3D sono state elaborate. Due saggi di colonia per progenitori pancreatici sono stati sviluppati nel nostro laboratorio: uno contiene una preparazione commerciale di proteine murine matrice extracellulare (ECM) (vedere Metodi e Impianti Table), e l'altra contiene idrogel laminina, un definito ECM proteina artificiale 7-11. cellule progenitrici sono mescolati in mezzo semisolido contenente metilcellulosa. Metilcellulosa è un materiale biologicamente inerte e viscosa preparato da fibre di legno, ed è stato utilizzato di routine in saggi colonie ematopoietiche 16. La metilcellulosa contenente mezzo semisolido limita il movimento delle cellule progenitrici singoli in modo che non può ri-aggregate. Tuttavia, il mezzo è abbastanza morbida da consentire una cellula progenitrice di crescere e differenziarsi in una colonia di cellule nello spazio 3D. Seguendo la tradizione degli ematologi, una cellula progenitrice del pancreas che è stato in grado di dare origine a una colonia di cellule era named una unità formanti colonie pancreatica (PCFU). PCFUs, quando coltivate nel saggio colonia ECM contenenti murino, danno origine a colonie cistica che sono denominati "Ring" colonie 7. L 'aggiunta di un agonista Wnt, R-spondin1, nella cultura murino ECM-contenente, alcune colonie Anello trasformano in colonie "dense" 7. In questo articolo, questi due tipi di colonie cresciute in coltura ECM murino sono indicate collettivamente come colonie "Ring / dense". Quando anello colonie / dense sono dissociate in sospensione di cellule singole e ri-placcato in culture che contengono laminina idrogel, colonie "Endocrine / acinari" si formano 7.
Utilizzando singola colonia analisi, si è constatato che la maggior parte delle colonie Ring / densi e Endocrino / acinari, sia da adulto (2-4 mesi) 7,11 o giovani (1 settimane di età) 9 pancreas di topo, esprimono tutti e tre marcatori lignaggio. Questo suggerisce che la maggior parte delle PCFUs originari sono tri-potenti. Nel saggio colonia ECM contenenti murino, adulto PCFUs murino robusta auto-rinnovarsi e di espandere di circa 500.000 volte più di 11 settimane nella cultura 7. ECM murino supporta preferenzialmente la differenziazione delle cellule duttali oltre endocrine e acinose lignaggi, mentre in presenza di laminina idrogel, PCFUs murini sono incoraggiati a differenziarsi preferenzialmente in cellule endocrine e acinose e meno al duttale stirpe 7,9,11. È importante sottolineare che, insulina + glucagone - celle mono-ormonale sono generati nella cultura idrogel laminina e secernere insulina in risposta al glucosio stimolazione in vitro 7,9, suggerendo la maturità funzionale. La differenziazione tri-lignaggio potenziale 7,9 e di auto-rinnovamento 11 dei singoli PCFUs sono confermate da micromanipolazione cella singola, vale a dire, la coltura di una cella per bene per la formazione di colonie. Insieme, questi risultati forniscono la prova che ci sono auto-rinnovamento, tri-potent, cellule progenitrici simili nel pancreas murino postnatale che mostrano le attività in coltura 3D.
I saggi PCFU murini descritti in questo articolo sono derivati da un test colonia prima progettata per le cellule progenitrici differenziate da cellule murine embrionali staminali (mESCs) 17. Questo protocollo è documentato in dettaglio in un'altra pubblicazione JoVE 18. I componenti e le tecniche necessarie per eseguire il test colonia ECM contenenti murino per PCFUs adulti cultura sono gli stessi di progenitori Mesc-derivati 17,18. Pertanto, questi aspetti del test non saranno ripetute qui; invece saranno affrontate le seguenti procedure: 1) la dissociazione del pancreas adulti e ordinamento / EGFP + cellule duttali CD133 + SOX9, che arricchiscono PCFUs da topi adulti 7, 2) la manipolazione cella singola delle cellule ordinati, 3) single-colonia analisi usando microfluidica qRT-PCR e tutto il montaggio immunostaining, e 4) la dissociazione di Colonies in cella singola sospensione e ri-placcatura in ECM murino o laminina saggi di idrogel colonia.
Protocollo
Dichiarazione etica: Aderiamo agli standard etici ampiamente accettati nel condurre ricerche per garantire la qualità e l'integrità dei risultati. La sperimentazione animale è condotto secondo protocolli approvati dalla cura degli animali e del Comitato Istituzionale Usa al City of Hope.
1. Preparare cella singola sospensione da adulti Murine pancreata
NOTA: Nelle pubblicazioni precedenti 7,11, sono stati utilizzati topi CD-1 o di sfondo B6; entrambi gli sfondi dato risultati simili. Una linea di topo transgenico (designato Sox9 / EGFP) con una maggiore proteina fluorescente verde guidata da Sox9 loci 19,20, è stato creato nel CD-1 di fondo.
- Euthanize 3 a 5 topi adulti che usano gas CO 2 per 1-2 minuti o fino a quando si ferma la respirazione. Successivamente, eseguire dislocazione cervicale su ogni mouse.
- Sezionare e preparare il pancreas.
NOTA: Sezionare i topi appena possibile dopo eutanasia. Questo è importante per evitare autodigestione del pancreas dovutiai cambiamenti post-mortem.- Fare un incisione verticale sulla linea mediana della parete addominale del mouse con le forbici e aprire la cavità addominale. Trova la milza e utilizzare pinze per sollevare delicatamente. Tagliare il tessuto connettivo tra la milza e il lobo splenica del pancreas con le forbici.
- Ripetere questa pratica per i lobi gastriche e duodenali del pancreas. Posizionare i tessuti pancreatici in una piastra di Petri su ghiaccio contenente soluzione fredda di Dulbecco modificato tampone fosfato (DPBS), 0,1% di siero albumina bovina (BSA), e la penicillina e streptomicina (P / S; soluzione completa designato come PBS / BSA).
- Rimuovere tessuti grassi da parte del pancreas sotto un microscopio da dissezione con pinze fine-tip.
NOTA: Questo è critico per la salute delle cellule pancreatiche dissociate nei seguenti passaggi.- (Opzionale) Controllare il pancreas per fluorescenza verde con lo stereomicroscopio a fluorescenza utilizzando 488-509 nm di eccitazione per garantireespressione EGFP.
- In una cappa coltura tissutale, risciacquare il tessuto tre volte in sequenza in tre piatti 100 millimetri Petri contenenti 10 ml di PBS freddo / BSA.
- Fare un incisione verticale sulla linea mediana della parete addominale del mouse con le forbici e aprire la cavità addominale. Trova la milza e utilizzare pinze per sollevare delicatamente. Tagliare il tessuto connettivo tra la milza e il lobo splenica del pancreas con le forbici.
- Genera Piccoli pezzi di tessuti.
- Trasferire il pancreas sezionato ad un secco sterile, piastra di Petri per rimuovere la maggior quantità di PBS / BSA possibile, e trasferirli su un altro piatto a secco di Petri sul ghiaccio.
- Preparare PBS / BSA contenente DNasi I con l'aggiunta di 2 ml soluzione madre DNasi I (1 milione di unità [MU] / ml) per 1 ml di PBS / BSA.
NOTA: Questa soluzione è indicata PBS / BSA / DNasi I. Rendere ~ 200 ml di questa soluzione in una sola volta, che coprirà un esperimento di smistamento. - Tritare il pancreas con le forbici a molla per 2-3 minuti o fino a quando il tessuto è a pezzi pregiati. Aggiungere 2-3 ml di PBS freddo / BSA / DNasi ai pezzi di tessuto nella capsula di Petri di sospenderli.
- Trasferire i pezzi di tessuto in una provetta conica da 50 ml su ghiaccio con una pipetta 10 ml. Portare il volume totale di 10 ml con PBS / BSA / DNasi l dopo aver recuperato il più possibile di tessuto.
- Digerire il pancreas Pezzi nelle celle Per lo più singoli.
- Aggiungere collagenasi B (100 mg / ml di brodo) a 350-450 ml / 10 ml per i pezzi di tessuto e incubare il tessuto a 37 ° C in un bagno d'acqua per 8 minuti, agitando ogni 3-4 min. Utilizzare una siringa da 10 ml con un ago 16 ½ G per elaborare e successivamente spruzzare la soluzione di tessuto lungo la parete del tubo da 50 ml a temperatura ambiente. Ripetere questo sette volte.
NOTA: utilizzare una forza sufficiente per rompere i gruppi di cellule, ma evitare le bolle che generano che possono uccidere le cellule. - Riportare il tubo per il bagno d'acqua a 37 ° C per 8 minuti e mescolare agitando ogni 3-4 minuti. Siringa il tessuto su e giù sette volte, come detto sopra, e posizionare un campione (10 microlitri) della soluzione di tessuto su un piatto Petri secca. Osservare la soluzione tessuto sotto un invertito, a contrasto di fase, microscopio ottico con una lente obiettivo 10X. Aspettatevi cellule singole e alcune piccole dimensioni ccluster ELL di essere presenti.
- Maniglia le cellule in ghiaccio da questo punto in poi per rallentare o arrestare l'attività di collagenasi. Regolare il volume a 50 ml con PBS / BSA / DNasi I. Centrifugare le cellule a 400 xg per 5 minuti a 4 ° C e risospendere in 5 ml di PBS freddo / BSA / DNasi I usando una pipetta P1000.
- Aggiungere collagenasi B (100 mg / ml di brodo) a 350-450 ml / 10 ml per i pezzi di tessuto e incubare il tessuto a 37 ° C in un bagno d'acqua per 8 minuti, agitando ogni 3-4 min. Utilizzare una siringa da 10 ml con un ago 16 ½ G per elaborare e successivamente spruzzare la soluzione di tessuto lungo la parete del tubo da 50 ml a temperatura ambiente. Ripetere questo sette volte.
- Filtro per Yield sospensioni singola cella e lavare.
- Filtrare le cellule attraverso una tazza filtro a rete di nylon 70 micron e poi attraverso una tazza filtro a rete di nylon 40 micron.
- Risospendere le cellule in 5 ml di PBS freddo / BSA / DNasi I e contare le cellule.
NOTA: per 2-4 mesi di età B6 o topi CD-1, ciascuno pancreas possono produrre ~ 5 o 10 milioni di cellule, rispettivamente. Questi numeri possono variare tra i diversi sperimentatori. Se detriti cellulari eccessiva è situato al conteggio, portare il volume a 50 ml con PBS / BSA / DNasi I e centrifugare le cellule a 400 xg per 5 minuti a 4 ° C. - Regolare il volume della sospensione cellulare ad una concentrazione di 2 x 107 cellule / ml con PBS / BSA / DNasi I.
2. ordinare alle cellule di arricchire pancreatici Progenitori formanti colonie
NOTA: Da topi B6, CD133 + ma non CD133 - le cellule sono arricchiti per PCFUs 7,9,11. Cellule CD133 + rappresentano ~ 13% del totale dissociato cellule pancreatiche dopo tutti i parametri di gating vengono applicati 11. Da CD-1 nei topi, le cellule CD133 + Sox9-EGFP + tipicamente rappresentano ~ 4% delle cellule del pancreas totale, e questa popolazione di cellule è arricchito da PCFUs 7. Ordinamento delle cellule / EGFP + CD133 + SOX9 è descritto qui.
- Macchiare le cellule pancreatiche dissociato.
- Bloccare l'intera cella singola sospensione pancreatica per ridurre legame non specifico incubando la sospensione singola cella con anti-topo CD16 / 32 a 10 ug / ml concentrazione finale per 5 minuti in ghiaccio.
- Rimuovere una aliquota di 1 x 10 6 cellule (50 &# 181; l) a macchia con l'anticorpo controllo isotipico, biotina-coniugato IgG1 ratto a 5 mg / ml concentrazione finale, per 20 minuti in ghiaccio, agitando ogni 5-7 minuti.
- Rimuovere una aliquota di 1 x 10 6 celle (50 ml) e tenere in ghiaccio come un controllo senza macchia.
- Macchia il resto delle cellule con un anti-topo CD133 anticorpo primario biotina-coniugato, a 5 ug / ml concentrazione finale, per 20 min in ghiaccio, agitando ogni 5-7 min.
- Cellule di lavaggio.
- Lavare il controllo isotipico e campioni colorate con anticorpo primario portando il volume ad 1 ml con PBS / BSA / DNasi I e centrifugare a 400 xg per 5 minuti a 4 ° C. Ripetere questa fase di lavaggio.
- Risospendere il controllo isotipico e campioni colorate con anticorpo primario in PBS / BSA / DNasi I, per cui la concentrazione finale è di 2 x 10 7 cellule / ml.
- Colorare il controllo isotipico e campioni colorate con anticorpo primario con streptavidina (STV) allophycocyanin -labeled (APC) a 2 & #181; g / ml concentrazione finale. Incubare per 15 min in ghiaccio, agitando ogni 5-7 minuti.
- Lavare le cellule e 4 ', 6-diamidino-2-phenylindole colorazione (DAPI).
- Lavare il controllo isotipico e campioni colorate con anticorpo primario due volte con PBS / BSA / DNasi I, come al punto 2.2. Risospendere le cellule in PBS / BSA / DNasi I con DAPI (0,2 mg / ml concentrazione finale). Il volume finale del campione di controllo isotipico deve essere di 0,5 ml.
NOTA: Assicurarsi che la densità finale del campione colorate con anticorpo primario è appropriato per il sorter da utilizzare. Una concentrazione di 5 x 10 6 cellule / ml viene normalmente utilizzato per l'ordinamento. - Regolare il volume delle cellule non colorate a 0,5 ml con PBS / BSA / PS / DNasi I. Filtrare tutte le cellule attraverso una maglia di 20 micron prima cernita e mantenere le cellule in ghiaccio al buio.
- Lavare il controllo isotipico e campioni colorate con anticorpo primario due volte con PBS / BSA / DNasi I, come al punto 2.2. Risospendere le cellule in PBS / BSA / DNasi I con DAPI (0,2 mg / ml concentrazione finale). Il volume finale del campione di controllo isotipico deve essere di 0,5 ml.
- Ordinamento delle cellule.
- Utilizzare un ugello di 80 micron o più grandi per l'ordinamento.
NOTA: le cellule endocrine del pancreas murini sono inclini a stress fisico. HoWever, PCFUs murine non sembrano risentire lo stress causato passando attraverso un sorter 7. - Acquisire gli eventi cellulari e parametri di analisi sul sorter. Porta le cellule per avanti e le zone laterali scatter da escludere detriti cellulari 7. Porta per larghezze in avanti e scatter lato di escludere doppietti cellulari. Porta di escludere DAPI + cellule morte 7. Scegliere gating parametri per i segnali EGFP e CD133-APC in base ai valori delle cellule di controllo isotipico (Figura 1).
- Raccogliere le cellule ordinati in 5 ml provette di polistirene contenenti 1,5 ml di terreno / F12 DMEM supplementato con 5% di siero fetale bovino (FCS). Centrifuga le popolazioni ordinate a 400 xg per 5 minuti e risospendere in un piccolo volume (~ 200 ml) di una DMEM / F12 o PBS / BSA / DNasi I integrata con 5% FCS. Mantenere le cellule in ghiaccio fino al momento dell'uso.
- Utilizzare un ugello di 80 micron o più grandi per l'ordinamento.
- Contare il numero di cellule CD133 + Sox9-EGFP + ottenuti dal selezionatore. Prendete un10 microlitri campione cellulare e contare le cellule con un emocitometro per determinare la densità cellulare.
NOTA: l'uso emocitometro è raccomandato perché conta macchina dalla selezionatrice sono spesso inaffidabili.
3. Piastra le cellule ordinati nella colonia saggio contenenti murini ECM Proteine
NOTA: Si prega di fare riferimento ai protocolli dettagliati per il fasciame delle cellule nel saggio colonia ECM contenenti murino in un'altra pubblicazione JoVE 18.
- Preparare Culture Media.
- Preparare un terreno di coltura contenente DMEM / F12, 1% (p / v) metilcellulosa, 5% (v / v) proteine ECM murine, 50% (v / v) medium condizionato da cellule pancreatiche-like Mesc-derivati, 5% (v / v) FCS, 10 mmol / L nicotinamide, 10 ng / ml ricombinante activin B umana, 0.1 nmol / L exendin-4, e 1 ng / ml di crescita endoteliale vascolare fattore-A. Metodi per generare il terreno condizionato sono descritti altrove 18.
- Aggiungere 750 ng / ml di RSPO-1 al mezzose la formazione di colonie denso si desidera.
- Incubare la coltura proteine ECM murino a 37 ° C e 5% CO 2 per 3 settimane.
4. Cultura le cellule ordinati a 1 cellulare per pozzetto
NOTA: Le seguenti procedure si applicano per la manipolazione di singole cellule utilizzando mano e la bocca le pipette. Un approccio alternativo è quello di acquistare un micromanipolatore. Un tipico micromanipolatore include un microscopio invertito con una piattaforma motorizzata joystick azionato.
- Preparare Vetro Pasteur pipette.
- Utilizzando un becco Bunsen, estrarre la punta di una pipetta Pasteur di vetro ad una multa punto (~ 30 micron in apertura). Le pipette Pasteur di vetro devono avere un tappo di cotone per creare una barriera al flusso d'aria dall'operatore.
- Autoclavare le pipette Pasteur di vetro fiammati a 121 ° C per 20 minuti per la sterilizzazione.
- Preparare piastre con 96 pozzetti per la Cultura.
- Preparare freddo semi-solido terreno di coltura accordozione al protocollo descritto in precedenza 18.
- Distribuire il terreno nei pozzetti interne di una piastra a 96 pozzetti a fondo piatto a basso legame a 100 l / pozzetto utilizzando una siringa da 1 ml. Riempire i pozzetti esterni con acqua sterile per mantenere l'umidità.
- Porre la capsula cultura in ghiaccio fino al momento dell'uso.
- Preparare le cellule ordinati.
- Aggiungere ~ 6.000 cellule raccolte da una selezionatrice a 2,5 volume finale ml di DMEM / F12 / PS contenente 10% FCS e 1% di metilcellulosa in una provetta 5 polistirene. Agitare energicamente per miscelare i componenti. Attendere 5 minuti o finché le bolle alla sommità del tubo. Questa fase non deve essere eseguita su ghiaccio.
- Distribuire la soluzione cella per due 35 piatti mm a 1 ml / piatto utilizzando una siringa da 1 ml con un ago 18 G ½.
- Stendere la soluzione di cellule nel piatto dal dondolo delicatamente il piatto a mano. Non permettere il mezzo semisolido per raggiungere il margine del piatto 35 mm, le singole cellule al margine del pozzo cannot osservare chiaramente utilizzando un microscopio ottico invertito.
- Preparare l'area di lavoro attorno a un microscopio.
- Fare una soluzione contenente DMEM / F-12 medio e 1% di metilcellulosa senza cellule (medium 'no-cell'), ed erogare la soluzione (come descritto in 4.3.2) in due 35 millimetri Petri (1 ml per piastra) .
- Pulire e pulire l'area di lavoro intorno a un microscopio a contrasto di fase invertito con una soluzione di alcool al 70%.
- Montare la pipetta con il boccaglio.
- Scegli una sterile pipetta Pasteur di vetro che è stato preparato nel passo 4.1. Attaccare l'estremità grande di 1 ml di plastica puntale all'inizio della pipetta Pasteur di vetro. Attaccare l'estremità più piccola della plastica punta della pipetta 1 ml ad una estremità di un tubo di gomma a parete sottile, e il boccaglio per l'altra estremità del tubo. Usare la stessa pipetta di vetro per raccogliere più celle dello stesso gruppo.
- Elaborare, dalla bocca di aspirazione, un piccolo volume (~ 10 a 50 microlitri) di"No-cella" soluzione semi-solida fatta al passo 4.4.1 con la pipetta Pasteur di vetro.
NOTA: La soluzione semi-solido a stretta apertura della pipetta Pasteur di vetro crea resistenza al flusso e fornisce una barriera per impedire la contaminazione delle cellule da prelevare.
- Scegliere una singola cella.
- Porre la capsula 35 millimetri contenente le cellule ordinati sul palco microscopio e rimuovere il coperchio.
- Trova le cellule utilizzando una lente obiettivo 10X e messa a fuoco su un cellulare adatto per essere ritirato.
- Trovare e posizionare l'apertura del puntale accanto alla cella di interesse. Applicare l'aspirazione attraverso la bocca.
NOTA: Il movimento della cella deve essere piuttosto lento, in modo che non vi è alcun rischio di perdere il cellulare durante il processo di seguito. Il movimento della cella entrare l'apertura della pipetta deve essere visibile. Se il flusso si muove troppo velocemente, passare a una pipetta con apertura stretta.
- Depositare la singola cella in una cultura Bene.
- Una volta che la cella è nella pipetta, utilizzare la lingua di fermare il flusso bloccando l'apertura del boccaglio. Breve pausa prima di ritirare la punta dal terreno semisolido per garantire che il mezzo semisolido ha smesso di scorrere.
- Posizionare la punta della pipetta in un pozzo nella piastra a 96 pozzetti preparato al punto 4.2. Spingere il cellulare lentamente soffiando delicatamente nella parte di bocca. Mark pozzo dopo la cella viene depositato, per evitare placcatura due celle in un pozzo.
- Assicurarsi che una singola cella è collocato in una cultura Bene.
- Posizionare la punta della pipetta nella 'no-cell' media preparato al punto 4.4.1. Osservando l'apertura della punta al microscopio, spingere la soluzione semi-solido rimanente. Aspettatevi nessuna cella di fuoriuscire la punta della pipetta.
- Per doppio controllo, trovare la posizione nel pozzo cultura in cui è stato impiantato l'singola cella.
- Cultura delle singole cellule a 37 ° C in 5% di CO 2 per un massimoa 3 settimane.
5. Scegliere singole colonie dalla cultura semi-solido per l'analisi Microfluidic qRT-PCR
NOTA: Tre settimane dopo la placcatura allineati cellule CD133 + SOX9 / EGFP + nel saggio colonia ECM contenenti murino, Ring o colonie dense sono formati 7 (Figura 2). Quando anello colonie / dense sono dissociate in sospensione di cellule singole e ri-placcato nella cultura idrogel laminina, colonie endocrino / acinari sono generati dopo circa una settimana 7 (Figura 2). Per determinare la composizione lignaggio di ogni colonia, microfluidica qRT-PCR è utilizzato per rilevare l'espressione di marcatori lignaggio 7. Per la pre-amplificazione, una colonia è mescolato in una master mix contenente un mix TaqMan probe, tampone di reazione, e SuperScript III 21. Il chip 48.48 array viene successivamente utilizzato per le reazioni PCR microfluidica 21.
- Preparare la pre-amplificazione PCRmix contenente 48 sonde.
- Pipettare 1,5 ml di ciascuna sonda TaqMan (20x magazzino) in una provetta da 1,5 ml. Aggiungere 78 ml di tampone TE per regolare il volume a 150 ml.
- Preparare la master mix seguendo i protocolli del produttore 21.
- Mettere 9 ml di master mix in ciascuna da 0,2 ml a parete sottile tubo di reazione adatti per la PCR, e ripetere questo passaggio per un massimo di 48 tubi.
- Scegliere singole colonie dalla cultura semi-solido.
NOTA: Anello / colonie dense sono più grandi colonie endocrino / acinari, con diametri che vanno da ~ 50 a 400 micron 9,11. Pertanto, singolo anello / colonie dense vengono raccolte utilizzando una pipetta P10 dotato di un puntale 10 microlitri che viene piegato in una forma curva. Per raccogliere il piccolo endocrino / colonie acinari (figura 2), fare riferimento al punto 4.- Individuare una colonia di interesse sotto alto ingrandimento (ad esempio, 20X lente dell'obiettivo), ridurre l'ingrandimento, e aspiratvia e la colonia. (Opzionale) Prendere un'immagine a contrasto di fase della colonia in questa fase di documentare le caratteristiche visibili della colonia.
- Trasferire la colonia nel tubo di PCR contenente 9 ml di master mix.
- Scegliere la prossima colonia. Fino a 45 colonie in totale possono essere analizzati per eseguire la PCR, lasciando 3 punti per i controlli.
- Estrazione di RNA e la sintesi del cDNA con pre-amplificazione.
- Vortice campioni vigorosamente prima di eseguire la reazione termica.
- Eseguire le reazioni cicli termici secondo le istruzioni 21 del produttore. Anello / colonie dense richiedono 14 cicli, colonie endocrino / acinari richiedono 16-20 cicli, e le singole cellule richiedono 22 cicli.
NOTA: Pre-amplificazione cDNA possono essere conservati a -20 ° C prima dell'analisi microfluidica PCR.
- Eseguire reazioni PCR successive, utilizzando un chip microfluidico, secondo le istruzioni 21 del produttore.
- Raccolta e Fix Colonie.
- Raccogliete le colonie sotto il microscopio, come nei passaggi 4 o 5.4, e aggiungerli ad una soluzione di paraformaldeide al 4%. Incubare O / N a 4 ° C con un leggero scuotimento.
- Lavare le colonie con 1X PBS due volte per 10-30 minuti a temperatura ambiente. Conservare le colonie fissati a 4 ° C in 1,5 ml tubi sigillati con paraffina.
- Macchiare le colonie con anticorpi.
- colonie Trasferire un pozzetto di una piastra a 96 pozzetti nera con fondo trasparente contenente 200 ml di tampone bloccante (5% asino e / o di siero di capra, 0,1% Triton X-100 in PBS 1x). Incubare O / N a 4 ° C con un leggero scuotimento.
- Diluire l'anticorpo primario ad una concentrazione predeterminata (ad esempio, 1: 500 per il criceto anti-Mucin 1 anticorpi) con tampone di bloccaggio. Trasferire le colonie per un ambiente pulito bene con 200 ml di anticorpo primario e incubare O / N a 4 ° C con un leggero scuotimento. Wcenere colonie 3 volte con PBS contenente 0,1% di Tween 20. Transfer colonie in un nuovo pozzo con 200 microlitri di PBS 1x / 0,1% Tween 20 per 10 minuti a RT per ogni lavaggio.
- Diluire l'anticorpo secondario ad un predeterminato concentrazione (ad esempio, 1: 2.000 per anticorpi di capra anti-hamster armena) utilizzando tampone bloccante. Conservare la soluzione al buio. Trasferire le colonie per pulire pozzetti contenenti 200 ml di anticorpo secondario, e incubare per 2 ore a temperatura ambiente. Lavare le colonie 3 volte con PBS / 0.1% Tween 20, come al punto 6.2.2.
- colonie Counter-macchia con DAPI e visualizzare con microscopia confocale.
- Trasferire le colonie nei pozzetti con PBS contenente 300 Nm DAPI e incubare per 5 minuti a temperatura ambiente.
- Trasferire le colonie DAPI-macchiati di 35 mm Petri fondo di vetro per la visualizzazione. Posizionare un vetrino sopra le colonie per prevenire l'evaporazione.
- Utilizzare un microscopio confocale per catturare le immagini. Per visualizzare DAPI staining, utilizzare eccitazione a due fotoni lunghezza d'onda di 730-950 nm. Utilizzare un laser ad argon con una lunghezza d'onda di 458 nm per eccitare fluorocromi con lunghezze d'onda di emissione di 519 e 561 nm. Utilizzare un laser ad elio-neon con una lunghezza d'onda di 633 nm per eccitare fluorocromi con lunghezze d'onda di emissione di 665 nm.
7. Dissociate e Re-piastra primaria Ring / Dense colonie in secondari Colony Assays
NOTA: Tutte le procedure devono essere eseguite in condizioni sterili. Evitare shock freddo per le cellule di questa procedura il più possibile, come mettere le cellule in cellule di ghiaccio o di lavaggio con PBS freddo / BSA. Tali pratiche riducono la vitalità delle cellule Re-plated.
- Preparare soluzioni.
- Il tampone di lavaggio pre-caldo (DMEM / F12; P / S; 0,1% BSA) in un bagno di acqua a 37 ° C.
- Pre-riscaldare una piastra a 96 pozzetti (fondo piatto, basso vincolante) in un incubatore a 37 °. Aggiungere 100 microlitri 100% FCS ad un pozzetto della piastra e soluzione di tripsina-EDTA 100 microlitri 0,25% ad una secondabene.
- Raccogliere Colonie.
- Pick and in comune per un totale di 20 o più anelli / colonie dense in colture primarie che utilizzano punte per pipette 10 ml, come descritto al punto 5.4.
- Mettere le colonie a caldo (almeno RT) tampone di lavaggio (~ 1000 ml) in una provetta da 1,5 ml e far girare a 400 xg per 5 min. Rimuovere il surnatante.
- Dissociare il colonie in cella singola sospensioni Uso tripsina.
- Trasferire il volume residuo (20 ml o meno), che contiene le colonie, nel pozzo contenente soluzione di tripsina calda (preparato in 7.1).
- Incubare la piastra in un incubatore a 37 ° (non un bagno d'acqua) per 1,5 min. Rimuovere la piastra e pipetta le colonie un paio di volte. Incubare a 37 ° C per altri 1,5 min.
- Rimuovere la piastra e pipetta su e giù un paio di volte per rompere le colonie. Controllare al microscopio per vedere se le colonie sono state disperse in prevalenza in cella singola sospensione.Evitare un eccesso di digestione delle colonie.
- Arrestare la reazione tripsina con l'aggiunta di FCS.
- Trasferire 100 ml di FCS caldi nel pozzo che contiene le cellule. Pipetta su e giù un paio di volte. Trasferire le cellule in una provetta da 1,5 ml contenente 1.000 ml tampone di lavaggio caldo. Centrifugare a 400 xg per 5 minuti a temperatura ambiente.
- Lavare due volte con tampone caldo.
- Risospendere le cellule in ~ 200 ml di tampone o di terreno di coltura.
- Contare il numero di cellule utilizzando un emocitometro. Mantenere la sospensione cellulare a RT.
- Re-plate dissociata cellule in saggi di colonia secondarie che contengono sia le proteine ECM murine (5% v / v) o laminina idrogel (100 mg / ml) e incubare le cellule a 37 ° C con 5% di CO 2.
NOTA: per ri-placcatura cellule in proteine ECM murine, utilizzare 2.500-5.000 cellule per bene e la cultura per 2-3 settimane. Per ri-panti nella cultura idrogel laminina, utilizzare 10,000-25,000 cellule per bene e cultura per 7-12 giorni.
Risultati
Adulti cellule progenitrici del pancreas possono essere arricchiti mediante fluorescenza-attivato cell sorting (Figura 1). La linea di topi transgenici Sox9 / EGFP usato qui è stato generato a seguito del GENSAT Cervello Atlas Progetto 19, e il reporter EGFP è sotto il controllo di un cromosoma artificiale batterico contenente ~ 75 kb a monte e ~ 150 KB sequenze a valle di Sox9 20 . In questi topi, EGFP etichette dotti pancreatici in modo efficiente e in particolare 22. Pancreas è stato procurato e dissociato in una cella singola sospensione, e colorati con gli anticorpi anti-CD133 coniugati con biotina, seguita dalla colorazione con anticorpi secondari coniugati con STV-APC. Le cellule risultanti sono stati analizzati mediante citometria di flusso con parametri di gating appropriati (Figura 1). Le cellule ottenute utilizzando diversi parametri di gating possono essere ordinati e placcato nei saggi di colonia metilcellulosa contenenti perla formazione di colonie. In studi precedenti, è stato osservato che la formazione di colonie capacità si trova solo nella ordinata CD133 + Sox9 / EGFP + cellule duttali 7.
Le colonie formate nei saggi colonia metilcellulosa contenenti stati classificati secondo le loro morfologie, come osservato utilizzando un invertito, a contrasto di fase, microscopio ottico (Figura 2). Successivamente, singole colonie sono state raccolte a mano e analizzati da microfluidica qRT-PCR per l'espressione genica (Figura 3) o con tutto il montaggio immunocolorazione per l'espressione della proteina (Figura 4). In studi pubblicati 7,9,11, si è constatato che molte colonie individuali hanno espresso marcatori lignaggio per condotto (mucina-1), acinare (amilasi) e le cellule endocrine (insulina), che indica che la maggior parte dei PCFUs avvio di queste colonie sono tri-potenti. La proporzione delle tre linee cellulari in ogni colonia Tuttavia, è stato influenzato dai tipi e le concentrazioni di proteine ECM presenti nella colonia saggi 7,9 metilcellulosa contenenti. Proteine ECM murini stimolati auto-rinnovamento di PCFUs e la differenziazione cellulare duttale mentre idrogel laminina preferenzialmente sostenuto la differenziazione del sistema endocrino e cellule acinose linee 7,9,11.
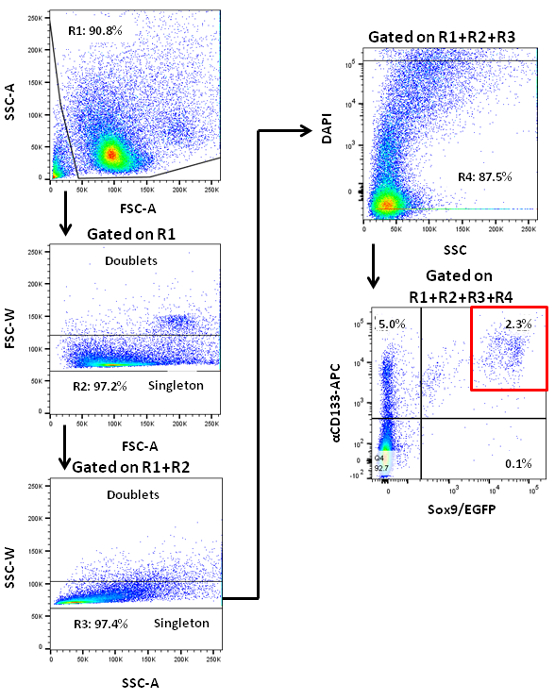
Figura 1. citometria a flusso delle cellule pancreatiche dissociate da topi adulti che mostrano pattern di colorazione in base a due marcatori di cellule duttali, CD133 e Sox9. Sox9 / EGFP topi transgenici che conteneva Sox9 loci-driven EGFP giornalista sono stati utilizzati. Viene mostrato un cancello di smistamento rappresentante (scatola rossa) per il pancreas CD133 + cellule / EGFP + SOX9. Cellule / EGFP + CD133 + SOX9 sono arricchiti per PCFUs 7.les / ftp_upload / 54016 / 54016fig1large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
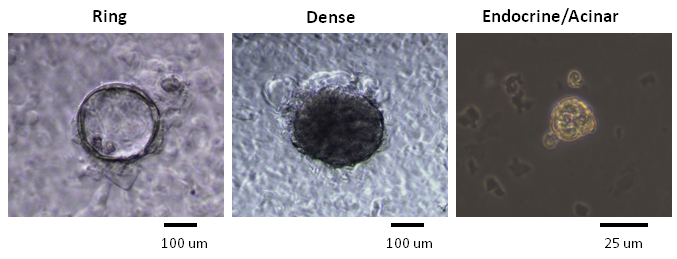
Figura 2. Le colonie con diverse morfologie sono stati generati in saggi colonia metilcellulosa contenenti. Microfotografie rappresentativi di anello, vengono mostrati colonie dense e endocrino / acinari da un microscopio a contrasto di fase illuminata dalla luce visibile. Ring e colonie dense vengono generate quando PCFUs appena ordinati sono placcati in terreno di coltura contenente proteine ECM murini e coltivate per 3 settimane 7. Colonie endocrino / acinari si formano dopo la ri-placcatura il cellule colonia densi Anello dissociato o in terreno di coltura contenente un idrogel laminina e coltivate per ~ 1 settimana 7. Barre di scala per Ring e colonie dense = 100 micron. Barra di scala per Endo / acinose colonie = 25 μ;. m Clicca qui per vedere una versione più grande di questa figura.
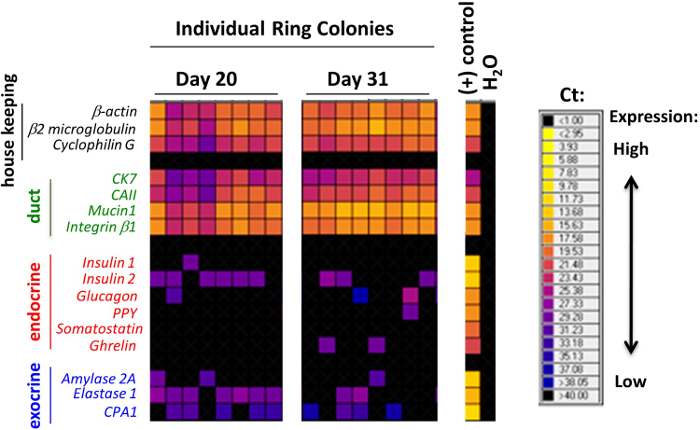
Figura 3. colonie individuali coltivate in proteine ECM murine marcatori per cellule duttali, acinari ed endocrini espresse. I risultati rappresentativi di microfluidica qRT-PCR di colonie anello individuali. Ogni colonna rappresenta una singola colonia. I livelli di espressione di geni sono espressi come calore mappa qui, con colori più caldi indicativi di una maggiore espressione e colori più freddi indicativi di espressione più bassa. Molte delle singole colonie esprimere almeno uno dei geni in ogni pannello per i marcatori indicativi del condotto, endocrine o lineage cellule acinose. Questi dati dimostrano che molte delle singole colonie esprimono marcatori tri-lignaggio, e suggeriscono che la maggior partePCFUs originari sono tri-potenti. Questa cifra viene modificato da una figura in precedenza pubblicato 7. Clicca qui per vedere una versione più grande di questa figura.

Figura 4. Due colonie anello espresso una proteina marker duttale Mucin 1. Risultati rappresentativi di immunocolorazione delle colonie anello tutto il montaggio, che mostra l'espressione della proteina di un marcatore duttale Mucin 1 (colore verde). I nuclei sono contro-colorati con DAPI (colore blu). Molte cellule in queste colonie Anello esprimono Mucin 1 proteine. Ciò è coerente con i risultati microfluidica qRT-PCR che mostrano che le colonie Anello coltivate in proteine ECM murini esprimono livelli elevati (colori più caldi in figura 3) di mucin1 e di altri marcatori cellulari duttale. La barra di scala rappresentanoS 50 micron. Cliccate qui per vedere una versione più grande di questa figura.
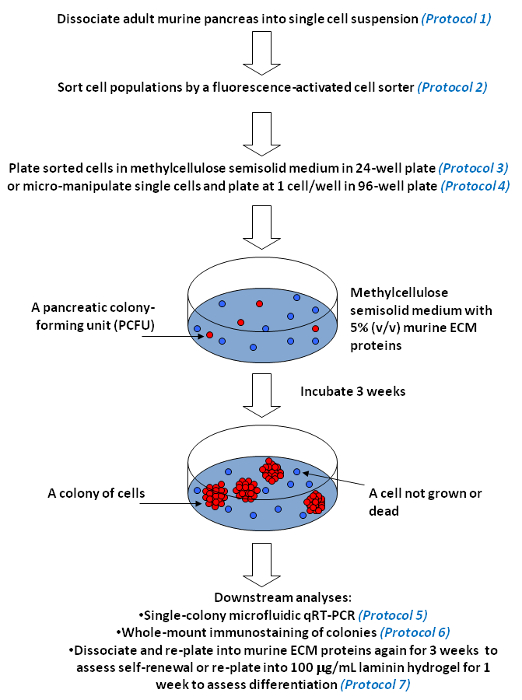
Figura 5. saggi di colonia pancreatici per la misura di auto-rinnovamento e multi-lignaggio differenziazione delle cellule progenitrici individuali in coltura. Flusso di lavoro rappresentante è presentato. I nostri saggi colonia pancreatiche contengono un materiale viscoso, metilcellulosa, in modo che il mezzo di coltura diventa semi-solido. mezzo semisolido limita il movimento e impedisce l'aggregazione delle cellule progenitrici singoli (indicata in rosso). Tuttavia, il mezzo è abbastanza morbido per consentire una singola cellula progenitrice di auto-rinnovare e / o differenziare, e crescere in una colonia di cellule (rappresentato da più cerchi rossi). Al contrario, le singole cellule che non hanno le capacità di formazione di colonie, vale a dire, le cellule non-progenitrici (indicato in blu), rimangono come singole cellule o morire nel corso del tempo nella cultura. Metilcellulosa permette anche l'inserimento di proteine ECM a basse concentrazioni, come il 5% di proteine murine ECM o 100 mg / ml idrogel laminina. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
I saggi colonia pancreatiche e singola colonia analisi qui descritti sono stati ispirati dai saggi delle colonie ematopoietiche metilcellulosa contenenti che hanno giocato un ruolo importante nel decifrare la biologia delle cellule progenitrici ematopoietiche nei decenni passati 23. In questi test (Figura 5), dissociate cellule del pancreas sono placcati in metilcellulosa contenenti supporti semi-solido con fattori di crescita appropriati e proteine ECM che sostengono la formazione di anello, densa o endocrino / acinari colonie 7. Una singola cellula progenitrice che è capace di dare luogo ad una colonia di cellule è definito un PCFU. Caratterizzando colonie individuali utilizzando microfluidica qRT-PCR e tutto il montaggio immunostaining, le potenzialità lignaggio dei PCFUs originarie possono essere dedotte. Si è constatato che la maggioranza dei PCFUs murini adulti sono tri-potenti, capaci di dare origine a duttale, acinar, e le cellule endocrine lignaggio in vitro 7,9. mentre murine proteine ECM favorire la differenziazione delle PCFU tri-potenti verso condotto lignaggio, l'idrogel laminina permette endocrino robusto e cellule acinose lignaggio differenziazione 7,9. Per valutare in vitro capacità di auto-rinnovamento della PCFUs, l'anello o dense colonie coltivate in un test ECM colonia murino primario può essere dissociato in cella singola sospensione e ri-placcato in un murino ECM saggio colonia secondaria 7. Si è constatato che PCFUs ampliato ~ 500.000 volte in proteine ECM murine più di 11 settimane 7. Le fasi critiche comprendono la rimozione dei tessuti grassi dal pancreas sezionato, evitando over-digestione delle cellule pancreatiche da collagenasi, e minimizzando shock termico alle cellule colonia Dense dissociate anello / prima di ri-placcatura. Mastering micromanipolazione di singole cellule può richiedere un certo tempo; sono necessari pazienza e pratica.
Rispetto ad altri test di cellule progenitrici del pancreas, tra cui la cultura 2D 24, le suspension "pancreasphere" 25 ed i saggi organoide 12-15, i principali vantaggi dei saggi colonia metilcellulosa contenenti qui descritti sono i seguenti. Innanzitutto, l'aggiunta e la sintonizzazione di proteine ECM ad una vasta gamma di concentrazioni possono essere realizzati facilmente. Questo perché metilcellulosa è la sostanza che conferisce la natura 3D del mezzo semisolido. Al contrario, i metodi di coltura organoide dipendono dalla solidificazione delle proteine ECM murine, presenti al 33% v / v o superiore. Va osservato che il meno 1% proteina murina ECM può inibire la differenziazione delle cellule endocrine 9, sottolineando l'importanza della concentrazione della proteina ECM nel saggio cellule progenitrici. In secondo luogo, le colonie sono equamente distribuiti in tutta la cultura bene e possono essere contati con precisione. In terzo luogo, le colonie singoli possono essere facilmente selezionati con cura per la successiva analisi. In quarto luogo, il mezzo semisolido metilcellulosa contenente è facile da mantenere, e nessun mezzocambiamento è richiesto durante il corso della coltura. Infine, un gran numero di cellule (fino a 25.000 cellule per 24 pozzetti) possono essere placcati ed esaminati in questi test colonia, rendendoli efficiente per rilevare attività di cellule progenitrici anche se sono una popolazione minore tra le cellule piastrate.
I saggi di cellule progenitrici del pancreas qui descritte si basano su funzionale, ma non basata sui marcatori, analisi delle cellule progenitrici del pancreas. Ciò significa che le cellule progenitrici del pancreas possono essere studiate senza sapere cosa marcatori che esprimono. Questo è importante perché c'è poca conoscenza di ciò che i marcatori specifici delle cellule progenitrici pancreatiche adulte possono esprimere. Inoltre, marcatori per cellule progenitrici pancreatiche embrionali non possono essere adeguati per lo studio dei progenitori adulti. Utilizzando analisi funzionali, si può cominciare a individuare marcatori di cellule progenitrici specifici determinando prima sub-popolazione che ha un'attività PCFU, come il CD133 + </ sup> cellule / EGFP + SOX9 illustrati qui. Questo può essere seguito da l'identificazione, utilizzando RNA-Seq, di geni che sono differenzialmente espressi dalla popolazione PCFU contenenti. I marcatori candidati possono poi essere testati e verificati da test come ad esempio in vitro e in vivo le tecniche lineage tracing che traccia le capacità di differenziazione delle cellule progenitrici.
Le limitazioni dei test colonia metilcellulosa contenenti in vitro sono di tre tipi. In primo luogo, anche se i saggi mimano il microambiente in vivo del pancreas fornendo proteine ECM e fattori di crescita per le cellule progenitrici pancreatiche nello spazio 3D in coltura, le condizioni non sono identici. Inoltre, le strutture delle cellule epiteliali in vivo sono interrotti per dissociazione in cellule singole, che possono avere conseguenze importanti. Pertanto, sarà importante verificare cellule progenitrici in studi di follow-up utilizzando in vivo Saggi. In secondo luogo, i componenti della cultura contengono reagenti non definiti, come le proteine murine ECM, FCS, e dei media condizionati 18. Questi componenti non definiti possono influenzare la funzione di fattori di crescita specifici sulle cellule progenitrici indirettamente e più lavoro è necessario per creare un set completo della condizioni di coltura. Infine, lineage tracing esperimenti hanno dimostrato cellule acinose-to-beta cellule 26,27 o alfa cellule-to-beta 28 conversioni in vivo in topi adulti. Le condizioni di coltura metilcellulosa qui descritte possono essere specifici solo per la conversione delle cellule del condotto-a-beta. Altre condizioni di coltura sconosciuti possono essere necessari per le cellule non-Duct per convertire in cellule beta in coltura.
Ci sono diversi casi in cui può essere necessario la risoluzione dei problemi. Ad esempio, se le cellule dissociate sono raggruppate insieme, utilizzare dosi più elevate di DNasi I in soluzioni. DNase I è importante per evitare grovigli di cellule pancreatiche dissociate causate da mo DNAlecules rilasciato dalle cellule morte (vedi punto 1.3.2).
In alternativa, se i tessuti macinate bastone nella pipetta 10 ml, tritare il tessuto in pezzi più piccoli. L'apertura della pipetta 10 ml deve essere sufficientemente ampia per i pezzi di tessuto di passare attraverso dopo digestione collagenasi. Se si blocca pezzi sulla punta della pipetta 10 ml, questo indica che la macinazione del tessuto da parte delle forbici a molla non è sufficiente (vedi punto 1.3.4).
Un altro problema che può sorgere c'è crescita delle colonie di proteine ECM murine dalle cellule pancreatiche dissociate (ad esempio, le cellule non ordinati). Se questo accade, non tentare di rompere tutti i cluster in singole cellule durante la fase di dissociazione del pancreas, in quanto ciò potrebbe causare overdigestion e la morte cellulare. Se ci sono grandi pezzi, restituire il tubo a 37 ° C per pochi (4) min e la siringa 7 volte o meno. Controllare nuovamente le cellule sotto il microscopio. Il tempo massimo per trattamento con collagenasi B è di 30 min. Depending sul collagenasi utilizzato, il momento ottimale per la digestione può essere diverso (vedi punto 1.4.2).
Inoltre, ciuffi di murine proteine della matrice extracellulare nei pozzi di coltura possono essere osservati dopo l'incubazione. Per evitare questo, assicurarsi che tutti i componenti della cultura che entrano in contatto con murine proteine della matrice extracellulare sono tenuti freddo sul ghiaccio per evitare la solidificazione prematura prima dell'incubazione a 37 ° C (vedi punto 3).
Inoltre, può essere difficile a raccogliere una cella alla volta in una pipetta Pasteur di vetro. Una soluzione a questo è di ridurre la densità delle cellule appena filtrate placcati nel mezzo semisolido per assicurarsi che una cellula ha una distanza sufficiente da altre celle. Ciò eviterà ricevuto più celle contemporaneamente. Inoltre, è preferibile posizionare il fuoco del microscopio vicino al fondo del mezzo semisolido, in quanto è più facile raccogliere singole cellule mano vicino quel piano senza micromanipolatore (vedi punto 4.6.2).
Inoltre, può essere chiaro se manipolazione singola cella è riuscita. Una soluzione è praticare il singolo micromanipolazione cellulare prima dell'esperimento attuale. Una volta che la cella viene prelevato nella pipetta Pasteur di vetro, trasferire la cella a una Petri piastra da 35 mm avente 1 ml di soluzione di metilcellulosa 1% senza cellule ( 'no-cell' terreno preparato nel passaggio 4.4.1). Visualizzare e posizionare l'apertura della punta della pipetta Pasteur a fuoco al microscopio, e spingere la cella lentamente. Aspettiamo che la singola cella di apparire lentamente intorno alla punta della pipetta e quindi spostare nel mezzo di 'no-cell' (vedi punto 4.8.2).
Infine, nessuna crescita delle colonie può verificarsi nelle colture secondarie di colonie anello primario / Dense dissociate. Per la risoluzione dei problemi, in modo che le cellule provenienti da colonie primarie dissociate sono tenuti in RT prima di placcatura in culture secondari. Per la coltura in proteine ECM murine, aggiungile cellule ultimi alla provetta contenente terreno di coltura freddo prima di miscelazione 18, riducendo al minimo l'esposizione delle cellule alla temperatura fredda, che può uccidere le cellule dissociate ottenute da colonie primarie. Tuttavia, la ri-placcatura di celle in laminina idrogel non deve essere eseguita su ghiaccio prima 37 ° C di incubazione (vedere la fase 7).
In sintesi, due saggi di colonia metilcellulosa contenenti sono stati utilizzati per caratterizzare le cellule progenitrici simili dal pancreas di adulti 7,11 e postnatale giovani topi 9,10, così come dal fegato di topi giovani 10. Le future applicazioni saranno diretti alla identificazione e caratterizzazione delle cellule progenitrici formanti colonie umane da organi del pancreas da cadavere.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Lucy Brown e Alexander Spalla dalla Analytical Citometria core a Città della Speranza per l'assistenza nella selezione. Questo lavoro è supportato in parte dal National Institutes of Health (NIH) sovvenzioni R01DK081587 e R01DK099734 per HTK e U01DK089533 di ADR, e dalla National Science Foundation concessione NSF-DMR-1.206.121 e California Institute for Regenerative Medicine concessione RB5-07398 a DAT Supporti dal Joseph J. Jacobs Istituto di Ingegneria molecolare per la Medicina al Caltech di DAT, e quelli da Oxnard Foundation e Ella Fitzgerald Foundation per HTK sono anche riconosciuto con gratitudine.
Finanziamento: Questo lavoro è supportato in parte dal National Institutes of Health (NIH) concede R01DK081587 e R01DK099734 per HTK e U01DK089533 di ADR, e dalla National Science Foundation concessione NSF-DMR-1.206.121 e California Institute for Regenerative Medicine concessione RB5-07398 a DAT supporta da Joseph J. JacobsIstituto di Ingegneria Molecolare per la Medicina al Caltech di DAT, e quelli da Oxnard Foundation e Ella Fitzgerald Foundation per HTK sono anche ringraziano. La ricerca riportato nella presente pubblicazione incluso lavoro svolto nel Analitica citometria Core e microscopia ottica Digital Imaging Nucleo sostenuto dal National Cancer Institute dei National Institutes of Health con il numero premio P30CA33572.
Sponsor dello studio: Lo sponsor non ha partecipato allo studio di progettazione, la raccolta, l'analisi, o l'interpretazione dei dati.
Materiali
| Name | Company | Catalog Number | Comments |
| Murine ECM proteins (Matrigel) | Becton Dickson (Franklin Lakes, NJ, USA) | 354230 | Stock kept at -20oC |
| Laminin Hydrogel | Provided by David Tirrell (Pasadena, CA USA) | Stock kept at -20oC | |
| Methylcellulose | Shinetsu Chemical (Tokyo, Japan) | 1500 centipoise (dynamic viscosity unit equal to 15g/cm/s) (high viscosity) | |
| Dulbecco's Phosphate-Buffered Saline | Mediatech (Manassas, VA, USA) | 21-031-CV | |
| Phosphate Buffered Saline | Gibco (Grand Island, NY, USA) | 15070-063 | |
| 50mL Flacon Conical vial | Corning Inc. (Corning, NY, USA) | 352070 | |
| 100mmx20mm Suspension culture dish | Corning Inc. (Corning, NY, USA) | 430591 | |
| Bovine Serum Albumin | Sigma (St. Louis, MO, USA) | A8412 | |
| Penicillin/Streptomycin | Gibco (Grand Island, NY, USA) | 15070-063 | |
| DNase1 | Calbiochem (Darmstadt, Germany) | 260913 | |
| Collagenase B | Roche (CH-4070, Basel, Schweiz, Switzerland) | 11088831001 | Stock kept at -20oC |
| Anti-mouse CD16/32 | Biolegend (San Diego, CA, USA) | 101310 | low endotoxin, azide free |
| PE-Cy7 Rat IgG2a κ Isotype Control | Biolegend (San Diego, CA, USA) | 400522 | |
| Rat IgG1 κ Isotype Control | eBioscience (San Diego, CA, USA) | 13-4301-82 | |
| Anti-CD133-Biotin | eBioscience (San Diego, CA, USA) | 13-1331-82 | |
| Anti-CD71-PE-Cy7 | Biolegend (San Diego, CA, USA) | 113812 | |
| Streptavidin-Allophycocyanin | Biolegend (San Diego, CA, USA) | 405207 | |
| 4',6-Diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | 3571 | Stock kept at -20oC |
| Anti-mucin 1 | Thermo Fisher Scientific (Waltham, MA USA) | HM-1630-P1 | |
| Dylight 649 Goat anti-Armenian Hamster | Jackson Immuno (West Grove, PA, USA) | 127-495-160 | |
| Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 | Mediatech(Manassas, VA, USA) | 10-092-CV | |
| Fetal Bovine Serum | Tissure Culture Biologicals (Long Beach, CA, USA) | 101 | Stock kept at -20oC |
| Tris Ethylenediaminetetraacetic acid | TEKnova (Hollister, CA, USA) | T0221 | |
| Rneasy Micro Kit | Qiagen (Venlo, Netherlands) | 74004 | |
| QuantiTec Reverse Transcription Kit | Qiagen (Venlo, Netherlands) | 205310 | |
| CellsDirect One-Step qRT-PCR Kit | Ambion/Invitrogen(Grand Island, NY, USA) | 11753-100 | |
| Paraformaldehyde | Santa Cruz Bio (Santa Cruz, CA, USA) | SC-281692 | |
| Goat serum | Jackson Immuno (West Grove, PA, USA) | 005-000-121 | Stock kept at -20oC |
| Donkey serum | Jackson Immuno (West Grove, PA, USA) | 0017-000-121 | Stock kept at -20oC |
| Triton X-100 | Sigma (St. Louis, MO, USA) | T9284 | |
| Trypsin | Sigma (St. Louis, MO, USA) | T-4799 | |
| Ethylenediaminetetraacetic acid | Invitrogen (Waltham, MA, USA) | 15575-020 | |
| Trypsin-EDTA | Life Technologies (Waltham, MA, USA) | 25200-056 | |
| Sterile Water | Gibco (Grand Island, NY, USA) | 15230-147 | Molecular biology grade |
| Pasteur Pipette | Fisher Scientific (Pittsburgh, PA , USA) | 13-678-8B | |
| 40um Filter Mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-1 | |
| 70 um filter mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-2 | |
| TC Plate 96 Well Suspension | Sarstedt | 83.3924 (Previously 83.1835) | |
| 1cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 309659 | |
| 10cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 301604 | |
| 48.48 Dyanmic Array Chip | Fluidigm (San Francisco, CA, USA) | BMK-M-48.48 | |
| Fluidigm GE 48.48 Dynamic Array Sample & Assay Loading Reagent Kit | Fluidigm (San Francisco, CA, USA) | 85000800 | |
| TaqMan Universal PCR Master Mix | Applied Biosystems (Grand Island, NY, USA) | 4304437 | |
| Polyethylene glycol sorbitan monolaurate | Sigma (St. Louis, MO, USA) | P7949 | |
| Glass Bottom Dish | MatTek (Ashland, MA, USA) | P35G-1.5-14-C | 35 mm petri dish with glass bottom |
| Mouth Piece/ Rubber Tubing | Renova Life Inc. (College Park, MD, USA) | MP-SET | |
| Nicotinamide | Sigma (St. Louis, MO, USA) | N0636 | Stock kept at -20oC |
| Vascular Endothelial Growth Factor | R&D Systems (Minneapolis, MN, USA) | 293-VE | Stock kept at -80oC |
| Activin B | R&D Systems (Minneapolis, MN, USA) | 659-AB | Stock kept at -80oC |
| Extendin 4 | Sigma (St. Louis, MO, USA) | E7144 | Stock kept at -20oC |
| Rspondin-1 | R&D Systems (Minneapolis, MN, USA) | 3474-RS | Stock kept at -80oC |
| Falcon 5mL Polystyrene Round-Bottom Tube | Corning Inc. (Corning, NY, USA) | 352054 | |
| PrecisionGlide Needle 18Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305196 | |
| PrecisionGlide Needle 16Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305198 | |
| Costar Ultra-Low Attachment Surface 24 well flat bottom plate | Corning Inc. (Corning, NY, USA) | 3473 | |
| Costar 96 Black Well Plate | Corning Inc. (Corning, NY, USA) | 3603 | Flat, clear bottom with lid. Black polystyrene TC-treated microplates |
| Zeiss LSM510 META NLO Axiovert 200M Inverted Microscope | Carl Zeiss AG (Oberkochen, Germany) | ||
| Biomark HD | Fluidigm (San Francisco, CA, USA) | ||
| Aria Special Order Research Product Cell Sorter | Becton Dickson (Franklin Lakes, NJ, USA) |
Riferimenti
- Gu, G., Brown, J. R., Melton, D. A. Direct lineage tracing reveals the ontogeny of pancreatic cell fates during mouse embryogenesis. Mech Dev. 120, 35-43 (2003).
- Kopp, J. L., et al. Sox9+ ductal cells are multipotent progenitors throughout development but do not produce new endocrine cells in the normal or injured adult pancreas. Development. 138, 653-665 (2011).
- DiGiusto, D. L., et al. RNA-based gene therapy for HIV with lentiviral vector-modified CD34(+) cells in patients undergoing transplantation for AIDS-related lymphoma. Science translational medicine. 2, 36-43 (2010).
- Inada, A., et al. Carbonic anhydrase II-positive pancreatic cells are progenitors for both endocrine and exocrine pancreas after birth. Proc Natl Acad Sci U S A. 105, 19915-19919 (2008).
- Solar, M., et al. Pancreatic exocrine duct cells give rise to insulin-producing beta cells during embryogenesis but not after birth. Dev Cell. 17, 849-860 (2009).
- Ku, H. T. Minireview: pancreatic progenitor cells--recent studies. Endocrinology. 149, 4312-4316 (2008).
- Jin, L., et al. Colony-forming cells in the adult mouse pancreas are expandable in Matrigel and form endocrine/acinar colonies in laminin hydrogel. Proc Natl Acad Sci U S A. 110, 3907-3912 (2013).
- Fu, X., et al. MicroRNA-26a targets ten eleven translocation enzymes and is regulated during pancreatic cell differentiation. Proc Natl Acad Sci U S A. 110, 17892-17897 (2013).
- Ghazalli, N., et al. Postnatal Pancreas of Mice Contains Tripotent Progenitors Capable of Giving Rise to Duct, Acinar, and Endocrine Cells In Vitro. Stem Cells Dev. , (2015).
- Jin, L., et al. Colony-forming progenitor cells in the postnatal mouse liver and pancreas give rise to morphologically distinct insulin-expressing colonies in 3D cultures. Rev Diabet Stud. 11, 35-50 (2014).
- Jin, L., et al. In Vitro Multilineage Differentiation and Self-Renewal of Single Pancreatic Colony-Forming Cells from Adult C57Bl/6 Mice. Stem Cells Dev. , (2014).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. Embo J. 32, 2708-2721 (2013).
- Greggio, C., et al. Artificial three-dimensional niches deconstruct pancreas development in vitro. Development. 140, 4452-4462 (2013).
- Lee, J., et al. Expansion and conversion of human pancreatic ductal cells into insulin-secreting endocrine cells. Elife. 2, e00940 (2013).
- Dorrell, C., et al. The organoid-initiating cells in mouse pancreas and liver are phenotypically and functionally similar. Stem Cell Res. 13, 275-283 (2014).
- Ku, H., Yonemura, Y., Kaushansky, K., Ogawa, M. Thrombopoietin, the ligand for the Mpl receptor, synergizes with steel factor and other early acting cytokines in supporting proliferation of primitive hematopoietic progenitors of mice. Blood. 87, 4544-4551 (1996).
- Ku, H. T., et al. Insulin-expressing colonies developed from murine embryonic stem cell-derived progenitors. Diabetes. 56, 921-929 (2007).
- Winkler, M., et al. A quantitative assay for insulin-expressing colony-forming progenitors. J Vis Exp. , e3148 (2011).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Formeister, E. J., et al. Distinct SOX9 levels differentially mark stem/progenitor populations and enteroendocrine cells of the small intestine epithelium. Am J Physiol Gastrointest Liver Physiol. 296, G1108-G1118 (2009).
- Seymour, P. A., et al. A dosage-dependent requirement for Sox9 in pancreatic endocrine cell formation. Dev Biol. 323, 19-30 (2008).
- Ogawa, M. Differentiation and proliferation of hematopoietic stem cells. Blood. 81, 2844-2853 (1993).
- Suzuki, A., Nakauchi, H., Taniguchi, H. Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting. Diabetes. 53, 2143-2152 (2004).
- Seaberg, R. M., et al. Clonal identification of multipotent precursors from adult mouse pancreas that generate neural and pancreatic lineages. Nat Biotechnol. 22, 1115-1124 (2004).
- Zhou, Q., Brown, J., Kanarek, A., Rajagopal, J., Melton, D. A. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 455, 627-632 (2008).
- Baeyens, L., et al. Transient cytokine treatment induces acinar cell reprogramming and regenerates functional beta cell mass in diabetic mice. Nat Biotechnol. 32, 76-83 (2014).
- Thorel, F., et al. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature. 464, 1149-1154 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon