Method Article
Los ensayos in vitro de colonias para la caracterización de células progenitoras Tri-potentes Aislado de los murinos adultos Páncreas
* Estos autores han contribuido por igual
En este artículo
Resumen
En ensayos de colonias in vitro para la detección de auto-renovación y diferenciación de células progenitoras aisladas de páncreas murinos adultos estén concebidas. En estos ensayos, los progenitores de páncreas dan lugar a colonias de células en el espacio de 3 dimensiones en un medio semi-sólido que contiene metilcelulosa. Se describen protocolos para la manipulación de células individuales y caracterización de las colonias individuales.
Resumen
Madre y células progenitoras de páncreas adulto podría ser una fuente potencial de las células beta-como terapéuticos para el tratamiento de pacientes con diabetes tipo 1. Sin embargo, todavía no se sabe si existen células madre y progenitoras en el páncreas adulto. Las estrategias de investigación que utilizan cre-lox linaje de trazado en ratones adultos han arrojado resultados que apoyar o refutar la idea de que las células beta pueden ser generados a partir de los conductos, el presunto lugar donde adultos progenitores pancreáticos pueden residir. Estos métodos de trazado de linaje in vivo cre-lox, sin embargo, no pueden responder a las preguntas de auto-renovación y diferenciación de dos criterios múltiples linajes necesarios para definir una célula madre. Para empezar a solucionar esta brecha técnica, ideamos ensayos de colonias en 3 dimensiones para progenitores pancreáticos. Poco después de nuestra primera publicación, otros laboratorios desarrollaron independientemente un similar, pero no idéntica, método llamado el ensayo organoid. En comparación con el ensayo organoide, nuestro método empleametilcelulosa, que forma soluciones viscosas que permiten la inclusión de proteínas de matriz extracelular en bajas concentraciones. Los ensayos que contiene metilcelulosa, permiten la detección y el análisis de las células progenitoras a nivel de una sola célula, que son críticos cuando los progenitores constituyen una pequeña subpoblación más fácil, como es el caso de muchas células madre adultas de órganos. En conjunto, los resultados de varios laboratorios demuestran in vitro auto-renovación y multi-linaje diferenciación de células progenitoras similar pancreáticas de ratones. Los protocolos actuales describen dos ensayos de colonias a base de metilcelulosa para caracterizar progenitores pancreáticos de ratón; uno contiene una preparación comercial de proteínas de la matriz extracelular murino y el otro una proteína de matriz extracelular artificial conocido como un hidrogel laminina. Las técnicas que se muestran aquí son 1) disociación del páncreas y la clasificación de CD133 + Sox9 / EGFP + células ductales de ratones adultos, 2) la manipulación sola célula de las scélulas orted, 3) sola colonia análisis usando microfluidos QRT-PCR y todo el montaje inmunotinción, y 4) la disociación de las colonias primarias en una sola célula suspensiones y re-chapado en ensayos de colonias secundarias para evaluar la auto-renovación o diferenciación.
Introducción
El páncreas se compone de tres grandes linajes de células; Las células acinares segregan enzimas digestivas, conductos secretan mucina para defenderse de patógenos y el transporte de las enzimas digestivas en el intestino, y las células endocrinas secretan hormonas, como la insulina y el glucagón, que mantienen la homeostasis de la glucosa. Durante el desarrollo embrionario del páncreas, las células ductales primeros son la fuente de las células progenitoras tri-potente capaz de dar lugar a los tres linajes en el páncreas de animales adultos 1,2. Dado que las células madre y progenitoras adultas, tales como células madre de médula ósea, ya se utilizan con éxito para el tratamiento de diversas enfermedades 3, hay un gran interés en la búsqueda de las células madre y progenitoras en el páncreas adulto. Si el aislamiento y la manipulación de células madre y progenitoras pancreáticas adultas eran posibles, estas células podrían utilizarse para tratar enfermedades tales como la diabetes tipo 1, en el que las células secretoras de insulina se destruyen por autoinmunidad.
si las células progenitoras tri-potente todavía existen en los conductos pancreáticos adultos después de la finalización del desarrollo embrionario es una cuestión que está muy debatido en la comunidad científica. En este debate, y el uso in vivo cre-lox linaje de trazado de técnicas, Inada y colaboradores demostraron que las células ductales murinos adultos marcados con un marcador, anhidrasa carbónica II, podrían dar lugar a los tres linajes pancreáticos 4. Sin embargo, utilizando otros marcadores ductales, como HNF1B 5 y Sox9 2, se concluyó que las células ductales no son la principal fuente de las células beta en ratones adultos.
Hace varios años, hemos propuesto que la causa del mencionado debate puede ser debido a la falta, en el campo de 6,7, de herramientas analíticas adecuadas que se pueden utilizar para medir la auto-renovación y multi-linaje de diferenciación y dos criterios necesarios para definir una célula madre. El vivo cre-lox técnica de trazado de linaje en el mencionadoanterior puede proporcionar evidencia de la relación progenitor-hijo en un nivel de población. Sin embargo, esta técnica de rastreo de linaje está limitada en su poder de discernir si las células progenitoras individuales pueden auto-renovarse y diferenciarse en múltiples linajes. El análisis de una sola célula es importante porque si varios progenitores mono-potente, cada uno con un potencial de linaje diferente, se analizaron en conjunto, pueden aparecer colectivamente tener capacidades de diferenciación de múltiples linajes. Además, las células madre son por lo general una población menor de un órgano adulto. Las actividades de una población de células de menor importancia podrían ser enmascarados por la importante población. Por lo tanto, un resultado negativo de un estudio de la población no indica necesariamente la ausencia de células madre. Por último, el trazado de cre-lox linaje actualmente no permiten la medición de auto-renovación.
Para empezar a solucionar la brecha técnica en el campo de la biología de células progenitoras de páncreas, colonia 7-11 o 12-15 organoid ensayos que utilizan sistemas de cultivo en 3D. Dos ensayos de colonias de progenitores pancreáticos se han desarrollado en nuestro laboratorio: uno contiene una preparación comercial de proteínas murinas de la matriz extracelular (ECM) (ver Métodos y equipos de mesa), y el otro contiene hidrogel laminina, una proteína artificial ECM definido 7-11. Las células progenitoras se mezclan en un medio semi-sólido que contiene metilcelulosa. Metilcelulosa es un material biológicamente inerte y viscoso preparado a partir de fibras de madera, y se ha utilizado de forma rutinaria en ensayos de colonias hematopoyéticas 16. El medio semi-sólido que contiene metilcelulosa-restringe el movimiento de las células progenitoras individuales de manera que no pueden volver a agregado. Sin embargo, el medio es lo suficientemente suave para permitir que una célula progenitora para crecer y diferenciarse en una colonia de células en el espacio 3D. Siguiendo la tradición de los hematólogos, una célula progenitora pancreática que era capaz de dar lugar a una colonia de células era named una unidad formadora de colonias de páncreas (PCFU). PCFUs, cuando se cultiva en el ensayo de colonias que contiene ECM-murino, dan lugar a colonias quísticas que se denominan colonias "anillo" 7. Tras la adición de un agonista de Wnt, R-spondin1, en el cultivo que contiene ECM-murino, algunas colonias del anillo se convierten en colonias "densos" 7. En este artículo, estos dos tipos de colonias crecidas en cultivo ECM murino se conocen colectivamente como "anillo colonias / densos". Cuando el anillo / Densas colonias se disocian en suspensión de células individuales y re-chapada en cultivos que contienen hidrogel laminina, colonias "Endocrino / acinares" se forman 7.
El uso de una sola colonia de análisis, se encontró que la mayoría de las colonias Anillo / denso y Endocrino / acinares, ya sea de adultos (2-4 meses de edad) 7,11 o jóvenes (1 semana de edad) 9 páncreas murino, expresan los tres marcadores de linaje. Esto sugiere que la mayoría de los PCFUs originarios se tri-potente. En el ensayo de colonias que contiene ECM-murino, adulto PCFUs murino robusta auto-renovarse y ampliar aproximadamente 500.000 veces más de 11 semanas en la cultura 7. ECM murino preferentemente apoya la diferenciación de células ductales más de endocrinos y acinares linajes, mientras que en presencia de hidrogel laminina, se anima a PCFUs murinos para diferenciar preferentemente en células endocrinas y acinares y en menor medida con el linaje ductal 7,9,11. Es importante destacar que, Insulina + Glucagon - células mono-hormonal se generan en la cultura de hidrogel laminina y secretan insulina en respuesta a la estimulación de glucosa in vitro 7,9, lo que sugiere la madurez funcional. La diferenciación tri-linaje potencial 7,9 y auto-renovación 11 de PCFUs individuales son confirmados por micromanipulación de una sola célula, es decir, el cultivo de una célula por pocillo para la formación de colonias. En conjunto, estos resultados proporcionan evidencia de que hay auto-renovación, tri-potenT, células progenitoras-como en el páncreas murino posnatal que muestran actividades en cultivo 3D.
Los ensayos PCFU murinos descritos en este artículo se derivan de un ensayo de colonias antes diseñado para células progenitoras diferenciadas a partir de células madre embrionarias murinas (mESCs) 17. Dicho protocolo se documenta en detalle en otra publicación JoVe 18. Los componentes y las técnicas necesarias para llevar a cabo el ensayo de colonias que contiene ECM-murino para PCFUs adultos de cultivo son los mismos que para los progenitores derivados de mESC 17,18. Por lo tanto, no se repetirán aquí estos aspectos del ensayo; en su lugar se abordarán los siguientes procedimientos: 1) la disociación del páncreas adulto y clasificación + células ductales CD133 + Sox9 / EGFP, que enriquecen PCFUs de ratones adultos 7, 2) la manipulación de una sola célula de las células clasificadas, 3) de una sola colonia análisis utilizando microfluidos QRT-PCR y todo el montaje inmunotinción, y 4) la disociación de colonies en la suspensión de una sola célula y re-chapado en ECM murino o ensayos de colonias de hidrogel de laminina.
Protocolo
Declaración de ética: se adhieren a las normas éticas ampliamente aceptadas en la realización de investigaciones para garantizar la calidad y la integridad de los resultados. La experimentación con animales se lleva a cabo de acuerdo con los protocolos aprobados por el Cuidado de Animales institucional y el empleo en City of Hope.
1. Preparar la suspensión de células individuales desde murino adulto páncreas
NOTA: En publicaciones anteriores 7,11, se utilizaron ratones CD-1 o fondo B6; ambos fondos arrojado resultados similares. Una línea de ratón transgénico (designado Sox9 / EGFP) con la proteína verde fluorescente mejorada impulsado por Sox9 loci 19,20, fue creado en el fondo de CD-1.
- La eutanasia de 3 a 5 ratones adultos utilizando gas CO 2 durante 1-2 minutos o hasta que la respiración se detiene. A continuación, realice dislocación cervical en cada ratón.
- Diseccionar y preparar el páncreas.
NOTA: Disección de los ratones tan pronto como sea posible después de la eutanasia. Esto es importante para evitar la auto-digestión del páncreas debidoa los cambios post-mortem.- Hacer una incisión vertical en la línea media de la pared abdominal del ratón usando tijeras y abrir la cavidad abdominal. Encuentra el bazo y el uso de fórceps para sacarlo con cuidado. Cortar el tejido conectivo entre el bazo y el lóbulo esplénico del páncreas con tijeras.
- Repita esta práctica de los lóbulos duodenales y gástricas del páncreas. Coloque los tejidos pancreáticos en una placa de Petri en el hielo que contenía la solución de Dulbecco frío modificado tampón de fosfato (DPBS), 0,1% de albúmina de suero bovino (BSA), y penicilina y estreptomicina (/ S P; solución completa designado como PBS / BSA).
- Retire el tejido graso del páncreas bajo un microscopio de disección con unas pinzas de punta fina.
NOTA: Esto es crítico para la salud de las células pancreáticas disociados en los siguientes pasos.- (Opcional) Compruebe el páncreas para la fluorescencia verde bajo el microscopio estereoscópico de fluorescencia utilizando 488 a 509 nm de excitación para garantizarEGFP expresión.
- En una campana de cultivo de tejidos, enjuagar el tejido tres veces secuencialmente en tres platos 100 mm de Petri que contiene 10 ml de PBS frío / BSA.
- Hacer una incisión vertical en la línea media de la pared abdominal del ratón usando tijeras y abrir la cavidad abdominal. Encuentra el bazo y el uso de fórceps para sacarlo con cuidado. Cortar el tejido conectivo entre el bazo y el lóbulo esplénico del páncreas con tijeras.
- Generar pequeños trozos de tejidos.
- Transferir el páncreas diseccionado a una placa de Petri estéril seco para eliminar la mayor cantidad de PBS / BSA como sea posible, y transferirlos a otra placa de Petri seca sobre hielo.
- Preparar PBS / BSA que contiene DNasa I mediante la adición de 2 l DNasa I solución madre (1 millón de unidades [MU] / ml) por 1 ml de PBS / BSA.
NOTA: Esta solución se designa PBS / BSA / DNasa I. Hacer ~ 200 ml de esta solución a la vez, que cubrirá un experimento de clasificación. - Picar el páncreas usando tijeras de primavera durante 2-3 minutos o hasta que el tejido está en trozos finos. Añadir 2-3 ml de PBS frío / BSA / DNasa I de las piezas de tejido en la placa de Petri para suspenderlos.
- La transferencia de las piezas de tejido a un tubo cónico de 50 ml en hielo con una pipeta de 10 ml. Llevar el volumen total a 10 ml con PBS / BSA / l DNasa después de recuperar la mayor cantidad posible de tejido.
- Digerir el páncreas piezas en su mayoría de las células individuales.
- Añadir colagenasa B (100 mg / ml de solución madre) a 350-450 l / 10 ml a las piezas de tejido e incubar el tejido a 37 ° C en un baño de agua durante 8 minutos, girando cada 3-4 min. Utilice una jeringa de 10 ml con una aguja de 16 G ½ de elaborar y posteriormente rociar la solución del tejido por la pared del tubo de 50 ml a temperatura ambiente. Repita esto siete veces.
NOTA: Use suficiente fuerza para disolver los grupos de células, pero evitar las burbujas de generación que pueden matar las células. - Vuelva a colocar el tubo al baño María a 37 ° C durante 8 minutos y mezclar por agitación cada 3-4 min. Jeringa el tejido hacia arriba y abajo siete veces, como se mencionó anteriormente, y colocar una muestra (10 l) de la solución de tejido en una placa de Petri seco. Observe la solución de tejido bajo un, contraste de fase invertida, microscopio óptico con una lente objetivo de 10X. Esperar que las células individuales y algunos de tamaño pequeño cracimos ell estén presentes.
- Manejar las células en hielo a partir de ahora para desacelerar o detener la actividad de la colagenasa. Ajustar el volumen a 50 ml usando frío PBS / BSA / DNasa I. Centrifugar las células a 400 xg durante 5 min a 4 ° C, y resuspender en 5 ml de PBS frío / BSA / DNasa I usando una pipeta P1000.
- Añadir colagenasa B (100 mg / ml de solución madre) a 350-450 l / 10 ml a las piezas de tejido e incubar el tejido a 37 ° C en un baño de agua durante 8 minutos, girando cada 3-4 min. Utilice una jeringa de 10 ml con una aguja de 16 G ½ de elaborar y posteriormente rociar la solución del tejido por la pared del tubo de 50 ml a temperatura ambiente. Repita esto siete veces.
- Se filtra para Rendimiento suspensiones de células individuales y de lavado.
- Filtrar las células a través de una malla de nylon taza del filtro 70 micras y luego a través de una malla de nylon taza del filtro 40 micras.
- Resuspender las células en 5 ml de PBS frío / BSA / DNasa I y contar las células.
NOTA: Para los 2-4 meses de edad B6 o ratones CD-1, cada uno páncreas puede producir ~ 5 o 10 millones de células, respectivamente. Estos números pueden variar entre los diferentes experimentadores. Si los restos celulares excesivo se encuentra en el recuento, llevar el volumen a 50 ml con PBS frío / BSA / DNasa I y centrifugar las células a 400 xg durante 5 min a 4 ° C. - Ajustar el volumen de la suspensión celular a una concentración de 2 x 107 células / ml utilizando PBS frío / BSA / DNasa I.
2. Clasificar los células pancreáticas para enriquecer Progenitores formadoras de colonias
NOTA: A partir de ratones B6, CD133 + CD133 - pero no las células se enriquecen de PCFUs 7,9,11. Células CD133 + representan ~ 13% del total disociarse células pancreáticas después de todos los parámetros de activación periódica se aplican 11. De ratones CD-1, las células CD133 + Sox9-EGFP + representan típicamente ~ 4% del total de las células pancreáticas, y esta población celular se enriquecen de PCFUs 7. La clasificación de las células / EGFP + CD133 + Sox9 se describe aquí.
- Teñir las células disociadas de páncreas.
- Bloquear toda la suspensión de una sola célula de páncreas para reducir la unión no específica mediante la incubación de la suspensión de una sola célula con anti-ratón CD16 / 32 a 10 mg concentración final / ml durante 5 min en hielo.
- Retirar una alícuota de 1 x 10 6 células (50 y# 181; l) para teñir con el anticuerpo de control de isotipo, IgG1 de rata conjugado con biotina en 5 mg / ml de concentración final, por 20 min en hielo, girando cada 5-7 min.
- Retirar una alícuota de células de 1 x 10 6 (50 l) y se mantiene en hielo como un control sin teñir.
- Manchar el resto de las células con un anticuerpo primario anti-ratón de CD133 conjugado con biotina, a 5 mg / ml de concentración final, por 20 min en hielo, girando cada 5-7 min.
- Las células se lavan.
- Lavar el control de isotipo y las muestras de anticuerpos primarios manchado por llevando el volumen a 1 ml con PBS / BSA / DNasa I y centrifugar a 400 xg durante 5 min a 4 ° C. Repita este paso de lavado.
- Resuspender el control de isotipo y las muestras de anticuerpo-manchado primarios en PBS / BSA / DNasa I, por lo que la concentración final es de 2 x 10 7 células / ml.
- Manchar el control de isotipo y las muestras de anticuerpos primarios manchado con estreptavidina (STV) aloficocianina marcada con (APC) en 2 y #181; g / ml de concentración final. Incubar durante 15 minutos en hielo, girando cada 5-7 minutos.
- Lavar las células y 4 ', 6-diamidino-2-fenilindol tinción (DAPI).
- Lavar el control de isotipo de anticuerpos y las muestras manchadas primarios dos veces con PBS / BSA / DNasa I, como en el paso 2.2. Resuspender las células en PBS / BSA / DNasa I con DAPI (0,2 mg / ml de concentración final). El volumen final de la muestra de control de isotipo debe ser de 0,5 ml.
NOTA: Asegúrese de que la densidad final de la muestra primaria de anticuerpos manchados es apropiado para el clasificador para ser utilizado. Una concentración de 5 x 10 6 células / ml se utiliza habitualmente para la clasificación. - Ajustar el volumen de las células no teñidas a 0,5 ml con PBS / BSA / PS / DNasa I. Filtro todas las células a través de una malla de 20 micras antes de la clasificación y mantener las células en hielo en la oscuridad.
- Lavar el control de isotipo de anticuerpos y las muestras manchadas primarios dos veces con PBS / BSA / DNasa I, como en el paso 2.2. Resuspender las células en PBS / BSA / DNasa I con DAPI (0,2 mg / ml de concentración final). El volumen final de la muestra de control de isotipo debe ser de 0,5 ml.
- La clasificación de las células.
- Use una boquilla de 80 micras o más grande para la clasificación.
NOTA: Las células endocrinas pancreáticas murinas son propensos al estrés físico. HoWever, no parece ser afectada por la tensión causada por el paso a través de un clasificador de 7 PCFUs murinos. - Adquirir eventos celulares y parámetros de análisis sobre la clasificadora. Puerta de las células para adelante y áreas de dispersión lateral para excluir los desechos celulares 7. Puerta de dispersión frontal y lateral anchuras de excluir dobletes de células. Puerta de excluir DAPI + 7 células muertas. Elija gating parámetros para las señales de EGFP y CD133-APC en base a los valores de las células de control de isotipo (Figura 1).
- Recoger las células clasificadas en 5 ml tubos de poliestireno que contienen 1,5 ml de medio DMEM / F12 suplementado con suero de ternera fetal al 5% (FCS). Centrifugar las poblaciones clasificadas a 400 xg durante 5 min y se resuspenden en un volumen pequeño (~ 200 l) de cualquiera de DMEM / F12 o PBS / BSA / DNasa I suplementado con 5% de FCS. Mantener las células en hielo hasta su uso.
- Use una boquilla de 80 micras o más grande para la clasificación.
- Contar el número de células CD133 + Sox9-EGFP + obtenidas a partir del clasificador. tome una10 muestra de células l y recuento de las células con un hemocitómetro para determinar la densidad celular.
NOTA: El uso del hemocitómetro es recomendable porque los recuentos de la máquina de la clasificadora son a menudo poco fiables.
3. Placa de las células clasificadas en el ensayo de colonias que contienen proteínas ECM murinos
NOTA: Por favor refiérase a los protocolos detallados para el revestimiento de las células en el ensayo de colonias que contiene ECM-murino en otra publicación JoVe 18.
- Preparar medios de cultivo.
- Preparar un medio de cultivo que contiene medio DMEM / F12, 1% (v / p) de metilcelulosa, 5% (v / v) proteínas ECM murinos, 50% (v / v) medio condicionado de células pancreáticas como derivados de mESC, 5% (v / v) de FCS, 10 mmol / L de nicotinamida, 10 ng / ml de activina B humana recombinante, 0,1 nmol / L de exendina-4, y 1 ng / ml del factor de crecimiento endotelial vascular-A. Los métodos para generar el medio condicionado se detallan en otro lugar 18.
- Añadir 750 ng / ml de RSPO-1 al medio deSi se desea la formación de colonias densas.
- Incubar el cultivo de proteínas ECM murino a 37 ° C y 5% de CO2 durante 3 semanas.
4. cultivar las células seleccionadas en 1 célula por pocillo
NOTA: Los siguientes procedimientos se aplican a la manipulación de células individuales utilizando pipetas mano y la boca. Un enfoque alternativo es la compra de un micromanipulador. Un micromanipulador típico incluye un microscopio invertido con una plataforma motorizada de joystick.
- Preparar vidrio Pipetas Pasteur.
- El uso de un mechero Bunsen, extraer la punta de una pipeta Pasteur de vidrio hasta una punta fina (~ 30 micras, con la apertura). Las pipetas Pasteur de vidrio deben tener un tapón de algodón para crear una barrera al flujo de aire desde el operador.
- Autoclave las pipetas Pasteur de vidrio flameado a 121 ° C durante 20 min para la esterilización.
- Preparar las placas de 96 pocillos de Cultura.
- Preparar fría acuerdo de medio de cultivo semisólidoing al protocolo descrito previamente 18.
- Dispensar el medio en los pocillos interiores de una placa de 96 pocillos de fondo plano de unión baja a 100 l / pocillo utilizando una jeringa de 1 ml. Llenar los pocillos exteriores con agua estéril para mantener la humedad.
- Coloque la placa de cultivo en hielo hasta su uso.
- Preparar las células clasificadas.
- Añadir ~ 6.000 células recogidas de un clasificador a 2,5 ml de volumen final de DMEM / F12 / PS que contiene 10% de FCS y 1% de metilcelulosa en un tubo de poliestireno de 5 ml. Agitar vigorosamente para mezclar los componentes. Esperar durante 5 minutos o hasta que las burbujas floten en la parte superior del tubo. Este paso no es necesario realizar en hielo.
- Dispensar la solución de células a dos placas de 35 mm a 1 ml / placa utilizando una jeringa de 1 ml con una aguja de 18 G ½.
- Corre la solución de células en el plato moviendo suavemente el plato con la mano. No permitir que el medio semisólido para alcanzar el margen de la placa de 35 mm, ya que las células individuales en el margen de la Cann bienSe observa claramente ot usando un microscopio de luz invertida.
- Preparar el área de trabajo alrededor de un microscopio.
- Hacer una solución que contiene DMEM / F-12 medio y 1% de metilcelulosa sin células (medio 'no-celular'), y dispensar la solución (como se describe en 4.3.2) en dos 35 mm placas de Petri (1 ml por placa) .
- Limpio y limpie el área de trabajo alrededor de un microscopio de contraste de fase invertida con una solución de alcohol al 70%.
- Montar la pipeta con la pieza de la boca.
- Escoja una pipeta Pasteur de vidrio estéril que fue preparado en el paso 4.1. Una el extremo grande de una punta de pipeta de plástico de 1 ml a la parte superior de la pipeta Pasteur de vidrio. Una el extremo pequeño de la punta de pipeta de plástico 1 ml a un extremo de un tubo de caucho de pared delgada, y la boquilla en el otro extremo del tubo. Utilice la misma pipeta de vidrio para recoger múltiples células de un mismo grupo.
- Establecer, mediante succión boca, un pequeño volumen (~ 10 a 50 l) de la"No-celular" solución semisólida hizo en el paso 4.4.1 con la pipeta Pasteur de vidrio.
NOTA: La solución semi-sólido a la estrecha abertura de la pipeta Pasteur de vidrio crea resistencia al flujo y proporciona una barrera para prevenir la contaminación de las células para ser recogido.
- Elija una sola celda.
- Coloque la placa de 35 mm que contiene las células clasificadas en la platina del microscopio y quitar la tapa.
- Encuentra las células por medio de una lente objetivo de 10X y se centran en una célula adecuada para ser recogidos.
- Encontrar y colocar la abertura de la punta de la pipeta al lado de la célula de interés. Aplicar succión a través de la boca.
NOTA: El movimiento de la celda debe ser bastante lento, por lo que no hay riesgo de perder la célula durante el proceso posterior. El movimiento de la célula de entrar en la abertura de la pipeta debe ser visible. Si el flujo se mueve demasiado rápido, cambiar a una pipeta con una abertura estrecha.
- Depositar el teléfono único de cara a una cultura bien.
- Una vez que la célula se encuentra en la pipeta, el uso de la lengua para detener el flujo mediante el bloqueo de la abertura de la pieza de boca. Haga una breve pausa antes de retirar la punta del medio semisólido para asegurar que el medio semisólido ha dejado de fluir.
- Coloque la punta de la pipeta en un pozo en la placa de 96 pocillos preparada en el paso 4.2. Empuje la celda lentamente soplando suavemente en la pieza de boca. Marcar el bien después se deposita la célula, para evitar chapado dos células en un pozo.
- Asegúrese de que una sola célula se coloca en un pocillo de cultivo.
- Coloque la punta de la pipeta en el "no-celular 'medio preparado en el paso 4.4.1. Mientras se observa la abertura de la punta bajo el microscopio, empujar hacia fuera la solución semi-sólido restante. Esperar ninguna célula fluya hacia fuera de la punta de la pipeta.
- Para comprobarlo, encontrar la ubicación en el pocillo de cultivo en el que se implanta la célula individual.
- Cultivar las células individuales a 37 ° C en 5% de CO 2 durante un máximoa 3 semanas.
5. Recoger colonias individuales de cultivo semi-sólida para el análisis de microfluidos QRT-PCR
NOTA: Tres semanas después de la siembra ordenadas CD133 + Sox9 células / EGFP + en el ensayo de colonias que contiene ECM-murino, anillo o colonias densas se forman 7 (Figura 2). Cuando el anillo / Densas colonias se disocian en suspensión de células individuales y re-chapada en la cultura de hidrogel laminina, colonias Endocrino / acinares se generan después de una semana aproximadamente 7 (Figura 2). Para determinar la composición de linaje de cada colonia, microfluidos QRT-PCR análisis se utiliza para detectar la expresión de marcadores de linaje 7. Para pre-amplificación, una colonia se mezcla en una mezcla maestra que contiene una mezcla TaqMan sonda, tampón de reacción, y el superíndice III 21. El chip 48,48 matriz se utiliza posteriormente para las reacciones de PCR microfluidos 21.
- Preparar el pre-amplificación por PCRla mezcla que contiene 48 sondas.
- Pipetear 1,5 l de cada sonda TaqMan (20x acciones) en un tubo de 1,5 ml. Añadir 78 l de tampón TE para ajustar el volumen a 150 ml.
- Preparar la mezcla maestra siguiendo los protocolos del fabricante 21.
- Colocar 9 l de mezcla maestra en cada tubo de reacción de 0,2 ml de paredes delgadas adecuadas para la PCR, y repetir este paso para hasta 48 tubos.
- Recoger colonias individuales a partir del cultivo semisólido.
NOTA: Anillo / colonias densas son más grandes que las colonias Endocrino / acinares, con diámetros que van desde ~ 50 a 400 micras 9,11. Por lo tanto, solo anillo / Densas colonias se recogieron usando una pipeta P10 equipado con una punta de pipeta de 10 l que se dobla en una forma curvada. Para recoger el pequeño Endocrino / colonias acinares (Figura 2), consulte el paso 4.- Localizar una colonia de interés con gran aumento (por ejemplo, lente objetivo 20X), reducir la ampliación, y aspirate la colonia. (Opcional) Tome una imagen de contraste de fase de la colonia en este paso para documentar las características visibles de la colonia.
- La transferencia de la colonia en el tubo de PCR que contenía 9 l de mezcla maestra.
- Recoger la siguiente colonia. Hasta 45 colonias en total pueden ser analizados por PCR plazo, dejando 3 puntos para los controles.
- La extracción de RNA y la síntesis de ADNc con pre-amplificación.
- Vórtice vigorosamente las muestras antes de realizar la reacción térmica.
- Llevar a cabo las reacciones de ciclos térmicos de acuerdo con las instrucciones del fabricante 21. / Anillo de colonias densas requieren 14 ciclos, las colonias Endocrino / acinares requieren 16-20 ciclos, y las células individuales requieren 22 ciclos.
NOTA: Pre-amplificación de ADNc se pueden almacenar a -20 ° C antes del análisis PCR de microfluidos.
- Ejecutar posteriores reacciones de PCR, utilizando un chip de microfluidos, de acuerdo con las instrucciones del fabricante 21.
- Cosecha y Fix Colonias.
- Recoger las colonias bajo el microscopio, como en los pasos 4 o 5.4, y añadirlos a una solución de paraformaldehído al 4%. Incubar O / N a 4 ° C con agitación suave.
- Lavar las colonias con 1X PBS dos veces por 10 a 30 min a TA. Almacenar las colonias fijas a 4 ° C en tubos de 1,5 ml sellados con parafina.
- Manchar las colonias con anticuerpos.
- colonias de transferencia a un pocillo de una placa de 96 pocillos negro con un fondo transparente que contiene 200 l de tampón de bloqueo (5% burro y / o suero de cabra, 0,1% de Triton X-100 en PBS 1x). Incubar O / N a 4 ° C con agitación suave.
- Diluir el anticuerpo primario a una concentración predeterminada (por ejemplo, 1: 500 para hámster anti-mucina 1 anticuerpo) utilizando tampón de bloqueo. La transferencia de las colonias a una limpia bien con 200 l de anticuerpo primario, y se incuba O / N a 4 ° C con agitación suave. Wcenizas las colonias 3 veces con PBS que contiene 0,1% de Tween 20. Transferencia de las colonias en un nuevo bien con 200 l de 1x PBS / 0,1% de Tween 20 durante 10 min a RT para cada lavado.
- Diluir el anticuerpo secundario a una concentración predeterminada (por ejemplo, 1: 2.000 para el anticuerpo anti-hámster armenio cabra) utilizando tampón de bloqueo. Guardar la solución en la oscuridad. La transferencia de las colonias de limpiar los pozos que contienen 200 l de anticuerpo secundario, y se incuba durante 2 horas a RT. Lavar las colonias 3 veces con PBS / 0,1% de Tween 20, como en el paso 6.2.2.
- colonias tinción de contraste con DAPI y visualizar con microscopía confocal.
- La transferencia de las colonias en los pocillos con PBS que contenía 300 nM DAPI y se incuba durante 5 min a TA.
- La transferencia de las colonias teñidas con DAPI a una placa de Petri con fondo de vidrio de 35 mm para la visualización. Colocar una hoja de la cubierta en la parte superior de las colonias para evitar la evaporación.
- Utilizar un microscopio confocal para capturar las imágenes. Para visualizar DAPI staining, utilice la longitud de onda de excitación de dos fotones de 730 a 950 nm. Utilizar un láser de argón con una longitud de onda de 458 nm para excitar fluorocromos con longitudes de onda de emisión de 519 y 561 nm. Utilizar un láser de helio-neón con una longitud de onda de 633 nm para excitar fluorocromos con longitudes de onda de emisión de 665 nm.
7. disocian y Re-placa primaria Anillo / Denso colonias en ensayos secundarios de colonias
NOTA: Todos los procedimientos deben realizarse en condiciones estériles. Evitar el choque de frío a las células en este procedimiento tanto como sea posible, como poner las células en células de hielo o de lavado en frío con PBS / BSA. Tales prácticas reducen la viabilidad de las células re-plateado.
- Preparar soluciones.
- tampón de lavado Pre-caliente (DMEM / F12; P / S; 0,1% de BSA) en un baño de agua a 37 °.
- Pre-calentar una placa de 96 pocillos (fondo plano; una baja unión) en una incubadora a 37ºC. Añadir 100 l 100% de FCS a un pocillo de la placa y solución de tripsina-EDTA 100 l 0,25% a un segundobien.
- Recoger colonias.
- Recoger y poner en común un total de 20 o más anillo / Densas colonias en cultivos primarios utilizando 10 l puntas de pipeta, tal como se describe en el paso 5.4.
- Colocar las colonias en caliente (al menos RT) tampón de lavado (~ 1,000 l) en un tubo de 1,5 ml y centrifugado a 400 xg durante 5 min. Eliminar el sobrenadante.
- Disociar las colonias en una sola célula suspensiones utilizando tripsina.
- Transferir el volumen restante (20 l o menos), que contiene las colonias, en el pocillo que contiene solución de tripsina caliente (preparado en 7.1).
- Se incuba la placa en una incubadora de 37 ° C (no es un baño de agua) durante 1,5 min. Retire la placa y una pipeta de las colonias unas cuantas veces. Incubar a 37 ° C durante otra 1,5 min.
- Retire la placa y la pipeta hacia arriba y abajo unas cuantas veces para romper las colonias. Compruebe bajo el microscopio para ver si las colonias se han dispersado predominantemente en la suspensión de una sola célula.Evitar el exceso de la digestión de las colonias.
- Se detiene la reacción por adición de tripsina FCS.
- Transferir 100 l de FCS cálidas en el pozo que contiene las células. Pipeta hacia arriba y abajo varias veces. La transferencia de las células en un tubo de 1,5 ml contiene 1.000 l de tampón de lavado con agua tibia. Centrifugar a 400 xg durante 5 min a TA.
- Lavar dos veces con tampón caliente.
- Vuelva a suspender las células en ~ 200 l de tampón o medio de cultivo.
- Contar el número de células utilizando un hemocitómetro. Mantener la suspensión de células a TA.
- Re-placa de células en ensayos de colonias secundarias que contienen cualquiera de las proteínas ECM murinos (5% v / v) o hidrogel laminina (100 g / ml) se disoció e incubar las células a 37 ° C con 5% de CO 2.
NOTA: Para las células re-chapado en proteínas ECM murinos, utilice 2.500-5.000 células por pocillo y la cultura durante 2-3 semanas. Para re-pantes en la cultura de hidrogel laminina, utilice 10,000-25,000 células por pocillo y la cultura de 7-12 días.
Resultados
Células progenitoras pancreáticas adultas pueden ser enriquecidas por fluorescencia de células activadas por la clasificación (Figura 1). La línea de ratones transgénicos Sox9 / EGFP usado aquí se generó por primera vez como resultado del Proyecto GENSAT Atlas Cerebral 19, y el reportero EGFP está bajo el control de un cromosoma artificial bacteriano que contiene ~ 75 kb aguas arriba y ~ 150 kb abajo secuencias de Sox9 20 . En estos ratones, EGFP etiquetas conductos pancreáticos de manera eficiente y específicamente 22. Páncreas se adquirió y se disociaron en una suspensión de una sola célula, y se tiñeron con anticuerpos anti-CD133 conjugados con biotina, seguido por tinción con anticuerpos secundarios conjugados con STV-APC. Las células resultantes se analizaron por citometría de flujo con los parámetros de activación periódica apropiadas (Figura 1). Las células obtenidas usando diferentes parámetros de compuerta pueden ordenarse y se sembraron en los ensayos de colonias de metilcelulosa que contiene-paraformación de colonias. En estudios previos, se observó que la capacidad de formación de colonias sólo se encuentra en las células ductales 7 ordenada CD133 + Sox9 / EGFP +.
Las colonias formadas en los ensayos de colonias de metilcelulosa que contiene-se clasificaron de acuerdo con su morfología, como se observa utilizando una, de contraste de fases invertido, microscopio de luz (Figura 2). Posteriormente, las colonias individuales fueron analizados y seleccionados a mano por el análisis de microfluidos QRT-PCR para la expresión de genes (Figura 3) o por todo el montaje inmunotinción para expresión de la proteína (Figura 4). En estudios publicados 7,9,11, se encontró que muchas colonias individuales expresan los marcadores de linaje de conducto (mucina-1), acinar (amilasa) y las células endocrinas (insulina), lo que indica que la mayoría de los PCFUs iniciadores para estas colonias son tri-potente. La proporción de los tres linajes de células en cada colonia Sin embargo, fue influenciado por los tipos y concentraciones de proteínas ECM presentes en la metilcelulosa que contiene ensayos de colonias-7,9. Proteínas ECM murinos estimulados auto-renovación de PCFUs y la diferenciación celular ductal mientras que la laminina hidrogel preferentemente apoya la diferenciación de las células acinares endocrinas y linajes 7,9,11.
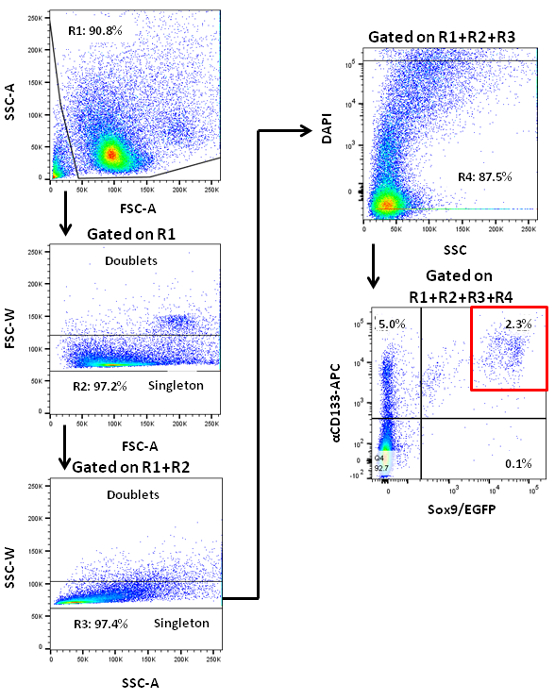
Figura 1. Flujo de análisis de las células pancreáticas disociadas de ratones adultos que muestran patrones de tinción de acuerdo con dos marcadores de células ductales, CD133 y Sox9. Sox9 / ratones transgénicos EGFP que contenía fueron utilizados reportero EGFP loci impulsada por citometría de Sox9. Se muestra una puerta de clasificación representativo (cuadro rojo) para CD133 + células de páncreas / EGFP + Sox9. Células / EGFP + CD133 + Sox9 se enriquecen de PCFUs 7.Les / ftp_upload / 54016 / 54016fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
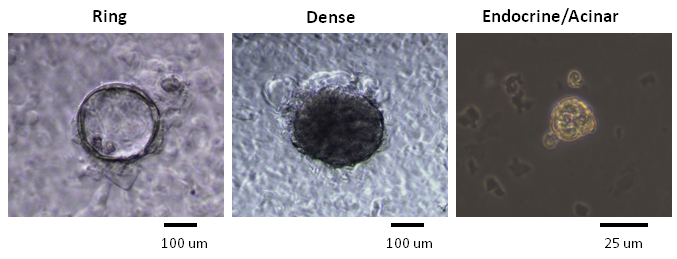
Figura 2. Colonias con diferentes morfologías se generaron en ensayos de colonias de metilcelulosa que contiene. Fotomicrografías representativas de anillo, se muestran colonias densas y Endocrino / acinares de un microscopio de contraste de fase iluminada por la luz visible. Anillo y colonias densas se generan cuando PCFUs recién según se siembran en medio de cultivo que contiene las proteínas ECM murinos y se cultivaron durante 3 semanas 7. Colonias Endocrino / acinares se forman después de la re-plating el Anillo disociado o células de colonias densas en medio de cultivo que contiene un hidrogel laminina y se cultivaron durante ~ 1 semana 7. Las barras de escala para Ring y colonias densas = 100 micras. La barra de escala para Endo / acinar colonias = 25 μ;. m Haga clic aquí para ver una versión más grande de esta figura.
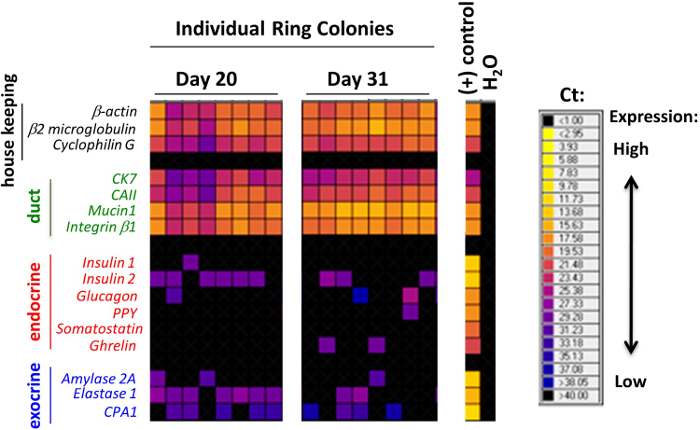
Figura 3. Las colonias individuales crecen en proteínas ECM murinos expresan marcadores de células ductales, acinares y endocrino. Los resultados representativos de microfluidos QRT-PCR análisis de las colonias anillo individual. Cada columna representa una sola colonia. Los niveles de expresión de genes se expresan como un mapa de calor aquí, con colores más cálidos indicativos de una mayor expresión y los colores fríos indicativos de expresión inferior. Muchas de las colonias individuales expresan al menos uno de los genes en cada panel para los marcadores indicativos de conducto, endocrino o linaje de células acinares. Estos datos demuestran que muchas de las colonias individuales expresan marcadores tri-linaje, y sugieren que la mayoría de laPCFUs originarios se tri-potente. Esta cifra se modificó a partir de una figura publicada previamente 7. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Dos colonias anillo expresan un marcador de proteína ductal mucina 1. Los resultados representativos de la inmunotinción de colonias Anillo de todo el montaje, que muestra la expresión de proteína de un marcador ductal mucina 1 (color verde). Los núcleos son contra el teñidas con DAPI (azul). Muchas células en estas colonias anillo expresan mucina proteína 1. Esto es consistente con los resultados de microfluidos QRT-PCR que muestran que las colonias cultivadas en anillo proteínas ECM murinos expresan niveles altos (colores más cálidos en la Figura 3) de mucin1 y otros marcadores de células ductales. La barra de escala representas 50 micras. Haga clic aquí para ver una versión más grande de esta figura.
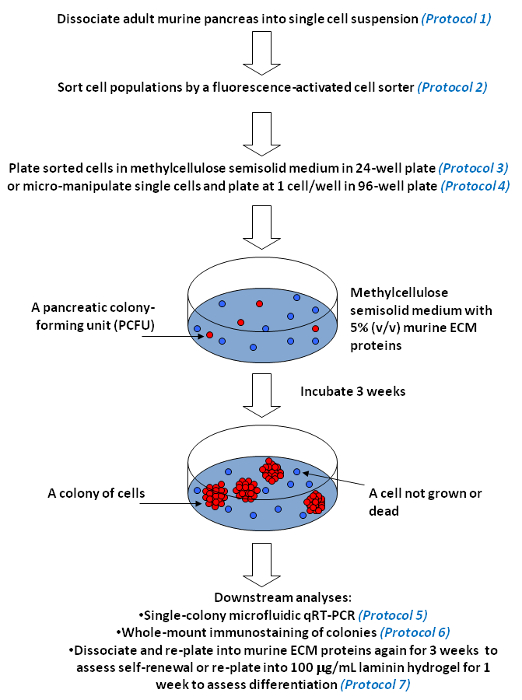
Figura 5. ensayos de colonias pancreático para la medición de la auto-renovación y diferenciación multi-linaje de células progenitoras individuales en cultivo. Se presenta el flujo de trabajo Representante. Nuestros ensayos de colonias pancreáticos contienen un material viscoso, metilcelulosa, de manera que el medio de cultivo se vuelve semi-sólido. medio semisólido restringe el movimiento y evita la agregación de las células progenitoras individuales (indicado en rojo). Sin embargo, el medio es lo suficientemente suave para permitir que una sola célula progenitora de auto-renovación y / o diferenciar, y crecer en una colonia de células (representada por múltiples círculos rojos). En contraste, las células individuales que no tienen las capacidades de formación de colonias, es decir, las células no progenitora (indicado en azul), permanecen como células individuales o morir con el tiempo en cultivo. Metilcelulosa también permite la inclusión de proteínas ECM y bajas concentraciones, las proteínas ECM murino como el 5% o 100 mg / ml de laminina hidrogel. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los ensayos de colonias pancreáticas y única colonia análisis descritos aquí se inspiraron en los ensayos de colonias hematopoyéticas que contiene metilcelulosa, que han jugado un papel importante en el desciframiento de la biología de las células progenitoras hematopoyéticas en las últimas décadas 23. En estos ensayos (Figura 5), disocian las células pancreáticas se sembraron en medios semisólidos con factores de crecimiento adecuados y proteínas ECM que apoyan la formación de colonias circulares, denso o Endocrino / acinares 7 que contiene metilcelulosa. Una célula progenitora individual que es capaz de dar lugar a una colonia de células se denomina un PCFU. Al caracterizar colonias individuales usando microfluidos QRT-PCR y todo el montaje inmunotinción, los potenciales de linaje de los PCFUs originarios se pueden deducir. Se encontró que la mayoría de PCFUs murinos adultos son tri-potentes, capaces de dar lugar a ductal, acinar, y células endocrinas in vitro de linaje 7,9. mientras murproteínas ECM ine estimulan la diferenciación de tri-potente PCFU hacia el linaje del conducto, el hidrogel laminina permite endocrina robusto y las células acinares linaje diferenciación 7,9. Para evaluar la capacidad de auto-renovación in vitro de la PCFUs, el anillo o densas colonias que crecen en un ensayo de colonias de ECM murino primaria puede disociarse en la suspensión de una sola célula y re-chapada en un ensayo de colonias de ECM murino secundaria 7. Se encontró que PCFUs expandido ~ 500.000 veces en las proteínas ECM murinos de más de 11 semanas 7. Los pasos críticos incluyen la eliminación de los tejidos grasos de los páncreas diseccionado, evitando el exceso de la digestión de las células pancreáticas por la colagenasa, y la minimización de choque de frío a las células de colonias densas disociadas anillo / antes de volver a chapado. El dominio de micromanipulación de células individuales puede tomar algún tiempo; Se requiere paciencia y práctica.
En comparación con otros ensayos de células progenitoras pancreáticas, incluyendo la cultura 2D 24, las sUSPENSIÓN "pancreasphere" 25 y los ensayos de organoides 12-15, las principales ventajas de los ensayos de colonias de metilcelulosa que contiene descritos aquí son los siguientes. En primer lugar, la adición y ajuste de las proteínas ECM a una amplia gama de concentraciones se pueden conseguir fácilmente. Esto se debe a la metilcelulosa es la sustancia que confiere la naturaleza 3D del medio semisólido. Por el contrario, los métodos de cultivo de organoides dependen de la solidificación de las proteínas ECM murinos, que están presentes en el 33% v / v o mayor. Se observa que tan poco como 1% de proteínas ECM murino puede inhibir la diferenciación de las células endocrinas 9, lo que subraya la importancia de la concentración de proteínas ECM en el ensayo de células progenitoras. En segundo lugar, las colonias se distribuyen uniformemente a través de la cultura y así pueden ser contados con exactitud. En tercer lugar, las colonias individuales se pueden cosechadas a mano fácilmente para su posterior análisis. En cuarto lugar, el medio semi-sólido que contiene metilcelulosa-es fácil de mantener, y no mediose requiere un cambio en el curso del cultivo. Finalmente, un gran número de células (hasta 25.000 células por placa de 24 pocillos) se pueden sembraron y se examinaron en estos ensayos de colonias, haciéndolos eficiente para la detección de actividades de células progenitoras, incluso si son una población menor entre las células cultivadas en placas.
Los ensayos de células progenitoras pancreáticas descritos aquí se basan en funcional, pero no en base a marcadores, los análisis de las células progenitoras pancreáticas. Esto significa que las células progenitoras pancreáticas se pueden estudiar sin saber qué marcadores que expresan. Esto es importante porque hay poco conocimiento acerca de lo que los marcadores específicos de las células progenitoras pancreáticas adultas pueden expresar. Además, los marcadores de células progenitoras pancreáticas embrionarias no pueden ser adecuados para el estudio de los progenitores adultos. Mediante el uso de análisis funcionales, se puede comenzar a identificar marcadores de células progenitoras específicos determinando primero la sub-población que tiene actividad PCFU, tal como el CD133 + </ sup> células / EGFP + Sox9 ilustran aquí. Esto puede ser seguido por la identificación, usando RNA-seq, de genes que son expresados diferencialmente por la población que contiene PCFU. Los marcadores candidatos pueden entonces ser probados y verificados por ensayos tales como in vitro e in vivo de linaje rastreo de técnicas que hacen un seguimiento de las capacidades de diferenciación de las células progenitoras.
Las limitaciones de los ensayos de colonias de metilcelulosa que contiene-in vitro son tres. En primer lugar, aunque los ensayos imitan el microentorno in vivo del páncreas, proporcionando proteínas ECM y factores de crecimiento a las células progenitoras pancreáticas en el espacio 3D en cultivo, las condiciones no son idénticos. Además, las estructuras de las células epiteliales in vivo se interrumpen por la disociación en células individuales, que pueden tener consecuencias importantes. Por lo tanto, será importante verificar células progenitoras en los estudios de seguimiento utilizando in vivo Ensayos. En segundo lugar, los componentes del cultivo contienen reactivos no definidas, como las proteínas murinas ECM, FCS, y 18 medios condicionados. Estos componentes no definidos pueden afectar la función de los factores de crecimiento específicos sobre las células progenitoras de manera indirecta y se necesita más trabajo para crear un conjunto totalmente definido de condiciones de cultivo. Por último, el linaje rastreo experimentos demostraron células acinares-a células beta 26,27 o alfa-células-beta a 28 conversiones in vivo en ratones adultos. Las condiciones de cultivo metilcelulosa descritos aquí pueden ser específicos para la conversión de células-conducto-a beta solamente. Otras condiciones de cultivo desconocidos pueden ser necesarios para las células no se convierten en conductos de las células beta en cultivo.
Hay varios casos en que la resolución de problemas puede ser necesario. Por ejemplo, si las células disociadas se agrupan juntos, usar dosis más altas de DNasa I en soluciones. DNasa I es importante para evitar que se enreden las células pancreáticas disociadas causadas por mo ADNlecules liberada por las células muertas (ver paso 1.3.2).
Por otra parte, si los tejidos picados se pegan en la pipeta de 10 ml, picar el tejido en trozos más pequeños. La abertura de la pipeta de 10 ml debe ser lo suficientemente amplia como para las piezas de tejido para pasar a través después de la digestión con colagenasa. Si las piezas se quedan atascadas en la punta de la pipeta de 10 ml, esto indica que el picado del tejido por las tijeras de primavera no es suficiente (véase la etapa 1.3.4).
Otro problema que puede surgir es ningún crecimiento de las colonias en las proteínas ECM murinos de células pancreáticas disociadas (es decir, células no clasificadas). Si esto sucede, no intente romper todos los grupos en células individuales durante la etapa de disociación páncreas, ya que esto puede resultar en overdigestion y la muerte celular. Si hay piezas de gran tamaño, devolver el tubo a 37 ° C durante unos pocos (4) min y la jeringa 7 veces o menos. Vuelva a revisar las células bajo el microscopio. El tiempo máximo para el tratamiento de colagenasa B es de 30 min. reegún la colagenasa utilizado, el tiempo óptimo para la digestión puede variar (véase la etapa 1.4.2).
Además, grupos de proteínas de matriz extracelular murino en pocillos de cultivo pueden ser observados después de la incubación. Para evitar esto, asegúrese de que todos los componentes del cultivo que entran en contacto con las proteínas de la matriz extracelular murino se conservan en frío en hielo para evitar la solidificación prematura antes de la incubación de 37 ° C (ver paso 3).
Además, puede ser difícil en la selección de una celda a la vez en una pipeta Pasteur de vidrio. Una solución a esto es reducir la densidad de las células recién ordenados en placas en el medio semisólido para asegurarse de que una célula tiene una distancia suficiente de las otras células. Esto evitará recoger múltiples células al mismo tiempo. Además, es mejor colocar el foco del microscopio cerca de la parte inferior de la medio semisólido, ya que es más fácil de recoger células individuales a mano cerca de ese avión sin un micromanipulador (véase el paso 4.6.2).
Además, puede no estar claro si la manipulación de células individuales es exitosa. Una solución es practicar la micromanipulación de células individuales antes del experimento real. Una vez que la célula es recogido en la pipeta Pasteur de vidrio, transferir la célula a un 35 mm placa de Petri que contiene 1 ml de solución de metilcelulosa al 1% sin células ( "no-celular" medio preparado en la etapa 4.4.1). Visualizar y coloque la abertura de la punta de la pipeta Pasteur de enfoque bajo el microscopio, y empuje la celda lentamente. Espere que la única célula que aparezca lentamente alrededor de la punta de la pipeta y luego se mueven en el medio "no-celular" (ver paso 4.8.2).
Por último, no hay crecimiento de la colonia se puede producir en cultivos secundarios de anillo primario / Densas colonias disociadas. Para solucionar problemas, aseguran que las células de colonias primarias disociadas se mantienen en RT antes del chapado en cultivos secundarios. Para el cultivo en proteínas ECM murinos, añadirlas células últimos al tubo que contiene medio de cultivo frío antes de la mezcla 18, minimizando así la exposición de las células a la temperatura fría, que pueden matar las células disociadas obtenidas a partir de colonias primarias. Sin embargo, el re-enchapado de células en hidrogel laminina no necesita ser realizada en hielo antes de 37 ° C de incubación (ver paso 7).
En resumen, dos ensayos de colonias de metilcelulosa que contiene-se han utilizado para caracterizar las células progenitoras similar a partir de los páncreas de ratones adultos y jóvenes 7,11 9,10 posnatal, así como de los hígados de los ratones jóvenes 10. Las aplicaciones futuras serán dirigidas a la identificación y caracterización de las células progenitoras formadoras de colonias humanas de órganos cadavéricos pancreáticas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Lucy Brown y Alejandro Spalla de la analítica Citometría Core en City of Hope de asistencia en la clasificación. Este trabajo está apoyado en parte por los Institutos Nacionales de Salud (NIH) subvenciones R01DK081587 y R01DK099734 a HTK, y U01DK089533 de ADR, y por la National Science Foundation NSF-DMR-1206121 y California Instituto de Medicina Regenerativa RB5-07398 subvención a DAT Apoyos del Instituto J. Joseph Jacobs de Ingeniería Molecular de Medicina en Caltech a DAT, y los de la Fundación Fundación Oxnard y Ella Fitzgerald a HTK son también agradece.
Financiación: Este trabajo está apoyado en parte por los Institutos Nacionales de Salud (NIH) y otorga R01DK081587 R01DK099734 a HTK, y U01DK089533 de ADR, y por la National Science Foundation NSF-DMR-1206121 y California Instituto de Medicina Regenerativa de subvención RB5-07398 Soporta DAT de la Joseph J. JacobsInstituto de Ingeniería Molecular de Medicina en Caltech a DAT, y los de la Fundación Fundación Oxnard y Ella Fitzgerald a HTK también se agradece. Las investigaciones realizadas en esta publicación, se incluyó el trabajo realizado en la analítica de Citometría y Microscopía de Luz Core Digital Imaging Core apoyado por el Instituto Nacional del Cáncer de los Institutos Nacionales de la Salud con el número P30CA33572 premio.
Patrocinador del estudio: El patrocinador no participó en el diseño del estudio, la recogida, análisis o interpretación de los datos.
Materiales
| Name | Company | Catalog Number | Comments |
| Murine ECM proteins (Matrigel) | Becton Dickson (Franklin Lakes, NJ, USA) | 354230 | Stock kept at -20oC |
| Laminin Hydrogel | Provided by David Tirrell (Pasadena, CA USA) | Stock kept at -20oC | |
| Methylcellulose | Shinetsu Chemical (Tokyo, Japan) | 1500 centipoise (dynamic viscosity unit equal to 15g/cm/s) (high viscosity) | |
| Dulbecco's Phosphate-Buffered Saline | Mediatech (Manassas, VA, USA) | 21-031-CV | |
| Phosphate Buffered Saline | Gibco (Grand Island, NY, USA) | 15070-063 | |
| 50mL Flacon Conical vial | Corning Inc. (Corning, NY, USA) | 352070 | |
| 100mmx20mm Suspension culture dish | Corning Inc. (Corning, NY, USA) | 430591 | |
| Bovine Serum Albumin | Sigma (St. Louis, MO, USA) | A8412 | |
| Penicillin/Streptomycin | Gibco (Grand Island, NY, USA) | 15070-063 | |
| DNase1 | Calbiochem (Darmstadt, Germany) | 260913 | |
| Collagenase B | Roche (CH-4070, Basel, Schweiz, Switzerland) | 11088831001 | Stock kept at -20oC |
| Anti-mouse CD16/32 | Biolegend (San Diego, CA, USA) | 101310 | low endotoxin, azide free |
| PE-Cy7 Rat IgG2a κ Isotype Control | Biolegend (San Diego, CA, USA) | 400522 | |
| Rat IgG1 κ Isotype Control | eBioscience (San Diego, CA, USA) | 13-4301-82 | |
| Anti-CD133-Biotin | eBioscience (San Diego, CA, USA) | 13-1331-82 | |
| Anti-CD71-PE-Cy7 | Biolegend (San Diego, CA, USA) | 113812 | |
| Streptavidin-Allophycocyanin | Biolegend (San Diego, CA, USA) | 405207 | |
| 4',6-Diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | 3571 | Stock kept at -20oC |
| Anti-mucin 1 | Thermo Fisher Scientific (Waltham, MA USA) | HM-1630-P1 | |
| Dylight 649 Goat anti-Armenian Hamster | Jackson Immuno (West Grove, PA, USA) | 127-495-160 | |
| Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 | Mediatech(Manassas, VA, USA) | 10-092-CV | |
| Fetal Bovine Serum | Tissure Culture Biologicals (Long Beach, CA, USA) | 101 | Stock kept at -20oC |
| Tris Ethylenediaminetetraacetic acid | TEKnova (Hollister, CA, USA) | T0221 | |
| Rneasy Micro Kit | Qiagen (Venlo, Netherlands) | 74004 | |
| QuantiTec Reverse Transcription Kit | Qiagen (Venlo, Netherlands) | 205310 | |
| CellsDirect One-Step qRT-PCR Kit | Ambion/Invitrogen(Grand Island, NY, USA) | 11753-100 | |
| Paraformaldehyde | Santa Cruz Bio (Santa Cruz, CA, USA) | SC-281692 | |
| Goat serum | Jackson Immuno (West Grove, PA, USA) | 005-000-121 | Stock kept at -20oC |
| Donkey serum | Jackson Immuno (West Grove, PA, USA) | 0017-000-121 | Stock kept at -20oC |
| Triton X-100 | Sigma (St. Louis, MO, USA) | T9284 | |
| Trypsin | Sigma (St. Louis, MO, USA) | T-4799 | |
| Ethylenediaminetetraacetic acid | Invitrogen (Waltham, MA, USA) | 15575-020 | |
| Trypsin-EDTA | Life Technologies (Waltham, MA, USA) | 25200-056 | |
| Sterile Water | Gibco (Grand Island, NY, USA) | 15230-147 | Molecular biology grade |
| Pasteur Pipette | Fisher Scientific (Pittsburgh, PA , USA) | 13-678-8B | |
| 40um Filter Mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-1 | |
| 70 um filter mesh | Fisher Scientific (Pittsburgh, PA , USA) | 08-771-2 | |
| TC Plate 96 Well Suspension | Sarstedt | 83.3924 (Previously 83.1835) | |
| 1cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 309659 | |
| 10cc Syringe | Becton Dickson (Franklin Lakes, NJ, USA) | 301604 | |
| 48.48 Dyanmic Array Chip | Fluidigm (San Francisco, CA, USA) | BMK-M-48.48 | |
| Fluidigm GE 48.48 Dynamic Array Sample & Assay Loading Reagent Kit | Fluidigm (San Francisco, CA, USA) | 85000800 | |
| TaqMan Universal PCR Master Mix | Applied Biosystems (Grand Island, NY, USA) | 4304437 | |
| Polyethylene glycol sorbitan monolaurate | Sigma (St. Louis, MO, USA) | P7949 | |
| Glass Bottom Dish | MatTek (Ashland, MA, USA) | P35G-1.5-14-C | 35 mm petri dish with glass bottom |
| Mouth Piece/ Rubber Tubing | Renova Life Inc. (College Park, MD, USA) | MP-SET | |
| Nicotinamide | Sigma (St. Louis, MO, USA) | N0636 | Stock kept at -20oC |
| Vascular Endothelial Growth Factor | R&D Systems (Minneapolis, MN, USA) | 293-VE | Stock kept at -80oC |
| Activin B | R&D Systems (Minneapolis, MN, USA) | 659-AB | Stock kept at -80oC |
| Extendin 4 | Sigma (St. Louis, MO, USA) | E7144 | Stock kept at -20oC |
| Rspondin-1 | R&D Systems (Minneapolis, MN, USA) | 3474-RS | Stock kept at -80oC |
| Falcon 5mL Polystyrene Round-Bottom Tube | Corning Inc. (Corning, NY, USA) | 352054 | |
| PrecisionGlide Needle 18Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305196 | |
| PrecisionGlide Needle 16Gx1 1/2 | Becton Dickson (Franklin Lakes, NJ, USA) | 305198 | |
| Costar Ultra-Low Attachment Surface 24 well flat bottom plate | Corning Inc. (Corning, NY, USA) | 3473 | |
| Costar 96 Black Well Plate | Corning Inc. (Corning, NY, USA) | 3603 | Flat, clear bottom with lid. Black polystyrene TC-treated microplates |
| Zeiss LSM510 META NLO Axiovert 200M Inverted Microscope | Carl Zeiss AG (Oberkochen, Germany) | ||
| Biomark HD | Fluidigm (San Francisco, CA, USA) | ||
| Aria Special Order Research Product Cell Sorter | Becton Dickson (Franklin Lakes, NJ, USA) |
Referencias
- Gu, G., Brown, J. R., Melton, D. A. Direct lineage tracing reveals the ontogeny of pancreatic cell fates during mouse embryogenesis. Mech Dev. 120, 35-43 (2003).
- Kopp, J. L., et al. Sox9+ ductal cells are multipotent progenitors throughout development but do not produce new endocrine cells in the normal or injured adult pancreas. Development. 138, 653-665 (2011).
- DiGiusto, D. L., et al. RNA-based gene therapy for HIV with lentiviral vector-modified CD34(+) cells in patients undergoing transplantation for AIDS-related lymphoma. Science translational medicine. 2, 36-43 (2010).
- Inada, A., et al. Carbonic anhydrase II-positive pancreatic cells are progenitors for both endocrine and exocrine pancreas after birth. Proc Natl Acad Sci U S A. 105, 19915-19919 (2008).
- Solar, M., et al. Pancreatic exocrine duct cells give rise to insulin-producing beta cells during embryogenesis but not after birth. Dev Cell. 17, 849-860 (2009).
- Ku, H. T. Minireview: pancreatic progenitor cells--recent studies. Endocrinology. 149, 4312-4316 (2008).
- Jin, L., et al. Colony-forming cells in the adult mouse pancreas are expandable in Matrigel and form endocrine/acinar colonies in laminin hydrogel. Proc Natl Acad Sci U S A. 110, 3907-3912 (2013).
- Fu, X., et al. MicroRNA-26a targets ten eleven translocation enzymes and is regulated during pancreatic cell differentiation. Proc Natl Acad Sci U S A. 110, 17892-17897 (2013).
- Ghazalli, N., et al. Postnatal Pancreas of Mice Contains Tripotent Progenitors Capable of Giving Rise to Duct, Acinar, and Endocrine Cells In Vitro. Stem Cells Dev. , (2015).
- Jin, L., et al. Colony-forming progenitor cells in the postnatal mouse liver and pancreas give rise to morphologically distinct insulin-expressing colonies in 3D cultures. Rev Diabet Stud. 11, 35-50 (2014).
- Jin, L., et al. In Vitro Multilineage Differentiation and Self-Renewal of Single Pancreatic Colony-Forming Cells from Adult C57Bl/6 Mice. Stem Cells Dev. , (2014).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. Embo J. 32, 2708-2721 (2013).
- Greggio, C., et al. Artificial three-dimensional niches deconstruct pancreas development in vitro. Development. 140, 4452-4462 (2013).
- Lee, J., et al. Expansion and conversion of human pancreatic ductal cells into insulin-secreting endocrine cells. Elife. 2, e00940 (2013).
- Dorrell, C., et al. The organoid-initiating cells in mouse pancreas and liver are phenotypically and functionally similar. Stem Cell Res. 13, 275-283 (2014).
- Ku, H., Yonemura, Y., Kaushansky, K., Ogawa, M. Thrombopoietin, the ligand for the Mpl receptor, synergizes with steel factor and other early acting cytokines in supporting proliferation of primitive hematopoietic progenitors of mice. Blood. 87, 4544-4551 (1996).
- Ku, H. T., et al. Insulin-expressing colonies developed from murine embryonic stem cell-derived progenitors. Diabetes. 56, 921-929 (2007).
- Winkler, M., et al. A quantitative assay for insulin-expressing colony-forming progenitors. J Vis Exp. , e3148 (2011).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Formeister, E. J., et al. Distinct SOX9 levels differentially mark stem/progenitor populations and enteroendocrine cells of the small intestine epithelium. Am J Physiol Gastrointest Liver Physiol. 296, G1108-G1118 (2009).
- Seymour, P. A., et al. A dosage-dependent requirement for Sox9 in pancreatic endocrine cell formation. Dev Biol. 323, 19-30 (2008).
- Ogawa, M. Differentiation and proliferation of hematopoietic stem cells. Blood. 81, 2844-2853 (1993).
- Suzuki, A., Nakauchi, H., Taniguchi, H. Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting. Diabetes. 53, 2143-2152 (2004).
- Seaberg, R. M., et al. Clonal identification of multipotent precursors from adult mouse pancreas that generate neural and pancreatic lineages. Nat Biotechnol. 22, 1115-1124 (2004).
- Zhou, Q., Brown, J., Kanarek, A., Rajagopal, J., Melton, D. A. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 455, 627-632 (2008).
- Baeyens, L., et al. Transient cytokine treatment induces acinar cell reprogramming and regenerates functional beta cell mass in diabetic mice. Nat Biotechnol. 32, 76-83 (2014).
- Thorel, F., et al. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature. 464, 1149-1154 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados