Method Article
Использование ламинирование Методика Выполните конфокальной микроскопией Человеческой склеры
В этой статье
Резюме
Human sclera tissue is mainly collagen; therefore, it is not easily usable for immunohistochemistry. To achieve the goal of performing immunohistochemistry for confocal microscopy of scleral tissue, a laminating technique was used.
Аннотация
Склеры является плотной соединительной ткани, которая покрывает и защищает глаза. Она в основном состоит из плотных коллагеновых пучков (типов I, III, IV, V, VI и VII). Благодаря своему автофлуоресцентной, непрозрачности и толщины, не было обнаружено подходит для конфокальной микроскопии. Альтернативный подход к приведенному здесь, который использует фиксированные формалином склеры заключали в парафин для иммуногистохимии, имеет технические проблемы, особенно когда предварительное нагревание ткани для извлечения антигена. Поскольку склеры относительно бедна в обоих клетках и сосудах, использование больших образцов ткани была исследована, чтобы помочь предотвратить клетки с видом и понять их локализацию в отношении судов и других анатомических участков. Для обеспечения анализа больших образцов ткани под конфокальной микроскопии, метод ламинирования была выполнена для создания тонких слоев из склеры. После анализа результатов CD31 кровеносных сосудов и сосудов лимфатической эндотелиальной hyaluРонан рецептора 1 (LYVE1) положительных клеток, для которых было получено разрешение на научной экспертизы, преимущества и недостатки этого метода обсуждаются.
Введение
Склера жесткий внешний слой, который покрывает глаз, который сделан из плотной соединительной ткани. Это помогает защитить внутриглазных структур и для поддержания внутриглазного давления. Таким образом, склеры имеет важное значение для четкого видения. Она лишена лимфатических сосудов 1,2 и тем самым образует наружную лимфатическую свободной границы между ним и лимфатической свободной внутренней глаза 3-7. Она также обеспечивает места для прикрепления мышц глазного яблока, тем самым разделяя анатомических сходство с сухожилиями. Поскольку склера в основном состоит из плотных пучков типа I коллагена и имеет меньшее количество коллагена типа III, IV, V, VI, VIII 8,9 и эластина 10,11, эта ткань не является простым в использовании для иммуногистохимии.
Анатомически, склера могут быть разделены на три основные слои: (1) поверхностный васкуляризированной эписклеры, найденных под конъюнктиву и Теноновой капсулы и к сторонам и йе задней части глаза, обращенной к орбите; (2) Склеральное стромы, основная часть склеры; и (3) ламина fusca, которая представляет собой тонкий, пигментированный слой, расположенный непосредственно над сосудистой оболочки. Наше анатомическое знание о склеры проистекает главным образом из первой половины 20 - го века. В то время, исследователи изучали анатомию сосудистую систему, главным образом , с помощью тушью инъекций 12 и сосудистая литье 13-15. Позже он был исследован в ангиографических исследований 16-19.
С тех пор старые методы были улучшены, а новые были разработаны, которые позволили нам дополнить предыдущую анатомических знаний. Например, это только было около десяти лет , так как у нас были такие надежные маркеры лимфатическую как лимфатический эндотелий сосудов специфические гиалуронана рецептора-1 (LYVE1) 20 или podoplanin 21. Конфокальной микроскопии предлагает новые возможности для изучения анатомических особенностей различных тиОПРОСЫ глаза. Это позволяет несколько пятен, которые будут использоваться для дифференциации маркеров клеток или для локализации клеток по отношению к кровеносных сосудов и других анатомических структур. Это дает обзор, когда образец имеет больший размер и позволяет сканировать через образец, когда в поисках определенного типа клеток. С Z-Stack технологии, конфокальной микроскопии могут быть использованы для образцов до 100-200 мкм. Склеры отличается толщиной от 0,3 мм позади мышечных вставок и 1 мм на заднем полюсе 11. Благодаря своей толщине, так и непрозрачности, склеры не подходит для конфокальной микроскопии с использованием традиционных методов.
Чтобы исправить это, склеры ткани ламинируют, чтобы для их анализа с конфокальной микроскопии. Эта технология полезна для получения лучшего понимания как физиологических и патологических ситуаций в человеческом склеры.
протокол
Использование тканей человека должны быть рассмотрены и одобрены институциональным наблюдательным советом или эквивалент. Работа, описанная здесь, была одобрена местным комитетом по этике и получили одобрение на научной экспертизы. Эта работа была выполнена в соответствии с Хельсинской декларацией. Склеры образцы человека были получены от глаз доноров проходных (максимум посмертного время 24 часа в сутки) в Банке Глаз департамента офтальмологии Университета Кельна, Германия.
1. Экспериментальная подготовка
- Готовят 96% этанола и забуференный фосфатом физиологический раствор (PBS), в различных трубах. Подготовка первичных антител в рекомендуемом разведении ФБС, содержащим 2% бычьего сывороточного альбумина (БСА) и держать все решения на льду. Подготовьте 100 мкл на образце.
- Очистите все инструменты и использовать острые скальпели. После повторной резки с тем же скальпелем, изменить скальпель.
- Получить 1-2 Colibri щипцы, прямые микро рассекает ножницы, скальпель # 10или офтальмологического скальпеля микро перо, и четыре 26 G иглы.
- Оберните алюминиевой фольги вокруг полистирольной пластины или использовать пробковую пластину для прикрепления ткани. Работа под бинокулярным микроскопом стерео. Работа стерильными под ламинарного потока воздуха при необходимости.
2. Подготовить склеры
- Придерживая лампу и выполнить перфоратора трепанацию на корнеосклеральный части, а затем вращайте Трепан. Поверните Трепан тщательно и равномерно на поверхность, чтобы выполнить одинаково круглый разрез. Используйте Трепан размером 15,5 мм. Нарезать оставшиеся вложения с изогнутыми ножницами. Удалите корнеосклеральный трепанацию. Это приведет к кпереди открылась колбой.
- Поместите склеры на тампоном с открытой частью вверх. Удалить сетчатку и сосудистой оболочки, используя Colibri щипцов, чтобы снять оба слоя (сетчатка и сосудистая оболочка глазного яблока) из склеры. Не оставляйте пигментированной сосудистой оболочки на внутренней склеры. Используйте изогнутые ножницы, чтобы удалить сетчатку и сосудистой оболочки от сосочка. Удалите бэрAining конъюнктивы, мышцы глазного яблока, и капсула теноново от поверхностного склеры.
- Удалить склеры образец в требуемого размера с помощью ножниц прямого типа и CoLibri щипцов. Возьмите около 2 см 2 размера склеры образцы из разных мест. Из-за небольшого размера, удерживая склеры аккуратно и вырезать необходимый размер в виде квадратов, используя ножницы прямого типа. Корнеосклеральный трепанацию определяет переднего края склеры образцов.
- Избегайте повторного захвата с пинцетом, как область, где ткань схватился не подходит для анализа конфокальной микроскопии. Подготовьте необходимое количество образцов в зависимости от типа эксперимента (например , кпереди против кзади, сравните рисунок 1) и количество антител , используемых.
- Поместите образцы в 1,5 мл пробирки для последующего использования. Закрепить образцы в 1,5 мл 96% этанола в течение 15 мин, а затем промывают их три раза каждые 5 минв 1,5 мл PBS на шейкере. При работе с замороженной ткани, выполнить этот шаг перед оснастке замораживания.
- Используйте чистую ткань. Однако, если это не представляется возможным, оснастки заморозить склеры в жидком азоте и хранить его при температуре -20 ° C для дальнейшего использования. При работе с замороженной ткани, оттепель перед использованием. Избегайте повторного оттаивания и замораживания циклов.
- Хранить каждую пробу в PBS, содержащем 1,5 мл 5% БСА при комнатной температуре в течение 2 часов. Этот шаг вызывает набухание образца, который полезен для ламинирование, а также предотвращает неспецифическое связывание.
- После того, как образцы опухли, готовят склеры квадратов для ламинирования. Работа под микроскопом, например , бинокулярный стерео микроскоп. Наклейте задние склеры образцы к полистирольной мембраны, завернутые в алюминиевую фольгу или пробковой пластины с использованием 26 G иглы.
- Согните края иглы, чтобы они не мешали поля зрения под микроскопом.
- Ламинат полной толщины склеры SAMPле.
- Во-первых, удерживать передний край склеры с помощью Colibri щипцов. После этого тщательно тонкий слой поверхностной склере с использованием # 10 скальпель офтальмологические скальпель микро перо или шпателем лезвие. Удерживая скальпель по горизонтали и вырезать поверхностный слой как можно тоньше из нижележащего слоя.
- Рассеките тонкий слой склеры из склеры квадрата. Этот метод сравним со стандартными хирургические методы для подготовки лоскута во время трабекулэктомией и должно привести к толстым слоем 30-80 мкм (сравните рисунок 2).
- Предотвратить высыхание склеры путем добавления небольших количеств PBS в ткани, например , 50 мкл PBS с помощью пипетки.
- Положите нарезанные слои в 100 мкл PBS в 96 - луночного планшета и маркируют как ориентацию ( по отношению к Экстерн и стажер) и слой (поверхностный и глубокий) , например , с водонепроницаемым цвета.
- Повторите шаги 2.7-2.9, пока ткань полностью не ламинированными.
3. Выполните иммуногистохимии
- Добавьте 100 мкл необходимых первичных антител в рекомендуемом разведении. Здесь, например , использование CD - 31 (мышиное моноклональное анти человека) и LYVE1 антитело (кроличье анти человека), и в разведении 1: 100 в PBS (содержащий 2% БСА) и инкубируют при 4 ° С в течение ночи. Для изменения среды в 96-луночный планшет, удерживая пипетку к стенке скважины и удаления жидкости.
- На следующий день, мыть образцов по три раза в течение 5 мин с 200-300 мкл PBS на шейкере. Добавьте 100 мкл соответствующих вторичных антител; здесь используют козий анти мыши флуоресцеинизотиоцианатом (FITC) и козьи антитела против кроличьих цианиновые красители 3 (Су3) и инкубировать образцов при комнатной температуре в течение 1-2 ч. Разведите вторичные антитела 1: 300 в PBS, содержащем 2% сыворотки козьего.
- Промыть образцы снова трижды, каждый раз в течение 5 мин в 200-300 мкл PBS на шейкере.
- Выполните ядра окрашивания, например , . 4 ', 6-диамидино-2-фенилиндола (DAPI) (разведение 1: 2000, 100 мкл в каждую лунку и инкубируйте 10 мин при комнатной температуре), затем промывают еще раз 2 раза в 200-300 мкл PBS на шейкере.
- Передача образцов на предметные стекла микроскопа, встраивать их в 1-2 капли флуоресцентного монтажной среды, добавьте покровное, запечатать его, покрывая края прозрачным лаком, и хранят при температуре 4 ° С для последующего использования или непосредственно исследовать слайдам с помощью конфокальной микроскоп.
- С помощью конфокальной микроскопии (или эквивалент) для анализа образцов. Используйте желаемое увеличение, например , 10-40X увеличения.
- Чтобы проверить толщину образцов измеряют с помощью конфокальной микроскопии с использованием Z-стеки. Количество возможных склеры секций зависит от расположения склеру, а толщина экваториально и кзади (сравните введение) отличается.
Результаты
В представительных экспериментах, проведенных здесь, существуют доказательства выгоды, получаемые от использования данного конкретного способа ламинирования. Первый эксперимент иллюстрирует разнообразную сеть Эписклеральные сплетение кровеносных сосудов в трех репрезентативных снимков (рисунок 3). Сосуды являются позитивными для CD31.
Второй эксперимент показывает, иммунные клетки, в частности LYVE1 + клеток эписклеры и их отношения к CD31 положительным кровеносных сосудов. Здесь Z-Stack технология была использована при 10 - кратным увеличением для сканирования через ткань и понять трехмерные соотношения кровеносных сосудов и клеток иммунной системы (рисунок 4).
Склеры, а также прилагаемая мышцы глаза , могут быть проанализированы на наличие кровеносных сосудов или клеток иммунной системы . На рисунке 5 показаноLYVE1 положительных клеток и CD31 положительным кровеносные сосуды.
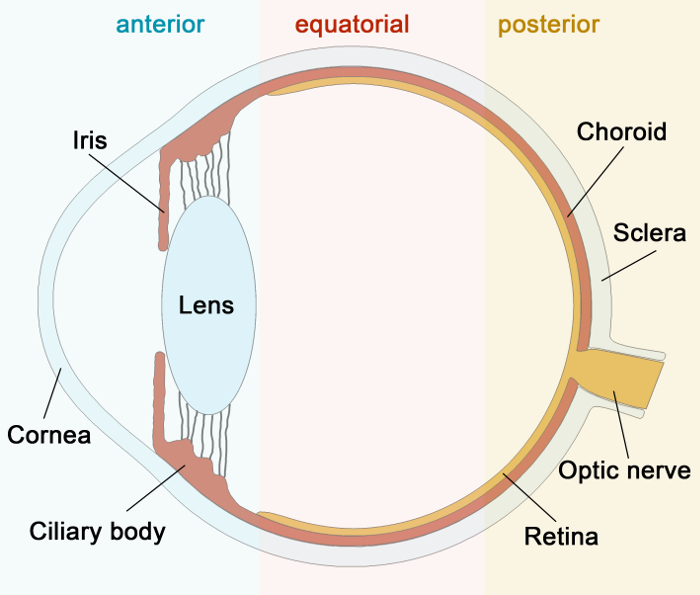
Рисунок 1:.. Схематическое изображение человеческого глаза Вот схематическое изображение поперечного сечения человеческого глаза Пожалуйста , нажмите здесь , чтобы увидеть большую версию этой фигуры.
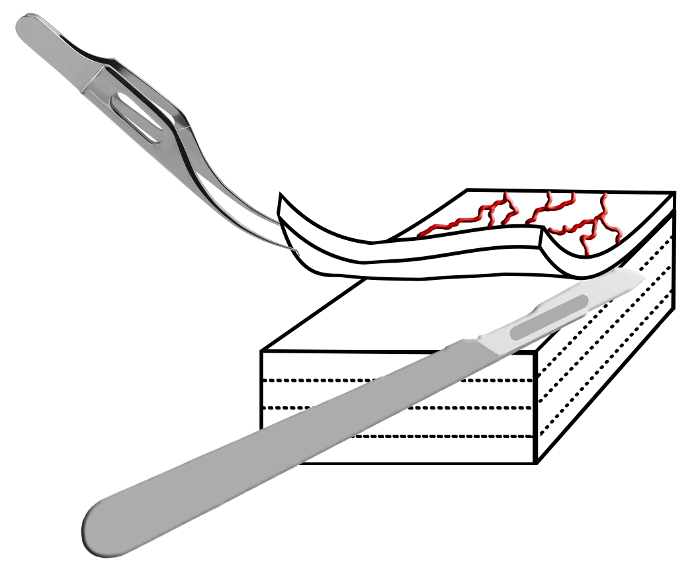
Рис . 2: Схематическое изображение ламинирование Техника Склеры тщательно проведено с Colibri пинцетом и ламинируют на тонкие слои с помощью скальпеля. Повторяя этот шаг приводит к тонким горками ткани , которые могут быть использованы для конфокальной микроскопии. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этого фифигура.
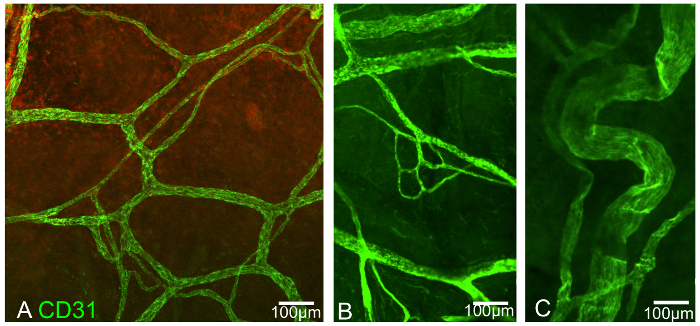
Рисунок 3:. Эписклеральные сосудохирургия сплетение, иммунопозитивные для CD31 А и В являются производными от передней эписклеры, в то время как С от места задней. Шкала бар показывает 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
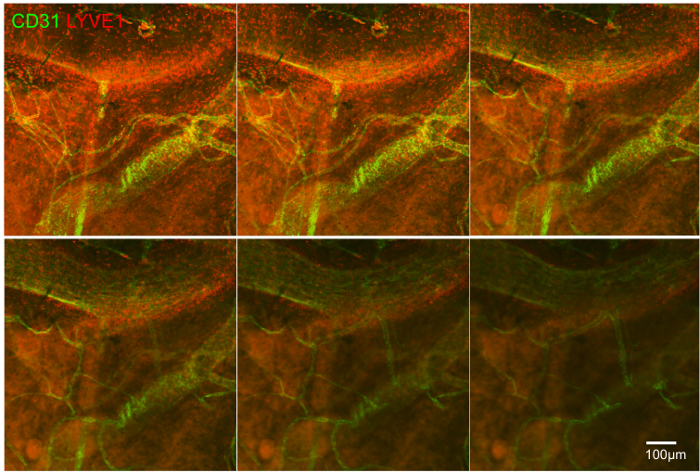
Рис . 4: CD31 + кровеносных сосудов и LYVE1 + клеток в г-стека, показываются анатомического отношения между ними Малые суда и более крупные из них могут перекрывать друг друга. Шкала бар показывает 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: Заключено в склеры являются экстраокулярной Они Мышцы содержат подобную тонкую сеть кровеносных сосудов и некоторые LYVE1 + клеток.. Шкала бар показывает 200 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Ламинирование человеческий склеры способ выполнения конфокальной микроскопии на этой ткани. Важным шагом в этом процессе является использование этанола вместо формалина для прикрепления ткани. По нашему опыту, лучшие результаты получаются при использовании этанола вместо формалина для фиксации. Тупые скальпели усугубить процедуру и ее следует избегать. Точно так же, высыхание склеры, следует избегать, поскольку это усложняет процедуру и снижает качество изображений.
Что касается иммуногистохимического окрашивания, могут быть использованы и другие антитела, помимо тех, которые применяются здесь. В общем, коллаген показывает более автофлуоресценции и фон в зеленом канале, поэтому красный, синий и дальнего красного каналов показывают лучшие результаты с меньшим фоном.
Тем не менее, существует несколько ограничений техники. Ламинирование склеры требует много практики, так как это микрохирургическая процедура, выполняемая под microscОПЕ. Поскольку эта методика выполняется вручную, то этот единственный слоистые кусочки не точно такой же размер и различаются по толщине в пределах одного куска ткани. Для того, чтобы иметь ткани точно такого же размера, трепанацию мог бы быть альтернативой, хотя толщина слоев будет по-прежнему меняться. Для достижения точно определенной толщины для склеры секций, автоматизированный микрокератом может быть альтернативой для будущих экспериментов. Если ламинирование выполняется со слоями, которые слишком толстая, крышка слайд может смещаться, и ткань может потенциально высыхают. Точные границы между эписклеры и стромы может быть трудно дифференцировать, как только слоистые выполняются.
Несмотря на это, ламинирование склеры имеет несколько преимуществ в использовании иммуногистохимии, особенно по сравнению с фиксированных формалином и залитых в парафин иммуногистохимии, который является стандартным методом в современной клинической ситуации. Ламинирование склеры позволяет конфокальной microscOpY быть выполнены, большего размера площади склеры, которые будут проанализированы, различные слои склеры, которые будут рассмотрены, а также скрининг и сканирование ткани. В отличие от этого, при работе с формалином фиксированных залитых парафином образцов, склера меняет свою консистенцию в неблаговидную способом во время предварительного нагрева для извлечения антигена. На протяжении всего процесса нагрева, коллагеновые волокна высыхают и ткань теряет контакт с горкой. Ранее сплетение судно в эписклеры только были видны с помощью ангиографических методов или в целом зрения монтирования, но не в сечениях.
Помимо технических трудностей, склера относительно бессосудистая и относительно бедна иммунных клеток по сравнению с другими тканями глаза, например сетчатки. Таким образом, при использовании фиксированных формалином и залитых в парафин слайды, которые, как правило 4 мкм толщиной, несколько горок необходимы для обнаружения положительных клеток в склере. В последнее время было показано, с помощью этого ламинированнING технику , что человеческий склеры не бесклеточная, но содержит множество LYVE1 + макрофагов накапливаются вокруг кровеносных сосудов 1.
Подводя итог, выполняя конфокальной микроскопии на ламинированных склеры участков является перспективным инструментом для исследования патологических нарушений в будущем, такие как склерит, увеит, или травмы.
Раскрытие информации
The authors declare no financial disclosures. The contents of this article are solely the responsibility of the authors.
Благодарности
German Research Foundation (FOR2240 "(Lymph) Angiogenesis and Cellular Immunity in Inflammatory Diseases of the Eye" to CC and LMH; HE 6743/2-1 and HE 7643/3-1 to LMH; CU47/6-1 to CC), German Cancer Aid (to LMH and CC), GEROK program University of Cologne (to SLS and LMH), and EU COST BM1302 "Joining Forces to Corneal Regeneration" (to CC).
Материалы
| Name | Company | Catalog Number | Comments |
| 96% ethanol | Merck Chemicals, Darmstadt, Germany | P075.4 | |
| binocular stereo microscope | Motic, Hongkong, China | n.a | |
| 26 G needles | Terumo, Leuven, Belgium | 303800 | |
| 15.5 mm trepan | Geuder, Heidelberg, Germany | n.a | |
| no.10 scalpel | Feather, pfm medical, Osaka, Japan | 2E+08 | |
| ophthalmic scalpel micro feather | Feather, pfm medical, Osaka, Japan | no. 7657BR | |
| CD 31 antibody (monoclonal mouse anti human) | Dako, USA | IR610 | |
| LYVE1 antibody (polyclonal rabbit anti human) | Zytomed, Germany | RBK014-05 | |
| goat anti mouse FITC antibody | Sigma Aldrich, Steinheim, Germany | F0257 | |
| goat anti rabbit Cy3 antibody | Dianova, Germany | 111-165-003 | |
| Goat Serum normal | Dako, Glostrup, Denmark | X090710-8 | |
| DAPI | Carl Roth GmbH, Karlsruhe, Germany | 6335.1 | |
| microscope slides | Engelbrecht, Edermünde, Germany | WC7695002 | |
| Coverslips 24 mm x 24 mm | Th. Gayer, Lohmar, Germany | 7695026 | |
| DAKO fluorescent mounting medium | DAKO, USA | S3023 | |
| LSM Meta 510 confocal microscopy | Carl Zeiss AG, Jena, Germany | n.a |
Ссылки
- Schlereth, S. L., et al. Enrichment of lymphatic vessel endothelial hyaluronan receptor 1 (LYVE1)-positive macrophages around blood vessels in the normal human sclera. Invest Ophthalmol Vis Sci. 55 (2), 865-872 (2014).
- Schlereth, S. L., et al. Absence of lymphatic vessels in the developing human sclera. Exp Eye Res. 125, 203-209 (2014).
- Hos, D., Cursiefen, C. Lymphatic vessels in the development of tissue and organ rejection. Adv Anat Embryol Cell Biol. 214, 119-141 (2014).
- Hos, D., Schlereth, S. L., Bock, F., Heindl, L. M., Cursiefen, C. Antilymphangiogenic therapy to promote transplant survival and to reduce cancer metastasis: what can we learn from the eye. Semin Cell Dev Biol. , (2014).
- Streilein, J. W. Immune privilege as the result of local tissue barriers and immunosuppressive microenvironments. Curr Opin Immunol. 5 (3), 428-432 (1993).
- Streilein, J. W., Niederkorn, J. Y. Induction of anterior chamber-associated immune deviation requires an intact, functional spleen. J Exp Med. 153 (5), 1058-1067 (1981).
- Streilein, J. W., Yamada, J., Dana, M. R., Ksander, B. R. Anterior chamber-associated immune deviation, ocular immune privilege, and orthotopic corneal allografts. Transplant Proc. 31 (3), 1472-1475 (1999).
- Keeley, F. W., Morin, J. D., Vesely, S. Characterization of collagen from normal human sclera. Exp Eye Res. 39 (5), 533-542 (1984).
- Lee, R. E., Davison, P. F. Collagen composition and turnover in ocular tissues of the rabbit. Exp Eye Res. 32 (6), 737-745 (1981).
- Moses, R. A., Grodzki, W. J., Starcher, B. C., Galione, M. J. Elastin content of the scleral spur, trabecular mesh, and sclera. Invest Ophthalmol Vis Sci. 17 (8), 817-818 (1978).
- Foster, C. S., Sainz de la Maza, M. The sclera. , Springer. (2012).
- Kiss, F. Der Blutkreislauf des Auges. Ophthalmologica. 106, 225(1943).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. Part I. Aqueous veins. Br J Ophthalmol. 35 (5), 291-303 (1951).
- Ashton, N., Smith, R. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. III. Arterial relations of Schlemm's canal. Br J Ophthalmol. 37 (10), 577-586 (1953).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts II. Aqueous veins. Br J Ophthalmol. 36 (5), 265-267 (1952).
- Hayreh, S. S., Scott, W. E. Fluorescein iris angiography. II. Disturbances in iris circulation following strabismus operation on the various recti. Arch Ophthalmol. 96 (8), 1390-1400 (1978).
- Virdi, P. S., Hayreh, S. S. Anterior segment ischemia after recession of various recti. An experimental study. Ophthalmology. 94 (10), 1258-1271 (1987).
- Bron, A. J., Easty, D. L. Fluorescein angiography of the globe and anterior segment. Trans Ophthalmol Soc U K. 90, 339-367 (1970).
- Ikegami, M. Fluorescein angiography of the anterior ocular segment. Part 1. Hemodynamics in the anterior ciliary vessels (author's transl). Nihon Ganka Gakkai Zasshi. 78 (7), 371-385 (1974).
- Banerji, S., et al. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-specific receptor for hyaluronan. J Cell Biol. 144 (4), 789-801 (1999).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены