Method Article
Utilizzando una tecnica di laminazione per l'esecuzione di Microscopia confocale della sclera umana
In questo articolo
Riepilogo
Human sclera tissue is mainly collagen; therefore, it is not easily usable for immunohistochemistry. To achieve the goal of performing immunohistochemistry for confocal microscopy of scleral tissue, a laminating technique was used.
Abstract
La sclera è un tessuto connettivo denso che copre e protegge l'occhio. Essa consiste essenzialmente di fasci di collagene denso (tipo I, III, IV, V, VI, e VII). Grazie alla sua autofluorescenza, opacità e spessore, non è stato trovato adatto per la microscopia confocale. Un approccio alternativo a quello qui presentato, che utilizza sclera fissati in formalina inclusi in paraffina per immunoistochimica, ha problemi tecnici, in particolare per preriscaldare il tessuto per il recupero antigene. Dal momento che la sclera è relativamente povero di entrambe le cellule e dei vasi, l'uso di campioni di tessuto più grandi è stato esplorato per aiutare a prevenire le cellule che si affacciano e per capire la loro localizzazione in relazione alle navi e altri siti anatomici. Per consentire l'analisi di campioni di tessuto grandi al microscopio confocale, una tecnica di laminazione è stata eseguita per creare strati sottili dalla sclera. Dopo l'analisi dei risultati dei vasi sanguigni CD31 e vasi linfatici endoteliale hyaluRonan recettore 1 (LYVE1) cellule positive, per le quali è stato ottenuto l'approvazione per l'esame scientifico, i vantaggi ei limiti di questo metodo sono discussi.
Introduzione
La sclera è lo strato esterno rigido che copre l'occhio, che è fatto di tessuto connettivo denso. Aiuta a proteggere le strutture intraoculari e di mantenere la pressione intraoculare. Così, la sclera è essenziale per una visione chiara. E 'privo di vasi linfatici 1,2 e, quindi, forma un bordo esterno libero-linfatica tra essa e l'occhio interiore senza linfatica 3-7. Esso fornisce inoltre i siti di attacco per i muscoli estrinseci, condividendo in tal modo somiglianze anatomiche con tendini. Poiché la sclera consiste principalmente di densi fasci di collagene di tipo I e ha un numero inferiore di collagene di tipo III, IV, V, VI, VIII 8,9 ed elastina 10,11, questo tessuto non è facile da usare per immunoistochimica.
Anatomicamente, la sclera può essere suddiviso in tre strati principali: (1) il superficiale episclera vascolarizzato, trovati sotto la congiuntiva e la capsula di tenone e verso i lati e the posteriore dell'occhio rivolto verso l'orbita; (2) stroma sclerale, la parte principale della sclera; e (3) il fusca lamina, che è un sottile strato pigmentato situato direttamente sopra la uvea. La nostra conoscenza anatomica sulla sclera deriva principalmente dalla prima metà del 20 ° secolo. A quel tempo, i ricercatori hanno studiato l'anatomia del sistema vascolare prevalentemente utilizzando iniezioni di inchiostro India 12 e vascolare fusione 13-15. Successivamente, è stato studiato in studi angiografici 16-19.
Da quel momento, le tecniche più vecchie sono state migliorate e nuove sono state sviluppate che ci hanno permesso di completare una precedente conoscenza anatomica. Ad esempio, è stato solo di circa un decennio da quando abbiamo avuto tali marcatori linfatici affidabili come linfatico vascolare acido ialuronico specifico recettore-1 (LYVE1) 20 o 21 podoplanin. La microscopia confocale offre nuove possibilità per lo studio delle caratteristiche anatomiche dei diversi tiUESTIONI dell'occhio. Esso consente più macchie da utilizzare per differenziare marcatori di cellule o per la localizzazione delle cellule in relazione ai vasi sanguigni e altre strutture anatomiche. Esso fornisce una panoramica quando il campione è di dimensioni maggiori e ci permette di scandiamo un campione quando alla ricerca di un tipo specifico di cellula. Con la tecnologia Z-Stack, microscopia confocale può essere utilizzato per i campioni fino a 100-200 micron. La sclera differisce di spessore tra 0,3 mm dietro le inserzioni muscolari e 1 mm al polo posteriore 11. A causa sia suo spessore e opacità, la sclera non è adatto per la microscopia confocale con metodi tradizionali.
Per rimediare a questo, i tessuti sclerali sono stati stratificati per consentire la loro analisi con microscopia confocale. Questa tecnologia è utile per una migliore comprensione di entrambe le situazioni fisiologiche e patologiche nella sclera umana.
Protocollo
L'uso di tessuti umani deve essere esaminato e approvato da un comitato istituzionale di revisione o equivalente. Il lavoro qui descritto è stato approvato dal comitato etico locale e ha avuto l'approvazione per l'esame scientifico. Questo lavoro è stato eseguito in base alla Dichiarazione di Helsinki. I campioni sclerali umani sono stati ottenuti dagli occhi dei donatori globo (massimo post mortem 24 ore) presso la Banca degli Occhi del Dipartimento di Oftalmologia, Università di Colonia, in Germania.
1. Preparazione sperimentale
- Preparare 96% etanolo e tampone fosfato isotonico (PBS) in tubi diversi. Preparare gli anticorpi primari nella diluizione raccomandata di PBS contenente 2% di albumina sierica bovina (BSA) e mantenere tutte le soluzioni su ghiaccio. Preparare 100 microlitri per campione.
- Pulire tutti gli strumenti e utilizzare bisturi taglienti. Dopo ripetute taglio con la stessa bisturi, cambiare il bisturi.
- Ottenere 1-2 pinze Colibri, forbici dissezione micro scala, un # 10 bisturio oftalmica bisturi micro piuma, e quattro aghi 26 G.
- Avvolgere un foglio di alluminio intorno a un piatto di polistirolo o utilizzare una piastra di sughero di apporre il tessuto. Lavorare sotto un stereomicroscopio binoculare. Lavorare sterile sotto un flusso laminare, se necessario.
2. Preparare la sclera
- Premere delicatamente la lampadina ed eseguire una trapanazione perforazione da parte corneosclerale, quindi ruotare il trapano. Ruotare il trapano con cura e in modo uniforme sulla superficie di eseguire un taglio altrettanto rotondo. Utilizzare un trapano di dimensioni 15,5 millimetri. Tagliare i restanti allegati con forbici curve. Rimuovere la trapanazione corneosclerale. Questo si tradurrà in una lampadina anteriormente aperto.
- Mettere la sclera su un tampone con la parte aperta verso l'alto. Rimuovere la retina e uvea, con pinze Colibri di tirare fuori entrambi gli strati (retina e uvea) dalla sclera. Non lasciare uvea pigmentato sulla sclera interiore. Utilizzare forbici curve per rimuovere la retina e uvea dalla papilla. Rimuovere il remaining congiuntiva, muscoli estrinseci, e la capsula di tenone dalla sclera superficiale.
- Rimuovere il campione sclerale nella dimensione desiderata utilizzando le forbici straight-tipo e le pinze Colibri. Prendere circa 2 cm 2 campioni sclerali dimensioni da luoghi diversi. A causa delle piccole dimensioni, tenere la sclera delicatamente e tagliare fuori la dimensione richiesta come quadrati utilizzando le forbici straight-tipo. La trapanazione corneosclerale definisce il margine anteriore dei campioni sclerali.
- Evitare afferrando ripetuto con le pinze come l'area in cui il tessuto è stato afferrato non è adatto per le analisi microscopia confocale. Preparare il numero di campioni in funzione del tipo di esperimento (es anteriormente vs. posteriormente, confrontare Figura 1) e la quantità di anticorpi utilizzati.
- Mettere i campioni in provette da 1,5 ml per un uso successivo. Fissare i campioni in 1,5 ml di etanolo 96% per 15 minuti, e poi lavarli tre volte ciascuno per 5 minin 1,5 ml di PBS sul shaker. Se si lavora con il tessuto congelato, eseguire questo passaggio prima di scatto di congelamento.
- Utilizzare tessuto fresco. Tuttavia, se ciò non è possibile, a scatto congelare la sclera in azoto liquido e la tiene a -20 ° C per un uso successivo. Se si lavora con il tessuto congelato, scongelare prima dell'uso. Evitare ripetuti cicli di congelamento scongelamento e.
- Mantenere ogni campione in PBS contenente 1,5 ml 5% BSA a temperatura ambiente per 2 ore. Questo passo induce un rigonfiamento del campione che è utile per la laminazione e impedisce anche legame aspecifico.
- Dopo che i campioni hanno gonfiato, preparare le piazze sclerali per la laminazione. Lavorare sotto un microscopio, ad esempio uno stereo microscopio binoculare. Fissare i campioni sclerali posteriori alla membrana in polistirolo avvolto in un foglio di alluminio o la piastra di sughero con gli aghi 26 g.
- Piegare i bordi degli aghi in modo da non interferire con il campo visivo sotto il microscopio.
- Laminare il tutto spessore SAMP scleraleles.
- In primo luogo, tenere il bordo sclerale anteriore con pinze Colibri. Poi accuratamente tagliato un sottile strato di sclera superficiale utilizzando il bisturi # 10, il oftalmica bisturi micro piuma, o una lama spatola. Tenere il bisturi orizzontale e tagliare lo strato superficiale più sottile possibile dallo strato sottostante.
- Sezionare uno strato sottile sclerale dalla piazza sclerale. Questo metodo è simile alle tecniche chirurgiche standard per preparare un lembo durante trabeculectomia e dovrebbe tradursi in strati di spessore 30-80 micron (confronta figura 2).
- Impedire essiccamento della sclera aggiungendo piccole quantità di PBS al tessuto, per esempio 50 microlitri di PBS utilizzando una pipetta.
- Mettere i livelli di taglio in 100 pl di PBS nella piastra da 96 pozzetti e l'etichetta sia l'orientamento (verso extern e intern) e lo strato (superficiale e profonda) ad esempio con un colore impermeabile.
- Ripetere i passaggi 2,7-2,9 fino a quando il tessuto è completamente laminato.
3. Eseguire immunoistochimica
- Aggiungere 100 ml di anticorpi primari necessari alla diluizione raccomandata. Qui, per esempio CD utilizzo 31 (topo monoclonale anti umano) e anticorpi LYVE1 (coniglio anti umano), sia in una diluizione di 1: 100 in PBS (contenente 2% BSA) e incubare a 4 ° C durante la notte. Per cambiare il supporto nella piastra da 96 pozzetti, tenere la pipetta alla parete del pozzo e rimuovere il liquido.
- Il giorno dopo, lavare i campioni per tre volte ciascuno per 5 min con 200-300 ml di PBS sul shaker. Aggiungere 100 pl di corrispondenti anticorpi secondari; qui utilizzare capra anti topo fluoresceina isotiocianato (FITC) e di capra anti coniglio cianina coloranti 3 (Cy3), e incubare i campioni a temperatura ambiente per 1-2 ore. Diluire gli anticorpi secondari 1: 300 in PBS contenente 2% di siero di capra.
- Lavare i campioni di nuovo tre volte ciascuno per 5 min in 200-300 ml di PBS sul shaker.
- Eseguire colorazione nucleo, ad esempio, . 4 ', 6-diamidino-2-fenilindolo (DAPI) (diluizione 1: 2.000, 100 microlitri in ciascun pozzetto ed incubare 10 min a temperatura ambiente), poi lavare ancora 2 volte in PBS 200-300 microlitri l'agitatore.
- Trasferire i campioni su vetrini da microscopio, incorporare loro in 1-2 gocce di mezzo di montaggio fluorescente, aggiungere un vetrino, sigillarla coprendo i bordi con vernice trasparente, e conservare a 4 ° C per un uso successivo o esaminare direttamente i vetrini con il confocale microscopio.
- Utilizzare un microscopio confocale (o equivalente) per analizzare i campioni. Utilizzare l'ingrandimento desiderato, ad esempio 10-40X ingrandimento.
- Per verificare lo spessore dei campioni, misurare con microscopia confocale utilizzando Z-Stack. La quantità di possibili sezioni sclerali dipende dalla posizione della sclera, come lo spessore diverso equatoriale e posteriormente (confrontare introduzione).
Risultati
Negli esperimenti rappresentativi condotti qui, ci sono benefici dimostrabili derivanti dall'uso di questa particolare tecnica di laminazione. Il primo esperimento illustra la rete diversificata del plesso vaso sanguigno episclerale in tre immagini rappresentative (Figura 3). I vasi sono positivi per CD31.
Il secondo esperimento mostra cellule immunitarie, in particolare le cellule LYVE1 + del episclera e il loro rapporto con i vasi sanguigni positivo CD31. Qui la tecnologia Z-stack è stato utilizzato a ingrandimento 10X per la scansione attraverso il tessuto e comprendere le relazioni tridimensionali di vasi sanguigni e cellule immunitarie (Figura 4).
La sclera, nonché i muscoli estrinseci allegate, possono essere analizzati per la presenza di vasi sanguigni e cellule immunitarie. Figura 5 mostracellule positive LYVE1 e CD31 vasi sanguigni positivo.
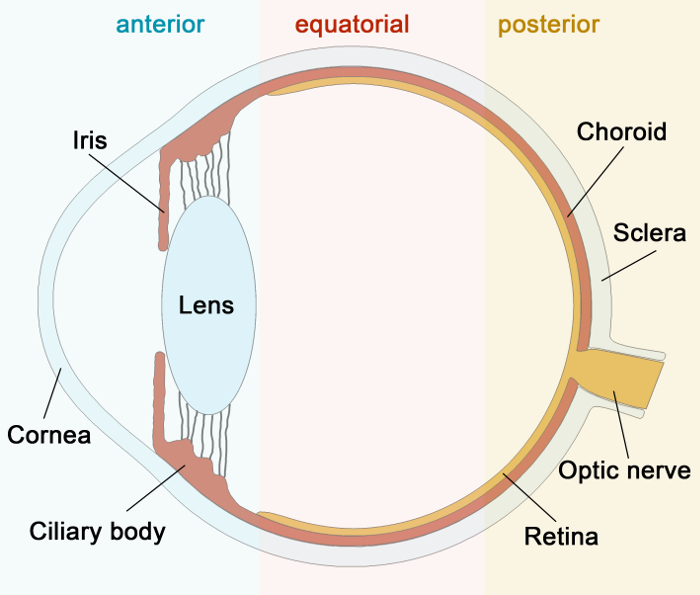
Figura 1:.. Schema Immagine del Occhio umano Ecco uno schema di sezione trasversale dell'occhio umano prega di cliccare qui per vedere una versione più grande di questa figura.
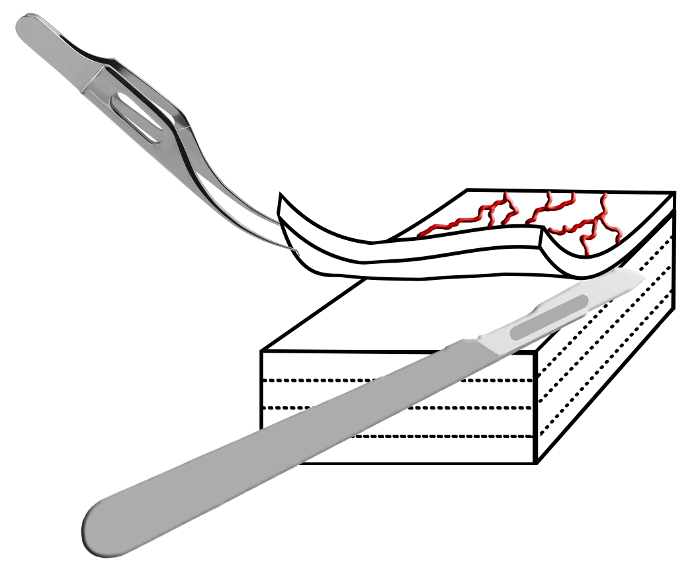
Figura 2:. Schema Immagine della tecnica di laminazione La sclera è accuratamente tenuto con una pinza colibri e laminato in strati sottili utilizzando un bisturi. Ripetendo questo passaggio porta a diapositive tessuti sottili che possono essere utilizzati per la microscopia confocale. Clicca qui per vedere una versione più grande di questa fifigura.
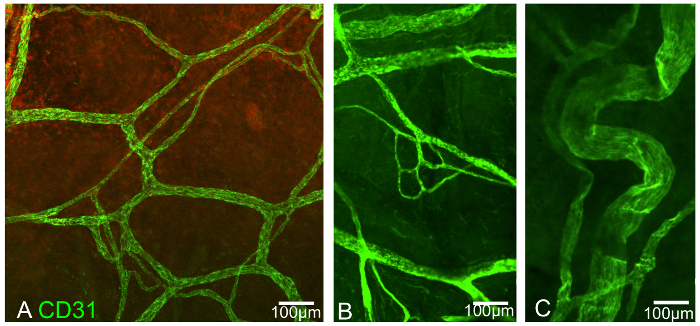
Figura 3:. Episclerale Vaso sanguigno plesso, immunopositive per CD31 A e B sono derivati dalla episclera anteriore, mentre C è dalla posizione posteriore. Barra della scala indica 100 micron. Clicca qui per vedere una versione più grande di questa figura.
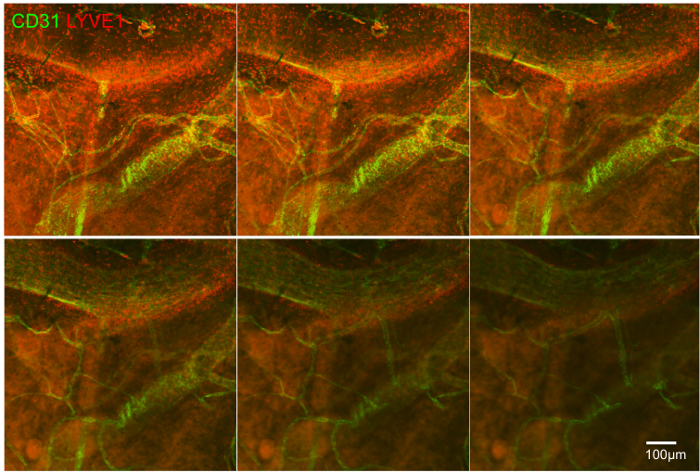
Figura 4:. CD31 + vasi sanguigni e LYVE1 + cellule in un z-stack, che mostra il Relazioni anatomiche tra loro piccoli vasi e quelli più grandi possono sovrapporsi. Barra della scala indica 100 micron. Clicca qui per vedere una versione più grande di questa figura.

Figura 5: Racchiuso nella sclera sono i muscoli estrinseci Esse contengono una simile fitta rete dei vasi sanguigni e alcune cellule LYVE1 +.. Barra della scala indica 200 micron. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Laminazione la sclera umana è un metodo per eseguire la microscopia confocale in questo tessuto. Un punto critico in questo processo è l'uso di etanolo invece di formalina per l'apposizione del tessuto. Nella nostra esperienza, i risultati migliori si ottengono quando si utilizza etanolo invece di formalina per fissare. bisturi Blunt aggravano la procedura e deve essere evitato. Analogamente, il prosciugamento della sclera dovrebbe essere evitata, in quanto complica la procedura e riduce la qualità delle immagini.
Per quanto riguarda la colorazione immunoistochimica, altri anticorpi rispetto a quelli applicati qui possono essere utilizzati. In generale, collagene mostra più auto-fluorescenza e sfondo nel canale verde, quindi rosso, blu, e canali rosso lontano mostrare risultati migliori con meno sfondo.
Tuttavia, ci sono diverse limitazioni della tecnica. Laminazione la sclera richiede molta pratica, in quanto è un procedimento microchirurgico eseguita sotto un microscOPE. Poiché questa tecnica viene eseguita manualmente, le singole fette laminato non sono esattamente le stesse dimensioni e differiscono nel loro spessore in un unico campione di tessuto. Per avere tessuti esattamente le stesse dimensioni, trapanazione potrebbe essere un'alternativa, anche se lo spessore degli strati ancora variare. Per ottenere uno spessore esattamente definita per sezioni sclerali, un microcheratomo automatizzato potrebbe essere un'alternativa per esperimenti futuri. Se la laminazione viene eseguita con strati troppo spessi, la slitta coperchio può dislocate, e il tessuto può potenzialmente asciugare. I confini precisi tra episclera e stroma può essere difficile distinguere una volta che vengono eseguiti i lamierini.
Nonostante questo, laminando la sclera presenta diversi vantaggi nell'uso di immunoistochimica, in particolare rispetto agli paraffina immunoistochimica fissati in formalina, che è il metodo standard nella situazione clinica corrente. Laminazione la sclera permette microsc confocaleopy da eseguire, aree di dimensioni maggiori del sclera da analizzare, diversi strati della sclera da esaminare, così come lo screening e la scansione del tessuto. Al contrario, quando si lavora con campioni di paraffina fissati in formalina, la sclera cambia la sua consistenza in modo inutile durante il preriscaldamento per il recupero antigene. Durante tutto il processo di riscaldamento, le fibre di collagene avvizziscono e il tessuto perde contatto con la slitta. In precedenza, il plesso nave nel episclera essere soltanto visibile utilizzando tecniche angiografiche o l'intera vista monte, ma non nelle sezioni trasversali.
Oltre alle difficoltà tecniche, la sclera è relativamente avascolare e relativamente povera di cellule immunitarie rispetto ad altri tessuti dell'occhio, come la retina. Pertanto, quando si utilizza paraffina fissati in formalina e diapositive, che sono di solito 4 micron di spessore, più diapositive sono necessari per rilevare le cellule positive nella sclera. Recentemente, è stato dimostrato utilizzando questo laminatozione tecnica che la sclera umana non è acellulare, ma contiene un sacco di macrofagi LYVE1 + ad accumularsi attorno ai vasi sanguigni 1.
Per riassumere, l'esecuzione di microscopia confocale su sezioni sclerali laminato è uno strumento promettente per studiare i disturbi patologici, in futuro, come ad esempio sclerite, uveite, o traumi.
Divulgazioni
The authors declare no financial disclosures. The contents of this article are solely the responsibility of the authors.
Riconoscimenti
German Research Foundation (FOR2240 "(Lymph) Angiogenesis and Cellular Immunity in Inflammatory Diseases of the Eye" to CC and LMH; HE 6743/2-1 and HE 7643/3-1 to LMH; CU47/6-1 to CC), German Cancer Aid (to LMH and CC), GEROK program University of Cologne (to SLS and LMH), and EU COST BM1302 "Joining Forces to Corneal Regeneration" (to CC).
Materiali
| Name | Company | Catalog Number | Comments |
| 96% ethanol | Merck Chemicals, Darmstadt, Germany | P075.4 | |
| binocular stereo microscope | Motic, Hongkong, China | n.a | |
| 26 G needles | Terumo, Leuven, Belgium | 303800 | |
| 15.5 mm trepan | Geuder, Heidelberg, Germany | n.a | |
| no.10 scalpel | Feather, pfm medical, Osaka, Japan | 2E+08 | |
| ophthalmic scalpel micro feather | Feather, pfm medical, Osaka, Japan | no. 7657BR | |
| CD 31 antibody (monoclonal mouse anti human) | Dako, USA | IR610 | |
| LYVE1 antibody (polyclonal rabbit anti human) | Zytomed, Germany | RBK014-05 | |
| goat anti mouse FITC antibody | Sigma Aldrich, Steinheim, Germany | F0257 | |
| goat anti rabbit Cy3 antibody | Dianova, Germany | 111-165-003 | |
| Goat Serum normal | Dako, Glostrup, Denmark | X090710-8 | |
| DAPI | Carl Roth GmbH, Karlsruhe, Germany | 6335.1 | |
| microscope slides | Engelbrecht, Edermünde, Germany | WC7695002 | |
| Coverslips 24 mm x 24 mm | Th. Gayer, Lohmar, Germany | 7695026 | |
| DAKO fluorescent mounting medium | DAKO, USA | S3023 | |
| LSM Meta 510 confocal microscopy | Carl Zeiss AG, Jena, Germany | n.a |
Riferimenti
- Schlereth, S. L., et al. Enrichment of lymphatic vessel endothelial hyaluronan receptor 1 (LYVE1)-positive macrophages around blood vessels in the normal human sclera. Invest Ophthalmol Vis Sci. 55 (2), 865-872 (2014).
- Schlereth, S. L., et al. Absence of lymphatic vessels in the developing human sclera. Exp Eye Res. 125, 203-209 (2014).
- Hos, D., Cursiefen, C. Lymphatic vessels in the development of tissue and organ rejection. Adv Anat Embryol Cell Biol. 214, 119-141 (2014).
- Hos, D., Schlereth, S. L., Bock, F., Heindl, L. M., Cursiefen, C. Antilymphangiogenic therapy to promote transplant survival and to reduce cancer metastasis: what can we learn from the eye. Semin Cell Dev Biol. , (2014).
- Streilein, J. W. Immune privilege as the result of local tissue barriers and immunosuppressive microenvironments. Curr Opin Immunol. 5 (3), 428-432 (1993).
- Streilein, J. W., Niederkorn, J. Y. Induction of anterior chamber-associated immune deviation requires an intact, functional spleen. J Exp Med. 153 (5), 1058-1067 (1981).
- Streilein, J. W., Yamada, J., Dana, M. R., Ksander, B. R. Anterior chamber-associated immune deviation, ocular immune privilege, and orthotopic corneal allografts. Transplant Proc. 31 (3), 1472-1475 (1999).
- Keeley, F. W., Morin, J. D., Vesely, S. Characterization of collagen from normal human sclera. Exp Eye Res. 39 (5), 533-542 (1984).
- Lee, R. E., Davison, P. F. Collagen composition and turnover in ocular tissues of the rabbit. Exp Eye Res. 32 (6), 737-745 (1981).
- Moses, R. A., Grodzki, W. J., Starcher, B. C., Galione, M. J. Elastin content of the scleral spur, trabecular mesh, and sclera. Invest Ophthalmol Vis Sci. 17 (8), 817-818 (1978).
- Foster, C. S., Sainz de la Maza, M. The sclera. , Springer. (2012).
- Kiss, F. Der Blutkreislauf des Auges. Ophthalmologica. 106, 225(1943).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. Part I. Aqueous veins. Br J Ophthalmol. 35 (5), 291-303 (1951).
- Ashton, N., Smith, R. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. III. Arterial relations of Schlemm's canal. Br J Ophthalmol. 37 (10), 577-586 (1953).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts II. Aqueous veins. Br J Ophthalmol. 36 (5), 265-267 (1952).
- Hayreh, S. S., Scott, W. E. Fluorescein iris angiography. II. Disturbances in iris circulation following strabismus operation on the various recti. Arch Ophthalmol. 96 (8), 1390-1400 (1978).
- Virdi, P. S., Hayreh, S. S. Anterior segment ischemia after recession of various recti. An experimental study. Ophthalmology. 94 (10), 1258-1271 (1987).
- Bron, A. J., Easty, D. L. Fluorescein angiography of the globe and anterior segment. Trans Ophthalmol Soc U K. 90, 339-367 (1970).
- Ikegami, M. Fluorescein angiography of the anterior ocular segment. Part 1. Hemodynamics in the anterior ciliary vessels (author's transl). Nihon Ganka Gakkai Zasshi. 78 (7), 371-385 (1974).
- Banerji, S., et al. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-specific receptor for hyaluronan. J Cell Biol. 144 (4), 789-801 (1999).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon