Method Article
Mit Hilfe einer Laminiertechnik konfokale Mikroskopie der menschlichen Sclera to Perform
In diesem Artikel
Zusammenfassung
Human sclera tissue is mainly collagen; therefore, it is not easily usable for immunohistochemistry. To achieve the goal of performing immunohistochemistry for confocal microscopy of scleral tissue, a laminating technique was used.
Zusammenfassung
Die Sklera ist ein dichtes Bindegewebe, bedeckt und schützt das Auge. Es besteht hauptsächlich aus dichten Kollagenbündeln (Typen I, III, IV, V, VI und VII). Aufgrund seiner Eigenfluoreszenz, Undurchsichtigkeit und die Dicke ist es nicht geeignet für die konfokale Mikroskopie gefunden. Ein alternativer Ansatz für die hier vorgestellt, die für die Immunhistochemie in Paraffin eingebettet Formalin fixierten Sklera verwendet, hat technische Herausforderungen, insbesondere, wenn das Gewebe für Antigen Retrieval Vorwärmen. Da die Sklera in beiden Zellen und Gefäße relativ schlecht ist, wurde die Verwendung von größeren Gewebeproben untersucht, um mit Blick auf Zellen zu verhindern und ihre Lokalisierung in Bezug auf Schiffen und anderen anatomischen Stellen zu verstehen. Um die Analyse von grßeren Gewebeproben unter dem konfokalen Mikroskop zu ermöglichen, eine Laminiertechnik wurde durchgeführt, um dünne Schichten von der Sklera erstellen. Im Anschluss an die Analyse der Ergebnisse von CD31 Blutgefäße und Lymphgefäße endothelialen Hyaluronan-Rezeptor 1 (LYVE1) positive Zellen, für die eine Genehmigung für die wissenschaftliche Untersuchung erhalten wurde, werden die Vorteile und Grenzen dieser Methode diskutiert.
Einleitung
Die Sklera ist die starre äußere Schicht, die das Auge bedeckt, die aus dichtem Bindegewebe besteht. Es hilft intraokularen Strukturen zu schützen und intraokularen Druck aufrechtzuerhalten. Somit ist die Sklera für klare Sicht unerlässlich. Es ist frei von Lymphgefäßen 1,2 und bildet dadurch eine äußere lymphatischen freie Grenze zwischen ihm und dem lymphatischen freien inneren Auge 3-7. Es bietet auch Bindungsstellen für Extraokularmuskeln, damit anatomische Ähnlichkeiten mit Sehnen zu teilen. Da vor allem die Sklera dichten Bündeln von Typ - I - Kollagen besteht und hat kleinere Anzahlen von Kollagentypen III, IV, V, VI, VIII 8,9 und Elastin 10,11, ist dieses Gewebe nicht leicht für die Immunhistochemie verwendet werden .
Anatomisch kann die Sklera in drei Schichten getrennt werden: (1) die oberflächliche vaskularisierten Episklera unterhalb der Bindehaut und Tenon-Kapsel und in Richtung der Seiten und th gefundene Rückseite des Auges die Bahn zugewandt ist; (2) das sklerale Stroma, der Hauptteil der Sklera; und (3) die Lamina fusca, die eine dünne, pigmentierte Schicht direkt über der Uvea befindet. Unsere anatomischen Kenntnisse über die Sklera resultiert im Wesentlichen aus der ersten Hälfte des 20. Jahrhunderts. Damals untersuchten die Forscher die Anatomie des Gefäßsystems hauptsächlich durch die Verwendung Tusch Injektionen 12 und Gefäß Gießen 13-15. Später wurde in angiographischen Studien erforscht 16-19.
Seit dieser Zeit wurden ältere Techniken verbessert und neue entwickelt worden, die erlaubt haben, uns vorherigen anatomischen Kenntnisse zu ergänzen. Zum Beispiel hat es nur etwa ein Jahrzehnt her , dass wir eine solche zuverlässige lymphatische Marker als lymphatischen Gefäßendothel spezifischen Hyaluronan - Rezeptor-1 (LYVE1) 20 oder podoplanin 21 hatten. Die konfokale Mikroskopie bietet neue Möglichkeiten für die Untersuchung der anatomischen Merkmale der unterschiedlichen tiHEMEN des Auges. Es ermöglicht mehrere Flecken zum Differenzieren von Zellen oder Marker zur Lokalisierung von Zellen in Bezug auf die Blutgefäße und anderer anatomischer Strukturen verwendet werden. Es gibt einen Überblick, wenn die Probe von einer größeren Größe und ermöglicht es uns durch eine Probe abzutasten, wenn auf der Suche nach einem bestimmten Zelltyp. Mit Z-Stack-Technologie kann die konfokale Mikroskopie für Proben auf 100-200 & mgr; m bis verwendet werden. Die Sklera unterscheidet zwischen 0,3 mm hinter der Muskelinsertionen und 1 mm am hinteren Pol 11 in der Dicke. Aufgrund sowohl seine Dicke und Undurchsichtigkeit ist die Sklera für die konfokale Mikroskopie mit herkömmlichen Methoden nicht geeignet.
Um Abhilfe zu schaffen, wurden skleralen Gewebe laminiert für ihre Analyse mit der konfokalen Mikroskopie zu ermöglichen. Diese Technik ist nützlich für ein besseres Verständnis der beiden physiologischen und pathologischen Situationen im menschlichen Sklera gewinnt.
Protokoll
Die Verwendung von menschlichen Geweben müssen von einem Institutional Review Board oder gleichwertig geprüft und genehmigt werden. Die hier beschriebene Arbeit wurde von der lokalen Ethikkommission genehmigt und hatte die Genehmigung für die wissenschaftliche Untersuchung. Diese Arbeit wurde nach der Deklaration von Helsinki durchgeführt. Die menschlichen scleral Proben wurden vor den Augen der ganzen Welt Spender (maximal post-mortem Zeit 24 h) an der Augenbank der Augenklinik der Universität zu Köln, Deutschland, erhalten.
1. Experimentelle Vorbereitung
- Vorbereitung 96% Ethanol und Phosphat-gepufferter Salzlösung (PBS) in verschiedenen Röhren. Bereiten Sie die primären Antikörper in der empfohlenen Verdünnung von PBS, die 2% Rinderserumalbumin (BSA) und halten alle Lösungen auf dem Eis. Bereiten Sie 100 ul pro Probe.
- Reinigen Sie alle Instrumente und verwenden scharfe Skalpelle. Nachdem er mit dem gleichen Skalpell wiederholte Schneiden, das Skalpell ändern.
- Erhalten Sie 1-2 Colibri Zange, gerade Mikro Dissektionsscheren, ein # 10 Skalpelloder ophthalmische Skalpell Mikro Feder und vier 26 G Nadeln.
- Wickeln Sie Aluminiumfolie um eine Polystyrolplatte oder verwenden Sie eine Korkplatte um das Gewebe zu befestigen. Arbeiten unter einem binokularen Stereomikroskop. Arbeiten steril unter einem laminaren Luftstrom, wenn nötig.
2. Bereiten Sie die Sclera
- Sie vorsichtig die Lampe halten und ein Perforieren Trepanation auf dem korneoskleralen Teil ausführen, drehen Sie dann den trepan. Drehen Sie den trepan sorgfältig und gleichmäßig auf der Oberfläche eine ebenso runde Schnitt durchzuführen. Verwenden Sie einen 15,5 mm große trepan. Schneiden Sie die restlichen Anlagen mit einer gebogenen Schere. Entfernen Sie die korneoskleralen Trepanation. Dies wird sich in einer nach vorne geöffneten Lampe führen.
- Legen Sie die Sklera auf einem Tupfer mit dem offenen Teil nach oben. Entfernen Sie die Retina und Uvea, Colibri Zange mit beiden Schichten abziehen (Retina und Uvea) von der Sklera. Sie nicht die pigmentierte Uvea auf der inneren Lederhaut verlassen. Verwenden einer gebogenen Schere die Retina und Uvea von der Papille zu entfernen. Entfernen Sie die remaining Konjunktiven, Augenmuskeln, und Tenon-Kapsel von der oberflächlichen Sklera.
- Entfernen Sie die scleral Probe in der gewünschten Größe von straight-Typ Schere und Colibri Zange. Nehmen Sie etwa 2 cm 2 Größe scleral Proben von verschiedenen Orten aus . Aufgrund der geringen Größe, halten Sie die Lederhaut sanft und die gewünschte Größe als Quadrate schneiden Sie die straight-Typ Schere. Die korneoskleralen Trepanation definiert den vorderen Rand der Sklera-Proben.
- Vermeiden Sie wiederholte greifen mit der Zange als den Bereich, wo das Gewebe wurde gepackt ist nicht geeignet für die konfokale Mikroskopie analysiert. Bereiten Sie die erforderliche Anzahl von Proben je nach Experiment Typ (zB ventral nach dorsal vs., vergleiche Abbildung 1) und die Menge von Antikörpern verwendet.
- Setzen Sie die Proben in 1,5-ml-Röhrchen für die spätere Verwendung. Befestigen Sie die Proben in 1,5 ml 96% Ethanol für 15 Minuten und dann waschen Sie sie dreimal jeweils 5 minin 1,5 ml PBS auf dem Schüttler. Wenn mit gefrorenem Gewebe arbeiten, führen Sie diesen Schritt vor dem Snap Einfrieren.
- Verwenden Sie frische Gewebe. Ist dies jedoch nicht möglich ist, rasten die Sklera in flüssigem Stickstoff einfrieren und halten Sie sie bei -20 ° C für die spätere Verwendung. Wenn mit gefrorenem Gewebe arbeiten, Tauwetter vor dem Gebrauch. Vermeiden Sie wiederholtes Auftauen und Einfrieren Zyklen.
- Halten jede Probe in PBS, die 1,5 ml 5% BSA bei Raumtemperatur für 2 Std. Dieser Schritt bewirkt eine Quellung der Probe, die für die Laminierung nützlich ist und verhindert auch unspezifische Bindung.
- Nachdem die Proben schwoll haben, bereiten Sie die scleral Quadrate für die Laminierung. Arbeiten unter einem Mikroskop, zB einem binokularen Stereomikroskop. Befestigen Sie die hinteren scleral Proben auf die Polystyrol-Membran in Aluminiumfolie eingewickelt oder die Korkplatte mit den 26 G Nadeln.
- Biegen Sie die Kanten der Nadeln, so dass sie nicht mit dem Gesichtsfeld unter dem Mikroskop stören.
- Laminat, das die gesamte Dicke scleral samples.
- Zunächst halten die vordere Kante scleral mit Colibri Pinzette. Dann schneiden Sie vorsichtig eine dünne Schicht der oberflächlichen Sklera die # 10 Skalpell, das ophthalmologische Skalpell Mikro Feder oder einem Spatel Klinge. Halten Sie das Skalpell horizontal und schneiden Sie die oberflächliche Schicht so dünn wie möglich von der darunter liegenden Schicht.
- Präparieren einer dünnen scleral Schicht aus dem scleral Platz. Dieses Verfahren ist vergleichbar mit Standard - OP - Techniken , um eine Klappe während der Trabekulektomie vorzubereiten und in 30-80 um dicke Schichten (vergleiche Abbildung 2) zur Folge haben sollte.
- Trocknen der Sklera verhindern , indem kleine Mengen an PBS zu dem Gewebe, beispielsweise 50 & mgr; l PBS mit einer Pipette hinzugefügt wird .
- Setzen Sie die geschnittenen Schichten in 100 ul PBS in der 96 - Well - Platte und beschriften sowohl die Ausrichtung (Richtung extern und intern) und die Schicht (oberflächliche und tiefe) , zB mit einer wasserdichten Farbe.
- Wiederholen Sie die Schritte 2,7-2,9, bis das Gewebe vollständig laminiert.
3. Führen Immunohistochemistry
- 100 l der erforderlichen primären Antikörper in der empfohlenen Verdünnung. Hier zB Verwendung CD 31 (monoklonaler Maus anti human) und LYVE1 Antikörper (Kaninchen - anti human), die beide in einer Verdünnung von 1: 100 in PBS (enthaltend 2% BSA) und über Nacht bei 4 ° C inkubieren. Um das Medium ändern, in der 96-Well-Platte, halten Sie die Pipette auf die Wand des Bohrlochs und entfernen Sie die Flüssigkeit.
- Am nächsten Tag, waschen Sie die Proben dreimal jeweils 5 min mit 200 bis 300 & mgr; l PBS auf dem Schüttler. 100 l der entsprechenden Sekundärantikörper; hier verwenden Ziege anti-Maus-Fluorescein (FITC) und Ziege anti-Kaninchen-Cyaninfarbstoffe 3 (Cy3) und die Proben bei Raumtemperatur für 1-2 Stunden inkubiert. Verdünnen Sie die sekundären Antikörper 1: 300 in PBS 2% Ziegenserum enthält.
- Spülen Sie die Proben wieder dreimal jeweils 5 min in 200 bis 300 & mgr; l PBS auf dem Schüttler.
- Führen Kernfärbung, zB . 4 ', 6-diamidino-2-phenylindole (DAPI) (Verdünnung 1: 2000, 100 & mgr; l in jeder Vertiefung und 10 Minuten bei Raumtemperatur inkubieren), dann waschen Sie erneut 2-mal in 200 bis 300 & mgr; l PBS auf dem Schüttler.
- Übertragen Sie die Proben auf Objektträger, betten sie in 1-2 Tropfen fluoreszierenden Eindeckmediums, fügen Sie ein Deckglas, verschließen Sie diese durch die Kanten Abdeckung mit transparenten Lack, und lagern bei 4 ° C für die spätere Verwendung oder direkt die Folien mit dem konfokalen untersuchen Mikroskop.
- Verwenden, um ein konfokales Mikroskop (oder Äquivalent), um die Proben zu analysieren. Verwenden Sie die gewünschte Vergrößerung, zB 10-40x Vergrößerung.
- Um die Dicke der Proben zu überprüfen, messen mit der konfokalen Mikroskopie mit Z-Stacks. Die Menge der möglichen skleralen Abschnitte hängt von der Lage der Sklera, als die Dicke äquatorial und posterior (Einführung Vergleich) unterscheidet.
Ergebnisse
In den repräsentativen Experimenten hier durchgeführt wird, gibt es nachweisbare Vorteile aus der Verwendung dieser besonderen Laminiertechnik abgeleitet. Das erste Experiment veranschaulicht die unterschiedlichen Netzwerk des episkleralen Blutgefß Plexus in drei repräsentativen Bilder (Bild 3). Die Gefäße sind positiv für CD31.
Das zweite Experiment zeigt, Immunzellen, insbesondere LYVE1 + Zellen des Episklera und ihre Beziehung zu den CD31 positive Blutgefäße. Hier Z-Stack - Technologie wurde bei 10 - facher Vergrößerung zu scannen durch das Gewebe und zu verstehen , dreidimensionale Beziehungen von Blutgefäßen und Immunzellen (Abbildung 4) verwendet.
Die Sklera, sowie die geschlossenen Augenmuskeln kann auf das Vorhandensein von Blutgefäßen oder Immunzellen untersucht werden. 5 zeigtLYVE1 positive Zellen und CD31 positive Blutgefäße.
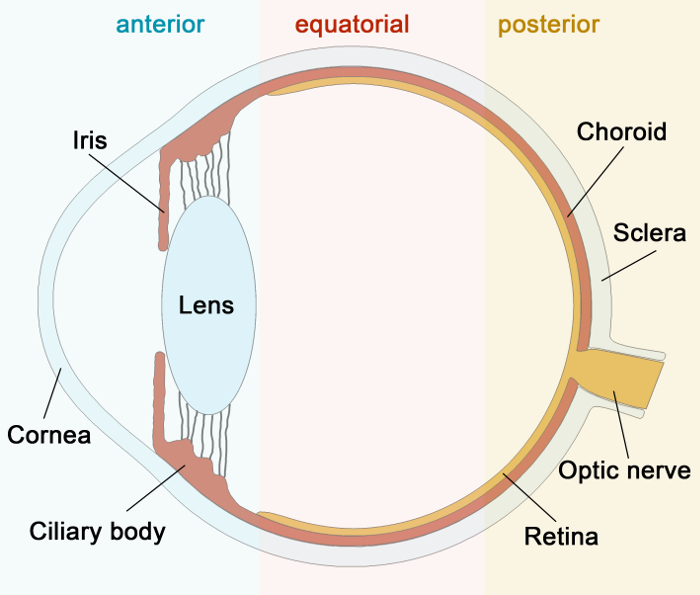
Abbildung 1:.. Schematische Darstellung des menschlichen Auges Hier ist eine schematische Darstellung des Querschnitts des menschlichen Auges Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
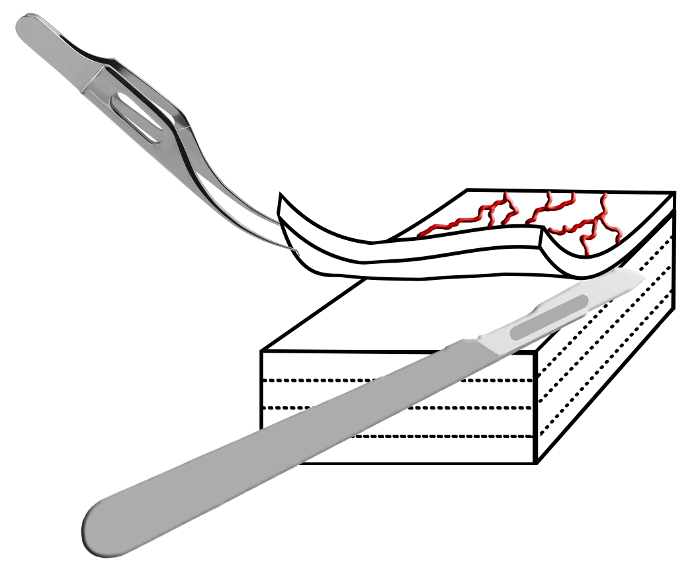
Abbildung 2:. Schematische Darstellung der Laminiertechnik Die Sklera wird sorgfältig mit Colibri Zange gehalten und laminiert in feinen Schichten mit einem Skalpell. Dieser Schritt wird wiederholt führt zu dünnen Gewebeschnitten , die für die konfokale Mikroskopie verwendet werden können. Bitte hier klicken , um eine größere Version dieses fi anzuzeigenAbbildung.
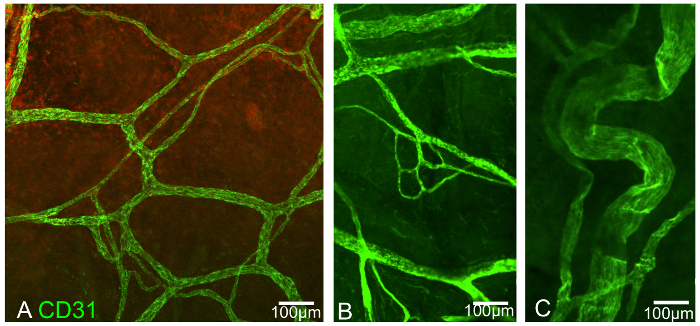
Abb . 3: Episklerale Blutgefäß Plexus, Immunpositive für CD31 A und B von der vorderen Episklera abgeleitet, während C von der hinteren Position befindet. Maßstabsbalken zeigt an 100 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
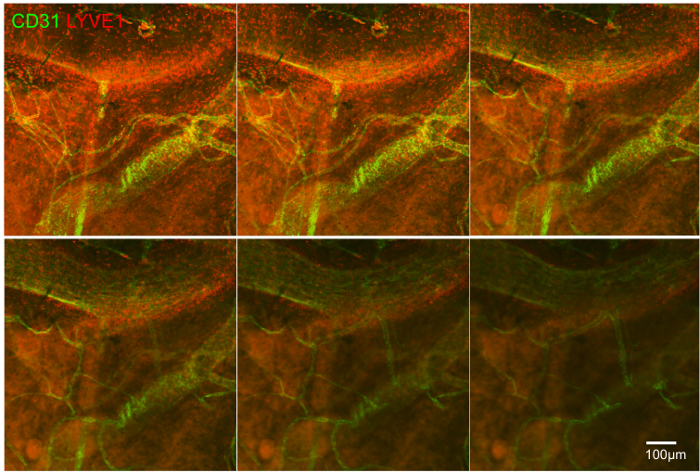
Abbildung 4:. CD31 + Blutgefäße und LYVE1 + Zellen in einer Z-Stapel, Anzeigen der anatomischen Beziehungen zwischen ihnen Boote und größere überlappen können. Maßstabsbalken zeigt an 100 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 5: Eingeschlossen in der Sclera sind die Extraokularmuskeln Sie enthalten ein ähnliches feinen Blutgefäßnetzwerk und einige LYVE1 + Zellen.. Maßstabsbalken zeigt an 200 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
die menschliche Sklera Laminieren ist ein Verfahren zur konfokalen Mikroskopie an diesem Gewebe durchgeführt wird. Ein wichtiger Schritt in diesem Verfahren ist die Verwendung von Ethanol anstelle von Formalin für das Gewebe zu befestigen. Nach unserer Erfahrung sind bessere Ergebnisse erhalten, wenn Ethanol anstelle von Formalin für die Fixierung verwendet wird. Blunt Skalpelle verschlimmern das Verfahren und sollte vermieden werden. Ebenso sollte die Austrocknung der Sklera vermieden werden, da es das Verfahren verkompliziert und verringert die Qualität der Bilder.
In Bezug auf die immunhistochemische Färbung, andere Antikörper als die hier angewendet diejenigen verwendet werden. Im Allgemeinen zeigt Kollagen mehr Autofluoreszenz und Hintergrund in den grünen Kanal, also rot, blau und dunkelroten Kanäle zeigen bessere Ergebnisse mit weniger Hintergrund.
Es gibt jedoch mehrere Einschränkungen der Technik. die Sklera Kaschieren erfordert viel Übung, da es ein mikrochirurgischer Eingriff unter einem Microsc ausgeführt istope. Da diese Technik manuell durchgeführt wird, sind die einzigen laminierten Scheiben nicht genau die gleiche Größe und unterscheiden sich in einem Stück von Gewebe in ihrer Dicke. In Gewebe von genau gleicher Größe haben, trepanation könnte eine Alternative sein, obwohl die Dicke der Schichten immer noch variieren. Um das zu erreichen eine genau definierte Dicke für die scleral Abschnitte, eine automatisierte Mikrokeratom könnte eine Alternative für zukünftige Experimente sein. Wenn Laminierung mit Schichten durchgeführt wird, die zu dick sind, kann die Abdeckschlitten verrücken, und das Gewebe kann möglicherweise austrocknen. Die genauen Grenzen zwischen Episklera und Stroma kann schwierig sein, zu unterscheiden, wenn die Lamellen durchgeführt werden.
Trotzdem hat die Sklera Laminieren mehrere Vorteile bei der Verwendung von Immunhistochemie, insbesondere im Vergleich zu Formalin fixierten Paraffin eingebettet Immunhistochemie, die das Standardverfahren in der derzeitigen klinischen Situation. die Sklera Kaschieren ermöglicht konfokalen Microscopy ausgeführt werden, größer dimensionierte Bereiche der Sklera zu analysierenden, verschiedenen Schichten der Lederhaut untersucht werden, sowie das Screening und Scannen von Gewebe. Im Gegensatz dazu, wenn sie mit Formalin fixierten Paraffin-eingebetteten Proben arbeiten, ändert sich die Sklera ihre Konsistenz in einem unhelpful Weg für Antigen-Retrieval während des Vorheizens. Während des gesamten Heizprozesses, schrumpfen die Kollagenfasern und das Gewebe verliert den Kontakt mit der Folie. Zuvor haben das Schiff Plexus in der Episklera nur sichtbar gewesen durch angiographische Techniken oder in der ganzen Mount View verwenden, aber nicht in den Querschnitten.
Zusätzlich zu den technischen Schwierigkeiten, die Sklera relativ avaskulären und relativ schlecht in Immunzellen im Vergleich zu anderen Geweben in das Auge, wie beispielsweise der Netzhaut. Deshalb wird, wenn Formalin-fixierten und in Paraffin eingebetteten Folien verwenden, die in der Regel 4 um dick, werden mehrere Folien benötigt positive Zellen in der Lederhaut zu erkennen. Kürzlich wurde unter Verwendung dieses laminat gezeigting Technik , die das menschliche Sklera nicht azellulärem ist, enthält aber viel LYVE1 + Makrophagen um Blutgefäße 1 zu akkumulieren.
Um zusammenzufassen, konfokale Mikroskopie Durchführung auf laminierten scleral Abschnitte ist ein vielversprechendes Werkzeug, um pathologische Störungen in der Zukunft zu untersuchen, wie Skleritis, Uveitis oder Trauma.
Offenlegungen
The authors declare no financial disclosures. The contents of this article are solely the responsibility of the authors.
Danksagungen
German Research Foundation (FOR2240 "(Lymph) Angiogenesis and Cellular Immunity in Inflammatory Diseases of the Eye" to CC and LMH; HE 6743/2-1 and HE 7643/3-1 to LMH; CU47/6-1 to CC), German Cancer Aid (to LMH and CC), GEROK program University of Cologne (to SLS and LMH), and EU COST BM1302 "Joining Forces to Corneal Regeneration" (to CC).
Materialien
| Name | Company | Catalog Number | Comments |
| 96% ethanol | Merck Chemicals, Darmstadt, Germany | P075.4 | |
| binocular stereo microscope | Motic, Hongkong, China | n.a | |
| 26 G needles | Terumo, Leuven, Belgium | 303800 | |
| 15.5 mm trepan | Geuder, Heidelberg, Germany | n.a | |
| no.10 scalpel | Feather, pfm medical, Osaka, Japan | 2E+08 | |
| ophthalmic scalpel micro feather | Feather, pfm medical, Osaka, Japan | no. 7657BR | |
| CD 31 antibody (monoclonal mouse anti human) | Dako, USA | IR610 | |
| LYVE1 antibody (polyclonal rabbit anti human) | Zytomed, Germany | RBK014-05 | |
| goat anti mouse FITC antibody | Sigma Aldrich, Steinheim, Germany | F0257 | |
| goat anti rabbit Cy3 antibody | Dianova, Germany | 111-165-003 | |
| Goat Serum normal | Dako, Glostrup, Denmark | X090710-8 | |
| DAPI | Carl Roth GmbH, Karlsruhe, Germany | 6335.1 | |
| microscope slides | Engelbrecht, Edermünde, Germany | WC7695002 | |
| Coverslips 24 mm x 24 mm | Th. Gayer, Lohmar, Germany | 7695026 | |
| DAKO fluorescent mounting medium | DAKO, USA | S3023 | |
| LSM Meta 510 confocal microscopy | Carl Zeiss AG, Jena, Germany | n.a |
Referenzen
- Schlereth, S. L., et al. Enrichment of lymphatic vessel endothelial hyaluronan receptor 1 (LYVE1)-positive macrophages around blood vessels in the normal human sclera. Invest Ophthalmol Vis Sci. 55 (2), 865-872 (2014).
- Schlereth, S. L., et al. Absence of lymphatic vessels in the developing human sclera. Exp Eye Res. 125, 203-209 (2014).
- Hos, D., Cursiefen, C. Lymphatic vessels in the development of tissue and organ rejection. Adv Anat Embryol Cell Biol. 214, 119-141 (2014).
- Hos, D., Schlereth, S. L., Bock, F., Heindl, L. M., Cursiefen, C. Antilymphangiogenic therapy to promote transplant survival and to reduce cancer metastasis: what can we learn from the eye. Semin Cell Dev Biol. , (2014).
- Streilein, J. W. Immune privilege as the result of local tissue barriers and immunosuppressive microenvironments. Curr Opin Immunol. 5 (3), 428-432 (1993).
- Streilein, J. W., Niederkorn, J. Y. Induction of anterior chamber-associated immune deviation requires an intact, functional spleen. J Exp Med. 153 (5), 1058-1067 (1981).
- Streilein, J. W., Yamada, J., Dana, M. R., Ksander, B. R. Anterior chamber-associated immune deviation, ocular immune privilege, and orthotopic corneal allografts. Transplant Proc. 31 (3), 1472-1475 (1999).
- Keeley, F. W., Morin, J. D., Vesely, S. Characterization of collagen from normal human sclera. Exp Eye Res. 39 (5), 533-542 (1984).
- Lee, R. E., Davison, P. F. Collagen composition and turnover in ocular tissues of the rabbit. Exp Eye Res. 32 (6), 737-745 (1981).
- Moses, R. A., Grodzki, W. J., Starcher, B. C., Galione, M. J. Elastin content of the scleral spur, trabecular mesh, and sclera. Invest Ophthalmol Vis Sci. 17 (8), 817-818 (1978).
- Foster, C. S., Sainz de la Maza, M. The sclera. , Springer. (2012).
- Kiss, F. Der Blutkreislauf des Auges. Ophthalmologica. 106, 225(1943).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. Part I. Aqueous veins. Br J Ophthalmol. 35 (5), 291-303 (1951).
- Ashton, N., Smith, R. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts. III. Arterial relations of Schlemm's canal. Br J Ophthalmol. 37 (10), 577-586 (1953).
- Ashton, N. Anatomical study of Schlemm's canal and aqueous veins by means of neoprene casts II. Aqueous veins. Br J Ophthalmol. 36 (5), 265-267 (1952).
- Hayreh, S. S., Scott, W. E. Fluorescein iris angiography. II. Disturbances in iris circulation following strabismus operation on the various recti. Arch Ophthalmol. 96 (8), 1390-1400 (1978).
- Virdi, P. S., Hayreh, S. S. Anterior segment ischemia after recession of various recti. An experimental study. Ophthalmology. 94 (10), 1258-1271 (1987).
- Bron, A. J., Easty, D. L. Fluorescein angiography of the globe and anterior segment. Trans Ophthalmol Soc U K. 90, 339-367 (1970).
- Ikegami, M. Fluorescein angiography of the anterior ocular segment. Part 1. Hemodynamics in the anterior ciliary vessels (author's transl). Nihon Ganka Gakkai Zasshi. 78 (7), 371-385 (1974).
- Banerji, S., et al. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-specific receptor for hyaluronan. J Cell Biol. 144 (4), 789-801 (1999).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.