Method Article
Секвенирование растений стены Heteroxylans Использование ферментативной, химической (метилирование) и физический (масс-спектрометрия, ядерный магнитный резонанс) Методики
В этой статье
Резюме
This protocol describes the specific techniques used for the structural characterization of reducing end (RE) and internal region glycosyl sequence(s) of heteroxylans by tagging the RE with 2 aminobenzamide prior to enzymatic (endoxylanase) hydrolysis and then analysis of the resultant oligosaccharides using mass spectrometry (MS) and nuclear magnetic resonance (NMR).
Аннотация
Этот протокол описывает конкретные методы, применяемые для характеристики восстанавливающего конца (RE) и последовательность гликозильную внутреннюю область (и) heteroxylans. Де-крахмальные стены эндосперме пшеницы клеток выделяли в виде спиртовой нерастворимого остатка (AIR) 1 и последовательно экстрагировали водой (W-SOL Fr) и 1 М КОН , содержащем 1% NaBH 4 (KOH-SOL Fr) , как описано Ратнаяке ЕТ и др. (2014) 2. Два разных подхода (см резюме на рисунке 1) принимаются. В первом случае, интактные W-SOL AXS обрабатывают 2ab помечать исходную RE основной цепи остаток сахара, а затем обрабатывают эндоксиланазой, чтобы сформировать смесь 2ab меченных RE и внутренней области восстановительной олигосахариды, соответственно. Во втором подходе, KOH-золь ПТ гидролизуется с эндоксиланазой сначала подготовить смесь олигосахаридов, которые впоследствии меченных 2ab. В ферментативно выпустили ((ООН) отмеченном) олигосахариды с обеихW- и KOH-SOL Frs затем метилированной и детальный структурный анализ как нативных , так и метилированных олигосахаридов производится с использованием комбинации MALDI-TOF-MS, RP-HPLC-ESI-QTOF-МС и ESI-MS п. Эндоксиланазой переваривается KOH-золь AXS также характеризуются ядерного магнитного резонанса (ЯМР), которая также предоставляет информацию о конфигурации аномерного. Эти методы могут быть применены к другим классам полисахаридов с использованием соответствующих эндо-гидролазы.
Введение
Heteroxylans представляют собой семейство полисахаридов , которые являются преобладающими нецеллюлозные полисахариды первичных стенок трав и вторичных стенок всех покрытосеменные 3-6. Ксилана магистральные сети различаются по типам и моделей замещения с гликозил (глюкуроновой кислоты (GlcA), арабинозы (Араф)) и не гликозил (O-ацетил, феруловая кислота) остатки в зависимости от типа ткани, стадии развития и видов 7.
Стены из пшеницы (Triticum AESTIVUM L.) , эндосперма состоят в основном из арабиноксиланов (AXS) (70%) и (1 → 3) (1 → 4) -β-D-глюкан (20%) с небольшими количествами целлюлозы и heteromannans (2% каждый) 8. Ксилана цепь может быть различным образом ун-замещенные и преимущественно монозамещенным (в основном O-2 положении и в меньшей степени, O-3-положении) и ди-замещенные (O-2 и O-3 позиции), с & alpha; -L-Ara F остатки 9. Восстанавливающий конец (RE) гетеросвязейксиланы из двудольных (например, Резуховидка Таля) 10 и голосеменных (например, ель (Picea пихта)) 11 содержит характерную последовательность тетрасахарид гликозильную; -β-D-Xyl р - (1 → 3) -α-L-Rha р - (1 → 2) -α-D-Gal р А- (1 → 4) -D-Xyl р. Чтобы понять heteroxylan биосинтез и функции (биологической и промышленных), важно, чтобы полностью секвенировать ксилана позвоночник, чтобы понять типы и образцы замен, а также последовательность восстанавливающего конца (RE).
Конкретные методы, используемые для структурной характеристики восстанавливающего конца (RE) и последовательность гликозильную внутреннюю область (и) heteroxylans описаны в этой рукописи. Методы полагаются на флуорофора мечения (с 2 аминобензамидом (2ab)) восстанавливающий конец (RE) в heteroxylan цепи предшествующего уровня ферментативной (эндоксиланазой) гидролиза. Такой подход, в частности, для РЗ последовательности, быловпервые сообщили в лаборатории - Йорк 10,12-13 , но теперь расширена , чтобы включить внутреннюю область секвенирование и представляет собой сочетание установленных методов , которые в равной степени адаптированы ко всем heteroxylans независимо от их источника изоляции. Этот подход может быть также применен к другим классам полисахаридами, используя (если таковые имеются) соответствующие эндо-гидролазы.
В настоящем исследовании, де-накрахмален стены эндосперме пшеницы клеток выделяли в виде спиртовой нерастворимого остатка (воздух) и последовательно экстрагируют водой (W-золь Fr) и 1 М КОН , содержащем 1% NaBH 4 (КОН-SOL Fr) , как описано в Ратнаяке и др. (2014) 2. Освобожденные олигосахариды с обеих W- и KOH-SOL Frs затем метилированной и детальный структурный анализ как нативных, так и метилированных олигосахаридов производится с использованием комбинации MALDI-TOF-MS, ESI-QTOF-МС-в сочетании с ВЭЖХ с онлайн хроматографическое разделение с использованием с-18 колонке RPи ESI-МС п. Эндоксиланазой переваривается КОН-золь AXS характеризовался также ядерного магнитного резонанса (ЯМР).
протокол
1. Этикетировочное восстанавливающего конца (RE) сахарный остаток W-золь AXS с 2-аминобензамидом (2AB)
- Выдержите W-золь AXS с 2ab (0,2 М) в присутствии 1 М NaBH 3 CN (цианоборгидрид натрия) (рН 5,5) в течение 2 ч при 65 ° С , чтобы преобразовать восстанавливающих концы полисахарид основной цепи с их производными флуоресцентными.
ВНИМАНИЕ: Следующий шаг должен выполняться в вытяжном шкафу , как NaBH 3 CN выпускает ядовитый цианистый газ , когда он находится в контакте с водой.- Взвесить NaBH 3 CN (62,8 мг) и растворяют в воде (1 мл) в микроцентрифужных трубки (1,5 мл) с получением 1 М раствора NaBH 3 CN. Растворите 2AB реагента (27,2 мг) в 1 М растворе NaBH 3 CN (1 мл) при нагревании при 65 ° С и довести рН реакционной смеси (0,2 М 2ab, 1 М NaBH 3 CN) до рН 5,5 с помощью 10% -ной уксусной кислоты.
- Добавить 200 мкл реакционной смеси (0,2 М 2ab, 1 М NaBH 3 CN) в W-такл AXS (1 мг) в стеклянной трубке с крышкой и перемешать с помощью вихревой мешалки. Инкубировать в течение 2 часов при температуре 65 ° C в вытяжном шкафу. Охлаждают суспензию до комнатной температуры и добавить 4 тт. абсолютного этанола.
- Поместите суспензию в холодном хранении (4 ° C) O / N для осаждения полисахаридов.
- Центрифуга (1500 XG, 10 мин, RT) для удаления надосадочной жидкости. Промывают осадок экстенсивно с абсолютным этанолом (4 ×), ацетон (1x) и метанола (1x), центрифугирование между каждой промывке. Вакуумная сушка при 40 ° CO / N.
Примечание: Обширные мойка также удаляет остатки 2ab.
2. Генерация Xylo-олигосахаридов от 2 AB Меченые W-золь AXS
- Растворите 2AB меченый W-золь AXS (1 мг) в 500 мкл буферного раствора ацетата натрия (100 мМ, рН 5) в микроцентрифужных трубки (1,5 мл). Добавить 4 единицы эндоксиланазой (GH 11, [M1]) и инкубировать при температуре 37 ° C в течение 16 часов.
- Уничтожить активность фермента путем нагревания микст реакцииЮр в течение 10 мин в кипящей водяной бане. Охлаждают суспензию до комнатной температуры и передать в стеклянную трубку с крышкой. Добавьте 4 тт. абсолютного этанола и помещают суспензию, в холодном хранении (4 ° C) O / N для осаждения любых непереваренные полисахаридами.
- Центрифуга (1500 XG, 10 мин, RT), чтобы отделить непереваренные полисахариды (пеллет) и эндоксиланазой генерироваться Xylo-олигосахариды (супернатант). Декантируют надосадочную жидкость в чистую стеклянную трубку и поместить его в теплую ванну водой (40 ° C).
- Выпаривают этанол в токе газообразного азота, к объему конечной точке (~ 500 мкл). Замораживание супернатант при -80 ° С в течение 4 ч и сухой замороженный супернатант в сублимационной сушилке для восстановления ксило-олигосахариды.
3. Генерация Xylo-олигосахаридов из KOH-SOL AXS и 2ab маркировки
- Treat KOH-SOL AXS с эндоксиланазой (GH 11, [M1]) для генерации ксило-олигосахаридов, как описано выше (разделы 2.1-2.4).
- Лечить endoxylanase генерируется ксило-олигосахариды с KOH-SOL AXS с реакционной смесью 2AB (0,2 М 2ab, 1 М NaBH 3 CN) , как описано выше (разделы 1.1.1-1.1.2).
- Декантируют надосадочную жидкость в чистую стеклянную трубку и поместить его в теплую ванну водой (40 ° C). Выпаривают этанол в токе газообразного азота, к объему конечной точке (~ 500 мкл). Замораживание супернатант при -80 ° С в течение 4 ч и сухой замороженный супернатант в сублимационной сушилке для восстановления ксило-олигосахариды.
4. MALDI-TOF-MS
- Получение MALDI-матричного решения
- Добавьте небольшое шариком 2, 5-dihydroxbenzoic кислоты (DHB) до 50% ацетонитрила (500 мл), содержащей 0,1% муравьиной кислоты в трубе (MALDI-матрица раствора). Смешайте с помощью вихря, если он быстро растворяется, добавьте еще один маленький совок DHB. Примечание: Идеальная концентрация MALDI-матричного раствора составляет 10 мкг / мкл -1.
- Получение MALDI-целевой плиты
- Депозит aqueoмы олигосахарид (родной) образцы (5-10 мкг) (W-золь и / или KOH-золь) на в MALDI-целевой пластины. Добавить 0,3 мкл раствора MALDI-матрицы с использованием отдельного наконечника и перемешать с помощью пипетки вверх и вниз. Дайте смеси высохнуть при комнатной температуре.
Примечание: Правильно высушенные образцы должны состоять из длинных игольчатых кристаллов, указывающими по направлению к центру пятна. Если депозит является липким и / или вязкий образец может быть либо слишком сгущенные или состоят из солей, такие месторождения вряд ли будут производить хорошие спектры и образец должен быть очищен далее. - Введем целевую пластину в источник MS и работать в положительном (+ IVE) режиме ионов. Регулировка напряжения акселератора до 19,0 кВ на источник ионов 1 и 16,3 кВ на источнике ионов 2. Отрегулировать мощность лазера до более чем 70%. Выберите место образца на MALDI-целевой пластины и нажмите кнопку Пуск, чтобы начать лазерные выстрелы.
Примечание: Все области мишени не даст сигналы. Особым местом будет только дать сигнал на несколько лазерных выстрелов из-либоИстощение образца / растворной смеси или характеристик кристалла.- Переместите лазер в различных областях цели при приобретении и в среднем около 200 случайных спектров для получения удовлетворительного соотношения сигнал-шум.
- Депозит aqueoмы олигосахарид (родной) образцы (5-10 мкг) (W-золь и / или KOH-золь) на в MALDI-целевой пластины. Добавить 0,3 мкл раствора MALDI-матрицы с использованием отдельного наконечника и перемешать с помощью пипетки вверх и вниз. Дайте смеси высохнуть при комнатной температуре.
5. ESI-MS-QTOF
- Анализ эндоксиланазой генерируемых олигосахариды (родной) с использованием нано-ВЭЖХ в сочетании с ионизацией электрораспылением (ESI) квадрупольный время пролета (QTOF) MS инструмент с онлайн хроматографического использованием RP колонка С-18 (75 мкм х 150 мм; 3,5 мкм шарик размер).
- Передача эндоксиланазой сгенерированных водные олигосахариды смесь во флакон и помещают в автосэмплера ВЭЖХ. Предварительно запрограммируйте градиент элюции 5-80% с подвижной фазы 0,1% (об / об) муравьиной кислоты в воде и 0,1% (об / об) муравьиной кислоты в ацетонитриле, соответственно, в течение 60 мин.
- Регулировка скорости потока до 0,2 мкл / мин. Настройка режима положительных ионов в диапазоне сканированияиз 300-1,600 т / г и сканирующим скоростью 0,5 сканирований / сек с использованием условий ESI источника следующим образом : Занавес газ 10, GS1 4, температура источника 100 ° С, с ионным распылением напряжение 2300 В, и де-кластеризация потенциал 50 V. Запустите программу LC хроматографического и элюции олигосахаридов. Полученная общая ионная хроматограмма (TIC) сохраняется автоматически с помощью программного обеспечения.
- Откройте сохраненный TIC и выберите хроматограмму экстракта. Введите ожидаемые массы (например, 271, 403, 535, 667, 799 и 931 м / г) в командной строке. Сканирование хроматограмму, нажав Enter. Процесс выбранных ионов сканы данных хроматограммы ESI-MS QTOF с использованием программного обеспечения в соответствии с инструкциями 14 изготовителя.
6. ESI-МС п
- Вставка 1 до 2 мкл на-O-метилированных олигосахаридов (метилированный , как описано Pettolino и др. 1) образца в 50% ацетонитрила в наконечнике микросфер с использованием шприца. Отделкакончик нано-спрей, используя стеклорез, чтобы вписаться в дискретном держатель нано-спрей, прикрепленной к MS.
- Установите массу в соответствии с ожидаемым диапазоном масс (200-1,500 м / г) и занавеской газа до 10, ionspray напряжения на 1,900 V и полярности к положительной.
- Нажмите кнопку , чтобы открыть сбора по релевантного окна, введите имя файла данных для получения общего ионного сканирования (ESI-MS 1). Затем нажмите кнопку STOP.
- Изменение типа сканирования из иона продукта фрагментировать пик интереса. Введите массу интерес (например, 885 м / г) , чтобы фрагментировать и регулировать диапазон масс (200-900 м / з). Нажмите кнопку получения и регулировки энергии столкновения (вверх и / или вниз на вкладке соединения) для достижения всей фрагментации родительского иона (885 м / г) и приобрести ионный фрагмент сканирования (ESI-MS 2).
- Ввод массы фрагмента иона интерес (например, 711 м / г) и регулировать диапазон масс (200-720 м / г). Нажмите кнопку Приобретатьd регулировать энергию удара , чтобы достичь всего фрагментации иона - предшественника (711 м / г) и приобретают ионный фрагмент сканирования (ESI-MS 3).
7. H 1 ЯМР - спектроскопия
- Растворите эндоксиланазой генерироваться смесь олигосахаридов (КОН-золь, нативной форме) (~ 500 мкг) в D 2 O (1,0 мл, 99,9%) в пластиковую пробирку (15 мл). Замораживание суспензии при -80 ° С в течение 4 ч и сухой замороженный приостановку в сублимационной сушилке для восстановления ксило-олигосахариды.
- Повторите 7.1 дважды, чтобы полностью обменять H 2 O с D 2 O.
- Растворите высушенных олигосахариды в D 2 O (0,6 мл, 99,9%) и добавьте 0,5 мкл ацетона (5% в D 2 O) в качестве внутреннего стандарта. Передача дейтерированных олигосахариды в ЯМР пробирку.
- Держите ЯМР пробирку, содержащую образец с верхней и вставьте пробирку с пробой в пластиковом блесны. Поместите вертушку в глубине образца датчика. Гнойч или тянуть пробирку, чтобы регулировать глубину образца, чтобы гарантировать, что центральная линия верхней и нижней образца глубиномеры равны.
- Извлеките глубиномер и вставить образец в автосамплера, прикрепленного к 600 МГц ЯМР-спектрометре, снабженном крио-зондом.
- Логин и открытое программное обеспечение управления спектрометром. Введите имя файла образца. Откройте существующий набор данных, а затем использовать команду "EDC", чтобы сохранить его под новым именем. Введите номер позиции образца в автоматическом пробоотборнике и нажмите "ENTER".
Примечание: при нажатии кнопки "ENTER" сбросит пробирку осторожно, чтобы отверстие магнита, где оно будет расположено в верхней части зонда. - Установите желаемую температуру образца, набрав "edte" в командной строке. Подождите, пока температура образца достигнет желаемого значения, прежде чем перейти к следующему шагу. Введите "замок" в командной строке и выбрать соответствующий растворитель (D 2 O). Подождите, & #34; блокировка готовой "сообщение появится в нижней части окна.
- Введите "atmm" в командной строке и нажмите кнопку "Оптимизировать" в верхней части строки меню atmm. Выберите Пуск для настройки и согласования датчика для выбранного канала (1 H в данном случае).
- Введите "topshim" в командной строке для процесса подкладок, в котором незначительные корректировки для магнитного поля до однородного магнитного поля не будет достигнуто вокруг sample.Acquire сигнал, набрав "ZG" в командной строке и введите.
- Анализ спектров с использованием программного обеспечения 15 в соответствии с инструкциями изготовителя с 1 H химического сдвига , отнесенная к внутреннему стандарту ацетона при 2.225 частей на миллион.
Результаты
Эндоксиланазой переваривание 2ab меченных W-золь AXS производит смесь 2ab меченных RE олигосахариды и ряд не-меченый (без этикетки 2ab) олигосахаридов , полученных из внутренних областей ксилана цепи (рис 1, из Ратнаяке и др. 2). Ряд хроматографических подходов затем используют для фракционирования сложную смесь изомеров. И, наконец, методы MS используются для идентификации изомерных структур, которые затем секвенировали с помощью MS н методов. Здесь мы представляем своего представителя, а не всеобъемлющего, например подхода.
Сигналы в спектре MALDI-TOF-MS олигосахаридов , полученных из 2ab меченных нативной W-золь AXS (фиг.2А) включают в себя весьма обильную псевдо-молекулярному иону серии при m / z 701, 833, и 965 , представляющий серию непомеченная нейтральный внутреннийобласть олигосахариды с 5-7 pentosyl остатками (Р 5-7), соответственно. Серия сигналов при m / z 745, 877, и 1009 г. , обозначают , что немеченого кислом серии олигосахаридов, с P 4-6 + HexA 1 (аскорбиновая кислота), также присутствует в этой фракции (фиг.2А). Псевдо-молекулярных ионов при м / з 821 и 953 указывают на наличие 2ab меченных оригинального RE олигосахариды P 5-6 + 2AB соответственно.
Анализ ESI-QTOF-MS для нативных олигосахаридов с он-лайн хроматографического фракционирования олигосахаридов с помощью RP C-18 ВЭЖХ затем выполняется. Рисунок 2B и 2C, показывает выбранные ионных сканирований, извлеченный из общего иона ESI-QTOF-MS хроматограмма (TIC), олигосахариды, выпущенных эндоксиланазой из W-SOL Fr AXS. Сигналы включают псевдо-молекулярный ион серии , назначенный в качестве [M + NH 4] + при т/ г 696, 828, 960, 1092, 1224, и 1356 , представляющий серию внутренней области нейтральных олигосахаридов с 5-10 pentosyl остатков (P 5-10) соответственно (рис 2В). Несколько изомерных структур возможны для олигосахарида определенной массы (см ниже ESI-MS н анализа). Отсюда множество пиков для каждого из сканов молекулярных ионных возможны , как отмечено на фигуре 2В. Псевдо-молекулярных ионов , назначенных в качестве [M + H] + при m / z 271, 403, 535, 667, 799 и 931 указывают на наличие 2ab маркированы RE олигосахарид серии П 1-6 + 2AB, соответственно (рис 2C) , Сигналы , обнаруженные в [М + Н] + при m / z 613, 745, 877, 1009, 1141, 1273 и указывают на наличие кислых олигосахаридов с P 3-8 + HexA 1 соответственно (фиг.2с). В commelenid однодольные, ксилан позвоночник также может быть замещен фенольные кислоты,в первую очередь феруловая кислота (а также р -coumaric кислота), которая имеет ту же молекулярную массу , как и глюкуроновой кислоты и могут быть обнаружены в W-SOL AXS стенок эндосперме пшеницы клеток. Тем не менее, дальнейший анализ W- и KOH-SOL AXS с использованием ESI-MS (п и композиционной анализа методом ГХ-МС производных TMS следуя метанолизе; здесь не показано) подтверждают кислые олигосахариды с P 3-8 + 1 HexA в эндосперме пшеницы AXS.
Сигналы , назначенные как [М + Н] + ионы : ESI-Q-TOF полный спектр сканирования области между 3.10-3.48 мин (рис 2D) включает в себя серию 2ab меченый RE олигосахариды: m / z 271, 403, 535, 667, 799, 931, 1063, и 1195 (Р 1-8 + 2AB, соответственно). Серия псевдо-молекулярных ионов в ЭРИ-Q-TOF полный спектр сканирования области между 3.59-4.05 мин (рис 2E) представляют собой внутреннюю область кислые олигосахариды наблюдатьd и как [M + Na] + ионов: m / z 613, 745, 877, 1009 и 1141 (P 3-7 + HexA 1, соответственно) и [M + NH 4] + ионов: m / z 740, 872, 1004, 1136, и 1268 (С 4-8 + HexA 1, соответственно).
Для того , чтобы показать порядок отдельных олигосахариды, мы проводили ESI-МС п на за-O-метилированных олигосахариды , а не на нативных олигосахаридов , полученных из W-SOL и KOH-SOL AXS , поскольку она является сложной задачей , чтобы однозначно присвоить структуры с помощью секвенирования нативные олигосахариды , Кроме того, он также требует большого количества материала. Метилирование олигосахаридов осуществляли, как описано Pettolino и др. 1. ESI-МС п исследования , выполненные на RE нейтрального олигосахарида полиолов , полученных из KOH-золь AXS и 2AB маркированы нейтральный RE олигосахарид получен из W-SOL AXS описаны БелуW в качестве примера для оказания помощи в интерпретации спектров и выведенными структур. Такой же подход может быть применен ко всем олигосахаридов, полученных от ферментативного гидролиза. Ионы фрагмент в ESI-MS н спектры были определены в качестве ионов Y и B в соответствии с Domon & Costello. 16 Ун-метилированных гидроксильную группу (группы) , образующихся при газофазной фрагментации на-O-метилированных олигосахаридов в MS N обеспечивает 14Da разность масс "шрам" , который может быть использован для идентификации ветвление и гликозильные последовательности. 12-13 Каждый шрам , порожденный события фрагментации помечен как сплошной линией (Рисунки 3 и 4). Поскольку несколько изомерных структур возможны для определенной массы, то в этих изомерных структур, ионы Y и B обозначены в красный и черный, соответственно.
ESI-МС 2, ESI-МС 3 и ESI-МС 4 ОФЭКТра из за O-метилированный RE нейтральной олиго-гликозильная альдита генерируется из фрагментации псевдо-молекулярных ионов т / г +885 (P 4 + Xyl ол) показан на рисунке 3. 2 - спектр ESI-MS включает в себя богатый Y ионы при m / z 711, 551, и 391 , порожденный потерей одного, двух и трех pentosyl остатков, соответственно, от родительского иона. Обильные м / з 711 ионов может быть сгенерирован либо потерей невосстановительной Xyl концевой остаток конца или потерей терминала боковой цепи Ara остатка. Диагностическая Y м / з 391 ионов в полученном спектре может быть восстановлена из потери трех невосстанавливающих концевых Xyl остатков из РЗ олигосахарида , который имеет Ara остаток боковой цепи на остатке ола RE Xyl или RE олигосахарида , который имеет боковой цепи Ara остаток на остаток 2 - й Xyl из ола остатка RE Xyl. Хотя существует формальная возможность того, что другие структуры, такие какXyl 4 -Xyl ол и (ARA) Xyl-Xyl-Xyl-Xyl ол бы привести к этому ионный фрагмент этих структур, исключаются из рассмотрения в качестве специфичности эндо-ксиланазы, используемой для расщепления полисахарида будет либо ухудшать или не расщепляют на гликозидной связи, прилегающей к точке ветвления, соответственно. Соответственно, диагностический Y м / з 551 ион может быть восстановлена из потери двух невосстанавливающих концевых Xyl остатков из РЗ олигосахарида , который имеет АРА остаток боковой цепи , либо на остаток ола RE Xyl или RE олигосахарида , который имеет сторону цепь Ara остаток на предпоследнем остаток Xyl. Таким образом, четыре возможных изомерных структур могут быть предложены (Рисунок 3: I, II, III и IV). Обильные Y ион м / з 377 (смотри рисунок 3: Ia и IIa) и B иона m / z 503 (см Рисунок 3: Ia, Ib, IVA и IVb) , полученные от дальнейшей фрагментации изомерных предшественника м/ г 711 ионов также наблюдаются в этом спектре. 3 - спектр : ESI-МС (рис 3) , записанные с помощью фрагментации изомерных предшественника m / z 711 ионы включены основной пик при м / з 537 (Y ион P 2 + Xyl ола с двумя рубцами, генерируется из предшественника иона Ia , Ib, IIa, IIb, IIIa, IIIb, IVa и IVb) , и м / з 391 (Y ион P 1 + Xyl ола с одним рубцом, генерируется из предшественника иона IIB, IIIA, IIIB, IVa и IVb). Эти два основных пика (m / z 537 и m / z 391) могут быть получены в результате потери одного и двух невосстанавливающих концевых остатков Xyl, соответственно, из изомерных предшественника м / з 711 ион генерируется из фрагментации псевдо -molecular исходный ион м / з 885 (P 4 + Xyl ол) во время ESI-MS 2. Относительно более низкие пики численности при м / з 377 (Y ион P 1 + Xyl ола с двумя рубцами, генерируется из precursoг ионов Ia и IIa) и 551 (Y ион P 2 + Xyl ола с одним рубцом, полученные от предшественника иона Ib и IIb) также наблюдались в этом спектре.
ESI-МС 4 фрагментации изомерных предшественника т / г 551 ионы включены основной пик при м / з 377 (Y ион P 1 + Xyl ола с двумя рубцами) и м / з 391 (Y ион P 1 + Xyl ола с одним рубцом) , образующихся из предшественника иона структур I и II. Поэтому коллективные данные свидетельствуют о том, что последовательность RE гликозильная состоит из боковой Ара цепи , присоединенной к ола остатка RE Xyl (диагностическая фрагментация путь м / Z 885 → 711 → 551 → 391; Рисунок 3II), Ара боковой цепи , присоединенной к обоим RE Xyl ола и предпоследний (1 - й Xyl остаток от RE Xyl ола) Xyl остаток (диагностическая фрагментация путь м / г 885 → 711 → 537 → 391; Рисунок 3III), Ара боковой цепи , присоединенной к предпоследнему (1-Xyl из RE Xyl ол) Xyl остаток (диагностическая фрагментация путь м / Z 885 → 711 → 537 → 377; Рисунок 3I) , и сторона Ара цепь прикреплена к остатку 2 - й Xyl из RE Xyl ола (рис 3IV).
Присутствие этих ионов подтверждает предложенные изомерных структур I, II, III и IV , а нейтральный олигосахарид RE структура: - [Ара F - (1 → 3)] (+/-) -Xyl р - (1 → 4) - [Ара F - (1 → 3)] (+/-) -Xyl р - (1 → 4) - [Ара F - (1 → 3)] (+/-) -Xyl р.
ESI-MS 2 спектр за O-метилированной 2ab маркированы RE олигосахариды генерируется из Фрагментация из квазимолекулярный [M + Na] + ионов при т / г 871 (P 4 + 2AB) показан на рисунке 4. Этот спектр включает в себя наиболее обильные Y ион при м / з 697 (P + 3 2ab с одним рубец), м / з 537 (P 2 + 2AB с одного шрама) и m / z 377 (P 1 + 2ab с одним рубцом), порожденный потерей либо один, два или три невосстанавливающих остатков pentosyl соответственно. М / з 697 ионов может быть сгенерирован либо потерей невосстановительной остатка концевая Xyl или потерей остатка терминала Ara , тогда как т / г 537 ионов может быть сгенерирован только потерей двух концевых остатков Xyl , Диагностическая фрагментация путь (м / Z 871 → 697 → 537 → 377) предположил , что существование линейной не-разветвленного ксилана магистральную олигосахарида (ов) на RE , соответствующий квазимолекулярный ионным м / з 871 (Р 4 + 2AB ). Однако линейный ун-разветвленными ксилозил магистральная (P 4 + 2AB) является susceptible на сайт конкретных эндоксиланазой для дальнейшего переваривания. Поэтому два иона изомерные м / г 697 может существовать. Соответственно два возможных изомерных структур предложены (Рисунок 4: I и II). В этих изомерных структур ионов Y и B обозначены в красный и черный, соответственно. ESI-МС 3 Спектр записывается от фрагментации изомерных предшественника т / г 697 ион генерирует m / z 523 ион (Y ион P 2 + 2AB с двумя рубцами, рисунок 4, структуры Ia, Ib, IIa и IIb), м / Z 363 ион (Y ион P 1 + 2AB с двумя рубцами; Рисунок 4, структура IIа) и Y ион при m / z 377 (P 1 + 2AB с одним рубцом; Рисунок 4, структуры Ia и Ib). Ионный фрагмент при м / з 377 может возникнуть только из предложенной структуры I и фрагмент ионов при м / з 363 может возникнуть только из предложенной структуры II. Одновременное присутствие этих двух ионов подтверждает предложенные структуры I и II, Таким образом, последовательность RE гликозильная из ксилана цепи эндосперме пшеницы AXS состоят из ветви Ara прикрепленной к остатку RE Xyl (осколочной затрагивающего пути м / з 871 → 697 → 523 → 363) и / или предпоследний Xyl остаток (фрагментация путь m / z 871 → 697 → 523 → 377).
ЯМР-анализ AXS
Анализы MS на основе не предоставляют информацию о любой конфигурации аномерного (α / р) или конфигурации D / L из сахаров , которые должны быть получены другими подходами, в том числе ферментативной и физические (например, ЯМР). Для heteroxylans с характерным RE сниженной тетрасахарида (Xyl-Rha-GALA-Xyl ол), спектр ЯМР содержит аномерные сигналы , приводящие к идентификации и секвенирования этого RE олигосахариды. Описано использование 600 МГц 1D 1 H-ЯМР - спектроскопии в качестве единственного метода шага опргорностая полную последовательность гликозильную пшеницы эндосперма AX RE олигосахарида на KOH-SOL Fr, включая конфигурацию аномерного (α / р) и конфигурации D / L из сахаров. Резонансы были назначены на основании опубликованных присвоений пшеницы AX олигосахаридов 17-18 (рисунок 5, таблица 1). 1 H-ЯМР - спектр AX , извлеченной из эндосперме пшеницы преобладают аномерная химических сдвигов в 5,39, 5,27 и 5,22 промилле, которые назначены на протон в α-L-Ara ф концевой остаток, прикрепленной к O-3 позиции (Т-α-L-Ara F → 3 S) , из однократно разветвленного (1,4) -β-Xyl р магистральным остатков и как O-3 и о-2 позиции (Т-α-L-Ara F → 3 D и Т-α-L-Ara F → 2 D) , двукратно разветвленными (1,4) -β-Xyl р магистральным остатков, соответственно (рис 5 и в таблице 1).
Сигналы на 5,41 присваиваются (T-a-L-Ara F → 3 S + D) H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 однократно разветвленного р остатка β-D-Xyl с примыкающей двукратно разветвленного β-D-Xyl с. Сигнал на 5,29 назначается (T & alpha; -L-Ara F → 3 D + D) H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 двукратно разветвленного бета-D-Xyl р остаток с примыкающей двукратно разветвленного β-D-Xyl с. сигнал на 5,24 назначается (T & alpha; -L-Ara F → 2 D + D) H1 сигнал α-L-Ara F боковой цепи , присоединенной к O-2 положение двукратно разветвленного р остатка β-D-Xyl с примыкающей двукратно разветвленного β-D-Xyl р.


Рисунок 2. MALDI-TOF MS (А) и ESI-QTOF МС (В - Е) анализ нативных олигосахаридов , выпущенных эндоксиланазой из 2ab меченый W-SOL AXS , как показано на рисунке 1. MALDI-TOF МС - спектр: (A) ( сигнализирует вновь идентифицирована как [M + Na] + ионов аддукта); Отдельные ионные сканы ESI-MS QTOF хроматограммах: B = P 5-10 , полученной из внутренних олигосахариды области (Сигналы обозначены как [M + NH 4] + ионов аддукта), C = P 1-6 + 2ab , полученные из RE олигосахариды (сигналы обозначены как [M + H] + ионов аддукта) & P G 3-8 , получаемые из кислотных олигосахаридов (сигналы обозначены как [M + Na] + ионов аддукта), D = ESI-Q-TOF полный спектр сканирования: область между 3.10-3.48 мин, E = ESI-Q-TOF полный спектр сканирования: область между 3.59-4.05 мин (сигналы обозначены как оба [M + Na] + и [M + NH 4] + ионов аддукта ); P = pentosyl блок (либо Ара или Xyl); G = остаток uronosyl (GlcA); RE = восстанавливающий конец олигосахариды; 2AB = 2 аминобензамид; EIC: извлеченный ионная хроматограмма. Объявление / 53748 / 53748fig2large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
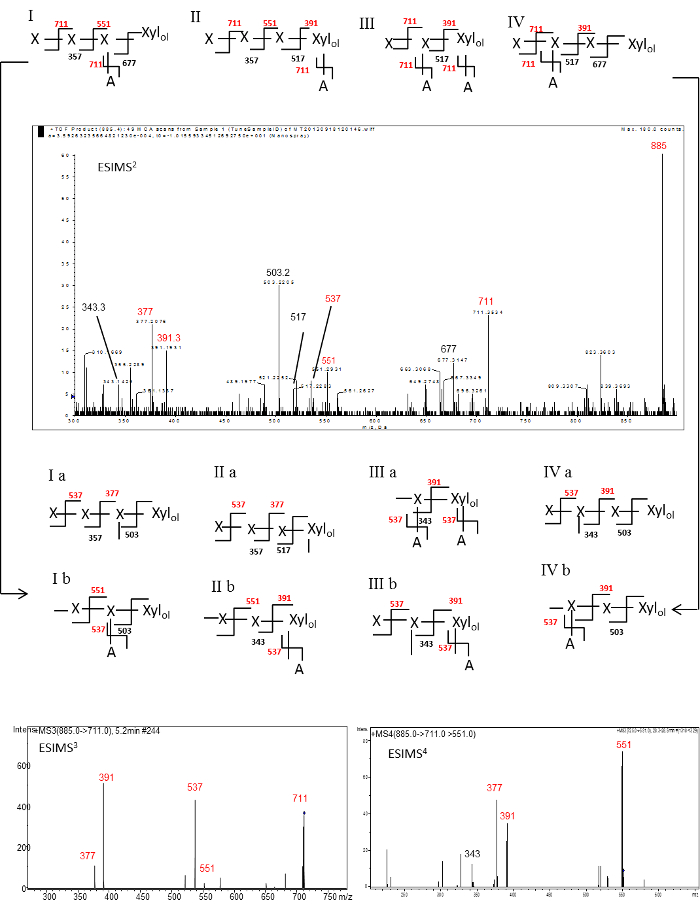
Рисунок 3. ESI-МС 2, ESI-МС 3 и ESI-МС 4 - спектры на-O-метилированных RE нейтрального гликозильного альдита (Р 4 + Xyl ола) - м / з 885. Сигналы назначаются в качестве [M + Na] + псевдо-молекулярных ионов аддуктов. Поскольку несколько изомерных структур для определенной массы возможны, то в изомерных структурах ионы Y и B обозначены в красный и черный, соответственно. Каждый "шрам" генерируется событие фрагментации отмечен как сплошной линией. X = ксилозил остаток; A = Arabinosyl остаток. 3 Спектры ESI-MS была воспроизведена с разрешения Ратнаяке и др. (2014) 2.748fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. ESI-MS 2 и ESI-MS 3 спектры за O-метилированной 2ab маркированы нейтральный олигосахарид RE (P 4 + 2AB) - м / з 871. Сигналы назначаются как [M + Na] + псевдо -molecular ионных аддуктов. Поскольку несколько изомерных структур для определенной массы возможны в изомерных структурах, ионы Y и B обозначены в красный и черный соответственно. Каждый "шрам" генерируется событие фрагментации отмечен как сплошной линией. X = ксилозил остаток; A = Arabinosyl остаток. Эта цифра была воспроизведена с разрешения Ратнаяке и др. (2014) 2. Пожалуйста , нажмите здесь , чтобы увидеть увеличенное версион этой фигуры.

Рисунок 5. аномерная область спектра 600 МГц 1D 1 H-ЯМР AX олигосахариды , порожденного эндоксиланазой обработкой KOH- Sol Фр 1 Н химический сдвиг ссылка на внутренний стандарт ацетона при 2.225 частей на миллион. Т-α-L-Ara F → 3 S: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 однократно разветвленного р остатка β-D-Xyl; Т-α-L-Ara F → 2 D: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-2 двукратно разветвленного р остатка β-D-Xyl; Т-α-L-Ara F → 3 D: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 двукратно разветвленного р остатка β-D-Xyl; T-α-L-Arg F → 3 S + D: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 однократно разветвленного р остатка β-D-Xyl с прилегающим двукратно разветвленной β-D- Xyl р; Т-α-L-Ara F → 2 D +: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-2 двукратно разветвленного р остатка β-D-Xyl с прилегающим двукратно разветвленной β-D -Xyl р; Т-α-L-Ara F → 3 D +: H1 сигнал α-L-Ara F боковой цепи , присоединенной к положению O-3 двукратно разветвленного р остатка β-D-Xyl с прилегающим двукратно разветвленной β-D -Xyl р; 2-α-L-Ara F → 3 S: H1 сигнал 2-α-L-Ara остаток е боковой цепи , прикрепленной к положению O-3 однократно разветвленного р остатком β-D-Xyl; Пожалуйста , нажмите сюда , чтобы просмотретьувеличенная версия этой фигуры.
| Сахарные остатки | Н-1 / C-1 | Н-2 / С-2 | Н-3 / С-3 | Н-4 / С-4 | Н-5 экв / С-5 | H-5 топор / C-5 |
| Т-α-L-Араф → 3 S | 5,396 / 107,6 | 4.16 | 3,95 | 4.3 | 3,82 | 3,72 |
| Т-α-L-Араф | 5,415 / | 4,18 | 3,95 | |||
| → 3 S + D | ||||||
| Т-α-L-Араф → 2 Д | 5,223 / | 4.16 | 3,97 | 3,82 | 3,74 | |
| Т-α-L-Араф → 2 D + | 5,243 / | 4.16 | 3,98 | |||
| Т-α-L-Араф → 3 D | 5,272 / 108,9 | 4,18 | 3,96 | 4,26 | 3,79 | 3,74 |
| Т-α-L-Араф → 3 D + | 5,298 / | 4,18 | 3,96 | |||
| 2-α-L-Араф → 3 S | 5,548 / 106,4 | 4,27 | 4,06 | 4.3 | 3,82 | |
| a-Xylp (уменьшение) | 5,185 / 91,9 | 3,55 | 3,72 | |||
| бета-Xylp (уменьшение) | 4,580 / 96,6 | 3,29 | 3,48 | 3,64 | 4,06 | 3,38 |
| β-4-Xylp | 4,470 / | 3,32 | 3,58 | |||
| & beta ; -4-Xylp + S | 4,461 | 3,31 | 3,56 | 3,75 | 4,08 | 3,36 |
| β-4-Xylp + D , | 4,448 | 3,31 | 3,56 | 3,75 | 4,08 | 3,36 |
| бета-3,4-Xylp | 4,518 / | 3,44 | 3,85 | |||
| S + β-3,4-Xylp | 4,514 / | 3,47 | 3,75 | 3,86 | 4,14 | 3,43 |
| D + β-3,4-Xylp | 4,505 | |||||
| бета-3,4-Xylp + S , | 4,492 | 3,45 | 3,74 | |||
| β-3,4-Xylp + D , | 4,482 | 3,45 | 3,74 | |||
| бета-2,3,4-Xylp | 4,638 | |||||
| S + β-2,3,4-Xylp | 4,627 | 3,59 | 3,87 | 3,88 | ||
| D + β-2,3,4-Xylp | 4,616 | |||||
| бета-2,3,4-Xylp + S | 4,593 | |||||
| β-2,3,4-Xylp + D | 4,593 | |||||
| Химические сдвиги представлены относительно внутреннего ацетона, б 2,225. | ||||||
| S = Поодиночке разветвленные β-Xylp | ||||||
| S + D = Поодиночке разветвленным β-Xylp + Вдвойне разветвленные бета-Xylp | ||||||
| D = Вдвойне разветвленным β-Xylp | ||||||
| D + D = Вдвойне разветвленным β-Xylp + Вдвойне разветвленные бета-Xylp | ||||||
Таблица 1. 1 H-ЯМР сигналы ксило-олигосахариды , генерируемых эндоксиланазой обработкой пшеницы эндосперма KOH-золь Фр
Обсуждение
Большинство фазы матрицы полисахаридами клеточной стенки имеют по- видимому случайным образом замещенные основные цепи (с обоими гликозильная и не Гликозильные остатков) , которые сильно варьируют в зависимости от вида растений, стадии развития и типа ткани 3. Поскольку полисахаридами являются вторичными генные продукты их последовательность не шаблона: происходит и нет, поэтому ни один аналитический подход, например, существует для нуклеиновых кислот и белков, их последовательности. Наличие очищенных рычажную конкретных гидролитических ферментов обеспечила мощный инструмент деградировать полисахаридов олигосахаридов, которые затем могут быть хроматографически фракционированию, и при использовании в сочетании с химическими и физическими методами полностью секвенирован. Задача состоит в том, чтобы затем вновь собрать эти сложные смеси в исходный полисахарида sequence- тот, который еще предстоит быть успешно решена.
Здесь мы опишем подход (чей порядок применения окп разнообразны), которая опирается на интеграцию установленного ферментативных, химических и физических методов структурной характеристике как восстанавливающего конца (RE) и последовательности гликозильного внутренней области (ами) heteroxylans. Дополнительный метод дополняют друг друга , не описанные здесь , что оказалось весьма полезным для характеристики олигосахариды является PACE (анализ полисахарида с помощью электрофореза в углеводном геле) , разработанный группой Дюпри 19 и может быть легко интегрирован в этот протокол , если оборудование. Кроме того, вариации на LC-хроматографии также может быть полезным, например, тандем инлайн гидрофильное взаимодействия хроматографии (HILIC), а затем с помощью ОФ хроматографии, предлагающим возможность разделения как непомеченная / помечено олигосахариды в одну стадию. Методы полагаются на мечение (с 2 аминобензамидом (2ab)) восстанавливающего конца (RE) от heteroxylan цепи предшествующего уровня ферментативной (эндоксиланазой) гидролиза. Два разных подхода (см резюме вРисунок 1) принимаются. В первом случае, интактные W-SOL AXS обрабатывают 2ab помечать исходную RE основной цепи остаток сахара, а затем обрабатывают эндоксиланазой, чтобы сформировать смесь 2ab меченных RE и внутренней области восстановительной олигосахариды, соответственно. Во втором подходе KOH-золь ПТ гидролизуется с эндоксиланазой сначала подготовить смесь олигосахаридов, которые впоследствии меченных 2ab. В этом последнем случае оригинал RE из KOH-золь AX не будет помечена 2ab , поскольку она была сведена к гликозильному-альдит во время щелочной экстракции , который содержал восстановитель, борогидрид натрия (NaBH 4). Поэтому 2AB меченые олигосахариды генерироваться после ксиланазы пищеварение, будет исходить из "внутренних" олигосахаридов и оригинального RE олигосахарида будет содержать RE альдитол без 2ab тега (рисунок 1). Этот подход может быть также применен к другим классам полисахаридами Uпеть (если таковые имеются) соответствующие эндо-гидролаз.
MS-ориентированный подход значительно повышается за счет метилирования олигосахаридов генерируется после обработки эндоксиланазой , так как ООН-метилированных гидроксильную группу (ы) генерируется во время газовой фазы фрагментации на-O-метилированный олигосахаридов в MS п обеспечивает разность масс 14Da "шрам " , которые могут быть использованы для оказания помощи в идентификации ветвления и последовательности гликозильного. 5-6 Идентичность pentosyl остатков (и любого остатка сахара) не могут быть сделаны только из данных MS , но приходит от иметь знания о состав молекулы; где это не доступно , то соответствующие моносахаридов и рычажный анализы должны быть выполнены до выполнения этих заданий в MS п. Кроме того , сигналы , соответствующие RE кислой олигосахаридов альдита, генерируемой из KOH-SOL Fr (Xyl 3 -MeGlcA-ксилитом: m / z 761) и чaracteristic двудольным ксилана RE последовательность гликозильная (Xyl 2 -Rha-GALA-Ксилит: м / з 761), если они присутствуют, не в состоянии отличить , как оба имеют одинаковую молекулярную массу в нативном виде , но можно отличить от их фрагментации MS ( МС п) спектры , которые лучше всего проводить на метилированных олигосахаридов. И, наконец, методы , основанные на МС не в состоянии предоставить информацию о любой конфигурации аномерной (α / β) гликозидной связи или конфигурации D / L от sugars- это должно определяться альтернативными методами, в том числе и ферментативный физические (например, ЯМР).
Раскрытие информации
We have nothing to disclose.
Благодарности
This project was supported by funds from Commonwealth Scientific and Research Organisation Flagship Collaborative Research Program, provided to the High Fibre Grains Cluster via the Food Futures Flagship. AB also acknowledges the support of an Australia Research Council (ARC) grant to the ARC Centre of Excellence in Plant Cell Walls (CE110001007).
Материалы
| Name | Company | Catalog Number | Comments |
| 2 aminobenzamide (2AB) | Sigma-Aldrich (www.sigmaaldrich.com) | A89804 | |
| sodium borohydride (NaBH4) | Sigma-Aldrich (www.sigmaaldrich.com) | 247677 | Hazardous, handle with care |
| sodium cyanoborohydride (NaBH3CN) | Sigma-Aldrich (www.sigmaaldrich.com) | 156159 | Hazardous, handle with care |
| endo-1,4-β-Xylanase M1 (from Trichoderma viride) (120101a) | Megazyme (www.megazyme.com) | E-XYTR1 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich (www.sigmaaldrich.com) | 151882 | |
| Freeze dryer (CHRIST-ALPHA 1-4 LD plus) | |||
| RP C18 Zorbax eclipse plus column | Agilent | (2.1×100 mm; 1.8 µm bead size) | |
| MicroFlex MALDI-TOF MS (Model - MicroFlex LR) | (Bruker Daltonics, Germany) | ||
| (ESI) -(QTOF) MS (Model # 6520) | (Agilent, Palo Alto, CA ) | ||
| ESI-MSn - ion-trap (Model # 1100 HCT) | (Agilent, Palo Alto, CA). | ||
| Bruker Avance III 600 MHz -NMR | Bruker Daltonics, Germany | ||
| Topspin (version 3.0)-Biospin- software | Bruker | ||
| GC-MS (Model # 7890B) | Agilent |
Ссылки
- Pettolino, F. A., Walsh, C., Fincher, G. B., Bacic, A. Determining the polysaccharide composition of plant cell walls. Nature Protocols. 7, 1590-1607 (2012).
- Ratnayake, S., Beahan, C. T., Callahan, D. L., Bacic, A. The reducing end sequence of wheat endosperm cell wall arabinoxylans. Carbohydr. Res. 386, 23-32 (2014).
- Bacic, A., Harris, P. J., Stone, B. A., Preiss, J. . The Biochemistry of Plants, Vol. 14, Carbohydrates. 14, 297-371 (1988).
- York, W. S., O'Neill, M. A. Biochemical control of xylan biosynthesis - which end is up?. Plant Biol. 11, 258-265 (2008).
- Fincher, G. B. Revolutionary times in our understanding of cell wall biosynthesis and remodeling in the grasses. Plant Physiol. 149, 27-37 (2009).
- Faik, A. Xylan Biosynthesis: News from the Grass. Plant Physiol. 153, 396-402 (2010).
- Scheller, H. V., Ulskov, P. Hemicelluloses. Annu. Rev. Plant Biol. 61, 263-289 (2010).
- Bacic, A., Stone, B. A (1→3)- and (1→4)-linked β-D-glucan in the endosperm cell-wall of wheat. Carbohydr. Res. 82 (13), 372-377 (1980).
- Comino, P., Collins, H., Lahnstein, J., Beahan, C., Gidley, M. J. Characterisation of soluble and insoluble cell wall fractions from rye, wheat and hull-less barley endosperm flours. Food Hydrocolloids. 41, 219-226 (2014).
- Pena, M. J., et al. Arabidopsis irregular xylem8 and irregular xylem9: Implicationsfor the Complexity of Glucuronoxylan Biosynthesis. Plant Cell. 19, 549-563 (2007).
- Andersson, S. I., Samuelson, O., Ishihara, M., Shimizu, K. Structure of the reducing end-groups in Spruce xylan. Carbohydr. Res. 111, 283-288 (1983).
- Mazumder, K., York, W. S. Structural analysis of arabinoxylans isolated from ball-milled switchgrass biomass. Carbohydr. Res. 345, 2183-2193 (2010).
- Kulkarni, A. R., et al. The ability of land plants to synthesize glucuronoxylans predates the evolution of tracheophytes. Glycobiol. 22 (2012), 439-451 (2012).
- . . Agilent MassHunter Workstation Software - Quantitative Analysis Familiarization Guide. , (2010).
- . . Topspin User Manual. , (2010).
- Domon, B., Costello, C. E. A systematic nomenclature for carbohydrate fragmentation in FAB-MS/MS spectra of glycoconjugates. Glycoconjugate. J. 5, 397-409 (1988).
- Hoffmann, R. A., Leeflang, B. R., De Barse, M. M. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H-n.m.r. spectroscopy of oligosaccharides, derived from arabinoxylans of white endosperm of wheat, that contain the elements ----4)[alpha-L-Araf-(1----3)]-beta-D-Xylp-(1---- or ----4)[alpha- L-Araf-(1----2)][alpha-L-Araf-(1----3)]-beta-D-Xylp-(1----. Carbohydr. Res. 221, 63-81 (1991).
- Gruppen, H., Hoffmann, R. A., Kormelink, F. J. M., Voragen, A. G. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H NMR spectroscopy of enzymically derived oligosaccharides from alkali-extractable wheat-flour arabinoxylan. Carbohydr. Res. 233, 45-64 (1992).
- Kosik, O., Bromley, J. R., Busse-Wicher, M., Zhang, Z., Dupree, P. Studies of enzymatic cleavage of cellulose using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Methods Enzymol. 510, 51-67 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены