Method Article
酵素的、化学(メチル化)と物理(質量分析、核磁気共鳴)技術を用いた植物の壁ヘテロキシランのシーケンシング
要約
This protocol describes the specific techniques used for the structural characterization of reducing end (RE) and internal region glycosyl sequence(s) of heteroxylans by tagging the RE with 2 aminobenzamide prior to enzymatic (endoxylanase) hydrolysis and then analysis of the resultant oligosaccharides using mass spectrometry (MS) and nuclear magnetic resonance (NMR).
要約
このプロトコルは、ヘテロキシランのグリコシル配列(単数または複数)を終了(RE)を低減し、内部領域の特徴付けのために使用される具体的な手法について説明します。脱糊小麦胚乳細胞壁は、アルコール不溶性残留物(AIR)1として単離し、順次水(W-ゾルFR)で抽出し、Ratnayake らによって記載されているように、1%のNaBH 4(KOH-ゾル金曜日)を含む1 M KOH ら (2014年)2。 2つの異なるアプローチは、( 図1の概要を参照)を採用しています。最初に、インタクトなW-ゾルAXSは、元のRE主鎖糖残基にタグを2ABで処理し、次いで、それぞれ、オリゴ糖の還元2AB標識REと内部領域との混合物を生成するためのエンドキシラナーゼで処理しました。第2のアプローチでは、KOH、ゾルFRが最初に、続いて2ABで標識されたオリゴ糖の混合物を生成するために、エンドキシラナーゼで加水分解されます。両方から酵素的に放出((非)タグ付けされた)オリゴ糖W-及びKOHゾルFRSは、MALDI-TOF-MS、RP-HPLC-ESI-QTOF-MSおよびESI-MS nの組み合わせを用いて実行されるその後のメチル化との両方の天然及びメチル化オリゴ糖の詳細な構造解析です。エンドキシラナーゼは、KOH、ゾルAXSもまた、アノマーの設定に関する情報を提供し、核磁気共鳴(NMR)によって特徴付けられる消化しました。これらの技術は、適切なエンドヒドロラーゼを用いた多糖の他のクラスに適用することができます。
概要
ヘテロキシランは、草の主壁とすべての被子植物3-6の二次壁の主要な非セルロース多糖類である多糖類のファミリーです。キシランの骨格は、その種類及びグリコシル(グルクロン酸(グルクロン酸)、アラビノース(ARAF))および非グリコシル(O-アセチル、フェルラ酸)の組織型、発生段階および種7に応じ残基の置換パターンが異なります。
小麦の壁は( コムギ L.)の胚乳は、主にアラビノキシラン(AXS)(70%)と、(1→3)で構成されている(1→4)-β-D-グルカン(20%)、セルロースおよびheteromannansの少量で(2%ずつ)8。キシランバックボーンは、主に(主にO-2位およびより少ない程度にO-3位)置換モノおよびジ置換α-L-アラと(O-2およびO-3位)様々-未置換であってもよいですF残基9。ヘテロの還元末端(RE)(例えば、トウヒ( ドイツトウヒ ))(例えば、 シロイヌナズナ )双子葉植物からキシラン10と裸子植物11は、特徴的な四糖のグリコシル配列を含みます。 -β-D-XYL のp - (1→3)-α-L-RhaでのP - (1→2)-α-D-GalのP A-(1→4)-D-XYL pを。 (生物学的および工業用)ヘテロキシランの生合成と機能を理解するには、完全なタイプと置換のパターンだけでなく、還元末端(RE)のシーケンスを理解するためにキシランの骨格の配列を決定することが重要です。
端部(RE)とヘテロキシランの内部領域のグリコシル配列を低減する構造的特徴のために使用される特定の技術は、この原稿に記載されています。技術は、酵素(エンドキシラナーゼ)加水分解する前にヘテロキシラン鎖の還元末端(RE)(2アミノベンズアミド(2AB)で)タギングフォアに依存しています。特にRE配列決定のためのこのアプローチは、ました最初のニューヨーク研究所10,12-13によって報告されたが、現在は内部領域のシーケンシングを含むように拡張および分離のそのソースに関係なく、すべてのヘテロキシランにも等しく適用可能である確立された技術の組み合わせです。このアプローチは、(利用可能な)適切なエンドヒドロラーゼを用いた多糖の他のクラスに適用することができます。
説明したように、本 研究では、脱糊小麦胚乳細胞壁は、アルコール不溶性残留物(AIR)として単離し、順次水(W-ゾルFR)で抽出し、1MのKOHを、1%のNaBH 4(KOH-ゾル金曜日)を含みますRatnayakeでら (2014年)2。 FRSは、次に、メチル化され、両方のネイティブとメチル化オリゴ糖の詳細な構造分析は高速液体クロマトグラフィーを用いて、MALDI-TOF-MSの組み合わせを用いて実行ESI-QTOF-MS結合さW-及びKOH、ゾルの両方から放出されたオリゴ糖RP C-18カラムを使用してオンラインクロマトグラフィー分離およびESI-MS nを。エンドキシラナーゼは、KOH、ゾルAXSは、核磁気共鳴(NMR)によって特徴づけられた消化しました。
プロトコル
2 - アミノベンズアミドとのW-ゾルAXSの還元末端の1標識は、(RE)シュガー残渣(2AB)
- それらの蛍光誘導体多糖主鎖の還元末端を変換するために65℃で2時間、1 MのNaBH 3 CN(シアノ水素化ホウ素ナトリウム)(pHは5.5)の存在下で2AB(0.2 M)とW-ゾルAXSインキュベートします。
注意:それは水と接触しているときのNaBH 3 CNが有毒シアン化ガスを放出するように、次のステップは、ドラフト内で行うべきです。- 1 MのNaBH 3 CN溶液を調製するためにマイクロ遠心管(1.5mL)中(1mL)中のNaBH 3 CN(62.8 mg)を秤量し、水に溶解します。 65で加熱することにより、1 MのNaBH 3 CN溶液(1 ml)に2AB試薬(27.2 mg)を溶解 °C、10%酢酸でpHを5.5に反応混合物(0.2 M 2AB、1 MのNaBH 3 CN)のpHを調整し、。
- W-ように反応混合物を200μl(0.2 M 2AB、1 MのNaBH 3 CN)を追加しますキャップ付きガラス管におけるL AXS(1 mg)を、ボルテックスミキサーを用いて混合します。 65で2時間インキュベートします ドラフト内でCを°。 RTにサスペンションを冷却し、4巻を追加します。無水エタノールの。
- 多糖類を沈殿させるために冷蔵(4°C)O / N中の懸濁液を置きます。
- 遠心分離(1500×gで、10分、RT)、上清を除去します。各洗浄の間に遠心分離し、無水エタノール(4×)、アセトン(1×)およびメタノール(1×)で広範囲にペレットを洗浄。 40°CO / Nで真空乾燥しました。
注:大規模な洗浄は、残留2ABを削除します。
2 AB標識W-ゾルAXSからのキシロオリゴ糖の2世代
- 2ABは、マイクロ遠心チューブ内の酢酸ナトリウム緩衝液(100mMの、pHが5)(1.5ミリリットル)の500μlのW-ゾルAXS(1 mg)を標識した溶解させます。エンドキシラナーゼの4単位(GH 11を、[M1])を追加し、37℃でインキュベート 16時間Cを°。
- 反応MIXTを加熱することにより酵素活性を破壊します沸騰水浴中で10分間URE。 RTにサスペンションを冷却し、キャップ付きガラス管に移します。 4巻を追加します。無水エタノールおよび任意の未消化多糖類を沈殿させるために冷蔵(4°C)O / N中の懸濁液を置きます。
- 遠心分離(1,500×gで、10分間、RT)未消化多糖類(ペレット)を分離し、生成されたキシロオリゴ糖(上清)をエンドキシラナーゼします。きれいなガラス管に上清を除去し、温水浴(40℃)に配置します。
- エンドポイント体積(〜500μL)に、窒素ガス気流下でエタノールを蒸発させます。 4時間-80℃上清を凍結し、キシロオリゴ糖を回収するために凍結乾燥機で凍結した上清を乾燥させます。
3. KOH-ゾルAXSからのキシロオリゴ糖の生成と2ABラベリング
- (セクション2.1から2.4)のようにキシロオリゴ糖を生成するために、エンドキシラナーゼとKOH-ゾルAXS(GH 11、[M1])を扱います。
- endoxトリート(セクション1.1.1-1.1.2)上記のようにylanaseは2ABの反応混合物(0.2 M 2AB、1 MのNaBH 3 CN)でKOH-ゾルAXSからキシロオリゴ糖を生成しました。
- きれいなガラス管に上清を除去し、温水浴(40℃)に配置します。エンドポイント体積(〜500μL)に、窒素ガス気流下でエタノールを蒸発させます。 4時間-80℃上清を凍結し、キシロオリゴ糖を回収するために凍結乾燥機で凍結した上清を乾燥させます。
4. MALDI-TOF-MS
- MALDIマトリックス溶液の調製
- チューブ(MALDIマトリックス溶液)中の0.1%ギ酸を含む50%のアセトニトリル(500mL)中に2,5-dihydroxbenzoic酸(DHB)の小さなスクープを追加します。それは迅速に溶解場合、DHBの別の小さなスコップを追加し、ボルテックスを用いて混合します。注:MALDI-マトリックス溶液の最適濃度は10μgの/μlである-1。
- MALDIターゲットプレートの調製
- aqueoを堆積させます私たちのオリゴ糖(ネイティブ)のサンプル(5〜10μgの)(W-ゾルおよび/またはKOH-ゾル)MALDIターゲットプレート上に。独立したチップを用いて0.3μlのMALDI-マトリックス溶液を加え、ピペッティングにより混合します。混合物を室温で乾燥することができます。
注:適切に乾燥した試料は、スポットの中心に向かって指して長い針状結晶で構成する必要があります。デポジットはサンプルがあまりにも濃厚であるか、またはその塩からなることができるいずれかの粘着性および/またはべたつくであれば、そのような堆積物は、良好なスペクトルを生成する可能性は低いとサンプルをさらに精製する必要があります。 - MSソースにターゲットプレートを導入し、正(+ IVE)イオンモードで動作します。 70%を超えるにレーザーパワーを調整し、イオン源2でイオン源1と16.3キロボルトで19.0 kVのに加速電圧を調整します。 MALDI-ターゲットプレート上のサンプルスポットを選択して、レーザーショットを開始し、開始をクリックします。
注意:ターゲットのすべての領域は、信号を得られません。特定のスポットのみのいずれかに起因するいくつかのレーザーショットのための信号を与えますサンプル/マトリックス混合物または結晶の特性の枯渇。- 良好な信号対雑音比を得るために取得し、平均約200ランダムスペクトル中にターゲットの異なる領域にレーザーを移動します。
- aqueoを堆積させます私たちのオリゴ糖(ネイティブ)のサンプル(5〜10μgの)(W-ゾルおよび/またはKOH-ゾル)MALDIターゲットプレート上に。独立したチップを用いて0.3μlのMALDI-マトリックス溶液を加え、ピペッティングにより混合します。混合物を室温で乾燥することができます。
5. ESI-QTOF-MS
- 3.5μmのビーズ; RPのC-18カラム(75μmのX 150ミリメートルを使用してオンラインクロマトグラフ分離して飛行時間(QTOF)MS機器を四重極エレクトロスプレーイオン化(ESI)と結合されたナノHPLCを使用して、エンドキシラナーゼ、生成されたオリゴ糖(ネイティブ)を分析サイズ)。
- バイアルにエンドキシラナーゼが生成した水性オリゴ糖の混合物を移し、HPLCオートサンプラーに置きます。プログラム60分間にわたって、それぞれの移動相、0.1%(v / v)の水中のギ酸およびアセトニトリル中の0.1%(v / v)のギ酸を5-80%で溶出勾配を、。
- 0.2μL/分の流量を調整します。スキャン範囲内で正イオンモードを調整します300-1,600 のm / zと0.5のスキャンのスキャン速度の/次のように、第2のESI源条件を使用:カーテンガス10、GS1 4、ソース温度100℃で、イオンスプレー電圧2,300 V、デクラスタリング電位50をV.ランLCクロマトグラフプログラムと溶出オリゴ糖。得られたトータルイオンクロマトグラム(TIC)は、ソフトウェアによって自動的に保存されます。
- 保存TICを開き、抽出クロマトグラムを選択します。コマンドラインで期待塊( 例えば、271、403、535、667、799および931メートル/ z)を入力します。入力してくださいクリックしてクロマトグラムをスキャンします。製造元の指示14に従って、ソフトウェアを使用してESI-QTOF MSクロマトグラムデータの選択イオンスキャンを処理します。
6. ESI-MS nは
- シリンジを用いてナノスプレーチップに50%アセトニトリル中のサンプルごとのO-メチル化オリゴ糖の1から2μLを挿入(Pettolino ら 1によって記載されるようにメチル化)。トリムMSに取り付けられた個別のナノスプレーホルダーに適合するようにガラスカッターを使用してナノスプレーチップ。
- 正への期待質量範囲(200-1,500 メートル/ z)及びカーテンガス10、イオンスプレー電圧を1900 Vでの極性に応じて質量を設定します。
- 関連するウィンドウを開くには、[取得]ボタンを押して、全イオンスキャン(ESI-MS 1)を得るために、データファイル名を入力します。その後、STOPボタンを押してください。
- 関心のピークを断片化するプロダクトイオンからのスキャンタイプを変更します。質量範囲(200〜900メートル/ z)を断片化し、調整するために関心の質量( 例えば、885メートル/ z)を入力します。取得ボタンを押して、親イオンの全体の断片化(885メートル/ z)を達成し、フラグメントイオンスキャン(ESI-MS 2)を取得する(アップおよび/ またはダウン化合物]タブ内の)衝突エネルギーを調整します。
- 関心のフラグメントイオン( 例えば、711メートル/ z)の質量を入力し、質量範囲(200〜720メートル/ z)を調整します。取得ボタンANを押しますD前駆体イオン(711メートル/ z)の全体の断片化を達成し、フラグメントイオンスキャン(ESI-MS 3)を取得する衝突エネルギーを調整します。
7. H 1 NMR分光法
- プラスチック試験管(15ミリリットル)中2 O(1.0ミリリットル、99.9%)Dにオリゴ糖のエンドキシラナーゼ生成混合物(KOH-ゾル、天然型)(〜500μgの)を溶解します。 4時間-80℃で、懸濁液を凍結し、キシロオリゴ糖を回収するために凍結乾燥機で凍結されたサスペンションを乾燥させます。
- 完全にD 2 OとH 2 Oを交換するために二度7.1を繰り返します
- D 2 O(0.6ミリリットル、99.9%)で乾燥したオリゴ糖を溶解し、内部標準としてアセトン0.5μlの(D 2 O中の5%)を追加します。 NMR試料管に重水素化オリゴ糖を転送します。
- トップによって試料を含むNMRチューブを保持し、プラスチック製のスピナーにサンプル管を挿入します。サンプル深度ゲージでスピナーを置きます。膿サンプルの頂部および底部の深さゲージの中心線が等しいことを保証するために、試料の深さを調整するために、サンプルチューブをH又は引きます。
- 深さゲージを取り外し、クライオプローブを備えた600 MHzのNMR分光計に取り付けたオートサンプラーにサンプルを挿入します。
- ログインとオープン分光器制御ソフトウェア。サンプルファイル名を入力します。既存のデータセットを開き、新しい名前でそれを保存するために「EDC」コマンドを使用します。オートサンプラにサンプルの位置番号を入力し、「ENTER」キーを押します。
注:それは、プローブの上部に配置されます磁石ボアに優しく試料管をドロップします「ENTER」ボタンを押します。 - コマンドラインで「EDTE」と入力して所望のサンプル温度を設定します。次のステップに進む前に、所望の値に到達するために試料温度を待ちます。入力したコマンドラインで「ロック」と、適切な溶媒(D 2 O)を選択します。 &#を待ち34;ウィンドウの下部に表示されるように、完成した」というメッセージをロックします。
- コマンドラインで「atmm」と入力し、atmmメニューバーの上部にある「最適化」をクリックします。選択されたチャネル(この場合は1 H)のためのプローブのチューニングおよびマッチングのために開始を選択します。
- 均一な磁場は、コマンドラインで「ZG」と入力して、Enterによってsample.Acquireの周りに信号を得られるまで微調整が磁場に作られていたシミングプロセスのためのコマンドラインで「topshim」と入力します。
- 2.225 ppmのアセトンの内部標準を基準にして1 H化学シフトとメーカーの指示に従って、ソフトウェア15を使用してスペクトルを分析します。
結果
ら Ratnayakeから、2AB標識W-ゾルAXSのエンドキシラナーゼ消化は2AB標識REオリゴ糖と(2ABラベルなし)未標識の一連キシラン鎖( 図1の内部領域由来のオリゴ糖の混合物を生成します。 2)。クロマトグラフィー手法一連のその後の異性体の複雑な混合物を分画するために使用されます。最後に、MSの技術は、その後、MS n個技術により配列決定された異性体の構造を同定するために利用されます。ここでは、むしろ包括的なよりも、アプローチの例を代表を提示します。
2AB標識された天然のW-ゾルAXS( 図2A)由来のオリゴ糖のMALDI-TOF-MSスペクトルのシグナルは、標識されていない一連の表現のm / z 701、833、および965に非常に豊富な擬似分子イオンシリーズが挙げられます内部ニュートラルそれぞれ5-7 pentosyl残基(P 5-7)、を有する領域のオリゴ糖。 m / z 745、877、および1009年における信号のシリーズは、P 4-6 +ヘキサ1(ヘキスロン酸)を用いて、非標識酸性オリゴ糖シリーズように指定、また、この画分( 図2A)に存在します。 m / z 821および953での擬似分子イオンはそれぞれ、2AB標識オリジナルREオリゴ糖のP 5-6 + 2ABの存在を示します。
RP C-18 HPLCによるオリゴ糖のオンラインクロマトグラフィー分画とネイティブオリゴ糖のためのESI-QTOF-MS分析が実行される。 図2Bおよび2C、ESI-QTOF-MSトータルイオンから抽出された、選択されたイオンスキャンを示していますクロマトグラム(TIC)、W-ゾルFrのAXSからのエンドキシラナーゼによって放出オリゴ糖。信号はメートルで[M + NH 4] +として割り当てられた擬似分子イオン系列を含みますそれぞれ5-10 pentosyl残基(P 5-10)と内部領域中性オリゴ糖、( 図2B)の系列を表す/ zの696、828、960、1092、1224、および1356。いくつかの異性体構造が定義された質量のオリゴ糖(ESI-MS n分析下記参照)に対して可能です。 図2Bに見られるようしたがって、分子イオンスキャンの各々のための複数のピークが可能です。擬似分子[M + H] +としてのm / z 271、403、535、667、799で割り当てられたイオン、および931は、2ABの存在がそれぞれREオリゴ糖シリーズP 1-6 + 2AB、( 図2C)をラベル付けを示しています。 [M + H] +としてのm / z 613、745、877、1009、1141年にイオン、および1273検出された信号は、それぞれP 3-8 +ヘキサ1、( 図2C)で酸性オリゴ糖の存在を示します。 commelenid単子葉植物では、キシラン骨格はまた、フェノール酸で置換することができます、主にフェルラ酸(およびP -coumaric酸)、グルクロン酸と同じ分子量を有し、小麦胚乳細胞壁のW-ゾルAXSに検出することができます。しかし、W-とKOH-ゾルAXSのさらなる分析は、ESI-MS n個を使用して(と組成がメタノリシスを以下のTMS誘導体のGC-MS分析によって、ここには示していない)小麦の胚乳におけるP 3-8 +ヘキサ1酸性オリゴ糖を確認AXS。
m / z 271、403、535、[M + H] + 3.10から3.48分( 図2D)との間の領域のESI-Q-TOFフルスキャンスペクトルが2ABのシリーズはREオリゴ糖標識含みのイオンとして割り当てられた信号667、799、931、1063、および1195(P 1-8 + 2AB、それぞれ)。 3.59から4.05分( 図2E)との間の領域のESI-Q-TOFフルスキャンスペクトルの擬似分子イオンのシリーズは、酸性オリゴ糖が観察内部領域を表しますm / z 613、745、877、1009、および1141(それぞれP 3-7 +ヘキサ1)および[M + NH 4] +イオン:[M +のNa] +イオンの両方をd のm / z 740、 872、1004、1136、および1268(それぞれP 4-8 +ヘキサ1、)。
個々のオリゴ糖の配列を決定するために、我々はESI-MSを行ってn個あたり-O-メチル化オリゴ糖上ではなく、明確にネイティブオリゴ糖を配列決定することにより構造体を割り当てるために挑戦されているので、ゾル-WとKOH-ゾルAXSから得られる天然のオリゴ糖に。さらに、それはまた、材料のより大きな量を必要とします。 Pettolino らによって記載されるようにオリゴ糖のメチル化を行った。1。 ESI-MS のn KOH-ゾルAXS由来RE中性オリゴ糖のアルジトールで行わ調査、および2ABは、W-ゾルAXS由来の中性REオリゴ糖は、ベロに記載されているラベル付きスペクトルと推定される構造の解釈を支援するための一例として、ワット同様のアプローチは、酵素加水分解から生成されるすべてのオリゴ糖に適用することができます。 ESI-MS のnスペクトル中のフラグメントイオンはドモン&コステロに従ってYとBイオンと同定された。16非メチルヒドロキシル基(複数可)は、MS毎のO-メチル化オリゴ糖の気相フラグメンテーションの間に生成N A提供します分岐パターンおよびグリコシル配列を同定するために使用することができる14Daの質量差「瘢痕」。12-13フラグメンテーション事象によって生成された各傷を実線( 図3,4)としてマークされています。いくつかの異性体構造が定義された質量に対して可能であるように、これらの異性体構造で、YおよびBイオンは、それぞれ、赤と黒のラベルが付いています。
ESI-MS 2、ESI-MS 3およびESI-MS 4 SPECT擬似分子イオンのm / z 885のフラグメンテーションから生成あたり-O-メチル化RE中立オリゴグリコシルアルジトールのRA(P 4 XYL オール +)、図3に示されている。ESI-MS 2スペクトルが豊富Yを含み、 m / z 711、551、および391でイオンが親イオンから、それぞれ1つ、2つ、3つpentosyl残基の喪失によって生成します。豊富のm / z 711イオンは、非還元末端のXYL残基の喪失または末端側鎖アラ残基の喪失のどちらかによって発生させることができます。得られたスペクトルにおける診断のY のm / z 391のイオンは、RE XYLのオール残基またはAはREオリゴ糖上の側鎖のAra残基を有するREオリゴ糖からの3つの非還元末端XYL残基の損失から生成することができますRE XYLのオール残基から2 番目の XYL残基上の側鎖アラ残基。正式な可能性がありますが、そのような他の構造、これを引き起こすであろう4 -Xylのオール 、及び(アラ)XYL-XYL-XYL-XYLのオールを XYL これらの構造のイオンフラグメントは、それぞれ、分岐点に隣接するグリコシド結合で切断分解またはないであろういずれかの多糖を切断するために使用されるエンド - キシラナーゼの特異性として考慮から除外されています。それに応じて、診断Y のm / z 551イオンRE XYLのオール残基または側を有するREのオリゴ糖のいずれかの側鎖アラ残基を有するREオリゴ糖からの二つの非還元末端のXYL残基の喪失から生成することができます最後から二番目のXYL残基上チェーンアラ残基。 (I、II、III及びIV 図3)このように、四つの可能な異性体の構造が提案されていることができます。豊富なYイオンのm / z 377( 図3を参照してください:Ia及びIIa)およびBイオンのm / z 503( 図3参照:IA、IB、IVa族およびIVb)の異性体前駆体メートルのさらなるフラグメンテーションから生成しました/ Z 711イオンもこのスペクトルにおいて観察されます。 Iaの前駆イオンから生成; 711イオンはのm / z 537(2傷跡とP 2 + XYL OLのYイオンで 主要なピークを含ま異性体前駆体のm / zの断片化によって記録されたESI-MS 3スペクトル( 図3) 、IB、IIA、第IIb、IIIa族、IIIb族、IVa族およびIVb)と1つの傷跡とP 1 + XYLのオール のm / z 391(Yイオン、IIb族、IIIa族、IIIb族、IVa族およびIVbイオン前駆体から生成されます)。これらの二つの主要なピーク( のm / z 537 および m / zの 391)は、擬似のフラグメンテーションから生成された異性体前駆体のm / z 711イオンから、それぞれ、一方の損失および二つの非還元末端XYL残基によって生成することができます-molecular親イオンのm / ESI-MS 2中のz 885(P 4 + XYLのOL)。 precursoから生成された ; m / zの 377(2傷跡とP 1 + XYL OLのYイオンで 比較的低い存在量ピークRイオンIaの一瘢痕とP 2 + XYL OLのIIa)および551(Yイオン、Ib及びIIb族イオン前駆体から生成される)も、このスペクトルにおいて観察されました。
551イオンは主要のm / z 377(2傷跡とP 1 + XYL OLのYイオン)のピークとのm / z 391(P 1のYイオンを含ま異性体前駆体のm / zの断片化のESI-MS 4 )1傷跡とXYLのオール +構造IおよびIIの前駆イオンから生成されました。 、両方に取り付けられたアラ側鎖がRE XYL;そのための集団的な証拠は、REのグリコシルシーケンスが( 図3II診断断片化経路のm / z 885→711→551→391)RE XYLのオール残基に結合アラ側鎖から構成されていることを示唆しましたオール及び(RE XYLのオールから1 番目 XYL残基)最後から二番目のXYL残基(診断断片化経路のm / z 88→391→711→537 5; 図3III)→377、RE XYLのオールから最後から二番目(1 番目 XYLに添付のAra側鎖)XYL残基(診断断片化経路のm / z 885→711→537; 図3I)とアラ側鎖は、RE XYLのオール ( 図3IV)から2 番目の XYL残留物に取り付けられています。
[アラF - - (1→3)](+/-)-Xyl P - (→4 1):これらのイオンの存在が提案されている異性体構造I、II、IIIおよびIVとの中性REオリゴ糖構造を確認します- [アラF - (1→3)](+/-)-Xyl のp - (1→4) - [アラのF - (1→3)](+/-)-Xyl pを。
あたり-O-メチル化2ABのESI-MS 2スペクトルがfragmから生成されたREオリゴ糖を標識しました準分子[M +のNa]のentation + のm / z 871(P 4 + 2AB)でのイオンはこのスペクトルは、1でのm / z 697(P 3 + 2ABで最も豊富なYイオンが含まれ、図4に示します。瘢痕)、それぞれ、いずれか1つ、2つまたは3つの非還元pentosyl残基の喪失によって生成たm / z 537(P 1、瘢痕を有するもの瘢痕)とのm / z 377(P 1 + 2AB 2 + 2AB)。 m / z 537イオンが2つだけの端末XYL残基の喪失によって生成することができ、一方のm / z 697イオンは、非還元末端のXYL残基の喪失するか、端末のAra残基の喪失によって生成することができます。診断フラグメンテーション経路(→377メートル/ zの 871→697→537)は準分子イオンのm / z 871(P 4 + 2ABに相当するREで線形非分岐キシランバックボーンオリゴ糖(複数可)の存在があることを示唆しました)。しかし、線形非分岐キシロシルバックボーン(P 4 + 2AB)がsusceですさらに消化のためptibleサイトに固有のエンドキシラナーゼ。したがって、2つの異性体のm / z 697のイオンが存在することができます。従って二つの可能な異性体の構造は、(:IとII 図4)が提案されています。これらの異性体構造では、YとBのイオンはそれぞれ、赤と黒のラベルが付いています。 、 メートル ;異性体前駆体のm / zのフラグメント化から記録ESI-MS 3スペクトルは、697イオンは( 図4、構造Ia、Ib、IIaおよびIIb 2傷跡とP 2 + 2ABのYイオン) のm / z 523のイオンを生成し、 (; 図4、構造IaおよびIb 1傷跡とP 1 + 2AB) のm / z 377であり、Yイオン; / Z 363イオン( 図4、構造式IIa 2傷跡とP 1 + 2ABのYイオン)。 m / z 377でフラグメントイオンは、私だけとのm / z 363でフラグメントイオンのみが提案された構造IIから発生する可能性が提案された構造から生じ得ます。これらの二つのイオンの同時存在は、提案された構造IおよびIIを確認します。したがって、小麦胚乳AXSのキシランチェーンのREのグリコシルシーケンスは、RE XYL残基(断片化経路のm / z 871→697→523→363)、および/ または最後から二番目のXYL残基(断片化経路のm / zに添付のAra支店で構成され871→697→523→377)。
AXSのNMR分析
MSベースの分析では、アノマー配置(α/β)または酵素および物理的( 例えば、NMR)を含む他のアプローチによって得なければならない糖類のD / L配置のいずれかの情報を提供していません。特徴RE減少四糖(XYL-Rhaで-GALA-XYLのオール )とのヘテロキシランについては、NMRスペクトルは、このREオリゴ糖の同定および配列決定につながるアノマーシグナルが含まれています。我々は、DET、単一工程の方法として600MHzの1D 1 H-NMR分光法の使用を記載していますアノマー配置(α/β)および糖のD / Lの構成を含むKOH-ゾルFrの上で小麦胚乳のAX REオリゴ糖の完全なグリコシルシーケンスをオコジョ。共鳴は小麦AXオリゴ糖の公開割り当て17-18( 図5、 表1)に基づいて割り当てられました。小麦胚乳から抽出されたAXの1 H-NMRスペクトルは、O-3位に結合した末端α-L-アラのF残基のプロトンに割り当てられた5.39、5.27および5.22 ppmにアノマー化学シフトによって支配されます単独分岐鎖状の(1,4)-β-XYL のp骨格残基の(T-α-L-のAra F→3 S)とO-3の両方とO-2の位置(T-α-L-のAra F→3 Dと二重鎖、分岐(1,4)-β-XYL P骨格残基、それぞれ( 図5および表1)のT-α-L-アラF→2 D)。
5.41の信号がα-L-アラFの(T-α-L-のAra F→3 S + D)H1信号に割り当てられています側鎖が二重に分岐したβ-D-XYL pを隣接して単独で分枝β-D-XYLのp個の残基のO-3位に結合しました。 5.29の信号が二重に分岐鎖のβ-D-XYLのO-3位に結合したα-L-アラF側鎖の(T-α-L-アラF→3 D + D)H1信号に割り当てられています二重分岐鎖のβ-D-XYL pを隣接のp残基 。5.24の信号がに割り当てられているα-L-アラF側鎖のH1信号に接続されている(T-α-L-アラ→2 D + Dを f)二重分枝β-D-XYL pを隣接すると、二重分枝β-D-XYLのP残基のO-2位。


(A)( - 図2 MALDI-TOF MS(A)及びESI-QTOF MS(B E)2ABからのエンドキシラナーゼによって放出天然オリゴ糖の分析は、図1のMALDI-TOF MSスペクトルに概説されるようにW-ゾルAXS標識信号a再[M +のNa] +付加イオン)として同定されました。 RE由来C = P 1-6 + 2AB、内部領域のオリゴ糖由来B = P 5-10(信号が[M + NH 4] +付加イオンとして識別されます):ESI-QTOF MSクロマトグラムの選択されたイオンスキャンオリゴ糖(信号が[M + H] +付加イオンとして識別されている)&酸性オリゴ糖由来P 3-8 G(信号が[M +のNa] +付加イオンとして識別されている); D = ESI-Q-TOFフル3.59から4.05分の間の領域(信号が両方とも[M +のNa] +および[M + NH 4] +付加イオンとして識別されます。スキャンスペクトル:3.10から3.48分、E = ESI-Q-TOFフルスキャンスペクトルとの間の領域); P = pentosylユニット(アラまたはXYLのいずれか)。 G = uronosyl残基(グルクロン酸);エンドオリゴ糖を減らす= RE; 2AB = 2アミノベンズアミド; EIC:抽出イオンクロマトグラム。広告/ 53748 / 53748fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
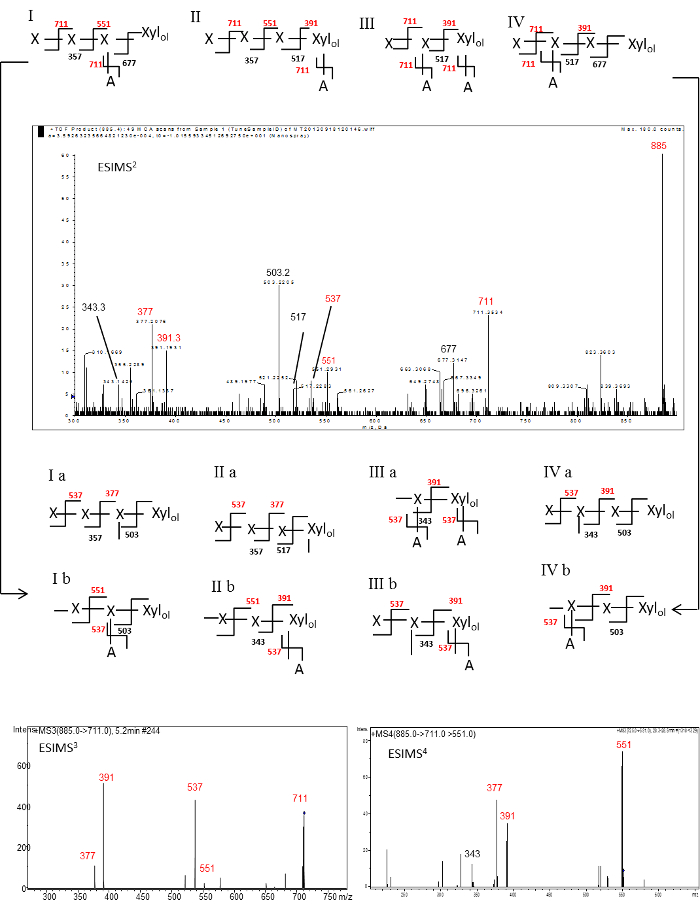
図3. ESI-MS 2、ESI-MS 3およびESI-MSあたり-O-メチル化RE中立グリコシルアルジトールの4スペクトル(P 4 + XYLのオール ) -信号は[Mとして割り当てられたm / z 885 +のNa] +擬似分子イオン付加物。定義された質量のためのいくつかの異性体構造が異性体構造で、その後可能であるため、YとBのイオンはそれぞれ、赤と黒のラベルが付いています。断片化イベントによって生成された各「傷跡」は実線としてマークされています。 X =キシロシル残基; A =アラビノシル残基。 ESI-MS 3スペクトルはRatnayake らの許可を得て再現されています。 (2014年)2。748fig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

m / z 871の信号は、[M +のNa] +擬似として割り当てられている- ESI-MS 2及びあたり-O-メチル化2ABが中立REオリゴ糖(P 4 + 2AB)を、標識のESI-MS 3スペクトル4図 -molecularイオン付加物。定義された質量のためのいくつかの異性体構造が異性体構造において可能であるように、YおよびBイオンがそれぞれ赤と黒のラベルが付いています。断片化イベントによって生成された各「傷跡」は実線としてマークされています。 X =キシロシル残基; A =アラビノシル残基。この図は、Ratnayake らの許可を得て再現されています。 (2014年)2。 大きい輸出自主規制を表示するには、こちらをクリックしてください。この図のイオン。

KOH-ソル神父のエンドキシラナーゼ処理により生成されたAXオリゴ糖の600MHzの1D 1 H-NMRスペクトルを 図5 アノマー領域 2.225 ppmのアセトンの内部標準を基準にして1 H化学シフト。 T-α-L-アラのF→3 S:単独で分枝β-D-XYLのp個の残基のO-3位に結合したα-L-アラF側鎖のH1信号。 T-α-L-アラF→2 D:二重分枝β-D-XYLのP残基のO-2位に結合したα-L-アラF側鎖のH1信号。 T-α-L-アラF→3 D:二重分岐鎖のβ-D-XYL pの残基のO-3位に結合したα-L-アラF側鎖のH1信号。 T-α-L-アラF→3 S + D:と単独分岐鎖のβ-D-XYL pの残基のO-3位に結合したα-L-アラF側鎖のH1信号が二重に分岐鎖の隣接するもの同士β-D- XYL pを。 T-α-L-アラF→2 D + D:二重分岐鎖のβ-D隣接して二重に分岐鎖のβ-D-XYL pの残基のO-2位に結合したα-L-アラF側鎖のH1信号-Xyl のp; T-α-L-アラF→3 D + D:二重分岐鎖のβ-D隣接して二重に分岐鎖のβ-D-XYL pの残基のO-3位に結合したα-L-アラF側鎖のH1信号-Xyl のp; 2-α-L-アラF→3 S:単独分岐鎖のβ-D-XYL pの残基のO-3位に結合した2-α-L-アラF側鎖残基のH1信号; 表示するには、こちらをクリックしてください。この図の拡大版。
| 糖残基 | H-1 / C-1 | H-2 / C-2 | H-3 / C-3 | H-4 / C-4 | H-5 当量 / C-5 | H-5 AX / C-5 |
| T-α-L-ARAF→3 S | 5.396 / 107.6 | 4.16 | 3.95 | 4.3 | 3.82 | 3.72 |
| T-α-L-ARAF | 5.415 / | 4.18 | 3.95 | |||
| →3 S + D | ||||||
| T-α-L-ARAF→2 D | 5.223 / | 4.16 | 3.97 | 3.82 | 3.74 | |
| T-α-L-ARAF→2 D + D | 5.243 / | 4.16 | 3.98 | |||
| T-α-L-ARAF→3 D | 5.272 / 108.9 | 4.18 | 3.96 | 4.26 | 3.79 | 3.74 |
| T-α-L-ARAF→3 D + D | 5.298 / | 4.18 | 3.96 | |||
| 2-α-L-ARAF→3 S | 5.548 / 106.4 | 4.27 | 4.06 | 4.3 | 3.82 | |
| α-Xylp(削減) | 5.185 / 91.9 | 3.55 | 3.72 | |||
| β-Xylp(削減) | 4.580 / 96.6 | 3.29 | 3.48 | 3.64 | 4.06 | 3.38 |
| β-4-Xylp | 4.470 / | 3.32 | 3.58 | |||
| β-4- Xylp + S | 4.461 | 3.31 | 3.56 | 3.75 | 4.08 | 3.36 |
| β-4-Xylp + D | 4.448 | 3.31 | 3.56 | 3.75 | 4.08 | 3.36 |
| β-3,4- Xylp | 4.518 / | 3.44 | 3.85 | |||
| S +β-3,4- Xylp | 4.514 / | 3.47 | 3.75 | 3.86 | 4.14 | 3.43 |
| D +β-3,4- Xylp | 4.505 | |||||
| β-3,4- Xylp + S | 4.492 | 3.45 | 3.74 | |||
| β-3,4- Xylp + D | 4.482 | 3.45 | 3.74 | |||
| β-2,3,4- Xylp | 4.638 | |||||
| S +β-2,3,4- Xylp | 4.627 | 3.59 | 3.87 | 3.88 | ||
| D +β-2,3,4- Xylp | 4.616 | |||||
| β-2,3,4- Xylp + S | 4.593 | |||||
| β-2,3,4- Xylp + D | 4.593 | |||||
| 化学シフトは2.225δ、内部アセトンに対して報告されています。 | ||||||
| Sは、単独で β-Xylp分枝鎖= | ||||||
| S + D =片方向分岐鎖のβ-Xylp +二重は、β-Xylp分枝 | ||||||
| D =二重分岐鎖のβ-Xylp | ||||||
| D + D =二重分岐鎖のβ-Xylp +二重は、β-Xylp分枝 | ||||||
小麦の胚乳KOH-ゾル神父のエンドキシラナーゼ処理により生成されたキシロオリゴ糖の 表1 の 1 H-NMRシグナル
ディスカッション
ほとんどのマトリックス相の細胞壁多糖類は、一見ランダムに植物種、発達段階および組織型3に応じて、非常に多様である(グリコシルおよび非グリコシル残基の両方を含む)の骨格を置換しています。多糖類は、第二の遺伝子産物であるので、それらの配列は、派生テンプレートされておらず、そのような彼らの配列決定のために、核酸およびタンパク質のために存在するとして単一の分析的アプローチは、したがって、ありません。精製された結合特異的加水分解酵素の利用可能性は、その後、クロマトグラフ分別することができるオリゴ糖の多糖を分解するための強力なツールを提供し、化学的および物理的な技術と組み合わせて使用される場合、完全に配列決定しました。課題は、その後、正常に対処することはまだある元の多糖類、配列1にこれらの複雑な混合物を再び組み立てることです。
ここでは、アプローチ(アプリケーションCAのその順序を記述しますnは構造的な還元末端(RE)の両方の特性評価およびヘテロキシランの内部領域のグリコシル配列(単数または複数)のための確立された酵素、化学的および物理的技術の統合に依存していること)に変化させること。オリゴ糖を特徴づけるために非常に有用であることが証明されているここに記述されていない追加の相補的な技術は、デュプリー19グループによって開発されたPACE(炭水化物ゲル電気泳動による多糖分析)であり、機器が利用可能な場合には、容易にこのプロトコルに統合することができます。また、LCクロマトグラフィーのバリエーションもタグなしの両方のような分離の可能性を提供RPクロマトグラフィーに続くタンデムインライン親水性相互作用クロマトグラフィー(HILIC)として、有用であることができる/シングルステップでオリゴ糖をタグ付けされました。技術は、酵素(エンドキシラナーゼ)加水分解する前にヘテロキシラン鎖の還元末端(RE)(2アミノベンズアミド(2AB)で)タグ付けに依存しています。 2つの異なるアプローチ(で概要を参照してください。図1)を採用しています。最初に、インタクトなW-ゾルAXSは、元のRE主鎖糖残基にタグを2ABで処理し、次いで、それぞれ、オリゴ糖の還元2AB標識REと内部領域との混合物を生成するためのエンドキシラナーゼで処理しました。第2のアプローチではKOH-ゾルFrが最初に、続いて2ABで標識されたオリゴ糖の混合物を生成するために、エンドキシラナーゼで加水分解されます。この後者のシナリオでは、それは還元剤を含有し、アルカリ抽出、水素化ホウ素ナトリウム(NaBH 4)の間にグリコシルアルジトールに還元されていたので、KOH-ゾルAXを2ABで標識されていないであろう、元のRE。したがって、2AB標識オリゴ糖は、ポストキシラナーゼ消化を生成し、「内部」オリゴ糖から発信され、元のREオリゴ糖は、( 図1を参照)2ABタグなしREのアルジトールが含まれています。このアプローチはまた、多糖類のuの他のクラスに適用することができます(利用可能)適切なエンド - 加水分解酵素を歌います。
nは MSに当たりO-メチル化オリゴ糖の気相フラグメンテーション中に生成非メチル化ヒドロキシル基(複数可)は、14Daの質量差」瘢痕を提供するので、MSベースのアプローチは、著しくエンドキシラナーゼ処理後に生成されたオリゴ糖のメチル化によって増強されます「それは分岐パターンおよびグリコシル配列の同定を補助するために使用することができる。5-6 pentosyl残基(及び任意の糖残基)の同一性は、単独でMSデータから作られたが、の知識を有するから来ることができません分子の組成物;これが利用できない場合、関連する単糖との結合分析は、MS n内のこれらの割り当てを行う前に実行する必要があります。さらにKOH-ゾル神父から生成されたRE酸性オリゴ糖のアルジトール、に対応する信号(XYL 3 -MeGlcA-キシリトールた:m / z 761)およびCHaracteristic双子葉キシランREのグリコシルシーケンス(XYL 2 -RHA-GALA-キシリトールた:m / z 761)、存在する場合、天然の形態で同一の分子質量は両方のように区別することができていませんが、そのMSフラグメンテーションと区別することができます(最高のメチル化オリゴ糖上で実行されるMS n)のスペクトル。最後に、MSベースの技術は、グリコシド結合のアノマー配置(α/β)またはsugars-のD / L配置のいずれかに関する情報を提供することができないこれは、例えば (酵素的および物理などの、別の方法によって決定されなければなりませんNMR)。
開示事項
We have nothing to disclose.
謝辞
This project was supported by funds from Commonwealth Scientific and Research Organisation Flagship Collaborative Research Program, provided to the High Fibre Grains Cluster via the Food Futures Flagship. AB also acknowledges the support of an Australia Research Council (ARC) grant to the ARC Centre of Excellence in Plant Cell Walls (CE110001007).
資料
| Name | Company | Catalog Number | Comments |
| 2 aminobenzamide (2AB) | Sigma-Aldrich (www.sigmaaldrich.com) | A89804 | |
| sodium borohydride (NaBH4) | Sigma-Aldrich (www.sigmaaldrich.com) | 247677 | Hazardous, handle with care |
| sodium cyanoborohydride (NaBH3CN) | Sigma-Aldrich (www.sigmaaldrich.com) | 156159 | Hazardous, handle with care |
| endo-1,4-β-Xylanase M1 (from Trichoderma viride) (120101a) | Megazyme (www.megazyme.com) | E-XYTR1 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich (www.sigmaaldrich.com) | 151882 | |
| Freeze dryer (CHRIST-ALPHA 1-4 LD plus) | |||
| RP C18 Zorbax eclipse plus column | Agilent | (2.1×100 mm; 1.8 µm bead size) | |
| MicroFlex MALDI-TOF MS (Model - MicroFlex LR) | (Bruker Daltonics, Germany) | ||
| (ESI) -(QTOF) MS (Model # 6520) | (Agilent, Palo Alto, CA ) | ||
| ESI-MSn - ion-trap (Model # 1100 HCT) | (Agilent, Palo Alto, CA). | ||
| Bruker Avance III 600 MHz -NMR | Bruker Daltonics, Germany | ||
| Topspin (version 3.0)-Biospin- software | Bruker | ||
| GC-MS (Model # 7890B) | Agilent |
参考文献
- Pettolino, F. A., Walsh, C., Fincher, G. B., Bacic, A. Determining the polysaccharide composition of plant cell walls. Nature Protocols. 7, 1590-1607 (2012).
- Ratnayake, S., Beahan, C. T., Callahan, D. L., Bacic, A. The reducing end sequence of wheat endosperm cell wall arabinoxylans. Carbohydr. Res. 386, 23-32 (2014).
- Bacic, A., Harris, P. J., Stone, B. A., Preiss, J. . The Biochemistry of Plants, Vol. 14, Carbohydrates. 14, 297-371 (1988).
- York, W. S., O'Neill, M. A. Biochemical control of xylan biosynthesis - which end is up?. Plant Biol. 11, 258-265 (2008).
- Fincher, G. B. Revolutionary times in our understanding of cell wall biosynthesis and remodeling in the grasses. Plant Physiol. 149, 27-37 (2009).
- Faik, A. Xylan Biosynthesis: News from the Grass. Plant Physiol. 153, 396-402 (2010).
- Scheller, H. V., Ulskov, P. Hemicelluloses. Annu. Rev. Plant Biol. 61, 263-289 (2010).
- Bacic, A., Stone, B. A (1→3)- and (1→4)-linked β-D-glucan in the endosperm cell-wall of wheat. Carbohydr. Res. 82 (13), 372-377 (1980).
- Comino, P., Collins, H., Lahnstein, J., Beahan, C., Gidley, M. J. Characterisation of soluble and insoluble cell wall fractions from rye, wheat and hull-less barley endosperm flours. Food Hydrocolloids. 41, 219-226 (2014).
- Pena, M. J., et al. Arabidopsis irregular xylem8 and irregular xylem9: Implicationsfor the Complexity of Glucuronoxylan Biosynthesis. Plant Cell. 19, 549-563 (2007).
- Andersson, S. I., Samuelson, O., Ishihara, M., Shimizu, K. Structure of the reducing end-groups in Spruce xylan. Carbohydr. Res. 111, 283-288 (1983).
- Mazumder, K., York, W. S. Structural analysis of arabinoxylans isolated from ball-milled switchgrass biomass. Carbohydr. Res. 345, 2183-2193 (2010).
- Kulkarni, A. R., et al. The ability of land plants to synthesize glucuronoxylans predates the evolution of tracheophytes. Glycobiol. 22 (2012), 439-451 (2012).
- . . Agilent MassHunter Workstation Software - Quantitative Analysis Familiarization Guide. , (2010).
- . . Topspin User Manual. , (2010).
- Domon, B., Costello, C. E. A systematic nomenclature for carbohydrate fragmentation in FAB-MS/MS spectra of glycoconjugates. Glycoconjugate. J. 5, 397-409 (1988).
- Hoffmann, R. A., Leeflang, B. R., De Barse, M. M. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H-n.m.r. spectroscopy of oligosaccharides, derived from arabinoxylans of white endosperm of wheat, that contain the elements ----4)[alpha-L-Araf-(1----3)]-beta-D-Xylp-(1---- or ----4)[alpha- L-Araf-(1----2)][alpha-L-Araf-(1----3)]-beta-D-Xylp-(1----. Carbohydr. Res. 221, 63-81 (1991).
- Gruppen, H., Hoffmann, R. A., Kormelink, F. J. M., Voragen, A. G. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H NMR spectroscopy of enzymically derived oligosaccharides from alkali-extractable wheat-flour arabinoxylan. Carbohydr. Res. 233, 45-64 (1992).
- Kosik, O., Bromley, J. R., Busse-Wicher, M., Zhang, Z., Dupree, P. Studies of enzymatic cleavage of cellulose using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Methods Enzymol. 510, 51-67 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved