Method Article
Sequenciamento de parede planta heteroxilanos Usando enzimática, química (metilação) e físico (espectrometria de massa, ressonância magnética nuclear) Técnicas
Neste Artigo
Resumo
This protocol describes the specific techniques used for the structural characterization of reducing end (RE) and internal region glycosyl sequence(s) of heteroxylans by tagging the RE with 2 aminobenzamide prior to enzymatic (endoxylanase) hydrolysis and then analysis of the resultant oligosaccharides using mass spectrometry (MS) and nuclear magnetic resonance (NMR).
Resumo
Este protocolo descreve as técnicas específicas utilizadas para a caracterização de reduzir extremidade (RE) e a sequência de glicosilo região interna (s) de heteroxilanos. As paredes celulares do endosperma do trigo de-engomados foram isolados como um resíduo de álcool insolúvel (AR) 1 e sequencialmente extraída com água (W-Sol Pe) e 1 M de KOH contendo 1% NaBH4 (KOH-Sol Fr) como descrito por Ratnayake et al. (2014) 2. Duas abordagens diferentes (ver o resumo na Figura 1) são adotados. No primeiro, AXs W-Sol intactas são tratados com 2AB para marcar o RE espinha dorsal resíduo de açúcar cadeia original e, em seguida, tratada com uma endoxilanase para gerar uma mistura de RE marcado com 2AB região interna e reduzindo oligossacidos, respectivamente. Numa segunda abordagem, o FR-Sol KOH é hidrolisado com endoxilanase a primeira geração de uma mistura de oligossacáridos, que são, subsequentemente, rotulados com 2AB. Os enzimaticamente liberados ((ONU) tag) oligossacarídeos de ambosW- e Pes de KOH-SOL são então metilado e a análise estrutural detalhada de ambos os oligossacáridos nativos e metilados é realizada usando uma combinação de MALDI-TOF-MS, de RP-HPLC-ESI-MS e QTOF-ESI-MS n. Endoxilanase digerido KOH-Sol AXs são também caracterizados por ressonância magnética nuclear (RMN) que também fornece informações sobre a configuração anomérica. Estas técnicas podem ser aplicadas a outras classes de polissacáridos, utilizando os endo-hidrolases adequadas.
Introdução
Heteroxilanos são uma família de polissacarídeos que são predominantes os polissacáridos não celulósicas das paredes primárias de gramíneas e as paredes secundárias de todas as angiospérmicas 3-6. Os backbones xylan diferem em seus tipos e padrões de substituição com glicosil (ácido glucurónico (GlcA), arabinose (Araf)) e de resíduos, dependendo do tipo de tecido, estágio de desenvolvimento e de espécies não-7 glicosilo (O-acetil, ácido ferúlico).
Paredes de trigo (Triticum aestivum L.) endosperma são compostos principalmente de arabinoxilanos (AXs) (70%) e (1 → 3) (1 → 4) glucanos -β-D-(20%) com quantidades menores de celulose e heteromannans (2% cada) 8. A espinha dorsal xilano pode ser variadamente não-substituído e predominantemente mono-substituído (principalmente O-2 posição e, em menor extensão O na posição 3) e (O-2 e O-3 posições) com α-L-Ara di-substituído F 9 resíduos. A extremidade redutora (RE) de heteroxilanas de dicotiledóneas (por exemplo, de Arabidopsis thaliana 10) e gimnospermas (por exemplo, abeto vermelho (Picea abies) 11) contém uma sequência de tetrassacárido glicosilo característicos; -β-D-Xil P - (1 → 3) -α-L-Rha P - (1 → 2) -α-D-Gal P A- (1 → 4) -D-Xil p. Para compreender a biossíntese e função (biológica e industrial) heteroxylan, é importante para sequenciar completamente a espinha dorsal xilano de compreender os tipos e os padrões de substituição, bem como a sequência da extremidade redutora (RE).
As técnicas específicas utilizadas para a caracterização estrutural de redução final (RE) e sequência glicosil região interna (s) de heteroxilanos são descritos neste manuscrito. As técnicas dependem de fluoróforo marcação (com 2 aminobenzamida (2AB)) na extremidade redutora (RE) da cadeia heteroxylan antes enzimática (endoxilanase) hidrólise. Esta abordagem, em particular para a sequenciação RE, estavaprimeiro reportados pelo laboratório Iorque 10,12-13 mas agora é alargado para incluir a sequência e a região interna é uma combinação de técnicas estabelecidas que é igualmente adaptável a todos os heteroxilanos, independentemente da sua fonte de isolamento. Esta abordagem também pode ser aplicada a outras classes de polissacáridos usando (quando disponíveis), os endo-hidrolases adequadas.
No presente estudo, as paredes celulares do endosperma do trigo engomado-de foram isolados como um resíduo de álcool insolúvel (AR) e sequencialmente extraída com água (W-Sol Pe) e KOH 1M contendo 1% de NaBH 4 (KOH-Sol Fr) como descrito em Ratnayake et al. (2014) 2. Os oligossacidos libertados de ambos W- e Pes de KOH-SOL são então metilado e a análise estrutural detalhada dos oligossacidos nativos e metilados é realizada usando uma combinação de MALDI-TOF-MS, ESI-MS-QTOF-acoplado com HPLC, com a separação cromatográfica utilizando uma linha de RP C-18 de colunae n ESI-MS. Endoxilanase digerido KOH-Sol AXs também foi caracterizado por ressonância magnética nuclear (RMN).
Protocolo
1. A rotulagem do Fim Reduzir (RE) resíduo de açúcar de AXs W-sol com 2-aminobenzamida (2AB)
- Incubar AXs W-sol com 2AB (0,2 M) na presença de 1 M de NaBH3CN (cianoboro-hidreto de sódio) (pH 5,5) durante 2 h a 65 ° C para converter as extremidades redutoras das cadeias de polissacárido espinha dorsal de seus derivados fluorescentes.
CUIDADO: O passo seguinte deve ser realizada na capela como NaBH3CN libera o gás venenoso cianureto quando está em contacto com a água.- Pesar NaBH3CN (62,8 mg) e dissolver em ua (1 mL) num tubo de microcentrifugação (1,5 ml) para preparar uma solução 1 M de NaBH3CN. Dissolve-se o reagente 2AB (27,2 mg) numa solução 1 M de NaBH3CN (1 ml) por aquecimento a 65 ° C e ajustar o pH da mistura de reacção (0,2 M 2AB, 1 M de NaBH3CN) para pH 5,5 com ácido acético a 10%.
- Adicionar 200 uL de mistura de reacção (0,2 M 2AB, 1 M de NaBH3CN) para W-assiml AXs (1 mg) em um tubo de vidro com uma tampa e misture utilizando um misturador de vórtice. Incubar durante 2 horas a 65 ° C em um exaustor. Arrefece-se a suspensão até à temperatura ambiente e adicionar 4 vols. de etanol absoluto.
- Colocar a suspensão num armazenamento a frio (4 ° C) O / N para precipitar polissacarídeos.
- Centrífuga (1500 xg, 10 min, RT) para remover o sobrenadante. Lava-se a pelete extensivamente com etanol absoluto (4x), acetona (1x) e metanol (1x), centrifugação entre cada lavagem. Secar sob vácuo a 40 ° CO / N.
Nota: Ampla de lavar também remove 2AB residual.
2. Geração de xilo-oligossacarídeos de 2 AB etiquetado W-sol AXs
- Dissolver 2AB marcado W-Sol AXs (1 mg) em 500 ul de tampão de acetato de sódio (100 mM, pH 5) num tubo de microcentrifugação (1,5 ml). Adicionar 4 unidades de endoxilanase de GH (11, [M1]) e incubar a 37 ° C durante 16 horas.
- Destruir a actividade da enzima por aquecimento dos MIXT reaccionaisure durante 10 min num banho de água a ferver. Arrefece-se a suspensão até à temperatura ambiente e transferir para um tubo de vidro com tampa. Adicione 4 vols. de etanol absoluto e colocar a suspensão em um armazenamento a frio (4 ° C) O / N para precipitar os polissacáridos não digeridos.
- Centrífuga (1500 xg, 10 min, RT) para separar polissacáridos não digeridos (grânulo) e endoxilanase gerado xilo-oligossacáridos (sobrenadante). Decantar o sobrenadante para um tubo de vidro limpo e colocá-lo em um banho de água quente (40 ° C).
- Evapora-se o etanol sob uma corrente de gás de azoto para um volume de ponto final (~ 500 mL). Congela-se o sobrenadante a -80 ° C durante 4 h e o sobrenadante seco congelada num secador por congelação para se recuperar xilo-oligossacáridos.
3. Geração de xilo-oligossacarídeos de KOH-sol AXs e Rotulagem 2AB
- Tratar KOH-Sol AXs com endoxilanase (GH 11, [M1]) para gerar xilo-oligossacáridos como descrito acima (secções de 2,1-2,4).
- Trate endoxylanase gerado xilo-oligossacáridos a partir de KOH-Sol AXs com mistura reaccional 2AB (0,2 M 2AB, 1 M de NaBH3CN) como descrito acima (secções 1.1.1-1.1.2).
- Decantar o sobrenadante para um tubo de vidro limpo e colocá-lo em um banho de água quente (40 ° C). Evapora-se o etanol sob uma corrente de gás de azoto para um volume de ponto final (~ 500 mL). Congela-se o sobrenadante a -80 ° C durante 4 h e o sobrenadante seco congelada num secador por congelação para se recuperar xilo-oligossacáridos.
4. MALDI-TOF-MS encontrado
- Preparação de Solução de MALDI-matriz
- Adicionar uma pequena colher de 2, 5-ácido dihydroxbenzoic (DHB) a 50% de acetonitrilo (500 ml) contendo 0,1% de ácido fórmico em um tubo (solução-matriz MALDI). Misture usando um vortex, se dissolve rapidamente, adicione outra pequena colher de DHB. Nota: concentração ideal de solução de MALDI-matriz é 10 mg / mL -1.
- Preparação da placa alvo de MALDI-
- Depositar o aqueonos oligossacárido amostras (nativas) (5-10 ug) (W-Sol e / ou KOH-Sol) numa placa de MALDI-alvo. Adicionar solução de MALDI-matriz de 0,3 mL utilizando uma ponta separada e misture pipetando cima e para baixo. Permitir que a mistura se secar à temperatura ambiente.
Observação: as amostras devidamente secas deve consistir de cristais em forma de agulha comprida apontando para o centro do local. Se o depósito não é pegajoso e / ou manchada na amostra podem ser quer demasiado concentrada ou consistem em sais, estes depósitos não são susceptíveis de produzir um bom espectro e a amostra deve ser ainda purificado. - Introduzir a placa-alvo para a fonte MS e operar em modo de ião positivo (+ ive). Ajustar a voltagem do acelerador de 19,0 kV na fonte iónica 1 e 16,3 kV na fonte iónica 2. Ajustar a potência do laser para mais do que 70%. Selecione o local da amostra na placa MALDI-alvo e clique em Iniciar para começar a disparos de laser.
Nota: Todas as áreas do alvo não produzirá sinais. Um ponto particular só irá dar um sinal para alguns disparos de laser devidas quer adepleção da mistura amostra / matriz ou as características do cristal.- Mova o laser para diferentes áreas do alvo durante a aquisição e média, cerca de 200 espectros aleatória para obter o sinal-ruído satisfatório.
- Depositar o aqueonos oligossacárido amostras (nativas) (5-10 ug) (W-Sol e / ou KOH-Sol) numa placa de MALDI-alvo. Adicionar solução de MALDI-matriz de 0,3 mL utilizando uma ponta separada e misture pipetando cima e para baixo. Permitir que a mistura se secar à temperatura ambiente.
5. ESI-MS-QTOF
- Analise oligossacáridos gerado-endoxilanase (nativo) usando nano-HPLC acoplado com uma ionização por electrospray (ESI) tempo de quadrupolo de voo do instrumento (QTOF) MS com separação cromatográfica em linha usando um RP coluna C-18 (75 um x 150 mm; 3,5 um grânulo tamanho).
- Transferir a mistura de oligossacáridos aquosas gerado-endoxilanase para um frasco e colocá-las no amostrador automático de HPLC. Programar o gradiente de eluição de 5-80% com as fases móveis 0,1% (v / v) de ácido fórmico em água e 0,1% (v / v) de ácido fórmico em acetonitrilo, respectivamente, durante 60 min.
- Ajustar a taxa de fluxo de 0,2 mL / min. Ajuste o modo de ião positivo na faixa de varredurade 300-1,600 m / z e uma taxa de varredura de 0,5 varreduras / segundo, utilizando as condições da fonte de ESI da seguinte forma: Cortina de gás 10, GS1 4, temperatura da fonte de 100 ° C, tensão de pulverização de iões de 2.300 V, e de-agrupamento potencial de 50 V. Execute o programa LC cromatográfica e oligossacarídeos eluir. O cromatograma iónico total resultante (TIC) é salvo automaticamente pelo software.
- Abra o TIC salva e selecione extrato cromatograma. Tipo as massas esperadas (por exemplo, 271, 403, 535, 667, 799 e 931 m / z) na linha de comando. cromatograma digitalização clicando Enter. Processar os varrimentos de iões seleccionados dos dados do cromatograma ESI-MS QTOF utilizando software de acordo com as instruções do fabricante 14.
6. ESI-MS N
- Inserção de 1 a 2 ul de per-O-metilado oligosacárido (metilado como descrito por Pettolino et ai. 1) da amostra em 50% de acetonitrilo em uma ponta de nanospray, utilizando uma seringa. aparara ponta nano-pulverização usando um cortador de vidro para se ajustar dentro do suporte de nano-pulverização a discreto ligado à MS.
- Definir a massa de acordo com o intervalo esperado de massa (200-1,500 m / z) e gás de cortina para 10, a tensão ionspray a 1.900 V e polaridade para positiva.
- Pressione o botão AQUISIÇÃO para abrir a janela relevante, digite o nome do arquivo de dados para obter uma varredura total de iões (ESI-MS 1). Em seguida, pressione o botão STOP.
- Alterar o tipo de digitalização a partir de íons produto para fragmentar um pico de interesse. Indicar a massa de interesse (por exemplo, 885 m / z) para fragmentar e ajustar a faixa de massa (200-900 m / z). Pressione o botão de adquirir e ajustar a energia de colisão (para cima e / ou para baixo na guia composto) para atingir toda a fragmentação do ião pai (885 m / z) e adquirir uma varredura fragmento ion (ESI-MS 2).
- Indicar a massa de iões de fragmento de interesse (por exemplo, 711 m / z) e ajustar a faixa de massa (200-720 m / z). Pressione o botão de adquirir umd ajustar a energia de colisão para alcançar toda a fragmentação do ião precursor (711 m / z) e adquirir um fragmento de verificação de iões (ESI-MS 3).
7. H 1 RMN Espectroscopia
- Dissolve-se endoxilanase gerado mistura de oligossacáridos (KOH-Sol, forma nativa) (~ 500 mg) em D 2 O (1,0 mL, 99,9%) num tubo de ensaio de plástico (15 ml). Congelar a suspensão a -80 ° C durante 4 h e seca-se a suspensão congelada num secador por congelação para se recuperar xilo-oligossacáridos.
- Repita duas vezes 7.1 a fim de trocar completamente a H2O com D 2 O.
- Dissolver oligossacáridos secas em D 2 O (0,6 mL, 99,9%) e adicionar 0,5 mL de acetona (5% em D 2 O) como um padrão interno. Transferir os oligossacáridos deuterados para o tubo de amostra de RMN.
- Segure o tubo contendo a amostra NMR por cima e inserir o tubo de amostra em um spinner de plástico. Coloque o botão rotativo no medidor de profundidade amostra. Push ou puxar o tubo de amostra para ajustar a profundidade da amostra para assegurar que a linha de centro da parte superior da amostra e indicadores de profundidade inferior são iguais.
- Remover o medidor de profundidade e inserir a amostra para o amostrador automático acoplado a um espectrómetro de RMN de 600 MHz equipado com uma crio-sonda.
- Login e software de controle espectrômetro aberto. Digite o nome do arquivo de amostra. Abrir um conjunto de dados existente e, em seguida, use o comando "EDC" para salvá-lo com um novo nome. Digite o número da posição da amostra no amostrador automático e pressione "Enter".
Nota: Pressionar o botão "ENTER" vai cair o tubo de amostra suavemente para o magneto onde será posicionado na parte superior da sonda. - Definir a temperatura da amostra desejado, digitando "edte" na linha de comando. Espera para a temperatura da amostra até atingir o valor desejado antes de prosseguir para o próximo passo. Enter "bloquear" na linha de comando e selecione solvente apropriado (D 2 O). Espere pelo " bloquear mensagem acabada "para aparecer na parte inferior da janela.
- Digite "ATMM" na linha de comando e clique em "otimizar" no topo da barra de menu ATMM. Escolha Iniciar para o ajuste e combinação da sonda para o canal selecionado (1 H, neste caso).
- Digite "topshim" na linha de comando para o processo de calços em que pequenos ajustes são feitos para o campo magnético até campo magnético uniforme é conseguido em torno do sample.Acquire o sinal, digitando "zg" na linha de comando e digite.
- Analisar os espectros utilizando o software 15 de acordo com as instruções do fabricante, com um desvio químico H referenciado a um padrão interno de acetona a 2.225 ppm.
Resultados
Digestão da endoxilanase de 2AB marcado W-Sol AXs gera uma mistura de oligossacáridos RE marcado com 2AB e uma série de oligossacáridos (sem rótulo 2AB) marcado com un derivadas das regiões internas da cadeia de xilano (Figura 1; a partir Ratnayake et ai. 2). Uma série de abordagens cromatográficos é então utilizado para fraccionar a mistura complexa de isómeros. Finalmente, técnicas de MS são utilizados para identificar as estruturas isoméricas que são então sequenciados por MS N técnicas. Apresentamos aqui um representante, em vez de exaustiva, exemplo da abordagem.
Os sinais do espectro de MALDI-TOF-MS de oligossacáridos derivados da marcado com 2AB nativa W-Sol AXs (Figura 2A) incluem uma série altamente abundante pseudo-molecular de iões a m / z 701, 833, e 965 que representa uma série de não marcado neutra internaoligossacáridos região com 5-7 resíduos de pentosilo (P 5-7), respectivamente. Uma série de sinais a m / z 745, 877, e 1009, que designa uma série de oligossacáridos ácida não marcado, com 4-6 P + 1 HexA (ácido hexurónico), também está presente nesta fracção (Figura 2A). Iões pseudo-molecular para m / z 821 e 953 indicam a presença da marcado com 2AB inicial oligossacáridos RE P 5-6 + 2AB, respectivamente.
A análise ESI-QTOF-MS para os oligossacáridos nativos com um fraccionamento em linha cromatográfica de oligossacáridos por RP HPLC C-18 é então realizada. A Figura 2B e 2C, mostra as verificações de iões seleccionados, extraídos total de iões ESI-QTOF-MS cromatograma (TIC), de oligossacarídeos liberados por endoxilanase de W-sol Pe AXs. Os sinais incluem uma série de ião pseudo-molecular designado como [M + NH4] + a m/ z 696, 828, 960, 1092, 1224, 1356 e representando uma série de oligossacáridos neutros região interna com 5-10 resíduos de pentosilo P (5-10), respectivamente (Figura 2B). Várias estruturas isoméricas são possíveis para um oligossacárido de uma massa definida (ver abaixo ESI-MS N análise). Daí os múltiplos picos para cada um dos varreduras de iões moleculares são possíveis como se observa na Figura 2B. Iões pseudo-molecular designados como [M + H] + a m / z 271, 403, 535, 667, 799, e 931 indicam a presença de uma série 2AB marcado RE oligossacárido P 1-6 + 2AB, respectivamente (Figura 2C) . Os sinais detectados como [M + H] + iões a m / z 613, 745, 877, 1009, 1141, e 1273 indicam a presença de um oligossacáridos acídicos com 3-8 P + HexA 1, respectivamente (Figura 2C). Nos monocotiledóneas commelenid, a espinha dorsal xilano também pode ser substituído com os ácidos fenólicos,principalmente ácido ferúlico (e também ácido p--coumaric), que tem a mesma massa molecular, como o ácido glucurónico e pode ser detectada em W-Sol AXs das paredes celulares do endosperma do trigo. No entanto, uma análise mais aprofundada de W- e KOH-Sol AXs utilizando ESI-MS n (e composicional análises por GC-MS de derivados de TMS seguinte metanólise, não mostrado aqui) confirmam os oligossacáridos acídicos com P 3-8 1 + HexA em endosperma de trigo AXs.
Os sinais atribuídos como [M + H] + iões de ESI-Q-TOF espectro de varrimento total da região entre 3,10-3,48 min (Figura 2D) inclui uma série de oligossacáridos 2AB marcado RE: m / z 271, 403, 535, 667, 799, 931, 1063, e 1195 (P + 2AB 1-8, respectivamente). Uma série de iões pseudo-molecular na ESI-Q-TOF espectro de varrimento total da região entre 3,59-4,05 min (Figura 2E) representam os oligossacáridos ácidos região interna observard tanto como [M + Na] + iões: m / z 613, 745, 877, 1009, e 1141 (P + 7/3 HexA 1, respectivamente) e [M + NH4] + iões: m / z 740, 872, 1004, 1136, e 1268 (P + 8/4 HexA 1, respectivamente).
De modo a sequenciar os oligossacáridos individuais, foi realizada a ESI-MS N na per-O-metilado oligossacáridos em vez de sobre os oligossacidos nativos obtidos a partir de W-Sol e KOH-Sol AXs uma vez que é um desafio para atribuir inequivocamente estruturas por sequenciação de oligossacáridos nativos . Além disso, também requer maiores quantidades de material. A metilação dos oligossacarídeos foi levada a cabo tal como descrito por Pettolino et ai. 1. O ESI-MS n investigações realizadas sobre a re neutro alditols oligossacarídeos derivados de AXs KOH-sol, e 2AB marcado neutra oligossacarídeos RE derivado de AXs W-sol são descritos BeloW como um exemplo para ajudar na interpretação do espectro e estruturas deduzidas. A mesma abordagem pode ser aplicada a todos os oligossacáridos gerados a partir de hidrólise enzimática. Os iões do fragmento no espectro de ESI-MS N foram identificados como os iões Y e B de acordo com Domon & Costello. 16 grupo hidroxilo Un-metilado (s) gerada durante a fragmentação em fase gasosa de per-O-metilado oligossacáridos em MS n fornece um 14DA diferença de massa "cicatriz" que pode ser usado para identificar o padrão de ramificação e as sequências de glicosilo. 12-13 Cada cicatriz gerada pelo evento de fragmentação é marcado como uma linha a cheio (Figuras 3 e 4). Como várias estruturas isoméricas são possíveis para uma massa definida, em seguida, nestas estruturas isoméricas, os iões Y e B são marcados em vermelho e preto, respectivamente.
Os dados de ESI-MS 2, ESI-MS e 3 ESI-MS 4 SPECTra de per-O-metilado RE alditol oligo-glicosilo neutro gerado a partir da fragmentação da pseudo-molecular de iões m / z 885 (P 4 + Xil ol) é mostrado na Figura 3. Os dados de ESI-MS 2 espectro inclui a abundante Y iões a m / z 711, 551, e 391 gerada pela perda de um, dois e três resíduos de pentosilo, respectivamente, a partir do ião precursor. O abundante m / z 711 de iões podem ser gerados por qualquer perda de um resíduo de Xil extremidade terminal não redutora ou pela perda de um resíduo Ara terminal de cadeia lateral. O diagnóstico Y m / z 391 ião no espectro resultante pode ser gerado a partir da perda de três não redutor resíduos de Xil finais do oligossacárido RE que tem um resíduo Ara cadeia lateral no resíduo ol RE Xil ou o oligossacárido RE que tem um Ara resíduo de cadeia lateral no resíduo 2 ND Xil a partir do resíduo ol RE Xil. Embora haja uma possibilidade formal que outras estruturas, tais comoXil 4 -Xyl ol, e ol (Ara) Xil-Xil-Xil-Xil daria origem a este fragmento ião estas estruturas são tidos em consideração como a especificidade do endo-xilanase utilizada para clivar o polissacárido seria ou degradar ou não clivar a ligação glicosídica adjacente a um ponto de ramificação, respectivamente. Correspondentemente, o Y de diagnóstico m / z 551 ião pode ser gerado a partir da perda de dois não-redução resíduos de Xil finais do oligossacárido RE que tem o resíduo Ara cadeia lateral em ambos o resíduo ol RE Xil ou o oligossacárido RE que tem o lado resíduo Ara corrente na resíduo Xil penúltimo. Assim, quatro possíveis estruturas isoméricas podem ser proposto (Figura 3: I, II, III e IV). O abundante Y ião m / z 377 (ver Figura 3: Ia e IIa) e B ião m / z 503 (ver Figura 3: Ia, Ib, IVa e IVb) gerada a partir de uma grande fragmentação do precursor m isomérica/ z 711 iónica também são observados neste espectro. Os dados de ESI-MS 3 espectro (Figura 3) gravado por fragmentação dos isomérica precursor de m / z 711 iões incluído um grande pico a m / z 537 (ião Y de P 2 + Xil ol com duas cicatrizes; gerado a partir do precursor de iões Ia , Ib, IIa, IIb, IIIa, IIIb, IVA e IVB) e m / z 391 (ião Y de P 1 + Xil ol com uma cicatriz; gerado a partir do precursor ion IIb, IIIa, IIIb, IVA e IVB). Estes dois picos principais (m / z 537 e m / z 391) pode ser gerado pela perda de um e dois não redutor resíduos de Xil terminais, respectivamente, a partir do isomérica precursor de m / z 711 ião gerado a partir da fragmentação da pseudo -molecular ião progenitor m / z 885 (P + 4 Xil ol) durante 2 ESI-MS. Relativamente menor abundância picos a m / z 377 (ião Y de P 1 + Xil ol com duas cicatrizes; gerada a partir do precursor de iões Ia e IIa) e 551 (ião Y de P 2 + Xil ol com uma cicatriz; gerado a partir do precursor de iões Ib e IIb) também foram observados neste espectro.
Os dados de ESI-MS 4 da fragmentação do isomérica precursor de m / z 551 iões incluído um grande pico a m / z 377 (ião Y de P 1 + ol Xil com duas cicatrizes) e m / z 391 (Y iónica de P 1 + Xil ol com uma cicatriz) gerado a partir do ião precursor de estruturas I e II. Por conseguinte, a evidência colectiva sugerido que a sequência de RE glicosilo consiste na cadeia lateral Ara ligada ao resíduo ol RE Xil (diagnóstico via fragmentação m / z 885 → 711 → 551 → 391; Figura 3ii), Ara cadeia lateral ligada a ambos os RE Xil ol eo penúltimo (1 resíduo st Xil de RE Xil ol) resíduo Xil (diagnóstico via fragmentação m / z 885 → 711 → 537 → 391; Figura 3III), cadeia lateral Ara ligado ao penúltimo (1º Xil de RE Xil ol) resíduo Xil (diagnóstico via fragmentação m / z 885 → 711 → 537 → 377; Figura 3I) eo cadeia lateral Ara anexado no resíduo de 2 nd Xil do ol RE Xil (Figura 3iV).
A presença destes iões confirma as estruturas isoméricas proposto I, II, III e IV e a estrutura oligossacido neutro de RE: - [Ara F - (1 → 3)] (+/-) -Xyl P - (1 → 4) - [Ara F - (1 → 3)] (+/-) -Xyl P - (1 → 4) - [Ara F - (1 → 3)] (+/-) -Xyl p.
O espectro de ESI-MS de 2 2AB per-O-metilado marcado RE oligossacárido gerado a partir do Fragmentação do quasi-moleculares [M + Na] + ião a m / z 871 (P + 4 2AB) é mostrada na Figura 4. Este espectro inclui o ião Y mais abundante a m / z 697 (P + 3 2AB com um cicatriz), m / z 537 (P 2 + 2AB com uma cicatriz) e m / z 377 (P 1 + 2AB com uma cicatriz), gerada pela perda de um, dois ou três não redutoras resíduos pentosilo, respectivamente. O ião de m / z 697 pode ser gerado, quer pela perda de um resíduo terminal da extremidade Xil não redutoras ou pela perda de um resíduo terminal de Ara Considerando que a m / z 537 ião só podem ser gerados pela perda de dois resíduos de Xil terminais . A via de fragmentação de diagnóstico (m / z 871 → 697 → 537 → 377) sugeriu que a existência de oligossacárido linear não-ramificado espinha dorsal xilano (s) no RE correspondente ao quase molecular de iões m / z 871 (P 4 + 2AB ). No entanto, o xilosil backbone un-ramificado linear (P 4 + 2AB) é susceptible ao local endoxilanase específico para posterior digestão. Portanto duas isomeric m / z 697 íons pode existir. Por conseguinte duas possíveis estruturas isoméricas são propostos (Figura 4: I e II). Nestas estruturas isoméricas iões Y e B são marcados em vermelho e preto, respectivamente. Os dados de ESI-MS 3 espectro gravado a partir da fragmentação de precursor isomérico m / z 697 ião gera m / z 523 ião (ião Y de P 2 + 2AB com duas cicatrizes; Figura 4, estruturas de Ia, Ib, IIa e IIb), m / z 363 ião (ião de Y P 1 + 2AB com duas cicatrizes; Figura 4, a estrutura lia) e Y ião a m / z 377 (P + 1 2AB com uma cicatriz; Figura 4, as estruturas de Ia e Ib). O fragmento ião a m / z 377 só pode surgir a partir da estrutura proposta I e o ião fragmento a m / z 363 só pode surgir a partir da estrutura proposta II. A presença simultânea destes dois iões confirma as estruturas propostas I e II. Assim, a sequência de RE glicosilo da cadeia de xilano de AXs endosperma de trigo consistem de um ramo de Ara ligada ao resíduo RE Xil (fragmentação via de m / z 871 → 697 → 523 → 363) e / ou resíduo de Xil penúltimo (fragmentação via de m / z 871 697 → → → 523 377).
A análise por RMN do AXs
Análises baseadas-MS não fornecem informações sobre a configuração anomérica, quer (α / β) ou da configuração D / L dos açúcares que deve ser obtidos por outras abordagens, incluindo enzimática e físico (por exemplo, RMN). Para heteroxilanos com a tetrassac�ido RE característica reduzida (Xil-Rha-GALA-Xil ol), o espectro de RMN contém sinais anom�icos que conduzam à identificação e sequenciação deste oligossacarídeos RE. Descreve-se a utilização de 600 MHz 1D 1 H-RMN espectroscopia como um método de um só passo para detArminho a sequência completa de glicosilo do endosperma de trigo oligossacárido AX RE no Pe KOH-sol, incluindo a configuração anomérica (α / β) e a configuração D / L dos açúcares. As ressonâncias foram atribuídas com base em trabalhos publicados de trigo oligossacáridos AX 17-18 (Figura 5, Quadro 1). O espectro de 1H-RMN do AX extraído de endosperma de trigo é dominado pelos deslocamentos anomérica químicos em 5,39, 5,27 e 5,22 ppm que está atribuído para o protão de um resíduo α-L-Ara F terminal, ligado a O-3 posição (t-α-L-Ara F → 3 S) dos (1,4) -β-Xil resíduos p backbone isoladamente ramificados e ambos os o-3 e S-2 (posições T-α-L-Ara F 3 → D e T-α-L-Ara F → 2 D) de (1,4) -β-Xil resíduos p backbone duplamente ramificado, respectivamente (Figura 5 e Tabela 1).
Os sinais a 5,41 são atribuídos ao (t-α-L-ara F @ 3 V + D) H1 sinal de α-L-f Ara cadeia lateral ligada à posição 3 de o-se o resíduo p-D-β Xil isoladamente ramificada com conjugados duplamente ramificados β-D-Xil p. O sinal a 5,29 é atribuída à (t-α-L-Ara F → 3 D + D) do sinal H1 de α-L-Ara cadeia lateral f ligado à posição-O-3 da duplamente ramificado β-D-Xil resíduo p com conjugados duplamente ramificados β-D-Xil p. o sinal a 5,24 é atribuída à (t-α-L-Ara F → 2 D + D) do sinal H1 de α-L-Ara cadeia lateral f ligado ao posição o-2 do resíduo de p-D-β Xil duplamente ramificado com conjugados duplamente ramificados β-D-Xil p.

Figura 1. Resumo da Abordagem Experimental Um resumo da estratégia utilizada na geração, purificação e sequenciação do terminal redutor (RE) e oligossacarídeos região interna. do trigo arabinoxilanos endosperma (AXs) é mostrado. Este número foi reproduzido com permissão de Ratnayake et al. (2014) 2. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. MALDI-TOF MS (A) e ESI-MS QTOF (B - E) análise de oligossacáridos nativos divulgados pela endoxilanase de 2AB marcado W-Sol AXs tal como delineado na Figura 1. MALDI-TOF MS espectro de: (A) ( o sinais de um está identificado como [M + Na] + iões aductos); Varreduras de iões seleccionados do ESI-MS QTOF cromatogramas: B = 10/05 P derivados de oligossacáridos região interna (Os sinais são identificados como [M + NH4] + iões aductos); C = P 1-6 + 2AB derivados de RE oligossacáridos (Os sinais são identificados como [M + H] + iões de aducto) P & G 3-8 derivado de oligossacáridos acídicos (Os sinais são identificados como [M + Na] + iões aductos); D = ESI-Q-TOF completo espectro de varredura: região entre 3,10-3,48 min, e = ESI-Q-TOF espectro de varrimento total: região entre 3,59-4,05 min (Os sinais são ambos identificados como [M + Na] + e [M + NH4] + iões de aducto ); P = pentosilo unidade (quer Ara ou Xil); G = resíduo uronosyl (GlcA); RE = oligossacáridos redutores finais; 2AB = 2 aminobenzamida; EIC: extraído cromatograma iónico. ad / 53748 / 53748fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
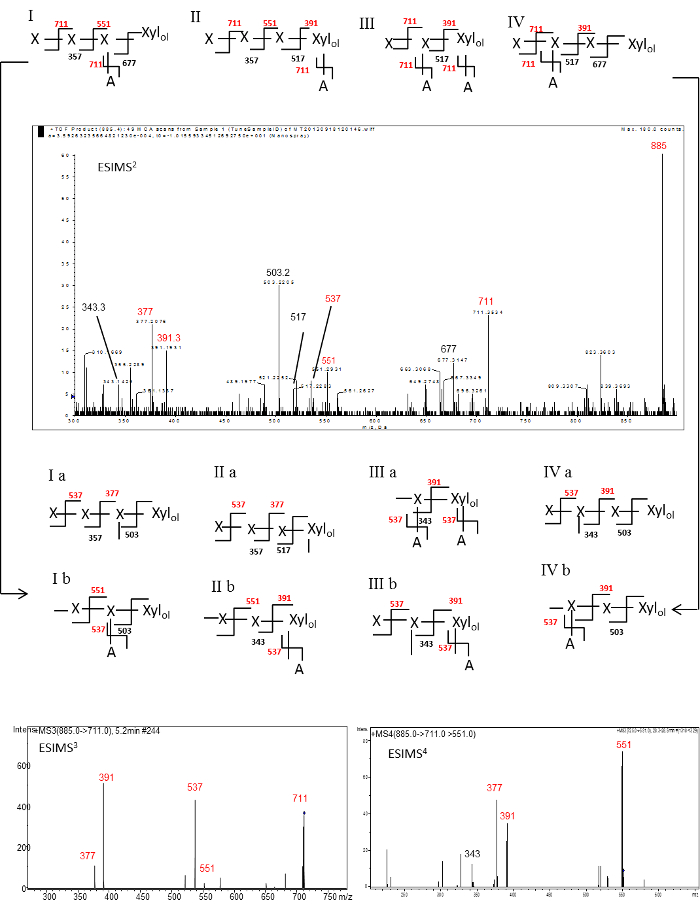
Figura 3. Os dados de ESI-MS 2, ESI-MS 3 e 4 ESI-MS Os espectros de per-O-metilado RE neutro alditol glicosilo (P 4 + Xil ol) - m / z 885. Os sinais são designados como o [H + Na] + aductos de iões de pseudo-molecular. Como várias estruturas isoméricas para a massa definida são possíveis, em seguida, em estruturas isoméricas iões Y e B são marcados em vermelho e preto, respectivamente. Cada "cicatriz" gerada pelo evento de fragmentação é marcado como uma linha a cheio. X = resíduo xilosilo; Um resíduo = arabinosilo. O ESI-MS 3 espectros foi reproduzido com permissão de Ratnayake et al. (2014) 2.748fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 4. Os dados de ESI-MS e 2 ESI-MS 3 espectros de 2AB per-O-metilado marcado oligossacareo neutro RE (P + 4 2AB) - m / z 871. Os sinais são designados como a [M + Na] + pseudo adutos íon -molecular. Como várias estruturas isoméricas para a massa definida são possíveis em estruturas isoméricas, os iões Y e B são marcados em vermelho e preto, respectivamente. Cada "cicatriz" gerada pelo evento de fragmentação é marcado como uma linha a cheio. X = resíduo xilosilo; Um resíduo = arabinosilo. Este número foi reproduzido com permissão de Ratnayake et al. (2014) 2. Por favor clique aqui para ver uma vers maioresion desta figura.

Figura 5. região anomérica do espectro de 600 MHz 1D 1 H-RMN dos oligossacáridos AX gerado por tratamento da endoxilanase do Sol KOH- P. 1 H desvio químico referenciado a um padrão interno de acetona a 2.225 ppm. T-α-L-Ara F @ 3 S: H1 sinal de α-L-Ara F cadeia lateral ligada à posição 3 de O-se o resíduo p-D-β Xil isoladamente ramificada; T-α-L-Ara F → 2 D: H1 sinal de α-L-Ara F cadeia lateral ligada à posição-2 O do resíduo p-D-β Xil duplamente ramificado; T-α-L-Ara F → 3 D: H1 sinal de α-L-Ara F cadeia lateral ligada à posição 3 de O-se o resíduo p-D-β Xil duplamente ramificado; T-α-L-Ara F → 3 S + D: H1 sinal de α-L-Ara F cadeia lateral ligada à posição 3 de O-se o resíduo p-D-β Xil isoladamente ramificada com conjugados duplamente ramificados β-D- Xil p; T-α-L-Ara F → 2 D + D: sinal de H1 de α-L-Ara cadeia lateral f ligado à posição O-2 do resíduo p β-D-Xil duplamente ramificado com conjugados duplamente ramificados β-D p -Xyl; T-α-L-Ara F → 3 D + D: sinal de H1 de α-L-Ara cadeia lateral f ligado à posição-O-3 do resíduo p β-D-Xil duplamente ramificado com conjugados duplamente ramificados β-D p -Xyl; 2-α-L-Ara f → 3 S: sinal de H1 de 2-α-L-Ara resíduo cadeia lateral f ligado à posição O-3 do resíduo p β-D-Xil isoladamente ramificado; Por favor clique aqui para veruma versão maior desta figura.
| Os resíduos de açúcar | H-1 / C-1 | H-2 / C-2 | H-3 / C-3 | H-4 / C-4 | H-5 eq / C-5 | H-5 machado / C-5 |
| T-α-L-Araf → 3 S | 5,396 / 107,6 | 4.16 | 3.95 | 4.3 | 3,82 | 3,72 |
| T-α-L-Araf | 5,415 / | 4.18 | 3.95 | |||
| → 3 S + D | ||||||
| T-α-L-Araf → 2 D | 5.223 / | 4.16 | 3,97 | 3,82 | 3,74 | |
| T-α-L-Araf → 2 D + D | 5.243 / | 4.16 | 3,98 | |||
| T-α-L-Araf → 3 D | 5.272 / 108,9 | 4.18 | 3,96 | 4,26 | 3,79 | 3,74 |
| T-α-L-Araf → 3 D + D | 5,298 / | 4.18 | 3,96 | |||
| 2-α-L-Araf → 3 S | 5.548 / 106.4 | 4,27 | 4,06 | 4.3 | 3,82 | |
| -a-Xylp (Redução) | 5.185 / 91,9 | 3.55 | 3,72 | |||
| P-Xylp (Redução) | 4.580 / 96,6 | 3,29 | 3,48 | 3,64 | 4,06 | 3,38 |
| β-4-Xylp | 4.470 / | 3,32 | 3,58 | |||
| p -4-Xylp + S | 4.461 | 3.31 | 3,56 | 3,75 | 4,08 | 3,36 |
| β-4-Xylp + D | 4.448 | 3.31 | 3,56 | 3,75 | 4,08 | 3,36 |
| p-3,4-Xylp | 4.518 / | 3,44 | 3,85 | |||
| S + β-3,4-Xylp | 4.514 / | 3,47 | 3,75 | 3,86 | 4.14 | 3,43 |
| + Β-3,4-D Xylp | 4.505 | |||||
| p-3,4-Xylp + S | 4.492 | 3.45 | 3,74 | |||
| β-3,4-D + Xylp | 4.482 | 3.45 | 3,74 | |||
| p-2,3,4-Xylp | 4.638 | |||||
| S + β-2,3,4-Xylp | 4.627 | 3,59 | 3,87 | 3,88 | ||
| + Β-2,3,4-D Xylp | 4.616 | |||||
| p-2,3,4-Xylp + S | 4.593 | |||||
| β-2,3,4-Xylp + D | 4.593 | |||||
| Os desvios químicos são referidos em relação à acetona interna, ô 2,225. | ||||||
| S = Singly ramificada β-Xylp | ||||||
| S + D = Isoladamente ramificada β-Xylp + Duplamente ramificada β-Xylp | ||||||
| D = Duplamente ramificada β-Xylp | ||||||
| D + D = Duplamente ramificada β-Xylp + Duplamente ramificada β-Xylp | ||||||
Tabela 1. Sinais de 1H-RMN dos xilo-oligossacáridos gerados por tratamento da endoxilanase do P. KOH-Sol endosperma de trigo
Discussão
A maioria dos polissacáridos da parede celular fase de matriz têm aparentemente de forma aleatória espinhas dorsais substituído (com ambos glicosilo e resíduos de não-glicosilo) que são altamente variáveis dependendo da espécie de planta, fase de desenvolvimento e tipo de tecido 3. Desde polissacarídeos são produtos de genes secundários sua sequência não é modelo de derivados e não há, portanto, nenhuma abordagem analítica única, como existe para os ácidos nucléicos e proteínas, por sua sequenciação. A disponibilidade de enzimas hidrolíticas específicas de ligação purificados forneceu uma ferramenta poderosa para degradar a oligossacáridos polissacáridos que podem depois ser cromatograf icamente fraccionado, e quando usado em combinação com técnicas químicas e físicas completamente sequenciado. O desafio é, em seguida, voltar a montar estas misturas complexas em um polissacarídeo originais sequence- que ainda está a ser enfrentados com êxito.
Aqui nós descrevemos uma abordagem (cuja ordem de ca aplicaçãon ser variada) que se baseia na integração de enzimática estabelecida, químicas e técnicas físicas para a caracterização estrutural de ambos o fim redutor (RE) e a sequência de glicosilo região interna (s) de heteroxilanos. Uma técnica complementar adicional não aqui descrito que se revelou muito útil para caracterizar oligossacarídeos é PACE (análise polissacarídeo por eletroforese em gel de carboidrato), desenvolvido pelo grupo Dupree 19 e pode ser facilmente integrado em este protocolo se o equipamento está disponível. Além disso, as variações no cromatografia LC pode também ser útil, tal como cromatografia em tandem em linha interacção hidrófila (HILIC) seguido por cromatografia em RP oferecendo a possibilidade de separar, tanto não marcada / etiquetado oligossacáridos num único passo. As técnicas dependem de marcação (com 2 aminobenzamida (2AB)) na extremidade redutora (RE) da cadeia heteroxylan antes enzimática (endoxilanase) hidrólise. Duas abordagens diferentes (ver resumo naFigura 1) são adotados. No primeiro, AXs W-Sol intactas são tratados com 2AB para marcar o RE espinha dorsal resíduo de açúcar cadeia original e, em seguida, tratada com uma endoxilanase para gerar uma mistura de RE marcado com 2AB região interna e reduzindo oligossacidos, respectivamente. Em uma segunda abordagem do Pe KOH-sol é hidrolisada com endoxilanase a primeira geração de uma mistura de oligossacarídeos que são posteriormente marcadas com 2AB. Neste último caso o RE original do AX KOH-Sol não seriam marcadas com 2AB, uma vez que tinha sido reduzida para o glicosil-alditol durante a extracção alcalina que continha o agente redutor, borohidreto de sódio (NaBH4). Portanto, os oligossacarídeos 2AB-rotulados gerado digestão pós-xilanase, dará origem a partir oligossacarídeos "internos" e o oligossacarídeo RE inicial conterá um alditol RE sem uma etiqueta 2AB (veja a Figura 1). Esta abordagem também pode ser aplicada a outras classes de polissacáridos ucantar (quando disponível) as endo-hidrolases adequadas.
A abordagem baseada em MS é significativamente melhorada pela metilação dos oligossacarídeos gerado após tratamento endoxilanase uma vez que o grupo hidroxilo metilado-un (s) gerada durante a fragmentação em fase gasosa de per-O-metilado oligossacáridos em MS n fornece uma diferença de massa 14DA "cicatriz "que podem ser usadas para ajudar na identificação do padrão de ramificação e a sequência de glicosilo. 06/05 a identidade dos resíduos de pentosilo (e qualquer resíduo de açúcar) não pode ser feita a partir dos dados de MS sozinho, mas vem de ter um conhecimento da composição da molécula; onde este não estiver disponível, as análises de monossacarídeos e de ligação relevantes deve ser feita antes de fazer essas atribuições em MS n. Além disso, os sinais que correspondem ao alditol RE oligossacárido ácida, produzida a partir de KOH-Sol P. (Xil-3 -MeGlcA Xilitol: m / z 761) e o chsequência dicot aracteristic glicosil RE xilana (Xil 2 -RHA-GALA-xilitol: m / z 761), se presente, não são capazes de ser distinguido como ambos têm a mesma massa molecular na forma nativa, mas pode ser distinguida da sua fragmentação MS ( MS n) os espectros que é melhor realizada sobre os oligossacáridos metilados. Finalmente, técnicas baseadas-MS são incapazes de fornecer informação em ambos a configuração anomérica (α / β) da ligação glicosídica de configuração a ou D / L do sugars- este deve ser determinada por métodos alternativos, incluindo enzimática e físico (por exemplo, RMN).
Divulgações
We have nothing to disclose.
Agradecimentos
This project was supported by funds from Commonwealth Scientific and Research Organisation Flagship Collaborative Research Program, provided to the High Fibre Grains Cluster via the Food Futures Flagship. AB also acknowledges the support of an Australia Research Council (ARC) grant to the ARC Centre of Excellence in Plant Cell Walls (CE110001007).
Materiais
| Name | Company | Catalog Number | Comments |
| 2 aminobenzamide (2AB) | Sigma-Aldrich (www.sigmaaldrich.com) | A89804 | |
| sodium borohydride (NaBH4) | Sigma-Aldrich (www.sigmaaldrich.com) | 247677 | Hazardous, handle with care |
| sodium cyanoborohydride (NaBH3CN) | Sigma-Aldrich (www.sigmaaldrich.com) | 156159 | Hazardous, handle with care |
| endo-1,4-β-Xylanase M1 (from Trichoderma viride) (120101a) | Megazyme (www.megazyme.com) | E-XYTR1 | |
| Deuterium Oxide (D2O) | Sigma-Aldrich (www.sigmaaldrich.com) | 151882 | |
| Freeze dryer (CHRIST-ALPHA 1-4 LD plus) | |||
| RP C18 Zorbax eclipse plus column | Agilent | (2.1×100 mm; 1.8 µm bead size) | |
| MicroFlex MALDI-TOF MS (Model - MicroFlex LR) | (Bruker Daltonics, Germany) | ||
| (ESI) -(QTOF) MS (Model # 6520) | (Agilent, Palo Alto, CA ) | ||
| ESI-MSn - ion-trap (Model # 1100 HCT) | (Agilent, Palo Alto, CA). | ||
| Bruker Avance III 600 MHz -NMR | Bruker Daltonics, Germany | ||
| Topspin (version 3.0)-Biospin- software | Bruker | ||
| GC-MS (Model # 7890B) | Agilent |
Referências
- Pettolino, F. A., Walsh, C., Fincher, G. B., Bacic, A. Determining the polysaccharide composition of plant cell walls. Nature Protocols. 7, 1590-1607 (2012).
- Ratnayake, S., Beahan, C. T., Callahan, D. L., Bacic, A. The reducing end sequence of wheat endosperm cell wall arabinoxylans. Carbohydr. Res. 386, 23-32 (2014).
- Bacic, A., Harris, P. J., Stone, B. A., Preiss, J. . The Biochemistry of Plants, Vol. 14, Carbohydrates. 14, 297-371 (1988).
- York, W. S., O'Neill, M. A. Biochemical control of xylan biosynthesis - which end is up?. Plant Biol. 11, 258-265 (2008).
- Fincher, G. B. Revolutionary times in our understanding of cell wall biosynthesis and remodeling in the grasses. Plant Physiol. 149, 27-37 (2009).
- Faik, A. Xylan Biosynthesis: News from the Grass. Plant Physiol. 153, 396-402 (2010).
- Scheller, H. V., Ulskov, P. Hemicelluloses. Annu. Rev. Plant Biol. 61, 263-289 (2010).
- Bacic, A., Stone, B. A (1→3)- and (1→4)-linked β-D-glucan in the endosperm cell-wall of wheat. Carbohydr. Res. 82 (13), 372-377 (1980).
- Comino, P., Collins, H., Lahnstein, J., Beahan, C., Gidley, M. J. Characterisation of soluble and insoluble cell wall fractions from rye, wheat and hull-less barley endosperm flours. Food Hydrocolloids. 41, 219-226 (2014).
- Pena, M. J., et al. Arabidopsis irregular xylem8 and irregular xylem9: Implicationsfor the Complexity of Glucuronoxylan Biosynthesis. Plant Cell. 19, 549-563 (2007).
- Andersson, S. I., Samuelson, O., Ishihara, M., Shimizu, K. Structure of the reducing end-groups in Spruce xylan. Carbohydr. Res. 111, 283-288 (1983).
- Mazumder, K., York, W. S. Structural analysis of arabinoxylans isolated from ball-milled switchgrass biomass. Carbohydr. Res. 345, 2183-2193 (2010).
- Kulkarni, A. R., et al. The ability of land plants to synthesize glucuronoxylans predates the evolution of tracheophytes. Glycobiol. 22 (2012), 439-451 (2012).
- . . Agilent MassHunter Workstation Software - Quantitative Analysis Familiarization Guide. , (2010).
- . . Topspin User Manual. , (2010).
- Domon, B., Costello, C. E. A systematic nomenclature for carbohydrate fragmentation in FAB-MS/MS spectra of glycoconjugates. Glycoconjugate. J. 5, 397-409 (1988).
- Hoffmann, R. A., Leeflang, B. R., De Barse, M. M. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H-n.m.r. spectroscopy of oligosaccharides, derived from arabinoxylans of white endosperm of wheat, that contain the elements ----4)[alpha-L-Araf-(1----3)]-beta-D-Xylp-(1---- or ----4)[alpha- L-Araf-(1----2)][alpha-L-Araf-(1----3)]-beta-D-Xylp-(1----. Carbohydr. Res. 221, 63-81 (1991).
- Gruppen, H., Hoffmann, R. A., Kormelink, F. J. M., Voragen, A. G. J., Kamerling, J. P., Vliegenthart, J. F. Characterisation by 1H NMR spectroscopy of enzymically derived oligosaccharides from alkali-extractable wheat-flour arabinoxylan. Carbohydr. Res. 233, 45-64 (1992).
- Kosik, O., Bromley, J. R., Busse-Wicher, M., Zhang, Z., Dupree, P. Studies of enzymatic cleavage of cellulose using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Methods Enzymol. 510, 51-67 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados