Method Article
Характеристика воспалительных реакций во время интраназальной колонизации стрептококковой пневмонией
В этой статье
Резюме
Описана колонизация муринной носоглотки со стрептококковой пневмонией и последующая экстракция адептичных или завербованных клеток. Этот метод включает в себя промывку носоглотки и сбор жидкости через nares и адаптируется для различных считываний, в том числе дифференциальной количественной оценки клеток и анализа экспрессии мРНК на месте.
Аннотация
Колонизация носоглотки стрептококковой пневмонией является необходимым условием для вторжения в легкие или кровоток1. Этот организм способен колонизировать слизистую поверхность носоглотки, где он может находиться, размножаться и в конечном итоге преодолевать защитные силы хозяина, чтобы вторгнуться в другие ткани хозяина. Установление инфекции в обычно нижних дыхательных путях приводит к пневмонии. Кроме того, бактерии могут распространяться в кровоток, вызывая бактериемию, которая связана свысоким уровнем смертности 2, или же привести непосредственно к развитию пневмококкового менингита. Понимание кинетики и иммунной реакции на колонизацию носоглотки является важным аспектом моделей инфекции S. pneumoniae.
Наша модель мыши интраназальной колонизации адаптирована изчеловеческих моделей 3 и была использована несколькими исследовательскими группами в изучении реакций хозяина-патогена в носоглотку4-7. В первой части модели мы используем клинический изолят S. pneumoniae для создания самоограничения бактериальной колонизации, которая похожа на перевозки событий у взрослых людей. Процедура, подробно описанная в настоящем, включает в себя подготовку бактериального инокулума, а затем создание события колонизации путем доставки инокулума через интраназальный маршрут введения. Резидентные макрофаги являются преобладающим типом клеток в носоглотки во время устойчивого состояния. Как правило, Есть несколько лимфоцитов, присутствующих в неинфицированныхмышей 8, однако слизистой колонизации приведет к низкой до высококачественной воспаления (в зависимости от вирулентности бактериальных видов и штаммов), что приведет к иммунной реакции и последующего набора иммунных клеток хозяина. Эти клетки могут быть изолированы от лаваж содержимого трахеи через nares, и коррелирует с плотностью бактерий колонизации, чтобы лучше понять кинетику инфекции.
протокол
Прежде чем начать: все шаги сделаны в Biohazard Уровень 2 (BSL2) Биологическая безопасность кабинета (BSC), если не указано иное. Пожалуйста, убедитесь, что вы получили соответствующее разрешение Biohazard для использования инфекционных бактериальных патогенов в соответствии с институциональными руководящими принципами до начала экспериментов. Кроме того, убедитесь, что у вас есть все материалы и реагенты, необходимые для проведения процедуры, подготовленной заранее. Мыши, используемые в этих экспериментах, включали самок мышей C57BL/6 из Лабораторий Джексона, Чарльз Ривер или Таконик и были в возрасте 10-14 недель (хотя мы не обнаружили каких-либо гендерно-зависимых значительных различий в кинетике зазора колонизации носа или инфекции). Все мыши, используемые в этих экспериментах, были выведены и поддерживались в условиях, свободных от конкретных патогенов, и были свободны от распространенных вирусов, (LCMV, MNV, MPV, реовирус ECTV и других) бактерий (например,H. pylori) и паразитов (например, остриц, эктопаразиты) путем тестирования фекальных образцов, а также частой анатомической оценки При проведении этих экспериментов мы рекомендуем использовать контрольных мышей не моложе 10-12 недель и не старше 6 месяцев. Мыши моложе или старше этого возрастного диапазона более восприимчивы к более длительной продолжительности перевозки носоглотки и повышенной вероятности распространения инфекции. Мышь фон является еще одним важным фактором, который может повлиять на результаты эксперимента колонизации, как несколько групп показали, что мыши разного генетического происхождения имеют различные восприимчивости к S. pneumoniae D39 (серотип 2)штамм 9,10. S. Pneumoniae не является естественным патогеном мурина и его единственным естественным резервуаром является носоглотка человека. Передача происходит через дыхательные капли, и, как мыши не производят дыхательных секреций, отдельные мыши не могут передавать бактерии другим мышам, так что нет никакой озабоченности для мыши к мышипередачи 11. Для визуального обзора процедур, описанных в этой рукописи, пожалуйста, обратитесь к рисунку 1.
1. Подготовка культуры С. пневмонии
- Прививка 5 мл триптического соевого агара для подвесного роста стрептококковой пневмонии.
- Культура в статических условиях при 37 градусов по Цельсию в 5% CO2 до тех пор, пока бактериальный инокулум не достигнет фазового роста журнала с соответствующей плотностью жидкости 108 CFU/ml, определяемой одометром, установленным до 600 нм. Точное чтение, соответствующее этому CFU будет отличаться в зависимости от конкретного выбранного бактериального штамма; для большинства штаммов S. pneumoniae это соответствует диапазону OD600 0,45-0,55. Как правило, штаммы S. pneumoniae в жидкой культуре вырастут до такой плотности в пределах 1,5-2,5 часа при рекомендуемых условиях, без необходимости подкачения. Культура не должна быть позволена overgrow (за чтением OD 0.75) по мере того как это представляет пункт на котором бактерии no longer в росте фазы журнала и проходят обширный autolysis.
- Каждая мышь будет привита примерно 107 бактериями. Таким образом, для каждых 9 мышей, которые будут колонизированы, пипетка 1 мл инокулума в трубку Эппендорф и спина на 15000 х г в течение 1 мин. Беловатые гранулы должны быть видны. Удалите супернатант, будучи осторожным, чтобы не беспокоить гранулы и повторно использовать бактерии в 100 мкл фосфата буферного солевого раствора (PBS), тем самым увеличивая концентрацию до 109 CFU/ml. На данном этапе бактерии должны оставаться жизнеспособными, но не будут легко размножаться.
- При использовании нескольких aliquots, объединить в одну трубку для контроля для небольших меж образец изменения в бактериальной плотности.
- Держите бактерии на льду до готовности к прививке, максимум 1 час.
- Для получения точного бактериального подсчета, выполните журнал-мудрый серийный разбавления серии, начиная с аккуратным бактериальной инокулы. Разбавить последовательно 10 раз, добавив 10 мкл до 90 мл стерильных PBS.
- Плита из 3 капель 10 йл образцов разбавления 10-5 - 10-9, плюс PBS только контроль загрязнения, на отдельно помечены разделы триптического соевого агара (TSA) пластины дополнены 5% крови овец (Рисунок 2). Убедитесь, что пипетки советы меняются для каждого шага разбавления от более высокой концентрации CFU к более низкой концентрации CFU, чтобы избежать переноски избыточных бактерий и повышение изменчивости результатов. Пластины агара крови человека (HBA) также могут быть использованы вместо TSA. Поскольку многие штаммы S. pneumoniae устойчивы к неомицину (от 5-20 мкг/мл), этот антибиотик также может быть добавлен в агарную среду выбора во время фазы подготовки пластины. Это облегчает перечисление, поскольку он устраняет несуществующих бактерий. Чувствительность к антибиотикам каждого штамма должна быть проверена заранее, чтобы определить оптимальную концентрацию антибиотиков для использования для каждого бактериального штамма.
- Дайте высохнуть в течение 15-30 мин обнаружили, затем покрыть пластины и поместить вверх дном в бактериальный инкубатор установлен на 37 градусов по Цельсию и 5% CO2. Выращиваем бактериальные колонии на тарелке 24 часа.
- Определить количество колоний, образующих единицы, и их соответствующую концентрацию. Основываясь на определениях значения OD600, концентрация должна быть в пределах 1-4 х 109 CFU/ml. S. Пневмония колоний должна появиться как небольшие, круговые колонии желтовато-бежевого цвета, с небольшой депрессией в центре давая им пончик, как внешний вид (Рисунок 3).
2. Мурин интраназальная колонизация
- Сдерживайте мышей, помещая их в аппарат мизера мыши (модифицированная трубка Сокола 50 мл с кончиком отрезаны для создания диафрагмы) обеспечение их основанием их тела с большим пальцем, так что их носы просто выйти из конической конце аппарата удержатель (Рисунок 4). Использование этого аппарата позволяет иммобилизации головы мыши и сегрегации его nares таким образом, что сводит к минимуму движение, а также препятствует попыткам животного, чтобы мастикулировать кончик пипетки, что позволяет для полной доставки инокулума. Кроме того, мыши могут быть обездвижены через потертости на шее и ручной сдержанности. Мы не рекомендуем анестезию животных до интраназальной прививки. Администрация инокулума животным под наркозом приводит к некоторым из инокулума распространяется на легкие12,13.
- Используя P10 или P20 pipette, привить каждую мышь, относя 10 мкл подготовленной культуры, равномерно распределяя ее между обоими нарами (позвольте инокулуму капать в нос, постепенно пульсав прививку, постепенно набирая время для мышей вдыхать инокулум). Для достижения полной доставки инокулума, приостановить администрирование в любой момент мышь начинает двигать носом чрезмерно. Весь инокулум не может быть введен в nares, как мыши могут изгнать некоторые через нос во время выдоха; однако, как изгнанное количество, как правило, мизерные, и инокулум содержит чрезвычайно большое количество бактерий, это не существенно влияет на колонизации бактериальной нагрузки. Кроме того, площадь поверхности, доступной для колонизации слизистой оболочки носоглотки ограничена и, следовательно, мы и другие обнаружили, что рекомендуемая 107 доза достаточна для получения последовательного уровня бактерий у всех мышей, в результате чего минимальная изменчивость в начальных количествахколонизации бактерий 14,15 .
- Взвешивайте мышей при использовании индикаторов веса в рамках мониторинга конечных тоок. Мониторинг мышей каждые 12-24 часа для клинических симптомов, в том числе вялость, взъерошенный мех и потеря веса. Мыши, как правило, не показывают симптомы болезни до 3-5 дней после колонизации, и они будут предшествовать потере веса, которые могут в среднем около 5% от общей массы тела в день. По мере того как мыши будут все больше и больше более больными они притязают hunched позы и показывают уменьшенную деятельность и уменьшенную отзывчивость к стимуляции, включая регулировать. На данном этапе болезнь, как правило, свидетельствует о сепсисе и/или пневмонии и, вероятно, будет неизлечимой, хотя мышей можно лечить 1 мл подкожного солевого раствора ежедневно для улучшения результатов. Выжившие мыши должны начать показывать улучшение после 7-го дня после колонизации, о чем свидетельствует стабилизация веса с последующим увеличением веса, хотя различные штаммы S. pneumoniae могут вызвать болезнь быстрее и привести к прогрессированию клинических симптомов по другой линии времени. Пожалуйста, смотрите рисунок 5 для репрезентативного результата веса, отслеживаемого у мышей, колонизированных штаммом P1547.
3. Коллекция образцов носовой лавы
Перед началом: подготовить канюли иглы с использованием 1 мл шприцев ограничен 26 3/8 G скошенные иглы. Вырезать 2,5 см кусочки ПОЛИЭТИЛЕНа PE20 трубки с внутренним диаметром 0,38 мм, гарантируя, что каждый конец имеет скошенный кончик. Используя типсы, сдвиньте 2,5 см длинного куска полиэтиленовой трубки PE20 (внутренний диаметр 0,38 мм) на кончик иглы, избегая прокола трубной стороны. Каннюлированные иглы можно хранить в 70% этанола до необходимости.
- Евтанизировать экспериментальных мышей. Поскольку вывих шейки матки потенциально может повредить трахею, этого метода эвтаназии следует избегать. Наш предпочтительный метод является изофлюран анестезии следуют exsanguination, однако, убедитесь, что вы будете следовать институциональным руководящим принципам при выборе способа эвтаназии.
- Используя 70% аквозного этанола, стерилизовать супероантерий меха животного, особенно шеи, заботясь, чтобы предотвратить этанол от доступа к nares.
- Сделайте один продольный разрез вдоль средней линии шеи животного, и два горизонтальных разреза на обоих концах, создавая отверстие, чтобы представить себе трахею.
- Тщательно очистить кожу спины в обе стороны, выявление шеи ткани под.
- Трахея должна быть видна, окружена продольными мышцами с обеих сторон. Тщательно отрежьте их, чтобы обеспечить четкое представление о самой трахее, заботясь о том, чтобы не разорвать окружающую сосуды.
- Если сосуды были сокращены и кровь присутствует, до начала, позволяют кровотечения, чтобы остановить, а затем очистить область несколько раз, распределяя стерильные PBS и с помощью стерильной марли, чтобы мягко впитывать избыток влаги в этом районе.
- После того, как трахея должным образом подвергается, сделать поперечный, полулунар вырезать в трахее около половины пути вверх (Рисунок 6).
- Нарисуйте 1000 мкл стерилизованного PBS в ранее подготовленную иглу с каннулированной иглой.
- Вставьте канюлю в трахею к носу, сохраняя скошенный край, указывающий вниз для удобства вставки (Рисунок 7). После того, как игла на месте, поверните его на 180 ", и осторожно зонд вверх, пока вы не почувствуете светоустойчивость.
- Место Eppendorf предназначен для сбора образцов прямо под носом мыши.
- Проверьте правильное размещение иглы, выделив минимальное (20 мкл) количество жидкости PBS лаваж - капля жидкости должна образовываться вокруг нары мыши; если это так, переходите к шагу 3.13).
- Если тест PBS возникает непосредственно из уст животного, тянуть канюлю назад, и перепозиционировать снова осторожно зондирования вперед, пока очень небольшое сопротивление ощущается - заботиться, чтобы не толкать канюлю слишком далеко мимо этого сопротивления, как вы будете двигаться мимо носового неба и до полости рта.
- Быстро распределять содержимое иглы, чтобы помочь вытеснить и собрать максимальное количество клеток - содержимое должно вытекать через нары мыши и в коллекторную трубку. Поместите образец сразу на лед.
- Для сбора образцов для анализа РНК повторите шаги 3.8-3.13) с помощью каннулированной иглы, содержащей 500 мкл буфера РНК-лиза на одной мыши. Это позволит получить лиссат образца из оставшихся популяций клеток, в основном состоит из носоглотки слизистой эпителия, как неадъеренные клетки должны были быть удалены после первоначального PBS лаваж. Пожалуйста, обратите внимание, что буфер РНК-лиза будет денудеть эпителий и уничтожить окружающие ткани, поэтому необходимо позаботиться, чтобы избежать контакта с органами, такими как легкие, если удержание этих тканей желательно. После сбора, поместите образец в буфере РНК-лиза непосредственно на сухой лед, чтобы заморозить. Оказавшись в буфере лиза, образцы могут храниться в соответствии с инструкциями производителя и стабильны, как правило, при -70 градусах Цельсия в течение нескольких месяцев.
4. Определение бактериальной нагрузки в носоглотку
- Квантитатные бактерии, подготовив серийную серию разбавления для каждого образца промывки носа. В целом, бактериальная нагрузка может быть между 0-104 CFU, поэтому провести три 10-кратное последовательное разбавления. Добавьте 10 мкл аккуратного образца носовой лавы (100 CFU/ml) к первой трубке с концентрацией 10-1 CFU/ml. Vortex тщательно.
- Разделите бактериологическую пластину на квадранты и наклеите квадранты каждый с членом серии разбавления (100-10-3 CFU/ml). Плита из 3 капель 10 образцов 3 разбавления и аккуратный образец на триптических сое агар пластин, дополненных 5% крови овец, как на рисунке 2.
- Дайте высохнуть в течение 15-30 мин обнаружили, затем покрыть пластины и поместить вверх дном в бактериальный инкубатор с оптимальными условиями для роста бактерий (обычно 37 кк и 5% CO2).
- Выращиваем бактериальные колонии на тарелке по 18-24 часа.
- Определите количество колонизировавных бактерий путем усреднения колоний, образованных на тарелке для каждого разбавления(рисунок 3). Рисунок 8 демонстрирует бактериальную плотность в разные моменты времени, определяемую культурой носовых лав, у мышей, колонизированных с 3 различными штаммами S. pneumoniae на срок до 21 дня.
5. Подготовка образцов для цитометрии потока
Перед началом: Подготовка смеси антител. Для количественной оценки популяций лейкоцитов мы рекомендуем следующую смесь при указанных разбавлениях: PE-Ly6G (клон 1A8, 1 мкг/мл), FITC-Ly6C (клон AL-21,1 мкг/мл), eFluor 450-CD45 (клон 30-F11, 2,67 мкг/мл), БТР-Ф4/80 (клон PM8 RUO, 0,67 мкг/мл), PerCP-Cy5.5-CD11c (клон N418 RUO, 0,5 мкг/мл), PE-Cy7-CD11b (клон M1/70, 0,33 мкг/мл), Alexa Fluor 700-CD3 (клон 1782, 4 мкг/мл), eFluor 605NC-CD4 (клон GK1.5, 6.67 мкг/мл). Обратите внимание, что эта смесь в 2x концентрация (см. шаг 5.5). Все антитела должны быть разбавлены в буфере FACs Wash (0,5% сыворотки теленка плода, 2mM EDTA, 0,1% азида натрия в PBS), который также должен быть подготовлен заранее. В смеси изотипа должны быть подготовлены контрольные антитела, в идеале от того же поставщика, что и помеченные антитела и в тех же концентрациях, что и специфические антитела. Образцы, обработанные антителами контроля изотипа, будут функционировать как отрицательный контроль. Любая флуоресценция, наблюдаемая в образцах, обработанных антителами для контроля изотипа, должна рассматриваться в фоновом режиме.
- Prechill центрифуга способна вращать 1,5 мл труб Эппендорф до 4 градусов по Цельсию.
- Образцы носовой лавы центрифуги при 2000 х г в течение 10 мин при 4 градусах Цельсия. Тщательно пипетка из супернатантных и резерва. Примечание: из-за небольшого количества клеток в носоглотки, клеточные гранулы не будут видны, если есть нежелательное загрязнение красных кровяных телец, которые будут ярко-красный. Если это видно, образец должен быть отброшен.
- Повторное открытие образца в 50 мкл Fc? RIIb/CD16-2 (2.4G2) антитела (который связывает рецепторы Fc и уменьшает неспецифические антитела связывания) в FACs Мыть буфер в концентрации 4 мкг /мл.
- Инкубационный образец на льду в течение 30 мин.
- Добавьте в образец 50 мкл предварительной концентрированной смеси флуоресцентных антител 2x. Отложите репрезентативную выборку из каждой экспериментальной группы, чтобы выступать в качестве контроля изотипа. Добавьте смесь изотипных антител в этот образец вместо смеси пятен.
- Инкубационный образец на льду в течение 1 часа.
- Образцы центрифуги при 2000 х г в течение 10 мин при 4 градусах Цельсия. Откажитесь от супернатанта и хессенд в 200 мкл PBS.
- Повторите шаг 5.7.
- После второй стирки, образцы центрифуги снова при 2000 х г в течение 10 мин при 4 градусов по Цельсию.
- Resuspend в любом в PBS (если работает образец немедленно) или 2% параформальдегид (если работает образцов 1-3 дней после окрашивания).
- При проведении цитометрии потока собирают максимальное количество событий на образец или до тех пор, пока весь образец не будет аспирирован. У неинфицированных, здоровых, молодых мышей, это будет всего 1000-2000 общих событий; Во время бактериальной колонизации событие, это число может увеличиться более чем в 2-5 раз зависит от состояния болезни у животных и таких факторов, как возраст и генетический фон. На рисунке 9 показаны репрезентативные результаты цитометрии потока, собранные с 3-лазерного цитометра потока Becton Dickenson LSRII с использованием цитометра Forward Scatter 450 и Side Scatter 300, хотя мы рекомендуем оптимизировать параметры для конкретного цитометра потока, который вы собираетесь использовать до сбора образцов. Примечание: если образец содержит даже следы количества загрязнения крови, общее количество собранных событий будет значительно выше, чем ожидалось, и образец должен быть дисконтирован от анализа.
6. Количественный ПЦР (qPCR) Анализ носовых лаважей
- Оттепельная клетка лизирует от шага 3.14 комнатной температуры.
- Следуйте рекомендуемому протоколу, предоставленную предпочтительной добычей РНК по выбору.
- После завершения процедуры извлечения РНК в соответствии с инструкциями, количественно количество РНК с помощью спектрофотометра или электрофорез на основе метода(рисунок 10). Мы регулярно получаем от 975 до 3250 нг общей РНК на выборку с соотношением 260/280 нм >1,7 или РНК целостности числа (RIN) вокруг, 8,1±0,13.
- Транскрибировать cDNA с помощью M-MULV Обратная транскриптаза в соответствии с протоколом производителя с 1000 нг РНК (максимум 13 мкл).
- Разбавить полученные образцы cDNA 8x, и aliquot поровну в 4 отдельно пробки для долгосрочного хранения на -20 или -80 C.
- Для измерения экспрессии генов по qPCR подготовьте 25 образцов реакций в тройном на льду или холодной глыме, содержащей: 12,5 мл 2x qPCR мастер смеси из комплекта qPCR по вашему выбору, 0,25 мкл эталонного красителя, 2 мкл разбавленной кДНК (шаг 7,5), 1 мл смешанных вперед и обратной грунтовки (400 нм финала), 9,25 мкл свободной воды РНАСЕ-ДНК. Этот протокол представляет 16 методов, опубликованныхранее.
- В целом мы находим, что двухшаговое усиление qPCR (95 градусов по Цельсию в течение 10 минут с последующим до 40 циклов х 95 градусов по Цельсию х 15 сек, 60 градусов по Цельсию х 1 мин)) является эффективным(рисунок 11a); однако, каждая грунтовка пара должна быть оптимизирована. Диссоциация (плавление) кривых должна выполняться после усиления, чтобы не было никакого неспецифического усиления. усиление(рисунок 11b)
- Мы регулярно запускаем стандартные кривые для каждого анализируемого гена, а также стандартный калибровочные (производные от однородного ткани легких или селезенки) для каждой анализируемой пластины на 96 колодец. Относительные объемы транскрипции получены путем первой нормализации значений порога сырьевого цикла (Ct) эталонным красителем и преобразования полученных значений через соответствующие стандартные кривые. Эти относительные количества впоследствии нормализуются до стандартного калибратора и гена домашнего хозяйства, если это применимо.
Результаты
Рисунок 1 представляет собой схему обзора, обобщающая основные этапы протокола. Цифры 2-3 обеспечивают визуализацию микробиологической методологии, присущей описанным в ней протоколам. Рисунок 4 представляет собой правильное позиционирование мыши для выполнения интраназальной колонизации, в то время как рисунок 5 изображает обычно изменения в весе мышей, колонизированных штаммом S. pneumoniae P1547. Цифры 6-7 представляют собой конкретные этапы носовой части промывки процесса, для вспомогательной визуализации этих двух методов. Цифры 8-11 состоят из репрезентативных результатов анализов, проведенных на образцах, взятых из носоглотки мыши после носовой лавы. В частности, рисунок 8 является репрезентативным результатом бактериальной нагрузки в носоглотку, как это определено путем культивирования носовых лав, полученных от мышей колонизированных либо с S. пневмонии штамм P1121, P1547 или P1542. Рисунок 9 представляет собой клеточный фенотипирование изолированных иммунных клеток носоглотки с использованием цитометрических методов потока. Цифры 10-11 отображают репрезентативные результаты, относящиеся к экспрессивного анализа мРНК носоглотки с помощью количественного ПЦР.
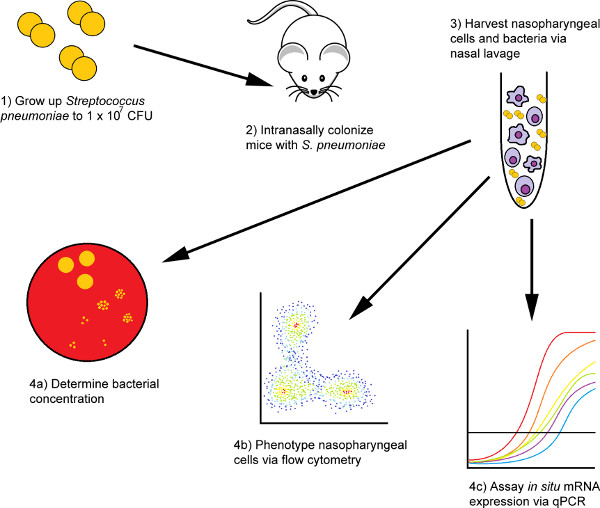
Рисунок 1. Диаграмма потока интраназальной прививки и процедур изоляции клеток носовой лавы с помощью мышиной модели. Сначала бактерии готовятся к прививке, а затем дают муриновые испытуемые интраназально. После желаемого периода времени проходит, мышей усываивать через терминальные кровотечения, и их клетки носоглотки изолированы через два носовых шага лаважа: PBS мыть шаг следуют вторичной мыть в РНК лиза буфера. Клетки из предварительной промывки PBS изолированы и проанализированы с использованием методов цитометрии потока, в то время как РНК, выделенная из второго образца, может быть использована для исследования относительного изобилия молекул, представляющих интерес на транскрипционные уровни.

Рисунок 2. Для определения бактериальной концентрации, 10 капли L помыться в тройной на пластине, разделенной на разделы, представляющие различные серийные разбавления. Эти капли затем разрешается сушить и пластин инкубируется на ночь при 37 градусов по Цельсию, 5% CO2.
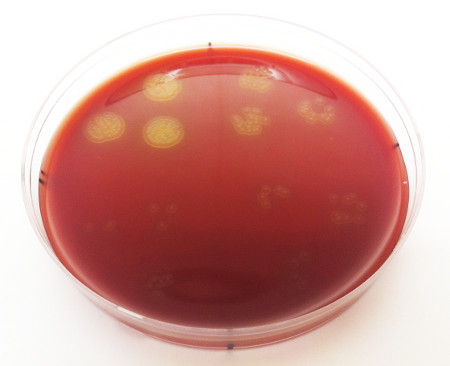
Рисунок 3. Концентрация стрептококковой пневмонии, изолированной от носоглотки представительного животного. Каждая дискретная колония представляет собой одну единицу формирования колонии, каждая коллекция колоний представляет собой одну каплю 10 мкл (поцараненной в трил-10), и каждый квадрант на пластине представляет собой отдельное последовательное разбавление. Бактериальная концентрация определяется в CFU/ml путем усреднения количества подсчитываемых, полностью сформированных колоний внутри, а затем между квалификационными квадрантами.
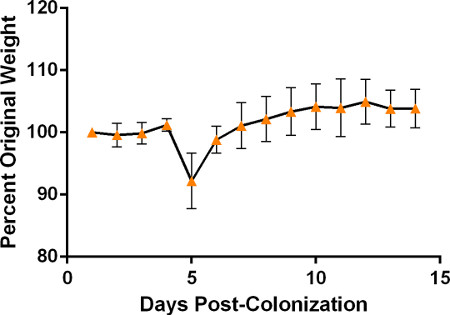
Рисунок 4. Движение любой мыши, чтобы быть привиты должны быть сведены к минимуму, особенно на шее, чтобы обеспечить надлежащую доставку бактериальной инокулы. Для этого предметная мышь сдерживается в модифицированном аппарате ограничения, состоящем из 50-мл трубки Falcon с диафрагмой на конической конце. Мышь затем расположен так, что ее нос выходит из диафрагмы, где он может быть доступен исследователем, что позволяет интраназальной прививки для будут выполнены.

Рисунок 5. Вес мышей колонизировали с штаммом P1547 от минимум 2 репрезентативных экспериментов отслеживается ежедневно после первоначальной прививки (n'6), чтобы изобразить типичные изменения в весе ожидается после колонизации носоглотки. Вес показан как процентное изменение первоначального веса. Обратите внимание на ожидаемую резкую начальную потерю веса, видимую в период с 3 по 5 дней, за которой следует стабилизация и постепенное увеличение веса выживших мышей.
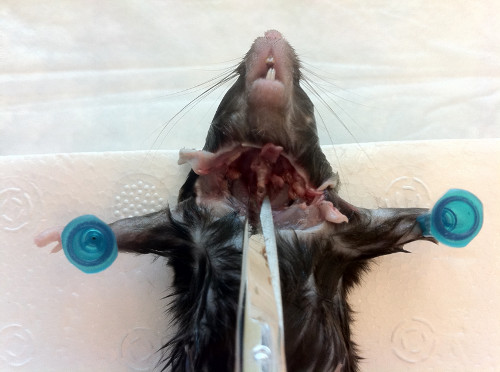
Рисунок 6. При воздействии трахеи, фланговые продольные мышцы удаляются тщательно до трахеи разрез таким образом, что не суровые окружающие кровеносные сосуды. Небольшой, полулунарный разрез затем делается на полпути вверх по трахее с помощью тонких хирургических ножниц. Важно, чтобы прорезать диаметр трахеи только частично, оставляя его нетронутым задней.
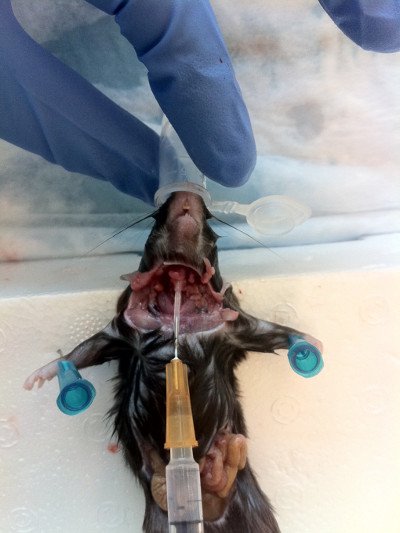
Рисунок 7. Вставка канюшеной иглы в трахею диафрагмы вверх к носу. После того, как канюла на месте, зонд осторожно, пока сопротивление не будет выполнено, а затем смыть содержимое через nares.

Рисунок 8. Репрезентативная серия бактериальной нагрузки, выделенной из носоглотки с использованием процедуры промывки носа, описанной после колонизации мышей C57BL/6 (треугольников) с штаммом P1547 (A), P1542 (B) или P1121 (C). Сравнительная колонизация мышей BALB/C (кругов) после колонизации P1121 также отображается в (C). Различные точки времени показаны на протяжении всей колонизации, включая дни 3, 7, 14 и 21. Как правило, высокая начальная нагрузка ожидается в день 3, с небольшим уменьшением в день 7. Клиренс, как правило, инициируется на 14-й день, с полным или почти полным оформлением, о чем свидетельствует день 21 после колонизации с большинством штаммов. Нажмите здесь, чтобы просмотреть большую цифру.
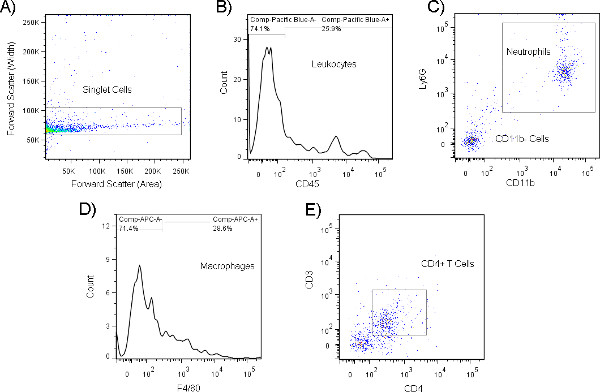
Рисунок 9. Представитель гистограммы (A) и точка участка (B) из общего числа клеток, изолированных от мурина носовых лавагов, как анализируется поток цитометрии. Дифференциальное выражение маркеров на популяциях клеток позволяет идентифицировать подмножества лейкоцитов с помощью флуоресцентных антител, направленных против этих белков. Как показано здесь, популяции лейкоцитов выбираются путем первого gating на синглетных клеток с помощью вперед рассеяния (область) по сравнению с вперед рассеяния(ширина)ворота ( ), а затем обогащения для CD45 "клеток в рамках этого подмножества (B). Эта популяция может быть дополнительно разделена на конкретные типы клеток путем закрытого для CD11b и Ly6G двойных положительных нейтрофилов (C). Анализ популяции CD11b- может быть проведен, чтобы выявить F4/80, CD11b-макрофаги (D) или CD11b-, CD3 и CD4 двойные положительные cd4 T-клетки (E). Популяции клеток могут быть фенотипированы до тех пор, пока они выражают один, или сочетание нескольких уникальных поверхностных рецепторов, которые могут быть использованы, чтобы отличить их от других типов клеток. Нажмите здесь, чтобы просмотреть большую цифру.
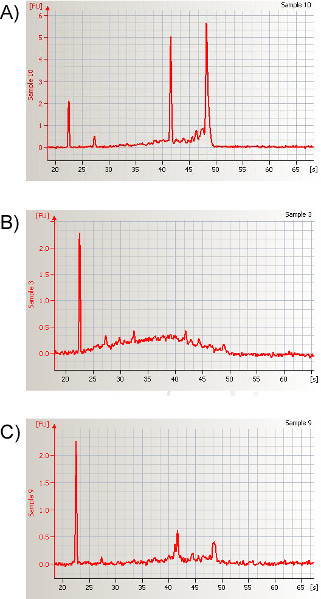
Рисунок 10. Представитель электроферограммы после электрофорезного автоматического секвенирования образца, выделенного из муриных носовых лав. Полученная электроферограмма показывает данные количественной оценки и характерную подпись высококачественного общего образца РНК, полученного из области носоглотки. При проведении анализа общей РНК для расчета их соответствующего соотношения используются области, на которых находятся пики РНК для двух основных рибосомных РНК - 18S и 28S. Значительные изменения в соотношении пиков, приписываемых 18S и 28S, как правило, свидетельствуют о деградации РНК. Степень деградации может быть обобщена числом целостности РНК (RIN); РИН для этой репрезентативной выборки составляет 8,1. Пример сильно деградированной РНК показан в(B) и (C), и последующий RIN составляет 1,9 и 4,6, соответственно. Нажмите здесь, чтобы просмотреть большую цифру.
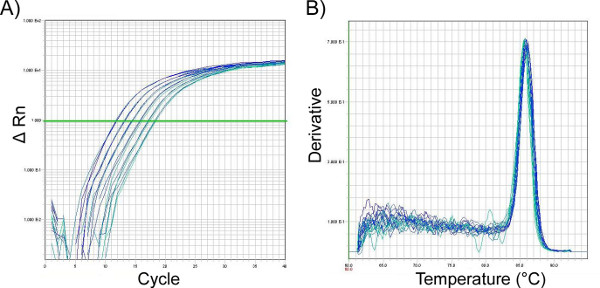
Рисунок 11. Усиление участка (A) и диссоциации (плавления) кривой (B) от qPCR анализ носовых лизолей клеток мытья, обеспечивая пример того, как эти два считывания, как правило, должны выглядеть после эффективного и правильно обнаруженного усиления продуктов мРНК, изолированных от мурин носоглотки. Представлена стандартная кривая для домашнего гена 18S. Результаты отображаются в (A) показывают желаемый продукт ПЦР после усиления с помощью грунтовки против GAPDH. Линия представляет порог цикла (Ct). Точка, в которой участки усиления, соответствующие различным образцам, пересекают этот порог, позволяет проводить сравнение между образцами, при этом в нем содержится более низкие значения, соответствующие более высоким количествам РНК, представляющих интерес. Сюжет в(B) показывает, что максимальная температура плавления продукта qPCR составляет 85 градусов по Цельсию и что в этой реакции нет загрязняющих продуктов, которые будут проявляться как дополнительный пик, отделенный от желаемого пика продукта. Нажмите здесь, чтобы просмотреть большую цифру.
| Название штамма | Серотип | вирулентность | Смертность у мышей | Ожидаемая продолжительность колонизации |
| P1121 | 23F | бессимптомный | 0% | 21-28 дней |
| P1542 | 4 | низкий | 0-20% | 21-28 дней |
| P1547 | 6A | средний | 20-50% | 14-21 день |
| D39 | 2 | высокий | 70-100% | 14-21 день |
Таблица 1. Табакулярный обзор 4 обычно используемых S. pneumoniae клинических штаммов изолята, их соответствующее число серотипа, связанные степени вирулентности, ожидаемая доля в инвазивности в колонизированной подмножество мышей и типичная продолжительность колонизации носоглотки.
Обсуждение
В этом исследовании мы представили подробные методы интраназальной колонизации мышей с использованием клинического изолятного штамма стрептококковой пневмонии и последующей изоляции и характеристики иммунных клеток, набранных в носоглотку в ответ на бактерии. Мы продемонстрировали, как бактериальный инокулум может быть откорен в богатых питательными веществами средствах массовой информации и используется для создания события колонизации у мышей, которые первоначально ограничивается носоглотки. Затем мы показали, как ответ иммунных клеток типов, которые набираются в носоглотку могут быть изолированы после воздействия трахеи, разрез и носовой промывки с помощью каннулированной иглы. Образцы носовой лавы могут быть собраны в PBS, чтобы изолировать нетронутыми, слегка приверженными клетками; РНК из более плотно приверженных клеток и окружающих эпителиальных слизистых слоя могут быть изолированы путем применения вторичного мытья, состоящего из буфера РНК лиза. Первый из этих образцов может быть использован для фенотипа конкретных клеток, набранных в контексте колонизации с помощью методов цитометрии потока, в то время как последний может быть применен к анализу ПЦР, чтобы определить функции эффектора этих набранных клеток, глядя на транскрипционные выражения иммунных регуляторов, представляющих интерес. Образцы носовой лавы могут быть дополнительно использованы для определения кинетики очистки бактериальной колонизации событие сравнения различных экспериментальных групп для решения конкретных вопросов исследования.
Использование этого метода интраназальной колонизации позволяет создать событие колонизации, которое изначально ограничивалось носоглотки животного. Поэтому любое последующее распространение бактерий в кровь или органы происходит вторично по отношению к нарушениям иммунной защиты, локализованным в слизистой оболочке носоглотки. Шаг за шагом прогрессии, достигнутой с помощью этой модели отражает более точно процесс пневмоккокального вторжения в организме человека, что позволяет изучать динамику между колонизации бактерий и принимающей слизистой оболочки носа - и, возможно, лучше понять сдвиги в бактериальной патогенности и / или принимающей иммунитет, которые позволяют для развития распространения болезни. Это в отличие от моделей, которые отказаться от создания первоначального события колонизации и избрать для изучения инвазивных заболеваний в изоляции путем прямой доставки бактериального инокулума в легкие через внутритрахаэль закапывания, в кровь через сосудистые инъекции или в брюшной полыше через перитонеальной инъекции.
Проведение PBS носовой лаваж после колонизации событие позволяет для изоляции не- или слегка-адепт клеток, набранных в носоглотку, а также любые слизисто-ассоциированные бактерии. Следует отметить, однако, что этот метод ограничен, поскольку он не будет выпускать клетки или бактерии, которые путешествовали между или под эпителия, и не позволит для сбора клеток или бактерий, которые локализованы в носовой связанных лимфоидной ткани (NALT), лимфоидный орган, который, как сообщается, потенциальное место инфекции после пневмококковойколонизации 17,18. Если дальнейшее изучение NALT желательно, мы рекомендуем микродиссекции и удаления этой ткани оптом для изучения после PBS носовой лаваж; поскольку эти два метода не являются взаимоисключающими, они могут проводиться на одном и том же животном. Однако, из-за литика и разрушительного характера шага сбора РНК (вторичного лаважа с использованием буфера РНК-лиза), этот шаг следует исключить, если он намеревается собрать NALT. Хотя носовой промывки является менее технически сложной процедурой, для групп, желающих получить более полную оценку бактериальной нагрузки, которая включает в себя не только слизисто-ассоциированных бактерий, но и тех, которые вторглись в ткани носоглотки, мы предлагаем уборки носоглотки ткани после удаления верхней кости черепаколонизированных мышейи вскрытия тканей в носовой конче, как описано другими 19 .
Характер вызываемого иммунного ответа зависит от взаимодействия между хозяином и патогеном. На сегодняшний день охарактеризовано более 90 серотипов S. pneumoniae, все с различными уровнями патогенности и экспрессии фактора вирулентности, что приводит к дифференциальной распространенности срединаселения 20-23. Аналогичным образом, у мышей, было сообщено, что степень, и кинетики, связанные с, иммунный ответ, вызываемый в ответ на колонизацию носоглотки зависит от колонизации штаммасебя 24. Таким образом, выбор соответствующего штамма для использования для создания колонизации носоглотки не является тривиальным вопросом, равно как и выбор генетического фона мыши. На рисунке 8 приводятся выборочных данных, которые изображают кинетику клиренса колонизации носоглотки из 3 различных штаммов S. pneumoniae после интраназальной колонизации самок мышей на фоне C57BL/6. Таблица 1 обеспечивает обзор степени вирулентности и продолжительности ожидаемого времени колонизации (при использовании на фоне C57BL/6) с 4 S. pneumoniae клинических штаммов изолята, описанных в литературе и, как известно, способны установить колонизации носоглотки25: avirulent P1121 (серотип 23F)26,27 низкой вирулентности P1542 (серотип 4)28, середина вирулентности P1547 (серотип 6A)29-31, и широко используется, хорошо охарактеризованный, очень вирулентный D39 (серотип 2)32-36. Если экспериментальная цель состоит в том, чтобы строго изучить аимптоматические события колонизации носа без сопровождения бактериального распространения в другие ткани, мы рекомендуем использовать авирулентный штамм P1121, который характеризуется как мощный колонизатор, как более длительные события колонизации (до 28 дней до наблюдаемого зазора) являются отличительной чертой этого штамма. Обычно мыши колонизированы с P1121 не будет работать без риска инвазивных заболеваний и не будет отображать клинические показатели болезни (за исключением временной потери веса). Остальная часть штаммов должны быть использованы в зависимости от желаемой степени вирулентности и связанной с ними смертности, с вирулентностью, чтобы означать не степень инфекции, которая развивается в пределах отдельной мыши, а скорее доля мышей, которые проявляют клинические признаки заболевания. Следует также отметить, что, как правило, степень вирулентности обратно коррелирует с продолжительностью продолжительности колонизации, при этом более опасные штаммы колонизируются в течение более короткого периода времени. Все 3 описанных вирулентных штамма приводят к смертности у мышей из-за, чаще всего, сепсиса, с фульминантной пневмонией, или одновременной пневмонией и сепсисом, развивающимся в подмножестве мышей. Различия в локализации инвазивных бактерий могут быть штамм-специфических, как это было ранее сообщалось, что некоторые штаммы показывают тропизмы для конкретныхорганов 37. В небольшом проценте животных, спонтанный менингит может также развиваться после колонизации. Определение причины смерти, а также степень инвазивности, может быть достигнуто путем сбора связанных тканей (легких, селезенки и / или мозга) от животных в конечной точке. Гомогенизация этих тканей и последующее покрытие может указывать на наличие инвазивных бактерий и соответствующих титров.
Пример количественной оценки плотности бактериальной культуры показан на рисунке 3. Если культура слишком сконцентрирована, колонии растут слишком плотно, чтобы их можно было пересчитать по отдельности, однако колонии, полученные из одиночных клеток, можно отличить, если помять серию разбавления журналом. Покрытие трех технических репликаций на разбавление сводит к минимуму изменчивость. Пожалуйста, обратите внимание, что при количественной оценке бактерий, извлеченных из носовой колонизации событие, можно столкнуться с кокультурных загрязняющих веществ, представляющих другие бактериальные виды одновременно изолированы от murine носоглотки. Если бактериальный штамм, представляющий интерес, имеет какие-либо известные устойчивости к антибиотикам (например, многие штаммы S. pneumoniae устойчивы к гентамицину или неомицину до 5 мкг/мл), можно свести к минимуму заболеваемость загрязняющими веществами, дополнив средства роста антибиотиком в соответствующей концентрации, тем самым ограничив рост загрязняющих веществ.
Цитометрия потока может быть использована для анализа маркеров поверхности клеток на образцах носовой лавы. Например, для анализа типов клеток, набранных в контексте инфекции, можно использовать смесь антител, специфичных для валовой дифференциации лейкоцитов, включая макрофаги (F4/80), нейтрофилов (CD11b и Ly6G) и Т-клеток (CD3 и CD4 или CD8). Кроме того, эти анализы могут быть объединены с цитометрическим анализом потока, проведенным на различных тканях или крови, чтобы лучше понять торговлю иммунными клетками в ходе инфекции. Из-за ограничения числа клеток (как правило, число в низких тысяч), которые могут быть изолированы от носоглотки, выявление редких подмножеств, как правило, сложной задачей, хотя исследователи, желающие достичь этого следует рассмотреть вопрос об объединение образцов из нескольких мышей для достижения желаемого количества клеток. Кроме того, поскольку из этого региона можно извлечь конечное количество ячеек, мы рекомендуем анализировать эти данные с точки зрения общего числа клеток.
Хотя уровни экспрессии белка, как правило, низки в носоглотке, ограничивая возможность анализа производства белка, можно проанализировать производство молекул-хозяй в ответ на колонизацию бактерий на уровне РНК. Для этого можно проводить промывки носа с использованием буфера РНК-лиза вместо PBS, что позволяет проводить анализ экспрессии генов. Для обнаружения усиления qPCR важно запустить соответствующую кривую диссоциации(рисунок 11),чтобы обеспечить обнаружение правильного и желаемого продукта. Это связано с тем, что анализ будет обнаружить любые двойные мель ДНК, включая грунтовки димеры, загрязняющих ДНК, и ПЦР продукт из неправильной грунтовки.
Мы надеемся, что описанные здесь методы будут побуждать вас применять модель интраназальной колонизации для изучения реакции принимающих людей на патогенные микроорганизмы, важные в контексте этого недостаточно изученного региона. Для некоторых человеческих патогенов, таких как S. pneumoniae, предшествующее событие колонизации носоглотки действует как важный предшественник последующего распространения бактерий и фатальных сиквелов, которые могут последовать, в том числе распространение в легкие, которые могут привести к пневмонии, или же в кровь, и в результате бактериемии и септического шока. Таким образом, изучая бактериальную колонизацию в этом регионе, мы можем лучше понять, как ее контролировать и вообще предотвратить более серьезную патологию.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить д-р Джеффри Вайзер из Университета Пенсильвании за его дар клинических штаммов стрептококковой пневмонии. Эта работа финансировалась Канадскими институтами исследований в области здравоохранения. CV финансировался стипендией M. G. DeGroote и стипендией Канадского торакального общества. Эта работа финансировалась Ассоциацией легких Онтарио и Канадскими институтами медицинских исследований (CIHR). Работа в лаборатории Боудиш частично поддерживается он Майкл Г. DeGroote Центр исследований инфекционных заболеваний и McMaster иммунологический исследовательский центр.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-Mouse Ly6C FITC | BD Pharmingen | 553104 | |
| Anti-Mouse Ly6G PE | BD Pharmingen | ||
| Anti-Mouse CD45.1 eFluor 450 | eBioscience | 48-0453-82 | |
| Anti-Mouse F4/80 Antigen APC | eBioscience | 17-4801-82 | |
| Anti-Mouse CD11c PerCP-Cy5.5 | eBioscience | 45-0114-82 | |
| Anti-Mouse CD11b PE-Cy7 | eBioscience | 25-0112-82 | |
| Anti-Mouse CD3 Alexa Fluor 700 | eBioscience | 56-0032-82 | |
| Anti-Mouse CD4 eFluor 605NC | eBioscience | 93-0041-42 | |
| Intramedic Polyethylene Tubing - PE20 | Becton Dickinson | 427406 | |
| BD 1 ml Syringe | Becton Dickinson | 309659 | |
| BD 26 G 3/8 Intradermal Bevel | Becton Dickinson | 305110 | |
| Buffer RLT Lysis Buffer | Qiagen | 79216 | |
| Difco Tryptic Soy Agar | Becton Dickinson | 236950 | |
| Defibrinated Sheep Blood | PML Microbiologicals | A0404 | |
| RNAqueous-Micro Kit | Ambion | AM1931 | |
| M-MuLV Reverse Transcriptase | New England Biolabs | M0253L | |
| GoTaq qPCR Master Mix | Promega | A6001 |
Ссылки
- Bogaert, D., de Groot, R., et al. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect. Dis. 4, 144-154 (2004).
- Kadioglu, A., Weiser, J. N., et al. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat. Rev. Microbiol. 6 (4), 288-301 (2008).
- McCool, T. L., Cate, T. R., et al. The immune response to pneumococcal proteins during experimental human carriage. J. Exp. Med. 195, 359-365 (2002).
- Nelson, A., Roche, A. M., et al. Capsule enhances pneumococcal colonisation by limiting mucus-mediated clearance. Infect. Immun. 75, 83-90 (2007).
- van Rossum, A., Lysenko, E., et al. Host and bacterial factors contributing to the clearance of colonisation by Streptococcus pneumoniae in a murine model. Infect. Immun. 73, 7718-7726 (2005).
- Barocchi, M. A., Ries, J., et al. A pneumococcal pilus influences virulence and host inflammatory responses. Proc. Natl. Acad. Sci. U.S.A. 103, 2857-2862 (2006).
- Malley, R., Henneke, P., et al. Recognition of pneumolysin by Toll-like receptor 4 confers resistance to pneumococcal infection. Proc. Natl. Acad. Sci. U.S.A. 100, 1966-1971 (2003).
- McCool, T. L., Weiser, J. N. Limited role of antibody in clearance of Streptococcus pneumoniae in a murine model of colonization. Infect. Immun. 72, 5807-5813 (2004).
- Gingles, N. A., et al. Role of genetic resistance in invasive pneumococcal infection: identification and study of susceptibility and resistance in inbred mouse strains. Infect. Immun. 69 (1), 426-434 (2001).
- Jeong, D., Jeong, E., et al. Difference in resistance to Streptococcus pneumoniae infection in mice. Lab Anim. Res. 27, 91-98 (2011).
- Wu, H. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Southam, D. S., Dolovich, M., et al. Distribution of intranasal instillations in mice: effects of volume, time, body position. Lung Physiol. 282, 833-839 (2002).
- Miller, M. A., Stabenow, J. M., et al. Visualization of Murine Intranasal Dosing Efficiency Using Luminescent Francisella tularensis: Effect of Instillation Volume and Form of Anesthesia. PLoS ONE. 7 (2), (2012).
- Briles, D. E., Novak, L. Nasal Colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73 (10), 6945-6951 (2005).
- Wu, H. -. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Mo, Y., Wan, R., et al. Application of reverse transcription-PCR and real-time PCR in nanotoxicity research. Methods Mol. Biol. 926, 99-112 (2012).
- Kuper, C. F., Koornstra, P. J., et al. The role of nasopharyngeal lymphoid tissue. Trends Immunol. 13, 219-224 (1992).
- Zhang, Q., Leong, S. C., et al. Characterisation of regulatory T cells in nasal associated lymphoid tissue in children: relationships with pneumococcal colonization. PLoS Pathog. 7, (2011).
- Briles, D. E., Novak, L., et al. Nasal colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73, 6945-6951 (2005).
- Weinberger, D. M., Trzcinski, K., et al. Pneumococcal capsular polysaccharide structure predicts serotype prevalence. PLoS Pathog. 5, (2009).
- Bryant, W. P., J, , et al. Which Pneumococcal Serogroups Cause the Most Invasive Disease: Implications for Conjugate Vaccine Formulation and Use, Part I.. Clin. Infect. Dis. 30, 100-121 (2000).
- Hausdorff, W. P., Feikin, D. R., et al. Epidemiological differences among pneumococcal serotypes. Lancet Infect. Dis. 5, 83-93 (2005).
- Brueggemann, A., Griffiths, D., et al. Clonal Relationships between Invasive and Carriage Streptococcus pneumoniae and Serotype and Clone Specific Differences in Invasive Disease Potential. J. Infect. Dis. 187, 1424-1432 (2003).
- Mohler, J., Azoulay-Dupis, E., et al. Streptococcus pneumoniae strain-dependent lung inflammatory responses in a murine model of pneumococcal pneumonia. Intensive Care Med. 29, 808-816 (2003).
- Wu, H. Y., Virolainen, A., Mathews, B., King, J., Russell, M. W., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Zhang, Z., Clarke, T. B., et al. Cellular effectors mediating Th17-dependent clearance of pneumococcal colonization in mice. J. Clin. Invest. 119, 1899-1909 (2009).
- Parker, D., Martin, F. J., et al. Streptococcus pneumoniae DNA initiates type I interferon signaling in the respiratory tract. MBio. 2, (2011).
- Haya, D. L., Camilli, A. Large-scale identification of serotype 4 Streptococcus pneumoniae virulence factors. Mol. Microbiol. 45, 1389-1406 (2002).
- Nakamura, S., Favis, K. M., et al. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. J. Clin. Invest. 121, 3657-3665 (2011).
- Kim, J. O., Weiser, J. N. Association of intrastrain phase variation in quantity of capsular polysaccharide and teichoic acid with the virulence of Streptococcus pneumoniae. J. Infect. Dis. 177, 368-377 (1998).
- Roche, A. M., King, S. J., et al. Live attenuated Streptococcus pneumoniae strains induce serotype-independent mucosal and systemic protection in mice. Infect. Immun. 75, 2469-2475 (2007).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Richards, L., Ferreira, D. M., Miyaji, E. N., Andrew, P. W., Kadioglu, A. The immunising effect of pneumococcal nasopharyngeal colonisation; protection against future colonisation and fatal invasive disease. Immunobiology. , 215-251 (2010).
- Lanie, J. A., Ng, W. L., et al. Genome sequence of Avery's virulent serotype 2 strain D39 of Streptococcus pneumoniae and comparison with that of unencapsulated laboratory strain R6. J. Bacteriol. 189, 38-51 (2007).
- Robertson, G. T., Ng, W. L., Foley, J., Gilmour, R., Winkler, M. E. Global transcriptional analysis of clpP mutations of type 2 Streptococcus pneumoniae and their effects on physiology and. 184, 3508-3520 (2002).
- Orihuela, C. J., Gao, G., et al. Tissue-specific contributions of pneumococcal virulence factors to pathogenesis. J. Infect. Dis. 190, 1661-1669 (2004).
- Orihuela, C. J., Gao, G., et al. Organ-specific models of Streptococcus pneumoniae disease. Scand. J. Infect. D. 35, 647-652 (2003).
- Swirski, F. K., Nahrendorf, M., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены