Method Article
肺炎球菌による鼻腔内コロニー形成時の炎症反応の特徴
要約
肺炎球菌によるマウス鼻咽頭のコロニー形成および後の付着またはリクルートされた細胞の抽出について説明する。この技術は、ナアレスを通して鼻咽頭および流体の収集を洗い流し、その場所でのmRNA発現の差動細胞定量および分析を含む様々な読み出しに適応可能である。
要約
肺炎球菌による鼻咽頭コロニー形成は、肺または血流1に侵入する前提条件である。この生物は、鼻咽頭の粘膜表面を植民地化することができ、宿主の他の組織に侵入するために宿主防御を克服し、増殖し、最終的に克服することができる。通常下気道に感染を起こすと肺炎が生じる。あるいは、細菌は、高い死亡率2に関連する細菌血症を引き起こす血流に広がり得るか、またはそれ以外の場合は肺炎球菌性髄膜炎の発症に直接導く。鼻咽頭コロニー形成の運動学および免疫応答を理解することは、S.肺炎感染モデルの重要な側面である。
我々の鼻腔内コロニー形成のマウスモデルは、ヒトモデル3 から適応され、鼻咽頭4-7における宿主病原体応答の研究において複数の研究グループによって使用されている。モデルの最初の部分では 、S.肺炎 の臨床的分離株を使用して、ヒト成人のキャリッジイベントに似た自己制限細菌コロニー形成を確立する。本明細書で詳述される手順は、細菌接種の調製を含み、続いて鼻腔内投与経路を介して接種を送達することによってコロニー形成事象を確立する。居住マクロファージは、定常状態の間に鼻咽頭の主要な細胞型である。典型的には、未感染マウス8に存在するリンパ球はほとんど存在しないが、粘膜コロニー形成は、免疫応答とその後の宿主免疫細胞の動員をもたらす低位から高等級の炎症(細菌種および株の病原性に応じて)をもたらす。これらの細胞は、ナレスを通して気管内容物の洗浄によって単離され、感染の動態をよりよく理解するためにコロニー形成細菌の密度と相関することができる。
プロトコル
開始する前に:特に明記されていない限り、すべてのステップはバイオハザードレベル2(BSL2)生物学的安全キャビネット(BSC)で行われます。実験開始前に、感染性細菌病原体の使用に関する適切なバイオハザード承認を、施設ガイドラインに従って取得していることを確認してください。また、事前に準備した手順を実施するために必要な材料と試薬をすべて用意してください。これらの実験で使用されたマウスには、ジャクソン研究所、チャールズ川またはタコニックの雌C57BL/6マウスが含まれており、10〜14週齢であった(鼻コロニー形成クリアランスまたは感染の運動学に性別依存的有意な差は見つかっていない)。これらの実験で使用されたすべてのマウスは、特異的病原体の自由な条件下で飼育および維持され、一般的なウイルス(LCMV、MNV、MPV、レオウイルスECTV、およびその他の)細菌(例えば、ピロリ菌)および寄生虫(例えば、ピノリ、エクトパラサイト)を、便サンプル検査およびセンチネルコド内の頻繁な解剖学的評価によって含まなかった。これらの実験を行う際には、10~12週未満で、6ヶ月未満のマウスを使用することをお勧めします。この年齢範囲より若いまたは古いマウスは、より長い鼻咽頭のキャリッジ期間に影響を受けやすく、感染を広める可能性が高くなります。マウスの背景は、異なる遺伝的背景のマウスがS.肺炎D39(血清型2)株9,10に異なる感受性を有することを示しているので、コロニー形成実験の結果に影響を与える可能性のあるもう一つの重要な考慮事項である。S. 肺炎は天然のネズミ病原体ではなく、その唯一の天然貯水池はヒト鼻咽頭である。伝達は呼吸液滴を介して起こり、マウスは呼吸分泌を産生しなくて、個々のマウスは他のマウスに細菌を伝達することができないので、マウスからマウスへの伝達に関する懸念はない。この原稿に記載されている手順の概要については、図1を参照してください。
1. S. 肺炎文化の 準備
- 肺炎球菌の懸濁成長のためのトリプティック大豆寒天の5 mlを接種する。
- 5%CO2の37°Cでの静条件下での培養は、600nmに設定された走行距離計で決定された108 CFU/mlの対応する液体密度で、細菌の接種が対数相成長に達する。このCFUに対応する正確な読み取り値は、特定の選択された細菌株によって異なります。肺炎のS.肺炎のほとんどの株のために、これは0.45-0.55のOD600範囲に対応する。典型的には、液体培養中のS.肺炎株は、サブキュリングを必要としない推奨条件下で1.5〜2.5時間以内にこの密度に成長する。これは、細菌がもはや対数相成長ではなく、広範な自己起合を受けている点を表すので、培養物が過剰増殖(0.75のOD読み取り値を超えて)許されるべきではない。
- 各マウスは約107 個の細菌を接種する。したがって、9匹のマウスがコロニー形成されるたびに、ピペット1mlの接種液をエッペンドルフ管に入れ、15,000xgで1分間回転させる。白っぽいペレットが見えるはずです。上清を取り除き、ペレットを乱さないよう気をつけて、100μlのリン酸緩衝生理食塩液(PBS)で細菌を再懸濁し、濃度を109 CFU/mlに増加させます。この段階では、細菌は生存可能であり続けるべきであるが、容易に複製されない。
- 複数のアリコートを使用する場合は、1つのチューブに組み合わせて、細菌密度のわずかなサンプル間変動を制御します。
- 細菌を接種の準備ができるまで氷の上に置いておき、最大1時間保管してください。
- 正確な細菌数を得るために、きちんとした細菌接種から始まる対数的な連続希釈シリーズを行う。連続して10倍に希釈し、10 μlを90 μlの無菌PBSに加えます。
- 希釈液の10 μlサンプルの3滴をプレートアウト 10-5 - 10-9、プラスPBSのみの汚染制御、トリプティック大豆寒天(TSA)プレートの5%の羊の血液を補った別々にラベル付けされたセクションに(図2)。ピペットチップは、余分な細菌を持ち越し、結果のばらつきを避けるために、より高いCFU濃度から低いCFU濃度に希釈する各ステップに対して変更されることを確認してください。ヒト血寒天(HBA)プレートもTSAの代わりに使用することができる。 S.肺炎 の多くの株はネオマイシン(5〜20 μg/mlから)に耐性があるので、この抗生物質はプレート調製段階で選択した寒天培地に添加することもできる。これは、非耐性細菌を排除するので、列挙を容易にします.各株の抗生物質感受性は、各細菌株に使用する抗生物質の最適濃度を決定するために事前にテストする必要があります。
- 15〜30分間乾燥させ、プレートを覆い、37°Cと5%CO2に設定した細菌インキュベーターに逆さまに置きます。24時間プレート上の細菌コロニーを育てる。
- コロニー形成ユニットの数とそれに対応する濃度を決定します。OD600値の決定に基づいて、濃度は1-4 x 109 CFU/ml.S.の範囲内にあるべきであり、肺炎のコロニーは黄色がかった小さなコロニーとして現れ、中央に小さなくぼみがドーナツのような外観を与える(図3)。
2. ネズミの鼻腔内コロニー形成
- マウスをマウスの抑制装置(先端を切り取って絞りを作る修正された50mlファルコンチューブ)に置いて拘束し、鼻が拘束装置の先細りの端から出てくるように親指で体の付け根で固定する(図4)。この装置の使用は動きを最小にする方法でマウスの頭部の固定化およびナレスの分離を可能にするだけでなく、ピペット先端を咀嚼する動物からの試みを妨げる、接種の完全な送達を可能にする。あるいは、マウスは首での擦り傷および手動拘束によって固定することができる。鼻腔内接種前の動物の麻酔は推奨しません。麻酔下で動物に接種を管理すると、肺に広がる接種の一部が生じる。
- P10またはP20ピペットを使用して、調製した培養物の10μlを堆積させて各マウスを接種し、両ナレス間で均等に分配する(接種を徐々に脈動させて鼻に滴り落ちるようにし、マウスが接種に時間を取る)。接種の完全な送達を達成するために、マウスが鼻を過度に動かし始める任意の時点で投与を一時停止する。マウスは呼気中に鼻から一部を排出する可能性があるため、接種全体をナレスに注入することはできません。しかし、排出量はマイナスになる傾向があり、接種量は非常に多くの細菌を含むため、これはコロニー形成細菌負荷に大きな影響を与えません。さらに、鼻咽頭粘膜のコロニー形成に利用可能な表面積は限られており、その結果、我々および他の人々は、推奨される107 用量が全てのマウスにおいて一貫したレベルの細菌を得るのに十分であることを発見し、その結果、コロニー形成細菌14,15 の初期量の変動が最小限となる。
- エンドポイントモニタリングの一環として体重インジケーターを使用する場合は、マウスの重量を量ります。無気力、フリルファー、体重減少などの臨床症状について、12〜24時間ごとにマウスを監視します。マウスは通常、植民地化後3〜5日まで病気の症状を示さないが、これらは1日平均体重の約5%の体重の体重減少が先行する。マウスがますます病気になるにつれて、彼らはハンチング姿勢を想定し、活動の減少と刺激に対する応答性の低下を示します。この段階では、病気は通常敗血症および/または肺炎を示し、終末期である可能性が高いが、マウスは結果を改善するために毎日1mlの皮下生理食音で治療される可能性がある。生き残ったマウスは、体重の安定化と体重増加の後に証明されるように、7日後に改善を示し始めるべきであるが 、S.肺炎 の異なる株はより迅速に病気を誘発し、異なる時系列に沿って臨床症状の進行をもたらす可能性がある。P1547株でコロニー形成されたマウスで追跡された体重の代表的な結果については 、図5 を参照してください。
3. 鼻洗浄サンプルコレクション
開始する前に:26 3/8 Gベベリング針でキャップされた1 mlの注射器を使用してカニューレ針を準備します。内径0.38mmのPE20ポリエチレンチューブ2.5cmをカットし、各端部にベベリングチップがあることを確認します。鉗子を使用して、長さ2.5cmのPE20ポリエチレンチューブ(内径0.38mm)を針先にスライドさせ、チューブ側の穿刺を避けます。カニューレツ針は必要になるまで70%エタノールに保つことができます。
- 実験マウスを安楽死させる。頸部脱臼は気管を損傷する可能性がありますので、安楽死のこの方法は避けなければなりません。私たちの好ましい方法は、イソフルラン麻酔に続いて排泄ですが、安楽死モードを選択する際に制度ガイドラインに従うことを確認してください。
- 70%水エタノールを使用して、動物、特に首のスーパーアンテリオールファーを殺菌し、エタノールがナレスにアクセスするのを防ぐように注意する。
- 動物の首の正中線に沿って単一の縦方向のカットを行い、両端に2つの水平カットを行い、気管を想像する開口部を作成します。
- 慎重に両側に皮膚を剥がし、下の首の組織を明らかにする。
- 気管は、両側の縦方向の筋肉に囲まれて、目に見えるはずです。慎重に気管自体の明確なビューを提供するためにこれらを切り取ります, 周囲の血管系を切断しないように注意してください.
- 血管系を切断し、血液が存在する場合は、進行する前に、出血を停止させ、滅菌PBSを分配し、滅菌ガーゼを使用して領域内の余分な水分を穏やかに浸漬することによって、領域を数回浄化します。
- 気管が正しく露出したら、気管の横方向の半月切りを半方向に切り取ります(図6)。
- 以前に調製したカニューレート針に1,000 μlの滅菌PBSを引き出します。
- 鼻に向かって気管にカニューレを挿入し、ベバの端を下向きにして挿入を容易にします(図7)。針を所定の位置に置いたら、180°回転させ、耐光性が感じるまで優しく上向きにプローブします。
- サンプルコレクション用に指定されたエペンドルフをマウスの鼻のすぐ下に置きます。
- PBS洗浄液の最小(〜20 μl)量を分配することによって針の正しい配置をテストする - 流体の滴は、マウスのナレスの周りに形成する必要があります。この場合は、ステップ 3.13 に進みます。
- テストPBSが動物の口から直接出てきた場合は、カニューレを後ろに引き戻し、非常にわずかな抵抗が感じられるまで再び穏やかに前方に探査することによって再配置する - 鼻口蓋を越えて口腔に移動するので、この抵抗を超えてカニューレを押し過ぎないように注意してください。
- 細胞の最大量を置き換え、収集するのを助けるために針の内容を迅速に分配する - 内容物は、マウスのナレスを介して、コレクションチューブに流れ出る必要があります。すぐに氷の上にサンプルを置きます。
- RNA分析用のサンプルを収集するには、同じマウス上のRNAリシスバッファーの500 μlを含むカニューレート針を使用して、ステップ3.8~3.13)を繰り返します。これは、初期のPBS洗浄に続いて非接着細胞を除去するはずであったため、主に鼻咽頭粘膜上皮で構成される残りの細胞集団からの溶菌サンプルの収集を可能にする。RNAのリシスバッファーは上皮を脱皮し、周囲の組織を破壊することに注意してください、 これらの組織の保持が望まれる場合は、肺などの器官との接触を避けるために注意する必要があります。採取したら、RNAのリシスバッファーに直接ドライアイスの上にサンプルを置き、凍結をスナップします。一度のリシスバッファーに、サンプルは、メーカーの指示に従って保存することができ、そして、典型的には数ヶ月間-70°Cで安定しています。
4. 鼻咽頭における細菌負荷の測定
- 各マウス鼻溶岩サンプル用のシリアル希釈シリーズを調製して細菌を定量化します。一般に、細菌負荷は0-104 CFUの間であると予想され、したがって3つの10倍の連続希釈を行う。1番目のチューブに10μlの清い鼻洗浄サンプル(100 CFU/ml)を加える。
- 細菌学プレートを象限に分割し、希釈系列(100-10-3 CFU/ml)のメンバーを持つ各領域をラベル付けします。 図2のように、3つの希釈液の10μlサンプルと、5%の羊の血液を補ったトリプティック大豆寒天プレートのきちんとしたサンプルを3滴プレートアウト。
- 15〜30分間乾燥させ、プレートを覆い、細菌増殖に最適な条件(通常37°Cおよび5%CO2)の細菌インキュベーターに逆さまに置きます。
- 18-24時間プレート上の細菌コロニーを育てる。
- 各希釈についてプレート上に形成されたコロニーを平均化してコロニー形成細菌の数を決定する(図3)。図8は、異なるタイムポイントの間の細菌密度を示し、鼻洗浄物の培養によって決定されるように、最大21日間のS.肺炎の3つの異なる株で植民地化されたマウスにおいて。
5. フローサイトメータのサンプルの調製
開始する前に: 抗体の混合を準備します。白血球の個体数の定量化については、指定された希釈液で以下の混合を推奨します: PE-Ly6G (クローン1A8、 1 μg/ml)、FITC-Ly6C(クローンAL-21,1 μg/ml)、eFluor 450-CD45(クローン30-F11、2.67 μg/ml)、APC-F4/80(クローンPM8 RUO、0.67 μg/ml)、PerCP-Cy5.5-CD11c(クローンN418、RUO 0.5 μg/ml)、PE-Cy7-CD11b(クローンM1/70、0.33 μg/ml)、アレクサフルオール700-CD3(クローン1782、4 μg/ml)、eFluor 605NC-CD4(クローンGK1.5、6.67 μg/ml)。このミックスは2倍の濃度であることに注意してください(ステップ5.5を参照)。すべての抗体は、FACsウォッシュバッファー(0.5%胎児の子牛血清、2mM EDTA、PBS中の0.1%ナトリウムアジド)で希釈する必要があります。アイソタイプ一致対照抗体の混合物において、理想的には標識抗体と同じサプライヤーから、および特異的抗体と同じ濃度で、調製されるべきである。アイソタイプ対照抗体で処理されたサンプルは、陰性対照として機能する。アイソタイプ対照抗体で処理されたサンプルで観察される蛍光は、背景と考えるべきである。
- プレチルは、1.5mlのエペンドルフ管を4°Cに紡糸することができる遠心分離機である。
- 遠心分離器の鼻洗浄サンプルを2,000 x gで4°Cで10分間用いた。 上清と予備を慎重にピペットアウト。注: 鼻咽頭内の細胞の量が少ないため、望ましくない赤血球汚染が存在しない限り、細胞ペレットは見えません。これが見られた場合、サンプルは破棄されるべきです。
- Fcの50 μlでサンプルを再中断しますか?4 μg/mlの濃度でのFACsウォッシュバッファーにおけるRIIb/CD16-2(2.4G2)抗体(Fc受容体に結合し、非特異的抗体結合を減少させる)。
- 氷上で30分間サンプルをインキュベートします。
- 調製済みの2x濃縮蛍光抗体ミックスを50 μl加えて、サンプルにします。各実験グループの代表的なサンプルを、アイソタイプコントロールとして機能するように脇に置きます。このサンプルにアイソタイプ抗体ミックスを加えて、染色ミックスの代わりに使用します。
- 氷上でサンプルを1時間インキュベートする。
- 遠心分離機サンプルを2,000 x gで4°Cで10分間用いた。 上清を捨て、PBSの200 μlで再中断します。
- ステップ 5.7 を繰り返します。
- 2回目の洗浄後、4°Cで10分間2,000xgで再び遠心分離サンプルを採取した。
- PBS(サンプルを直ちに実行している場合)または2%パラホルムアルデヒド(染色後1〜3日間サンプルを実行している場合)のいずれかで再中断します。
- フローサイトメトリーを行う場合、サンプル当たりの最大事象量を収集するか、サンプル全体が吸引されるまで収集します。感染していない健康な若いマウスでは、これはわずか1,000-2,000のイベントになります。細菌コロニー形成イベント中に、この数は、動物の疾患の状態および年齢および遺伝的背景などの要因に依存して2〜5倍以上増加する可能性がある。 図9 は、450の前方散乱と300の側面散乱を使用して3レーザーベクトンディケンソンLSRIIフローサイトメーターから収集された代表的なフローサイトメトリーの結果を示していますが、サンプル採取前に使用する予定の特定のフローサイトメーターのパラメータを最適化することをお勧めします。注: サンプルに微量の血液汚染が含まれている場合、収集されたイベントの総数は予想よりも大幅に高くなり、サンプルは分析から割引する必要があります。
6. 鼻溶岩の定量PCR(qPCR)分析
- ステップ3.14室温から細胞ライセートを解凍する。
- 選択の好ましいRNA抽出で提供される推奨されるプロトコルに従ってください。
- 指示に従ってRNA抽出手順を完了した後、分光光度計または電気泳動ベースの方法を用いてRNAの量を定量する(図10)。我々は、サンプルあたり975〜3,250 ngの総RNAを、260/280 nm比>1.7またはRNA完全性(RIN)の周り(8.1±0.13)で日常的に得ています。
- 1,000 ng の RNA (最大 13 μl) を使用するメーカーのプロトコルに従って M-MULV 逆転写酵素を使用して cDNA を書き起こします。
- 得られたcDNAサンプル8倍を希釈し、アリコートを4つの別々のチューブに均等にして-20または-80°Cで長期保存する。
- qPCRによる遺伝子発現を測定するには、氷またはコールドブロック上のトリクリケートで25 μlサンプル反応を調製します:お好みのqPCRキットから2倍qPCRマスターミックスの12.5 μl、0.25 μlの参照色素、希釈cDNAの2 μl(ステップ7.5)、1 μlの前方および逆プライマー(400 nM最終)、9.25μlの水の自由な水中のμlを含む。このプロトコルは、以前に公開されたメソッド16を適応したものです。
- 一般に、2段階のqPCR増幅(10分間95°C、それに続く最大40サイクルx[95°C x 15秒、60°C x 1分])が有効であることがわかります(図11a)。ただし、各プライマーペアは最適化する必要があります。非特異的増幅が発生しないように、解離(融解)曲線は増幅後に実行する必要があります。増幅(図11b)
- 分析された各遺伝子の標準曲線と、分析された各96ウェルプレートの標準的な校正器(肺または脾臓ホモゲンに由来する)を日常的に実行しています。相対転写量は、まず基準色素によって生周期閾値(Ct)値を正規化し、それぞれの標準曲線を通して結果の値を変換することによって得られる。これらの相対量は、その後、標準キャリブレーターおよびハウスキーピング遺伝子に対して、該当する場合に正規化される。
結果
図 1 は、プロトコルの主要な手順を要約した概略図を示しています。 図2〜3は 、本明細書に記載されたプロトコルに固有の微生物学的方法論の可視化を提供する。 図4 は、鼻腔内コロニー形成を行うマウスの適切な位置を示し、図 5 は典型的に S.肺炎株 P1547でコロニー形成されたマウスの体重の変化を示している。 図6〜7は 、プロセスの鼻洗浄部の特定段階を表し、これら2つの技術の補助可視化を図示する。 図8-11 は、鼻洗浄後のマウスの鼻咽頭から採取したサンプルに対して行われた分析の代表的な結果で構成されています。具体的には、 図8 は、鼻咽頭における細菌負荷の代表的な結果であり 、S.肺炎株 P1121、P1547またはP1542のいずれかで植民地化されたマウスから得られた鼻洗浄液の培養を通じて決定される。 図9 は、フローサイトメトリック技術を用いた単離された鼻咽頭免疫細胞の細胞表現型を表す。 図10〜11 は、定量PCRを介した鼻咽頭mRNAの発現解析に関する代表的な結果を示す。
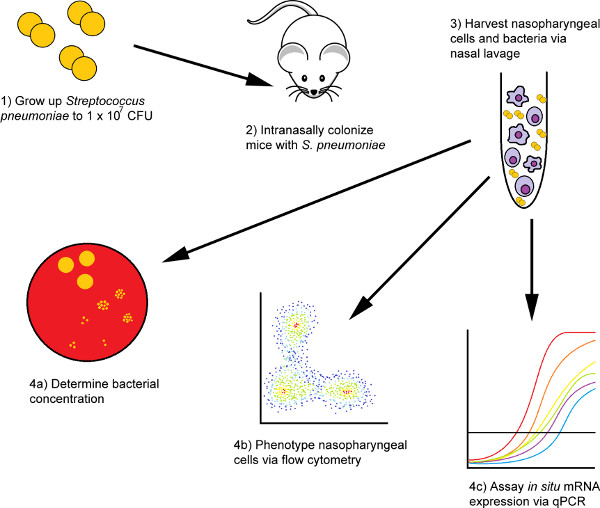
図 1.マウスモデルを用いた鼻腔内接種および鼻洗浄細胞の分離手順のフローチャート。 まず、細菌を接種のために準備し、次に鼻腔内の被験者に与える。所望の時間が経過した後、マウスは末端出血を介して安楽死させられ、それらの鼻咽頭細胞は2つの鼻洗浄ステップを介して単離される:PBS洗浄ステップに続いてRNAリシスバッファーで二次洗浄する。予備のPBS洗浄の細胞を単離し、フローサイトメトリー技術を用いて分析し、第2のサンプルから単離されたRNAを使用して、転写レベルで対象分子の相対的な存在を調査することができる。

図 2.細菌濃度を決定するために、10 μlの滴は、異なる連続希釈を表すセクションに分割されたプレート上の三重でめっきされる。これらの滴は、乾燥させ、プレートは37°C、5%CO2で一晩インキュベートされる。
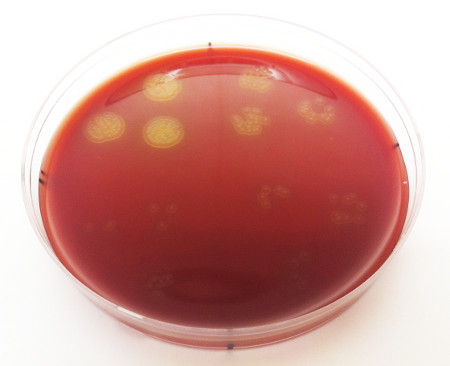
図 3.代表的な動物の鼻咽頭から分離された 肺炎 球菌の濃度。 各離散コロニーは1コロニー形成ユニットを表し、コロニーの各コレクションは10μlの滴(三重でめっき)を表し、プレート上の各象限は別々の連続希釈を表す。細菌濃度は、CFU/mlで、通過可能なコロニーの数を平均化することによって決定され、その後、適格な象限の間に形成されたコロニーの数を平均する。
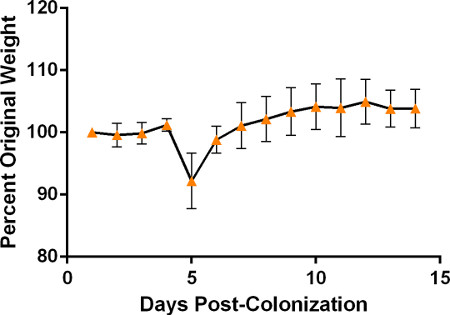
図 4.接種されるマウスの動きは、細菌接種の適切な送達を可能にするために、特に首で最小限に抑える必要があります。これを達成するために、被験者マウスは、そのテーパード端に開口を有する50mlファルコンチューブからなる修正制限装置で拘束される。その後、マウスは絞りから鼻が出るように配置され、研究者がアクセスできるようになり、鼻内接種が行われます。

図 5. 鼻 咽頭コロニー形成後に予想される体重の典型的な変化を描写するために、少なくとも2つの代表的な実験から株P1547でコロニー形成されたマウスの体重は、毎日最初の接種(n=6)に続いて追跡された。 重量は初期体重のパーセント変化として示される。3~5日目の間に予想される急激な初期体重減少、続いて生存マウスの安定化と体重の漸進的な増加に注意してください。
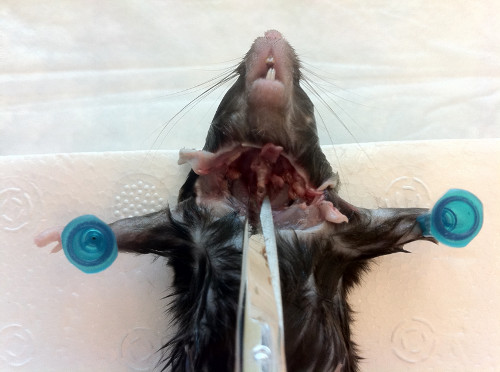
図 6.気管曝露時に、横方向の縦筋は、周囲の血管を重症にしない方法で気管切開前に慎重に除去される。 その後、小さな半月の切開部は、細かい外科用ハサミを使用して気管の途中で作られます。気管の直径を部分的に切り抜き、後でそのままにすることが重要です。
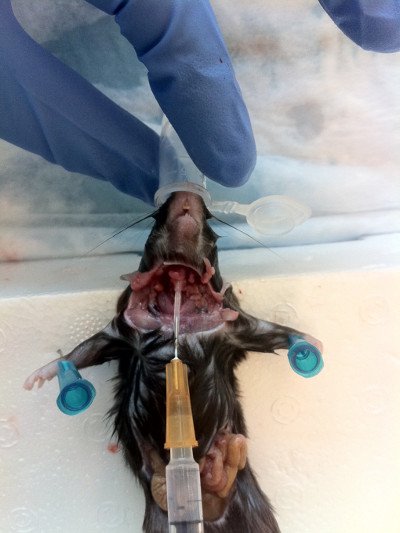
図 7.気管開口部にカニュール針を鼻に向かって上向きに挿入する。 カニューレが所定の位置に入ったら、抵抗が満たされるまで穏やかにプローブし、ナレスを通して内容物を洗い流します。

図 8.C57BL/6マウスのコロニー形成後に説明した鼻洗浄手順を用いて鼻咽頭から単離された細菌負荷の代表的な系列(三角形)をS.肺炎球菌P1547(A)、P1542(B)またはP1121(C)と共に行う。P1121に続くBALB/Cマウス(円)の比較コロニー形成も(C)に表示される。3日目、7日目、14日、21日目を含む、植民地化の過程を通じて異なる時点が示されます。一般的に、3日目には高い初期負荷が予想され、7日目の減少はほとんどありません。クリアランスは通常14日目までに開始され、ほとんどの株でコロニー形成された後、21日目までに完全またはほぼ完全なクリアランスが証明される。ここをクリックすると、より大きな図が表示されます。
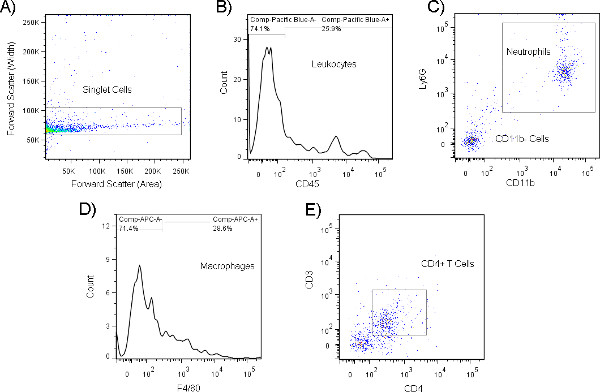
図 9.フローサイトメトリーで分析したマウス鼻洗浄から分離された全細胞の代表的なヒストグラム(A)およびドットプロット(B)。細胞集団上のマーカーの発現の差動は、これらのタンパク質に対する蛍光抗体を用いることを通して白血球サブセットの同定を可能にする。ここで示すように、白血球集団は、まず前方散乱(面積)対前方散乱(幅)ゲート(A)を使用してシングル細胞上でゲートし、そのサブセット内のCD45+セルに対して富化することによって選択される(B)。この集団は、CD11bおよびLy6G二重陽性好中球(C)の格子化によって、さらに特定の細胞タイプに細分化することができる。CD11b-集団の分析は、F4/80+、CD11bマクロファージ(D)またはCD11b-CD11b-、CD3およびCD4二重陽性CD4 T細胞(E)を明らかにするために行うことができる。細胞集団は、1つを発現するか、または他の細胞型と区別するために使用できるいくつかのユニークな表面受容体の組み合わせを発現する限り、表現型にすることができます。ここをクリックすると、より大きな図が表示されます。
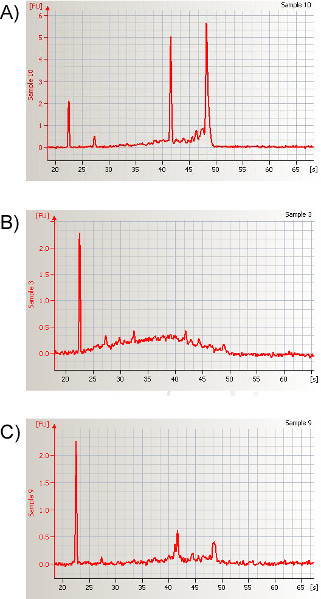
図10。マウス鼻洗浄から分離されたサンプルの電気泳動自動シーケンシングに続く代表的な電気泳動。得られたエレクトロフェログラムは、鼻咽頭領域に由来する高品質の全RNAサンプルの定量データと特徴的なシグネチャを示しています。全RNAの解析を行う場合、2つの主要なリボソームRNA(18Sおよび28S)のRNAピーク下の領域を使用して、対応する比を計算します。18Sおよび28Sに起因するピークの比の有意な変化は、典型的には分解されたRNAを示す。分解度はRNA完全性数(RIN)によって要約することができます。この代表的なサンプルの RIN は 8.1 です。高度に分解されたRNAの例は(B)と(C)で示され、その後のRINはそれぞれ1.9および4.6である。ここをクリックすると、より大きな図が表示されます。
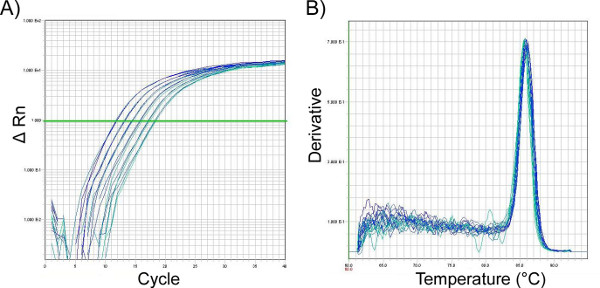
図11。鼻洗浄細胞溶解物のqPCR分析から増幅プロット(A)と解離(融解)曲線(B)は、これら2つの読み出しが通常、マウスナソファリンクから分離されたmRNA製品の効率的かつ正しく検出された増幅に従ってどのように見えるべきかの例を提供する。 表される、ハウスキーピング遺伝子18Sの標準曲線である。(A)に表示された結果は、GAPDHに対するプライマーを用いた増幅後の所望のPCR産物を示す。線はサイクルしきい値 (Ct) を表します。異なるサンプルに対応する増幅プロットがこの閾値を超える点は、サンプル間の比較を可能にし、そこに含まれる関心のあるRNAのより高い量に対応する低い値を使用する。プロット(B)のプロットは、qPCR生成物の最大融解温度が85°Cであり、この反応に存在する汚染産物がないことを示しており、これは所望の製品ピークとは別の追加のピークとして現れるであろう。 ここをクリックすると、より大きな図が表示されます。
| ひずみ名 | 血清型 | 毒性 | マウスの死亡率 | 予想される植民期間 |
| P1121 | 23F | 無症候性 | 0% | 21-28日 |
| P1542 | 4 | 低い | 0-20% | 21-28日 |
| P1547 | 6A | 半ば | 20-50% | 14-21日 |
| D39 | 2 | 高い | 70-100% | 14-21日 |
表 1.一般的に採用されている 4つのS.肺炎性 臨床的孤立株の表形式の概要は、対応する血清型数、病原性の関連度、マウスのコロニー形成されたサブセット内の侵襲性の予想される割合および鼻咽頭コロニー形成の典型的な持続期間である。
ディスカッション
本研究では、 肺炎球菌 の臨床単離株を用いたマウスの鼻腔内浸着の詳細な方法と、その後の細菌に応答して鼻咽頭に採用された免疫細胞の単離および特徴付けについて明記した。我々は、細菌接種物を栄養豊富な培地で培養し、マウスの植民地化イベントを確立するために使用する方法を実証した。次に、鼻咽頭に採用された免疫細胞型の応答が、口蓋暴露、切開および鼻洗浄に続いて、カニュード針を使用してどのように分離できるかを示した。鼻洗浄サンプルは、PBSで回収して、無傷で軽く接着された細胞を分離することができます。RNAは、より強固に接着性の細胞および周囲の上皮粘膜層からのRNAを、RNAライシスバッファーからなる二次洗浄を施すことによって単離することができる。これらのサンプルの前者は、フローサイトメトリー技術を介してコロニー形成の文脈で採用された特定の細胞を表現するために使用することができ、後者はQ-PCR分析に適用することができ、対象となる免疫調節因子の転写発現を見てこれらの求動細胞のエフェクター機能を決定する。鼻溶岩サンプルは、特定の研究問題に対処するために、異なる実験群を比較する細菌コロニー形成イベントのクリアランスの運動を決定するためにさらに使用することができる。
この鼻腔内コロニー形成法の利用は、動物の鼻咽頭に最初に限定されるコロニー形成イベントの確立を可能にする。したがって、血液または臓器への細菌のその後の播種は、鼻咽頭粘膜内に局在する免疫防御の侵害に二次的に起こる。このモデルを通じて達成された段階的な進行は、ヒトにおける肺炎球菌侵入のプロセスをより正確に反映し、コロニー形成細菌と宿主鼻粘膜のダイナミクスを研究し、おそらく細菌病原性および/または播種性疾患の発症を可能にする細菌病原性および/または宿主免疫の変化をよりよく理解することを可能にする。これは、初期の植民地化イベントの確立を見送り、トラカエル内点眼、血管注射による血液または腹膜注射を介して肺への細菌接種の直接送達を通じて単独で侵襲性疾患を研究することを選択するモデルとは対照的である。
植民地化イベントに続いてPBS鼻洗浄を行うと、鼻咽頭に採用された非粘着性細胞または軽度接着性細胞、ならびに粘膜関連細菌の単離が可能となる。しかし、この技術は、上皮の間または下を移動した細胞または細菌を放出しないことから、肺球菌コロニーカリゼーション17,18に続く感染の潜在的な部位であると報告されているリンパ器官である鼻関連リンパ組織(NALT)に局在した細胞または細菌の収穫を可能にしないことも、限定的である。NALTのさらなる研究が望まれる場合は、PBS鼻洗浄に続く研究のために、この組織卸売の微細解剖および除去をお勧めします。これら2つの技術は相互に排他的ではないため、同じ動物に対して行われる可能性があります。しかし、RNA採取工程(RNA溶岩緩衝液を用いた二次洗浄)の溶質および破壊的な性質のために、NALTを収穫しようとする場合は、このステップを省略すべきである。鼻洗浄は技術的に難しい手順ではありませんが、粘膜関連細菌だけでなく、鼻咽頭組織に侵入した細菌負荷のより包括的な評価を得ることを望むグループについては、浸血したマウスの上部頭蓋骨の除去と鼻小鼻コンカ内の組織の解剖に続いて鼻咽頭組織を採取することを提案する。
免疫応答の誘発の性質は、宿主と病原体の相互作用に依存する。S.肺炎の90以上の血清型は、ヒト集団20〜23の差有病率をもたらし、病原性および病原性因子発現の異なるレベルを有する、これまでに特徴付けられている。同様に、マウスにおいて、鼻咽頭コロニー形成に応答して誘発される免疫応答の程度、およびそれに伴う運動論の範囲が、コロニー形成株自体24に依存することが報告されている。したがって、鼻咽頭コロニー形成の確立に利用する適切な株の選択は些細な問題ではなく、マウスの遺伝的背景の選択でもない。図8は、C57BL/6バックグラウンドでの雌マウスの鼻腔内浸血後の3種類のS.肺炎株からの鼻咽頭コロニー形成のクリアランスの運動学的な動態を示すサンプルデータを提供する。表1は、4Sで(C57BL/6の背景で利用される場合)のコロニー形成時間の毒性の程度および長さの概要を示す。文献に記載されている肺炎の臨床単離株および鼻咽頭コロニー形成を確立できることが知られている: アビリエント P1121 (血清型 23F)26,27低毒性 P1542 (血清型 4)28,中毒性 P1547 (血清型 6A)29-31,広く使用されています。 よく特徴づけられる、非常に毒性の高いD39(血清型2)32-36.実験目標は、他の組織への細菌播種を伴わない無症候性の鼻コロニー形成事象を厳密に研究することである場合、より長いコロニー形成事象(観察されたクリアランスの28日前まで)がこの株の特徴であるため、強力なコロニーナイザーとして特徴付けられるアビルール性P1121株の使用をお勧めします。通常、P1121でコロニー形成されたマウスは侵襲性疾患のリスクを冒さないし、病気の臨床指標を表示しない(一時的な体重減少を除く)。残りの株は、所望の毒性の程度および関連する死亡率に応じて採用されるべきであり、病原性は個々のマウス内で発症する感染の程度ではなく、むしろ病気の臨床徴候を示すマウスの割合を意味する。また、通常、病原性の程度は、コロニー形成期間の長さと逆に相関し、より毒性の高い株がより短期間コロニー形成することにも留意すべきである。記載された毒性株の3つすべてが、最も一般的には、満数の肺炎、またはマウスのサブセットで同時に肺炎および敗血症を発症することによるマウスの死亡率につながる。侵襲性細菌の局在化の違いは、特定の株が特定の器官37に対して対栄養を示すという以前に報告されているとして、株特異的であり得る。動物のごく一部では、自発的な髄膜炎もコロニー形成後に発症する可能性があります。死因の決定は、侵襲性の程度と同様に、エンドポイントの動物からの関連組織(肺、脾臓および/または脳)の収集によって達成することができる。これらの組織の均質化および後続のめっきは、浸潤性細菌およびそれに対応する力素の存在を示すことができる。
細菌培養密度定量の例を 図 3に示す。培養が濃縮されすぎると、コロニーは密度が高すぎて個別に数えられるが、対数希釈系列がメッキされると単一細胞由来のコロニーを区別できる。希釈ごとに3つの技術的な複製をめっきすることで、変動を最小限に抑えます。鼻のコロニー形成イベントから採取した細菌を定量化すると、マウスナソ咽頭から同時に分離された他の細菌種を表す共培養汚染物質が発生する可能性があることに注意してください。目的の細菌株が既知の抗生物質耐性を有する場合(例えば 、S.肺炎 の多くの株が5μg/mlまでのゲンタマイシンまたはネオマイシンに耐性がある)、適切な濃度で成長培地を抗生物質で補うことによって汚染物質の発生率を最小限に抑えることができ、それによって汚染物質の増殖を制限する。
フローサイトメトリーは、鼻溶岩サンプル上の細胞表面マーカーを解析するために使用することができます。例えば、感染の文脈でリクルートされた細胞タイプの分析では、マクロファージ(F4/80+)、好中球(CD11b+およびLy6G+)、T細胞(CD3+およびCD4+またはCD8+)を含む白血球の総分化に特異的な抗体の組み合わせを、以前に公開されたように使用することができる。 さらに、これらの分析は、感染の過程で免疫細胞の人身売買をよりよく理解するために、異なる組織または血液に対して行われるフローサイトメトリック分析と組み合わせることができます。鼻咽頭から単離できる細胞の数(通常は数千人数が少ない)が制限されているため、まれなサブセットを特定することは通常困難ですが、これを達成したい研究者は、望ましい細胞数を達成するために複数のマウスからサンプルをプールすることを検討する必要があります。さらに、この領域から有限数の細胞を抽出できるため、総細胞数に関してこのデータを分析することをお勧めします。
タンパク質発現量は一般的に、タンパク質産生をアッシングする可能性を制限する鼻咽頭では低いが、RNAレベルでのコロニー形成細菌に応答して宿主分子の産生を分析することができる。これを達成するために、PBSの代わりにRNA溶岩を使用して鼻洗浄を行い、遺伝子発現の分析を可能にする。qPCR増幅検出では、適切な製品が検出されたことを確認するために、対応する解離曲線(図11)を実行することが重要です。これは、このアッセイが、ミスナーダイマー、汚染DNA、および誤生成プライマーからのPCR産物を含む二重鎖DNAを検出するという事実によるものです。
ここで説明する方法は、この研究対象地域の文脈で重要な病原体に対する宿主応答を研究するために鼻腔内コロニー形成モデルを適用することを奨励することを願っています。 S.肺炎などの特定のヒト病原体では、前の鼻咽頭コロニー形成イベントは、肺炎や血液への伝播を含む細菌播種およびそれに続く致命的な後遺症、および結果として生じる菌血症および敗血症性ショックを伴う重要な前駆体として機能する。したがって、この地域における細菌のコロニー形成を研究することによって、我々はそれを制御する方法をよりよく理解し、より深刻な病理が完全に起こるのを防ぐかもしれない。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ペンシルベニア大学のジェフリー・ワイザー博士が 肺炎球菌の臨床株の贈り物に感謝したいと思います。この研究は、カナダ保健研究所によって資金提供されました。CVは、M.G.デグルートフェローシップとカナダ胸部協会からのフェローシップによって資金提供されました。この研究は、オンタリオ肺協会とカナダ保健研究所(CIHR)によって資金提供されました。ボウディッシュ研究所での研究は、マイケル・G・デグルート感染症研究センターとマクマスター免疫学研究センターによって部分的にサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Anti-Mouse Ly6C FITC | BD Pharmingen | 553104 | |
| Anti-Mouse Ly6G PE | BD Pharmingen | ||
| Anti-Mouse CD45.1 eFluor 450 | eBioscience | 48-0453-82 | |
| Anti-Mouse F4/80 Antigen APC | eBioscience | 17-4801-82 | |
| Anti-Mouse CD11c PerCP-Cy5.5 | eBioscience | 45-0114-82 | |
| Anti-Mouse CD11b PE-Cy7 | eBioscience | 25-0112-82 | |
| Anti-Mouse CD3 Alexa Fluor 700 | eBioscience | 56-0032-82 | |
| Anti-Mouse CD4 eFluor 605NC | eBioscience | 93-0041-42 | |
| Intramedic Polyethylene Tubing - PE20 | Becton Dickinson | 427406 | |
| BD 1 ml Syringe | Becton Dickinson | 309659 | |
| BD 26 G 3/8 Intradermal Bevel | Becton Dickinson | 305110 | |
| Buffer RLT Lysis Buffer | Qiagen | 79216 | |
| Difco Tryptic Soy Agar | Becton Dickinson | 236950 | |
| Defibrinated Sheep Blood | PML Microbiologicals | A0404 | |
| RNAqueous-Micro Kit | Ambion | AM1931 | |
| M-MuLV Reverse Transcriptase | New England Biolabs | M0253L | |
| GoTaq qPCR Master Mix | Promega | A6001 |
参考文献
- Bogaert, D., de Groot, R., et al. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect. Dis. 4, 144-154 (2004).
- Kadioglu, A., Weiser, J. N., et al. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat. Rev. Microbiol. 6 (4), 288-301 (2008).
- McCool, T. L., Cate, T. R., et al. The immune response to pneumococcal proteins during experimental human carriage. J. Exp. Med. 195, 359-365 (2002).
- Nelson, A., Roche, A. M., et al. Capsule enhances pneumococcal colonisation by limiting mucus-mediated clearance. Infect. Immun. 75, 83-90 (2007).
- van Rossum, A., Lysenko, E., et al. Host and bacterial factors contributing to the clearance of colonisation by Streptococcus pneumoniae in a murine model. Infect. Immun. 73, 7718-7726 (2005).
- Barocchi, M. A., Ries, J., et al. A pneumococcal pilus influences virulence and host inflammatory responses. Proc. Natl. Acad. Sci. U.S.A. 103, 2857-2862 (2006).
- Malley, R., Henneke, P., et al. Recognition of pneumolysin by Toll-like receptor 4 confers resistance to pneumococcal infection. Proc. Natl. Acad. Sci. U.S.A. 100, 1966-1971 (2003).
- McCool, T. L., Weiser, J. N. Limited role of antibody in clearance of Streptococcus pneumoniae in a murine model of colonization. Infect. Immun. 72, 5807-5813 (2004).
- Gingles, N. A., et al. Role of genetic resistance in invasive pneumococcal infection: identification and study of susceptibility and resistance in inbred mouse strains. Infect. Immun. 69 (1), 426-434 (2001).
- Jeong, D., Jeong, E., et al. Difference in resistance to Streptococcus pneumoniae infection in mice. Lab Anim. Res. 27, 91-98 (2011).
- Wu, H. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Southam, D. S., Dolovich, M., et al. Distribution of intranasal instillations in mice: effects of volume, time, body position. Lung Physiol. 282, 833-839 (2002).
- Miller, M. A., Stabenow, J. M., et al. Visualization of Murine Intranasal Dosing Efficiency Using Luminescent Francisella tularensis: Effect of Instillation Volume and Form of Anesthesia. PLoS ONE. 7 (2), (2012).
- Briles, D. E., Novak, L. Nasal Colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73 (10), 6945-6951 (2005).
- Wu, H. -. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Mo, Y., Wan, R., et al. Application of reverse transcription-PCR and real-time PCR in nanotoxicity research. Methods Mol. Biol. 926, 99-112 (2012).
- Kuper, C. F., Koornstra, P. J., et al. The role of nasopharyngeal lymphoid tissue. Trends Immunol. 13, 219-224 (1992).
- Zhang, Q., Leong, S. C., et al. Characterisation of regulatory T cells in nasal associated lymphoid tissue in children: relationships with pneumococcal colonization. PLoS Pathog. 7, (2011).
- Briles, D. E., Novak, L., et al. Nasal colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73, 6945-6951 (2005).
- Weinberger, D. M., Trzcinski, K., et al. Pneumococcal capsular polysaccharide structure predicts serotype prevalence. PLoS Pathog. 5, (2009).
- Bryant, W. P., J, , et al. Which Pneumococcal Serogroups Cause the Most Invasive Disease: Implications for Conjugate Vaccine Formulation and Use, Part I.. Clin. Infect. Dis. 30, 100-121 (2000).
- Hausdorff, W. P., Feikin, D. R., et al. Epidemiological differences among pneumococcal serotypes. Lancet Infect. Dis. 5, 83-93 (2005).
- Brueggemann, A., Griffiths, D., et al. Clonal Relationships between Invasive and Carriage Streptococcus pneumoniae and Serotype and Clone Specific Differences in Invasive Disease Potential. J. Infect. Dis. 187, 1424-1432 (2003).
- Mohler, J., Azoulay-Dupis, E., et al. Streptococcus pneumoniae strain-dependent lung inflammatory responses in a murine model of pneumococcal pneumonia. Intensive Care Med. 29, 808-816 (2003).
- Wu, H. Y., Virolainen, A., Mathews, B., King, J., Russell, M. W., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Zhang, Z., Clarke, T. B., et al. Cellular effectors mediating Th17-dependent clearance of pneumococcal colonization in mice. J. Clin. Invest. 119, 1899-1909 (2009).
- Parker, D., Martin, F. J., et al. Streptococcus pneumoniae DNA initiates type I interferon signaling in the respiratory tract. MBio. 2, (2011).
- Haya, D. L., Camilli, A. Large-scale identification of serotype 4 Streptococcus pneumoniae virulence factors. Mol. Microbiol. 45, 1389-1406 (2002).
- Nakamura, S., Favis, K. M., et al. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. J. Clin. Invest. 121, 3657-3665 (2011).
- Kim, J. O., Weiser, J. N. Association of intrastrain phase variation in quantity of capsular polysaccharide and teichoic acid with the virulence of Streptococcus pneumoniae. J. Infect. Dis. 177, 368-377 (1998).
- Roche, A. M., King, S. J., et al. Live attenuated Streptococcus pneumoniae strains induce serotype-independent mucosal and systemic protection in mice. Infect. Immun. 75, 2469-2475 (2007).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Richards, L., Ferreira, D. M., Miyaji, E. N., Andrew, P. W., Kadioglu, A. The immunising effect of pneumococcal nasopharyngeal colonisation; protection against future colonisation and fatal invasive disease. Immunobiology. , 215-251 (2010).
- Lanie, J. A., Ng, W. L., et al. Genome sequence of Avery's virulent serotype 2 strain D39 of Streptococcus pneumoniae and comparison with that of unencapsulated laboratory strain R6. J. Bacteriol. 189, 38-51 (2007).
- Robertson, G. T., Ng, W. L., Foley, J., Gilmour, R., Winkler, M. E. Global transcriptional analysis of clpP mutations of type 2 Streptococcus pneumoniae and their effects on physiology and. 184, 3508-3520 (2002).
- Orihuela, C. J., Gao, G., et al. Tissue-specific contributions of pneumococcal virulence factors to pathogenesis. J. Infect. Dis. 190, 1661-1669 (2004).
- Orihuela, C. J., Gao, G., et al. Organ-specific models of Streptococcus pneumoniae disease. Scand. J. Infect. D. 35, 647-652 (2003).
- Swirski, F. K., Nahrendorf, M., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved