Method Article
Caractérisation des réponses inflammatoires au cours de la colonisation intranasale avec Streptococcus pneumoniae
Dans cet article
Résumé
La colonisation du nasopharynx murin avec Streptococcus pneumoniae et l’extraction ultérieure des cellules adhérentes ou recrutées sont décrites. Cette technique consiste à rincer le nasopharynx et la collecte du liquide à travers les narines et est adaptable à diverses lectures, y compris la quantification cellulaire différentielle et l’analyse de l’expression de l’ARNm in situ.
Résumé
La colonisation nasopharyngée par Streptococcus pneumoniae est une condition préalable à l’invasion des poumons ou de la circulation sanguine1. Cet organisme est capable de coloniser la surface muqueuse du nasopharynx, où il peut résider, se multiplier et éventuellement surmonter les défenses de l’hôte pour envahir d’autres tissus de l’hôte. L’établissement d’une infection dans les voies respiratoires normalement inférieures entraîne une pneumonie. Alternativement, la bactérie peut se disséminer dans la circulation sanguine provoquant une bactériémie, qui est associée à des taux de mortalité élevés2, ou bien conduire directement au développement d’une méningite à pneumocoque. Comprendre la cinétique de la colonisation nasopharyngé et les réponses immunitaires à celle-ci est un aspect important des modèles d’infection à S. pneumoniae.
Notre modèle murin de colonisation intranasale est adapté des modèles humains3 et a été utilisé par plusieurs groupes de recherche dans l’étude des réponses hôte-pathogène dans le nasopharynx4-7. Dans la première partie du modèle, nous utilisons un isolat clinique de S. pneumoniae pour établir une colonisation bactérienne auto-limitante qui est similaire aux événements de portage chez les adultes humains. La procédure décrite ci-dessus implique la préparation d’un inoculum bactérien, suivie de l’établissement d’un événement de colonisation par la livraison de l’inoculum par l’intermédiaire d’une voie intranasale d’administration. Les macrophages résidents sont le type de cellule prédominant dans le nasopharynx pendant l’état stable. Typiquement, il y a peu de lymphocytes présents chez les souris non infectées8, mais la colonisation muqueuse conduira à une inflammation de bas à haut grade (en fonction de la virulence de l’espèce bactérienne et de la souche) qui entraînera une réponse immunitaire et le recrutement ultérieur des cellules immunitaires de l’hôte. Ces cellules peuvent être isolées par un lavage du contenu trachéal à travers les narines, et corrélées à la densité des bactéries de colonisation pour mieux comprendre la cinétique de l’infection.
Protocole
Avant de commencer: toutes les étapes sont effectuées dans une enceinte de sécurité biologique (ESB) de niveau 2 (BSL2) de niveau 2, sauf indication contraire. Veuillez vous assurer que vous avez obtenu l’approbation appropriée en matière de biorisques pour l’utilisation d’agents pathogènes bactériens infectieux conformément aux lignes directrices de l’établissement avant le début des expériences. De plus, veuillez vous assurer que vous disposez de tous les matériaux et réactifs nécessaires pour effectuer la procédure préparée au préalable. Les souris utilisées dans ces expériences ont inclus des souris femelles C57BL/6 des laboratoires Jackson, Charles River ou Taconic et étaient âgées de 10 à 14 semaines (bien que nous n’ayons trouvé aucune différence significative selon le sexe dans la cinétique de la clairance ou de l’infection de colonisation nasale). Toutes les souris utilisées dans ces expériences ont été élevées et maintenues dans des conditions exemptes d’agents pathogènes spécifiques, et étaient exemptes de virus courants (LCMV, MNV, MPV, réovirus ECTV et autres) bactéries(p. ex. H. pylori)et parasites(p. ex. oxyures, ectoparasites) par des tests d’échantillons fécaux ainsi que par une évaluation anatomique fréquente de souris sentinelles co-abris dans les chambres de leurs installations. Lors de la réalisation de ces expériences, nous vous recommandons d’utiliser des souris témoins âgées d’au moins 10 à 12 semaines et d’au plus 6 mois. Les souris plus jeunes ou plus âgées que cette tranche d’âge sont plus sensibles à une plus longue durée de portage nasopharyngé et à une probabilité accrue de diffusion de l’infection. Le fond de souris est une autre considération importante qui peut avoir un impact sur les résultats d’une expérience de colonisation, car plusieurs groupes ont démontré que les souris de différents milieux génétiques ont des susceptibilités différentes à la souche9,10de S. pneumoniae D39 (sérotype 2). S. pneumoniae n’est pas un agent pathogène murin naturel et son seul réservoir naturel est le nasopharynx humain. La transmission se produit par l’intermédiaire de gouttelettes respiratoires, et comme les souris ne produisent pas de sécrétions respiratoires, les souris individuelles ne peuvent pas transmettre la bactérie à d’autres souris, il n’y a donc aucune préoccupation pour la transmission de souris à souris11. Pour un aperçu visuel des procédures décrites dans ce manuscrit, veuillez consulter la figure 1.
1. Préparation de la culture de S. pneumoniae
- Inoculer 5 ml de gélose tryptique au soja pour la croissance en suspension de Streptococcus pneumoniae.
- Culture dans des conditions statiques à 37 °C dans 5 % deCO2 jusqu’à ce que l’inoculum bactérien atteigne la phase logarithmique de croissance avec une densité liquide correspondante de10 8 UFC/ml déterminée par un odomètre réglé à 600 nm. La lecture exacte correspondant à cette UFC variera en fonction de la souche bactérienne spécifique sélectionnée; pour la plupart des souches de S. pneumoniae, cela correspond à une gamme deDO 600 de 0,45 à 0,55. Typiquement, les souches de S. pneumoniae en culture liquide se développeront à cette densité dans les 1,5-2,5 heures dans les conditions recommandées, sans avoir besoin de sous-culture. La culture ne doit pas être autorisée à envahir (au-delà d’une lecture OD de 0,75) car cela représente le point auquel les bactéries ne sont plus en phase logarithmique de croissance et subissent une autolyse étendue.
- Chaque souris sera inoculée avec environ 107 bactéries. Par conséquent, pour chaque 9 souris à coloniser, pipetter 1 ml d’inoculum dans un tube d’Eppendorf et tourner à 15 000 x g pendant 1 min. Une pastille blanchâtre doit être visible. Retirez le surnageant, en prenant soin de ne pas déranger la pastille et de ressusciter les bactéries dans 100 μl de solution saline tamponnée au phosphate (PBS), augmentant ainsi la concentration à 109 UFC/ml. À ce stade, les bactéries doivent rester viables, mais ne se répliqueront pas facilement.
- Si vous utilisez plusieurs aliquotes, combiner en un seul tube pour contrôler les légères variations de densité bactérienne entre les échantillons.
- Gardez les bactéries sur la glace jusqu’à ce qu’elles soient prêtes à être inoculées, pendant un maximum de 1 heure.
- Pour obtenir un nombre exact de bactéries, effectuez une série de dilutions en série logarithmique en commençant par un inoculum bactérien soigné. Diluer en série 10 fois, en ajoutant 10 μl de PBS stérile à 90 μl.
- Plaquer 3 gouttes d’échantillons de 10 μl de dilutions10-5 - 10-9, plus un contrôle de la contamination pbs uniquement, sur des sections étiquetées séparément de la plaque de gélose au soja tryptique (TSA) complétées par 5% de sang de mouton(Figure 2). S’assurer que les pointes de pipette sont modifiées pour chaque étape de dilution d’une concentration plus élevée de UFC à une concentration plus faible d’UFC afin d’éviter de transporter des bactéries en excès et d’augmenter la variabilité des résultats. Les plaques de gélose au sang humain (HBA) peuvent également être utilisées à la place de la TSA. Étant donné que de nombreuses souches de S. pneumoniae sont résistantes à la néomycine (de 5 à 20 μg/ml), cet antibiotique peut également être ajouté au milieu gélosé de choix pendant la phase de préparation de la plaque. Cela facilite le dénombrement car il élimine les bactéries non résistantes. La sensibilité aux antibiotiques de chaque souche doit être testée à l’avance afin de déterminer la concentration optimale d’antibiotique à utiliser pour chaque souche bactérienne.
- Laisser sécher pendant 15-30 min à découvert, puis couvrir les plaques et placer à l’envers dans un incubateur bactérien réglé à 37 °C et 5% deCO2. Cultiver des colonies bactériennes sur la plaque pendant 24 heures.
- Déterminer le nombre d’unités formant des colonies et leur concentration correspondante. D’après les déterminations de la valeur de do600, la concentration doit se situer dans la plage de 1-4 x10 9 UFC/ml. S. pneumoniae colonies doit apparaître sous forme de petites colonies circulaires de couleur beige jaunâtre, avec une petite dépression au centre leur donnant un aspect semblable à un beignet (Figure 3).
2. Colonisation intranasale murine
- Retenir les souris en les plaçant dans un appareil de retenue de souris (un tube Falcon modifié de 50 ml avec la pointe coupée pour créer une ouverture) en les fixant par la base de leur corps avec le pouce de sorte que leur nez émerge juste de l’extrémité conique de l’appareil de retenue(Figure 4). L’utilisation de cet appareil permet l’immobilisation de la tête de la souris et la ségrégation de ses narines d’une manière qui minimise les mouvements et empêche les tentatives de l’animal demastiquer la pointe de la pipette, permettant l’administration complète de l’inoculum. Alternativement, les souris peuvent être immobilisées par des éraflures au cou et une contention manuelle. Nous ne recommandons pas l’anesthésie des animaux avant l’inoculation intranasale. L’administration de l’inoculum à des animaux sous anesthésie entraîne une partie de l’inoculum qui se propage aux poumons12,13.
- À l’aide d’une pipette P10 ou P20, inoculer chaque souris en déposant 10 μl de la culture préparée, en la répartissant uniformément entre les deux narines (laisser l’inoculum s’égoutter dans le nez en pulsant l’inoculation progressivement, en prenant le temps pour les souris d’inhaler l’inoculum). Pour obtenir l’administration complète de l’inoculum, suspendez l’administration à tout moment où la souris commence à bouger son nez de manière excessive. L’inoculum entier ne peut pas être injecté dans les narines car les souris peuvent en expulser certains par le nez pendant l’expiration; cependant, comme la quantité expulsée a tendance à être minuscule et que l’inoculum contient une quantité extrêmement élevée de bactéries, cela n’affecte pas de manière significative la charge bactérienne colonisatrice. De plus, la surface disponible pour la colonisation dans la muqueuse nasopharyngée est limitée et, par conséquent, nous et d’autres avons constaté que la dose recommandée de 107 est suffisante pour obtenir des niveaux constants de bactéries chez toutes les souris, ce qui entraîne une variabilité minimale des quantités initiales de bactéries coloniseuses14,15 .
- Pesez les souris si vous utilisez des indicateurs de poids dans le cadre de votre surveillance du point final. Surveillez les souris toutes les 12 à 24 heures pour les symptômes cliniques, y compris la léthargie, la fourrure ébouriffée et la perte de poids. Les souris ne présenteront généralement pas de symptômes de maladie avant 3-5 jours après la colonisation, et ceux-ci seront précédés d’une perte de poids qui peut en moyenne autour de 5% du poids corporel total par jour. Au fur et à mesure que les souris tomberont de plus en plus malades, elles assumeront des postures voûtées et montreront une diminution de l’activité et une diminution de la réactivité à la stimulation, y compris la manipulation. À ce stade, la maladie est généralement révélatrice d’une septicémie et/ou d’une pneumonie et sera probablement terminale, bien que les souris puissent être traitées avec 1 ml de solution saline sous-cutanée par jour pour améliorer les résultats. Les souris survivantes devraient commencer à montrer une amélioration après le jour 7 après la colonisation, comme en témoigne la stabilisation du poids suivie d’un gain de poids, bien que différentes souches de S. pneumoniae puissent induire la maladie plus rapidement et entraîner la progression des symptômes cliniques selon une ligne de temps différente. Veuillez consulter la figure 5 pour un résultat représentatif du poids suivi chez les souris colonisées avec la souche P1547.
3. Prélèvement d’échantillons de lavage nasal
Avant de commencer: préparer des aiguilles canulées à l’aide de seringues de 1 ml coiffées d’aiguilles biseautées de 26 3/8 G. Couper des morceaux de 2,5 cm de tubes en polyéthylène PE20 d’un diamètre intérieur de 0,38 mm, en veillant à ce que chaque extrémité ait une pointe biseautée. À l’aide d’une pince, faites glisser un morceau de tube en polyéthylène PE20 de 2,5 cm de long (diamètre intérieur de 0,38 mm) sur la pointe de l’aiguille, en évitant de perforer le côté du tube. Les aiguilles canulées peuvent être conservées dans de l’éthanol à 70% jusqu’à ce qu’elles soient nécessaires.
- Euthanasier des souris expérimentales. Car la dislocation cervicale peut potentiellement endommager la trachée, cette méthode d’euthanasie doit être évitée. Notre méthode préférée est l’anesthésie isoflurane suivie d’une exsanguination, cependant, assurez-vous de suivre les directives institutionnelles lors de la sélection du mode d’euthanasie.
- En utilisant de l’éthanol aqueux à 70%, stérilisez la fourrure superoantérieure de l’animal, en particulier le cou, en prenant soin d’empêcher l’éthanol d’accéder aux narines.
- Faites une seule coupe longitudinale le long de la ligne médiane du cou de l’animal et deux coupes horizontales à chaque extrémité, créant une ouverture pour envisager la trachée.
- Pelez soigneusement la peau de chaque côté, révélant le tissu du cou en dessous.
- La trachée doit être visible, entourée de muscles longitudinaux de chaque côté. Coupez-les soigneusement pour fournir une vue claire de la trachée elle-même, en prenant soin de ne pas couper la vascularisation environnante.
- Si la vascularisation a été coupée et que du sang est présent, avant de procéder, laissez le saignement s’arrêter, puis nettoyez la zone plusieurs fois en distribuant du PBS stérile et en utilisant de la gaze stérile pour absorber doucement l’excès d’humidité dans la zone.
- Une fois que la trachée est correctement exposée, faire une coupe transversale et semi-lunaire dans la trachée à mi-hauteur (Figure 6).
- Prélever 1 000 μl de PBS stérilisé dans une aiguille canulée préalablement préparée.
- Insérez la canule dans la trachée vers le nez, en maintenant le bord biseauté pointant vers le bas pour faciliter l’insertion(figure 7). Une fois l’aiguille en place, faites-la pivoter de 180° et sondez doucement vers le haut jusqu’à ce que vous ressentiez une résistance à la lumière.
- Place Eppendorf désignée pour le prélèvement d’échantillons juste sous le nez de la souris.
- Tester le placement correct de l’aiguille en distribuant une quantité minimale (~ 20 μl) de liquide de lavage PBS - une goutte de liquide devrait se former autour des narines de la souris; si c’est le cas, passez à l’étape 3.13).
- Si le PBS de test émerge directement de la bouche de l’animal, tirez la canule en arrière et repositionnez-la en sondant à nouveau doucement vers l’avant jusqu’à ce qu’une très légère résistance soit ressentie - veillez à ne pas pousser la canule trop loin au-delà de cette résistance, car vous la déplacerez au-delà du palais nasal et à travers la cavité buccale.
- Distribuez rapidement le contenu de l’aiguille pour aider à déplacer et à recueillir la quantité maximale de cellules - le contenu doit s’écouler à travers les narines de la souris et dans le tube de collecte. Placez l’échantillon immédiatement sur la glace.
- Pour prélever des échantillons pour l’analyse de l’ARN, répétez les étapes 3.8-3.13) à l’aide d’une aiguille canulée contenant 500 μl de tampon de lyse de l’ARN sur la même souris. Cela permettra de prélever des échantillons de lysat dans les populations cellulaires restantes, en grande partie composées de l’épithélium muqueux nasopharyngé, car les cellules nonadherentes auraient dû être retirées après le lavage initial du PBS. Veuillez noter que le tampon de lyse de l’ARN désassudera l’épithélium et détruira les tissus environnants, il faut donc prendre soin d’éviter tout contact avec des organes tels que les poumons, si la rétention de ces tissus est souhaitée. Une fois prélevé, placez l’échantillon dans un tampon de lyse de l’ARN directement sur de la glace carbonique pour qu’il gèle. Une fois dans le tampon de lyse, les échantillons peuvent être conservés conformément aux instructions du fabricant et sont généralement stables à -70 °C pendant plusieurs mois.
4. Détermination de la charge bactérienne dans le nasopharynx
- Quantifier les bactéries en préparant une série de dilutions en série pour chaque échantillon de lavage nasal murin. En général, on peut s’attendre à ce que la charge bactérienne soit comprise entre 0 et10 4 UFC, donc effectuer trois dilutions en série 10 fois. Ajouter 10 μl de l’échantillon de lavage nasal soigné (100 UFC/ml) au premier tube à une concentration de 10-1 UFC/ml. Vortex soigneusement.
- Diviser la plaque bactériologique en quadrants et étiqueter les quadrants chacun avec un membre de la série de dilution (100-10-3 UFC/ml). Plaquez 3 gouttes d’échantillons de 10 μl des 3 dilutions et l’échantillon soigné sur des plaques tryptiques de gélose au soja complétées par du sang de mouton à 5%, comme à la figure 2.
- Laisser sécher pendant 15-30 min à découvert, puis couvrir les plaques et les placer à l’envers dans un incubateur bactérien avec des conditions optimales pour la croissance bactérienne (généralement 37 °C et 5% deCO2).
- Faire pousser des colonies bactériennes sur la plaque pendant 18-24 heures.
- Déterminer le nombre de bactéries colonisantes en faisant la moyenne des colonies formées sur la plaque pour chaque dilution(figure 3). La figure 8 montre la densité bactérienne pendant différents points temporels, déterminés par la culture de lavages nasaux, chez des souris colonisées avec 3 souches différentes de S. pneumoniae pendant jusqu’à 21 jours.
5. Préparation d’échantillons pour le cytomètre de flux
Avant de commencer : Préparer un mélange d’anticorps. Pour la quantification des populations de leucocytes, nous recommandons le mélange suivant aux dilutions spécifiées : PE-Ly6G (clone 1A8, 1 μg/ml), FITC-Ly6C (clone AL-21,1 μg/ml), eFluor 450-CD45 (clone 30-F11, 2,67 μg/ml), APC-F4/80 (clone PM8 RUO, 0,67 μg/ml), PerCP-Cy5.5-CD11c (clone N418 RUO, 0,5 μg/ml), PE-Cy7-CD11b (clone M1/70, 0,33 μg/ml), Alexa Fluor 700-CD3 (clone 1782, 4 μg/ml), eFluor 605NC-CD4 (clone GK1.5, 6,67 μg/ml). Veuillez noter que ce mélange est 2x concentration (voir étape 5.5). Tous les anticorps doivent être dilués dans un tampon DE LAVAGE FACs (0,5% de sérum de veau fœtal, EDTA 2mM, 0,1% d’azide de sodium dans du PBS) qui doit également être préparé à l’avance. Dans un mélange d’anticorps témoins correspondant à l’isotype, idéalement du même fournisseur que les anticorps marqués et aux mêmes concentrations que les anticorps spécifiques, il faut préparer. Les échantillons traités avec les anticorps de contrôle d’isotype fonctionneront comme le témoin négatif. Toute fluorescence observée dans les échantillons traités avec les anticorps de contrôle d’isotype doit être considérée comme un fond.
- Prechill une centrifugeuse capable de faire tourner 1,5 ml de tubes Eppendorf à 4 °C.
- Échantillons de lavage nasal par centrifugeuse à 2 000 x g pendant 10 min à 4 °C. Pipette soigneusement surnageant et réservez. Remarque: en raison de la petite quantité de cellules dans le nasopharynx, le culot cellulaire ne sera pas visible à moins qu’il n’y ait une contamination indésirable des globules rouges, qui sera rouge vif. Si cela se voit, l’échantillon doit être jeté.
- Ressusciter l’échantillon dans 50 μl de Fc? Anticorps RIIb/CD16-2 (2.4G2) (qui lie les récepteurs Fc et réduit la liaison aux anticorps non spécifiques) dans le tampon de lavage des FACs à une concentration de 4 μg/ml.
- Incuber l’échantillon sur la glace pendant 30 min.
- Ajouter 50 μl de mélange d’anticorps fluorescents concentrés 2x préparés à l’échantillon. Mettez de côté un échantillon représentatif de chaque groupe expérimental pour agir comme un contrôle d’isotype. Ajouter le mélange d’anticorps isotypes à cet échantillon au lieu du mélange de taches.
- Incuber l’échantillon sur la glace pendant 1 heure.
- Échantillons de centrifugeuses à 2 000 x g pendant 10 min à 4 °C. Jeter le surnageant et le ressusciter dans 200 μl de PBS.
- Répétez l’étape 5.7.
- Après le deuxième lavage, centrifuger à nouveau des échantillons à 2 000 x g pendant 10 min à 4 °C.
- Réinsérer dans le PBS (si l’échantillon est exécuté immédiatement) ou dans du paraformaldéhyde à 2% (si les échantillons sont en cours d’exécution 1-3 jours après la coloration).
- Lors de la cytométrie de flux, prélever le maximum d’événements par échantillon ou jusqu’à ce que l’échantillon entier ait été aspiré. Chez les jeunes souris non infectées, en bonne santé, ce sera aussi peu que 1 000-2 000 événements au total; Au cours d’un événement de colonisation bactérienne, ce nombre peut être multiplié par plus de 2 à 5 en fonction de l’état de la maladie chez l’animal et de facteurs tels que l’âge et le bagage génétique. La figure 9 montre les résultats de cytométrie de flux représentatifs recueillis à partir d’un cytomètre de flux Becton Dickenson LSRII à 3 lasers à l’aide d’une diffusion vers l’avant de 450 et d’une diffusion latérale de 300, bien que nous vous recommandons d’optimiser les paramètres du cytomètre de flux spécifique que vous avez l’intention d’utiliser avant le prélèvement d’échantillons. Remarque : si un échantillon contient même des traces de contamination sanguine, le nombre total d’événements recueillis sera considérablement plus élevé que prévu et l’échantillon ne doit pas être pris en compte dans l’analyse.
6. Analyse quantitative par PCR (qPCR) des lavages nasaux
- Dégeler les lysats de cellules à partir de l’étape 3.14 température ambiante.
- Suivez le protocole recommandé fourni avec l’extraction d’ARN préférée de choix.
- Après avoir terminé la procédure d’extraction de l’ARN comme indiqué, quantifier la quantité d’ARN à l’aide d’un spectrophotomètre ou d’une méthode basée sur l’électrophorèse(Figure 10). Nous obtenons régulièrement entre 975 et 3 250 ng d’ARN total par échantillon avec un rapport de 260/280 nm de >1,7 ou un nombre d’intégrité de l’ARN (RIN) autour de 8,1±0,13.
- Transcrivez l’ADNc à l’aide de la transcriptase inverse M-MULV selon le protocole du fabricant avec 1 000 ng d’ARN (maximum 13 μl).
- Diluer les échantillons d’ADNc résultants 8x, et aliquote également dans 4 tubes séparés pour le stockage à long terme à -20 ou -80 °C.
- Pour mesurer l’expression génique par qPCR, préparer des réactions d’échantillons de 25 μl en triple exemplaire sur de la glace ou un bloc froid contenant : 12,5 μl de mélange maître de 2x qPCR à partir de la trousse qPCR de votre choix, 0,25 μl de colorant de référence, 2 μl d’ADNc dilué (étape 7.5), 1 μl d’amorces mixtes avant et inverse (400 nM final), 9,25 μl d’eau sans RNAse-DNAse. Ce protocole est une adaptation des méthodes précédemment publiées16.
- En général, nous constatons qu’une amplification qPCR en deux étapes (95 °C pendant 10 min suivie d’un délai allant jusqu’à 40 cycles x [95 °C x 15 s, 60 °C x 1 min]) est efficace(figure 11a); toutefois, chaque paire d’amorces doit être optimisée. Des courbes de dissociation (fusion) doivent être effectuées après l’amplification pour s’assurer qu’aucune amplification non spécifique ne s’est produite. amplification (Figure 11b)
- Nous exécutons régulièrement des courbes standard pour chaque gène analysé ainsi qu’un calibrateur standard (dérivé de l’homogénat des poumons ou de la rate) pour chaque plaque de 96 puits analysée. Les quantités de transcription relatives sont obtenues en normalisant d’abord les valeurs de seuil de cycle brut (Ct) par le colorant de référence et en transformant les valeurs résultantes à travers la courbe standard respective. Ces quantités relatives sont par la suite normalisées en fonction de l’étalonneur standard et d’un gène d’entretien ménager, le cas échéant.
Résultats
La figure 1 représente un schéma de vue d’ensemble résumant les principales étapes du protocole. Les figures 2-3 permettent de visualiser la méthodologie microbiologique inhérente aux protocoles décrits ici. La figure 4 représente le positionnement approprié d’une souris pour effectuer une colonisation intranasale, tandis que la figure 5 illustre généralement les changements de poids des souris colonisées avec la souche P1547 de S. pneumoniae. Les figures 6-7 représentent des étapes spécifiques de la partie lavage nasal du procédé, pour la visualisation assistée de ces deux techniques. Les figures 8 à 11 sont constituées de résultats représentatifs d’analyses effectuées sur des échantillons prélevés dans le nasopharynx d’une souris à la suite d’un lavage nasal. Plus précisément, la figure 8 est un résultat représentatif de la charge bactérienne dans le nasopharynx, déterminée par la culture de lavages nasaux obtenus à partir de souris colonisées soit avec la souche P1121, P1547 ou P1542 de S. pneumoniae. La figure 9 représente le phénotypage cellulaire de cellules immunitaires nasopharyngées isolées à l’aide de techniques cytométriques en flux. Les figures 10 à 11 montrent des résultats représentatifs relatifs à l’analyse expressionnelle de l’ARNm nasopharyngé par PCR quantitative.
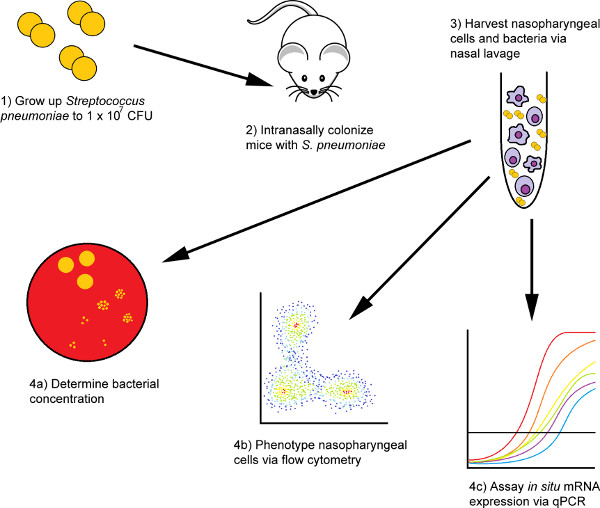
Figure 1. Organigramme des procédures d’isolement intranasal d’inoculation et de cellules de lavage nasales utilisant un modèle murin. Tout d’abord, les bactéries sont préparées pour l’inoculation, puis administrées à des sujets murins par voie intranasale. Une fois la durée souhaitée écoulée, les souris sont euthanasiées via un saignement terminal et leurs cellules nasopharyngées sont isolées via deux étapes de lavage nasal: une étape de lavage PBS suivie d’un lavage secondaire dans le tampon de lyse de l’ARN. Les cellules du lavage préliminaire pbs sont isolées et analysées à l’aide de techniques de cytométrie en flux, tandis que l’ARN isolé du deuxième échantillon peut être utilisé pour étudier les abondances relatives de molécules d’intérêt au niveau transcriptionnel.

Figure 2. Pour déterminer la concentration bactérienne, des gouttes de 10 μl sont plaquées en trois exemplaires sur une plaque divisée en sections représentant une dilution sérielle différente. Ces gouttes sont ensuite laissées sécher et les plaques sont incubées pendant une nuit à 37 °C, 5% deCO2.
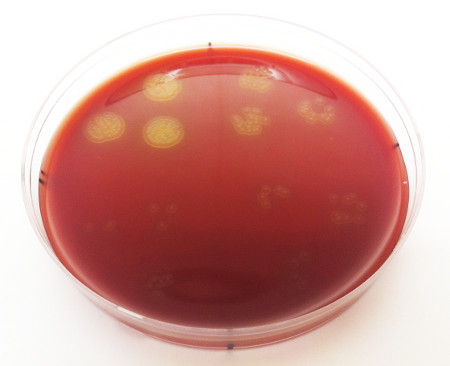
Figure 3. Concentration de streptoccous pneumoniae isolé dans le nasopharynx d’un animal représentatif. Chaque colonie discrète représente une unité formant colonie, chaque collection de colonies représente une goutte de 10 μl (plaquée en trois exemplaires) et chaque quadrant sur la plaque représente une dilution en série distincte. La concentration bactérienne est déterminée en UFC/ml en faisant la moyenne du nombre de colonies dénombrables et entièrement formées à l’intérieur des quadrants admissibles, puis entre ceux-ci.
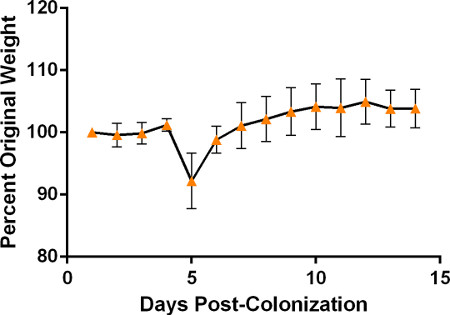
Figure 4. Le mouvement de toute souris à inoculer doit être réduit au minimum, en particulier au niveau du cou, pour permettre l’administration appropriée de l’inoculum bactérien. Pour ce faire, la souris du sujet est retenue dans un appareil de restriction modifié constitué d’un tube Falcon de 50 ml avec une ouverture à son extrémité conique. La souris est ensuite positionnée de manière à ce que son nez émerge de l’ouverture, où le chercheur peut y accéder, ce qui permet d’effectuer une inoculation intranasale.

Figure 5. Poids des souris colonisées avec la souche P1547 provenant d’un minimum de 2 expériences représentatives suivies quotidiennement après l’inoculation initiale (n = 6) pour décrire les changements typiques de poids attendus après la colonisation nasopharyngée. Le poids est affiché sous la forme d’un changement en pourcentage du poids initial. Veuillez noter la forte perte de poids initiale attendue entre les jours 3 et 5, suivie d’une stabilisation et d’une augmentation progressive du poids chez les souris survivantes.
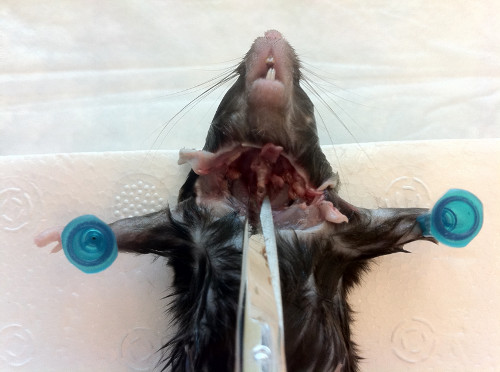
Figure 6. Lors de l’exposition trachéale, les muscles longitudinaux flanquants sont enlevés soigneusement avant l’incision trachéale d’une manière qui ne grave pas les vaisseaux sanguins environnants. Une petite incision semi-lunaire est ensuite faite à mi-chemin de la trachée à l’aide de ciseaux chirurgicaux fins. Il est important de ne couper le diamètre de la trachée que partiellement, en la laissant intacte postérieurement.
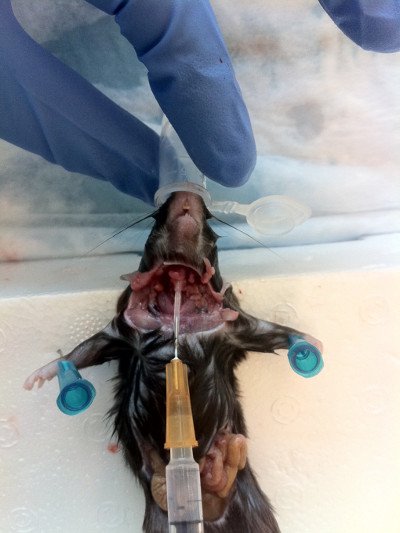
Figure 7. Insertion de l’aiguille canulée dans l’ouverture trachéale vers le haut vers le nez. Une fois la canule en place, sondez doucement jusqu’à ce que la résistance soit rencontrée, puis chassez le contenu à travers les narines.

Figure 8. Série représentative de charge bactérienne isolée du nasopharynx à l’aide de la procédure de lavage nasal décrite à la suite de la colonisation de souris C57BL/6 (triangles) avec la souche P1547 (A), P1542 (B) ou P1121 (C) de S. pneumoniae. Une colonisation comparative des souris BALB/C (cercles) suivant la colonisation P1121 est également affichée dans (C). Différents points temporels sont affichés tout au long de la colonisation, y compris les jours 3, 7, 14 et 21. En général, une charge initiale élevée est attendue au jour 3, avec peu de diminution au jour 7. Le dégagement est généralement amorcé au jour 14, avec un dégagement complet ou presque complet mis en évidence au jour 21 suivant la colonisation avec la plupart des souches. Cliquez ici pour agrandir la silhouette.
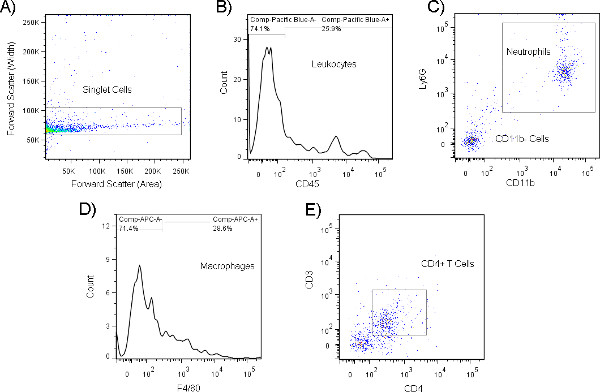
Figure 9. Histogramme représentatif (A) et diagramme à points (B) de cellules totales d’isolement dans des lavages nasaux murins comme analysés par cytométrie d’écoulement. L’expression différentielle des marqueurs sur les populations cellulaires permet l’identification de sous-ensembles de leucocytes grâce à l’utilisation d’anticorps fluorescents dirigés contre ces protéines. Comme indiqué ici, les populations de leucocytes sont sélectionnées en effectuant d’abord un contrôle sur les cellules siclites à l’aide d’une porte de diffusion vers l’avant (surface) par rapport à la porte de diffusion vers l’avant (largeur)(A), puis en enrichissant pour les cellules CD45 + dans ce sous-ensemble(B). Cette population peut être subdivisé en types cellulaires spécifiques en prévoyant des points de passage pour les neutrophiles cd11b et Ly6G doublement positifs(C). L’analyse de la population de CD11b- peut être effectuée pour révéler F4/80+, CD11b-macrophages(D) ou CD11b-, CD3 et CD4 double positifs lymphocytes T CD4(E). Les populations cellulaires peuvent être phénotypées tant qu’elles expriment soit une, soit une combinaison de plusieurs récepteurs de surface uniques qui peuvent être utilisés pour les distinguer des autres types de cellules. Cliquez ici pour agrandir la silhouette.
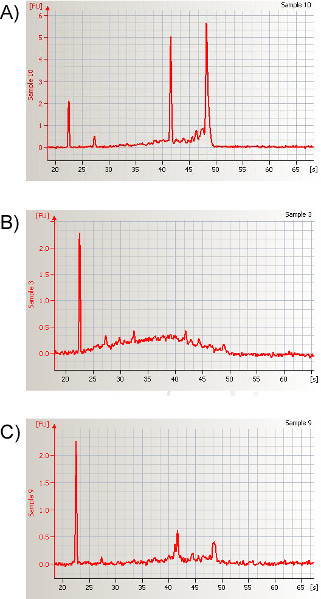
Figure 10. Électrophérogramme représentatif après l’électrophorèse automatique d’un échantillon isolé dans des lavages nasaux murins. L’électrophérogramme résultant montre les données de quantification et la signature caractéristique d’un échantillon d’ARN total de haute qualité dérivé de la région nasopharyngé. Lors de l’analyse de l’ARN total, les zones sous les pics d’ARN pour les deux principaux ARN ribosomiques, 18S et 28S, sont utilisées pour calculer leur rapport correspondant. Les changements significatifs dans les rapports des pics attribuables à 18S et 28S sont généralement indicatifs de la dégradation de l’ARN. Le degré de dégradation peut être résumé par le nombre d’intégrité de l’ARN (NRI); le NRI pour cet échantillon représentatif est 8.1. Un exemple d’ARN fortement dégradé est montré en (B) et (C), et le NRI suivant est 1.9 et 4.6, respectivement. Cliquez ici pour agrandir la silhouette.
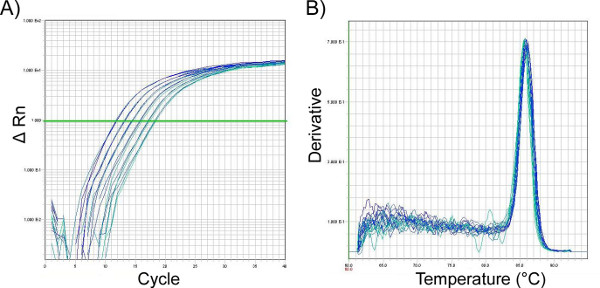
Figure 11. Diagramme d’amplification (A) et courbe de dissociation (fusion) (B) de l’analyse qPCR des lysats nasaux de cellules de lavage, fournissant un exemple de la façon dont ces deux lectures devraient typiquement regarder suivant une amplification efficace et correctement détectée des produits d’ARNm isolés du nasopharynx murin. Représenté est une courbe standard pour le gène d’entretien ménager 18S. Les résultats affichés dans (A) montrent le produit PCR désiré après amplification utilisant des amorces contre GAPDH. La ligne représente le seuil de cycle (Ct). Le point auquel les graphiques d’amplification correspondant à différents échantillons franchissent ce seuil permet de comparer entre les échantillons, avec des valeurs plus faibles correspondant à des quantités plus élevées d’ARN d’intérêt qu’ils contiennent. Le graphique en (B) montre que la température de fusion maximale du produit qPCR est de 85 °C et qu’il n’y a pas de produits contaminants présents dans cette réaction, ce qui se présenterait comme un pic supplémentaire distinct du pic de produit souhaité. Cliquez ici pour agrandir la silhouette.
| Nom de la souche | sérotype | Virulence | Mortalité chez la souris | Durée prévue de la colonisation |
| P1121 | 23F | Asymptomatique | 0% | 21-28 jours |
| P1542 | 4 | bas | 0-20% | 21-28 jours |
| P1547 | 6A | Milieu | 20-50% | 14-21 jours |
| D39 | 2 | haut | 70-100% | 14-21 jours |
Tableau 1. Un aperçu tabulaire de 4 souches cliniques d’isolats de S. pneumoniae couramment employées, leur nombre correspondant de sérotype, le degré associé de virulence, la proportion prévue d’invasivité dans un sous-ensemble colonisé de souris et la durée typique d’une colonisation nasopharyngée.
Discussion
Dans cette étude, nous avons présenté des méthodes détaillées pour la colonisation intranasale de souris utilisant une souche d’isolat clinique de Streptococcus pneumoniae et l’isolement et la caractérisation ultérieurs des cellules immunitaires recrutées au nasopharynx en réponse aux bactéries. Nous avons démontré comment un inoculum bactérien peut être cultivé dans des milieux riches en nutriments et utilisé pour établir un événement de colonisation chez la souris, qui est initialement limité au nasopharynx. Nous avons ensuite montré comment les types de cellules immunitaires répondantes qui sont recrutés pour le nasopharynx peuvent être isolés après une exposition trachéale, une incision et un lavage nasal à l’utilisation d’une aiguille cannulée. Des échantillons de lavage nasal peuvent être prélevés dans du PBS pour isoler les cellules intactes et légèrement adhérentes; l’ARN des cellules plus étroitement adhérentes et de la couche muqueuse épithéliale environnante peut être isolé en appliquant un lavage secondaire constitué d’un tampon de lyse de l’ARN. Le premier de ces échantillons peut ensuite être utilisé pour phénotyper les cellules spécifiques recrutées dans le cadre de la colonisation via des techniques de cytométrie en flux, tandis que le second peut être appliqué à l’analyse Q-PCR, pour déterminer les fonctions effectrices de ces cellules recrutées en examinant l’expression transcriptionnelle des régulateurs immunitaires d’intérêt. Des échantillons de lavage nasal peuvent également être utilisés pour déterminer la cinétique de clairance d’un événement de colonisation bactérienne en comparant différents groupes expérimentaux pour répondre à des questions de recherche spécifiques.
L’utilisation de cette méthode de colonisation intranasale permet l’établissement d’un événement de colonisation qui est initialement limité au nasopharynx de l’animal. Toute dissémination ultérieure de la bactérie dans le sang ou les organes se produit donc secondaire à des brèches dans les défenses immunitaires localisées dans la muqueuse nasopharyngée. La progression par étapes obtenue grâce à ce modèle reflète plus précisément le processus d’invasion pneumococcique chez l’homme, permettant d’étudier la dynamique entre les bactéries colonisantes et la muqueuse nasale de l’hôte - et peut-être de mieux comprendre les changements dans la pathogénicité bactérienne et / ou l’immunité de l’hôte qui permettent le développement de la maladie de diffusion. Ceci est en contraste avec des modèles qui renoncent à l’établissement d’un événement initial de colonisation et choisissent d’étudier la maladie invasive dans l’isolement par la livraison directe de l’inoculum bactérien aux poumons par l’intermédiaire de l’instillation intratrachael, au sang par l’intermédiaire de l’injection vasculaire ou au péritoine par l’intermédiaire de l’injection péritonéale.
La conduite d’un lavage nasal de PBS suivant un événement de colonisation tient compte de l’isolement des cellules non- ou légèrement-adhérentes recrutées au nasopharynx, aussi bien que de toutes les bactéries mucosally-associées. Il convient toutefois de noter que cette technique est limitée car elle ne libérera pas de cellules ou de bactéries qui ont voyagé entre ou sous l’épithélium, ni ne permettra le prélèvement de cellules ou de bactéries localisées dans le tissu lymphoïde associé au nez (NALT), un organe lymphoïde qui a été signalé comme étant un site potentiel d’infection à la suite d’une colonisation pneumococcique17,18. Si davantage d’étude du NALT est désirée, nous recommandons le microdissection et le déplacement de ce tissu en gros pour l’étude suivant le lavage nasal de PBS ; comme ces deux techniques ne s’excluent pas mutuellement, elles peuvent être pratiquées sur le même animal. Cependant, en raison de la nature lytique et destructrice de l’étape de récolte de l’ARN (le lavage secondaire utilisant le tampon de lyse de l’ARN), cette étape doit être omise si vous avez l’intention de récolter le NALT. Bien que le lavage nasal soit une procédure moins techniquement difficile, pour les groupes souhaitant obtenir une évaluation plus complète de la charge bactérienne qui comprend non seulement les bactéries associées aux muqueuses, mais également celles qui ont envahi le tissu nasopharyngé, nous suggérons de récolter le tissu nasopharyngé après l’ablation de l’os supérieur du crâne de souris colonisées et la dissection du tissu dans les conchaes nasales, comme décrit par d’autres19.
La nature d’une réponse immunitaire obtenue dépend de l’interaction entre l’hôte et l’agent pathogène. Plus de 90 sérotypes de S. pneumoniae ont été caractérisés à ce jour, tous avec des niveaux différents de pathogénicité et d’expression du facteur de virulence, ce qui entraîne une prévalence différentielle dans la population humaine20-23. De même, chez la souris, il a été rapporté que l’étendue et la cinétique associées à la réponse immunitaire obtenue en réponse à une colonisation nasopharyngée dépendent de la souche colonisatrice elle-même24. Ainsi, la sélection d’une souche appropriée à utiliser pour l’établissement d’une colonisation nasopharyngée n’est pas une question triviale, pas plus que la sélection du fond génétique de la souris. La figure 8 fournit des données d’échantillon qui illustrent la cinétique de clairance d’une colonisation nasopharyngée à partir de 3 souches différentes de S. pneumoniae à la suite de la colonisation intranasale de souris femelles sur un fond C57BL/6. Le tableau 1 donne un aperçu du degré de virulence et de la durée de colonisation attendus (lorsqu’ils sont utilisés sur le fond C57BL/6) avec 4 souches d’isolats cliniques de S. pneumoniae décrites dans la littérature et connues pour être capables d’établir une coloninisation nasopharyngée25: l’avirulent P1121 (sérotype 23F)26,27 la faible virulence P1542 (sérotype4) 28,la virulence moyenne P1547 (sérotype 6A)29-31,et la D39 (sérotype 2)32-36largement utilisée, bien caractérisée et très virulente. Si le but expérimental est d’étudier strictement un événement de colonisation nasale asymptomatique sans diffusion bactérienne d’accompagnement à d’autres tissus, nous recommandons l’utilisation de la souche avirulentE P1121, qui est caractérisée comme colonisateur efficace, car des événements de colonisation plus longs (jusqu’à 28 jours avant la clairance observée) sont une caractéristique de cette contrainte. Typiquement, les souris colonisées avec P1121 ne courront aucun risque de maladie invasive et ne présenteront aucun indicateur clinique de la maladie (à l’exception de la perte de poids temporaire). Le reste des souches doit être utilisé en fonction du degré de virulence souhaité et de la mortalité associée, la virulence ne signifiant pas le degré d’infection qui se développe chez une souris individuelle, mais plutôt la proportion de souris qui présentent des signes cliniques de maladie. Il convient également de noter que généralement, le degré de virulence est inversement corrélé avec la durée de la colonisation, avec des souches plus virulentes colonisant pendant une période plus courte. Les 3 souches virulentes décrites entraînent une mortalité chez les souris due, le plus souvent, à une septicémie, avec pneumonie fulminante, ou à une pneumonie concomitante et à une septicémie se développant chez un sous-ensemble de souris. Les différences dans la localisation des bactéries invasives peuvent être spécifiques à la souche, car il a été précédemment rapporté que certaines souches présentent des tropismes pour des organes particuliers37. Chez un petit pourcentage d’animaux, une méningite spontanée peut également se développer après la colonisation. La détermination de la cause du décès, ainsi que du degré d’envahissivité, peut être obtenue par la collecte de tissus associés (poumons, rate et/ou cerveau) chez les animaux au point final. L’homogénéisation de ces tissus et le placage subséquent peuvent indiquer la présence de bactéries invasives et de titres correspondants.
Un exemple de quantification de la densité de culture bactérienne est illustré à la figure 3. Si la culture est trop concentrée, les colonies se développent trop densément pour être comptées individuellement, mais les colonies dérivées de cellules individuelles peuvent être distinguées si une série de dilution logarithmique est plaquée. Le placage de trois répétitions techniques par dilution minimise la variabilité. Veuillez noter que lors de la quantification des bactéries extraites d’un événement de colonisation nasale, on peut rencontrer des contaminants de coculture, représentant d’autres espèces bactériennes isolées simultanément du nasopharynx murin. Si la souche bactérienne d’intérêt présente des résistances connues aux antibiotiques (par exemple, de nombreuses souches de S. pneumoniae sont résistantes à la gentamycine ou à la néomycine jusqu’à 5 μg/ml), on peut minimiser l’incidence des contaminants en complétant le milieux de croissance avec l’antibiotique à une concentration appropriée, limitant ainsi la croissance des contaminants.
La cytométrie de flux peut être utilisée pour analyser les marqueurs de surface cellulaire sur des échantillons de lavage nasal. Par exemple, pour l’analyse des types de cellules recrutés dans le cadre d’une infection, un mélange d’anticorps spécifiques pour la différenciation brute des leucocytes, notamment les macrophages (F4/80+),les neutrophiles (CD11b+ et Ly6G+),et les lymphocytes T (CD3+ et CD4+ ou CD8+),peut être utilisé comme précédemment publié. De plus, ces analyses peuvent être combinées avec une analyse cytométrique en flux effectuée sur différents tissus ou sang, afin de mieux comprendre le trafic de cellules immunitaires au cours d’une infection. En raison du nombre limité de cellules (généralement comptant en milliers) qui peuvent être isolées du nasopharynx, l’identification de sous-ensembles rares est généralement difficile, bien que les chercheurs qui souhaitent y parvenir devraient envisager de regrouper des échantillons de plusieurs souris pour atteindre le nombre de cellules souhaité. En outre, étant donné qu’un nombre fini de cellules peut être extrait de cette région, nous vous recommandons d’analyser ces données en ce qui concerne le nombre total de cellules.
Bien que les niveaux d’expression des protéines soient généralement faibles dans le nasopharynx limitant la possibilité de dosage de la production de protéines, il est possible d’analyser la production de molécules hôtes en réponse aux bactéries colonisantes au niveau de l’ARN. Pour ce faire, les lavages nasaux peuvent être effectués à l’aide d’un tampon de lyse de l’ARN au lieu du PBS, ce qui permet d’analyser l’expression des gènes. Pour la détection d’amplification qPCR, il est important d’exécuter une courbe de dissociation correspondante(Figure 11)pour s’assurer que le produit correct et souhaité a été détecté. Cela est dû au fait que le test détectera tout ADN double brin, y compris les dimères d’amorce, l’ADN contaminant et le produit PCR de l’amorce malannealée.
Nous espérons que les méthodes décrites ici vous encourageront à appliquer un modèle de colonisation intranasale pour étudier les réponses de l’hôte aux agents pathogènes importants dans le contexte de cette région peu étudiée. Pour certains agents pathogènes humains, tels que S. pneumoniae, un événement de colonisation nasopharyngé précédent agit comme un précurseur important de la dissémination bactérienne qui s’ensuit et des séquelles mortelles qui peuvent suivre, y compris la propagation dans les poumons, ce qui peut entraîner une pneumonie, ou bien dans le sang, et la bactériémie et le choc septique qui en résultent. Ainsi, en étudiant la colonisation bactérienne dans cette région, nous pouvons mieux comprendre comment la contrôler et prévenir une pathologie plus grave de se produire tout à fait.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier le Dr Jeffery Weiser de l’Université de Pennsylvanie pour son don des souches cliniques de Streptococcus pneumoniae. Ces travaux ont été financés par les Instituts de recherche en santé du Canada. CV a été financé par une bourse M. G. DeGroote et une bourse de la Société canadienne de thoracologie. Ces travaux ont été financés par l’Association pulmonaire de l’Ontario et les Instituts de recherche en santé du Canada (IRSC). Les travaux du laboratoire Bowdish sont appuyés en partie par le Michael G. DeGroote Centre for Infectious Disease Research et le McMaster Immunology Research Centre.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-Mouse Ly6C FITC | BD Pharmingen | 553104 | |
| Anti-Mouse Ly6G PE | BD Pharmingen | ||
| Anti-Mouse CD45.1 eFluor 450 | eBioscience | 48-0453-82 | |
| Anti-Mouse F4/80 Antigen APC | eBioscience | 17-4801-82 | |
| Anti-Mouse CD11c PerCP-Cy5.5 | eBioscience | 45-0114-82 | |
| Anti-Mouse CD11b PE-Cy7 | eBioscience | 25-0112-82 | |
| Anti-Mouse CD3 Alexa Fluor 700 | eBioscience | 56-0032-82 | |
| Anti-Mouse CD4 eFluor 605NC | eBioscience | 93-0041-42 | |
| Intramedic Polyethylene Tubing - PE20 | Becton Dickinson | 427406 | |
| BD 1 ml Syringe | Becton Dickinson | 309659 | |
| BD 26 G 3/8 Intradermal Bevel | Becton Dickinson | 305110 | |
| Buffer RLT Lysis Buffer | Qiagen | 79216 | |
| Difco Tryptic Soy Agar | Becton Dickinson | 236950 | |
| Defibrinated Sheep Blood | PML Microbiologicals | A0404 | |
| RNAqueous-Micro Kit | Ambion | AM1931 | |
| M-MuLV Reverse Transcriptase | New England Biolabs | M0253L | |
| GoTaq qPCR Master Mix | Promega | A6001 |
Références
- Bogaert, D., de Groot, R., et al. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect. Dis. 4, 144-154 (2004).
- Kadioglu, A., Weiser, J. N., et al. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat. Rev. Microbiol. 6 (4), 288-301 (2008).
- McCool, T. L., Cate, T. R., et al. The immune response to pneumococcal proteins during experimental human carriage. J. Exp. Med. 195, 359-365 (2002).
- Nelson, A., Roche, A. M., et al. Capsule enhances pneumococcal colonisation by limiting mucus-mediated clearance. Infect. Immun. 75, 83-90 (2007).
- van Rossum, A., Lysenko, E., et al. Host and bacterial factors contributing to the clearance of colonisation by Streptococcus pneumoniae in a murine model. Infect. Immun. 73, 7718-7726 (2005).
- Barocchi, M. A., Ries, J., et al. A pneumococcal pilus influences virulence and host inflammatory responses. Proc. Natl. Acad. Sci. U.S.A. 103, 2857-2862 (2006).
- Malley, R., Henneke, P., et al. Recognition of pneumolysin by Toll-like receptor 4 confers resistance to pneumococcal infection. Proc. Natl. Acad. Sci. U.S.A. 100, 1966-1971 (2003).
- McCool, T. L., Weiser, J. N. Limited role of antibody in clearance of Streptococcus pneumoniae in a murine model of colonization. Infect. Immun. 72, 5807-5813 (2004).
- Gingles, N. A., et al. Role of genetic resistance in invasive pneumococcal infection: identification and study of susceptibility and resistance in inbred mouse strains. Infect. Immun. 69 (1), 426-434 (2001).
- Jeong, D., Jeong, E., et al. Difference in resistance to Streptococcus pneumoniae infection in mice. Lab Anim. Res. 27, 91-98 (2011).
- Wu, H. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Southam, D. S., Dolovich, M., et al. Distribution of intranasal instillations in mice: effects of volume, time, body position. Lung Physiol. 282, 833-839 (2002).
- Miller, M. A., Stabenow, J. M., et al. Visualization of Murine Intranasal Dosing Efficiency Using Luminescent Francisella tularensis: Effect of Instillation Volume and Form of Anesthesia. PLoS ONE. 7 (2), (2012).
- Briles, D. E., Novak, L. Nasal Colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73 (10), 6945-6951 (2005).
- Wu, H. -. Y., Virolainen, A., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Mo, Y., Wan, R., et al. Application of reverse transcription-PCR and real-time PCR in nanotoxicity research. Methods Mol. Biol. 926, 99-112 (2012).
- Kuper, C. F., Koornstra, P. J., et al. The role of nasopharyngeal lymphoid tissue. Trends Immunol. 13, 219-224 (1992).
- Zhang, Q., Leong, S. C., et al. Characterisation of regulatory T cells in nasal associated lymphoid tissue in children: relationships with pneumococcal colonization. PLoS Pathog. 7, (2011).
- Briles, D. E., Novak, L., et al. Nasal colonization with Streptococcus pneumoniae includes subpopulations of surface and invasive pneumococci. Infect. Immun. 73, 6945-6951 (2005).
- Weinberger, D. M., Trzcinski, K., et al. Pneumococcal capsular polysaccharide structure predicts serotype prevalence. PLoS Pathog. 5, (2009).
- Bryant, W. P., J, , et al. Which Pneumococcal Serogroups Cause the Most Invasive Disease: Implications for Conjugate Vaccine Formulation and Use, Part I.. Clin. Infect. Dis. 30, 100-121 (2000).
- Hausdorff, W. P., Feikin, D. R., et al. Epidemiological differences among pneumococcal serotypes. Lancet Infect. Dis. 5, 83-93 (2005).
- Brueggemann, A., Griffiths, D., et al. Clonal Relationships between Invasive and Carriage Streptococcus pneumoniae and Serotype and Clone Specific Differences in Invasive Disease Potential. J. Infect. Dis. 187, 1424-1432 (2003).
- Mohler, J., Azoulay-Dupis, E., et al. Streptococcus pneumoniae strain-dependent lung inflammatory responses in a murine model of pneumococcal pneumonia. Intensive Care Med. 29, 808-816 (2003).
- Wu, H. Y., Virolainen, A., Mathews, B., King, J., Russell, M. W., et al. Establishment of a Streptococcus pneumoniae nasopharyngeal colonization model in adult mice. Microb. Pathog. 23, 127-137 (1997).
- Zhang, Z., Clarke, T. B., et al. Cellular effectors mediating Th17-dependent clearance of pneumococcal colonization in mice. J. Clin. Invest. 119, 1899-1909 (2009).
- Parker, D., Martin, F. J., et al. Streptococcus pneumoniae DNA initiates type I interferon signaling in the respiratory tract. MBio. 2, (2011).
- Haya, D. L., Camilli, A. Large-scale identification of serotype 4 Streptococcus pneumoniae virulence factors. Mol. Microbiol. 45, 1389-1406 (2002).
- Nakamura, S., Favis, K. M., et al. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. J. Clin. Invest. 121, 3657-3665 (2011).
- Kim, J. O., Weiser, J. N. Association of intrastrain phase variation in quantity of capsular polysaccharide and teichoic acid with the virulence of Streptococcus pneumoniae. J. Infect. Dis. 177, 368-377 (1998).
- Roche, A. M., King, S. J., et al. Live attenuated Streptococcus pneumoniae strains induce serotype-independent mucosal and systemic protection in mice. Infect. Immun. 75, 2469-2475 (2007).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Cohen, J. M., Khandavalli, S., Camberlein, E., Hyams, C., Baxendale, H. E., Brown, J. S. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-Cell responses to nasopharyngeal colonisation. PLoS One. 6 (10), (2011).
- Richards, L., Ferreira, D. M., Miyaji, E. N., Andrew, P. W., Kadioglu, A. The immunising effect of pneumococcal nasopharyngeal colonisation; protection against future colonisation and fatal invasive disease. Immunobiology. , 215-251 (2010).
- Lanie, J. A., Ng, W. L., et al. Genome sequence of Avery's virulent serotype 2 strain D39 of Streptococcus pneumoniae and comparison with that of unencapsulated laboratory strain R6. J. Bacteriol. 189, 38-51 (2007).
- Robertson, G. T., Ng, W. L., Foley, J., Gilmour, R., Winkler, M. E. Global transcriptional analysis of clpP mutations of type 2 Streptococcus pneumoniae and their effects on physiology and. 184, 3508-3520 (2002).
- Orihuela, C. J., Gao, G., et al. Tissue-specific contributions of pneumococcal virulence factors to pathogenesis. J. Infect. Dis. 190, 1661-1669 (2004).
- Orihuela, C. J., Gao, G., et al. Organ-specific models of Streptococcus pneumoniae disease. Scand. J. Infect. D. 35, 647-652 (2003).
- Swirski, F. K., Nahrendorf, M., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon