Method Article
Графен Покрытия для биомедицинских имплантатов
В этой статье
Резюме
Графен предлагает потенциал в качестве материала покрытия для биомедицинских имплантатов. В этом исследовании мы демонстрируем метод для покрытия сплавов нитинола с нанометровой толщины слоев графена и определить, как графен может повлиять на имплантат ответ.
Аннотация
Атомно-гладкой графена в качестве покрытия поверхности имеет потенциал для улучшения свойств имплантатов. Это свидетельствует о методе для покрытия сплавов нитинола с нанометровой толщины слоев графена для применения в качестве материала стента. Графен был выращен на медной подложке с помощью химического осаждения из паров, а затем переносится на нитинола субстратов. Для того, чтобы понять, как графен покрытие может изменить биологическую реакцию, жизнеспособность клеток из аорты крыс клетки эндотелия аорты крыс и клетки гладкой мускулатуры исследована. Кроме того, влияние графена покрытий на клеточной адгезии и морфология была рассмотрена флуоресцентной конфокальной микроскопии. Клетки были окрашены для актина и ядер, и там были заметны различия между нетронутые образцы нитинола по сравнению с графен покрытых образцов. Всего выражение актина из аорты крыс клетки гладкой мускулатуры была найдена с помощью вестерн-блот. Адсорбции белка характеристики, показатель для потенциальных тромбогенности, шпрежде чем определяться для сывороточного альбумина и фибриногена с гель-электрофореза. Кроме того, перенос заряда из фибриногена на подложку была выведена использованием спектроскопии комбинационного рассеяния. Было установлено, что графен покрытия на подложках нитинола встретился функциональные требования к стент материала и улучшить биологическую реакцию по сравнению с непокрытыми нитинола. Таким образом, графен покрытием нитинола является реальным кандидатом на стент материала.
Введение
За последние три десятилетия стали свидетелями открытия новых материалов на основе методов лечения и устройств для болезни лечения и диагностики. Новые материалы, такие как сплав нитинола (НИТИ) и нержавеющая сталь часто используется в биомедицинских имплантатов производства в связи с их превосходными механическими свойствами. 1-3 Однако многочисленные проблемы остаются в связи с экзогенными цитотоксичности материалов, био-и гемо-совместимость. Металлический характер этих сплавах приводит к плохому био-и гемосовместимость из-за выщелачивания металлов, отсутствие клеточной адгезии, пролиферации и тромбоз, когда он вступает в контакт с протекающей крови (например, катетеры, трансплантатов кровеносных сосудов, сосудистые стенты, искусственные клапаны сердца и т.д.). 1., 4, 5 взаимодействия белков или живые клетки с поверхности имплантата может привести к сильным иммунологического ответа и последующий каскад биохимических реакций, могут негативно повлиять на функциональность устройства. Таким образом, он Пертинных для достижения контроля над взаимодействием между биомедицинских имплантатов и окружающих его биологической среде. Модификация поверхности часто используется, чтобы уменьшить или предотвратить неблагоприятные физиологические реакции, происходящих из имплантата материала. Идеальное покрытие поверхности, как ожидается, имеют высокую прочность сцепления, химической инертностью, высокой гладкостью, и хороший гемо-и биосовместимости. Ранее многочисленные материалы, в том числе алмазоподобного углерода (DLC), SiC, TiN, TiO 2 и многих полимерных материалов были протестированы как био-совместимого покрытия поверхности имплантата. 1, 6-23 Тем не менее, эти материалы до сих пор не в состоянии удовлетворить все функциональным критериям подходящее покрытие поверхности имплантата.
Открытие атома толстым слоем SP 2 углерода, известный как графен, открыла двери для разработки новых многофункциональных материалов. Графен как ожидается, будет идеальным кандидатом на покрытие поверхности имплантата, поскольку онаявляется химически инертным, атомно-гладкой и очень долговечный. В этом письме мы исследуем жизнеспособность графена в качестве поверхностного покрытия для биомедицинских имплантатов. Наши исследования показали, что графен покрытием нитинола (Gr-NiTi) отвечает всем функциональным критериям, и дополнительно поддерживает отличную гладкую мускулатуру и рост эндотелиальных клеток, ведущих к лучшему клеточной пролиферации. Мы также обнаружили, что сывороточный альбумин адсорбции на Gr-NiTi выше, чем фибриногена. Важно отметить, что (I) наши детальные спектроскопические измерения подтвердили отсутствие переноса заряда между графена и фибриногена предполагая, что графен покрытие подавляет активацию тромбоцитов с помощью имплантатов, (II) графена покрытия не проявляют каких-либо значительных в пробирке токсичности для клеток эндотелия и гладкой мускулатуры клеточных линий, подтверждающих их биосовместимости, и (III) графена покрытия химически инертны, прочная и непроницаемая в потоке крови среды. Эти гемо-и биосовместимые свойства, наряду с высокими йrength, химическая инертность и долговечность, делают графен покрытий в качестве идеального покрытия.
протокол
1. Графен-покрытия NiTi
- Графеновых образцов, используемых в данном исследовании, были выращены на медь (Cu) подложках с использованием химического осаждения из паровой техники, а впоследствии переданы до 4,5 мм 2 NiTi субстратов.
- Cu фольга (1 см х 1 см) помещали в 1 дюйм кварцевой трубчатой печи и нагревают до 1000 ° С в присутствии 50 SCCM Н 2 и 450 SCCM Аг.
- Далее, метан (1 и 4 SCCM) был введен в печи при различных скоростях потока в течение 20-30 мин. Образцы были, наконец, охлаждают до комнатной температуры в токе H 2, Ar и CH 4.
- Далее, Cu пленки были спин-покрытием ПММА (разбавляют 4% анизола) при 4000 оборотов в минуту последующей термической обработки в течение 5 мин при температуре 150 ° C. Графен прикреплены к PMMA слой был получен путем травления меди фольги использованием Transene Inc, CE-100 травителя, и последующим полосканием в 10% HCl и де-ионизированной воды в течение 10 мин.
- СПримерами были переданы в NiTi субстратов (4,5 мм 2) и отожженного при 450 ° С в Ar (300 SCCM) и H 2 (700 SCCM) в течение 2 часов, чтобы удалить ПММА. Наконец, подложки промывают ацетоном, чтобы растворить остаточной PMMA, чтобы получить Gr-NiTi образца. Dilor XY тройного монохроматора решетка была использована для микро-КР характеристик (с помощью 100X цель) все Gr-NiTisamples с 514,5 нм возбуждения от лазерного Ar + ионов.
2. In Vitro токсичности Gr-NiTi
Аорты крыс эндотелиальных клеток (Cell приложения Inc,) культивировали на желатин покрытием 8 Слайд камер. Для проверки клеточного роста, чистым и Gr-NiTisubstrates были помещены в скважинах без желатина покрытия. Сканирующей электронной микроскопии изображения были получены с использованием Hitachi S-4800 SEM. Кроме того, крысы гладкомышечных клетках аорты были также выращивается в CellBind 96-луночные планшеты в качестве контрольной группы (Corning) в Dulbecco, модифицированная Eagle Medium (ATCC).
- Для проверки жизнеспособности клеток, клеток (как эндотелиальных и гладкомышечных клеток) высевали на 10 5 клеток / лунку в лунках, содержащих нетронутой NiTi, 1 SCCM или 4 SCCM Gr-NiTi субстратах, где заявил, SCCM соответствует потока метана, используемые в CVD роста графена. Клетки выращивались на нужный период времени в инкубаторе при температуре 37 ° C и 5% CO 2, обмен СМИ каждый день.
- В момент времени конца, средств массовой информации была удалена и свежей среде, содержащей 0,5 мг / мл тиазолил тетразолия бромид (или МТТ получил от Sigma) добавляют в каждую лунку. Затем клетки инкубировали еще в течение 3 часов. Для анализа МТС, средств массовой информации была удалена в конечной точке времени и заменены 120 мкл рабочего раствора МТС (сотовый уровня 96 водных, Promega) и выдерживают в течение 3 часов.
- Далее, средства массовой информации были аккуратно удалены и 100 мл диметилсульфоксида (Sigma) добавляли к каждой лунке. После аллоКрыло 10 минут для МТТ кристаллы растворяются, раствор переносили в другую и пластины. Для анализа МТС, не диметилсульфоксида добавляли в лунки. Ну содержания были перемещены в новую пластинку.
- Поглощение было читать при 490 нм и процента жизнеспособности определяется путем нормализации поглощения в средней оптической плотности образца NiTi нетронутой. По меньшей мере пять повторов было сделано для каждого типа образца.
3. Конфокальной микроскопии исследования морфологии клеток
- Для конфокальной микроскопии крысы гладкомышечных клетках аорты, субстраты были размещены в 8-камера слайд (Thermo Scientific). Клетки высевали на 25000 клеток / камеру и выдерживают в течение 3 дней при 37 ° C и 5% CO 2.
- Клетки фиксировали на подложке с 4% формальдегида в фосфатном буферном растворе в течение 20 мин.
- Пермеабилизированных с 0,1% Triton-X течение 1 мин.
- Актина окрашивали Alexa Fluor 488 фаллоидином (Lifэлектронной технологии). 100 мкл alexafluor 488 фаллоидином на 200 ЕД / мл в метаноле добавляли к 1,9 мл фосфатного буферного раствора. Клетки окрашивали 250 мкл alexafluor 488 фаллоидином в течение 45 мин, а затем дважды промывают фосфатным буферным раствором.
- Ядра были установлены с VectaShield флуоресцентные монтаж среде, содержащей DAPI (Vector Laboratories). Конфокальной изображения были собраны с помощью конфокальной Nikon TI. Камера высевают с клетками без подложки был использован в качестве контроля.
4. Адсорбции белка исследований
- Субстрат размеры были измерены с суппортами перед началом адсорбции белка экспериментов. Три измерения проводились для каждой стороны примерно квадратных образцов и в среднем, чтобы получить длину и ширину.
- Каждый образец, нетронутые NiTi, 1sccm и 4sccm Gr-NiTiwere инкубировали с 1 мг / мл альбумина в фосфатным буферным раствором (PBS) или 1 мг / мл фибриногена в PBS при комнатной тemperature в течение 3 часов.
- Alike образцы были объединены в микроцентрифуге трубки с 200 мкл буфера для образца сокращения и кипятят в течение 5 мин.
- Образцы затем разбавляют в Tris / глицин / SDS буфера (Bio-Rad) и запустить через 4-15% трис электрофореза в полиакриламидном геле (Bio-Rad) при 90 V на 100 мин.
- Гели затем окрашивали SYPRO Red. Развести SYPRO Red (Life Technologies) раствор в 1:5,000 в 7,5 V / V% уксусной кислоты. Пятно гель в течение 60 мин.
- Изображение гели использованием Flourchem SP (Alpha Innotech). Флуоресцентная интенсивность количественно, используя ImageJ программного обеспечения. Интенсивности флуоресценции от каждого образца была нормирована общей площади подложки и адсорбции фибриногена был по сравнению с альбумином адсорбции.
5. Вестерн-блоттинга для экспрессии белка
- Вестерн-блоттинга было проведено с целью анализа общего актина в аорты крыс клетки гладких мышц. Клетки высевали на 10000 клеток / субстрата в 96-WELL пластины.
- Клетки выращивались в течение трех дней перед снятием средств массовой информации. Всего белок извлекается с помощью буфера RIPA и стандартный BCA анализа (Lamda) был проведен количественно общего белка.
- Образцы разбавляют до той же концентрации в RIPA, а затем варят в снижении буфера для образца в течение 5 мин.
- Белки отделить от 4-15% Tris полиакриламидном геле с помощью электрофореза на 90 В в течение 100 мин. Калейдоскоп белка стандарт (Bio-Rad) был использован для оценки белок молекулярной массой.
- Белки были перенесены на мембрану PVDF и блокировали 1% сухого обезжиренного молока (Bio-Rad) решение.
- Всего актин был помечен с кроликом анти-крыса актин антител (Sigma). BM хемилюминесцентный комплект (Roche) был использован для обнаружения первичных антител. Мембраны были обследованы использованием FlourChem SP съемочной аппаратуры и интенсивность флуоресценции измеряли с помощью ImageJ программного обеспечения. Флуоресцентные интенсивность нормирована по сравнению с PRIСтайн NiTisample.
Результаты

На рис. 1) сердечно-сосудистых заболеваний выросла поликристаллического графена на Cu пленки имитирует металл кристаллических зерен (масштаб: 10 мкм). б) спектр комбинационного рассеяния из 1 SCCM (4 SCCM) графен показывает группу интенсивного (относительно слабые) G 'указывает монослоя (несколько слоев) характер, как подготовленные графена. в) АСМ изображение графен переносится на NiTi показывает шероховатости ~ 5 нм. Шкала бар = 500 нм.

Рисунок 2 конфокальной оптической микроскопии изображений для ГМК выросли на) слайд стекло, б) чистый NiTi, в) 1 SCCM Gr-NiTi и г) 4 SCCM Gr-NiTi субстратов (шкалы. 50 мкм).
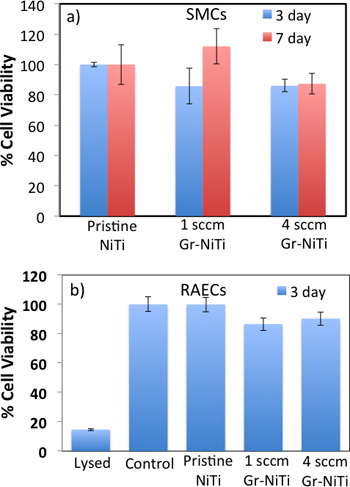
Рисунок 3.) МТТ-анализа показывают, что Gr-NiTi субстратов (1 и 4 SCCM) не проявляют значительную разницу в SMC жизнеспособности клеток относительно нетронутой NiTi. Б) МТС анализ показывает, что 3 дня жизнеспособности клеток для RAECs существенно не отличается от контроля.

Рисунок 4. Сканирование изображений электронной микроскопии для RAECs выросли) нетронутые NiTi, б) 1 SCCM Gr-NiTi и с) 4 SCCM Gr-NiTi субстратов показывает, что графен покрытия приведет к улучшению сферической морфологии клеток RAECs. Шкала бар = 10 мкм.

Рисунок 5.) Фибриноген / Альбумин соотношение нетронутых NiTi, Gr-NiTi (1 и 4 SCCM образцов). Б) Энергетическая схема уровней фибриногена и плотности электронных состояний для графена показывает уравновешивания уровня Ферми. Переноса электрона от фибриногена в Gr-NiTi возможна только с оккупированных электронных состояний молекулы фибриногена в пустые электронные состояния Gr-NiTi на том же уровне энергии. И одно-и несколько слоев графена полу-металлов при комнатной температуре с низкой плотностью состояний на EF, что приводит к слабой (по сравнению с голыми нитинола) переноса заряда от фибриногена в графене.

Рисунок 6. Графен не проявляет никаких изменений в G-группа формы линии или частота свидетельствует об отсутствии любого переноса заряда с белками плазмы. DeconvoluТед пиков, полученных от кривой представлены в черном цвете.

Рисунок 7.) Графен покрытие части Cu копейки воздействию 5% H 2 O 2 остается неизменной, а открытой части окрашенным. Б) Никаких изменений в G-диапазоне частот наблюдается в наших местах в комбинационного исследования Gr- NiTi погруженных в 70% HNO 3 подтверждающие прочность графена покрытий. с) время для травления меди в CE 100 растворителем в два раза, когда Cu покрыта графена (как в Gr-NiTi), указывающий на герметичность графеновых мембран.
Обсуждение
Биосовместимости и цитотоксичность: химическое осаждение из паровой фазы (CVD) метод дал поликристаллических образцах графена, что передразнил Cu кристаллических зерен, как показано на рисунке 1а. Мы использовали спектроскопии комбинационного рассеяния света, чтобы подтвердить наличие монослоя (несколько слоев) графена на 1 SCCM (4 SCCM) образцов (см. рис 1b). Очевидно, что 1 SCCM (4 SCCM) образцов наблюдаются интенсивные группы (относительно слабые) G 'свидетельствует о монослоя (несколько слоев) графена. Рис. 1в показывает, атомно-силовой микроскопии (АСМ) изображения нескольких слоев графена на NiTi субстратов. Наши детальные измерения дали величину шероховатости поверхности R Q = 5 нм для переданы слоев графена (Gr-NiTi). Известно, что наноструктурированные топографии поверхности сильно влияет на форму цитоскелета клетки и сборку в эндотелиальных клетках и гладкомышечных клеток. Эти клеточные линии реагировать на механические напряжения путем изменения их липидный бислой-текучести, которые могут негативно повлиять транслокации белка и вступления активаторы, такие как кальция в клетки. Более того, повышение напряжения градиент клеточной мембраны может изменить конформацию и плотность рецепторов клеточной поверхности. Для того чтобы проверить влияние графена покрытия на стресс градиенты клетки, мы изучали гладких мышц и эндотелиальных клеток с использованием морфологии микроскопии.
Как показано на рисунке 2, гладкие мышечные клетки (SMC) морфологии на нетронутых NiTi не является сферической. Кроме того, клетки распространились редко указывает слабую адгезию ГМК к нетронутой NiTi. Напротив, SMCs плотные и сферические на Gr-NiTi (как 1 и 4 SCCM) поверхность похожа на контроль. Графен покрытие уменьшает стресс градиентов в клетках, обеспечивая гладкую поверхность (очевидно от низких значений R д показано на рисунке 1c) и, следовательно, приводит к улучшению морфологии клеток.Для того чтобы измерить жизнеспособность и пролиферацию клеток, мы провели МТТ на ГМК выросли на нетронутых и Gr-NiTisubstrates на 3 и 7 очков дневное время. В этом анализе, краситель МТТ (желтого цвета) уменьшается в формазана краситель (фиолетового цвета) на активные ферменты редуктазы и, следовательно, здоровыми и пролиферирующих клеток (или цитотоксичности материала) может быть определена количественно путем проведения колориметрических измерений. Как показано на рисунке 3а, мы не наблюдали каких-либо значительных изменений в токсичности для Gr-NiTi субстратов через 3 и 7 дней. Эти результаты подтверждают, что графен покрытия не вызывает избыточной токсичности по сравнению с нетронутой NiTi субстратов себя.
Чтобы подтвердить эффект графена покрытия, мы провели подробный электронных экспериментов визуализации микроскопа на крыс аорты эндотелиальных клеток (см. рисунок 4). Клетки на нетронутых подложки NiTi редки и удлиненные, пока они находятся эллипсоидальной и дЭнзе на Gr-NiTi субстратов. Такой улучшенный морфологии клеток и плотность оказалась сродни SMCs подтверждающие снижение стресса градиенты предоставляемых графена покрытия. Кроме того, мы измерили графена цитотоксичность покрытия на РАЭК использованием МТС 3 - (4,5-диметилтиазол-2-ил) -5 - (3-carboxymethoxyphenyl) -2 - (4-сульфофенил)-2H-тетразолия анализа. Обоснованием для использования МТС анализа (вместо МТТ) заключается в его лучшей совместимости с РАЭК питательной среды и условий. Как показано на рисунке 3b, наши МТС анализа на эндотелиальных клеток показали очень хорошую жизнеспособность и пролиферацию клеток подтверждающие отсутствие избыточного токсичность графена покрытия даже для РАЭК. Важно отметить, что как 1 и 4 SCCM Gr-NiTi выставлены никаких существенных изменений в пролиферации клеток свидетельствует об отсутствии зависимости морфологии клеток от числа слоев графена.
Адсорбции белка и гемосовместимость: свертывания крови в окрестностях га материал имплантатовс одним из основных препятствий в имплантат технологий с 2003 года. Как уже упоминалось ранее, имплантат материал запускает каскад коагуляции, когда он вступает в контакт с кровью. Взаимодействие между биомедицинских имплантатов и крови начинается с адсорбции белков плазмы (сывороточный альбумин, фибриноген и т.д.). На его поверхности. Первоначально, очень обильные белки, такие как сывороточный альбумин, flbrinogen, и flbronectin адсорбируются, но позже сменил факторов XII и высокой кининогена. Отношение адсорбированных flbrinogen и альбумин имеет решающее значение в определении гемосовместимость биоматериала. Ранее, низкое отношение фибриногена / альбумина, адсорбированных на поверхности имплантата биомедицинских были связаны с низким уровнем адгезии тромбоцитов и образованию тромбов. 1 Как показано на рисунке 5а, Gr-NiTi выставки низкой фибриногена / альбумин соотношении относительно нетронутой NiTi предлагая лучшие гемосовместимость, возникающих из графена. FIB / альб ратиO была значительно ниже для 1 и 4 SCCM Gr-NiTi о том, что гемосовместимость графена слой независимой.
Известно, что перенос электрона от молекулы фибриногена на имплантат является ответственной за образование фибрина в качестве первого шага на рост тромба. Как показано на рисунке 5б, фибриногена проявляет полупроводниковые как плотность электронных состояний или DOS (обозначается р (Е)) с энергетической щели 1,8 эВ. Ферми (EF) фибриногена и Gr-NiTi равновесие в их интерфейсе. Перенос заряда одного электрона на фибриноген необходим для образования фибрина на нетронутых NiTi, и перенос электрона от молекулы фибриногена в Gr-NiTi возможна только с оккупированных электронных состояний молекулы фибриногена в пустые электронные состояния Gr-NiTi на том же уровне энергии. И одно-и несколько слоев графена полу-металлов при комнатной температуре с низким р (Е) в окрестности F E 24. Таким образом, перезарядка ток от фибриногена в графен является незначительным (по сравнению с голыми нитинола) из-за низких значениях р (Е). Это внутреннее свойство графена покрытий имеет решающее значение для подавления любой перенос заряда из фибриногена (и последующего свертывания крови).
Мы использовали микро-спектроскопии комбинационного рассеяния света, чтобы подтвердить, что перенос заряда между динамикой фибриногена и Gr-NiTi действительно незначительны. Спектр комбинационного рассеяния графен обладает несколькими резкими чертами лица за счет резонансных эффектов. Примечательно, что тангенциальная группы (G-зона) возникает из плоских вибрации атомов углерода, и было ранее установлено, что весьма чувствительны к переносу заряда 25. G-полоса частот, как известно, повышение передачи (вниз), когда любой акцептор (донора) вида взаимодействует с графена с помощью отверстий (электронного) перевода. Важно отметить, что форма линии G-группа разработчикаiates от симметричного лоренцевы с асимметричным Брейта-Вигнера-Фано (BWF) форма линии в связи с переносом заряда 25. Как и ожидалось, мы не наблюдаем сдвиг в G-диапазоне частот графена при адсорбции фибриногена, подтверждающие отсутствие переноса заряда между Gr-NiTi и фибриногена (рис. 6). Такое ингибирование переноса заряда и низкой FIB / альб соотношения свидетельствуют о хорошем гемосовместимость графена покрытий.
Химическая инертность Графен покрытия: Графен, как известно, выступают в качестве защитного слоя благодаря своим уникальным физико-химическим свойствам. Его SP 2 сотовой решетки обеспечивает естественный барьер диффузии и, следовательно, предотвращает вымывание ионов металла из имплантата материала. В последнее время графен был использован в качестве микроскопических герметичный баллон 26 и защитное покрытие для Cu / Ni 27. Несмотря на устойчивость и герметичность графена хорошо документированы в литературеры, мы представляем наши данные, связанные с травлением медной монеты на рисунке 7 подтвердить полезность и жизнеспособность графена в качестве имплантата покрытий. Как показано на рисунке 7а, графен покрытие части монеты (~ 95% Cu) остается защищенной от окисления при контакте с H 2 O 2 в то время как голые области монета стала обесцвечиваются при контакте с 5% H 2 O 2 (см. увеличенное изображение оптического микроскопа в рис. 7а).
Чтобы проверить прочность графена покрытия, мы подвержены Gr-NiTi субстратов до 70% азотной кислоты до NiTi был частично стравливается. Наши на месте спектроскопии комбинационного рассеяния света в Gr-NiTi погружен в HNO 3 показал никаких изменений в D-и G-зоны графена, подразумевая, что графен покрытие очень прочное (рис. 7б). Кроме того, мы обнаружили, что графен покрытия в Gr-NiTi снижает скорость травления базовой CoppeГ как показано на рисунке 7в.
В заключение, наши подробные спектроскопические измерения подтвердили отсутствие переноса заряда между графена и фибриногена, предполагая, что графен покрытие подавляет активацию тромбоцитов с помощью имплантатов. Кроме того, графен покрытия не проявляют каких-либо значительных в пробирке токсичности для клеток эндотелия и гладкой мускулатуры клеточных линий, подтверждающие их биосовместимость. Кроме того, графен покрытия были найдены, чтобы быть химически инертным, прочного и непроницаемого в потоке крови среды. Био-и гемосовместимость графена покрытия вместе с его химическая инертность, прочность и герметичность делают графен уникальный материал для покрытия биомедицинских имплантатов. Наконец, отметим, что мы преуспели в передаче графеновых листов на отдельные волокна NiTi, с помощью которой графен покрытием сетка может быть изготовлена. Мы также разработали химическую вспученного графеновых листов, которые могут быть непосредственно спина покрытием ОНТO сетки, как стенты. Кроме того, наши предварительные эксперименты показывают, что это действительно можно выращивать графен прямо на сплаве NiTi.
Раскрытие информации
Нет конфликта интересов объявлены.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | |||
| Дульбекко изменения Eagle Средний | ATCC | 30-2002 | |
| Тиазолил тетразолия метила | Sigma-Aldrich | M2128 | |
| CellTiter 96 Водный Одним из решений пролиферации клеток анализа (МТС) | Promega | G3582 | |
| Диметилсульфоксид | Sigma-Aldrich | D8418 | |
| 36,5% формальдегидом | Sigma-Aldrich | F8775 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Alexafluor 488 фаллоидином | Life Technologies | A12379 | |
| VECTASHIELD монтажа среду с DAPЯ | Vector Laboratories | H-1200 | |
| Сывороточного альбумина человека | Sigma-Aldrich | A9511 | |
| Фибриногена человека | |||
| Tris / глицин / SDS | Bio-Rad | 161-0732 | |
| Готовый гель Трис-HCl Gel | Bio-Rad | 161-1158 | |
| Уксусная кислота | Sigma-Aldrich | 45726 | |
| SYPRO красный | Life Technologies | S-6653 | |
| Белки низкой анализа BCA | Lamda Biotech | G1003 | |
| Precision Plus Standard белка калейдоскоп | Bio-Rad | 161-0375 | |
| Immun-блот PVDF мембраны | Bio-Rad | 162-0177 | |
| Блоттинга класса блокаторов обезжиренного сухого молока | Bio-Rad | 170-6404XTU | |
| Anti-актин антитела производятся в кролика | Sigma-Aldrich | A2066 | |
| BM Хемилюминесценция вестерн-блоттинга комплект (мышь / кролик) | Roche Applied Science | 11520709001 | |
| RIPA буфер | Sigma-Aldrich | R0278 | |
| NiTi (51% Ni, 49% Ti) | Альфа-Aesar | 44953 | |
| Оборудование | |||
| Horiba JobinYvon | Спектрометр комбинационного рассеяния | Dilor XY 98 | |
| Nikon | Конфокальной микроскопии | Затмение TI микроскопом | |
| Thermoscientific | Ридер | ||
| Bio-Rad | Источник питания | 164-5050 | PowerPac основного источника питания |
| Bio-Rad | Электрофорез клетки | 165-8004 | Мини-PROTEAN тетра клетки |
| Bio-Rad | Гель для держателя кассеты | 170-3931 | Мини гель держатель кассеты |
Ссылки
- Roy, R. K., Lee, K. -R. Biomedical applications of diamond-like carbon coatings: A review. Journal of Biomedical Materials Research Part B-Applied Biomaterials. 83 B (1), 72-84 (2007).
- Shah, A. K., Sinha, R. K., Hickok, N. J., Tuan, R. S. High-resolution morphometric analysis of human osteoblastic cell adhesion on clinically relevant orthopedic alloys. Bone. 24 (5), 499-506 (1999).
- Huang, N., Yang, P., Leng, Y. X., Chen, J. Y., Sun, H., Wang, J., Wang, G. J., Ding, P. D., Xi, T. F., Leng, Y. Hemocompatibility of titanium oxide films. Biomaterials. 24 (13), 2177-2187 (2003).
- Gutensohn, K., Beythien, C., Bau, J., Fenner, T., Grewe, P., Koester, R., Padmanaban, K., Kuehnl, P. In vitro analyses of diamond-like carbon coated stents: Reduction of metal ion release, platelet activation, and thrombogenicity. Thrombosis Research. 99 (6), 577-585 (2000).
- Gillespie, W. J., Frampton, C. M. A., Henderson, R. J., Ryan, P. M. The Incidence of Cancer Following Total Hip-Replacement. Journal of Bone and Joint Surgery-British Volume. 70 (4), 539-542 (1988).
- Sperling, C., Schweiss, R. B., Streller, U., Werner, C. In vitro hemocompatibility of self-assembled monolayers displaying various functional groups. Biomaterials. 26 (33), 6547-6557 (2005).
- Mikhalovska, L. I., Santin, M., Denyer, S. P., Lloyd, A. W., Teer, D. G., Field, S., Mikhalovsky, S. Fibrinogen adsorption and platelet adhesion to metal and carbon coatings. Thrombosis and Haemostasis. 92 (5), 1032-1039 (2004).
- Airoldi, F., Colombo, A., Tavano, D., Stankovic, G., Klugmann, S., Paolillo, V., Bonizzoni, E., Briguori, C., Carlino, M., Montorfano, M., Liistro, F., Castelli, A., Ferrari, A., Sgura, F., Mario, C. D. i Comparison of diamond-like carbon-coated stents versus uncoated stainless steel stents in coronary artery disease. American Journal of Cardiology. 93 (4), 474-477 (2004).
- Allen, M., Myer, B., Rushton, N. In vitro and in vivo investigations into the biocompatibility of diamond-like carbon (DLC) coatings for orthopedic applications. Journal of Biomedical Materials Research. 58 (3), 319-328 (2001).
- Butter, R., Allen, M., Chandra, L., Lettington, A. H., Rushton, N. In-vitro Studies of DLC Coatings with Silicon Intermediate Layer. Diamond and Related Materials. 4 (5-6), 857-861 (1995).
- Dearnaley, G., Arps, J. H. Biomedical applications of diamond-like carbon (DLC) coatings: A review. Surface & Coatings Technology. 200 (7), 2518-2524 (2005).
- Dorner-Reisel, A., Schurer, C., Nischan, C., Seidel, O., Muller, E. Diamond-like carbon: alteration of the biological acceptance due to Ca-O incorporation. Thin Solid Films. 420, 263-268 (2002).
- Dowling, D. P., Kola, P. V., Donnelly, K., Kelly, T. C., Brumitt, K., Lloyd, L., Eloy, R., Therin, M., Weill, N. Evaluation of diamond-like carbon-coated orthopaedic implants. Diamond and Related Materials. 6 (2-4), 390-393 (1997).
- Grill, A. Diamond-like carbon coatings as biocompatible materials - an overview. Diamond and Related Materials. 12 (2), 166-170 (2003).
- Hauert, R. A review of modified DLC coatings for biological applications. Diamond and Related Materials. 12 (3-7), 583-589 (2003).
- Windecker, S., Mayer, I., De Pasquale, G., Maier, W., Dirsch, O., De Groot, P., Wu, Y. P., Noll, G., Leskosek, B., Meier, B., Hess, O. M. Working Grp Novel Surface, C., Stent coating with titanium-nitride-oxide for reduction of neointimal hyperplasia. Circulation. 104 (8), 928-933 (2001).
- Zhang, F., Zheng, Z. H., Chen, Y., Liu, X. G., Chen, A. Q., Jiang, Z. B. In vivo investigation of blood compatibility of titanium oxide films. Journal of Biomedical Materials Research. 42 (1), 128-133 (1998).
- Bolz, A., Schaldach, M. Artificial-Heart Valves - Improved Blood Compatibility By PECVD a-SiC-H COATING. Artificial Organs. 14 (4), 260-269 (1990).
- Haude, M., Konorza, T. F. M., Kalnins, U., Erglis, A., Saunamaki, K., Glogar, H. D., Grube, E., Gil, R., Serra, A., Richardt, H. G., Sick, P., Erbel, R., Invest, C. T. Heparin-coated stent placement for the treatment of stenoses in small coronary arteries of symptomatic patients. Circulation. 107 (9), 1265-1270 (2003).
- Suggs, L. J., Shive, M. S., Garcia, C. A., Anderson, J. M., Mikos, A. G. In vitro cytotoxicity and in vivo biocompatibility of poly(propylene fumarate-co-ethylene glycol) hydrogels. Journal of Biomedical Materials Research. 46 (1), 22-32 (1999).
- Clarotti, G., Schue, F., Sledz, J., Benaoumar, A. A., Geckeler, K. E., Orsetti, A., Paleirac, G. Modification of the biocompatible and haemocompatible properties of polymer substrates by plasma-deposited fluorocarbon coatings. Biomaterials. 13 (12), 832-840 (1992).
- Gombotz, W. R., Guanghui, W., Horbett, T. A., Hoffman, A. S. Protein adsorption to poly(ethylene oxide) surfaces. Journal of Biomedical Materials Research. 25 (12), 1547-1562 (1991).
- Ishihara, K., Fukumoto, K., Iwasaki, Y., Nakabayashi, N. Modification of polysulfone with phospholipid polymer for improvement of the blood compatibility. Part 2. Protein adsorption and platelet adhesion. Biomaterials. 20 (17), 1553-1559 (1999).
- Jung, N., Kim, B., Crowther, A. C., Kim, N., Nuckolls, C., Brus, L. Optical Reflectivity and Raman Scattering in Few-Layer-Thick Graphene Highly Doped by K and Rb. ACS Nano. 5 (7), 5708-5716 (2011).
- Rao, A. M., Eklund, P. C., Bandow, S., Thess, A., Smalley, R. E. Evidence for charge transfer in doped carbon nanotube bundles from Raman scattering. Nature. 388 (6639), 257-259 (1997).
- Bunch, J. S., Verbridge, S. S., Alden, J. S., vander Zande, A. M., Parpia, J. M., Craighead, H. G., McEuen, P. L. Impermeable atomic membranes from graphene sheets. Nano Letters. 8 (8), 2458-2462 (2008).
- Chen, S., Brown, L., Levendorf, M., Cai, W., Ju, S. -Y., Edgeworth, J., Li, X., Magnuson, C. W., Velamakanni, A., Piner, R. D., Kang, J., Park, J., Ruoff, R. S. Oxidation Resistance of Graphene-Coated Cu and Cu/Ni Alloy. Acs Nano. 5 (2), 1321-1327 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены