Method Article
Модели костных метастазов
В этой статье
Резюме
Животные модели часто используются для изучения раковых метастаз в костях. В этом протоколе мы опишем два распространенных метода инокуляции опухоли для исследования костного метастазирования, и кратко описать некоторые из анализов используются для мониторинга и количественной оценки этих моделей.
Аннотация
Bone metastases are a common occurrence in several malignancies, including breast, prostate, and lung. Once established in bone, tumors are responsible for significant morbidity and mortality1. Thus, there is a significant need to understand the molecular mechanisms controlling the establishment, growth and activity of tumors in bone. Several in vivo models have been established to study these events and each has specific benefits and limitations. The most commonly used model utilizes intracardiac inoculation of tumor cells directly into the arterial blood supply of athymic (nude) BalbC mice. This procedure can be applied to many different tumor types (including PC-3 prostate cancer, lung carcinoma, and mouse mammary fat pad tumors); however, in this manuscript we will focus on the breast cancer model, MDA-MB-231. In this model we utilize a highly bone-selective clone, originally derived in Dr. Mundy's group in San Antonio2, that has since been transfected for GFP expression and re-cloned by our group3. This clone is a bone metastatic variant with a high rate of osteotropism and very little metastasis to lung, liver, or adrenal glands. While intracardiac injections are most commonly used for studies of bone metastasis2, in certain instances intratibial4 or mammary fat pad injections are more appropriate. Intracardiac injections are typically performed when using human tumor cells with the goal of monitoring later stages of metastasis, specifically the ability of cancer cells to arrest in bone, survive, proliferate, and establish tumors that develop into cancer-induced bone disease. Intratibial injections are performed if focusing on the relationship of cancer cells and bone after a tumor has metastasized to bone, which correlates roughly to established metastatic bone disease. Neither of these models recapitulates early steps in the metastatic process prior to embolism and entry of tumor cells into the circulation. If monitoring primary tumor growth or metastasis from the primary site to bone, then mammary fat pad inoculations are usually preferred; however, very few tumor cell lines will consistently metastasize to bone from the primary site, with 4T1 bone-preferential clones, a mouse mammary carcinoma, being the exception 5,6.
This manuscript details inoculation procedures and highlights key steps in post inoculation analyses. Specifically, it includes cell culture, tumor cell inoculation procedures for intracardiac and intratibial inoculations, as well as brief information regarding weekly monitoring by x-ray, fluorescence and histomorphometric analyses.
протокол
1. Сотовые обслуживание
- Многие кости метастатического подклонах MDA-MB-231 существуют, которые имеют переменную склонность к колонизации костей и роста. Для наших экспериментов мы используем клон происходит от GFP с метками MDA-MB-231 разработан в UTHSCA 2. Этот конкретный суб-клон образуют видимые остеолитические поражения костей примерно в 3 прививки сообщению недель, с жертвоприношением в течение 4 недель.
- Поддерживать клеток в DMEM, содержащей 10% FBS и 0,1 мг / мл пенициллина-стрептомицина при 37 ° С в 5-8% CO 2 7.
- Прохождение клеток на 80-90% слияния и повторно пластины при разведении 1:10 (это зависит от типа клеток и размер пластины. Для MDA-MB-231 клеток в Т-75 это примерно 6х10 5), который примерно каждые 72 часа.
- MDA-MB-231 поддерживают клеток фибробластов в целом внешний вид с многочисленными псевдоподии. Любой округления свидетельствует о перенаселенности или других нежелательных стрессов, и его следует избегать, так как этоможет повлиять на метастатического потенциала в естественных условиях.
- В идеале, клетки должны поддерживаться в культуре только на короткое время перед прививкой (мы рекомендуем менее 1 недели или пока у вас есть достаточное количество клеток для эксперимента), и новый флакон следует разморозить при округлении или изменения в клетке темпы роста происходит.
2. Сотовые подготовка
- Trypsinize клеток на 80-90% слияния с 0,15% трипсин / ЭДТА (разбавлять 0,5% Gibco Трипсин EDTA 1:2 в PBS). Такая концентрация позволяет быстро отряда (<2 мин) и уменьшает слипание клеток.
- Немедленно снять клеток из пластины с 10 мл ледяной DMEM, содержащей 10% FBS, пипетки на 15 мл коническую трубку и центрифуги при 200 мкг в течение 5 мин.
- Ресуспендируют гранул в 50 мл коническую трубку в 25 мл ледяной PBS (без Са и Mg) и считать.
- Центрифуга повторно гранул, и ресуспендируют на 10 6 клеток на мл (внутрисердечных) или на 250000 cells/10 мкл (intratibial) в ледяной PBS. Температуратуры ФСБ важно для предотвращения слипания клеток и последующей эмболии после инъекции. Суспензии клеток должны оставаться на льду при выполнении инъекций и будет жизнеспособным и остаются без слипаются в течение 30 мин. Хотя точное число пластин необходимо будет варьироваться от следователя к следователю, мы обычно используем 1 Т-75 по цене от 8-10 мышей.
3. Прививка Внутрисердечные
- 4-6 недельных самок (Foxn ню-/ -: Харлан) мышей используют для этих экспериментов, хотя другие с нарушением иммунной системы мышей (RAG1-/ -, RAG2-/ -, SCID, XID, и т.д.) также может быть использованы с человека экспериментов раковых клеток.
- Голым мышам следует кормить Teklad 2920x диеты 5-10 дней до инъекции для уменьшения смертности от введения процедуры и сократить фоновой флуоресценции в процедурах томография (так как еда является люцерна бесплатно).
- При использовании мыши, кроме ню / ню, удаление волос после бритья или использования Наир (в нашем опыте Nair работает лучше) на вентральной брюшной арEA перед началом процедуры.
- Anesthetize мыши в изоляции камеры с использованием изофлурана испаритель (2,5% Iso: 2-3 л / мин O 2) или другим предпочтительным анестезии (в нашем опыте изофлуран лучше переносится внутрисердечных прививки).
- Перемещение на одну мышь в то время, в носовой конус из наркоза машину внутри нержавеющая сталь вентилируемый капот.
- Поместите каждую мышь на спине, с грудью вверх.
- Мыть грудь с 10% повидон / йода тампон / раствором с последующим 70% этанола, повторяя 2 раза.
- Все мыши груди для инъекций (с помощью стерильного маркером или маркировка немного в сторону, чтобы сохранить место инъекции стерильными). Мы используем полпути знак расположен между выемкой грудины и верхнюю часть xyphoid процесс, и немного влево (анатомическая) от грудины. Нарисуйте маленький пузырек воздуха в шприц, чтобы создать пространство между поршнем и мениск (важно для видя сердечные импульсы) в 300 мкл 28 г ½ инсулиновый шприц, исоставляет 100 мкл клеток.
- Держите иглу в вертикальном положении. Удерживая кожу мыши туго с другой стороны, вставить иглу.
- Успешное включение в левый желудочек сердца должны привести различные ярко-красные импульса крови в шприце. На этой глубине, осторожно нажмите поршень шприца (100 мкл), без существенного движения иглы, чтобы избежать прокалывания сердца или разлив клеток в грудной полости.
- После клетки вводили, подтянуть немного на поршень, чтобы создать небольшое количество отрицательное давление, чтобы уменьшить капает клеток в грудной полости.
- Вытяните иглу прямо из груди, будучи уверены, чтобы избежать наклона иглы во время удаления, которая может разорвать оболочки сердца и вызвать кровотечение.
- Применить мягкое давление на грудь на месте инъекции для уменьшения кровотечения.
- Удалить мыши из носовой конус и продолжают применять светового давления примерно на 1 мин.
- Подведите курсор к грелку до полного консознательной.
- Если мышь начинает вращаться или дергаться после восстановления, вероятной причиной является эмболия. Inject мыши intraperitonally с 80-120 мг / кг кетамина, чтобы увеличить поток крови и сердечного выброса при снижении сосудистого сопротивления. Это должно помочь мышь проходит сгусток. После этого происходит, то лучше изменить клеточных препаратов, а это означает, что клетки слипания. Мы меняем клеточных препаратов примерно через 8 мышей, или 30 мин.
4. Intratibial
- Inject мыши с Buprenex (0,1 мг / кг) или аналогичные утвержденной обезболивающего непосредственно перед процедурой.
- Anesthetize мыши, используя изофлуран, а затем перейти к носовой конус и поддержания анестезии.
- Очистите обе ноги с 10% повидон / йода тампон / раствор, а затем этанолом, повторять 2 раза. Депилировать ног (с Наир или аналогичного продукта) перед очисткой, если мех присутствует.
- Аккуратно понять латеральной лодыжки, медиальной лодыжки и нижней половины голени с большим и указательным йUMB, затем согните ноги (сочетание сгибания и боковое вращение, так что колено видна и доступна.
- Смочите кожу с 70% этанола, чтобы увеличить видимость, лежащие в основе связки коленной чашечки, которая должна быть видна как отдельное, толстая, белая линия. В то время как крепко держа лодыжки / ног мыши вставки 28g ½ иглы под коленную чашечку, до середины коленной связки, а в передней межмыщелковое в верхней части голени.
- При установке иглы в кость, руководство внимательно за счет роста пластины с использованием устойчивой, твердой давления с небольшим действием бурения.
- После проникновения большеберцовой пластины роста, игла встретит заметно меньшим сопротивлением.
- Используйте мягкое, боковое движение иглы для обеспечения игла находится в голень и за счет роста пластины. Движение будет ограничено, если игла находится в нужном месте в голени.
- Медленно нажать на поршень, вводят 10 мкл клеточной решение. Практически не сопротивление должно быть чувствовал в этот момент.
- Slowly извлечения иглы.
- Следуя той же процедуре, переходите к следующему ноги для введения 10 мкл PBS.
- Удалить мышь от наркоза и держать на грелку, пока восстановлены.
- Следить за мышами в течение следующих 24 часов и ввести дополнительные Buprenex каждые 12 часа, если животные продолжают демонстрировать признаки бедствия.
5. Изображениями время курса
- Luciferase Imaging: Где это применимо, люциферазы изображений следует использовать, начиная с 7 дней после инокуляции опухолевых клеток (хотя в большинстве моделей костных метастазов, обнаруживаемых день ближе к 14). Мышь внутрибрюшинно вводили 150 мг / кг люциферин, под наркозом, и отображаемого 8 мин после инъекции с использованием ИВИС оборудования 8.
- GFP изображений: как правило GFP-экспрессирующих опухоли начинают быть обнаружены около 10-14 дней для intratibial инъекции и 16-21 внутрисердечных эксперименты с использованием Maestro съемочной аппаратуры (CRI) 9. Коротко, мышей анестезировали изофлурана (3%) И выдерживают под наркозом через носовой конус в камеру Maestro изображений. Для наших EGFP-клеток, экспрессирующих мы используем сине набор фильтров (498 excitation/515 выбросов для EGFP) на 500 мс экспозиции с шагом 10 нм.
- Faxitron (X-Ray): X-лучи принимаются еженедельно, начиная с 7-й день до 14. Поражения будет видна в внутрисердечных модели на 21 день и на неделю раньше в intratibial инъекций 3. Наши рентгенографические данные для естественных бывших и в естественных условиях были получены с помощью Faxitron LX-60 на 35 кВ в течение 8 секунд воздействия.
- Другие изображения: изображения условиях будет полностью основано на конкретных исследованиях. В дополнение к вышеуказанным методам, изображений живых животных на основе 3D микро-компьютерная томография (μCT), микро-позитронной эмиссионной томографии (μPET), и другие условия 10,11 могут предоставить ценную информацию.
6. Мышь жертвы
- Каждая модель имеет несколько иной ход времени. С MDA-MB-231 клеток мышей обычно становятся худосочные или страдающий параличом нижних конечностей от 21 до 35 дней, а обычно около 28-й день (IT вводили мышам между 21-28 дней).
- После нескольких мышей развиваются поражения, которые начинают разрушаться через кортикальной кости, стал страдающий параличом нижних конечностей, или потерять 10-20% от веса тела, пожертвовать всем мышам в исследовании с использованием кетамина / ксилазина передозировки смещения шейных позвонков (или другой IACUC утвержденным методом).
- Удалить кости, необходимых для дальнейшего исследования и хранить в буфере 4% формалином.
- У мышей с опухолями груди является признаком пропустили инъекцию и должны быть исключены из исследования.
7. Ex Vivo анализ
- μCT: сканирование в 70% этанола позволяет структурных и гистологических параметров, измеренных на того же образца кости.
- Контура и анализа в соответствии с индивидуальными опытно-конструкторских и имеющегося оборудования 10. Наши данные были получены с Scanco μCT 40 с использованием 12 мкМ резолюции.
- Histomorphometry: Процесс образцы использованием предпочтительного гистологических методов и окраска гематоксилин / эозином 7
8. Представитель Результаты
После внутрисердечного или intratibial инокуляции опухолевых клеток (рис. 1) мышей контролируется еженедельно с помощью рентгенографии и флуоресценции (или люминесценции). Поражения обычно проявляются на рентгеновских неделю между 2 и 3, в то время как они могут быть видимой флуоресценции и люминесценции в начале недели 2, в зависимости от модели (рис. 2). Поражения видны как темные отверстия в кости, и становятся более выраженными с течением времени (рис. 3). Поражения были количественно, используя Metamorph анализа рентгенограмм и флуоресценции измеряли с помощью Maestro (CRI) приобретение визуализации и анализа программного обеспечения. Как поражений начинают расти, мышей часто становятся худосочные. Жертва необходима при мышей потеряли 10-20% своего первоначального веса. Состоянии мышах могут быстро меняться и должны быть проверены несколько раз в течение дня. В период с 3-4 недель мышей стали тащить один или оба задних конечностей и всего исследования была принесена в жертву. Изображения были приняты до жертвовать. После анестезии передозировки, брали кровь для измерения маркеров костного или других факторов. После смещения шейных позвонков, кожа была лишена от мыши и кости вырезали и очищены для бывших естественных изображений (рис. 3), которая позволит визуализации опухолевых очагов по крайней мере 7 дней раньше, чем в естественных методов визуализации. Как только изображение было завершено кости были помещены в маркированных кассеты и хранятся в формалине для фиксации и дальнейшей гистологической обработки или μCT анализа. Гистоморфометрия проводился на образцах для обозначения опухоли и BV / TV после μCT был выполнен на голени, чтобы определить количество костной деструкции (рис. 4).
/ 4260/4260fig1.jpg "/>
Рисунок 1. Правильное размещение инъекций. Брюшной радиографический (A) взрослого грудной клетки мыши показывает правильное размещение иглы в 4-м межреберье и в левый желудочек для прививки внутрисердечной. Анатомические ориентиры показано с горизонтальной пунктирной линии на грудине (они изложены в белом). На коже мыши грудины качество и xyphoid процесса служат в качестве ориентиров, а игла немного слева от грудины. Брюшной зрения радиографический (B) взрослого ногу мыши показывает правильное размещение иглы в проксимальных голени, соответствие между мыщелков. Из боковой перспективе кончике иглы помещается за бугристости большеберцовой кости и глубоко, чтобы эпифизарных пластин. Идеальное место для инъекций показан белым кругом.

Рисунок 2. Время хода кости модели метастазов. Прогрессирование окncer вызванных заболеванием костей показано с Х-лучами и GFP + флуоресцентные изображения опухолей в естественных условиях от intratibial инъекций (A) и внутрисердечной инъекции (B).
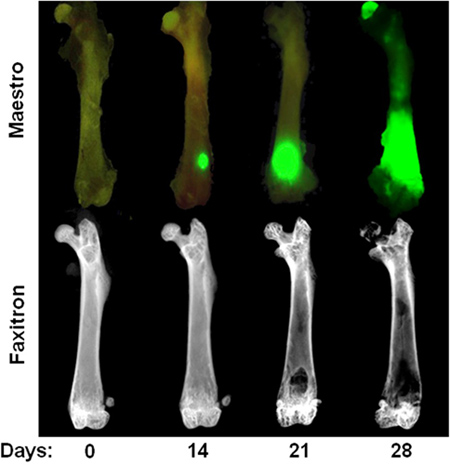
Рисунок 3. Время конечно внутрисердечной MDA-MB-231 модель Верхний ряд:. Ex изображение естественных условиях флуоресцентного микроскопа показывает на 0 день, 14, 21 и 28 после внутрисердечной инъекции MDA-MB-231. Обратите внимание, что опухолевых очагов на 14 день видны только в бывших естественных условиях после удаления мягких тканей. Нижний ряд: EX VIVO рентгенографических изображений одного и того же бедра иллюстрирующие остеолитические поражения костей. Обратите внимание, что разрушения кости обычно не видно, пока через 3 недели после сердечных инъекций.
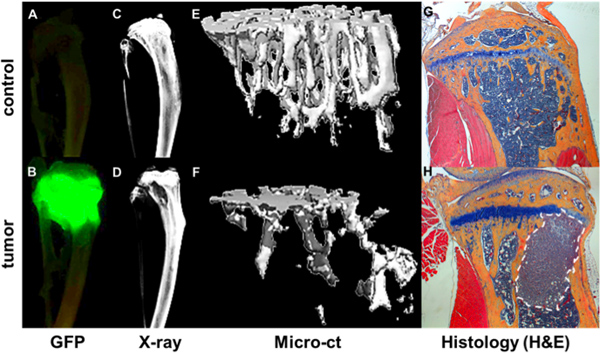
Рисунок 4. Количественная оценка кости метастатического прогрессирования. GFP + опухоли, как визуализируется Maestro изображения бывших естественных условиях из Тибип. в неопухолевой подшипник мыши (А) и мышей через 4 недели после внутрисердечной инъекции GFP выражение MDA-MB-231 субклона (B). Опухолевых очагов коррелируют с участками костной деструкции, как показано Faxitron (D) по сравнению кости без опухоли (C). Кость структурных и минеральных данные из microCT измерений отображаются как 3D изображение здоровой кости (E) и опухоли костей подшипника (F), где области костной деструкции показано, как пустота области. Дальнейшие подробности костей и опухоли наблюдается в соответствующем H & E окрашенных гистологических срезов (G & H).
Обсуждение
Исследование индуцированного опухолью болезни костей полагаются на нескольких животных моделях из которых два наиболее часто используемых внутрисердечной и intratibial прививок. Во многих случаях внутрисердечной является лучшим вариантом для изучения метастазы в кости, однако она не представляет полной метастатического процесса, и, следовательно, молочной жировой ткани или других ортотопической инъекции в идеале должны быть использованы в этом направлении. Опухолевые клетки не метастазируют легко с основного сайта в большинстве исследований с использованием человеческих клеток, и если да, то они в первую очередь метастазы в легкие. Некоторые штаммы 4T1 клетки метастазы в кости 5,6, но поражения меньше, более трудно оценить количественно, и клетки мышиной, а не человека. Кроме того, GFP выражение может вызвать иммунный ответ у иммунокомпетентных моделей, где 4T1 клоны часто используются, что может осложнить долгосрочные исследования метастаза 12. Другие модели опухоль-индуцированной болезни костей, как миелома, используют хвостовую вену инъекциюотражений 13. Однако, этот подход не будет работать для солидных опухолей исследования метастаза, как он будет подавляющее большинство семян опухоли в легких, в результате чего мыши умирают от заболеваний легких, прежде чем разрабатывать костных метастазов. Intratibial инъекции, как правило, рассматривается менее благоприятно, чем другие методы, так как она не представляет собой модель метастазов, а прогрессирование установлены метастазы костей и может вызвать воспаление в месте инъекции. Тем не менее, эта процедура полезна отделить начальную метастатическим шагов и создание от прямого воздействия на конечной стадии рака вызванных заболеванием костей. Кроме того, в случае многих моделях опухолей предстательной железы, это единственный подход, который позволяет для последовательного роста опухоли в костях 4.
Выбор методов мониторинга болезней кости как критическую и специфичные для исследования как путь заражения. В нашей группе мы используем различные методы в зависимости от исследования, тОн наиболее распространенными из которых являются рентген, флуоресценция и гистологии. В то время как многие группы перешли к люциферазы изображений, мы обнаружили, что мы получаем меньше метастазов в кости с люциферазы трансфецированных клеток и что мы лучше анатомические детали с флуоресцентных изображений и проще совместной локализации с Х-лучами. Кроме того, прямое сравнение между условиями не дали значительное преимущество люциферазы визуализации для раннего обнаружения в кости. Тем не менее, каждая группа выполнении этих экспериментов должны оценить полезность каждого из подходов для их исследования.
Кроме того, хотя использовались и во многих других моделях, подробные методы естественных бывший анализа являются специфическими для костей. Мы обычно анализируют потери костной массы по μCT. В то время как осуществляется аналогично исследований, посвященных анализу нормальной кости, анализ опухолями костей осложняется частой потере или нарушению роста пластины в качестве маркера. Гистологический анализ также несколько нюансов в опухолевыхНесущие кости по сравнению с протоколами, разработанными для неопухолевой подшипник костей и мягких тканей. В этом протоколе мы ограничились описанием экс анализ естественных условиях, чтобы сохранить фокус на наиболее часто используемые нашей группе. Как и в естественных условиях анализов, каждая группа должна будет определить, какие подходы работают лучше всего для их изучения.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы признают следующие источники финансирования: P01CA040035 (FE / JAS) и В. А. премию развития карьеры (JAS).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| MDA-MB-231 человеческих клеток рака молочной железы | Первоначально ATCC-Внутренне клонировали и выбранные | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040-CV | |
| FBS | Атлас биологического | F-0050a | |
| Трипсин | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Маэстро | CRi | ||
| μCT сканер | Scanco | ||
| Бестимусным голых мышей | Харлан | Fox ню - / - | |
| Инсулиновые шприцы (300 мкл, 28,5 г) | Becton Dickinson | 309300 | |
| ИВИС | Каверномер | ||
| Облученных диета грызунов | Teklad | 2920x |
Ссылки
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, Nova Science Publishers. (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены