Method Article
Models von Knochenmetastasen
In diesem Artikel
Zusammenfassung
Tiermodelle werden häufig genutzt, um Krebs Metastasen in Knochen zu untersuchen. In diesem Protokoll werden wir zwei gängige Methoden der Tumorinokulation für Knochenmetastasen Studien beschreiben und beschreiben Sie kurz einige Analysen genutzt werden, um zu überwachen und zu quantifizieren diese Modelle.
Zusammenfassung
Knochenmetastasen sind ein gemeinsames Auftreten in mehreren Malignitäten, einschließlich Brust-, Prostata-und Lungenkrebs. Einmal im Knochen festgestellt, sind Tumoren verantwortlich für erhebliche Morbidität und Mortalität 1. Somit besteht ein erheblicher Bedarf, um die molekularen Mechanismen, die die Einrichtung, Wachstums und der Aktivität von Tumoren in Knochen zu verstehen. Mehrere in-vivo-Modellen wurden eingerichtet, um diese Ereignisse zu studieren und jeder hat spezifische Vorteile und Einschränkungen. Das am häufigsten verwendete Modell nutzt intrakardialen Inokulation von Tumorzellen direkt in den arteriellen Blutversorgung athymischen (nackten) BalbC Mäusen. Dieses Verfahren kann auf viele verschiedene Tumortypen (unter anderem PC-3 Prostatakarzinom, Lungenkarzinom, und Maus Brustfettpolster Tumoren) aufgebracht werden, jedoch in diesem Manuskript wir uns auf die Brustkrebsmodell konzentrieren, MDA-MB-231. In diesem Modell nutzen wir eine hoch Knochen selektive Klon, ursprünglich in Dr. Mundy Gruppe in San Antonio 2 abgeleitet, dass hwie seit GFP-Expression transfiziert worden und durch unsere Gruppe 3 erneut geklont. Dieser Klon ist ein Knochen metastasierenden Variante mit einer hohen Rate von osteotropism und sehr kleine Metastasen in Lunge, Leber oder Nebennieren. Während intrakardiale Injektionen werden am häufigsten für Studien von Knochenmetastasen 2, in bestimmten Fällen verwendet intratibial 4 oder Brustfettpolster Injektionen sind besser geeignet. Intrakardiale Injektionen durchgeführt werden typischerweise bei der Verwendung von humanen Tumorzellen mit dem Ziel der Überwachung der späteren Stufen der Metastasenbildung, insbesondere die Fähigkeit der Krebszellen im Knochen zu verhaften, überleben, proliferieren und etablieren Tumoren, die in Krebs-induzierten Knochenerkrankung entwickeln. Intratibial Injektionen werden durchgeführt, wenn die sich auf die Beziehung von Krebszellen und Knochen nach ein Tumor an Knochen, die in etwa korreliert mit etablierten Knochenmetastasen metastasiert. Keines dieser Modelle rekapituliert frühen Schritte in der metastatischen Prozess vor Embolien und Eintragvon Tumorzellen in den Kreislauf. Wenn die Überwachung primäre Tumorwachstum oder Metastasen von primären Standort zu Knochen, dann Brustfettpolster Impfungen sind in der Regel bevorzugten, aber nur sehr wenige Tumorzelllinien konsequent den Knochen metastasieren vom primären Standort mit 4T1 Knochen bevorzugte Klone, eine Maus-Mamma- Karzinom, die Ausnahme 5,6.
Dieses Manuskript Details Impfung Verfahren und Highlights wichtige Schritte in post Inokulation Analysen. Insbesondere umfasst es Zellkultur, Tumorzellinokulation Verfahren zur intrakardialen und intratibial Impfungen sowie kurze Informationen über wöchentliche Überwachung durch Röntgen, Fluoreszenz und histomorphometrische Analysen.
Protokoll
Ein. Zelle Wartung
- Viele Knochen metastasierenden Subklone von MDA-MB-231 existieren, haben variable Neigung zum Knochen Besiedlung und das Wachstum. Für unsere Experimente verwenden wir ein Klon aus der GFP-markierten MDA-MB-231 bei UTHSCA 2 entwickelt abgeleitet. Diese besondere Sub-Klon wird sichtbar osteolytische Knochenläsionen bei ca. 3 Wochen nach der Impfung zu bilden, mit dem Opfer bei 4 Wochen.
- Pflegen Zellen in DMEM mit 10% FBS und 0,1 mg / ml Penicillin-Streptomycin bei 37 ° C in 5-8% CO 2 7.
- Durchgang Zellen bei 80-90% Konfluenz und Re-Platte bei einer 1:10-Verdünnung (dieser variiert je nach Zelltyp und der Größe Platte. Für MDA-MB-231-Zellen in einer T-75 dieses ca. 6x10 5 ist), die etwa alle 72 Stunden.
- MDA-MB-231-Zellen aufrechtzuerhalten einen allgemein fibroblastische Erscheinungsbild mit zahlreichen Pseudopodien. Eine Rundung ist bezeichnend für Überbelegung oder andere unerwünschte Stress und sollte, da dies vermieden werdenmöglicherweise metastatischen Potential in vivo beeinflussen.
- Idealerweise sollten die Zellen in Kultur gehalten werden nur kurz vor der Inokulation (wir empfehlen weniger als 1 Wo. oder bis genügend Zellen für das Experiment) und ein neues Röhrchen sollten aufgetaut wenn Rundung oder Veränderungen in Zellwachstumsrate auftreten.
2. Cell Preparation
- Trypsinieren Zellen bei 80-90% Konfluenz mit 0,15% Trypsin / EDTA (Gibco verdünnen 0,5% Trypsin EDTA 1:2 in PBS). Diese Konzentration ermöglicht eine schnelle Ablösung (<2 min) und reduziert Verklumpung der Zellen.
- Umgehend entfernen Zellen aus Platte mit 10 ml eiskaltem DMEM mit 10% FBS, Pipette in 15 ml konischen Röhrchen und Zentrifuge bei 200 xg für 5 min.
- Pellet in einem 50 ml konischen Röhrchen in 25 ml eiskaltem PBS (ohne Ca und Mg) und zählen.
- Zentrifuge erneut Pellets und resuspendieren bei 10 6 Zellen pro ml (intrakardiale) oder 250.000 Zellen/10 ul (intratibial) in eiskaltem PBS. Die Temperaturtur von PBS ist wichtig, um zu verhindern Verklumpung der Zellen und anschließender Embolie nach Injektion. Die Zellsuspension auf Eis bleiben während der Durchführung Injektionen und lebensfähig sein wird und bleiben für 30 min un-verklumpt. Während die genaue Anzahl der Platten erforderlich vom Ermittler Ermittler variieren, verwenden wir grundsätzlich 1 T-75 für zwischen 8-10 Mäusen.
3. Intrakardiale Impfung
- 4-6 Wochen alte weibliche (Foxn nu-/ -: Harlan) Mäuse werden für diese Experimente verwendet, obwohl andere immungeschwächten Mäusen (RAG1-/ -, RAG2-/ -, SCID, XID, usw.) können auch verwendet mit menschlichen Krebszelle Experimente.
- Die nackten Mäusen sollte fed Teklad 2920x Ernährung 5-10 Tage vor der Injektion Mortalität von der Injektion zu verringern, um und reduzieren Hintergrundfluoreszenz in bildgebenden Verfahren (seit das Essen ist Luzerne frei).
- Bei der Verwendung von Mäusen außer nu / nu, entfernen Haare durch Rasieren oder mit Nair (in unserer Erfahrung Nair besser funktioniert) auf ventralen Bauch area vor Beginn Prozedur.
- Anesthetize Maus in einer isolierten Kammer mit einem Isofluran Verdampfer (2,5% Iso: 2-3 L / min O 2) oder anderen bevorzugten Anästhesie (nach unserer Erfahrung Isofluran ist die beste für intrakardiale Impfungen toleriert).
- Bewegen einer Maus zu einem Zeitpunkt zu dem Nasenkonus des Anästhesiegerät in einem Edelstahl belüftete Haube.
- Positionieren Sie jede Maus auf seinem Rücken mit der Brust nach oben.
- Waschen Sie die Brust mit einem 10% Povidon / Jod Tupfer / Lösung von 70% Ethanol, Wiederholung 2 mal.
- Mark Maus Brust zur Injektion (unter Verwendung eines sterilen Marker oder Kennzeichnung leicht zur Seite, um die Injektionsstelle steril). Wir verwenden eine Marke Ort auf halbem Weg zwischen der Brustbeinkerbe und oben Xyphoid Prozess, und leicht nach links (anatomischen) des Brustbeins. Zeichne eine kleine Luftblase in die Spritze zum Raum zwischen dem Kolben und Meniskus (wichtig für das Sehen Herzpulses) eines 300 ul 28 g ½ Insulinspritze erstellen, undauszuarbeiten 100 ul Zellen.
- Halten Nadel aufrecht. Halten Sie die Haut der Maus straff mit der anderen Hand, legen Nadel.
- Erfolgreiche Insertion in linke Herzkammer sollte in einer ausgeprägten hellrot Impulses von Blut in der Spritze führen. In dieser Tiefe, sorgfältig niederdrücken Kolben der Spritze (100 ul Volumen), ohne signifikante Bewegung der Nadel zu vermeiden Punktieren des Herzens oder Verschütten Zellen in die Brusthöhle.
- Nachdem die Zellen injiziert werden, ziehen sich leicht am Stößel, um einen kleinen Betrag von Unterdruck zu reduzieren Abtropfen von Zellen in die Brusthöhle zu erstellen.
- Ziehen Nadel direkt aus Brust wobei sichergestellt, um ein Kippen der Nadel während der Entfernung, die die Auskleidung des Herzens reißen kann und zu Blutungen vermeiden.
- Sanften Druck auf der Brust auf die Injektionsstelle, um Blutungen zu verringern.
- Entfernen Maus vom Nasenkonus und weiterhin leichten Druck für etwa 1 min anzuwenden.
- Bewegen Sie die Maus, um Heizkissen bis zur vollständigen conbewusste.
- Wenn mit der Maus beginnt sich zu drehen oder zu zucken nach der Wiederherstellung, ist die wahrscheinliche Ursache eine Embolie. Injizieren Maus intraperitoneal mit 80 bis 120 mg / kg Ketamin und um den Blutfluss zu erhöhen, während Herzleistung abnehmender Gefäßwiderstand. Dies sollte helfen, die Maus passieren das Gerinnsel. Nachdem dies geschehen ist, ist es am besten Zellpräparationen ändern, da zeigt es, dass die Zellen verklumpen. Wir ändern Zellpräparationen nach ca. 8 Mäuse oder 30 min.
4. Intratibial
- Injizieren Maus mit Buprenex (0,1 mg / kg) oder ähnlichen analgetischen zugelassenen unmittelbar vor Prozedur.
- Anesthetize Maus mit Isofluran, dann Nasenkonus bewegen und Aufrechterhaltung einer Narkose.
- Reinigen beider Schenkel mit 10% Povidon / Iod Tupfer / Lösung, gefolgt von Ethanol, 2 mal wiederholt. Enthaarung Beine (mit Nair oder ähnliches Produkt) vor der Reinigung, wenn fur vorhanden.
- Fassen Außenknöchel, Innenknöchel und untere Hälfte der Tibia mit Zeigefinger und thumb, dann Biegung Schenkel (Kombination von Beugung und laterale Rotation, so dass das Knie sichtbar und zugänglich ist.
- Befeuchten Sie die Haut mit 70% EtOH, um die Sichtbarkeit der zugrunde liegenden Patellarsehne, die sichtbar sein als eigenständige, dicke, weiße Linie erhöhen sollte. Während fest Greifen Knöchel / Bein der Maus einfügen 28g ½ Nadel unter Patella, durch die Mitte der Patellarsehne und in der vorderen Area intercondylaris in der Oberseite des Schienbeins.
- Beim Einsetzen Nadel in Tibia, sorgfältig führen durch Wachstum Platte mit stetigen, festen Druck mit leichten Bohrwirkung.
- Beim Eindringen von tibialen Epiphysenfuge, wird die Nadel stoßen deutlich weniger Widerstand.
- Verwenden Sie einen sanften, seitliche Bewegung der Nadel, um sicherzustellen, Nadel in Tibia und durch das Wachstum Platte. Bewegung wird begrenzt, wenn die Nadel im richtigen Platz im Tibia werden.
- Langsam drücken Stößel 10 ul Zell-Lösung zu injizieren. Wenig bis gar keine Widerstand sollte an dieser Stelle zu spüren.
- SloWLY extrahieren Nadel.
- Nach dem gleichen Verfahren, um nächste Etappe fahren Sie 10 ul PBS injizieren.
- Entfernen Sie mit der Maus aus der Narkose und halten auf Heizkissen bis erholt.
- Überwachen Sie die Maus über die nächsten 24 Stunden und spritzen mit zusätzlichen Buprenex alle 12 Stunden, wenn die Tiere auf Anzeichen von Leiden zeigen, fortzusetzen.
5. Imaging Zeit Course
- Luciferase Imaging: Gegebenenfalls Luciferase Bildgebung sollte genutzt werden beginnend 7 Tage nach der Inokulation der Tumorzellen (obwohl in den meisten Knochenmetastasen Modelle, erkennbar näher an Tag 14). Maus intraperitoneal mit 150 mg / kg Luciferin, betäubt injiziert und abgebildet 8 min nach der Injektion mit IVIS Ausrüstungen 8.
- GFP Bildgebung: Typischerweise GFP-exprimierenden Tumoren beginnen zu sein um Tag 10-14 nachweisbar intratibial Injektionen und 16-21 für die intrakardiale Experimente mit Maestro bildgebende Geräte (CRi) 9. In Kürze, Mäuse werden mit Isofluran (3%) Und unter Narkose durch eine Bugspitze im Maestro Bildgebung Kammer aufrechterhalten. Für unsere eGFP-exprimierende Zellen verwenden wir den blauen Filter-Set (498 excitation/515 Emission für eGFP) bei 500 ms Belichtungszeit in 10 nm Schritten.
- Faxitron (X-ray): X-Strahlen getroffen werden wöchentlich ab zwischen Tag von 7 bis 14. Läsionen werden in der intrakardialen Modell an Tag 21 sichtbar und eine Woche zuvor in der intratibial Injektionen 3. Unsere Daten für radiografische ex vivo und in vivo wurden unter Verwendung eines Faxitron LX-60 bei 35 kV für 8 Sekunden Belichtung.
- Andere Imaging: Bildgebende Verfahren wird vollständig von der spezifischen Forschungsergebnisse gestützt werden. Zusätzlich zu den oben genannten Methoden können lebendes Tier Bildgebung an 3D-Mikro-Computertomographie (μCT), Mikro-Positron-Emissions-Tomographie (μPET), und andere Modalitäten 10,11 basieren wertvolle Informationen liefern.
6. Maus Sacrifice
- Jedes Modell verfügt über eine leicht unterschiedliche zeitliche Verlauf. Mit MDA-MB-231 Zellen Mäusen Regel geworden kachektische oder querschnittsgelähmt zwischen 21 und 35 Tagen und in der Regel um den Tag 28 (IT injizierten Mäusen zwischen 21-28 Tage).
- Sobald mehrere Mäuse entwickeln Läsionen, die durch den kortikalen Knochen zu brechen, werden querschnittsgelähmt, oder verlieren zwischen 10-20% des Körpergewichts, opfern alle Mäuse in der Studie mit Ketamin / Xylazin Überdosierung mit Genickbruch (oder andere IACUC anerkannten Methode) beginnen.
- Entfernen Sie Knochen zur weiteren Untersuchung und Shop in gepuffertem 4% Formalin benötigt.
- Mäuse, die mit der Brust Tumoren sind ein Zeichen für eine verpasste Injektion und muss von der Studie ausgeschlossen werden.
7. Ex-vivo-Analyse
- μCT: Abtasten in 70% EtOH ermöglicht strukturellen und histologischen Parameter auf derselben Knochenprobe gemessen werden.
- Contour und analysieren nach individuellen experimentellen Design und die Ausstattung 10. Unsere Daten wurde mit einem Scanco μCT 40 mit 12 uM Auflösung erhalten.
- Histomorphometry: Process Proben anhand bevorzugter histologischen Methoden und Flecken mit Hämatoxylin / Eosin 7
8. Repräsentative Ergebnisse
Nach intrakardialen oder intratibial Inokulation der Tumorzellen (Abbildung 1) Mäuse werden wöchentlich überwacht durch Radiographie und Fluoreszenz (oder Lumineszenz). Läsionen in der Regel zu werden, indem x-ray deutlich zwischen Woche 2 und 3, während sie sichtbar sein kann durch Fluoreszenz und Lumineszenz bereits in Woche 2, je nach Modell (Abbildung 2). Die Läsionen sind als dunkle Löcher in den Knochen, und immer deutlicher mit der Zeit (Abb. 3). Läsionen wurden quantifiziert mit Metamorph Analyse von Röntgenaufnahmen und Fluoreszenz quantifiziert wurde mit Maestro (CRi) Imaging-und Analysesoftware. Als Läsionen zu wachsen beginnen, Mäuse werden häufig Kachexie. Sacrifice ist erforderlich, wenn die Mäuse zwischen 10-20% ihres ursprünglichen Körpergewichts verloren haben. Der Zustand der Mäuse können rasch ändern und zu überwachen mehrere Male während des Tages werden. Zwischen 3-4 Wochen Mäusen begann eine oder beide Hinterbeine ziehen und die gesamte Studie wurde geopfert. Die Bilder wurden vor der Tötung genommen. Nach der Anästhesie Überdosierung wurde Blut gesammelt, um Marker des Knochenstoffwechsels oder andere Faktoren zu messen. Nach Genickbruch wurde die Haut von der Maus und Knochen herausgeschnitten entkleidet und gereinigt ex-vivo-Bildgebung (Abb. 3), die Visualisierung von Tumorherde ermöglichen wird mindestens 7 Tage früher als in vivo Bildgebung. Sobald Bildgebung abgeschlossen Knochen wurden in etikettierten Kassetten gegeben und in Formalin Fixierung und weitere histologische Verarbeitung oder μCT Analyse. Histomorphometrie wurde an den Proben durchgeführt, um die Tumorbelastung und BV / TV geben nach μCT auf einer Tibia durchgeführt wurde, um die Menge des Knochenabbaus (Abbildung 4) zu quantifizieren.
/ 4260/4260fig1.jpg "/>
Abbildung 1. Die richtige Platzierung der Injektion. Ventral radiologischen Ansicht (A) der erwachsenen Maus Thorax zeigt die richtige Platzierung der Nadel im 4. Interkostalraum und in der linken Herzkammer zur intrakardialen Impfung. Anatomischen Landmarken sind mit horizontalen gestrichelten Linien auf dem Brustbein (dargestellt in weiß). Auf der Maus Haut das Brustbeinkerbe und Xyphoid Prozess als Landmarken dienen, und die Nadel leicht des Brustbeins links eingefügt. Ventralen röntgenologischen Ansicht (B) des Schenkels erwachsenen Maus zeigt richtige Platzierung der Nadel in der proximalen Tibia, ausgerichtet zwischen den Kondylen. Aus einer seitlichen Perspektive die Spitze der Nadel hinter der Tuberositas und tief auf die Epiphysenfuge platziert. Ideale Lage für die Injektion von weißen Kreis angezeigt.

Abbildung 2. Zeitlicher Verlauf von Knochenmetastasen Modelle. Progression von ca.ncer induzierten Knochenerkrankung mit Röntgenstrahlen und GFP + gezeigten Fluoreszenzbilder der Tumoren in vivo aus intratibial Injektionen (A) und intrakardiale Injektionen (B).
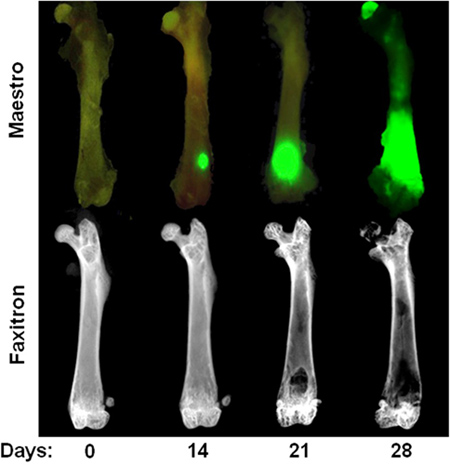
Abbildung 3. Zeitverlauf der intrakardialen MDA-MB-231-Modell Obere Reihe:. Ex vivo-Bild zeigt GFP-Fluoreszenz am Tag 0, 14, 21, und 28 nach intrakardiale Injektion von MDA-MB-231. Beachten Sie, dass Tumorherde am Tag 14 nur in ex vivo sind nach Weichgewebe entfernen. Untere Reihe: Ex vivo Röntgenbildern der gleichen Femora Veranschaulichung osteolytische Knochenläsionen. Beachten Sie, dass Knochenabbau normalerweise nicht sichtbar, bis 3 Wochen nach herzchirurgischen Injektion.
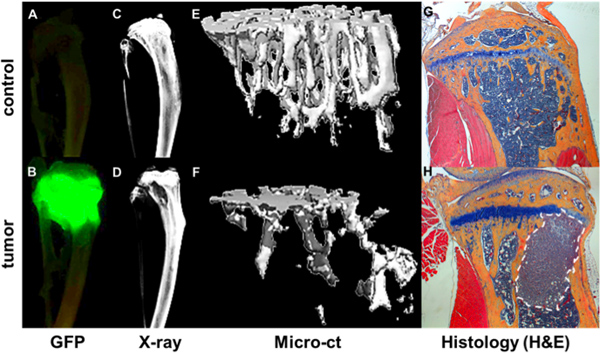
Abbildung 4. Quantifizierung der Knochen metastasiertem Progression. GFP + Tumor visualisiert Maestro Bildgebung ex vivo tibiae eines nicht-tumortragenden Maus (A) und einer Maus 4 Wochen nach intrakardiale Injektion eines GFP exprimierenden MDA-MB-231-Subklon (B). Tumorherde korrelieren mit Bereichen Knochenabbau wie durch Faxitron (D) gezeigt, im Vergleich einen Knochen ohne Tumor (C). Knochen strukturellen und mineralischen Daten aus MicroCT Messungen als 3D-Bilder eines gesunden Knochens (E) und einer tumortragenden Knochen (F), wo Bereichen Knochenabbau werden als nichtig Bereich angezeigt gerendert. Weitere Knochen-und Tumor Detail in entsprechenden H & E gefärbten histologischen Schnitten (G & H) gesehen.
Diskussion
Studium der Tumor-induzierten Knochenerkrankungen verlassen sich auf mehreren Tiermodellen von denen die beiden am häufigsten verwendeten sind intrakardialen und intratibial Impfungen. In vielen Fällen intrakardialen ist die beste Option für die Untersuchung Metastasen in Knochen, aber es gibt nicht die volle metastatischen Prozess, und daher Brustfettpolster oder andere orthotopen Injektionen sollten idealerweise auf dieses Ziel verwendet werden. Tumorzellen nicht leicht metastasieren vom primären Standort in den meisten Studien mit menschlichen Zellen, und wenn ja, sie in erster Linie auf die Lunge metastasieren. Einige Stämme der 4T1 Zellen den Knochen 5,6 metastasieren, aber die Verletzungen sind kleiner, schwer zu quantifizieren, und die Zellen sind murine als Mensch. Zusätzlich kann GFP-Expression eine Immunantwort in immunkompetenten Modellen, bei denen 4T1 Klone, die häufig verwendet werden, können erschweren langfristige Metastasierung Studien 12. Andere Modelle von Tumor-induzierten Knochenerkrankungen, wie Myelom, nutzen Schwanzvene injxionen 13. Allerdings wird dieser Ansatz nicht für feste Tumormetastasen Studium arbeiten, wie es will überwältigend Saatgut die Tumoren in der Lunge, was die Mäuse von Lungenkrankheiten vor der Entwicklung von Knochenmetastasen sterben. Intratibial Injektionen werden im allgemeinen weniger günstig als die anderen Verfahren angesehen, da sie nicht stellen ein Modell von Metastasen, sondern die Progression der Knochenmetastasen etabliert und können Entzündungen an der Injektionsstelle verursachen. Dennoch ist dieses Verfahren nützlich, um anfängliche metastasierendem Schritte und Etablierung von den direkten Auswirkungen auf die im Endstadium Krebs-induzierten Knochenerkrankungen zu trennen. Ferner ist in dem Fall von vielen Prostatatumor Modellen ist es der einzige Ansatz, für eine konsistente Tumorwachstum in Knochen 4 ermöglicht.
Die Auswahl von Techniken für die Überwachung Knochenerkrankung ist als kritisch und spezifisch für die Studie der Route der Inokulation. In unserer Gruppe nutzen wir viele verschiedene Techniken je nach Studie, tEr häufigsten davon sind x-ray-, Fluoreszenz-und Histologie. Während viele Gruppen an Luciferase Bildgebung haben transitioned haben wir gefunden, dass wir weniger Knochenmetastasen mit den Luciferase-transfizierten Zellen und dass wir bessere anatomische Detail mit Fluoreszenz-Bildgebung und einfacher Colokalisierung mit Röntgenstrahlen erhalten. Darüber hinaus hat direkten Vergleich zwischen Modalitäten nicht zu einem signifikanten Vorteil Luciferase Bildgebung zur Früherkennung in den Knochen. Allerdings wird jede Gruppe der Durchführung dieser Experimente müssen die Nützlichkeit von jedem Ansatz für ihre Studien zu evaluieren.
Zusätzlich, wenn auch in vielen anderen Modellen verwendet werden, sind die detaillierten ex vivo Analyse-Techniken spezifisch für Knochen. Wir gemeinsam zu analysieren, Knochenschwund durch μCT. Während ähnlich Studien zur Analyse normaler Knochen durchgeführt wird, wird die Analyse von Tumor-tragenden Knochen durch den häufigen Verlust oder Zerstörung der Wachstumsfuge als Marker kompliziert. Histologische Analysen werden auch etwas in der Tumor-nuanciertTragenden Knochen um Protokolle für Nicht-Tumor-tragenden Knochen und Weichgewebe entwickelt verglichen. In diesem Protokoll haben wir die Beschreibung der ex vivo-Analysen begrenzt, um den Fokus auf die am häufigsten von unserer Gruppe Verwendete aufrechtzuerhalten. Wie bei in vivo-Analysen, wird jede Gruppe braucht, um festzustellen, welche Ansätze am besten für ihre Studie.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich folgende Finanzierungsquellen: P01CA040035 (FE / JAS) und VA Career Development Award (JAS).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| MDA-MB-231 Brustkrebszellen | Ursprünglich ATCC-Intern kloniert und ausgewählt | ||
| DMEM | GIBCO | 11885 | |
| PBS | Mediatech Inc | 21-040-CV | |
| FBS | Atlas Biological | F-0050a | |
| Trypsin | GIBCO | 15400 | |
| Faxitron | Faxitron | ||
| Maestro | CRi | ||
| μCT-Scanner | Scanco | ||
| Nacktmausmodell | Harlan | Fox nu - / - | |
| Insulinspritzen (300 ul, 28,5 g) | Becton Dickinson | 309300 | |
| IVIS | Caliper | ||
| Bestrahlten Rodent Diet | Teklad | 2920x |
Referenzen
- Sterling, J. A., Edwards, J. R., Martin, T. J., Mundy, G. R. Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone. 48, 6-15 (2011).
- Yoneda, T., Sasaki, A., Mundy, G. R. Osteolytic bone metastasis in breast cancer. Breast Cancer Res. Treat. 32, 73-84 (1994).
- Johnson, R. W. TGF-beta promotion of Gli2-induced expression of parathyroid hormone-related protein, an important osteolytic factor in bone metastasis, is independent of canonical Hedgehog signaling. Cancer Res. 71, 822-831 (2011).
- Li, X. Loss of TGF-beta Responsiveness in Prostate Stromal Cells Alters Chemokine Levels and Facilitates the Development of Mixed Osteoblastic/Osteolytic Bone Lesions. Mol. Cancer Res. , (2012).
- Yoneda, T. Actions of bisphosphonate on bone metastasis in animal models of breast carcinoma. Cancer. 88, 2979-2988 (2000).
- Rose, A. A. Osteoactivin promotes breast cancer metastasis to bone. Mol. Cancer Res. 5, 1001-1014 (2007).
- Sterling, J. A. The hedgehog signaling molecule Gli2 induces parathyroid hormone-related peptide expression and osteolysis in metastatic human breast cancer cells. Cancer Res. 66, 7548-7553 (2006).
- Lu, X. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell. 20, 701-714 (2011).
- Oyajobi, B. O. Detection of myeloma in skeleton of mice by whole-body optical fluorescence imaging. Mol. Cancer Ther. 6, 1701-1708 (2007).
- Johnson, L. C. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48, 141-151 (2011).
- Sterling, J., Johnson, R. Imaging Techniques for the Detection and Examination of Breast Cancer Metastasis to Bone. 46, Nova Science Publishers. (2011).
- Steinbauer, M. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin. Exp. Metastasis. 20, 135-141 (2003).
- Oyajobi, B. O. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 102, 311-319 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten