Method Article
Оценка биоматериалов для мочевого пузыря Увеличение использования цистометрическая анализа в различных моделях грызунов
В этой статье
Резюме
Хирургические этапы пузыря увеличение описываются с использованием 3-D лесов в мышиных и крысиных моделях. Чтобы проверить эффективность биоматериала конфигурации для использования в мочевой пузырь увеличение, техники для бодрствования и анестезии цистометрия представлены.
Аннотация
Renal function and continence of urine are critically dependent on the proper function of the urinary bladder, which stores urine at low pressure and expels it with a precisely orchestrated contraction. A number of congenital and acquired urological anomalies including posterior urethral valves, benign prostatic hyperplasia, and neurogenic bladder secondary to spina bifida/spinal cord injury can result in pathologic tissue remodeling leading to impaired compliance and reduced capacity1. Functional or anatomical obstruction of the urinary tract is frequently associated with these conditions, and can lead to urinary incontinence and kidney damage from increased storage and voiding pressures2. Surgical implantation of gastrointestinal segments to expand organ capacity and reduce intravesical pressures represents the primary surgical treatment option for these disorders when medical management fails3. However, this approach is hampered by the limitation of available donor tissue, and is associated with significant complications including chronic urinary tract infection, metabolic perturbation, urinary stone formation, and secondary malignancy4,5.
Current research in bladder tissue engineering is heavily focused on identifying biomaterial configurations which can support regeneration of tissues at defect sites. Conventional 3-D scaffolds derived from natural and synthetic polymers such as small intestinal submucosa and poly-glycolic acid have shown some short-term success in supporting urothelial and smooth muscle regeneration as well as facilitating increased organ storage capacity in both animal models and in the clinic6,7. However, deficiencies in scaffold mechanical integrity and biocompatibility often result in deleterious fibrosis8, graft contracture9, and calcification10, thus increasing the risk of implant failure and need for secondary surgical procedures. In addition, restoration of normal voiding characteristics utilizing standard biomaterial constructs for augmentation cystoplasty has yet to be achieved, and therefore research and development of novel matrices which can fulfill this role is needed.
In order to successfully develop and evaluate optimal biomaterials for clinical bladder augmentation, efficacy research must first be performed in standardized animal models using detailed surgical methods and functional outcome assessments. We have previously reported the use of a bladder augmentation model in mice to determine the potential of silk fibroin-based scaffolds to mediate tissue regeneration and functional voiding characteristics.11,12 Cystometric analyses of this model have shown that variations in structural and mechanical implant properties can influence the resulting urodynamic features of the tissue engineered bladders11,12. Positive correlations between the degree of matrix-mediated tissue regeneration determined histologically and functional compliance and capacity evaluated by cystometry were demonstrated in this model11,12. These results therefore suggest that functional evaluations of biomaterial configurations in rodent bladder augmentation systems may be a useful format for assessing scaffold properties and establishing in vivo feasibility prior to large animal studies and clinical deployment. In the current study, we will present various surgical stages of bladder augmentation in both mice and rats using silk scaffolds and demonstrate techniques for awake and anesthetized cystometry.
протокол
Хирургические методы
1. Хирургическая подготовка и анестезия
- Настройка стерильных хирургических поле с необходимым хирургических инструментов: ножницы для бритья, щипцы с зубами, прекрасно атравматической щипцы, тонкая игла водитель, марля, Metzenbaum ножницы, тенотомии ножницы, лезвие скальпеля, 30 калибровочных шприц, заполненный солевым 1 мл шприца, четыре 6-0 полипропиленовых нитей, 7-0 полиглактин шов, шов 4-0 полиглактин.
- Обезболить животное ИФ ингаляции в индукционной камере. Подтверждение полной индукции животных до передачи операционного поля. Убедитесь, что ингаляционная анестезия трубка находится в соответствующем положении, чтобы непрерывное обезболивание.
- Поместите животных лежа на стерильной драпировки.
[Для цистометрическая анализа, см. ниже в туннелирование цистостомии катетер.] - Используйте для бритья ножницы для удаления шерсти из нижней части живота.
- Подготовка живот бытьtadine и 70% этанола.
- До разреза, таких как анальгетик бупренорфин (0,05-0,1 мг / кг) можно вводить подкожно для периоперационной контроль боли.
2. Разрез и выдержки из мочевого пузыря
- Сделайте 1-2 см (в зависимости от размера животного и ли крысы или мыши) ниже средней линии разрез скальпелем через кожу. Углубление разрез в нижней части разреза по прямой мышцы, стараясь не повредить основной кишечника и мочевого пузыря.
- Использование зубчатого щипцы, поднять прямой мышцы и анализировать свободные задней поверхности мышц с тонкими ножницами Metzenbaum.
- Надрезать оставшуюся часть мышцы в средней линии по всей длине вашего кожного разреза.
- Доставить в мочевой пузырь через рану разреза (рис. 1). Мочевого пузыря, как правило, наиболее зависимых органов в области таза. (У мужчин предстательная железа на самом деле более зависимым и большераспаковать мочевого пузыря).
- Поместите один пребывания шов через заднюю стенку мочевого пузыря, а потом еще через переднюю стенку мочевого пузыря использованием полипропилена 6-0 шва. Установите дополнительные швы сбоку. Не привязывайте этих швов. Когда швы проходят тугой, мочевой пузырь будет иметь конфигурации и площади размером примерно 1 см 2 (рис. 2). Будьте осторожны, чтобы не слишком много напряженности на эти швы, как они легко могут быть выведены через ткани мочевого пузыря.
- Надрезать мочевого пузыря продольно через переднюю стенку мочевого пузыря (чуть меньше купола мочевого пузыря), в средней линии примерно на 1 см (1,5-2 см у крыс мочевого пузыря).
3. Анастомоз леса
- Использование тонких ножниц обрежьте шелка эшафот к приближенным области мочевого пузыря дефекта.
- Используя 7-0 полиглактин шов, начните с одного угла на эшафот и сшивать ее в мочевой пузырь в непрерывном, бегмода для создания водонепроницаемого уплотнения по всему периметру дефекта (рис. 3).
- Проверка целостности анастомоза путем заполнения мочевого пузыря стерильным физиологическим раствором, внушая через стенку мочевого пузыря на 30 иглы подкожного датчика. Если утечки не найден, это может быть закрыта с дополнительным прерван 7-0 полиглактин шов, чтобы закрыть этот пробел.
- Уменьшить реконструированного мочевого пузыря обратно в брюшную полость.
4. Закрытие Инцизионная
- До закрытия брюшной стенки, вводить прямой мышцы и подкожной клетчатки с bupivicaine для местной анестезии (<3 мг / кг 0,25%).
- Reapproximate прямой мышцы с непрерывной работы 4-0 шва полиглактин.
- Закройте кожи с непрерывным, работает 4-0 шва полиглактин.
- Очистите и высушите разрез (рис. 4).
- Передача животных в теплую, чистую клетку для пробуждения от наркоза.
- Настройка стерильных хирургических поле с необходимым хирургических инструментов: ножницы для бритья, щипцы с зубами, прекрасно атравматической щипцы, тонкая игла водитель, марля, Metzenbaum ножницы, ножницы тенотомии, небольшой изогнутый зажим, лезвие скальпеля, 6-0 полипропилена, 4-0 полиглактин шов, шов 3-0 шелка (4-0 шва шелком для мышей), 18G иглы 22G тупым кончиком иглы, игла 25G, 1 мл физиологического раствора заполнены шприц, полиэтиленовых труб 50 (ПЭ-50) разрезать на длине ~ 10 см.
- Flare конца ПЭ-50, трубы, аккуратно выставлять ее на огонь. Будьте осторожны, чтобы не расплавиться от конца или закупорить просвет (это может быть проверена путем инъекционного введения физиологического раствора через иглу 25G связаны с «не-клеш" конец и обеспечение потока). Это служит якорем для поддержания трубки в мочевой пузырь (рис. 5). анестезию животного, как указано выше в пункте 1.2.
- Используйте для бритья ножницы для удаления шерсти и от спины животного между лопаткой и нижней части живота на нижняя часть.
- Подготовка районов с бетадин и 70% этанола. Поместите животных ничком на драпировку.
- Сделать 1 см разрез на спине между лопаток. Использование Metzenbaum ножницы, разработка самолета между кожей и основные мышцы, поставив кончики ножницами в самолете и распространения их для создания туннеля вокруг брюшной живота.
- Расположите животных на спине. Сделайте разрез брюшной и подвергать мочевого пузыря, как указано выше в 2,1-2,4 шагов. Сокращение мочевого пузыря обратно в брюшную полость.
- Поместите небольшой зажим в ваш подкожный туннель, созданный на шаге 5,6, начиная с вашего спинного разреза кожи. Использование пальцев для защиты внутрибрюшного содержание, проникнуть через брюшную стенку с концами зажим в животе.
- Возьмите сmooth конца ПЭ-50, трубка с зажимом и вытащить его через спинной разрез. Убедитесь, что bulbed конца не вытащил прошлом брюшной стенки (рис. 6).
- Доставка мочевого пузыря через разрез. С этой точки зрения, мочевого пузыря следует обращаться с тонкими щипцами, чтобы предотвратить травмы мочевого пузыря, которые могут вызвать повреждение или воспаление, которое может исказить ваш цистометрическая результаты или влекут за собой дополнительные неудобства для животного после операции.
- Обратите внимание на предлагаемый сайт цистостомии трубку. Он должен находиться на купола мочевого пузыря (выше более усилит сегмента). Это позволит предотвратить извитость или закупорка труб.
- Использование полипропиленовых 6-0 шва, поместите pursestring стежка на купола мочевого пузыря следующим образом: первое место бросок через стенку мочевого пузыря продольно, сбоку от предлагаемого места для цистостомии трубы. Оставьте небольшой зажим на свободный конец так, чтобы шов не случайно вытащил весь путь до конца. Поместите следующий бросок в поперечном направлении, начав идти в стенке мочевого пузыря немного сбоку от выхода вашего первого броска.
- Не тяните шов тугой. Поместите следующий параллельный шов на ваш первый (продольно) собирается в мочевом пузыре только краниально к выходу сайт вашего последнего, поперечный шов. Четвертый броска начнет боковое к выходу последнего стежка и конечным рядом с входом для первого броска. Совершено правильно, это образует окружные квадрат вокруг предполагаемого места катетер (рис. 7).
- Использование 18G иглу, прокалывают стенки мочевого пузыря в центре pursestring шва. Будьте осторожны, чтобы не прокалывать слишком глубоко (достаточно, чтобы быть просвета). Положите кончики тонких щипцов в отверстие и аккуратно развести расширить отверстие.
- Вставьте bulbed конце катетера в дефектмочевой пузырь, пока он не просвета. Потяните pursestring шов плотно вокруг катетера и связать его. Это должно подпруга стенки мочевого пузыря вокруг катетера держать его на место (рис. 8).
- Возьмите один конец шва и оберните его вокруг катетера раз и связывают это до дальнейшего обеспечения катетера.
- С 1 мл шприц и игла 25G, вставить иглу в трубку и медленно вводят солевой разбухают в мочевом пузыре. Соблюдайте для утечки вокруг катетера. Как только вы увидите утечки из мочеиспускательного канала, аспирации солевого распаковать мочевой пузырь снова.
- Закройте разреза брюшной полости, что и выше с шагом 4.1-4.4.
- Расположите животных склонны.
- Разрежьте трубки катетера на уровне кожи с ножницами. Вставьте 22G тупая тис иглой в трубку.
- Закройте кожу над трубкой с 4-0 полиглактин в запущенном моде. Оставьте иглу центром выдавливания из кожи.
- Установите внутривенной крышка линии на тупой иглой. Используя 3-0 шелковые шва, закрепите катетера к коже (рис. 9).
- Очистите разрез. Передача крысы в теплую, чистую клетку для пробуждения от наркоза.
- * Окклюзии дистального конца катетера петель или с использованием его пламя, чтобы расплавить конца.
- * Катушка конец трубки и оставить его в сумке подкожной на спинке животного (НЕ резать трубы, чтобы сократить его) (рис. 10).
- * Закройте кожу над трубкой с 4-0 полиглактин в запущенном одежды (рис. 11).
- * В день цистометрия, подготовить спинной разрез с бетадин и 70% этанола. Откройте спинной разрез под наркозом и удаление гибких НКТ из мешочка подкожным. Закройте разрез. Пробуждение животного из наркоза и выполнять цистометрия когда он окончательно проснулся.
- Установка описана MLT844 ADInstruments с сбора данных и анализа LabChart v6 (ADInstruments) и настой с Гарвардским 22 шприцевой насос (Harvard аппаТус, Holliston, MA), хотя другие аналогичные системы имеются (рис. 12).
- Калибровка объема и давления, основанные на спецификации цистометрическая используемой системы.
- Поместите животных в метаболические клетки (клетки с пол сетки), которые подвешены на масштабе. Масштабы подключен к датчику.
- Очистить систему от пузырьков воздуха и обеспечить непрерывный поток от инфузионного насоса.
- Подключите систему сбора данных к компьютеру и наблюдать за данными обводка. Отрегулируйте масштаб соответственно. Давление мочевого пузыря и объем мочи будет постоянно регистрируются.
- Доступ к надлобковой катетеры с иглой 27G подключен через Т-трубку к преобразователю давления и инфузионного насоса. Начало вливание физиологического раствора на 12,5 мкл / мин для мыши и 100 мкл / мин для крыс.
- Позвольте мочеиспускания шаблон трассировки для стабилизации (повышения давления мочевого пузыря, а затем пустота). Это обычно занимает приближениепримерно 10-20 минут. Запишите мочеиспускания циклов 45-120 минут или по крайней мере 3-4 циклов мочеиспускания.
- Соблюдать всю процедуру в режиме реального времени для устранения осложнений, которые приведут к артефакт (т.е. катетер извитости, обструкции и т.д., см. ниже обсуждение).
- Остановить вливания, отключить катетер из системы, и вернуть животное в клетку.
- Обезболить животное уретана (1-2 г / кг) внутрибрюшинном введении (IP).
- Выставьте мочевого пузыря, как указано выше с шагом 1.3-2.4.
- Калибровка системы, как в пункте 9.2. Подготовка системы, как в пункте 9.4-9.5.
- Вставьте иглу 27G подключен через Т-трубку датчика давления и инфузионных насосов в латеральной поверхности мочевого пузыря.
- Запишите мочеиспускания циклов 45-90 минут.
- Остановить инфузии, удалите иглу из мочевого пузыря и усыпить животное.
Шаги по цистостомии катетера для цистометрическая анализа являются следующие:
5. Туннелирование цистостомии катетер
6. Размещение цистостомии труб
7. Тестирование катетер и закрытия разреза брюшной полости
8. Закрытие спинного разреза и обеспечение безопасности катетер (для крыс)
8. * Закрытие спинного разреза и обеспечение безопасности катетер (для мышей и крыс)
9. Представитель Результаты - Хирургические методы
Реконструированного мочевого пузыря должна быть водонепроницаемой, чтобы избежать осложнений, связанных с утечкой значительных мочи (рис. 3). Боль или дискомфорт обычно проявляется в виде дрожи или царапин и грызть разреза брюшной полости. Это можно управлять с помощью ежедневных подкожных инъекций нестероидных противовоспалительных, такие как мелоксикам (0,5-1,0 мг / кг подкожно). Как правило, животные требуют только инъекции в течение первых 3 дней после операции. Это может быть дополнен опиоидов, таких как бупренорфин (0,05-0,1 мг / кг каждые 8-12 подкожной ч) по мере необходимости. Животные должны быть проверены 3 раза в день в течение первых 3 после операции дни, TWльда в день в течение послеоперационного дня на 3-5, а затем ежедневно после оценки боли, признаки инфекции, адекватные заживление ран, активность, уход, и тургор кожи. Антибиотики (Baytril, 5мг/кг подкожной каждые 24 ч в объеме не более 0,1 мл) приведены в первые 72 часа после операции, а хирургическое профилактики против инфекции. Признаки восстановления нормальной нормально передвигаться и уровня активности, соответствующее питание и питье, отсутствие боли или страдания (не вокализация) и нормальной социализации с cagemates. Время восстановления, по крайней мере 5-7 дней должна быть дана до цистометрическая анализа, чтобы обеспечить заживление мочевого пузыря и уменьшение воспаления, которые потенциально могут повлиять на результаты.
Анализ цистометрическая
10. Awake цистометрическая анализ
11. Бессознательное цистометрическая анализа (не надлобковой катетер)
12. Представитель Результаты - цистометрическая Анализы
Urodynamic начертания может быть проанализирована, чтобы получить такие параметры, как объемы аннулированы, соответствие пик мочеиспускания давление, в частности сокращение интервала, время мочеиспускания и после цикла недействительным остаточного объема.
Цистометрограмму можно разделить на заполнение и мочеиспускания фазы. Нормальной фазы наполнения является частью мочеиспускания цикл, в котором мочевой пузырь наполняется очень мало изменений в внутрипузырного давления. Нормальной фазы недействительными трассировки состоит из устойчивый рост внутрипузырного давления, соответствующего сокращения детрузора. Наибольшее давление, достигнутых в ходе мочеиспускания этапе трассировки называется пиковое давление мочеиспускания. Высокого давления мочеиспускания пик можно предположить, обструктивный модель мочеиспускания, мочевой пузырь или hypercontractile излом SP катетер. Соответствие может быть вычислена путем приобретения отношение объема привил Дуринг заполнения фазы и изменение давления (соблюдение = DV / DP). Hypocompliant мочевого пузыря является тот, который не может принять адекватные объемы мочи при низких давлениях. Intercontraction интервал может быть рассчитан на основе анализа времени между двумя сокращениями, как показано на цистометрограмму. Короткий промежуток intercontraction наводит на мысль о раздраженного мочевого пузыря. Время мочеиспускания цикла относится ко времени, которое требуется для заполнения всей фазы мочеиспускания и для завершения и может быть легко установлено на основе анализа трассировки. В заключение цистометрия, после недействительными остаточный (PVR) может быть получена. Это делается путем аспирации надлобковой катетера после завершения детрузора сокращения. Эти параметры помогают следователю объективно изучать динамику как пузырь мочевой пузырь заполняется и опорожняется.
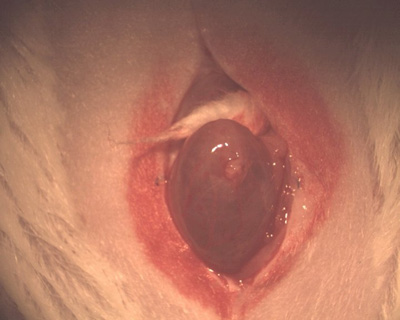
Рисунок 1. Фотография разреза брюшной полостиэкструзии и мочевого пузыря.

Рисунок 2. Мочевого пузыря разрез с воздействием мочевого пузыря просвет.
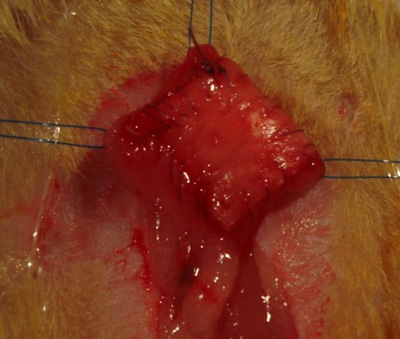
Рисунок 3. Интеграции имплантата на стенки мочевого пузыря.
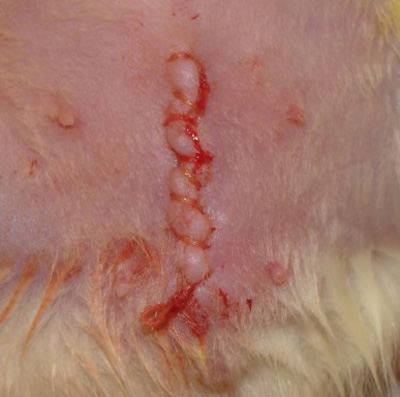
Рисунок 4. Фотография закрытой разрез.

Рисунок 5. Клеш конца ПЭ-50 трубки.

Рисунок 6. ПЭ-50, трубка (катетер) через спинной разрез.
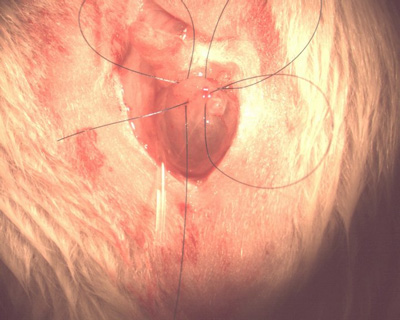
Рисунок 7.Pursestring шва.
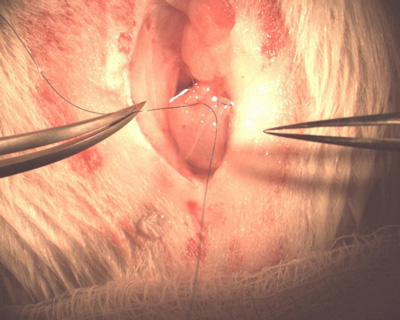
Рисунок 8. Обеспечение катетера в мочевой пузырь.
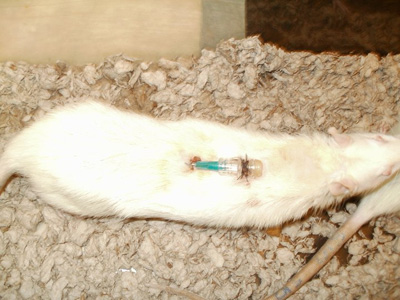
Рисунок 9. Обеспеченные центр катетера.
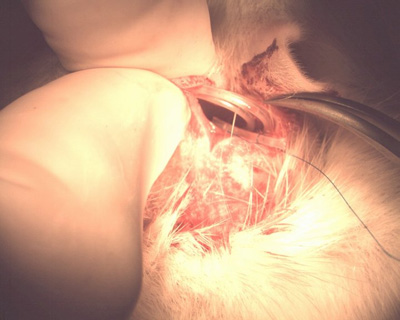
Рисунок 10. Колтюбинг в сумке подкожно.

Рисунок 11. Спинного разреза закрытия.

Рисунок 12. Пример цистометрическая настройки.

Рисунок 13. Представитель цистометрия трассировки.
Обсуждение
Цистометрическая оценки конфигурации после имплантации биоматериала и мочевого пузыря, увеличение в небольших моделях на животных представляет собой важный шаг проверки для определения оптимальных структурных и механических характеристик матрицы конструкции для использования в клинических ситуациях. В данной работе мы описываем хирургические методы для выполнения пузыря увеличение у мышей и крыс, а также цистометрическая методы определения свойств уродинамических инженерных органов для функциональной оценки. Мы использовали эти методы в нескольких экспериментов с участием мышей и крыс, при этом каждый эксперимент, состоящий из 30 + грызунов без существенных проблем. Наша научно-исследовательская лаборатория представляет собой конгломерат разнообразных основных ученых и врачей хирургов и хирургов, по крайней мере 5-6 лет аспирантуры хирургической подготовки выполняются процессуальные аспекты этих экспериментов.
Независимо от типа используемого биоматериала, главный диfference между увеличения мочевого пузыря у крыс, мышей по сравнению с размером мочевого пузыря. Из-за меньшего размера мочевого пузыря, рассечение и внедрение биоматериалов является более технически сложными в мышь. Чтобы помочь в визуализации, хирургический микроскоп может быть использован. Поскольку размер мочевого пузыря у крыс больше, это более склонны к ситуации, когда более чем одна процедура должна быть выполнена на мочевой пузырь (например, увеличение и размещение цистостомии катетер). Кроме того, протокол выше описывает использование ПЭ-50 Трубы для крыс 13, однако, еще больше катетеров размера, вплоть до PE-100 были использованы, особенно для долгосрочных исследований 14. У мышей, меньшего калибра, таких как ПЭ-10, трубка может быть использовано 15,16, но следует иметь в виду, что меньшие, более гибкие трубы не может передавать изменения давления к датчику точно. Кроме того, альтернативный способ крепления катетера на тыльной (шаг 8 * выше) делается в мисе в связи с их меньшими размерами тела и тупой иглой и IV крышка слишком громоздким. Недостатком этого является необходимость в анестезии, чтобы извлечь конец катетера в сумке подкожной до цистометрия.
Исследования показали, что в начальный первые дни (0-4 дней) после установки катетера, цистометрия показали высокое давление мочевого пузыря и гиперактивности с низким объемом мочеиспускания. Эти данные появились по стабилизации вокруг шестой-седьмой день 14,17, и поэтому, вероятно, идеальное время для цистометрическая оценки. Тем не менее, большинство докладов в литературе выполнять цистометрия в течение первых 3 дней катетеризации 18 лет, и этим объясняется большой разброс в указанных выше параметров по отношению к времени. Оставив надлобковой катетер сроком более 3 дней несет в себе заболевания, такие как риск камней, смещение, инфекция, гематурия и окклюзии катетера с мусором.
<с классом = "jove_content"> Различные скорости инфузии в течение цистометрия были описаны из 1-3mL/hr для мышей 15,16 и 10-11mL/hr для крыс 13,19,20. Supraphysiologic скорости инфузии может привести к ложно повышенных давлениях 14. Мы используем скорость инфузии 12,5 мкл / мин (0,75 мл / ч) для мышей и 100 мкл / мин (6 мл / ч) у крыс в нашей установке, но более низкие ставки могут быть использованы. Температура физиологического раствора должна быть не менее комнатной температуре, хотя и теплый (37 °), солевые более оптимальным, чтобы избежать пузыря гиперактивности спровоцирован воспитание холодный раствор. В проснулся цистометрия, крайне важно для обеспечения стабилизации мочеиспускания схеме, что и животное становится приспособлены к клетке, которые по нашему опыту, требует в течение 10-20 минут. После этого, регулярные циклы мочеиспускания могут быть записаны на 45-120 минут или, как минимум 3-4 циклов мочеиспускания. Животные должны быть соблюдены в режиме реального времени, так как животное свободно Movinг и осложнения, такие как скручивание или перегиба в катетер может изменить цистометрическая анализа. Ограничение шума окружающей среды во время цистометрия желательно, чтобы уменьшить движение животных и последующего артефактов. Бессознательное цистометрия не имеют сопутствующие проблемы, как проснулся цистометрия, но несколько анестетики, как было показано для подавления спонтанного сокращения мочевого пузыря. Это торможение непосредственно соответствует ожидаемой продолжительности действия обезболивающих препаратов, то есть когда спадает обезболивающий эффект, спонтанные сокращения возобновить 14. Кроме того, давление измеряется, когда мочевой пузырь переполнен, были статистически выше у крыс под наркозом, так живо и посмертные, что указывает на влияние на пассивных свойств соответствия стенки мочевого пузыря. Этот эффект наблюдается с фенобарбиталом 21, кетамин, и хлоралозой IM / IP, в дополнение к ингаляционным галотана и интратекального nesacaine 14. Более обширное исследование различных анестетиков подтвержденийм этот вывод с подавлением мочеиспускания рефлекс для ингаляционного (ИФ и метоксифлуран) и барбитуратов (фенобарбитала и thiobutabarbital) анестезии при умеренных уровнях анестезии 17. Этот эффект наблюдался даже при свете или седативное уровня анестезии лекарства, такие как фентанил, дроперидол и кетамин, диазепам, как и в предыдущем исследовании, в качестве анестезии эффект на убыль, так и сделали торможение 17. Для этой процедуры, уретан внутрибрюшинного введения могут быть использованы, так как это было показано, что рефлекс мочеиспускания сохраняется то же время позволяет адекватное обезболивание 17,22. Кроме того, не наблюдается эффект в отношении мочеиспускания давление 23. Надлобковая катетера для цистометрия описано здесь, так как внутримочеиспускательные катетеризации было показано, имеют более высокие давления в мочевом пузыре и нижней кривой расхода в соответствии с относительной обструкцией мочевого пузыря 24.Кроме того, внутримочеиспускательные катетеризации возможно только под наркозом животным, и даже тогда, катетеризация может быть трудно, особенно в мужской грызунов и мышей.В заключение отметим, что выбор, какую модель использовать для увеличения мочевого пузыря и / или цистометрическая анализа зависит от целей конкретного исследования. С технической точки зрения крыс четко держит преимущество по причинам, рассмотренным выше. Тем не менее, модель мыши могут быть использованы в исследованиях по оценке роли конкретных генов в кодировке конечных продуктов при заболеваниях мочевыводящих путей, в связи с их восприимчивости генетических манипуляций. Вообще, это не возможно в крысу.
Awake цистометрия наиболее точно имитирует нормальный физиологический состояние, в котором эти животные проходят свои циклы мочеиспускания, и поэтому, вероятно, даст более надежные физиологические определения функции мочевого пузыря. Кроме того, смешанные переменной непосредственного воздействияnesthetics на функцию мочевого пузыря не происходит.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эти исследования финансировались, в частности, в Детской больнице Бостона урологии фонда Фонд Доход и Национальные институты здравоохранения грантов NIBIB P41-EB002520 (Kaplan); NIDDK T32-DK60442 (Freeman); NIDDK 1K99-DK083616 (Mauney). Мы признаем, д-р Петер Звара из университета Вермонта за помощь в создании техники для цистостомии размещение труб и цистометрия.
Материалы
| Name | Company | Catalog Number | Comments | |
| Материалы по теме: | Описание / использование: | |||
| Бритье ножницы | Подготовка крыса / мышь для хирургии | |||
| Стерильные салфетки, бетадин, 70% этанола, стерильные марлевые | Подготовка стерильного операционного поля | |||
| Инструменты: | ||||
| Лезвие скальпеля | Разрез кожи | |||
| щипцы с зубами | Управление кожи | |||
| Изобразительное щипцы | Атравматичный (без зубов), не зубцами или с мелкими зубцами, чтобы манипулировать | |||
| Малый водитель иглы | Sharp рассечение тканей | |||
| Metzenbaum ножницы | Bldder разрез | |||
| Тенотомии ножницы | Для опровержения швов и развитие подкожной тunnel (цистостомии катетер) | |||
| Малый изогнутые зажимы | Подкожный туннеля (цистостомии катетер) | |||
| Швы: | ||||
| 6-0 нити полипропиленовые | Мочевого пузыря пребывания швы и шов pursestring | |||
| 7-0 полиглактин шва | Анастомоз леса в мочевой пузырь | |||
| 4-0 шва полиглактин | Закрытие мышц / кожа | |||
| 3-0 или 4-0 шва Шелковый | Обеспечение катетера к коже | |||
| Иглы и шприцы: | ||||
| 18 иглы | Пирсинг в мочевой пузырь катетер для цистостомии | |||
| 25 и 30 игл калибровочных | Тестирование на герметичность мочевого пузыря | |||
| 1 мл солевого еilled шприц | ||||
| 22 калибра тупым кончиком иглы | ||||
| Цистостомии катетера: | ||||
| ПЭ-50, трубка | ||||
| Легче | Сжигание ПЭ-50, трубка | |||
| Малый изогнутый зажим | Разработка подкожный туннель | |||
| Цистометрия: | ||||
| MLT844 ADInstruments сбора данных и программного обеспечения LabChart | Приобретение давлением данных | |||
| Гарвардский 22 шприцевой насос (Harvard аппарата, Holliston, MA) | Жидкость инфузионного насоса | |||
| Анестетики (бессознательное цистометрия): | ||||
| Яsoflurane | Индукционная / поддержание общей анестезии | |||
| Уретан | Unconconscious цистометрия | |||
| Bupivicaine или эквивалент | Местная анестезия | |||
| Мелоксикам | Послеоперационное обезболивание | |||
| Бупренорфин | Послеоперационное обезболивание | |||
Ссылки
- Atala, A. Tissue engineering for bladder substitution. World. J. Urol. 18, 364-370 (2000).
- Roehrborn, C. G. Male lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH). Med. Clin. North Am. 95, 87-100 (2011).
- Niknejad, K. G., Atala, A. Bladder augmentation techniques in women. Int. Urogynecol. J. Pelvic Floor Dysfunct. 11, 156-169 (2000).
- Hensle, T. W., Gilbert, S. M. A review of metabolic consequences and long-term complications of enterocystoplasty in children. Curr. Urol. Rep. 8, 157-162 (2007).
- Somani, B. K. Bowel dysfunction after transposition of intestinal segments into the urinary tract: 8-year prospective cohort study. J. Urol. 177, 1793-1798 (2007).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367, 1241-1246 (2006).
- Sharma, A. K. A nonhuman primate model for urinary bladder regeneration using autologous sources of bone marrow-derived mesenchymal stem cells. Stem Cells. 29, 241-250 (2011).
- Chung, S. Y. Bladder reconstitution with bone marrow derived stem cells seeded on small intestinal submucosa improves morphological and molecular composition. J. Urol. 174, 353-359 (2005).
- Ashley, R. A. Regional variations in small intestinal submucosa evoke differences in inflammation with subsequent impact on tissue regeneration in the rat bladder augmentation model. BJU Int. 105, 1462-1468 (2010).
- Zhang, Y., Frimberger, D., Cheng, E. Y., Lin, H. K., Kropp, B. P. Challenges in a larger bladder replacement with cell-seeded and unseeded small intestinal submucosa grafts in a subtotal cystectomy model. BJU Int. 98, 1100-1105 (2006).
- Gomez, P. 3rd The effect of manipulation of silk scaffold fabrication parameters on matrix performance in a murine model of bladder augmentation. Biomaterials. 32, 7562-7570 (2011).
- Mauney, J. R. Evaluation of gel spun silk-based biomaterials in a murine model of bladder augmentation. Biomaterials. 32, 808-818 (2011).
- Persson, K. Spinal and peripheral mechanisms contributing to hyperactive voiding in spontaneously hypertensive rats. Am. J. Physiol. 275, 1366-1373 (1998).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am. J. Physiol. 251, 1177-1185 (1986).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J. Urol. 164, 1385-1389 (2000).
- Soler, R., Fullhase, C., Lu, B., Bishop, C. E., Andersson, K. E. Bladder dysfunction in a new mutant mouse model with increased superoxide--lack of nitric oxide. J. Urol. 183, 780-785 (2010).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol. Urodyn. 19, 87-99 (2000).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Soler, R., Fullhase, C., Santos, C., Andersson, K. E. Development of bladder dysfunction in a rat model of dopaminergic brain lesion. Neurourol Urodyn. 30, 188-193 (2011).
- Streng, T., Santti, R., Andersson, K. E., Talo, A. The role of the rhabdosphincter in female rat voiding. BJU Int. 94, 138-142 (2004).
- Malmgren, A. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J. Urol. 137, 1291-1294 (1987).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol. Urodyn. 29, 1344-1349 (2010).
- Cannon, T. W., Damaser, M. S. Effects of anesthesia on cystometry and leak point pressure of the female rat. Life Sci. 69, 1193-1202 (2001).
- Smith, P. P., Hurtado, E., Smith, C. P., Boone, T. B., Somogyi, G. T. Comparison of cystometric methods in female rats. Neurourol. Urodyn. 27, 324-329 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены