Method Article
Bewertung von Biomaterialien für Blasenvergrößerung mit Zystometrische Analysen in verschiedenen Tiermodellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Chirurgische Stadien der Blase Augmentation beschrieben mit 3-D-Gerüste in Maus-und Ratten-Modellen. Um die Wirksamkeit der Biomaterial-Konfigurationen für den Einsatz in Blasenaugmentation zu testen, werden Techniken für beide wach und betäubt Zystometrie vorgestellt.
Zusammenfassung
Die Nierenfunktion und Kontinenz von Urin hängen entscheidend von der richtigen Funktion der Harnblase, die den Urin speichert bei niedrigem Druck und treibt es mit einer genau orchestrierten Kontraktion. Eine Reihe von angeborenen und erworbenen urologischen Anomalien einschließlich Urethralklappen, benigner Prostatahyperplasie und sekundären neurogenen Blase an Spina bifida / Verletzungen des Rückenmarks kann in pathologischen Gewebeumbildung führt zu einer Beeinträchtigung der Compliance und reduzierter Kapazität 1 zur Folge. Funktioneller oder anatomischer Obstruktion der Harnwege wird häufig mit diesen Bedingungen verbunden und kann zu Harninkontinenz und Nierenschäden von der erhöhten Speicher-und Entleerungsdruck 2 führen. Chirurgische Implantation von Magen-Darm-Segmenten zu Orgel zu erweitern und reduzieren intravesikale Druck stellt die primäre chirurgische Behandlungsoption für diese Störungen, wenn medizinische Behandlung 3 ausfällt. Allerdings ist dieser Ansatz behindernED durch die Begrenzung der verfügbaren Spendergewebe, und ist mit erheblichen Komplikationen wie chronische Harnwegsinfektionen, metabolische Störung, Harnsteinbildung und sekundären Malignomen 4,5 assoziiert.
Aktuelle Forschung in der Blase des Tissue Engineering ist stark auf die Identifizierung Biomaterial-Konfigurationen, die Regeneration von Geweben an defekten Stellen unterstützen können konzentriert. Herkömmliche 3-D-Gerüste aus natürlichen und synthetischen Polymeren wie Dünndarmsubmukosa und Poly-Glykolsäure abgeleitet habe einige kurzfristige Erfolge bei der Unterstützung von Urothel-und glatten Muskelzellen Regeneration sowie zur Erleichterung der Orgel erhöhte Speicherkapazität sowohl im Tiermodell und in der Abbildung gezeigt Klinik 6,7. Jedoch Mängel in Schafott mechanische Integrität und Biokompatibilität oft schädlichen Fibrose 8, Transplantat Kontraktur 9, 10 und Verkalkung führen, wodurch das Risiko des Versagens des Implantats und brauchen for sekundären chirurgischen Eingriffen. Darüber hinaus hat die Wiederherstellung der normalen Entleerung Eigenschaften unter Verwendung von Standard Biomaterial-Konstrukte für die Augmentation cystoplasty noch erreicht werden, und damit der Forschung und Entwicklung von neuartigen Matrizen, die diese Aufgabe erfüllen kann, wird benötigt.
Um erfolgreich zu entwickeln und zu evaluieren optimale Biomaterialien für die klinische Blasenaugmentation, muss die Wirksamkeit der Forschung zunächst in standardisierten Tiermodellen unter Verwendung detaillierter chirurgischen Methoden und funktionelle Ergebnis Assessments durchgeführt werden. Wir haben zuvor die Verwendung eines Blasenaugmentation in Mäusen berichtet, um das Potenzial von Seidenfibroin-basierten Gerüsten Geweberegeneration und funktionellen Eigenschaften zu vermitteln Entleerung zu bestimmen. 11,12 Zystometrische Analysen dieses Modell haben gezeigt, dass Variationen in strukturellen und mechanischen Eigenschaften Implantat können die daraus resultierenden Eigenschaften der urodynamischen Gewebezüchtungen Blasen 11,12 beeinflussen. Positive Korrelationgen zwischen dem Grad der Matrix-vermittelte Regeneration der Gewebe bestimmt histologisch und funktionell Compliance und Leistungsfähigkeit von Zystometrie ausgewertet wurden in diesem Modell 11,12 demonstriert. Diese Ergebnisse legen nahe, dass deshalb funktionale Auswertungen von Biomaterial-Konfigurationen in Nagetieren Blasenaugmentation Systeme können ein nützliches Format für die Beurteilung der Eigenschaften und zur Errichtung Gerüst in vivo Machbarkeit vor dem großen Tier-Studien und klinischen Einsatz sein. In der aktuellen Studie, werden wir verschiedene chirurgische Stadien der Blase Augmentation in beiden Mäusen und Ratten mit Seide Gerüste präsentieren und zeigen Techniken zur Narkose wach und Zystometrie.
Protokoll
Chirurgische Verfahren
1. Chirurgische Vorbereitung und Anästhesie
- Stellen Sie die sterilen OP-Bereich mit den notwendigen chirurgischen Instrumente: Rasieren Scheren, Pinzetten mit Zähnen, feine atraumatische Pinzetten, feinen Nadel Fahrer, Gaze, Metzenbaum Schere, Tenotomie Schere, Skalpell, 30-Gauge-Injektionsnadel, gefüllt Kochsalzlösung 1 ml-Spritze, vier 6-0 Polypropylen Nahtmaterial, 7-0 Polyglactin Naht, 4-0 Polyglactin Naht.
- Betäuben das Tier mit Isofluran beim Einatmen in der Ansaugkammer. Bestätigen Sie vollständige Induktion des Tieres vor der Übertragung auf das OP-Feld. Sicherstellen, dass die Inhalationsnarkose Rohr in geeignete Position, um kontinuierliche Narkose haben ist.
- Platzieren Sie das Tier in Rückenlage auf dem sterilen Tuch.
[Für zystometrischen Analyse siehe Abschnitt unten im Tunnelbau die Zystostomie Katheter.] - Verwenden Sie die Rasur Schere, um das Fell aus dem Unterbauch entfernen.
- Prep mit der Bauch seinTadine und 70% Ethanol.
- Vor Einschnitt, einem Analgetikum, wie Buprenorphin (0,05-0,1 mg / kg) subkutan für perioperative Schmerzen Kontrolle injiziert werden.
2. Inzision und Freilegung der Blase
- Machen Sie eine 1-2 cm (je nach Größe des Tieres und ob Ratte oder Maus) untere Medianschnitt mit dem Skalpell durch die Haut. Vertiefen Sie den Einschnitt am unteren Teil des Schnittes durch den M. rectus kümmert sich nicht um die zugrunde liegende Darm oder Blase zu verletzen.
- Mit Hakenpinzette, heben das Rektusmuskel sezieren und kostenlos die hintere Fläche des Muskels mit feinen Metzenbaum-Schere.
- Inzision der Rest der Muskel in der Mittellinie für die gesamte Dauer Ihres Hautschnitt.
- Geben Sie sich die Blase durch die Narben-Wunde (Abbildung 1). Die Blase ist in der Regel die meisten abhängigen Organ im Becken. (Beim Mann ist die Prostata eigentlich mehr abhängig und ist größer als diedekomprimiert Blase.)
- Legen Sie eine Standnaht durch die hintere Wand der Blase, und dann noch durch die vordere Wand der Blase mit 6-0 Polypropylen Nahtmaterial. Setzen Sie zusätzliche Nähte seitlich. Binden Sie diese Nähte. Wenn die Fäden straff gehalten werden, wird die Blase haben eine quadratische Form mit Abmessungen von ungefähr 1 cm 2 (Abbildung 2). Seien Sie vorsichtig, nicht zu viel Spannung auf diesen Nähte haben, da sie leicht durch die Blase Gewebe gezogen werden.
- Inzision der Blase in Längsrichtung durch die vordere Blasenwand (unmittelbar unterhalb der Kuppel der Blase) in der Mittellinie etwa 1 cm (1,5-2 cm in der Ratte Blase).
3. Anastomose der Scaffold
- Mit einer feinen Schere, schneiden Sie die Seide Gerüst auf die ungefähren Bereich der Blase Defekt.
- Mit 7-0 Polyglactin Naht, die an einer Ecke des Gerüsts zu starten und zu nähen, um die Blase in einer kontinuierlichen, ausgeführtMode zu schaffen eine wasserdichte Abdichtung den ganzen Weg um den Defekt (Abbildung 3).
- Testen der Integrität der Anastomose durch Füllen der Blase mit steriler Kochsalzlösung durch Einträufeln durch die Wand der Blase mit einer 30-Gauge Kanüle. Wenn ein Leck gefunden wird, kann dies mit einer zusätzlichen Naht unterbrochen 7-0 Polyglactin, um die Lücke zu schließen, geschlossen werden.
- Reduzieren Sie die rekonstruierten Blase zurück in den Bauch.
4. Incisional Closure
- Vor der Schließung der Bauchwand, spritzen sie den M. rectus und des subkutanen Gewebes mit Bupivacain zur Lokalanästhesie (<3 mg / kg von 0,25%).
- Reapproximate der M. rectus mit einem kontinuierlichen, Laufen 4-0 Polyglactin Naht.
- Schließen Sie die Haut mit einem kontinuierlichen, Laufen 4-0 Polyglactin Naht.
- Reinigen und trocknen Sie den Schnitt (Abbildung 4).
- Übertragen Sie das Tier in einen warmen, sauberen Käfig für das Erwachen aus der Narkose.
Die Schritte zum Zystostomie Platzierung des Katheters für zystometrischen Analyse sind wie folgt:
5. Untertunnelung der Zystostomie Katheter
- Stellen Sie die sterilen OP-Bereich mit den notwendigen chirurgischen Instrumente: Rasieren Scheren, Pinzetten mit Zähnen, feine atraumatische Pinzetten, feinen Nadel Fahrer, Gaze, Metzenbaum Schere, Schere Tenotomie, kleine gebogene Klemme, Skalpell, 6-0 Polypropylen, 4-0 Polyglactin Nahtmaterial, 3-0 Seidenfaden (4-0 Seidenfaden für Mäuse), 18G Nadel, 22G Nadel mit stumpfer Spitze, 25G Nadel, 1 ml Kochsalzlösung gefüllte Spritze, Polyethylen-Schlauch 50 (PE-50) schwenken, um eine Länge von ~ 10 cm.
- Flare das Ende des PE-50-Schlauch durch leichtes Aussetzen einer Flamme. Achten Sie darauf, um das Ende abzuschmelzen oder zu verschließen, die das Lumen (dies kann durch Injektion von Kochsalzlösung durch eine 25G-Nadel mit dem "nicht-aufgeweiteten" Ende und die Gewährleistung Durchfluss überprüft werden). Dies dient als Anker, um das Rohr innerhalb der Blase (5) zu halten.
- Anesthetize das Tier, wie oben in Schritt 1.2.
- Verwenden Sie die Rasur Schere, um das Fell sowohl aus dem Rücken des Tieres zwischen den Schulterblättern und den unteren Bauch auf der Ventralfläche zu entfernen.
- Prep die Bereiche mit Betadin und 70% Ethanol. Platzieren Sie das Tier in Bauchlage auf dem Tuch.
- Machen Sie einen Schnitt 1 cm auf dem Rücken zwischen den Schulterblättern. Mit dem Metzenbaum-Schere, entwickeln eine Ebene zwischen der Haut und der darunter liegenden Muskeln, indem man die Spitzen der Schere in der Ebene und breitet sie einen Tunnel rund um den ventralen Bauch zu schaffen.
- Positionieren Sie das Tier in Rückenlage. Machen Sie Ihren Bauchschnitt und entlarven die Blase, wie oben in Schritten von 2,1 bis 2,4. Reduzieren Sie die Blase zurück in den Bauch.
- Geben Sie eine kleine Klammer in Ihre subkutanen Tunnel in Schritt 5,6 ab Ihrem dorsalen Hautschnitt angelegt. Benutzen Sie Ihre Finger, um die intra-abdominale Inhalte, Pierce durch die Bauchdecke mit den Spitzen der Klammer in den Bauch zu schützen.
- Fassen Sie die smooth Ende des PE-50-Schlauch mit der Klemme und ziehen es durch die Dorsalschnitt. Sicherstellen, dass die bulbed Ende nicht an der Bauchwand (6) gezogen wird.
6. Platzieren des Zystostomieröhrchen
- Geben Sie sich die Blase durch den Schnitt. Von diesem Punkt sollte die Blase mit einer feinen Pinzette behandelt werden, um Verletzungen der Blase, die Beschädigung oder Entzündung verursachen könnte, die verhindern kann zur Folge haben Ihre Ergebnisse zystometrischen bzw. mit zusätzlichen Unannehmlichkeiten für den tierischen nach der Operation.
- Notieren Sie sich die vorgeschlagene Standort für die Zystostomieröhrchen. Es sei an der Kuppel der Blase (überlegen zu der Augmentation Segment) abgegeben werden. Dadurch wird verhindert, Knicken oder Okklusion des Rohres.
- Mit dem 6-0 Polypropylen Nahtmaterial, platzieren Sie einen Tabaksbeutelnähte Stich an der Kuppel der Blase in der folgenden Weise: statt den ersten Wurf durch die Wand der Blase längs, quer zu dem vorgeschlagenen Standort für die Zystostomieröhrchen. Lassen Sie eine kleine Klammer am losen Ende, so dass die Naht nicht versehentlich herausgezogen den ganzen Weg durch. Legen Sie die nächste Wurf in einer Querrichtung, beginnend gehen zuerst in die Blasenwand leicht lateral der Ausfahrt von Ihrem ersten Wurf.
- Ziehen Sie nicht die Naht stramm. Zeigen Sie mit der nächsten Naht parallel zu Ihrem ersten (längs) gehen in die Blase, nur um der Austrittsstelle des letzten, queren Naht kranial. Der vierte Wurf beginnt lateral der Ausgang der letzten Masche und am Ende neben dem Eingang für Ihren ersten Wurf. Bei korrekter Ausführung bildet dieser eine umlaufende Quadrat um den vorgeschlagenen Standort Katheter (Abbildung 7).
- Verwendung einer 18G Nadel, die Blasenwand durchbohren in der Mitte des Tabaksbeutelnaht. Seien Sie vorsichtig, nicht zu tief zu durchdringen (gerade genug, um sein intraluminale). Legen Sie die Spitzen der feinen Pinzette in die Öffnung und sanft verteilen, um das Loch zu erweitern.
- Legen Sie die bulbed Ende des Katheters in den Defekt in derBlase, bis es intraluminalen. Ziehen Sie die Tabaksbeutelnaht fest um den Katheter und binden Sie es nach unten. Dies sollte Cinch die Blasenwand um den Katheter halten es an Ort und Stelle (Abbildung 8).
- Nehmen Sie ein Ende des Fadens und wickeln Sie es um den Katheter wieder und binden diese bis auf weiteres sichern den Katheter.
7. Testen Sie den Katheter und Schließen der Bauchwunde
- Mit einer 1 ml Spritze und Nadel 25G, führen Sie die Nadel in den Schlauch und langsam injizieren Kochsalzlösung, um die Blase zu dehnen. Beachten Sie für undichte um den Katheter. Sobald Sie aus der Harnröhre austritt sehen, absaugen Kochsalzlösung, um die Blase wieder zu entpacken.
- Schließen Sie den Bauchschnitt wie oben in Schritten von 4,1 bis 4,4.
8. Das Schließen der dorsale Inzision und Befestigen des Katheters (für Ratten)
- Positionieren Sie das Tier anfällig.
- Schneiden Sie die Katheter-Schläuche auf der Ebene der Haut mit der Schere. Setzen Sie einen stumpfen 22G tip Nadel in den Schlauch.
- Schließen die Haut über dem Schlauch mit 4-0 Polyglactin in einer Weise ausgeführt. Lassen Sie die Nadelnabe Extrudieren von der Haut.
- Platzieren Sie eine intravenöse Leitung Kappe auf dem stumpfen Nadel. Mit 3-0 Seidenfaden, sichern Sie die Katheterspitze an der Haut (Abbildung 9).
- Reinigen Sie den Einschnitt. Übertragen Sie die Ratte in einen warmen, sauberen Käfig für das Erwachen aus der Narkose.
8. * Schließen der dorsale Inzision und Befestigen des Katheters (Für Mäuse oder Ratten)
- * Verschließen die distalen Ende des Katheters durch Knicken oder es mit einer Flamme, um das Ende zu schmelzen.
- * Wickeln Sie das Ende des Schlauches und lassen Sie ihn in der subkutanen Tasche auf dem Rücken des Tieres (nicht abschneiden Schlauch um ihn zu kürzen) (Abbildung 10).
- * Schließen Sie die Haut über den Schlauch mit 4-0 Polyglactin in einem laufenden Mode (Abbildung 11).
- * Am Tag der Zystometrie, bereiten Sie die dorsale Inzision mit Betadine und 70% Ethanol. Öffnen Sie die dorsale Inzision unter Narkose und entfernen Sie die Coiled Tubing aus dem subkutanen Beutel. Schließen Sie den Einschnitt. Wecken Sie das Tier aus der Narkose und führen Zystometrie, wenn es ganz wach ist.
9. Repräsentative Ergebnisse - Chirurgische Verfahren
Das rekonstruierte Blase sollte so wasserdicht wie möglich zu Komplikationen im Zusammenhang mit einer signifikanten Urin Leck (3) zu vermeiden. Schmerzen oder Beschwerden in der Regel manifestieren sich als Zittern oder Kratzen und Nagen an der Bauchschnitt. Dies kann mit tägliche subkutane Injektionen von einem nicht-steroidalen entzündungshemmenden wie Meloxicam (0,5-1,0 mg / kg subkutan) verwaltet werden. Typischerweise werden die Tiere nur mit den Injektionen für die ersten 3 Tage nach der Operation. Dies kann mit einem Opioid, wie Buprenorphin (0,05-0,1 mg / kg subkutane alle 8-12 Stunden), wie Bedarf ergänzt werden. Die Tiere sollten 3-mal täglich überwacht werden für die ersten 3 Tage nach der Operation, TWEis täglich zur postoperativen Tagen 3-5 und dann danach täglich bis zum Schmerz, Anzeichen einer Infektion, adäquate Wundheilung, Aktivität, Pflegen und Hautturgor bewerten. Antibiotika (Baytril, 5mg/kg subkutan alle 24 Stunden in einem Volumen von nicht mehr als 0,1 ml) werden für die ersten 72 Stunden nach der Operation gegeben, wie chirurgische Prophylaxe gegen Infektionen. Zeichen der Erholung sind normal normale Gehfähigkeit und Aktivität, geeignete Fress-und Trinkverhalten, das Fehlen von Schmerzen oder Leiden (keine Vokalisation) und normale Sozialisation mit cagemates. Eine Erholungszeit von mindestens 5-7 Tage sollten vor zystometrischen Analyse gegeben werden, um Heilung zu ermöglichen und Blase verringert Entzündung, die möglichen Auswirkungen auf die Ergebnisse.
Zystometrische Analysen
10. Awake Zystometrische Analyse
- Setup mit MLT844 ADInstruments mit Datenerfassung und-auswertung mit LabChart v6 (ADInstruments) und Infusion mit einer 22 Harvard Spritzenpumpe (Harvard Appara beschriebentus, Holliston, MA), obwohl auch andere vergleichbare Systeme verfügbar sind (Abbildung 12).
- Kalibrieren sowohl Volumen und Druck auf der Grundlage der Spezifikationen des zystometrischen verwendet.
- Legen Sie die Tiere in metabolischen Käfigen (Käfige mit einem Drahtgeflecht Stock), die sich über einer Skala suspendiert sind. Die Waage ist mit einem Wandler verbunden.
- Spülen Sie das System von Luftblasen und sorgen für kontinuierlichen Fluss von der Infusionspumpe.
- Verbinden Sie den Daten-Capture-System an einen Computer und beobachten, für die Daten-Aufzeichnungen. Passen Sie die Skalierung entsprechend. Blasendruck und Urinvolumen wird kontinuierlich aufgezeichnet werden.
- Zugriff auf die suprapubische Katheter mit einer 27G-Nadel über ein T-Rohr mit dem Druckwandler und der Infusionspumpe. Beginnen Sie die Infusion von physiologischer Kochsalzlösung bei 12,5 ul / min für die Maus und 100 &mgr; l / min für die Ratte.
- Lassen Sie das Muster für ungültig erklären Tracing zu stabilisieren (Blase Druckanstieg, gefolgt von einer Leere). Dies dauert in der Regel Angleirund 10-20 Minuten. Notieren Sie die Miktionszyklen für 45-120 Minuten oder mindestens 3-4 Zyklen Blasenentleerung.
- Beachten gesamte Verfahren in Echtzeit, um Komplikationen, die zu Artefakten (zB Katheter Knicken, Verstopfung, usw.; siehe unten diskutiert) führen wird, zu beheben.
- Stoppen Sie die Infusion, ziehen Sie den Katheter aus dem System, und senden Sie das Tier in seinen Käfig.
11. Unbewusste Zystometrische Analysis (Kein suprapubischen Katheter)
- Anesthetize das Tier mit Urethan (1-2 g / kg) intraperitoneal (ip) Injektion.
- Setzen Sie die Blase, wie oben in Schritten von 1,3 bis 2,4.
- Kalibrieren des Systems, wie in Schritt 9.2. Bereiten Sie das System wie in Schritt 9,4 bis 9,5.
- Legen Sie eine 27G-Nadel über ein T-Rohr mit dem Druckaufnehmer und Infusionspumpe in der lateralen Seite der Blase verbunden.
- Notieren Sie die Miktionszyklen für 45-90 Minuten.
- Stoppen Sie die Infusion, entfernen Sie die Nadel aus der Blase und das Tier einschläfern.
12. Repräsentative Ergebnisse - Zystometrische Analysen
Urodynamische Kurven können dann analysiert, um daraus Parameter wie nichtig Bände, Compliance, Peak Entleerungsdruck unter Kontraktion Intervall, Miktion Zykluszeit und Post nichtig Restvolumen werden.
Cystometrogram kann in einer Füllung und einer Entleerung Phase unterteilt werden. Ein normaler Befüllung Phase ist der Teil des Miktionszyklus in dem Blase füllt mit sehr geringer Änderung des intravesikalen Druck. Eine normale Entleerung Phase der Verfolgung besteht aus einem stetigen Anstieg der intravesikale Druck entsprechend dem Detrusorkontraktion. Der höchste Druck während der Phase der Entleerung Tracing erreicht den Gipfel Entleerung Druck bezeichnet. Ein hoher Spitzenleistung Entleerung Druck könnte vermuten lassen, eine obstruktive Miktion Muster, ein hypercontractile Blase oder ein Knick in der SP-Katheter. Die Einhaltung kann durch den Erwerb des Verhältnis des Volumens instillierte Duri berechnet werdenng der Füllphase und die Veränderung des Drucks (Compliance = AV / AP). Ein hypocompliant Blase ist eine, die nicht in der Lage, angemessene Mengen Urin bei niedrigen Drücken unterzubringen ist. Die intercontraction Intervall kann durch Analysieren der Zeit zwischen zwei Kontraktionen auf der cystometrogram gesehen berechnet werden. Ein kurzes Intervall intercontraction deutet auf eine Reizblase. Die Miktion Zykluszeit bezieht sich auf die Zeit, die für eine gesamte Befüllung und Entleerung Phase zu vollenden und kann leicht ermittelt durch die Analyse der Ablaufverfolgung. Am Ende des Zystometrie, kann nach Blasenentleerung Rest (PVR) erhalten werden. Dies wird durch Ansaugen des Suprapubische nach dem Abschluss einer Detrusorkontraktion durchgeführt. Diese Parameter helfen der Prüfer objektiv untersuchen die Blase Dynamik als die Blase füllt und leert.
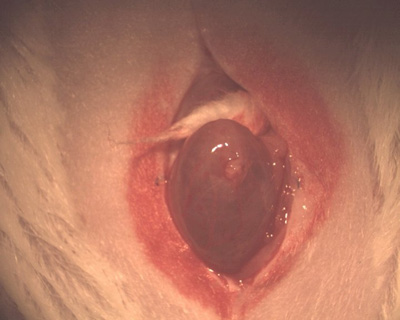
Abbildung 1. Foto des Bauchschnittund Extrusion der Blase.

Abbildung 2. Blasen-Schnitt mit der Exposition der Blase Lumen.
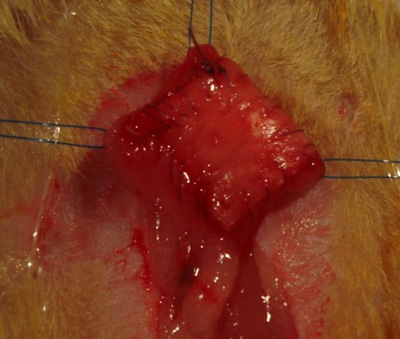
Abbildung 3. Integration des Implantats in die Blasenwand.
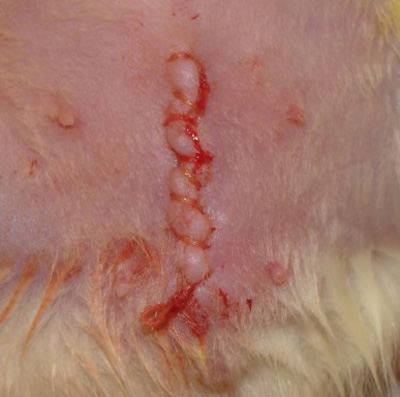
Abbildung 4. Foto des geschlossenen Schnitt.

Bild 5. Aufgeweitete Ende des PE-50-Schlauch.

6. PE-50-Schlauch (Katheter) durch die Dorsalschnitt.
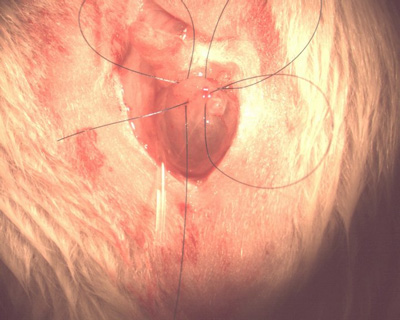
Abbildung 7.Tabaksbeutelnaht.
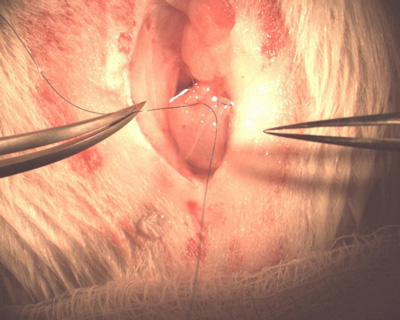
8. Befestigen des Katheters in die Blase.
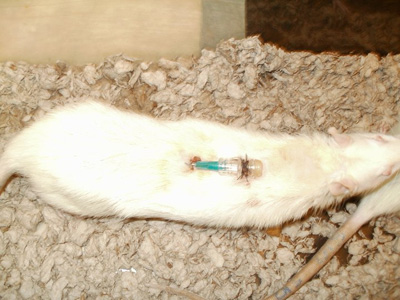
Abbildung 9. Secured Katheteransatz.
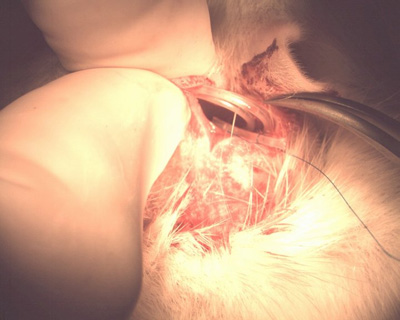
Abbildung 10. Coiled-Schlauch in subkutane Tasche.

Abbildung 11. Dorsal incisional Schließung.

Abbildung 12. Beispiel zystometrischen Set-up.

Abbildung 13. Vertreter Zystometrie Tracing.
Diskussion
Zystometrische Auswertungen von Biomaterial-Konfigurationen nach der Implantation und Augmentation Blase in kleinen Tiermodellen stellt einen wichtigen Schritt bei der Identifizierung Validierung optimalen strukturellen und mechanischen Eigenschaften der Matrix-Designs für den Einsatz in klinischen Situationen. In dieser Studie beschreiben wir chirurgische Verfahren für die Durchführung Blasenaugmentation bei Mäusen und Ratten sowie zystometrischen Techniken zur urodynamischen Eigenschaften von technischen Organe für funktionelle Beurteilungen zu bestimmen. Wir haben diese Techniken in mehreren Experimenten mit Mäusen und auch Ratten verwendet, wobei jedes Experiment, bestehend aus 30 + Nagetiere ohne nennenswerte Probleme. Unsere Forschungs-Labor ist ein Konglomerat von verschiedenen Grundlagenforscher und Ärzte Chirurgen und Chirurgen mit mindestens 5-6 Jahren von Post-Graduate-chirurgische Ausbildung erfolgen die verfahrensrechtlichen Aspekte dieser Experimente.
Unabhängig von der Art der Biomaterial, das wichtigste difference zwischen Vermehrung der Blase bei Ratten im Vergleich zu Mäusen ist die Größe der Blase. Aufgrund der kleineren Größe Blase, eine Präparation und Eingliederung des Biomaterials mehr technisch schwierig in der Maus. Um die Visualisierung zu unterstützen, kann ein chirurgisches Mikroskop verwendet werden. Da die Größe der Blase bei Ratten größer ist, ist es daher einfacher, wenn mehr als eine Prozedur muss auf die Blase (zB Verstärkung und die Platzierung der Zystostomie Katheter) durchgeführt werden. Zusätzlich kann die Protokoll oberhalb beschreibt die Verwendung von PE-50-Schlauch für die Ratten-13, jedoch auch größere Katheter, bis PE-100 wurden verwendet, insbesondere für Langzeitstudien 14. Bei Mäusen, kann ein kleineres Kaliber wie PE-10-Schlauch 15,16 verwendet werden, aber es sollte beachtet werden, dass kleinere, biegsamer Röhrchen es nicht gestattet, Druckänderungen an den Wandler genau. Auch die alternative Methode zur Sicherung des Katheters auf dem Rücken (Schritt 8 * oben) wird in mi getanCE aufgrund ihrer geringeren Körpergröße und der stumpfen Spitze Nadel und Kappe IV sind zu schwerfällig. Der Nachteil dieser Methode ist die Notwendigkeit für die Anästhesie, um das Ende des Katheters in dem subkutanen Beutel vor Zystometrie extrahieren.
Studien haben gezeigt, dass in den ersten ersten Tagen (0-4 Tage) nach der Platzierung der Katheter, Blase Zystometrie hohe Drücke und Überaktivität zeigte mit niedrigen Volumina Blasenentleerung. Diese Befunde erschien in der sechsten bis siebten Tag 14,17 stabilisieren und daher wahrscheinlich die optimalen Zeitpunkt zystometrischen Evaluierung. Allerdings führen die meisten Berichte in der Literatur Zystometrie innerhalb der ersten 3 Tagen nach der Katheterisierung 18, und das erklärt die großen Unterschiede in den oben genannten Parametern in Bezug auf Zeit. Verlassen des suprapubischen Katheter für eine Dauer länger als 3 Tage mit sich bringt wie das Risiko von Steinen, Umsiedlungen, Infektion, Hämaturie und Okklusion des Katheters mit Schutt Begleiterkrankungen.
Verschiedene Infusionsraten während Zystometrie haben aus 1-3mL/hr wurde für Mäuse und 15,16 10-11mL/hr für Ratten 13,19,20 beschrieben. Supraphysiologischen Infusionsraten kann zu falsch erhöhten Drucks 14. Wir verwenden eine Infusionsgeschwindigkeit von 12,5 ul / min (0,75 ml / h) für Mäuse und 100 &mgr; l / min (6 ml / h) für Ratten in unserem Setup, aber niedrigere Sätze können ebenfalls verwendet werden. Die Temperatur der physiologischen Kochsalzlösung mindestens Raumtemperatur, obwohl warm (37 °) Kochsalzlösung ist optimal, um Blasenüberaktivität mit Einträufeln kalte Lösung hervorgerufen vermeiden. In Zystometrie wach, ist es entscheidend, für die Stabilisierung der für ungültig erklären lassen Muster wie das Tier wird angepasst, um den Käfig, die nach unserer Erfahrung erfordert einen Zeitraum von ~ 10-20 Minuten. Im Anschluss daran können regelmäßig Miktionszyklen für 45-120 Minuten oder bei mindestens 3-4 Entleerung Zyklen aufgezeichnet werden. Das Tier muss in Echtzeit überwacht werden, da das Tier frei moving und Komplikationen wie Verdrehen oder Knicken des Katheters kann verändern zystometrischen Analyse. Die Begrenzung Umgebungslärm während Zystometrie gewünscht wird, Tier-Bewegung und die anschließende Artefakte zu verringern. Unbewusste Zystometrie nicht über die damit verbundenen Probleme wie wach Zystometrie, sondern mehrere Anästhetika haben gezeigt, dass spontane Kontraktionen der Blase zu verhindern. Diese Hemmung entspricht direkt der voraussichtlichen Dauer der Wirkung der Anästhetika, dh wenn die betäubende Wirkung nachlässt, spontane Kontraktionen 14 wieder aufzunehmen. Darüber hinaus waren Drücke gemessen, wenn die Blase übergelaufen, statistisch größer an narkotisierten Ratten, die beide am Leben und post mortem, was auf einen Effekt auf die passiven Eigenschaften Einhaltung der Blasenwand. Dieser Effekt wird mit Pentobarbital 21, Ketamin gesehen, und Chloralose IM / IP, zusätzlich zu inhalativen Halothan und intrathekale nesacaine 14. Eine weitergehende Untersuchung verschiedener Anästhetika Bestätigungm dieser Befund mit Unterdrückung des Miktionsreflexes sowohl für inhalative (Isofluran und Methoxyfluran) und Barbiturat (Pentobarbital und thiobutabarbital) Anästhetika unter moderatem Niveau Anästhesie 17. Dieser Effekt wurde auch mit Licht-oder Beruhigungsmittel Ebenen der Narkose mit Medikamenten wie Fentanyl-Droperidol und Ketamin-Diazepam beobachtet, und wie in der vorherigen Studie, als die Narkose nachließ Wirkung, so auch die Hemmung 17. Für dieses Verfahren können Urethan intraperitoneale Injektionen verwendet werden, da nachgewiesen wurde, dass Reflex Miktion erhalten bleibt während gleichzeitig eine adäquate Anästhesie 17,22 werden. Außerdem wird kein Effekt hinsichtlich der Miktion Druck 23 beobachtet. Suprapubische Platzierung des Katheters für Zystometrie wird hier beschrieben, da Intraurethral Katheterisierung gezeigt wurde, dass höhere Blasendruck Kurven und niedrigeren Strömungsgeschwindigkeiten im Einklang mit relativ Blasenauslassobstruktion 24 aufweisen.Darüber hinaus ist intraurethrale Katheterisierung nur möglich in narkotisierten Tieren, und selbst dann, Katheterisierung kann schwierig sein, vor allem bei männlichen Nagetieren und Mäuse.
Im Ergebnis ist die Wahl, für welches Modell für Blasenaugmentation und / oder zystometrischen Analyse verwenden abhängig von den Zielen des spezifischen Studie. Aus technischer Sicht das Rattenmodell klar hält den Vorteil, für den oben erörterten Gründen. Jedoch kann die Maus wurde in Studien, die die Funktion bestimmter Gen kodierten Endprodukte bei Erkrankungen der Harnwege, die aufgrund ihrer Empfindlichkeit für die genetische Manipulation verwendet werden. Dies ist im Allgemeinen nicht möglich bei der Ratte.
Awake Zystometrie am genauesten imitiert die normalen physiologischen Zustand, in dem diese Tiere zu unterziehen ihre Miktionszyklen, und so dürfte sich eine zuverlässigere physiologische Bestimmung der Funktion der Blase geben. Darüber hinaus ist die verwirrende Variable der direkte Wirkung einernesthetics auf die Blasenfunktion wird vermieden.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Studien wurden finanziert, zum Teil von der Kinderklinik Boston Urologie Endowment Fund Umsatz und den National Institutes of Health Zuschüsse NIBIB P41-EB002520 (Kaplan); NIDDK T32-DK60442 (Freeman); NIDDK 1K99-DK083616 (Mauney). Wir danken Dr. Peter Zvara von der University of Vermont um Unterstützung bei der Gründung der Technik für Zystostomieröhrchen Platzierung und Zystometrie.
Materialien
| Name | Company | Catalog Number | Comments | |
| Materialien: | Beschreibung / Verwendung: | |||
| Rasieren Scheren | Herstellung von Ratte / Maus für die Chirurgie | |||
| Sterilen Tüchern, Betadin, 70% Ethanol, steriler Gaze | Herstellung von sterilen OP-Feld | |||
| Instrumente: | ||||
| Skalpellklinge | Hautschnitt | |||
| Pinzetten mit Zähnen | Bearbeiten von Haut | |||
| Feinen Pinzette | Atraumatische (keine Zähne), keine Zacken oder mit feinen Zacken zu manipulieren | |||
| Kleine Nadeltrieb | Sharp Gewebedissektion | |||
| Metzenbaum-Schere | Bldder Einschnitt | |||
| Tenotomie Schere | Für Retraktion Nahtmaterial und zur subkutanen t entwickelnunnel (Zystostomie Katheter) | |||
| Kleine gebogene Klemmen | Subkutanen Tunnel (Zystostomie Katheter) | |||
| Nahtmaterial: | ||||
| 6-0 Polypropylen Nahtmaterial | Blase Haltefäden und Tabaksbeutelnaht | |||
| 7-0 Polyglactin Naht | Anastomose von Gerüst zu Blase | |||
| 4-0 Polyglactin Naht | Schließung von Muskel / Haut | |||
| 3-0 oder 4-0 Seidenfaden | Die Sicherung der Katheterspitze die Haut | |||
| Nadeln und Spritzen: | ||||
| Nadel mit 18 Gauge | Durchstechen der Blase für Zystostomie Katheter | |||
| 25 und 30 Gauge-Nadeln | Prüfung auf Dichtheit Blase | |||
| 1 ml Kochsalzlösung filled Spritze | ||||
| 22 Gauge Nadel mit stumpfer Spitze | ||||
| Zystostomie Katheter: | ||||
| PE-50-Schlauch | ||||
| Feuerzeug | Abfackeln PE-50-Schlauch | |||
| Kleine gebogenen Klemme | Entwickeln von subkutanen Tunnel | |||
| Zystometrie: | ||||
| MLT844 ADInstruments Datenerfassung und Software LabChart | Druck-Datenerfassung | |||
| Harvard 22 Spritzenpumpe (Harvard Apparatus, Holliston, MA) | Fluid Infusionspumpe | |||
| Anästhetika (Unbewusste Zystometrie): | ||||
| Ichsoflurane | Induktion / Aufrechterhaltung einer Vollnarkose | |||
| Urethan | Unconconscious Zystometrie | |||
| Bupivacain oder gleichwertige | Örtliche Betäubung | |||
| Meloxicam | Postoperativen Analgesie | |||
| Buprenorphin | Postoperativen Analgesie | |||
Referenzen
- Atala, A. Tissue engineering for bladder substitution. World. J. Urol. 18, 364-370 (2000).
- Roehrborn, C. G. Male lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH). Med. Clin. North Am. 95, 87-100 (2011).
- Niknejad, K. G., Atala, A. Bladder augmentation techniques in women. Int. Urogynecol. J. Pelvic Floor Dysfunct. 11, 156-169 (2000).
- Hensle, T. W., Gilbert, S. M. A review of metabolic consequences and long-term complications of enterocystoplasty in children. Curr. Urol. Rep. 8, 157-162 (2007).
- Somani, B. K. Bowel dysfunction after transposition of intestinal segments into the urinary tract: 8-year prospective cohort study. J. Urol. 177, 1793-1798 (2007).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367, 1241-1246 (2006).
- Sharma, A. K. A nonhuman primate model for urinary bladder regeneration using autologous sources of bone marrow-derived mesenchymal stem cells. Stem Cells. 29, 241-250 (2011).
- Chung, S. Y. Bladder reconstitution with bone marrow derived stem cells seeded on small intestinal submucosa improves morphological and molecular composition. J. Urol. 174, 353-359 (2005).
- Ashley, R. A. Regional variations in small intestinal submucosa evoke differences in inflammation with subsequent impact on tissue regeneration in the rat bladder augmentation model. BJU Int. 105, 1462-1468 (2010).
- Zhang, Y., Frimberger, D., Cheng, E. Y., Lin, H. K., Kropp, B. P. Challenges in a larger bladder replacement with cell-seeded and unseeded small intestinal submucosa grafts in a subtotal cystectomy model. BJU Int. 98, 1100-1105 (2006).
- Gomez, P. 3rd The effect of manipulation of silk scaffold fabrication parameters on matrix performance in a murine model of bladder augmentation. Biomaterials. 32, 7562-7570 (2011).
- Mauney, J. R. Evaluation of gel spun silk-based biomaterials in a murine model of bladder augmentation. Biomaterials. 32, 808-818 (2011).
- Persson, K. Spinal and peripheral mechanisms contributing to hyperactive voiding in spontaneously hypertensive rats. Am. J. Physiol. 275, 1366-1373 (1998).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am. J. Physiol. 251, 1177-1185 (1986).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J. Urol. 164, 1385-1389 (2000).
- Soler, R., Fullhase, C., Lu, B., Bishop, C. E., Andersson, K. E. Bladder dysfunction in a new mutant mouse model with increased superoxide--lack of nitric oxide. J. Urol. 183, 780-785 (2010).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol. Urodyn. 19, 87-99 (2000).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Soler, R., Fullhase, C., Santos, C., Andersson, K. E. Development of bladder dysfunction in a rat model of dopaminergic brain lesion. Neurourol Urodyn. 30, 188-193 (2011).
- Streng, T., Santti, R., Andersson, K. E., Talo, A. The role of the rhabdosphincter in female rat voiding. BJU Int. 94, 138-142 (2004).
- Malmgren, A. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J. Urol. 137, 1291-1294 (1987).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol. Urodyn. 29, 1344-1349 (2010).
- Cannon, T. W., Damaser, M. S. Effects of anesthesia on cystometry and leak point pressure of the female rat. Life Sci. 69, 1193-1202 (2001).
- Smith, P. P., Hurtado, E., Smith, C. P., Boone, T. B., Somogyi, G. T. Comparison of cystometric methods in female rats. Neurourol. Urodyn. 27, 324-329 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten