Method Article
Avaliação de Biomateriais para ampliação vesical utilizando análises cistométricos Em modelos de roedores Vários
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Estádios cirúrgicos de aumento da bexiga são descritos utilizando 3-D andaimes em modelos murinos e de rato. Para testar a eficácia de configurações de biomateriais para utilização no aumento da bexiga, as técnicas para cistometria tanto acordado e anestesiados são apresentados.
Resumo
A função renal e continência de urina são extremamente dependente do bom funcionamento da bexiga, que armazena a urina à baixa pressão e expulsa-lo com uma precisão orquestrada contração. Um certo número de anomalias congênitas e adquiridas urológicas, incluindo válvula de uretra posterior, hiperplasia benigna da próstata e bexiga neurogênica secundárias a espinha bífida / lesão da medula espinhal pode resultar em remodelação do tecido patológico levando ao cumprimento deficiente e reduzida capacidade 1. Obstrução funcional ou anatômica do trato urinário é freqüentemente associada a estas condições, e pode levar à incontinência urinária e danos nos rins de armazenamento aumentou e pressões de esvaziamento 2. O implante cirúrgico de segmentos gastrointestinais para expandir a capacidade de órgãos e reduzir as pressões intravesicais representa a opção de tratamento cirúrgico primário para esses transtornos, quando o tratamento médico falha 3. No entanto, esta abordagem é dificultared pela limitação do tecido doador disponível, e está associada a complicações significativas, incluindo a infecção crônica do trato urinário, perturbação metabólica, formação de cálculos urinários, e malignidade secundária 4,5.
A pesquisa atual na engenharia de tecidos da bexiga é fortemente focada em identificar configurações de biomateriais que pode apoiar a regeneração de tecidos em locais de defeitos. Convencional 3-D scaffolds derivado a partir de polímeros naturais e sintéticos, tais como submucosa do intestino delgado e glicólico-ácido poli têm mostrado algum sucesso a curto prazo no apoio regeneração muscular urotelial e suave, bem como para facilitar a capacidade de armazenamento aumentada de órgãos em modelos animais e no clínica 6,7. No entanto, as deficiências em andaime integridade mecânica e biocompatibilidade muitas vezes resultar na fibrose deletério 8, 9 contratura enxerto, e calcificação 10, aumentando assim o risco de falha do implante e precisam de for secundárias procedimentos cirúrgicos. Além disso, a restauração das características urinários normais, utilizando construções padrão de biomateriais para cistoplastia aumento ainda tem de ser alcançado, e, portanto, a investigação e desenvolvimento de matrizes novos que podem cumprir esta função é necessário.
A fim de desenvolver com sucesso e avaliar biomateriais óptimas para o aumento da bexiga clínica, a investigação eficácia deve primeiro ser realizada em modelos animais padronizados usando detalhados métodos cirúrgicos e avaliações resultado funcional. Nós previamente relatada a utilização de um modelo de aumento da bexiga em ratos para determinar o potencial de seda fibroína baseados andaimes para mediar a regeneração do tecido e as características de esvaziamento funcionais. 11,12 análises cistométricos deste modelo têm mostrado que variações nas propriedades estruturais e mecânicas de implantes pode influenciar as características resultantes urodinâmicos das bexigas da engenharia de tecidos 11,12. Correlação positivações entre o grau de matriz mediada regeneração do tecido determinada histologicamente e conformidade funcional e capacidade avaliada por cistometria foram demonstrado neste modelo 11,12. Estes resultados sugerem, portanto, que as avaliações funcionais de configurações de biomateriais em sistemas de roedores ampliação vesical pode ser um formato útil para avaliar as propriedades de andaime e que estabelece, em viabilidade vivo antes de estudos com animais de grande porte e implantação de clínica. No presente estudo, vamos apresentar várias etapas cirúrgicas de ampliação vesical em ambos os ratos e camundongos utilizando andaimes de seda e demonstrar técnicas para cistometria acordados e anestesiados.
Protocolo
Os métodos cirúrgicos
1. Preparação Cirúrgica e Anestesia
- Configure o campo cirúrgico estéril com os instrumentos necessários cirúrgicos: tesouras de barbear, pinças com dentes, finas pinças atraumáticas, motorista agulha fina, gaze, tesoura, tesoura Metzenbaum tenotomia, lâmina de bisturi, agulha hipodérmica calibre 30, encheu salina seringa de 1 mL, quatro 6-0 de polipropileno, poliglactina 7-0 sutura, sutura poliglactina 4-0.
- Anestesiar o animal com a inalação de isoflurano na câmara de indução. Confirme indução completa do animal antes de transferir para o campo cirúrgico. Assegure-se que o tubo de anestesia por inalação está na posição apropriada para ter anestesia contínua.
- Coloque o animal em decúbito dorsal a cortina estéril.
[Para a análise cistométrica, consulte a seção abaixo na tunelização do cateter de cistostomia.] - Use a tesoura de corte para remover a pele da parte inferior do abdômen.
- Preparação do abdômen com atadine e etanol a 70%.
- Antes da incisão, um analgésico tal como buprenorfina (0,05-0,1 mg / kg) pode ser injectado por via subcutânea para controlo da dor perioperatória.
2. Incisão e exposição da Bexiga
- Fazer um centímetro 1-2 (dependente do tamanho do animal e se rato ou ratinho) incisão na linha média inferior com o bisturi através da pele. Aprofundar a incisão na porção inferior da incisão através do músculo rectus tomando cuidado para não ferir o intestino subjacente ou da bexiga.
- Utilizando uma pinça dentada, elevar o músculo reto e dissecar a superfície livre posterior do músculo com uma tesoura Metzenbaum finas.
- Incisão no restante do músculo na linha média para o comprimento de toda a sua incisão da pele.
- Entregar a bexiga através da ferida incisional (Figura 1). A bexiga é geralmente o órgão mais dependente na pelve. (No homem, a próstata é realmente mais dependente e é maior do que obexiga descomprimido.)
- O local de estadia sutura uma através da parede posterior da bexiga, e em seguida uma outra através da parede anterior da bexiga usando 6-0 fio de polipropileno. Coloque pontos adicionais lateralmente. Não amarrar essas suturas. Quando as suturas são mantida esticada, a bexiga terá uma configuração quadrada medindo aproximadamente 1 cm 2 (Figura 2). Tenha cuidado para não ter muita tensão sobre estas suturas como eles podem facilmente ser puxado através do tecido da bexiga.
- Incisão da bexiga longitudinalmente através da parede anterior da bexiga (apenas inferior à cúpula da bexiga) na linha média para cerca de 1 cm (1,5-2 cm na bexiga de rato).
3. Anastomose do andaime
- Com uma tesoura fina, cortar o andaime de seda para a área aproximada da lesão da bexiga.
- Usando sutura de poliglactina 7-0, começar em um canto do andaime e sutura da bexiga em um processo contínuo, executandomoda para criar uma vedação estanque a toda a volta do defeito (Figura 3).
- Testar a integridade da anastomose por enchimento da bexiga com uma solução salina estéril por incutir-lo através da parede da bexiga com uma agulha hipodérmica de calibre 30. Se um vazamento for encontrado, este pode ser fechado com uma sutura de poliglactina adicional interrompido 7-0 para fechar a lacuna.
- Reduzir a volta da bexiga reconstruída no abdômen.
4. Encerramento Incisional
- Antes do encerramento da parede abdominal, injectar o músculo rectus e tecido subcutâneo com bupivicaine para anestesia local (<3 mg / kg de 0,25%).
- O músculo reto Reapproximate com uma sutura contínua de poliglactina, correndo por 4-0.
- Feche a pele com uma sutura contínua de poliglactina, correndo por 4-0.
- Limpar e secar a incisão (Figura 4).
- Transfira o animal em uma gaiola, morna limpa para o despertar da anestesia.
Os passos para a colocação do cateter cistostomia para análise cistométrica são como se segue:
5. Tunelização do cateter de cistostomia
- Configure o campo cirúrgico estéril com os instrumentos necessários cirúrgicos: tesouras de barbear, pinças com dentes, finas pinças atraumáticas, motorista agulha fina, gaze, tesoura Metzenbaum, tesoura tenotomia, pinça curva pequena, lâmina de bisturi, de polipropileno 6-0, 4-0 poliglactina sutura, 3-0 sutura de seda (sutura de seda 4-0 para ratos), agulha 18G, 22G a ponta da agulha romba, agulha 25G, 1 mL de seringa preenchida salina, tubagem de polietileno 50 (PE-50) cortada para um comprimento de 10 ~ cm.
- Incendiar o final do tubo de PE-50 por suavemente expondo-o a uma chama. Tenha cuidado para não derreter o final desligado ou ocluir a luz (isto pode ser verificado pela injeção de solução salina através de uma agulha 25G conectado ao "não-queimado" final e garantindo o fluxo). Isto serve como uma âncora para manter o tubo dentro da bexiga (Figura 5).
- Anestesie o animal, tal como acima no passo 1.2.
- Use as tesouras de corte para remover o pêlo, tanto do dorso do animal entre a escápula e parte inferior do abdómen na ventrum.
- Prep as áreas com betadine e etanol a 70%. Coloque o animal deitado no pano.
- Faça uma incisão de 1 cm no dorso entre a escápula. Usando o tesoura Metzenbaum, desenvolver um plano entre a pele eo músculo subjacente, colocando as pontas dos tesoura no plano e espalhando-los para criar um túnel em torno do abdómen ventral.
- Reposicionar o supino animal. Fazer a sua incisão abdominal e expor a bexiga como acima nos passos 2,1-2,4. Reduzir a bexiga volta para o abdômen.
- Coloque um grampo pequeno em seu túnel subcutâneo criado em 5,6 passo a partir de sua incisão na pele dorsal. Usando os dedos para proteger o conteúdo intra-abdominais, perfuram através da parede abdominal com as pontas da pinça no abdômen.
- Segure a sMooth final do tubo de PE-50 com a braçadeira e puxá-lo de volta através da incisão dorsal. Assegurar que a extremidade bulbed não é puxado após a parede abdominal (Figura 6).
6. Colocar o tubo Cistostomia
- Entregar a bexiga através da incisão. Deste ponto em diante, a bexiga deve ser tratado com pinças finas para evitar trauma à bexiga que poderia causar lesão ou inflamação que pode distorcer os resultados cistometria ou resultar em desconforto adicional para o animal no pós-operatório.
- Anote o local proposto para o tubo de cistostomia. Ele deve ser colocado na cúpula da bexiga (superior ao segmento augment). Isto irá evitar acotovelamento ou oclusão do tubo.
- Usando o fio de polipropileno 6-0, colocar um ponto em bolsa na cúpula da bexiga, da seguinte maneira: lugar a reposição primeiro através da parede da bexiga longitudinalmente, lateral para o local proposto para o tubo de cistostomia. Deixar um grampo pequeno na extremidade solta de modo que a sutura não seja inadvertidamente puxado todo o caminho através. Coloque o próximo lançamento numa direcção transversal, começando primeiro entrar na parede da bexiga ligeiramente lateral para a saída do seu primeiro lance.
- Não puxe o fio esticado. Coloque o seu paralelo sutura ao lado de seu primeiro (longitudinalmente) vai para a bexiga apenas cranialmente ao local de saída de sua sutura, última transversal. A reposição quarto começará lateral à saída do último ponto final e ao lado da entrada para a sua reposição muito primeiro. Feito correctamente, isto forma um quadrado circunferencial em torno do local do cateter proposto (Figura 7).
- Utilizando uma agulha de 18G, perfurar a parede da bexiga, no centro da sutura em bolsa. Tenha cuidado para não furar muito profundamente (apenas o suficiente para ser intraluminal). Coloque as pontas de seus pinça fina na abertura e espalhar suavemente para alargar o buraco.
- Introduza a extremidade bulbed do cateter dentro do defeito nobexiga até que seja intraluminal. Puxe a sutura em bolsa apertada ao redor do cateter e amarrá-lo para baixo. Isto deve cinch da parede da bexiga em torno do cateter, mantendo-o no lugar (Figura 8).
- Pegue uma das extremidades da sutura e envolvê-la em torno do cateter e uma vez amarrar esse baixo para proteger ainda mais o cateter.
7. Testando o cateter e fechar a incisão abdominal
- Com uma agulha de seringa de 1 mL e 25G, inserir a agulha no tubo e, lentamente, injectar solução salina para distender a bexiga. Observe se há vazamento ao redor do cateter. Depois de ver vazando pela uretra, aspirar o soro fisiológico para descomprimir a bexiga novamente.
- Feche o incisão abdominal como acima nos passos 4.1-4.4.
8. Fechamento da incisão dorsal e protegendo o cateter (para ratos)
- Reposicionar o animal propenso.
- Cortar o tubo do cateter ao nível da pele com a tesoura. Insira um 22G contundente tip agulha no tubo.
- Feche a pele sobre o tubo com poliglactina 4-0 de uma forma em execução. Deixar o cubo da agulha de extrusão a partir da pele.
- Coloque uma tampa linha intravenosa na agulha sem corte. Utilizando 3-0 sutura de seda, proteger a ponta do cateter para a pele (Figura 9).
- Limpar a incisão. Transfira o rato em uma gaiola, morna limpa para o despertar da anestesia.
8. * Fechamento da incisão dorsal e protegendo o cateter (para camundongos ou ratos)
- * Ocluir a extremidade distai do cateter por torção ou utilizando uma chama para derreter o fim.
- Bobina * o fim da tubagem e deixá-lo na bolsa subcutânea no dorso do animal (não cortar tubos para o encurtar) (Figura 10).
- * Feche a pele sobre o tubo com poliglactina 4-0 em uma forma de corrida (Figura 11).
- * No dia da cistometria, preparar a incisão dorsal com betadine e etanol a 70%. Abrir a incisão dorsal sob anestesia e remover o tubo enrolado a partir da bolsa subcutânea. Feche o incisão. Desperte o animal de anestesia e executar cistometria quando estiver completamente acordado.
9. Resultados representante - Métodos Cirúrgicos
A bexiga reconstituídas deve ser tão estanque a água quanto possível para evitar complicações relacionadas com um vazamento urinária significativa (Figura 3). Dor ou desconforto geralmente se manifestar como tremores ou arranhando e mordendo a incisão abdominal. Isso pode ser gerenciado com injeções diárias subcutâneas de um não-esteróides anti-inflamatórios, como meloxicam (0,5-1,0 mg / kg por via subcutânea). Tipicamente, os animais requerem apenas as injecções para os primeiros 3 dias pós-operatório. Isto pode ser suplementado com um opióide, tal como a buprenorfina (0,05-0,1 mg / kg por via subcutânea a cada hr 8-12), conforme necessário. Os animais devem ser monitorizados 3 vezes por dia durante os primeiros 3 dias pós-operatório, TWgelo por dia para o pós-operatório 3-5 e, em seguida, depois diariamente para avaliar a dor, sinais de infecção, cicatrização adequada, atividade, grooming, e turgor da pele. Antibióticos (Baytril, 5mg/kg subcutânea cada hr 24 num volume não superior a 0,1 mL) são dadas para a cirurgia hr primeiro 72 a seguir, como profilaxia contra a infecção cirúrgica. Os sinais de recuperação normal são deambulação normal e os níveis de atividade, alimentação adequada e beber, ausência de dor ou desconforto (sem vocalização) e socialização normal com cagemates. Um tempo de recuperação de pelo menos 5-7 dias deve ser dada antes da análise cistométrica, para permitir a cura da bexiga e diminuição da inflamação que poderiam potencialmente afectar os resultados.
Análises cistométricos
10. Análise cistométrica Awake
- Configuração descrita com MLT844 ADInstruments com captura de dados e análise com LabChart v6 (ADInstruments) e infusão com uma bomba de seringa Harvard 22 (Harvard Apparatus, Holliston, MA), embora outros sistemas comparáveis estão disponíveis (Figura 12).
- Calibrar o volume e pressão com base nas especificações do sistema cistométrica usado.
- Colocar os animais em gaiolas metabólicas (gaiolas com um chão de rede de arame), que são suspensas sobre uma escala. A escala é ligada a um transdutor.
- Purga-se o sistema de quaisquer bolhas de ar e assegurar o fluxo contínuo a partir da bomba de infusão.
- Ligue o sistema de captação de dados para um computador e observar os traçados de dados. Ajuste a escala em conformidade. A pressão da bexiga e do volume de urina será continuamente registrado.
- O acesso dos cateteres suprapúbicas com uma agulha de 27G ligado através de um tubo em T para o transdutor de pressão e da bomba de infusão. Iniciar a infusão de solução salina fisiológica a 12,5 mL / min para o rato e 100 uL / min para o rato.
- Permitir que o padrão de micção rastreio para estabilizar (aumento da bexiga pressão, seguido por um vazio). Isso normalmente leva aproximadamentemadamente 10-20 minutos. Registre os ciclos de micção para 45-120 minutos ou, pelo menos, ciclos de esvaziamento 3-4.
- Observar procedimento completo em tempo real para solucionar problemas de complicações que levam ao artefato (ou seja, acotovelamento cateter, obstrução, etc, veja abaixo discussão).
- Parar a infusão, desligar o cateter a partir do sistema, e devolver o animal para a sua gaiola.
11. Análise cistométrica Inconsciente (Nenhum cateter suprapúbica)
- Anestesiar o animal com uretano (1-2 g / kg) de injecção intraperitoneal (IP).
- Expor a bexiga como acima nos passos 1.3-2.4.
- Calibrar o sistema como no passo 9.2. Prepare o sistema como no passo 9,4-9,5.
- Inserir uma agulha 27G ligado através de um tubo em T para o transdutor de pressão e uma bomba de infusão no aspecto lateral da bexiga.
- Registre os ciclos de micção para 45-90 minutos.
- Parar a infusão, remover a agulha da bexiga e euthanize do animal.
12. Resultados representativos - Análises cistométricos
Traçados urodinâmicos podem ser analisados para derivar parâmetros, tais como volumes anulados, conformidade, picos de pressão miccional, intervalo entre a contração, o tempo de ciclo de micção e volumes pós vazios residuais.
Cystometrogram pode ser dividido em um recheio e uma fase de esvaziamento. Uma fase de enchimento normal é a porção do ciclo em que a micção bexiga enche-se com muito pouca alteração na pressão intravesical. Uma fase de esvaziamento normal do traçado consiste de um aumento constante da pressão intravesical correspondente à contracção do detrusor. A maior pressão alcançada durante a fase de esvaziamento do traçado é chamado de pressão miccional pico. A pressão miccional elevado pico poderia sugerir um padrão miccional obstrutivo, uma bexiga hipercontrátil ou uma torção no cateter SP. A conformidade pode ser calculada através da aquisição de a razão entre o volume instilado during a fase de enchimento e da mudança de pressão (respeito = AV / AP). A bexiga hypocompliant é aquele que é incapaz de acomodar adequados volumes urinários a baixas pressões. O intervalo de intercontraction pode ser calculada através da análise do tempo entre duas contracções como visto na cystometrogram. Um intervalo curto intercontraction é sugestivo de uma bexiga irritável. O tempo de ciclo de micção refere-se ao tempo que leva para um enchimento completo ea micção fase para completar e pode facilmente ser verificado por análise do traçado. Na conclusão do cistometria, pós-void residual (PVR) pode ser obtido. Isto é feito por aspiração do cateter suprapúbica após a conclusão de uma contracção do detrusor. Estes parâmetros ajudar o investigador objetiva estudar a dinâmica da bexiga como a bexiga enche e esvazia.
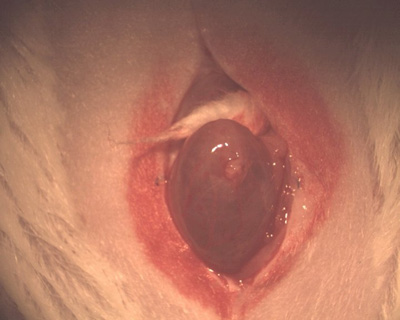
Figura 1. Fotografia da incisão abdominale extrusão da bexiga.

Figura 2. Incisão da bexiga com a exposição do lúmen da bexiga.
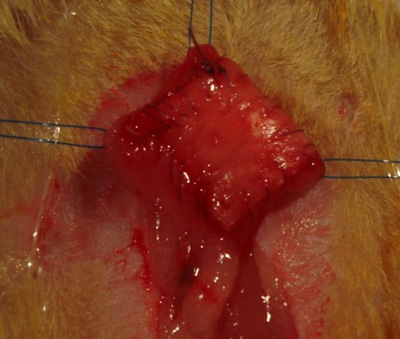
Figura 3. Integração do implante para a parede da bexiga.
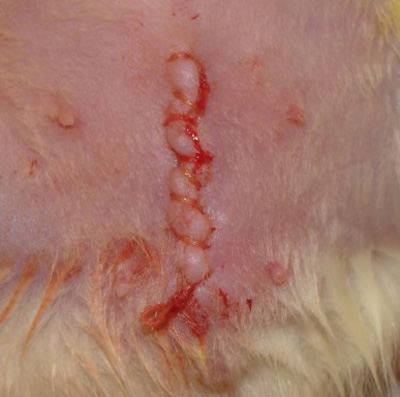
Figura 4. Fotografia da incisão fechada.

Figura 5. Extremidade alargada do tubo PE-50.

Figura 6. PE-50 tubagem (cateter) através da incisão dorsal.
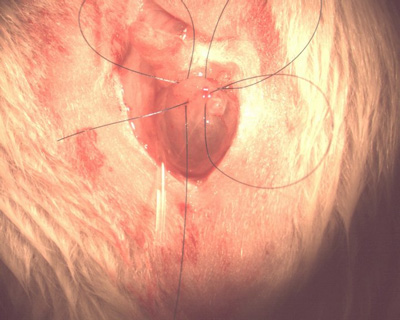
Figura 7.Sutura em bolsa.
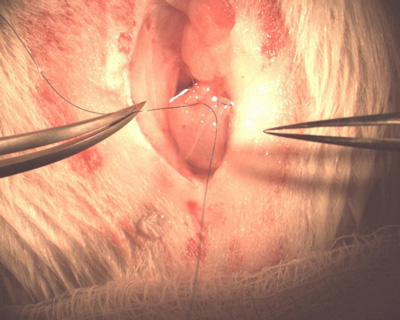
Figura 8. Fixação do cateter para a bexiga.
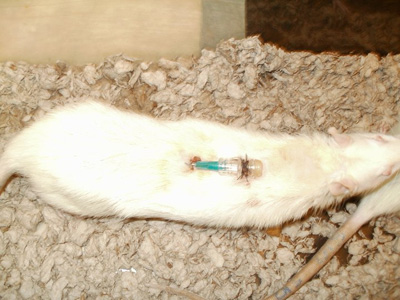
Figura 9. Hub cateter Secured.
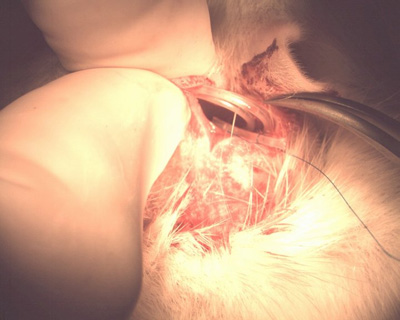
Figura 10. Coiled tubo na bolsa subcutânea.

Figura 11. Fechamento incisional dorsal.

Figura 12. Exemplo cistométrica set-up.

Figura 13. Cistometria Representante de rastreamento.
Discussão
Avaliações cistométricos de configurações de biomateriais após a implantação eo aumento da bexiga em modelos animais pequenos representa um passo importante na identificação de validação óptimas características estruturais e mecânicas dos desenhos matriz para uso em situações clínicas. Neste estudo, descrevemos os métodos cirúrgicos para a realização de ampliação vesical em camundongos e ratos, bem como técnicas para determinar as propriedades cistometria urodinâmicos dos órgãos de engenharia para avaliação funcional. Utilizamos estas técnicas em várias experiências que envolvem ambos os camundongos e ratos, com cada experimento consistia de 30 roedores + sem problemas significativos. Nosso laboratório de pesquisa é um conglomerado diversificado de cientistas básicos e cirurgiões médicos e cirurgiões com pelo menos 5-6 anos de formação pós-graduada cirúrgico realizado os aspectos processuais desses experimentos.
Independentemente do tipo de biomaterial utilizado, o di principalferença entre aumentando a bexiga em ratos, versus ratinhos é o tamanho da bexiga. Devido ao tamanho mais pequeno da bexiga, a dissecção ea incorporação do biomaterial é tecnicamente mais difícil no rato. Para ajudar na visualização, um microscópio cirúrgico pode ser usado. Uma vez que o tamanho da bexiga em ratos é maior, é mais susceptível a situações em que mais do que um processo tem de ser realizada sobre a bexiga (por exemplo, aumento e colocação do cateter cistostomia). Além disso, o protocolo acima descreve a utilização de tubagem PE-50 para o rato 13, no entanto, cateteres tamanho ainda maiores, até PE-100 foram utilizados, especialmente para estudos de longo prazo 14. Em ratinhos, uma menor calibre, tais como PE-10 tubagem pode ser utilizado 15,16, mas deve ser mantido em mente que os tubos flexíveis menor, mais não pode transmitir mudanças de pressão para o transdutor com precisão. Além disso, o método alternativo de fixação do cateter no dorso (passo 8 acima *) é feito em mice devido ao seu menor tamanho corporal ea agulha ponta romba e cap IV são demasiado pesado. A desvantagem disto é a necessidade de anestesia para extrair o final do cateter na bolsa subcutânea antes da cistometria.
Estudos têm demonstrado que nos dias iniciais primeiros (0-4 dias) após a colocação dos cateteres, cistometria revelou pressões elevadas da bexiga e hiperatividade com volumes urinários baixos. Essas descobertas parecem se estabilizar em torno do sexto ao sétimo dia 14,17 e, portanto, é provavelmente o momento ideal para a avaliação cistométrica. No entanto, a maioria dos relatos na literatura executar cistometria nos primeiros 3 dias de cateterismo 18 anos, e isso explica a grande variação nos parâmetros acima em relação ao tempo. Deixando o cateter suprapúbica para uma duração superior a 3 dias traz consigo morbidades, tais como risco de pedras, deslocamento, infecção, hematúria e oclusão do cateter com detritos.
diferentes velocidades de infusão durante cistometria têm sido descritas a partir de 1-3mL/hr para ratos 15,16 e 10-11mL/hr para ratos 13,19,20. As taxas de infusão suprafisiológicas podem causar pressões falsamente elevados 14. Usamos uma taxa de infusão de 12,5 uL / min (0,75 mL / hr) para ratinhos e 100 uL / min (6 mL / hr) para ratos em nossa configuração, mas taxas mais baixas podem também ser utilizados. A temperatura da solução salina fisiológica deve ser pelo menos a temperatura ambiente, embora salina (37 °) quente é mais optimizada a fim de evitar excesso de actividade da bexiga provocado com instilar solução fria. Em cistometria acordado, é crucial para permitir a estabilização do padrão anular que o animal se torna ajustado para a gaiola, que, na nossa experiência requer um período de ~ 10-20 minutos. Depois disso, ciclos regulares de micção pode ser gravada por 45-120 minutos ou no mínimo ciclos de esvaziamento 3-4. O animal deve ser observado em tempo real, uma vez que o animal é livremente moving, e complicações tais como a torção ou dobras do cateter pode alterar análise cistométrica. Limitando o ruído ambiental durante cistometria se deseja diminuir o movimento de animais e artefatos subseqüentes. Cistometria inconsciente não tem os problemas concomitantes como cistometria acordado, mas anestésicos múltiplos têm sido mostrados para inibir as contracções da bexiga espontâneas. Esta inibição corresponde diretamente à duração esperada da ação dos anestésicos, ou seja, quando os subsídios efeito anestésico, contrações espontâneas retomar 14. Além disso, as pressões medidos quando a bexiga transbordou, foram estatisticamente maior em ratos anestesiados, tanto vivo e post-mortem, indicando um efeito sobre as propriedades de conformidade passivas da parede da bexiga. Este efeito é visto com 21 pentobarbital, cetamina, e cloralose IM / IP, para além de halotano e inalado nesacaine intratecal 14. Um estudo mais extensa de vários anestésicos confirmaçãom este achado com a supressão do reflexo da micção para anestésicos tanto inalatória (isoflurano e metoxiflurano) e barbitúricos (pentobarbital e thiobutabarbital) sob níveis moderados de anestesia 17. Este efeito foi observado com os níveis de luz ou mesmo sedativo da anestesia com medicamentos como o fentanil-droperidol e diazepam-cetamina, e como no estudo anterior, como o efeito de anestesia diminuiu, assim como a inibição 17. Para este procedimento, as injecções intraperitoneais de uretano pode ser utilizado uma vez que foi demonstrado que a micção reflexo é preservada enquanto também permite que para anestesia adequada 17,22. Além disso, nenhum efeito é observado em relação às pressões de micção 23. Colocação do cateter suprapúbica para cistometria é descrito aqui, pois o cateterismo intra-uretral tem sido demonstrado que têm curvas mais elevados de pressão na bexiga e menores taxas de fluxo consistente com obstrução relativa da saída da bexiga 24.Além disso, o cateterismo intra-uretral só é possível em animais anestesiados e, mesmo assim, o cateterismo pode ser difícil, especialmente em roedores machos e ratos.
Em conclusão, a escolha de qual o modelo a utilizar para o aumento da bexiga e / ou análise cistométrica é dependente dos objectivos do estudo específico. Do ponto de vista técnico, o modelo de rato claramente tem a vantagem de as razões discutidas acima. No entanto, o modelo de rato pode ser usado em estudos sobre os papéis dos produtos específicos de genes codificados finais em doenças do tracto urinário, devido à sua susceptibilidade para a manipulação genética. Isto não é geralmente possível no rato.
Cistometria acordado com mais precisão imita o estado fisiológico normal em que estes animais submetidos a ciclos de seus da micção, e assim, é susceptível de dar uma determinação mais fiável fisiológica de função da bexiga. Além disso, a variável de confusão de efeitos diretos de umanesthetics sobre a função da bexiga é evitado.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Estes estudos foram financiados, em parte, pela Boston das Crianças Urologia Hospital Fundo Receita Endowment e do National Institutes of Health bolsas NIBIB P41-EB002520 (Kaplan); NIDDK T32-DK60442 (Freeman); NIDDK 1K99-DK083616 (Mauney). Reconhecemos Dr. Peter Zvara da Universidade de Vermont para a assistência no estabelecimento da técnica de colocação de tubos de cistostomia e cistometria.
Materiais
| Name | Company | Catalog Number | Comments | |
| Materiais: | Descrição / Utilização: | |||
| Tesouras de barbear | Preparação do rato / mouse para a cirurgia | |||
| Cortinas estéreis, Betadine, etanol 70%, gaze estéril | Preparação do campo cirúrgico estéril | |||
| Instrumentos: | ||||
| Lâmina de bisturi | Incisão na pele | |||
| forceps com dentes | Manipulando pele | |||
| Pinça fina | Atraumático (sem dentes), sem serrilhados ou com serrilhas finas para manipular | |||
| Motorista pequena agulha | Dissecção aguda do tecido | |||
| Metzenbaum tesoura | Incisão Bldder | |||
| Tenotomia tesoura | Para suturas de retracção e de desenvolver subcutânea tunnel (cateter de cistostomia) | |||
| Pequenas pinças curvas | Subcutânea túnel (cateter de cistostomia) | |||
| Suturas: | ||||
| 6-0 de polipropileno | Bexiga e suturas de ancoragem de sutura em bolsa | |||
| 7-0 sutura poliglactina | Anastomose de andaime para bexiga | |||
| Sutura de poliglactina 4-0 | Encerramento do músculo / pele | |||
| 3-0 ou sutura de seda 4-0 | Ponta do cateter Protegendo a pele | |||
| Agulhas e seringas: | ||||
| Agulha de calibre 18 | Perfurar a bexiga por cateter de cistostomia | |||
| 25 e 30 agulhas de calibre | Teste de vazamento da bexiga | |||
| 1 mL f salinaseringa illed | ||||
| 22 gauge agulha ponta romba | ||||
| Cateter de cistostomia: | ||||
| PE-50 tubagem | ||||
| Isqueiro | Queima PE-50 tubos | |||
| Pinça curva Pequeno | Desenvolvimento de túnel subcutâneo | |||
| Cistometria: | ||||
| MLT844 ADInstruments captura de dados e software LabChart | Aquisição de dados de pressão | |||
| Harvard bomba de seringa 22 (Harvard Apparatus, Holliston, MA) | Bomba de infusão de líquidos | |||
| Anestésicos (cistometria Inconsciente): | ||||
| Eusoflurane | Indução / manutenção da anestesia geral | |||
| Uretano | Cistometria Unconconscious | |||
| Bupivicaine ou equivalente | A anestesia local | |||
| Meloxicam | Analgesia pós-operatória | |||
| Buprenorfina | Analgesia pós-operatória | |||
Referências
- Atala, A. Tissue engineering for bladder substitution. World. J. Urol. 18, 364-370 (2000).
- Roehrborn, C. G. Male lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH). Med. Clin. North Am. 95, 87-100 (2011).
- Niknejad, K. G., Atala, A. Bladder augmentation techniques in women. Int. Urogynecol. J. Pelvic Floor Dysfunct. 11, 156-169 (2000).
- Hensle, T. W., Gilbert, S. M. A review of metabolic consequences and long-term complications of enterocystoplasty in children. Curr. Urol. Rep. 8, 157-162 (2007).
- Somani, B. K. Bowel dysfunction after transposition of intestinal segments into the urinary tract: 8-year prospective cohort study. J. Urol. 177, 1793-1798 (2007).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367, 1241-1246 (2006).
- Sharma, A. K. A nonhuman primate model for urinary bladder regeneration using autologous sources of bone marrow-derived mesenchymal stem cells. Stem Cells. 29, 241-250 (2011).
- Chung, S. Y. Bladder reconstitution with bone marrow derived stem cells seeded on small intestinal submucosa improves morphological and molecular composition. J. Urol. 174, 353-359 (2005).
- Ashley, R. A. Regional variations in small intestinal submucosa evoke differences in inflammation with subsequent impact on tissue regeneration in the rat bladder augmentation model. BJU Int. 105, 1462-1468 (2010).
- Zhang, Y., Frimberger, D., Cheng, E. Y., Lin, H. K., Kropp, B. P. Challenges in a larger bladder replacement with cell-seeded and unseeded small intestinal submucosa grafts in a subtotal cystectomy model. BJU Int. 98, 1100-1105 (2006).
- Gomez, P. 3rd The effect of manipulation of silk scaffold fabrication parameters on matrix performance in a murine model of bladder augmentation. Biomaterials. 32, 7562-7570 (2011).
- Mauney, J. R. Evaluation of gel spun silk-based biomaterials in a murine model of bladder augmentation. Biomaterials. 32, 808-818 (2011).
- Persson, K. Spinal and peripheral mechanisms contributing to hyperactive voiding in spontaneously hypertensive rats. Am. J. Physiol. 275, 1366-1373 (1998).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am. J. Physiol. 251, 1177-1185 (1986).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J. Urol. 164, 1385-1389 (2000).
- Soler, R., Fullhase, C., Lu, B., Bishop, C. E., Andersson, K. E. Bladder dysfunction in a new mutant mouse model with increased superoxide--lack of nitric oxide. J. Urol. 183, 780-785 (2010).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol. Urodyn. 19, 87-99 (2000).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Soler, R., Fullhase, C., Santos, C., Andersson, K. E. Development of bladder dysfunction in a rat model of dopaminergic brain lesion. Neurourol Urodyn. 30, 188-193 (2011).
- Streng, T., Santti, R., Andersson, K. E., Talo, A. The role of the rhabdosphincter in female rat voiding. BJU Int. 94, 138-142 (2004).
- Malmgren, A. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J. Urol. 137, 1291-1294 (1987).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol. Urodyn. 29, 1344-1349 (2010).
- Cannon, T. W., Damaser, M. S. Effects of anesthesia on cystometry and leak point pressure of the female rat. Life Sci. 69, 1193-1202 (2001).
- Smith, P. P., Hurtado, E., Smith, C. P., Boone, T. B., Somogyi, G. T. Comparison of cystometric methods in female rats. Neurourol. Urodyn. 27, 324-329 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados