Method Article
Быстрое удаление фибробластов с высокой плотностью эмбриональных стволовых клеток культур
В этой статье
Резюме
Несмотря на предпринимаемые усилия по переходу культур подачи без условий, получение и культуру человеческих эмбриональных стволовых клеток (ЭСК) по-прежнему во многом зависит от совместных культурах с мышиных эмбриональных фидеров (МЭФ). Здесь мы покажем новую методологию для быстрого удаления фидеров от чЭСК культур до экспериментов.
Аннотация
Мышиных эмбриональных фибробластов (МЭФ), были использованы для создания человеческих эмбриональных стволовых клеток (ЭСК) культур после бластоцисты изоляции 1. Эта система поддерживает подачи ЭСК от прохождения спонтанной дифференцировки в процессе клеточного роста. Тем не менее, это сотрудничество культуру метод трудоемкий, требует высококвалифицированного персонала, и дает низкую чистоту чЭСК 4. Во многих лабораториях пытались свести к минимуму количество фидерных клеток в культуре ЭСК (т.е. включающие матрицы покрытием блюда или другие устройства подачи типы клеток 5-8). Эти изменения системы культуры показали некоторые надежды, но не вытеснил стандартный метод культивирования ЭСК митомицином С обработанной фибробластов мыши embyronic для того, чтобы замедлить нежелательные спонтанную дифференцировку ЭСК культур. Таким образом, фидерных клеток, используемых в чЭСК расширения должны быть удалены в процессе дифференцировки экспериментов. Хотя несколько методов, доступных для очистки чЭСК сотрудничестваlonies (FACS, Mac, или использование лекарственной устойчивостью векторов) от кормушки, эти методы являются трудоемкими, дорогостоящими и / или разрушительной для ЭСК. Целью этого проекта было придумать способ очистки, который позволяет уборки чище населения ЭСК. Мы обнаружили, что в сливной культуре ЭСК, население MEF могут быть удалены с помощью простого и быстрого стремления лист MEF. Это удаление зависит от нескольких факторов, включая боковые клетки к клетке связывания MEFs, которые имеют более низкое сродство к стирола блюдо культуры, а также возможность колоний стволовых клеток нажать на фибробласты наружу во время создания своего собственного " нишу ". ЧЭСК затем были исследованы на SSEA-4, Oct3 / 4 и Тра 1-81 выражении до 10 дней после удаления MEF для обеспечения поддержания плюрипотентности. Кроме того, ЭСК колонии были в состоянии продолжать расти с в более крупные образования после удаления MEF, обеспечивая дополнительный уровень чЭСК расширения.
протокол
1. Подготовка мышиных эмбриональных Кормушки
- MEFs, используемых в совместной культуре ЭСК должна быть ранее получавших облучение или Митомицин-C для подавления клеток от прохождения дивизии.
- За два часа до посева MEF, пальто каждые 60 мм плазмы рассматривается культуры блюдо с 2 мл 0,05% желатина.
- Оттепель флакон обработанных MEFs и пластины на ~ 20000 клеток / см 2.
- Разрешить клетки придерживаться в течение ночи.
2. Со посева ЭСК на MEFs
- Новые колонии могут быть инициированы из криоконсервированных культур или пассажи текущего культур на новые MEF покрытием блюда, как показано ниже.
- Промыть пластины, содержащей большие колонии ЭСК будет пересевать 1 раз в 3 мл подогретого 1x PBS.
- Добавьте 3 мл коллагеназы IV / PBS раствора (1 мг / мл), и инкубировать в течение 5-10 мин при температуре 37 ° C. (Примечание: клетки не станет различны или мяч вверх, как показано с помощью трипсина).
- В то время как клетки все еще находятся вколлагеназы, используйте край 5 мл пипетки наконечник, создать сетку на колонии, разбивая их на мелкие сгустки клеток.
- Используйте конца пипетки наконечник (состоявшейся в перпендикулярном образом на культуру пластину), чтобы очистить нижнюю часть культуры плиты, выбить все клетки с поверхности.
- Сбор клеток в трубки Сокол и спина в (1000 оборотов в минуту) в течение 5 мин.
- После центрифугирования аспирации среды, оставляя осадок клеток в пробирке Falcon.
- Аспирируйте MEF среды от MEFs покрытием накануне.
- Re пластины клеток в соотношении 1:3 из исходного пластины, и корм с 3 мл чЭСК среде
3. Разрушающих MEFs от Co-культуре
Примечание: Human культур ESC должна быть высокой плотности, обычно между 10 и 14 днями культуры.
- Поместите кончик пипетки аспирационных на край плиты и дайте всасывания осторожно потяните вверх по краю листа MEF.
- Rалить средств массовой информации в блюдо и дайте чаевые, чтобы поймать ячейки листа и медленно двигать наконечник в дугу образом над плитой. Примечание: лист может забить на кончике пипетки, но это не является проблемой, как это не должно мешать пользователю вручную, потянув за лист от поверхности пластины культуры. Если клетки прилипла к концу аспиратор, вы можете использовать верхнюю часть культуры блюдо, чтобы разбить ячейку листа для полной аспирации.
- Заменить чЭСК среднего немедленно, и поставил тарелку обратно в инкубатор.
4. Представитель Результаты
Конечным результатом процесса удаления MEF производит небольшие спокойно колонии ЭСК (рис. 1D) могут пройти значительное расширение в очень больших колоний (рис. 2), сохраняя при этом выражение лица плюрипотентности SSEA-4 окт ¾, и Тра 1-81 (рис. 3).
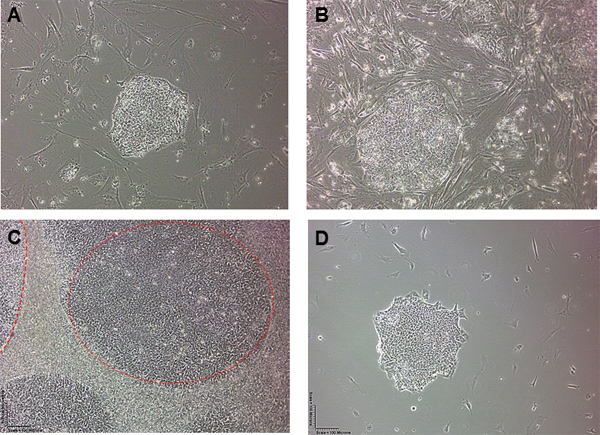
Рисунок 1. ESC морфологии колонии до и после удаления MEF. Эмбриональных стволовых клеток человека в колониях) 1 день и B) 2-й день после посева на культуру блюд. C) High Density Эмбриональных стволовых клеток человека колоний (H7), окруженный MEFs. Две колонии ЭСК изложены в красной тире.) После удаления MEF использованием методики, описанной стремления, мы остались с изолированной колонии ЭСК с очень немногими MEFs окружающего неповрежденного колонии.

Рисунок 2. ESC колонии расширения через 10 дней после удаления MEF. Оригинальный колонии ЭСК сразу после истощения MEF (слева) это позволило расширить в очень большой колонии (справа) соответствуюximately 800 мкм, 10x. Обратите внимание, что оригинальный колонии изображается в то же увеличение (10x), как составной колонии.

Рисунок 3. Иммуноокрашивание из MEF-обедненного колонии ЭСК. Иммунофлуоресцентного идентификации колоний до 10 дней после истощения MEF показывает, что колонии поддерживать свое выражение маркеров плюрипотентности, как видно по октябрь ¾, SSEA-4, и Тра-1-81 окрашивание. Кроме того, эти колонии ЭСК не проявляют к дифференциации мезодермального судьбы, на что указывает отсутствие Flk-1., E, I и М) пропускание света образы immunoflouscently окрашенных колоний, 20, 10, 10 и 2x, . соответственно B, F, J и N) показать ядер -. DAPI окрашенные клетки immunofluorescently окрашенных колоний, 20, 10, 10 и 2x соответственно CD) показывают выражениячеловека маркера стволовых клеток SSEA-4 только и композитные изображения, 20-кратным. GH) показать выражение человеческого стволовых клеток маркера октября ¾ только и композитные изображения, 10-кратным. KL) показать выражение человеческого маркеров стволовых клеток Tra только 1-81 и композитные изображения, 10-кратным. MP) последняя строка, если изображения изображают колонии изображая типичных гладких границ видел в этом увеличении, 2x, и эти колонии не выражают O) Flk-1, ранним маркером дифференциации мезодермы, и не они P) содержит фибробласты, как показали отсутствие DDR2 окрашивания.
Справочная видео. Удаление фибробластов лист аспирации. Щелкните здесь для просмотра фильмов .
Обсуждение
Метод, представленный в этой рукописи предлагает быстрое и менее дорогостоящей альтернативой ликвидации фибробластов подачи из человеческих эмбриональных клеточных культурах. Успешное удаление фибробластов зависит от существования тесно сливающийся монослой из этих клеток, которая развивается в более длительных культурах стволовых клеток. Через 7-10 дней, растущие колонии ЭСК будет толкать подачи фибробластов в направлении наружу, создавая более плотную монослоя фибробластов между колониями. Сильные клетки к клетке вложения в монослое фибробластов позволяет его быстрое удаление как ячейки листа. Следует тщательно отметил, что это очищение техники предлагается для использования в качестве метода MEF удаления из ЭСК до эксперимента только, и не используется для рутинной культуры расширения.
Можно также использовать эту технику очистки, чтобы спасти бедных колоний стволовых качества клетки. Высокая колонии ЭСК качества должны проявляться DISTINCT границы между собой и фидерных клеток. Если, однако, колоний стволовых клеток прошли частичную дифференциацию, демонстрируя менее четко определенных границ колонии, то этот метод также может быть использован для удаления частично дифференцированные колонии ЭСК вместе с листа клетки MEF, однако, физическое разделение чЭСК колонии пипетки наконечник может быть необходимо отделить любой чЭСК связи с нежелательными дифференцированных клеток или MEF.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась Новый факультет премии II из Калифорнийского института регенеративной медицины (RN2-00921-1), и NIH-финансируемые Национальной премии исследований (F32-HL104924)
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| DDR2 | Санта-Крус | 7555 | Фибробластов Маркера |
| Dapi | Calbiochem | 268298 | Маркер клеточного ядра |
| SSEA-4 | Millipore | MAB4304 | ЭСК человека Маркера |
| Oct 3/4 | Санта-Крус | 9081 | ЭСК человека Маркера |
| Flk-1 | BD Pharma | 555307 | Ранним маркером дифференциации |
| Тра-1-81 | Acris | AM20377AF4-S | ЭСК человека Маркера |
Таблица 1. Таблица конкретным причинамМужские используется для иммунной ЭСК.
Ссылки
- Bongso, A., Fong, C. Y., Ng, S. C., Ratnam, S. Isolation and culture of inner cell mass cells from human blastocysts. Hum. Reprod. 9, 2110-2117 (1994).
- Reubinoff, B. E., Pera, M. F., Fong, C. Y., Trounson, A., Bongso, A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat. Biotechnol. 18, 399-404 (2000).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Thomas, R. J. Automated, scalable culture of human embryonic stem cells in feeder-free conditions. Biotechnol Bioeng. 102, 1636-1644 (2009).
- Kolhar, P., Kotamraju, V. R., Hikita, S. T., Clegg, D. O., Ruoslahti, E. Synthetic surfaces for human embryonic stem cell culture. J. Biotechnol. 146, 143-146 (2010).
- Hovatta, O. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Hum. Reprod. 18, 1404-1409 (2003).
- McKay, T. R. Human feeder cell line for derivation and culture of hESc/hiPSc. Stem Cell Res. 7, 154-162 (2011).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Stein, G. S. Thawing, Seeding, and Changing Medium of Human Embryonic Stem Cells. Shi, M. J., Stencel, K., Borowski, M. , John Wiley & Sons, Inc. (2010).
- Schwartz, P. H., Brick, D. J., Nethercott, H. E., Stover, A. E. Traditional human embryonic stem cell culture. Methods Mol. Biol. 767, 107-123 Forthcoming.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены