Method Article
A remoção rápida de fibroblastos de Alta Densidade Humanos culturas de células estaminais embrionárias
Neste Artigo
Resumo
Apesar dos esforços em curso para as culturas de transição para a alimentação livres de condições, a derivação ea cultura de células estaminais embrionárias humanas (CTEh) permanecem em grande parte dependente de co-culturas com alimentadores embrionárias (MEFs). Aqui, mostramos uma nova metodologia para a rápida remoção de alimentadores de culturas CTEh antes da experimentação.
Resumo
Fibroblastos de rato embrionárias (MEFs) foram utilizados para estabelecer células-tronco embrionárias (hESCs) culturas após blastocisto isolamento 1. Este sistema de alimentação mantém hESCs de sofrer diferenciação espontânea durante a expansão de células. No entanto, este método de co-cultura é um trabalho intensivo, requer pessoal altamente treinado, e os rendimentos a pureza hESC baixo 4. Muitos laboratórios têm tentado minimizar o número de células de alimentação em culturas CTEh (isto é, a incorporação da matriz revestidos pratos ou outros tipos de células alimentadoras 5-8). Estes sistemas de cultura modificados têm mostrado alguma promessa, mas não suplantou o método padrão para hESCs cultura com mitomicina C tratados com fibroblastos de rato embyronic a fim de retardar a diferenciação espontânea indesejada das culturas CTEh. Portanto, as células de alimentação utilizados na expansão hESC deve ser removido durante as experiências de diferenciação. Embora várias técnicas disponíveis para a purificação do co hESClonies (FACS, Macs, ou o uso de vetores resistentes aos medicamentos) de alimentadores, estas técnicas são de trabalho intensivo, caro e / ou destruidores para o hESC. O objetivo deste projeto foi o de inventar um método de purificação que permite a colheita de uma população mais pura de hESCs. Temos observado que em uma cultura confluente hESC, a população MEF pode ser removido usando uma aspiração simples e rápida da folha de MEF. Esta remoção é dependente de vários factores, incluindo a ligação de célula-a-célula lateral MEFs que tem uma menor afinidade de ligação para o prato de cultura de estireno, e a capacidade de as colónias de células-tronco para empurrar para fora os fibroblastos durante a geração do seu próprio " nicho ". O hESC foram então examinadas para SSEA-4, Oct3 / 4 e expressão Tra 1-81 até 10 dias após a remoção do MEF para assegurar a manutenção da pluripotência. Além disso, as colônias CTEh foram capazes de continuar crescendo de em formações maiores após a remoção do MEF, proporcionando um nível adicional de expansão hESC.
Protocolo
1. Preparação de Alimentadores embrionárias de rato
- O MEFs utilizado na co-cultura de hESCs devem ser previamente tratadas por irradiação ou mitomicina C para inibir as células de sofrer divisão.
- Duas horas antes da semeadura MEF, revestimento de plasma 60 milímetros cada prato de cultura tratada com 2 ml de 0,05% de gelatina.
- Descongelar um frasco de MEFs tratada e da placa de ~ 20.000 células / cm 2.
- Permitir que as células a aderir durante a noite.
2. Co-semeadura hESCs em MEFs
- Novas colônias pode ser iniciada a partir de culturas criopreservados ou passagens em culturas atuais para novos MEF-revestidos pratos, como abaixo.
- Lave a placa contendo as colónias grandes CTEh a ser passadas uma vez com 3 mL de PBS 1x aquecido.
- Adicionar 3 ml de colagenase IV / solução de PBS (1 mg / ml) e incubar durante 5-10 min a 37 ° C. (Nota: As células não ficará visível ou bola para cima, como visto com tripsina).
- Enquanto que as células estão ainda nacolagenase, utilizar uma ponta de uma pipeta de 5 ml, crie um padrão de grade sobre as colónias, quebrando-as em pedaços de pequenas células.
- Usar o fim da ponta de pipeta (realizada de uma forma perpendicular à placa de cultura) para raspar o fundo da placa de cultura, deslocando todas as células da superfície.
- Recolher as células para um tubo Falcon e em rotação (1000 rpm) durante 5 min.
- Após a centrifugação, aspirar o meio, deixando o sedimento de células no tubo de Falcon.
- Aspirar o meio do dia MEF MEFs do folheado antes.
- Re-placa das células a uma razão de 1:3 a partir da placa original, e alimentos com 3 ml de meio de hESC
3. Esgotando MEFs da co-cultura
Nota: As culturas humanas CES devem estar em alta densidade, normalmente entre 10 e 14 dias de cultura.
- Colocar a ponta de uma pipeta de aspiração na extremidade da placa e permitir que a sucção puxe para cima da borda da folha de MEF.
- Remove a mídia do prato, e permita que a ponta para pegar a folha de celular e mova lentamente a ponta de forma arqueada acima da placa. Nota: A folha pode entupir a ponta da pipeta, mas isto não é problemática, uma vez que não deve impedir que o utilizador manualmente puxando a folha a partir da superfície da placa de cultura. Se as células são presos à extremidade do aspirador, é possível utilizar a parte superior do prato de cultura para quebrar a camada de células por aspiração completa.
- Substitua meio hESC imediatamente, e colocar a placa de volta para a incubadora.
4. Resultados representativos
O resultado final do processo de remoção MEF produz pequenas colónias CTEh não perturbadas (Figura 1D), capazes de sofrer uma expansão significativa em colónias grandes (Figura 2), mantendo a expressão de fabricantes de pluripotência SSEA-4, Out ¾ e Tra 1-81 (Figura 3).
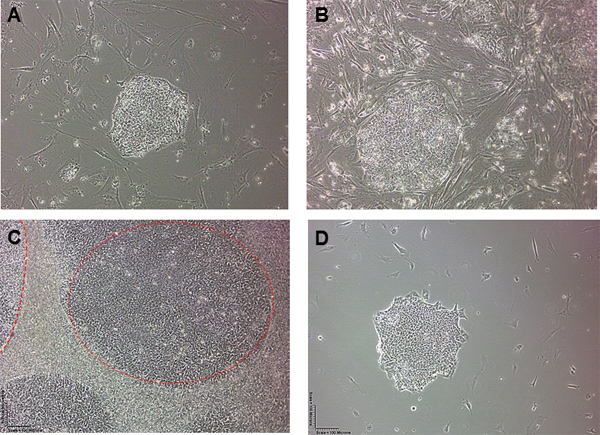
Figura 1. CES morfologia da colônia antes e após remoção MEF. Humanos Colônias células-tronco embrionárias em um dia) 1 e B) dias após a semeadura em duas placas de cultura. C) de Alta Densidade Humanos Colônias células-tronco embrionárias (H7) cercado por MEFs. As duas colônias CTEh estão descritos no traços vermelhos. D) Após a remoção MEF usando a técnica de aspiração descrito, ficamos com uma colônia isolada com hESC MEFs muito poucos em torno da colônia intacta.

Figura 2. CES Expansão Colônia 10 dias após a remoção MEF. HESC A colônia original imediatamente após a depleção MEF (à esquerda) é permitido a expansão em uma colônia muito grande (direita) adeximately 800 pm, 10x. Note-se que a colónia original, é criada uma imagem com a mesma ampliação (10x) quanto à colónia composto.

Figura 3. A imunocoloração de colónias MEF com depleção CTEh. Imunofluorescente identificação de colónias de até 10 dias após a depleção MEF mostra que as colónias manter a sua expressão de marcadores de pluripotência, como é evidente pelos outubro ¾, SSEA-4, e-Tra 1-81 coloração. Além disso, estas colónias CTEh não apresentam diferenciação para um destino mesodérmica, indicado pela ausência de Flk-1. A, E, I e M) são imagens de transmissão de luz das colónias coradas immunoflouscently, 20, 10, 10 e 2x, . respectivamente B, F, J e N) mostram os núcleos -. células DAPI corados das colónias coradas imunofluorescência, 20, 10, 10 e 2x, respectivamente CD) mostram a expressão demarcador de células estaminais humanas SSEA-4 apenas, e imagem composta, 20x. GH) mostram a expressão de células estaminais humanas marcador outubro ¾ só, e imagem composta, KL 10x.) mostram a expressão do marcador de células estaminais humanas Tra 1-81 só e imagem composta, 10x. MP) A última linha se imagens retratam uma colônia retratar as fronteiras típicas suaves visto com este aumento, 2x, e essas colônias não expressa O) Flk-1, um marcador precoce de diferenciação mesoderme, nem eles P) contém fibroblastos como mostrado pela ausência de coloração DDR2.
Vídeo suplementar. Remoção fibroblastos por aspiração Folha. Clique aqui para ver filme .
Discussão
O método apresentado neste manuscrito oferece uma alternativa rápida e menos onerosa para eliminar células alimentadoras de fibroblastos humanos de culturas de células embrionárias. A eliminação bem sucedida de fibroblastos é dependente da existência de uma monocamada confluente de firmemente estas células que se desenvolvem em culturas de células estaminais mais longos. Depois de 7-10 dias, as colónias que crescem CTEh vai empurrar os fibroblastos de alimentação numa direcção para fora, gerando uma monocamada de fibroblastos cada vez mais densa entre colónias. As fortes célula-a-célula anexos em monocamada de fibroblastos a permitir a sua rápida remoção como uma camada de células. Deve ser cuidadosamente notado que esta técnica de purificação é sugerido para uso como um método de remoção de MEF hESC antes da experimentação somente, e não utilizado para a cultura de rotina de expansão.
Também é possível utilizar esta técnica de purificação para resgatar má qualidade colónias de células-tronco. Uma colônia hESC alta qualidade deve apresentar distiNCT fronteiras entre si e as células alimentadoras. Se, no entanto, as colónias de células-tronco sofreram diferenciação parcial, exibindo menos fronteiras bem definidas de colónias, em seguida, este método pode também ser utilizado para remover as colónias CTEh parcialmente diferenciadas, juntamente com a camada de células MEF, no entanto a separação física de colónias com CTEh uma ponta de pipeta pode ser necessário separar quaisquer ligações CTEh com as células indesejadas diferenciados ou de MEF.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por uma Nova Faculdade Prêmio II do California Institute of Regenerative Medicine (RN2-00921-1), e um NIH-financiado Prêmio Nacional de Pesquisa (F32-HL104924)
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| DDR2 | Santa Cruz | 7555 | Marcador de fibroblastos |
| Dapi | Calbiochem | 268298 | Marcador Núcleo Celular |
| SSEA-4 | Millipore | MAB4304 | Humana ESC Marcador |
| Oct 3/4 | Santa Cruz | 9081 | Humana ESC Marcador |
| Flk-1 | BD Pharma | 555307 | Marcador de diferenciação precoce |
| Tra-1-81 | Acris | AM20377AF4-S | Humana ESC Marcador |
Tabela 1. Tabela de rea específicagents utilizado para a imunocoloração o hESC.
Referências
- Bongso, A., Fong, C. Y., Ng, S. C., Ratnam, S. Isolation and culture of inner cell mass cells from human blastocysts. Hum. Reprod. 9, 2110-2117 (1994).
- Reubinoff, B. E., Pera, M. F., Fong, C. Y., Trounson, A., Bongso, A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat. Biotechnol. 18, 399-404 (2000).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Thomas, R. J. Automated, scalable culture of human embryonic stem cells in feeder-free conditions. Biotechnol Bioeng. 102, 1636-1644 (2009).
- Kolhar, P., Kotamraju, V. R., Hikita, S. T., Clegg, D. O., Ruoslahti, E. Synthetic surfaces for human embryonic stem cell culture. J. Biotechnol. 146, 143-146 (2010).
- Hovatta, O. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Hum. Reprod. 18, 1404-1409 (2003).
- McKay, T. R. Human feeder cell line for derivation and culture of hESc/hiPSc. Stem Cell Res. 7, 154-162 (2011).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Stein, G. S. Thawing, Seeding, and Changing Medium of Human Embryonic Stem Cells. Shi, M. J., Stencel, K., Borowski, M. , John Wiley & Sons, Inc. (2010).
- Schwartz, P. H., Brick, D. J., Nethercott, H. E., Stover, A. E. Traditional human embryonic stem cell culture. Methods Mol. Biol. 767, 107-123 Forthcoming.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados