Method Article
Schnelle Fibroblast Entfernung aus High Density humanen embryonalen Stammzellen Kulturen
In diesem Artikel
Zusammenfassung
Trotz anhaltender Bemühungen, um den Übergang Kulturen Feeder-freien Bedingungen, bleiben die Ableitung und Kultur von humanen embryonalen Stammzellen (hES) weitgehend abhängig von Co-Kulturen mit embryonalen Feeder (MEF). Hier zeigen wir eine neuartige Methode zur schnellen Beseitigung Zubringer vom hESC Kulturen vor den Experimenten.
Zusammenfassung
Embryonale Maus-Fibroblasten (MEF) wurden verwendet, um menschliche embryonale Stammzellen (hES) Kulturen nach Blastozyste Trennung 1 zu etablieren. Dieser Anleger System hält hESCs vom unterziehen spontane Differenzierung während der Zellteilung Expansion. Allerdings ist diese Co-Kultur-Methode arbeitsintensiv, erfordert hoch qualifiziertes Personal, und die Renditen niedrig hESC Reinheit 4. Vielen Laboratorien haben versucht, die Anzahl von Feeder-Zellen in Kulturen hESC (dh Einbeziehung Matrix-beschichteten Schalen oder andere Zelltypen Feeder 5-8) zu minimieren. Diese modifizierten Kultur-Systeme haben einige Versprechen gezeigt, aber nicht die Standard-Methode zur Kultivierung hESCs mit Mitomycin C-behandelten Maus embyronic Fibroblasten um unerwünschte spontane Differenzierung der hESC Kulturen verzögern verdrängt. Daher sollten die Feeder-Zellen in hESC Expansion verwendet während der Differenzierung Experimenten entfernt werden. Obwohl mehrere Techniken zur Reinigung des hESC Zusammenarbeit zur Verfügunglonies (FACS, MACS, oder die Verwendung von resistenten Vektoren) von Feeder, sind diese Techniken arbeitsintensiv, teuer und / oder schädlich für die hESC. Das Ziel dieses Projektes war es, ein Verfahren zur Reinigung, die die Ernte von einer reineren Bevölkerung hESCs ermöglicht erfinden. Wir haben beobachtet, dass in einer konfluenten hESC Kultur, die MEF Population entfernt kann mit einer einfachen und schnellen Absaugen des MEF Blatt werden. Diese Entfernung ist abhängig von verschiedenen Faktoren, darunter seitliche Zell-zu-Zell-Bindung MEFs, die eine niedrigere Bindungsaffinität für das Styrol Kulturschale haben, und die Fähigkeit der Stammzellenkolonien die Fibroblasten nach außen während der Erzeugung der eigenen push " Nische ". Der HES wurden dann für SSEA-4, Oct3 / 4 und 1 bis 81 Tra Expression bis zu 10 Tage nach Entfernung MEF untersuchenden Aufrechterhaltung der Pluripotenz zu gewährleisten. Darüber hinaus waren hESC Kolonien in der Lage, weiter zu wachsen aus in größeren Formationen nach MEF Entfernung und bietet eine zusätzliche Ebene der hESC Expansion.
Protokoll
Ein. Vorbereitung der embryonalen Feeder
- Die MEFs in der Co-Kultur von HES verwendet werden zuvor durch Bestrahlung oder Mitomycin-C, um die Zellen vor Teilung durchläuft inhibieren behandelt werden.
- Zwei Stunden vor MEF Aussaat, Mantel je 60 mm Plasma-Kulturschale mit 2 ml 0,05% Gelatine behandelt.
- Auftauen ein Fläschchen behandelten MEFs und Platte bei ~ 20.000 Zellen / cm 2.
- Lassen Sie die Zellen über Nacht zu halten.
2. Co-seeding hESCs auf MEFs
- Neue Kolonien können von kryokonservierten Kulturen oder Passagierung aktuellen Kulturen auf neue MEF-beschichteten Schalen initiiert werden, wie unten.
- Waschen Sie die Platte mit den großen hESC Kolonien passagiert 1 Mal mit 3 ml erwärmte 1x PBS werden.
- 3 ml Collagenase IV / PBS-Lösung (1 mg / ml) und Inkubation für 5-10 min bei 37 ° C. (Hinweis: Die Zellen werden nicht deutlich werden oder Kugel als mit Trypsin gesehen).
- Während die Zellen noch in derKollagenase, verwenden eine Kante einer 5 ml Pipettenspitze, eine Rastermuster auf den Kolonien, brechen sie in kleine Zellklumpen.
- Verwenden das Ende der Pipettenspitze (statt in senkrechter Weise an der Kulturplatte), um den Boden der Kulturschale schaben, Verdrängen alle Zellen von der Oberfläche.
- Sammeln der Zellen in ein Falcon-Röhrchen und drehen sich mit (1000 UpM) für 5 min.
- Nach Zentrifugation, Absaugen des Mediums, so dass das Zellpellet im Falcon-Röhrchen.
- Saugen Sie die MEF Medium aus dem MEFs plated am Tag zuvor.
- Re-Platte die Zellen bei einem Verhältnis von 1:3 aus dem ursprünglichen Platte, und Futtermitteln mit 3 ml Medium hESC
3. Depleting MEFs aus der Co-Kultur
Anmerkung: Human ESC Kulturen müssen mit hoher Dichte, in der Regel zwischen 10 und 14 Tagen der Kultur.
- Setzen Sie die Spitze eines Absaugen Pipette am Rand der Platte und damit der Sog ziehen Sie den Rand des MEF Blatt.
- ReMove die Medien aus der Schüssel und lassen die Spitze der Zellschicht zu fangen und bewegen Sie langsam die Spitze in einer gebogenen Weise oberhalb der Platte. Anmerkung: Die Folie kann in der Spitze der Pipette verstopfen, aber dies ist nicht problematisch, da es nicht sollte dem Benutzer aus manuelles Ziehen des Blattes von der Oberfläche der Kulturschale. Wenn die Zellen bis zum Ende des Saugers stecken, können Sie den oberen Teil der Kulturschale zum Aufbrechen der Zellrasen für komplette Aspiration.
- Ersetzen hESC Medium unmittelbar und legte die Platte wieder in den Inkubator.
4. Repräsentative Ergebnisse
Das Endergebnis des MEF Löschvorgang produziert kleine ungestörten hESC Kolonien (1D) in der Lage, signifikante Expansion in sehr großen Kolonien (Abbildung 2) zu unterziehen und gleichzeitig Ausdruck der Pluripotenz Entscheidungsträger SSEA-4, Oktober ¾ und Tra 1-81 (Abbildung 3).
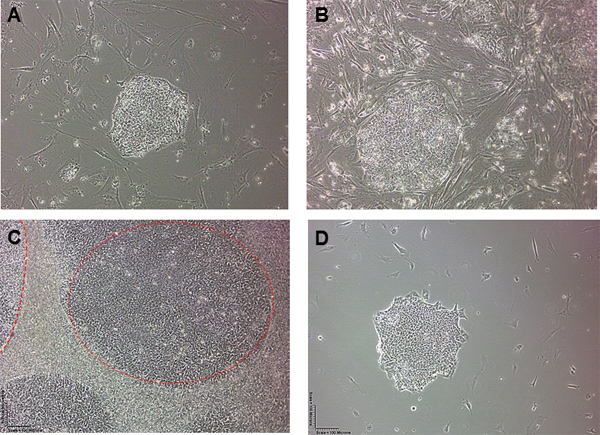
Abbildung 1. ESC Colony Morphologie vor und nach MEF Removal. Humanen embryonalen Stammzellen Kolonien bei A) Tag 1 und B) Tag 2 nach der Aussaat auf Kulturschalen. C) High Density Menschlichen embryonalen Stammzellen Kolonien (H7) von MEFs umgeben. Die beiden hESC Kolonien in roten Strichen skizziert. D) Nach MEF Entfernung mit dem Bestreben beschriebene Technik, sind wir mit einem isolierten hESC Kolonie mit sehr wenigen MEFs um die intakte Kolonie verlassen.

Abbildung 2. ESC Colony Expansion von 10 Tagen nach MEF Removal. Die ursprüngliche hESC Kolonie unmittelbar nach MEF Depletion (links) darf in einem sehr großen Kolonie (rechts) ent ausbauenximately 800 um, 10x. Beachten Sie, dass die ursprüngliche Kolonie in derselben Vergrößerung (10x) als zusammengesetztes Kolonie abgebildet wird.

Abbildung 3. Immunfärbung von MEF-abgereicherte hESC Kolonien. Immunfluoreszenz Identifizierung der Kolonien bis zu 10 Tage nach der MEF Erschöpfung zeigt, dass Kolonien ihre Expression von Pluripotenz Marker als offensichtlich durch Oktober ¾, SSEA-4 und Tra-1-81-Färbung erhalten. Darüber hinaus sind diese hESC Kolonien zeigen keine Differenzierung in Richtung einer mesodermalen Schicksal, angedeutet durch die Abwesenheit von Flk-1. A, E, I und M) Transmissionslichts Bilder der immunoflouscently gefärbten Kolonien, 20, 10, 10 und 2x, . bzw. B, F, J und N) zeigen die Kerne -. DAPI gefärbten Zellen der immunofluorescently gefärbten Kolonien, 20, 10, 10 und 2x bzw. CD) zeigen die Expression vonMenschen Stammzellmarker SSEA-4 nur, und zusammengesetzte Bild, 20x. GH) zeigen die Expression des humanen Stammzellmarker Oktober ¾ nur, und zusammengesetzte Bild, 10x. KL) zeigen die Expression des humanen Stammzellmarker Tra 1-81 nur und Composite-Bild, 10x. MP) Die letzte Zeile, wenn Bilder zeigen eine Kolonie porträtiert die typischen glatten Grenzen bei dieser Vergrößerung, 2x, und dieser Kolonien gesehen nicht ausdrückliche O) Flk-1, ein früher Marker von Mesoderm Differenzierung, noch sie P) enthalten keine Fibroblasten als durch die Abwesenheit von DDR2-Färbung dargestellt.
Supplemental Video. Entfernen Fibroblasten von Blatt Aspiration. Klicken Sie hier, um Film anzusehen .
Diskussion
Das Verfahren in diesem Manuskript vorgelegt bietet eine schnelle und kostengünstigere Alternative zu eliminieren Fibroblasten-Feeder-Zellen aus menschlichen embryonalen Zellkulturen. Die erfolgreiche Entfernung von Fibroblasten ist abhängig vom Vorhandensein eines dicht konfluente Monoschicht von diesen Zellen, die in mehr Stammzellkulturen entwickelt. Nach 7-10 Tagen werden die wachsenden hESC Kolonien den Feeder-Fibroblasten in einer Richtung nach außen zu drücken, erzeugen ein immer dichter werdendes Fibroblasten Monoschicht zwischen Kolonien. Die starke Zell-zu-Zell-Anlagen innerhalb der Fibroblasten Monoschicht ermöglichen die schnelle Entfernung als eine Zellschicht. Es sollte sorgfältig darauf hingewiesen, dass diese Reinigungsmethode für die Verwendung als ein Verfahren zum Entfernen von MEF hESC vor den Experimenten nur und nicht für die Routine Expansionskultur verwendet wird vorgeschlagen.
Es ist auch möglich, diese Reinigungsmethode nutzen zu schlechter Qualität Stammzellenkolonien retten. Eine hohe Qualität hESC Kolonie sollte zeigen distiNCT Grenzen zwischen sich und den Feeder-Zellen. Wenn jedoch haben die Stammzellenkolonien partielle Differenzierung unterzogen, aufweisend weniger gut definierte Ränder Kolonie, dann ist dieses Verfahren auch eingesetzt werden, um die teilweise differenzierten hESC Kolonien zusammen mit der MEF Zellschicht zu entfernen, jedoch physikalische Trennung von HES Kolonien mit a Pipettenspitze notwendig sein könnte, um alle hESC Verbindungen mit den unerwünschten differenzierten Zellen oder MEF trennen.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von einem New Faculty Award II vom California Institute of Regenerative Medicine (RN2-00921-1) und einer NIH-finanzierten National Research Award (F32-HL104924) finanziert
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| DDR2 | Santa Cruz | 7555 | Fibroblast Marker |
| Dapi | Calbiochem | 268298 | Zellkern Marker |
| SSEA-4 | Millipore | MAB4304 | Menschliche ESC Marker |
| Oct 3/4 | Santa Cruz | 9081 | Menschliche ESC Marker |
| Flk-1 | BD Pharma | 555307 | Frühe Differenzierung Marker |
| Tra-1-81 | Acris | AM20377AF4-S | Menschliche ESC Marker |
Tabelle 1. Tabelle spezifischer reagents verwendet für die Immunfärbung die hESC.
Referenzen
- Bongso, A., Fong, C. Y., Ng, S. C., Ratnam, S. Isolation and culture of inner cell mass cells from human blastocysts. Hum. Reprod. 9, 2110-2117 (1994).
- Reubinoff, B. E., Pera, M. F., Fong, C. Y., Trounson, A., Bongso, A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat. Biotechnol. 18, 399-404 (2000).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Thomas, R. J. Automated, scalable culture of human embryonic stem cells in feeder-free conditions. Biotechnol Bioeng. 102, 1636-1644 (2009).
- Kolhar, P., Kotamraju, V. R., Hikita, S. T., Clegg, D. O., Ruoslahti, E. Synthetic surfaces for human embryonic stem cell culture. J. Biotechnol. 146, 143-146 (2010).
- Hovatta, O. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Hum. Reprod. 18, 1404-1409 (2003).
- McKay, T. R. Human feeder cell line for derivation and culture of hESc/hiPSc. Stem Cell Res. 7, 154-162 (2011).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Stein, G. S. Thawing, Seeding, and Changing Medium of Human Embryonic Stem Cells. Shi, M. J., Stencel, K., Borowski, M. , John Wiley & Sons, Inc. (2010).
- Schwartz, P. H., Brick, D. J., Nethercott, H. E., Stover, A. E. Traditional human embryonic stem cell culture. Methods Mol. Biol. 767, 107-123 Forthcoming.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten