Method Article
Аналитические методы пробирного азотной окиси биоактивность
В этой статье
Резюме
Эндогенного оксида азота (NO), который регулирует широкий спектр биологических функций. Становится все более очевидным, что нарушение или нарушение регуляции NO на основе сигнализации участвует во многих заболеваний человека. Методы количественного соответствующих метаболитов NO может обеспечить новых диагностических и прогностических биомаркеров для человека заболеваний.
Аннотация
Nitric oxide (NO) is a diatomic free radical that is extremely short lived in biological systems (less than 1 second in circulating blood)1. NO may be considered one of the most important signaling molecules produced in our body, regulating essential functions including but not limited to regulation of blood pressure, immune response and neural communication. Therefore its accurate detection and quantification in biological matrices is critical to understanding the role of NO in health and disease. With such a short physiological half life of NO, alternative strategies for the detection of reaction products of NO biochemistry have been developed. The quantification of relevant NO metabolites in multiple biological compartments provides valuable information with regards to in vivo NO production, bioavailability and metabolism. Simply sampling a single compartment such as blood or plasma may not always provide an accurate assessment of whole body NO status, particularly in tissues. The ability to compare blood with select tissues in experimental animals will help bridge the gap between basic science and clinical medicine as far as diagnostic and prognostic utility of NO biomarkers in health and disease. Therefore, extrapolation of plasma or blood NO status to specific tissues of interest is no longer a valid approach. As a result, methods continue to be developed and validated which allow the detection and quantification of NO and NO-related products/metabolites in multiple compartments of experimental animals in vivo. The established paradigm of NO biochemistry from production by NO synthases to activation of soluble guanylyl cyclase (sGC) to eventual oxidation to nitrite (NO2-) and nitrate (NO3-) may only represent part of NO's effects in vivo. The interaction of NO and NO-derived metabolites with protein thiols, secondary amines, and metals to form S-nitrosothiols (RSNOs), N-nitrosamines (RNNOs), and nitrosyl-heme respectively represent cGMP-independent effects of NO and are likely just as important physiologically as activation of sGC by NO. A true understanding of NO in physiology is derived from in vivo experiments sampling multiple compartments simultaneously. Nitric oxide (NO) methodology is a complex and often confusing science and the focus of many debates and discussion concerning NO biochemistry. The elucidation of new mechanisms and signaling pathways involving NO hinges on our ability to specifically, selectively and sensitively detect and quantify NO and all relevant NO products and metabolites in complex biological matrices. Here, we present a method for the rapid and sensitive analysis of nitrite and nitrate by HPLC as well as detection of free NO in biological samples using in vitro ozone based chemiluminescence with chemical derivitazation to determine molecular source of NO as well as ex vivo with organ bath myography.
протокол
1. Всего для сбора крови
- Соберите венозной крови от человека или от экспериментальных животных в NEM / ЭДТА содержащих труб.
- Сразу спином вниз крови в настольных центрифуг на 14300 RCF (относительно центробежных сил) в течение 7 минут, чтобы подготовиться плазмы и красных клеток крови гранул.
- Подготовить образцы плазмы для высокоэффективной жидкостной хроматографии (ВЭЖХ) и обнаружения хемилюминесценции (CLD) анализа.
ВЭЖХ: Добавить 1:1 по объему холодного метанола в плазме, вихрь и центрифуги в 13 200 оборотов в минуту в течение 10 минут с белками плазмы осадок. Соберите супернатант для анализа ВЭЖХ.
CLD: аликвоту образца и preincubate с сульфаниламидных и сулемы специально нитрозотиолы анализа. - Подготовить красный осадок клеток для высокоэффективной жидкостной хроматографии и CLD анализа.
ВЭЖХ: Добавить 1:04 красный осадок клеток в гипотонический раствор лизиса, содержащего 10 мМ NEM, 2,5 мМ EDTA и 10 мМ феррицианида. Vortex тщательно, а затем добавить 1:01 метанол, вихревые и centrifЕГЭ в 13 200 оборотов в минуту в течение 10 минут для осаждения белков. Соберите супернатант для анализа ВЭЖХ.
ХЗЛ. Добавить 1:04 красный осадок клеток в гипотонический раствор лизиса, содержащего 10 мМ ЭДТА, 2,5 мМ EDTA и 10 мМ феррицианида. Алиготе образцов пробирки, содержащие сульфаниламиды и хлорид ртути для конкретных обнаружения нитрозотиолы.
2. Добыча и подготовка ткани
- Чтобы определить, ткань уровня метаболитов NO, в первую очередь необходимо собрать кровь бесплатно ткани для подготовки проб, как описано выше. Полный обмен крови будет проходить путем инфузии физиологического буфера через верхушки левого желудочка. Когда вся кровь удаляется, ткани интерес может быть собрано.
- Однородный образцы тканей и подготовки образцов, как описано выше для высокоэффективной жидкостной хроматографии и CLD анализа.
3. Аортального кольца изоляции для функции эндотелия
Ванна тканей органов
- Мыши будут ANESThetized с диэтиловый эфир, пока не реагирует на носу щепотку, и пройти шейки дислокации до операции. Торакотомия выполнена, чтобы подвергать грудной и брюшной аорты. 25 калибровочного шприца вводится в верхушке левого желудочка и перфузию бесплатно кровь с кислородом буфера Кребса Хенселейта.
- Правое предсердие режется обеспечить выход крови. Брюшной аорты, будут удалены и очищены от адвентиции.
- Кольца будут сокращены на 2 мм в длину сегментов и установлена на четырех каналов ткани ванночку (DMT 720MO, AD Instruments) купались в физиологическом растворе буфера.
- Судно кольца ведутся в 10-мл ванны орган с кислородом Кребса буфера (95% O 2 и 5% CO 2) при температуре 37 ° C. Один грамм претензии помещается на каждом аортального кольца (соответствующие исходные напряжение для оптимальной вазомоторной функции, которые определены в предыдущих экспериментах). Восьмиканальный восьмеричное моста (PowerLab) и сбора данных программное обеспечение (график версии 5.2.2)повторно используется для записи всех сил измерений.
- Кольца имеют право равновесие в течение 80 минут с буфером в каждом органе ванну менять каждые 20 мин. После уравновешивания в течение 80 мин, 1 мкМ фенилэфрин добавляется к каждому кольцо для субмаксимальной сокращения.
- После стабилизации состояния эндотелия агонистов, таких как ацетилхолин будет добавлено определение NO производства и степени судно релаксации. После того, как доза ответ на ацетилхолин, бани будет промыть и recontracted, а затем обрабатывают экзогенный источник оксида азота, натрия нитропруссид, чтобы определить чувствительность гладкой мускулатуры и, чтобы получить значение для 100% отдыха.
- НЕТ мусорщиков можно добавить в ванну, чтобы наглядно иллюстрируют освобождение NO и торможения судна релаксации.
4. Представитель Результаты
Использование ENO-20 выделенных ВЭЖХ обеспечивает простой в использовании метод высокой пропускной способности для специфичностью и чувствительностью обнаружения нитритов и нитратов вбиологической матрицы. Принцип обнаружения и оригинальные хроматограмм показано на рисунке 1. Этот метод может быть использован для любых биологических образцов для определения нитритов и нитратов. СТО на основе обнаружения метаболитов NO требует шаг химических derivitization для определения молекулярной источника NO. Экспериментальная установка для одновременного окислительной и восстановительной denitrosation denitrosation для хемилюминесценции детектора показана на рисунке 2. Реакционного сосуда справа заполнен 800 феррицианида в ФСБ рН 7,4 и реакционный сосуд на левой наполнен йодида калия / йода в смеси уксусной кислоты для уменьшения denitrosation (рис. 2A). Весь установки показана на рисунке 2Б. На рисунке 3 показаны группы специфических анализов denitrosation, которые могут обнаружить и количественно нитриты, нитрозотиолы, нитрозамины, а также нитрозильных продукции гема. Этот метод был ранее ОПИСАНИЕкровать и утверждены 4,5. Эти важные биохимические анализы могут быть легко связаны с функциональной исследования на изолированных кольца аорты, чтобы определить эндотелиальной NO производства в экспериментальных животных. Это классический фармакологического эксперимента можно легко и точно оценить эндотелиальной функции и производства. Измерение судно реактивность эндотелия агонистов, таких как ацетилхолин может непосредственно определить эндотелиальной NO производства, которые могут быть связаны с биохимическими биомаркеры обнаружен в крови и ткани экспериментальных животных. Типичное представление дозы ответ на ацетилхолин показано на рисунке 4. Здоровый контрольных мышей с нормальной функции эндотелия ответ на ацетилхолин, расслабляя. Мыши с эндотелиальной дисфункцией (гиперхолестеринемией мышей) показывают снижение релаксации в связи с сокращением производства NO на тот же раздражитель.
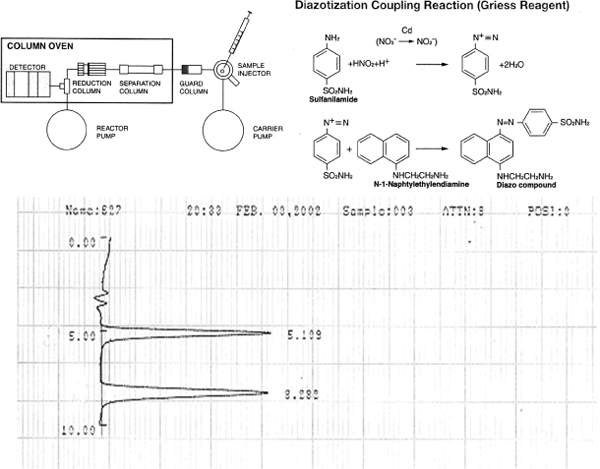
Инжиррисунке 1. Принцип обнаружения нитритов и нитратов ENO-20 и пример хроматограммы. (Вверху) Схема ENO-20 методом обнаружения нитритов и нитратов. (Внизу) Стандартный chromotogram 10 пмоль нитрит и нитрат вводили в ENO-20 (100 мкл 100 нМ решения нитриты и нитраты). Чувствительность 1 нМ для каждого аниона с 100 мкл инъекции. Никакого вмешательства с белком или цветных видов.

Рисунок 2. CLD экспериментальной установки с использованием как окислительный denitrosation феррицианидом и восстановительной denitrosation использованием йодида / йода с анализа газовой фазы обнаружения очищены азотной газа азота.

Рисунок 3. (Группа А) Хемилюминесценция обнаружения нитрит, RSNO, RNNO в восстановительной анализа denitrosation по образцу инкубации с группой конкретных химикодр. реагентов. Вычитание площади пика позволяют выявлять нитритов и RSNOs. (Группа B) Хемилюминесцентные обнаружения нитрозильных видов гема использованием окислительного решение denitrosation феррицианида. Этот способ можно использовать для NO-гем продуктов без перекрестной реактивности с RSNOs (GSNO или SNO-альбумин), или RNNO (NO-пирролидина и N-нитрозо-альбумин).

Рисунок 4. Ex естественных ванночку на изолированных кольца аорты представляет собой прямую меру эндотелиальной NO производства, которые могут быть связаны с биохимическими биомаркеры обнаружен с помощью ВЭЖХ и СТО. Эта цифра показывает, уменьшить отдых у мышей с эндотелиальной дисфункцией вследствие снижения NO производства.
Обсуждение
Методы, описанные здесь, для количественной оценки соответствующих метаболитов NO в различных биологических отделений позволит отпечатков пальцев НЕТ биологии в здоровье и болезни, которые могут быть связаны с функциональными измерения NO в эндотелии. Эти методы требуют простого приготовления образцов с потенциалом для адаптации к высокой пропускной способности. Относительные количества этих молекул может помочь понять, производство NO и его метаболической судьбы в ряде экспериментальных моделей заболеваний и даже серийные образцы от человека больным. Есть много подводных камней в обнаружении NO биомаркеров и многие аналитические методы искусственно производить некоторые из этих продуктов во время подготовки образца. Тщательный учет нитритов в биологических образцах является критическим из-за его реакции с цистеином тиолов 6 и искусственной формирования нитрозотиолы 7. CLD методологий для конкретного обнаружения нитритов в анаэробных условиях, привести вустойчивые результаты в связи с активностью специфических ферментов редуктазы нитритов в различных биологических отсеков 8. Все методы, описанные здесь, хорошо известны и проверены и принимать во внимание меры для устранения или уменьшения артефактов 9. Мы опишем основные меры, необходимые для предотвращения артефактов. Это мульти-купе скрининга НЕТ метаболитов поможет в выявлении соответствующих биомаркеров, которые могут иметь диагностическое и прогностическое утилита для человека и будет предусматривать разработку стандартных методов, которые могут быть использованы в клинике или для стандартного лабораторного анализа. Недавнее признание человеческого круговорота азота, которым нитратов и нитритов сводится к NO от enterosalivary обращение нитрата 10,11 в настоящее время открывает возможность использования слюны в качестве потенциального биомаркера НЕТ статуса в некоторых заболеваний. На сегодняшний день никакого статуса не входит в стандартный анализ крови на постоянной основе использовать в диагностических целях у пациентов. ThЭто является шокирует, учитывая критический характер NO многие процессы болезни. В конечном итоге, определение уровня этих биомаркеров, связанных НЕТ легким в использовании и, возможно быстрое тумбочки точка-в-санитарной анализов после соответствующей проверки будет реальным свидетельством их роль в молекулярной медицине. Целесообразно на данном этапе для концентрированных и совместных усилий в этой области, чтобы проверить и разработать стандарт и точный анализ для определения НЕТ статуса в моделях на животных для проверки на людях. Методы, описанные в данном протоколе позволит другим быстро принять консенсусом метод для таких измерений.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Гонконге Цзянь, к.т.н. и Дипа Parathasarthy, MPH, BDS за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| N-этилмалеимид | Thermo Scientific | 23030 | |
| ЭДТА | Sigma-Aldrich | E7889 | |
| Калий феррицианида | Fluka | 60299 | |
| ВЭЖХ | Eicom Corp | ENO-20 | |
| Автоматический пробоотборник | Олкотт | ||
| DMT миографа | AD инструменты | ||
| PowerLab | AD инструменты | ||
| Хемилюминесцентные | EcoPhysics | CLD 88Y | |
| Центрифугировать | Эппендорф | 5415D | |
| Ацетилхолин | Sigma-Aldrich | A6625 | |
| R-(-) Фенилэфрин | Sigma-Aldrich | P6126 |
Ссылки
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411, 273-289 (1999).
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetycholine. Nature. 288, 373-376 (1980).
- Ignarro, L. J. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proc. Natl. Acad Sci. U.S.A. 84, 9265-9269 (1987).
- Feelisch, M. Concomitant S-, N-, and heme-nitrosylation in biological tissues and fluids: implications for the fate of NO in vivo. FASEB J. 16, 1775-1785 (2002).
- Wang, X. Measurement of nitric oxide levels in the red cell: validation of tri-iodide-based chemiluminescence with acid-sulfanilamide pretreatment. J. Biol. Chem. 281, 26994-27002 (2006).
- Angelo, M., Singel, D. J., Stamler, J. S. An S-nitrosothiol (SNO) synthase function of hemoglobin that utilizes nitrite as a substrate. Proc. Natl. Acad. Sci. U.S.A. 103, 8366-8371 (2006).
- Bryan, N. S. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10, 221-228 (2004).
- Feelisch, M. Tissue Processing of Nitrite in Hypoxia: An Intricate Interplay of Nitric Oxide-Generating and -Scavenging Systems. J. Biol. Chem. 283, 33927-33934 (2008).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radic. Biol. Med. 43, 645-657 (2007).
- Lundberg, J. O., Weitzberg, E. NO generation from inorganic nitrate and nitrite: Role in physiology, nutrition and therapeutics. Arch. Pharm. Res. 32, 1119-1126 (2009).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat. Rev. Drug. Discov. 7, 156-157 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены