Method Article
В пробирке Ассамблеи Semi-искусственные молекулярные машины и его использование для обнаружения повреждений ДНК
В этой статье
Резюме
Мы демонстрируем сборки и применения молекулярного масштаба устройство питается от топоизомеразы белка. Конструкция био-молекулярных датчиков, какие метки два основных типа разрывов ДНК в срезах тканей путем присоединения двух различных флуорофоров в их конец.
Аннотация
Naturally occurring bio-molecular machines work in every living cell and display a variety of designs 1-6. Yet the development of artificial molecular machines centers on devices capable of directional motion, i.e. molecular motors, and on their scaled-down mechanical parts (wheels, axels, pendants etc) 7-9. This imitates the macro-machines, even though the physical properties essential for these devices, such as inertia and momentum conservation, are not usable in the nanoworld environments 10. Alternative designs, which do not follow the mechanical macromachines schemes and use mechanisms developed in the evolution of biological molecules, can take advantage of the specific conditions of the nanoworld. Besides, adapting actual biological molecules for the purposes of nano-design reduces potential dangers the nanotechnology products may pose. Here we demonstrate the assembly and application of one such bio-enabled construct, a semi-artificial molecular device which combines a naturally-occurring molecular machine with artificial components. From the enzymology point of view, our construct is a designer fluorescent enzyme-substrate complex put together to perform a specific useful function. This assembly is by definition a molecular machine, as it contains one 12. Yet, its integration with the engineered part - fluorescent dual hairpin - re-directs it to a new task of labeling DNA damage12.
Our construct assembles out of a 32-mer DNA and an enzyme vaccinia topoisomerase I (VACC TOPO). The machine then uses its own material to fabricate two fluorescently labeled detector units (Figure 1). One of the units (green fluorescence) carries VACC TOPO covalently attached to its 3'end and another unit (red fluorescence) is a free hairpin with a terminal 3'OH. The units are short-lived and quickly reassemble back into the original construct, which subsequently recleaves. In the absence of DNA breaks these two units continuously separate and religate in a cyclic manner. In tissue sections with DNA damage, the topoisomerase-carrying detector unit selectively attaches to blunt-ended DNA breaks with 5'OH (DNase II-type breaks)11,12, fluorescently labeling them. The second, enzyme-free hairpin formed after oligonucleotide cleavage, will ligate to a 5'PO4 blunt-ended break (DNase I-type breaks)11,12, if T4 DNA ligase is present in the solution 13,14 . When T4 DNA ligase is added to a tissue section or a solution containing DNA with 5'PO4 blunt-ended breaks, the ligase reacts with 5'PO4 DNA ends, forming semi-stable enzyme-DNA complexes. The blunt ended hairpins will interact with these complexes releasing ligase and covalently linking hairpins to DNA, thus labeling 5'PO4 blunt-ended DNA breaks.
This development exemplifies a new practical approach to the design of molecular machines and provides a useful sensor for detection of apoptosis and DNA damage in fixed cells and tissues.
протокол
Разделы для молекулярной машины основе обнаружения должен быть подготовлен, так как их подготовка занимает больше времени, чем сборка молекулярные устройства. Построить хорошо работает с 5-6 мкм толщиной разделы, вырезанные из параформальдегида-фиксированных, парафин блоков ткани. Использование слайд брендов, которые сохраняют разделы, например, такие как ProbeOn Плюс заряжать и precleaned слайдов (Fisher Scientific) или аналогичный. Мы рекомендуем при первом использовании ткани с хорошо известной модели повреждений ДНК, которая содержит как ДНКазы I-и II-ДНКазы типа разрывов, такие как дексаметазон обработанных апоптоза крысы тимуса 13,14.
1. Подготовка разделов
- Место секций в стойку слайдов и депарафинизировать в ксилоле в течение 15 мин, трансфер в свежей ванне ксилол для дополнительных 5 минут.
- Увлажняет, проходя через градуированные концентрации этанола: 96% этанол-2x5min; 80% этанола - 5 минут, вода - 2x5 мин.
- Дайджест раздела ProteinasИспользование электронной К. 100 мкл 50μg/mL раствора на секции. Инкубировать 15 'при комнатной температуре (23 ° С) во влажной камере. Время, возможно, потребуется корректировка в зависимости от типа ткани. Жесткий тканей может потребоваться больше пищеварения. Времена 15-25 мин, как правило, используется. Недостаточность пищеварения, может привести к более слабым сигналом. Избытком, с другой стороны результаты в исчезновении сигнала и раздел разрушения.
- Промыть в дистиллированной воде в течение 2х10 мин.
- Применить 100 мкл на раздел 2% БСА для preblocking. Инкубируйте в течение 15 мин при комнатной температуре (23 ° С). За это время собирать молекулярные машины.
2. Молекулярная сборка машин
Все реагенты масштабируются на 25 мкл общего объема, что достаточно для одной обнаружения в среднем срез ткани размера (10x10 мм). Объем может быть расширен по мере необходимости.
- Комбинат в небольшой пластиковой трубки в таком порядке:
|
- Осторожно перемешать с помощью пипетки. Молекулярной построить почти мгновенно самостоятельно собирает в этом растворе и может быть использован сразу при комнатной температуре (23 ° С). Повышение температуры до 37 ° C блоков Т4 ДНК-лигазы-компоненте маркировки.
3. Использование молекулярных машин, в срезах тканей двойного 5'OH этикетки и 5'PO4 разрывов ДНК
- Аспирируйте preblocking решение и применить 25 мкл полной смеси реакции, содержащие 70 пмоль олигонуклеотидных 1, 53 - 215 пмоль (1,76 - 7,1 мкг) VACCTOPO и 10 единиц T4 ДНК-лигазы (500 Ед / мл) в растворе из 66 мМ Трис-HCl, рН 7,5, 5 мМ MgCl 2, 0,1 ммоль dithioerythritol, 1 мМ АТФ, а 15% полиэтиленгликоля-8000. Же олигонуклеотидных последовательностей проведения одного FITC этикетки, олигонуклеотидов 2, может быть использован вместо для обнаружения одного типа разрывов ДНК. В таком случае опустить лигазы от маркировки реакции. Кроме того, в этой ситуации решение 50 мМ Трис-HCl, рН 7,4, 15% ПЭГ-8000 может быть использован вместо Т4 ДНК-лигазы буфера.
- Выдержите в течение 1 часа при комнатной температуре (23 ° С) во влажной камере с пластиковыми покровным. Защищать от света. Понижение температуры до 16 ° C снижает лигазы основе сигнала, повышение температуры до 37 ° C полностью исключает лигазы основе сигнала. Частичное торможение лигазы иногда происходит в реакционную смесь, возможно, из-за загрязнения введена топоизомеразы препаратов. Таким образом, больше инкубационный (2-4 часов) может потребоваться особенно, когда сignificant числа лигазы меченных перерывы присутствуют. Хотя оба лигазы и топологический сигналы можно наблюдать на данном этапе, во многих случаях лигазы сигнал может быть дополнена путем повторного применения реакционной смеси без VACC TOPO и двойного меченых олигонуклеотидов, но содержащие шпильки формы олигонуклеотида (олигонуклеотидов 3) (35 мг / мл) и T4 ДНК-лигазы (250 ЕД / мл). Для усиления сигнала перейдите к шагу 3, чтобы увидеть реакцию без повышения перейдите к шагу 5.
- Удалить покровные, осторожно погружая слайды вертикально в банку Коплин содержащих воду при комнатной температуре. Аспирируйте лишнюю воду.
- Повышение лигазы сигнала с применением 25 мкл реакционной смеси без VACC TOPO и олигонуклеотида 1, но содержащих олигонуклеотидов 3: 66 мм-Tris HCl, рН 7,5, 5 мМ MgCl 2, 0,1 ммоль dithioerythritol, 1 мМ АТФ, а 15% полиэтиленгликоля- 8000, 5 единиц T4 ДНК-лигазы, 35 мг / мл олигонуклеотидов 3 (тупыми концами шпильки). Общий объем решение маркировки окн быть расширены для размещения больших разделов. Инкубируйте в течение 18 часов (на ночь) при комнатной температуре (23 ° С) во влажной камере с пластиковыми покровным.
- Удалить покровные, осторожно погружая слайды вертикально в Коплин сосуд, содержащий воду при комнатной температуре. Затем промыть разделе 3х10 мин в дистиллированной воде.
- Промыть натрия бикарбоната буфера. Щелочной раствор полоскания улучшает FITC флуоресценции, которая рН чувствительной и значительно снижается ниже рН 7.
- Защитный кожух с antifading решение (Vectashield с DAPI), покровное и анализа сигнала с помощью флуоресцентного микроскопа. Дважды цепи ДНК порывает с 5'OH будут светиться зеленым, 5'PO 4 отдых - будут светиться красным (рис. 2).
4. Представитель Результаты
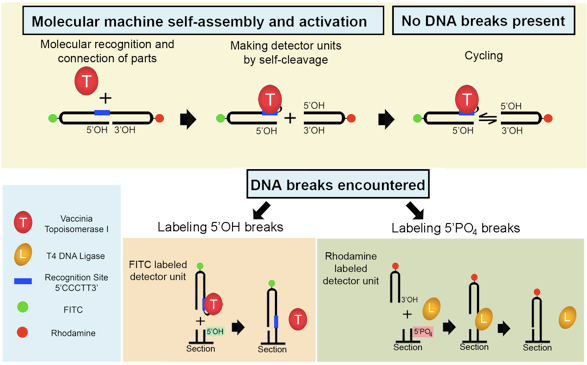
Рисунок 1. Полу-искусственные молекулярные машины определяет два типаПовреждение ДНК на месте. Флуоресцентные машины самостоятельно собирает, когда VACC ТОПО связывается с двойным шпильки 32-Мер. Машина начинает работать, разделив себя на два блока детекторов с помощью топоизомеразы производства сократить на конец 3 'узнаваемой последовательности. Это приводит к циклическим процессом, в котором FITC-меченого единица непрерывно разделяет и religates обратно родамин-меченого единицы. Это сохраняется до перерыва обнаружить ДНК встречается. Когда такой альтернативный акцептор (5'OH тупым разрыв ДНК конца) присутствует в тканях разделе FITC часть будет перевязывать к нему. Остальные родамина часть будет приложить к 5 'PO 4 ДНК тупой конец перерывы с помощью T4 ДНК-лигазы. Следовательно, оба типа разрывов ДНК одновременно обнаружено.
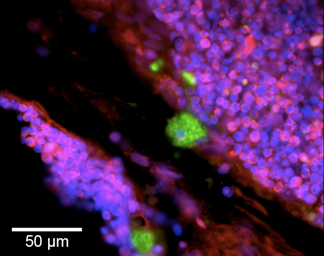
Рисунок 2. Молекулярная машина двойного этикетки двух типов разрывов ДНКв срез ткани дексаметазона обработанных тимуса. Блант состава ДНК разрывы ДНКазы I-и II-ДНКазы типа обнаружены в областях коры тимуса апоптоза. Зеленый цитоплазматических флуоресценции (5'OH разрывов ДНК) знаменует корковых макрофаги переваривают ядерный материал апоптоза тимоцитов. Этот сигнал вырабатывается VACC TOPO и локализуется в phagolysosomes с ДНК, содержащей 5'OH двунитевых разрывов 11,12. Красный флуоресценции (5'PO 4 перерывами) этикетки ядер апоптоза тимоцитов не охвачен макрофагов. Массивные числа тимоцитов одновременно подвергаются апоптозу сопровождается генерацией 5'PO 4 двунитевых разрывов, визуализируются с помощью лигазы основе маркировки. Эти разрывы находятся на периферии ядра, образуя кольцевые узоры. Все клеточных ядер визуализируются на counterstaining с DAPI (синий флуоресценции).
Обсуждение
В этом видео показано, как собрать и использовать двойной маркировки повреждений ДНК датчика. Датчик молекулярная машина управляется био-молекулярных двигателей, вирус-закодированного белка VACC ТОПО связаны с искусственным компонентов. Представлен пример развития био-включен подход, сторонники адаптации биологических структур, архитектуры и фактической части и компоненты клеток к дизайну нетоксичных молекулярных устройств масштаба 12,15. Такой подход решает две проблемы присущи области в естественных условиях наносенсоров: 1. трудности создания действительно единообразного и воспроизводимые нано-конструкций с помощью традиционных наноматериалов; и 2. потенциальной токсичности и высокой биологической реактивности нанозонды, частиц и другие высоко-дисперсных наноматериалов. Датчик объединяет естественные молекулярные машины с искусственными компонентами, которые перенаправляют его на новую функцию ДНК маркировки повреждений. Продукт такой интеграции является таковойМи-искусственные молекулярные машины, ориентированные на новые задачи. Хотя топоизомераз, полимеразы и других ферментных машины часто используется в биохимических исследованиях, они не интегрированы с инженерных приборов в отдельных молекулярных ансамблей. Следовательно, в их повседневного использования, они не используются в качестве полу-искусственные устройства 12.
Здесь мы покажем, как использовать датчик в формате срез ткани для одновременной маркировки ДНКазы I-и II-ДНКазы типа перерывов. Настоящее Есть никаких других методов, доступных для выполнения таких одновременных двойных обнаружения.
ДНКазы I-и II-ДНКазы типа перерывы важных маркеров клеточного смерти, в частности, маркировка апоптоза самостоятельной автономной и фагоцитарной фазы 11,16. Датчик полезным дополнением к арсеналу биомедицинских исследований, касающихся обнаружения и детальную характеристику апоптоза.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было поддержано грантом R01NS062842 из Национального института неврологических расстройств и инсульта, Национальные институты здравоохранения (ВСД) и грантами R21 NS064403 из Национального института неврологических расстройств и инсульта, Национальные институты здравоохранения через ARRA (ВСД) и R21 EB006301 Национального Института биомедицинской визуализации и биоинженерии, Национальные институты здравоохранения (ВСД).
Материалы
- Ксилол
- 80 и 96% этанола.
- 2% раствор бычьего сывороточного альбумина (БСА) в дистиллированной воде.
- Олигонуклеотидов 1: дважды шпильки, двойные помечены флуоресцеина и tetramethylrhodamine:
5'-AAG GGA CCT GC F GCA ГГТ CCC TTA АЧГ КПП R AT GCG ТТ-3 ', F - FITC-DT; R - Tetramethylrhodamine-дТ. Другие красное смещение флуорофоров, таких как BODIPY TR, родамин или TAMRA может быть использован вместо tetramethylrhodamine как R.
Также вы можете использовать олигонуклеотидов 2 -. Дважды одну шпильку помечены флуоресцеина (для выявления одного типа разрывов ДНК (ДНКазы II типа только) одного флуорофора несущих зонда значительно дешевле, и удобно, когда одна тип ДНК перерыв, подлежащих маркировке: 5'-AAG GGA CCT GC F GCA ГГТ CCC TTA АЧГ CAT ATG ВКТ Т-3 ', F - FITC-дТ
- Олигонуклеотидов 3. Блант состава родамин-меченого шпильки для повышения сигнала на месте перевязки с T4 ДНК-лигазы: 5'-GCG CTA GAC C R G GTC TAG CGC-3 ', R - Tetramethylrhodamine-дТ
- Vaccinia ДНК топоизомеразы л (VACC ТОПО) - 3000 ед / мкл (Vivid Technologies). В первых экспериментах мы использовали 215 пмоль (7,1 мкг) VACC TOPO на каждые 25 мкл реакционной смеси. Тем не менее, топоизомеразы концентрация может быть значительно уменьшена без потери чувствительности. Позже мы использовали четыре раза меньшее количество VACC TOPO в разделе (1,76 мкг в 25 мкл реакционной смеси в каждой секции) с аналогичными результатами. Сокращение количества фермента до 880 нг (в 25 мкл реакционной смеси) привело к более слабым сигналом и 8,8 нг VACC ТОПО производится не обнаруживается сигнал.
- Т4 ДНК-лигазы 5 ед / мкл (Roche). Это высококонцентрированный лигазы подготовка дает лучший сигнал в наших экспериментальных условиях.
- 10 х реакционный буфер для T4 ДНК-лигазы: 660 мМ Трис-HCl, 50 мМ MgCl 2, 10 мМ dithioerythritol, 10 мМ АТФ, рН 7,5 (20 ° C) (Roche). АТФ в реакционном буфере, легко разрушается в повторяющихся циклов оттаивания-замерзания. Алиготе буфера в небольших 15-20 мкл порции и храните при температуре - 20 ° C. Использование один раз.
- 30% (вес / объем) раствора ПЭГ-8000 (Sigma) в бидистиллированной воде. 15% ПЭГ-8000 в реакционную смесь сильно стимулирует выявление, увеличение эффективной концентрации его составляющие по объему исключения.
- Протеиназы К (Roche) 20 мг / мл маточного раствора в дистиллированной воде. Хранить при температуре - 20 ° С. В реакции использовать 50мг/мл решение в PBS, приготовленные из запаса. Не используйте повторно.
- Vectashield с DAPI (Vector Laboratories).
- Бикарбонат натрия буфера: 50 М NaHCO 3, 15м М NaCl, рН 8,2.
- 22x22mm или 22x40mm стекла или пластика покровных. Пластиковые покровные предпочтительнее в ходе реакции, так как ониповторно легче удалить из раздела.
Ссылки
- Meacham, G. C., Patterson, C., Zhang, W., Younger, J. M., Cyr, D. M. Nature. Cell. Biol. 3, 100-105 (2001).
- Schuldt, A. Dynamic Pol expeditions. Nature. Cell. Biol. 4, E279-E279 (2002).
- Urry, D. W. Molecular machines: how motion and other functions of living organisms can result from reversible chemical changes. Angew. Chem. Int. Ed. Engl. 32, 819-841 (1993).
- Schneider, T. D. Theory of molecular machines I. Channel capacity of molecular machines. J. Theor. Biol. 148, 83-123 (1991).
- McClare, C. W. Chemical machines, Maxwell's demon and living organisms. J. Theor. Biol. 30, 1-34 (1971).
- Spirin, A. S. Ribosome as a molecular machine. FEBS Lett. 514, 2-10 (2002).
- Fabbrizzi, L., Foti, F., Licchelli, M., Maccarini, P. M., Sacchi, D., Zema, M. Light-emitting molecular machines: pH-induced intramolecular motions in a fluorescent nickel(II) scorpionate complex. Chemistry. 8, 4965-4972 (2002).
- Drexler, K. E. Nanosystems: Molecular Machinery, Manufacturing and Computation. , Wiley. New York. (1992).
- Freitas, R. A. Nanomedicine: basic capabilities. , Landes Bioscience. Austin. (1999).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31, 1106-1121 (2001).
- Minchew, C. L., Didenko, V. V. Fluorescent probes detecting the phagocytic phase of apoptosis: enzyme-substrate complexes of topoisomerase and DNA. Molecules. 16, 4599-4614 (2011).
- Didenko, V. V., Minchew, C. L., Shuman, S., Baskin, D. S. Semi-artificial fluorescent molecular machine for DNA damage detection. Nano. Letters. 4, 2461-2466 (2004).
- Didenko, V. V., Hornsby, P. J. Presence of double-strand breaks with single-base 3' overhangs in cells undergoing apoptosis but not necrosis. J. Cell Biol. 135, 1369-1376 (1996).
- Didenko, V. V., Tunstead, J. R., Hornsby, P. J. Biotin-labeled hairpin oligonucleotides. Probes to detect double-strand breaks in DNA in apoptotic cells. Am. J. Pathol. 152, 897-902 (1998).
- Jones, R. A. L. Soft Machines: Nanotechnology and life. , Oxford University Press. USA. (2007).
- Samejima, K., Earnshaw, W. C. Trashing the genome: Role of nucleases during apoptosis. Nat. Rev. Mol. Cell. Biol. 6, 677-688 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены