Eficiência da Extração Líquido-Líquido
Visão Geral
Fonte: Kerry M. Dooley e Michael G. Benton, Departamento de Engenharia Química, Louisiana State University, Baton Rouge, LA
Extração líquido-líquido (LLE) é uma técnica de separação usada em vez de destilação quando: (a) as volatilidades relativas dos compostos a serem separados são muito semelhantes; b Um ou mais dos componentes da mistura são sensíveis à temperatura mesmo perto das condições ambientais; c A destilação exigiria uma pressão muito baixa ou uma relação destilado/alimentação muito alta. 1 A força motriz para a transferência de massa é a diferença na solubilidade de um material (o soluto) em dois outros fluxos imiscíveis ou parcialmente misçáveis (a alimentação e o solvente). Os fluxos de ração e solvente são misturados e separados, permitindo que o soluto seja transferido da ração para o solvente. Normalmente, esse processo é repetido em etapas sucessivas usando fluxo de contra-corrente. O solvente rico em soluto é chamado de extrato à medida que sai, e a ração despoada é a raffinate. Quando há uma diferença de densidade razoável entre os fluxos de ração e solventes, a extração pode ser realizada usando uma coluna vertical, embora em outros casos uma série de tanques de mistura e assentamento possam ser usados.
Neste experimento, o objetivo operacional é extrair isopropanol (IPA, ~10 - 15 wt. %, o soluto) de uma mistura de hidrocarbonetos C8-to-C10 usando água pura como solvente. Uma coluna de extração do tipo York-Scheibel (misturadores verticais e coalesceres, uma cada por estágio físico) está disponível. Como a maioria dos extratores, a eficiência geral (número de estágios teóricos/estágios físicos) desta coluna é bastante baixa, especialmente em comparação com muitas colunas de destilação. As baixas eficiências surgem tanto da transferência lenta de massa (duas resistências líquidas em vez de uma como na destilação) quanto, muitas vezes, também da má distribuição das fases. O efeito da velocidade do agitador tanto na recuperação do soluto no extrato quanto na eficiência geral da coluna será avaliado.
Princípios
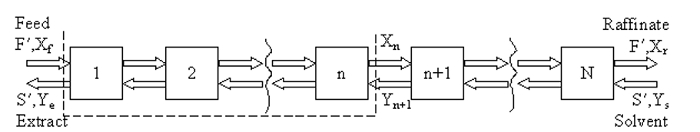
Ou o a) método McCabe-Thiele, ou b) um simulador de processo (por exemplo, ASPEN Plus, HYSYS, ChemSep) pode ser usado para estimar o número de estágios de equilíbrio (teórico). O método McCabe-Thiele é empregado sem solventes, o que significa que tanto as solubilidades do solvente no extrato quanto do composto diluído no raffinato são negligenciadas. Uma representação em estágio de extração líquido-líquido antiaúmente é mostrada na Figura 1, onde F' é a taxa de fluxo molar da ração (aproximadamente constante), S' é a taxa de fluxo molar de extrato (aproximadamente constante), Xf é a fração mole de soluto na ração,Y e é uma fração mole de soluto em solvente em fluxo extrato, e Xr é uma fração mole de soluto em diluído no fluxo raffinate.
Figura 1: Representação em estágio do processo de extração.
Em estado estável, um equilíbrio material no soluto entre a extremidade do feed da coluna e qualquer etapa, n (contorno pontilhado acima) leva à linha de operação:
 (1)
(1)
Em particular, a equação é satisfeita em ambas as extremidades da coluna, de modo que os pontos (Xf, Ye) e (Xr, Ys) estão na linha. Os dados de equilíbrio no apêndice podem ser usados em conjunto com esta equação (graficamente ou numericamente) para passar pela coluna.
Os simuladores de processo podem fazer cálculos estágio a estágio mais rigorosos, mas ainda assumindo estágios de equilíbrio. Os métodos NRTL ou UNIQUAC (ambos conjuntos de parâmetros no apêndice) podem ser usados para modelar a relação de equilíbrio. Note que a grande vantagem dos simuladores é que eles fazem dizer quanto solvente acaba no extrato e quanto diluído acaba no raffinate. Eles também podem dar as temperaturas de saída para uma coluna adiabática, ou o dever de calor necessário para manter a coluna isotérmica.
Um aparelho York-Scheibel é mostrado na Figura 2. O feed pode ser introduzido na parte inferior (11 estágios) ou no meio da coluna (6 estágios).

Figura 2: Aparelho de extração líquido-líquido York-Scheibel.
A unidade de extração consiste em uma coluna Pyrex de 2" i.D., com 11 estágios de extração, cada um consistindo de uma seção de mistura de uma polegada e uma seção de embalagem de malha de fio de quatro polegadas (coalescing). A coluna é mecanicamente agitada por agitadores tipo roda de remo (turbina Rushton). Um motor de velocidade variável, com um botão de controle e leitura digital no painel de controle, controla a velocidade do agitador. Rotametros nas entradas de ração e solvente são usados para medir essas taxas de fluxo. As taxas de fluxo do extrato e do raffinate podem ser medidas com um cilindro graduado e cronômetro.
As equações a seguir relacionam as leituras do rotametro às taxas de fluxo volumétrico (os fluxos também podem ser verificados com um cilindro graduado):
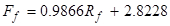 (2)
(2)
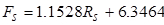 (3)
(3)
onde Ff é a taxa de fluxo de alimentação (~10 wt. % IPA) em mL/min,Rf é a leitura do rotametro de alimentação, F s é a taxade fluxo de solvente em ml/min, eRs é a leitura do rotametro solvente.
Procedimento
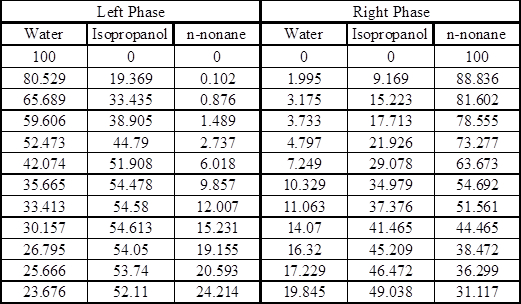
Neste experimento, as propriedades do n-nonane são uma boa aproximação às da mistura de hidrocarbonetos para fins de dados de equilíbrio. O sistema ternário água/isopropanol/n-nonane exibe o comportamento de equilíbrio tipo I (há alguma faixa de composição sobre qual divisão de fase não ocorrerá) à temperatura ambiente. Os dados de equilíbrio para este sistema podem ser encontrados no apêndice.
1. Operando a Coluna York-Scheibel
- Encha o extrator com mistura de hidrocarbonetos /Alimentação IPA (se necessário) e assobie ar da linha de alimentação. Desligue o fluxo de alimentação.
- Inicie a batedeira e mantenha a velocidade do agitador constante.
- Abra as válvulas de esfera solvente, ração, extrato e raffinate; e inicie o fluxo de solvente (água) para a coluna.
- Se não houver interface entre a entrada do solvente e a saída do raffina, deixe a fase dispersa subir e formar a interface superior.
- Quando a interface superior se formar, (re-)iniciar o fluxo de alimentação.
- Controle o nível da interface ajustando a altura do U invertido na linha extrato da parte inferior da torre. O ajuste de nível de interface superior (U invertido) é sensível. Movimentos de uma fração de polegada são muitas vezes suficientes.
- Verifique periodicamente o fluxo de raffinate para estado estável usando cromatografia a gás. O cromatógrafo a gás separará e quantificará os componentes da amostra.
- Use um hidrômetro para medir a gravidade específica do fluxo extrato e determinar a composição. (Isso também pode ajudar a confirmar que o estado estável foi atingido.) A composição do fluxo de extratos versus tabelas de gravidade específicas pode ser encontrada no Manual de Perry. 3 Esses dados podem ser usados para interpolar por cento do peso do IPA.
- Use um hidrômetro para medir a gravidade específica da alimentação e raffinate para uso em cálculos subsequentes.
2. Procedimento de desligamento
- Uma vez que os experimentos estejam concluídos, desligue o agitador e o interruptor de alimentação principal.
- Feche as válvulas de alimentação e bola de solvente, deixando a raffinate e extrai válvulas de esfera abertas.
Resultados
As figuras 3 e 4 mostram resultados quando tanto as taxas de agitação quanto de fluxo de alimentação foram variadas em uma ampla faixa. A eficiência geral e a recuperação aumentam antes de se tornarem assintotóticas, o que é bastante típico de extratores líquido-líquidos que não estão em ou perto de inundações. Em condições próximas de inundações, espera-se que a eficiência e a recuperação global diminuam drasticamente. Note que, ao contrário da destilação, as inundações podem ocorrer na extração líquido-líquido a altas taxas de solvente ou de alta alimentação (ou proporções). 1 Neste experimento, a fase orgânica mais leve é também a fase dispersa (gotícula), por isso, em altas taxas de alimentação, espera-se que as gotículas se coalescência antes das inundações, levando a taxas mais baixas de transferência de massa e, portanto, menores recuperações e eficiências. Em altas taxas de solvente as gotículas devem permanecer pequenas, por isso espera-se que a recuperação e eficiência permaneçam altas até muito perto do ponto de inundação.
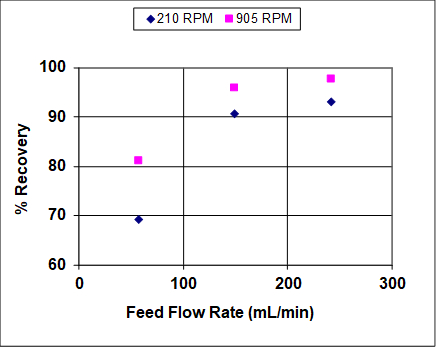
Figura 3: Recuperação percentual de IPA da mistura de hidrocarbonetos em água, para uma coluna York-Scheibel, 11 estágios, 16 - 18 mol% IPA em Isopar E (alimentação), S/F (molar) = 1,5.
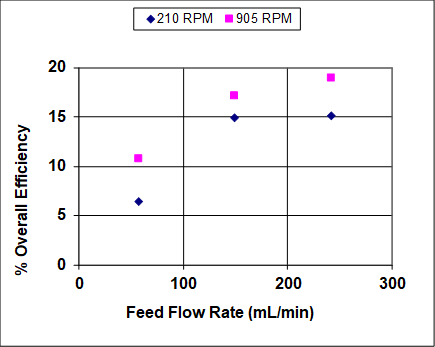
Figura 4: Eficiência total do estágio para extração de IPA usando uma coluna York-Scheibel, 11 estágios, 16 - 18 mol% IPA na mistura de hidrocarbonetos (alimentação), S/F (molar) = 1,5.
Como visto nos números 3 e 4, o aumento da taxa de agitação aumenta tanto a recuperação quanto a eficiência geral. Isso porque com maior entrada de energia as gotículas da fase dispersa são menores - a dependência observada é aproximadamente inversa em relação à velocidade do agitador. 4 O parâmetro "a" (área interfacial/volume total) que aparece em correlações de transferência de massa e equações fundamentais de fluxo de massa pode ser escrito da seguinte forma para gotículas esféricas de tamanho uniforme:
a = 6 ε/d (4)
onde ε é a fração de volume da fase dispersa. Embora ε possa aumentar com um aumento na velocidade superficial de qualquer fase, suas alterações geralmente são menos marcadas do que a mudança de diâmetro em relação à velocidade. Então (geralmente) quanto mais velocidade, mais área interfacial, levando a uma transferência de massa mais rápida.
A exceção à discussão acima está em velocidades muito altas, que não foram alcançadas nas Figs. 3 e 4, onde as duas fases são tão bem misturadas que, se a tensão interfacial entre elas for baixa, a emulsificação ocorrerá. A formação de uma emulsão impacta negativamente a recuperação e a eficiência porque as fases não podem mais se separar limpamente para subir ou descer para o próximo estágio físico. A emulsificação é um problema em muitas extrações líquido-líquidos e onde não pode ser limitada uma série de navios de batedeira e colonos em série é frequentemente preferido para projetos tipo coluna, como bandejas de peneira ou unidades York-Scheibel.
Aplicação e Resumo
A extração líquido-líquido (LLE) é uma alternativa à destilação que se baseia na imiscibilidade de solvente-alimentação (ou leve falta de compatibilidade) e coeficientes favoráveis de partição soluto para obter recuperações de solute elevados em uma fase solvente tão baixa quanto uma relação solvente/alimentação como prática. Embora a gama de fluxos (o "turndown") sobre o qual o LLE será eficaz seja muitas vezes limitada, e embora as eficiências de estágio sejam baixas, de modo que o equilíbrio de fase não seja atingido, certas misturas simplesmente não podem ser separadas usando outros métodos em um processo de contracorrente contínua. A análise matemática da operação de equilíbrio desses extratores segue um procedimento familiar do tipo McCabe-Thiele (embora o refluxo muitas vezes falte, portanto, apenas uma linha de operação). A análise de não-equilíbrio ("baseado em taxa") das LLEs é complexa e depende fortemente da velocidade relativa entre as duas fases (a "velocidade do deslizamento"), tamanho da bolha e fração de fase dispersa, tudo isso pode ser observado, mas são difíceis de prever.
Descrever perfeitamente a transferência hidráulica e de massa de um LLE típico está além da capacidade até mesmo dos simuladores de processo mais sofisticados, no momento. Portanto, o projeto de unidades industriais ainda depende da ampliação de unidades do tipo de planta-piloto, como a que foi testada neste experimento. Normalmente, o engenheiro tenta duplicar descritores-chave, como o parâmetro "a", a relação solvente/alimentação, entrada/volume total de energia do agitador, localização do feed e número de estágios físicos para manter a eficiência do estágio e a recuperação constante durante a escala. Mesmo assim, a escala é uma ciência inexata, e as impurezas, que alteram a tensão interfacial, podem impactar muito o desempenho de sistemas reais. Quanto mais fatores forem mantidos constantes, maior a probabilidade de a escala ser bem sucedida.
Existem muitos contatores LLE diferentes: uma série de misturadores - navios colonos, embalagens estruturadas semelhantes às usadas em absorventes e colunas de destilação, colunas de bandejas de peneira, contatores de disco rotativo (semelhantes ao York-Scheibel, mas com defletores em vez de malha), contatores Kuhni (uma combinação de bandejas de disco rotativo e peneiras) e contatores podbielniak ("Pods"), onde o fluxo é radial e força centrífuga é usado para melhorar a separação de fases líquidas. 5
Um exemplo clássico de LLE industrial é a separação do ácido acético da água usando éter etílico ou acetato etílico; 6 é preferido em vez de destilação em concentrações de ácido acético mais baixo. Possivelmente o maior volume do processo LLE é o de dessafação de propano, que é usado para refinar óleos lubrificantes em refinarias em condições quase supercríticas. 1 No entanto, a maioria das aplicações são encontradas na produção de produtos químicos especiais e em indústrias farmacêuticas, desde a extração de ácido cítrico a partir de caldo de fermentação até purificação de antibióticos e purificações proteicas. 1 Nestes casos, uma grande variedade de solventes orgânicos oxigenados ou sistemas aquosos de duas fases (com uma fase sendo principalmente água e a outra sais e polímeros aquosos) são utilizados. Para este último, um sistema típico de polímero é poli (etileno glicol)/dextran com NaCl e Na2SO4 como sais. As aplicações incluem separação de glóbulos vermelhos e extração da enzima fophofrtokinase de S. cerevisiae. 7
Apêndice – Dados de Equilíbrio8
Linhas de empate experimentais em Mole Percent a 25 °C
Parâmetros de modelo específicos em Kelvin
| UNIQUAC | NRTL (a = 0,2) | ||||
| Eu | J | AIJ | AJI | AIJ | AJI |
| 1 | 2 | -186.05 | 104.6 | 814.26 | -468.11 |
| 1 | 3 | 361.91 | 621.82 | 3151 | 1367.4 |
| 2 | 3 | -126.43 | 311.7 | 581.79 | -25.91 |
R1 = 0,92 R2 = 2,7792 R3 = 6,523
Q1 = 1,4 Q2 = 2,508 Q3 = 5.476
| Desvio Médio entre Calcule e Concentrações Experimentais em Mol. | |
| UNIQUAC (parâmetros específicos) | 1.4 |
| NRTL (parâmetros específicos) | 0.54 |
| UNIQUAC (parâmetros padrão) | 1.68 |
Referências
- T.C. Frank, L. Dahuron, B.S. Holden, W.D. Prince, A.F. Seibert and L.C. Wilson, Ch. 15 of “Chemical Engineers Handbook, 8th Edition”, R.H. Perry and D.W. Green, Eds., McGraw-Hill, New York, 2008.
- W.L. McCabe, J.C. Smith, and P. Harriott, “Unit Operations of Chemical Engineering”, 7th Ed., McGraw-Hill, New York, 2005, Ch. 23; C.J. Geankoplis, “Transport Processes and Unit Operations”, 3rd Ed., Prentice-Hall, Englewood Cliffs, 1993, Ch. 12; R.K. Sinnott, “Coulson and Richardson’s Chemical Engineering Vol. 6 – Chemical Engineering Design (4th ed.): http://app.knovel.com/hotlink/toc/id:kpCRCEVCE2/coulson-richardsons-chemical/coulson-richardsons-chemical
- B.E. Poling, G.H. Thomson, D.G. Friend, R.L. Rowley and W.V. Wilding, Ch.2 of “Chemical Engineers Handbook, 8th Edition”, R.H. Perry and D.W. Green, Eds., McGraw-Hill, New York, 2008.
- J.C. Godfrey, R. Reeve and F.I.N. Obi, Chem. Eng. Prog. Dec. 1989. pp. 61-69; I. Alatiqi, G. Aly, F. Mjalli and C.J. Mumford, Canad. J. Chem. Eng., 73, 523-533 (1995).
- http://www.pharmaceuticalonline.com/doc/podbielniak-contactor-a-unique-liquid-liquid-0003 (accessed 12/19/16).
- C.J. King, Ch. 18.5 of “Handbook of Solvent Extraction”, T.C. Lo, M.H.I Baird and C. Hanson, Eds., Wiley, New York, 1983.
- “Methods in Enzymology, Vol. 228, Aqueous Two-Phase Systems,” H. Walter and G. Johannson, Eds., Academic, San Diego, 1994.
- A.I. Vorobeva and M.Kh. Karapetyants, Zh. Fiz. Khim., 41, 1984 (1967). Fits to data from: J. Gmehling, and U. Onken, "Vapor-liquid equilibrium data collection", Dechema, 1977.
Pular para...
Vídeos desta coleção:

Now Playing
Eficiência da Extração Líquido-Líquido
Chemical Engineering
48.4K Visualizações

Teste de eficiência da transferência de calor de um trocador de calor de tubos aletados
Chemical Engineering
17.9K Visualizações

Uso de um secador de bandeja para investigar a transferência de calor por convecção e condução
Chemical Engineering
43.9K Visualizações

Viscosidade de soluções de propilenoglicol
Chemical Engineering
32.7K Visualizações

Porosimetria de um pó de sílica alumina
Chemical Engineering
9.6K Visualizações

Demonstração do modelo de lei de potência por meio de extrusão
Chemical Engineering
10.0K Visualizações

Absorvedor de gás
Chemical Engineering
36.5K Visualizações

Equilíbrio vapor-líquido
Chemical Engineering
88.6K Visualizações

O efeito da taxa de refluxo na eficiência da destilação em bandejas
Chemical Engineering
77.6K Visualizações

Reator de fase líquida: Inversão de sacarose
Chemical Engineering
9.7K Visualizações

Cristalização de Ácido Salicílico via Modificação Química
Chemical Engineering
24.2K Visualizações

Fluxo monofásico e bifásico em um reator de leito compactado
Chemical Engineering
18.9K Visualizações

Cinética da Polimerização por Adição ao Polidimetilsiloxano
Chemical Engineering
16.1K Visualizações

Reator Catalítico: Hidrogenação de etileno
Chemical Engineering
30.3K Visualizações

Avaliação a Transferência de Calor de um Equipamento de Resfriamento e Agitação
Chemical Engineering
7.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados