Method Article
Abordagem transconjuntival para injeção no nervo óptico de rato
Neste Artigo
Resumo
Este protocolo descreve uma técnica única usando uma abordagem transconjuntival para acessar o nervo óptico de rato para injeções.
Resumo
O rato serve como um modelo importante para o estudo de distúrbios do nervo óptico, incluindo condições hereditárias, traumáticas, neoplásicas e autoimunes. O acesso ao nervo óptico de rato para manipulações experimentais e injeções é um desafio devido ao pequeno tamanho da órbita e à vascularização dos tecidos orbitais circundantes. Técnicas anteriores envolveram uma incisão cutânea, que apresenta maior risco de infecção e requer o fechamento da ferida. Este estudo tem como objetivo descrever uma abordagem única, menos invasiva e potencialmente mais eficiente para acessar o nervo óptico de ratos. Uma incisão transconjuntival, juntamente com um gancho da medula espinhal de rato, é usada para isolar o nervo óptico para injeções experimentais. Nesses experimentos, um vetor adenoviral é injetado no nervo óptico com o objetivo de usar essa técnica para administração direta de terapia gênica no futuro. Essa técnica também pode ser aplicada por investigadores que precisam de acesso ao nervo óptico de rato para outros estudos experimentais, incluindo administração de medicamentos e pesquisa de lesão do nervo óptico.
Introdução
O rato é um modelo experimental chave para o estudo de distúrbios do nervo óptico, incluindo glaucoma, neuropatia óptica traumática, neuropatia óptica hereditária, doença desmielinizante e tumores do nervo óptico,2,3,4,5,6,7. No entanto, obter acesso ao nervo óptico para injeção experimental e manipulações pode ser difícil, dado o pequeno tamanho da órbita e dos tecidos vasculares orbitais.
As duas técnicas anteriores descritas para acessar o nervo óptico de rato para manipulações experimentais utilizam uma abordagem transcutânea orbital superior ou lateral para acessar a órbita 8,9. Raykova et al. descrevem a injeção de contas tingidas no nervo óptico usando uma incisão na pele orbital superior8. Embora sua técnica tenha sido eficaz, ela requer hemostasia e a necessidade de uma sutura de tração para exposição, o que pode ser mais desafiador com essa abordagem8. Outro grupo descreveu de forma semelhante uma abordagem usando uma incisão lateral na pele para acessar a órbita. Eles foram capazes de injetar o nervo óptico usando essa abordagem, mas necessitaram de hemostasia e fechamento da ferida9. Embora essas técnicas sejam abordagens eficazes para acessar o nervo óptico para estudo experimental, ambas envolvem uma incisão cutânea, necessidade de hemostasia e fechamento da ferida. Essas etapas têm riscos associados de infecção e potencialmente aumento do tempo sob anestesia devido à necessidade de fechamento da ferida 8,9,10.
Dadas as limitações das técnicas descritas anteriormente, o objetivo deste estudo é descrever uma abordagem mais eficiente e menos traumática para acessar o nervo para estudo experimental. Um gancho da medula espinhal é usado para isolar o nervo óptico, análogo à técnica cirúrgica usada em humanos para isolar estruturas musculares e anexiais oculares usando um gancho muscular. Essa técnica pode ser usada por investigadores que precisam de acesso ao nervo óptico de rato para muitas indicações, desde a administração de medicamentos até a terapia genética.
Este artigo descreve o novo uso de uma abordagem transconjuntival para acessar a órbita do rato e o nervo óptico para estudo experimental com o auxílio de um gancho da medula espinhal.
Protocolo
Todos os procedimentos com animais foram aprovados pelo Escritório do Comitê Institucional de Cuidados e Uso de Animais da Universidade de Iowa. Este estudo foi financiado pela Gilbert Family Foundation (número de concessão 913012). Uma combinação de ratos Sprague Dawley machos e fêmeas, com idade entre 4 e 12 semanas e pesando 100 a 400 g, foi usada para esses experimentos. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Anestesia
- Anestesiar ratos usando inalação de gás isoflurano. Coloque o animal na câmara de indução e gire o vaporizador para 4%-5% para indução de anestesia e 2%-3% para manter a anestesia.
- Verifique a profundidade da anestesia avaliando a ausência do reflexo de retirada do pedal antes de prosseguir.
- Aplique gel lacrimal artificial na superfície ocular.
2. Posicionamento
- Uma vez que a anestesia é induzida, coloque o animal em uma almofada de aquecimento em uma posição lateral reclinada. Use um nariz para manter a anestesia.
- Posicione a órbita abaixo do microscópio operacional.
3. Exposição cirúrgica
- Agarrar a conjuntiva com pinça dentada no quadrante inferotemporal (Figura 1).
- Use uma tesoura de Westcott para criar uma incisão conjuntival radial e, em seguida, abra a fáscia de Tenon no quadrante inferonasal (Figura 1). Use dissecção romba para remover o tecido orbital sobrejacente.
4. Isolamento do nervo óptico
- Gire o olho nasalmente usando uma pinça dentada e peça ao assistente que passe um gancho da medula espinhal no quadrante inferotemporal para isolar o nervo óptico (Figura 1). Tome cuidado para evitar a veia oftálmica ventral e os músculos extraoculares.
- Remova o tecido orbital sobrejacente e a fáscia de Tenon usando dissecção romba com um aplicador com ponta de algodão ou fórceps para expor o nervo óptico e a bainha.
5. Injeção
- Use uma agulha de 33 G conectada a uma seringa de 10 uL ou 1 mL para perfurar a bainha do nervo óptico (Figura 1).
- Injete diferentes concentrações de vírus adeno-associado-eGFP ou corante de tinta nanquim no nervo óptico sob visualização direta para garantir que o material seja injetado diretamente no nervo.
- Para avaliar o AAV-eGFP, injete 10 μL de suspensão contendo partículas virais de AAV (2 x 1013 genomas vetoriais (vg) / mL para uma dose total de 2 x 1011 vg).
NOTA: Os investigadores podem injetar outros corantes ou corantes, dependendo das necessidades experimentais.
6. Etapas pós-procedimento
- Reaproximar a conjuntiva do limbo para cobrir o local da incisão e aplicar pomada antibiótica sobre a conjuntiva (Figura 1).
- Permita que os animais se recuperem da anestesia e monitore-os quanto a quaisquer sinais de infecção.
7. Coloração
- Sete dias após a injeção, sacrificar os animais por asfixia por CO2 seguida de luxação cervical11 seguindo as diretrizes éticas. Disseque o nervo óptico.
- Fixe os nervos ópticos em paraformaldeído a 4% e enxágue em concentrações aumentadas de sacarose. Incorpore os criomoldes em uma solução 2:1 de composto OCT a 20% de sacarose. Congelar rapidamente as amostras em azoto líquido, conservar a -80 °C e seccioná-las a uma espessura de 7 μm.
- Bloqueie as criossecções do nervo óptico por 30 min em temperatura ambiente em tampão imunocitoquímico (IHQ) e albumina de soro bovino a 3%. Incubar seções com anticorpo primário anti-GFP de rato diluído em tampão IHC por 2 h à temperatura ambiente.
- Incubar seções com cabra anti-rato em tampão IHC por mais 1 h em temperatura ambiente. Durante a incubação de anticorpos secundários, marque as seções com dicloridrato de 4',6-Diamidino-2-fenilindol (DAPI) para visualizar os núcleos das células. Enxágue bem as seções com PBS e monte usando um meio de montagem.
8. Exames por imagem
- Visualize as seções rotuladas usando um sistema de microscópio confocal vertical.
- Especificamente, use um laser violeta de 405 nm para visualizar a rotulagem DAPI e um laser ciano de 488 nm para visualizar GFP.
NOTA: As configurações para cada laser (ou seja, potência do laser, intensidade/ganho, filtros de fundo/ruído) devem ser otimizadas por cada usuário para diferentes sistemas de microscópio confocal. Adquira imagens usando uma lente objetiva de 20x.
Resultados
Os resultados experimentais representativos usando esta técnica para injeção de nervo óptico em ratos são mostrados na Figura 2. Neste exemplo, o vírus adeno-associado eGFP (AAV-eGFP) foi injetado no nervo óptico de rato usando a técnica transconjuntival descrita acima com uma agulha de 33 G conectada a uma seringa de 10 μL. Esses resultados fizeram parte de um experimento usando essa técnica para estudar a injeção do nervo óptico como parte de um objetivo final de usar AAV para fornecer correção CRISPR aos nervos ópticos em um modelo de rato de neurofibromatose 1 (NF1). Uma combinação de corante e vetor AAV foi usada para desenvolver a técnica de injeção. Os animais foram sacrificados sete dias após a injeção no nervo óptico. Os nervos foram então dissecados e marcados com anticorpos anti-GFP para permitir a imagem do nervo óptico com microscopia confocal para confirmar que o material havia penetrado com sucesso na bainha do nervo óptico e entrado no nervo óptico. A introdução bem-sucedida do material no nervo óptico foi confirmada pela coloração de anticorpos, e apareceu verde na microscopia confocal, como visto na Figura 2A. Nos casos em que a penetração através da bainha do nervo óptico não foi completa, ou houve efluxo de material do trajeto da agulha, a coloração foi observada ao longo da borda da bainha do nervo óptico e não dentro do tecido nervoso, como visto na Figura 2C.
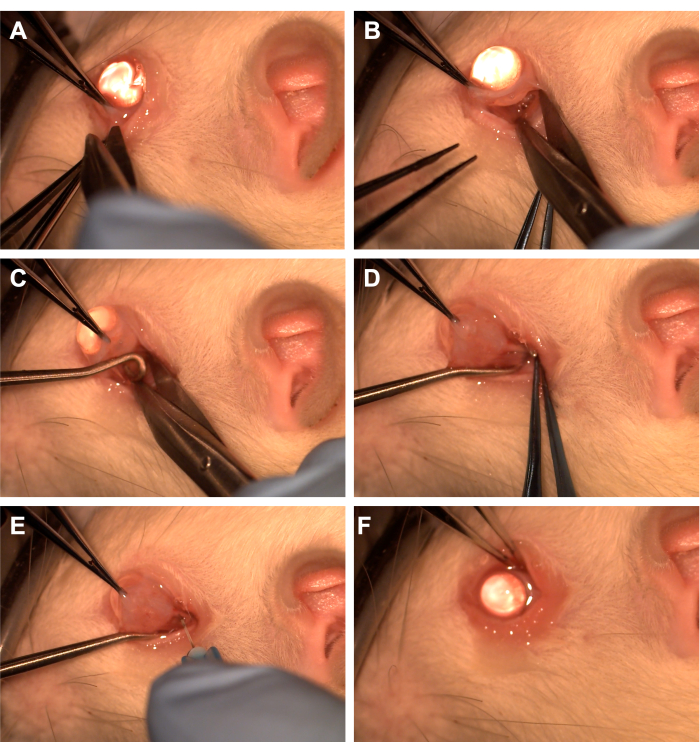
Figura 1: Sequência dos passos cirúrgicos. (A) A conjuntiva é agarrada com pinça dentada e tesouras de Westcott são usadas para criar uma peritomia límbica. (B) Depois que a fáscia da espiga é aberta e dissecada sem corte, a órbita é exposta com a ajuda de uma tesoura Westcott. (C) Um gancho da medula espinhal é inserido e usado para isolar o nervo óptico. (D) Após a dissecção romba do tecido orbital sobrejacente, o nervo óptico é exposto usando o gancho da medula espinhal. (E) Uma agulha de 33 G é usada para perfurar a bainha do nervo óptico e injetar adenovírus ou corante no nervo óptico. (F) O globo é reposicionado na órbita e a conjuntiva é reposicionada sobre o local da peritomia. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem panorâmica confocal fluorescente representativa do nervo óptico de rato 7 dias após a injeção bem-sucedida com AAV-eGFP (verde) na qual o vetor transduziu neurônios próximos ao quiasma óptico. (A) Os núcleos do nervo óptico são marcados com DAPI (azul). ONH com seta denota a cabeça do nervo óptico ou extremidade orbital do nervo, enquanto a extremidade do quiasma óptico é rotulada como "quiasma". (B) Fotografia de um nervo óptico de rato da órbita ao quiasma embutido em bloco de criossecção congelado. O nervo é injetado com tinta nanquim imediatamente posterior à órbita (local de injeção indicado pela seta preta) para orientar o nervo óptico. (C) Imagem fluorescente panorâmica do nervo óptico de rato 7 dias após a injeção malsucedida com AAV-eGFP (verde) na qual a maior parte da suspensão do vetor provavelmente efluiu para fora do trato nervoso, transduzindo a bainha óptica. Os núcleos do nervo óptico são marcados com DAPI (azul). ONH denota a cabeça do nervo óptico imediatamente posterior à retina neural e ao local da injeção indicado por uma seta branca. Quiasma e seta branca demarcam em direção ao quiasma óptico. Barras de escala = 400 μm em (A) e 200 μm em (C). Clique aqui para ver uma versão maior desta figura.
| Variável | Aproximação | ||
| Transconjuntival | Superior | Lateral | |
| Incisão na pele | Não | Sim | Sim |
| Incisão conjuntival | Sim | Não | Não |
| Microscópio | Sim | Sim | Sim |
| Transsecção do músculo orbital superior | Não | Sim | Não |
| Sutura de tração | Não | Sim | Sim |
| Gancho da medula espinhal | Sim | Não | Não |
| Sutura de pele | Não | Sim | Sim |
Tabela 1: Comparação com técnicas publicadas anteriormente para isolar o nervo óptico de rato para estudo experimental. Variáveis, incluindo a necessidade de incisão na pele, incisão conjuntival, microscópio cirúrgico, transecção do músculo orbital superior, sutura de tração, gancho da medula espinhal e sutura da pele, são comparadas usando as abordagens transconjuntival, superior e lateral.
Discussão
Este artigo descreve um novo método de acesso ao nervo óptico de rato para estudo experimental sem a necessidade de uma incisão na pele. Essa abordagem oferece as vantagens potenciais de eficiência e diminuição do risco de infecção e sangramento, dada a falta de necessidade de incisão na pele e menos etapas em comparação com outras técnicas 8,9. Essa técnica também usa a nova abordagem de isolar o nervo óptico com um gancho de medula espinhal de rato para evitar traumas no nervo e nos tecidos circundantes.
As etapas críticas da técnica incluem fazer uma incisão límbica adequada para acesso ao espaço subconjuntival, uso do gancho da medula espinhal para isolar o nervo óptico e uso de uma agulha de pequeno calibre para perfurar a bainha do nervo óptico e fornecer material ao nervo óptico. Deve-se tomar cuidado para girar o gancho da medula espinhal para isolar o nervo. Quando o nervo não está claramente isolado, o gancho pode precisar ser introduzido várias vezes para garantir que o nervo esteja isolado, e um aplicador com ponta de algodão pode ser usado para remover o tecido conjuntivo da bainha do nervo para melhor visualização. A exposição a essa técnica pode ser mais desafiadora em animais de maior porte e com maior volume de gordura orbital. O uso de um assistente para retrair os tecidos circundantes para uma exposição adequada pode ser útil nessas situações. Deve-se tomar cuidado para visualizar o nervo óptico diretamente durante a injeção. Garantir uma orientação perpendicular da agulha através da bainha nervosa durante a injeção melhora o sucesso da injeção.
Essa técnica baseia-se em trabalhos anteriores de Raykova et al. e Hallas e Wells 8,9. Raykova et al. descreveram o acesso ao nervo óptico de rato usando uma abordagem superior com uma incisão na pele criada sobre a crista orbital e transecção do músculo orbital superior8. Embora essa abordagem permita a exposição do nervo, ela requer a transecção de um músculo extraocular com maior risco de sangramento e a necessidade de sutura da incisão na pele. Da mesma forma, Hallas e Wells descrevem uma abordagem lateral da órbita do rato para alcançar o nervo óptico9. Eles descrevem uma incisão lateral na pele seguida por uma incisão conjuntival lateral e uma sutura de tração usada para girar o olho e expor o nervo óptico9. Semelhante à abordagem superior, essa técnica envolve uma incisão na pele com a consequente necessidade de fechamento da ferida e maior risco de infecção e sangramento 8,9. A técnica transconjuntival aqui apresentada evita a necessidade de uma incisão na pele e no músculo, reduzindo assim o risco de sangramento/infecção e melhorando a eficiência, evitando a necessidade de fechar uma incisão na pele. O procedimento causa sofrimento mínimo, é bem tolerado e não requer o uso prolongado de medicamentos analgésicos ou anti-inflamatórios. A técnica transconjuntival é comparada e contrastada com as técnicas publicadas anteriormente na Tabela 1.
As limitações da técnica apresentada neste estudo incluem uma curva de aprendizado para isolar o nervo óptico usando o gancho da medula espinhal, mas uma vez dominada, essa técnica permite um isolamento eficiente e atraumático do nervo. A familiaridade com o uso de um microscópio cirúrgico é necessária para esta técnica. Embora haja uma curva de aprendizado para essa técnica, o menor número de passos e a ausência da necessidade de sutura da ferida tornarão essa técnica mais fácil de dominar em relação às outras abordagens publicadas 8,9. A dissecção romba cuidadosa para expor o nervo e a bainha é imperativa, pois pode haver hemorragia dos vasos próximos e do tecido muscular. Em ratos maiores, pode ser mais difícil expor grandes seções do nervo óptico devido ao aumento da gordura / tecido orbital, mas com cuidado, esse tecido geralmente pode ser removido com dissecção romba para melhorar a visualização do nervo. Trabalhos adicionais poderiam abordar o uso dessa técnica em outros sistemas modelo, como o mouse, e poderiam comparar diretamente a eficiência cirúrgica com outras técnicas de acesso ao nervo óptico.
Esta técnica pode ser usada por outros grupos que precisam acessar o nervo óptico de rato para estudo experimental. Os experimentos apresentados aqui fizeram parte de um projeto maior com o objetivo de desenvolver maneiras de fornecer correção do gene CRISPR ao nervo óptico em modelos de ratos de neurofibromatose tipo 1 (NF1). O objetivo final deste projeto é encontrar maneiras de fornecer terapia gênica diretamente ao nervo óptico em pacientes com NF1 para prevenir o desenvolvimento de gliomas do nervo óptico, que ameaçam a visão12. Neste estudo, o corante da tinta nanquim ou vetor AAV-eGFP foi injetado no nervo óptico para garantir que o material fosse entregue ao nervo óptico e para demonstrar que o vetor poderia penetrar no nervo óptico.
Essa técnica pode ser mais amplamente usada por outros investigadores, pois o nervo pode precisar ser acessado ou novas terapias injetadas em um esforço para tratar uma variedade de condições que ameaçam a visão, incluindo neoplasias do nervo óptico, processos degenerativos como neuropatia óptica hereditária de Leber, neuropatia óptica traumática, glaucoma e doenças autoimunes, como neurite óptica13, 14. Por exemplo, Singh et al. descrevem a injeção de células de glioma C6 no nervo óptico de rato como um modelo de neurofibromatose tipo 1 acessando o nervo usando uma incisão cutânea3, Kwon et al. acessaram o nervo óptico a partir de uma abordagem cutânea lateral para estudos envolvendo compressão e regeneração do nervo óptico com células-tronco6, e Negishi et al. acessaram o nervo óptico de rato para colocação de enxerto de células de Schwann como um modelo de nervo óptico regeneração15. A técnica apresentada aqui pode fornecer uma abordagem mais eficiente e segura para estudos como esses, que requerem acesso ao nervo óptico de rato para responder a uma variedade de questões experimentais.
Em resumo, este trabalho demonstra eficácia na entrada do nervo óptico com uma abordagem de agulha de pequeno calibre e a capacidade de penetrar na bainha do nervo sem a necessidade de uma incisão cutânea. As imagens representativas mostram que o vetor adenoviral penetrou com sucesso no nervo óptico. Esta técnica tem aplicações em uma variedade de experimentos do nervo óptico em medicina regenerativa, oncologia e doenças hereditárias da retina.
Divulgações
Nenhuma divulgação relevante.
Agradecimentos
Os autores gostariam de agradecer à Gilbert Family Foundation por financiar este projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Referências
- Korn, P. et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383 (2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695 (2020).
- Ellouze, S. et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. 99, e52249 (2015).
- Hallas, B.H., Wells, M.R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F. et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. 128, e56272 (2017).
- Han I. H. et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T. et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683 (2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados