Method Article
ラット視神経への注射のための経結膜アプローチ
要約
このプロトコルは、経結膜アプローチを使用してラットの視神経にアクセスして注射する独自の技術について説明しています。
要約
ラットは、遺伝性、外傷性、腫瘍性、自己免疫疾患など、視神経の障害を研究するための重要なモデルとして機能します。実験的な操作や注射のためにラット視神経にアクセスすることは、眼窩のサイズが小さく、周囲の眼窩組織の血管性のために困難です。以前の技術では、皮膚切開が行われていましたが、これは感染のリスクが高く、創傷閉鎖が必要でした。この研究は、ラット視神経にアクセスするためのユニークで侵襲性が低く、潜在的により効率的なアプローチを説明することを目的としています。経結膜切開は、ラット脊髄フックとともに、実験的注射のために視神経を分離するために使用されます。これらの実験では、アデノウイルスベクターを視神経に注入し、将来的にこの技術を直接遺伝子治療に応用することを目指しています。この手法は、薬物送達や視神経損傷研究など、他の実験的研究のためにラット視神経へのアクセスを必要とする研究者にも適用できます。
概要
ラットは、緑内障、外傷性視神経障害、遺伝性視神経障害、脱髄疾患、視神経の腫瘍など、視神経の障害を研究するための重要な実験モデルです2,3,4,5,6,7。ただし、眼窩と血管眼窩組織のサイズが小さいため、実験的な注射や操作のために視神経へのアクセスを取得することは困難な場合があります。
実験操作のためにラット視神経にアクセスするために記載された2つの先行技術は、眼窩8,9にアクセスするために優れた眼窩または側方経皮的アプローチのいずれかを利用している。Raykovaらは、上眼窩皮膚切開8を使用して、染色されたビーズを視神経に注入することを説明しています。彼らの技術は効果的でしたが、止血と露出のための牽引縫合糸の必要性が必要であり、このアプローチではより困難になる可能性があります8。別のグループも同様に、眼窩にアクセスするために外側の皮膚切開を使用するアプローチについて説明しました。彼らはこのアプローチを使用して視神経を注入することに成功しましたが、止血と創傷閉鎖が必要でした9。これらの技術は、実験的研究のために視神経にアクセスするための効果的なアプローチですが、どちらも皮膚切開、止血の必要性、および創傷閉鎖を伴います。これらのステップは、感染のリスクを伴い、創傷閉鎖の必要性による麻酔下での時間が増加する可能性があります8,9,10。
前述の技術の限界を考えると、この研究の目標は、実験的研究のために神経にアクセスするためのより効率的で外傷の少ないアプローチを説明することです。脊髄フックは視神経を分離するために使用されますが、これは、筋肉フックを使用して筋肉と眼の付属器構造を分離するために人間で使用される外科的技術に似ています。この技術は、薬物送達から遺伝子治療まで、多くの適応症でラット視神経へのアクセスを必要とする研究者が使用できます。
この記事では、脊髄フックを使用して実験的研究のためにラットの軌道と視神経にアクセスするための経結膜アプローチの新しい使用について説明します。
プロトコル
すべての動物用処置は、アイオワ大学の動物管理・使用委員会のオフィスによって承認されました。この研究は、ギルバート家族財団(助成金番号913012)によって資金提供されました。これらの実験には、生後4〜12週齢、体重100〜400gの雄と雌のSprague Dawleyラットの組み合わせを使用しました。使用した試薬や機器の詳細は 、資料表に記載されています。
1.麻酔
- イソフルランガスの吸入を使用してラットに麻酔をかけます。動物を誘導室に入れ、気化器を麻酔導入のために4%〜5%に回し、麻酔を維持するために2%〜3%に回します。
- 先に進む前に、ペダル離脱反射の欠如を評価して、麻酔の深さを確認します。
- 眼の表面に人工涙液ジェルを塗布します。
2. ポジショニング
- 麻酔が誘発されたら、動物を横臥位で加熱パッドの上に置きます。麻酔を維持するためにノーズコーンを使用してください。
- オービットを手術用顕微鏡の下に置きます。
3. 外科的被ばく
- 下側頭象限の歯付き鉗子で結膜をつかみます(図1)。
- Westcottハサミを使用して橈骨結膜切開を作成し、鼻下象限のほぞ筋膜を開きます(図1)。鈍的解剖を使用して、上にある眼窩組織を取り除きます。
4.視神経の分離
- 歯付き鉗子を使用して目を鼻に回転させ、アシスタントに脊髄フックを下側頭形象限に通してもらい、視神経を分離します(図1)。腹側眼静脈や外眼筋を避けるように注意してください。
- 綿の先端のアプリケーターまたは鉗子を使用して鈍的解剖を使用して、上にある眼窩組織とほぞ筋膜を切除し、視神経と鞘を露出させます。
5.インジェクション
- 10 uLまたは1 mLシリンジに接続された33 G針を使用して、視神経シースを穿孔します(図1)。
- 異なる濃度のアデノ随伴ウイルス-eGFPまたはIndia Ink染料を視神経に直接注入し、直接可視化して、材料が直接神経に注入されるようにします。
- AAV-eGFPを評価するには、AAVウイルス粒子を含む懸濁液10 μLを注入します(2 x 1013 ベクターゲノム(vg)/mL、総用量は2 x 1011 vg)。
注: 研究者は、実験のニーズに応じて、他の染料または染色剤を注入する場合があります。
6. 手続き後の手順
- 結膜を輪部に近似し直して切開部位を覆い、結膜に抗生物質軟膏を塗布します(図1)。
- 動物が麻酔から回復するのを待ち、感染の兆候がないか監視します。
7. 染色
- 注射の7日後、倫理ガイドラインに従って、CO2窒息とそれに続く子宮頸部脱臼11によって動物を犠牲にします。視神経を解剖します。
- 視神経を4%パラホルムアルデヒドで固定し、高濃度のショ糖ですすいでください。OCT化合物と20%スクロースの2:1溶液にクライオモールドを埋め込みます。サンプルを液体窒素で瞬間凍結し、-80°Cで保存し、厚さ7μmで切片付けします。
- 視神経の凍結切片を、免疫細胞化学(IHC)緩衝液および3%ウシ血清アルブミン中で室温で30分間ブロックします。切片をラット抗GFP一次抗体で希釈したIHCバッファーで室温で2時間インキュベートします。
- 切片をヤギ抗ラットとIHCバッファーで室温でさらに1時間インキュベートします。二次抗体のインキュベーション中に、切片を4',6-ジアミジノ-2-フェニルインドール二塩酸塩(DAPI)で標識し、細胞核を可視化します。切片をPBSで十分にすすぎ、封入剤を使用して埋込します。
8. イメージング
- 直立共焦点顕微鏡システムを使用して、標識された切片を画像化します。
- 具体的には、405 nmの紫色レーザーを使用してDAPI標識を視覚化し、488 nmのシアンレーザーを使用してGFPを視覚化します。
注:各レーザーの設定(レーザー出力、強度/ゲイン、バックグラウンド/ノイズフィルターなど)は、各ユーザーがさまざまな共焦点顕微鏡システムに対して最適化する必要があります。20倍の対物レンズを使用して画像を取得します。
結果
この手法を用いたラット視神経注射の代表的な実験結果を 図2に示します。この例では、アデノ随伴ウイルス-eGFP(AAV-eGFP)を、10μLシリンジに接続された33G針を用いて、上述の経結膜技術を用いてラット視神経に注入した。これらの結果は、神経線維腫症1(NF1)のラットモデルにおいて、AAVを使用して視神経にCRISPR補正を届けるという究極の目的の一部として、この技術を使用して視神経注射を研究する実験の一部でした。色素とAAVベクターの組み合わせを使用して、注入技術を開発しました。動物は視神経への注射の7日後に犠牲にされました。次に、神経を解剖し、抗GFP抗体で標識して、共焦点顕微鏡で視神経をイメージングできるようにし、材料が視神経鞘をうまく貫通して視神経に入ったことを確認しました。視神経への物質の正常な導入は、抗体染色によって確認され、 図2Aに示すように、共焦点顕微鏡では緑色に見えました。視神経鞘の貫通が完全でない場合、または針跡から物質が流出した場合、 図2Cに示すように、神経組織内ではなく視神経鞘の縁に沿って染色が見られました。
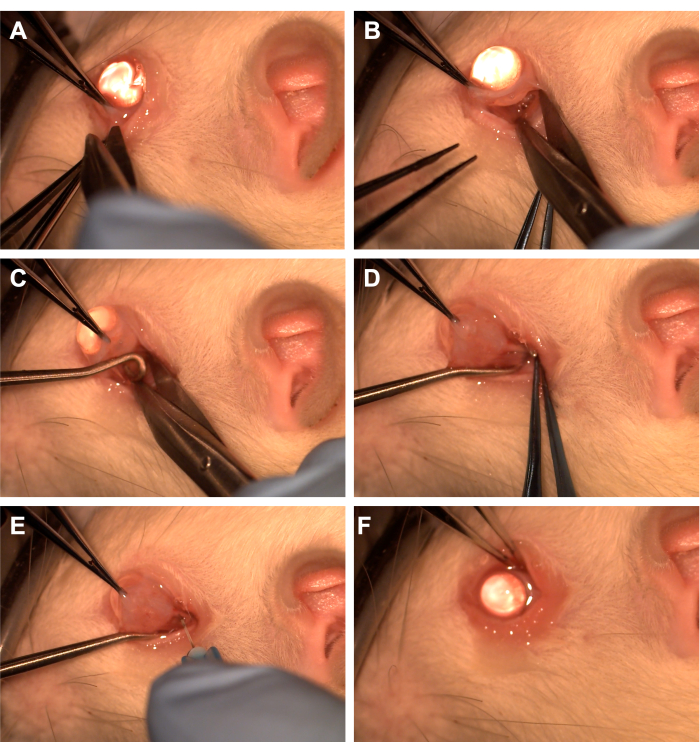
図1:手術手順の順序 (A)結膜を歯付き鉗子でつかみ、ウェストコットハサミを使用して辺縁部腹膜を造成する。(B)ほぞの筋膜が開いて鈍く解剖された後、ウェストコットのハサミの助けを借りて軌道が露出します。(C)脊髄フックを挿入し、視神経を分離するために使用されます。(D)上にある眼窩組織の鈍的解剖後、脊髄フックを使用して視神経を露出させます。(E)33Gの針を使用して視神経鞘を貫通し、アデノウイルスまたは色素を視神経に注入します。(F)地球を軌道に再配置し、結膜をペリトミー部位の上に再配置します。 この図の拡大版を表示するには、ここをクリックしてください。

図2: AAV-eGFP(緑)の注射成功から7日後のラット視神経の代表的な蛍光共焦点パノラマ画像で、視交叉付近のニューロンがベクトル変換されました。(A)視神経核はDAPI(青)でラベル付けされています。矢印の付いたONHは視神経頭または神経の眼窩端を示し、視交叉端は「交叉」とラベル付けされます。(B)凍結凍結切片ブロックに埋め込まれた眼窩から視交叉までのラット視神経の写真。神経には、視神経の向きを変えるために、眼窩のすぐ後方(黒い矢印で示された注射部位)にインディアインクが注入されます。(C)AAV-eGFPの注射失敗から7日後のラット視神経のパノラマ蛍光画像(緑)では、ほとんどのベクター懸濁液が神経管から流出し、視鞘を形質化した可能性が高い。視神経核はDAPI(青)でラベル付けされています。ONHは、神経網膜のすぐ後方にある視神経頭と、白い矢印で示された注射部位を示します。視交叉と白い矢印は視交叉に向かって境界を定めています。スケールバー = (A) で 400 μm、(C) で 200 μm。 この図の拡大版を表示するには、ここをクリックしてください。
| 変数 | 接近 | ||
| 経結膜 | 目上 | 側面 | |
| 皮膚切開 | いいえ | はい | はい |
| 結膜切開 | はい | いいえ | いいえ |
| 顕微鏡 | はい | はい | はい |
| 上眼窩筋の切断 | いいえ | はい | いいえ |
| 牽引縫合糸 | いいえ | はい | はい |
| 脊髄フック | はい | いいえ | いいえ |
| 皮膚縫合糸 | いいえ | はい | はい |
表1:実験的研究のためにラット視神経を分離するための以前に発表された技術との比較。 皮膚切開、結膜切開、手術顕微鏡、上眼窩筋の切断、牽引縫合、脊髄フック、皮膚縫合の必要性などの変数は、経結膜、上、および横方向のアプローチを使用して比較されます。
ディスカッション
この記事では、皮膚切開を必要とせずに実験的研究のためにラット視神経にアクセスするための新しい方法について説明します。このアプローチは、他の技術と比較して皮膚切開の必要性がなく、ステップが少ないことを考えると、効率と感染および出血リスクの減少という潜在的な利点を提供します8,9。この技術はまた、神経および周囲の組織への外傷を避けるためにラット脊髄フックで視神経を分離する新しいアプローチを使用します。
この技術の重要なステップには、結膜下腔にアクセスするための適切な輪肢切開を行うこと、視神経を分離するための脊髄フックの使用、および視神経鞘を突き刺して視神経に物質を送達するための小口径針の使用が含まれます。神経を分離するために、脊髄フックを回転させるように注意する必要があります。神経が明確に分離されていない場合は、神経を確実に分離するためにフックを数回導入する必要がある場合があります。また、綿の先端のアプリケーターを使用して神経鞘から結合組織を取り外し、視覚化を改善することができます。この技術への曝露は、眼窩脂肪の量が多い大型の動物ではより困難になる可能性があります。適切な曝露のために周囲の組織を引っ込めるためのアシスタントの使用は、これらの状況で有用であり得る。注射中に直接視神経を視覚化するように注意する必要があります。注射中に神経鞘を通る針の垂直な向きを確保すると、注射の成功が向上します。
この手法は、Raykova et al. と Hallas and Wells 8,9 による先行研究に基づいています。Raykova et al. は、眼窩隆起上に作成された皮膚切開と上眼窩筋の切断による優れたアプローチを使用してラット視神経へのアクセスについて説明しました8。このアプローチでは神経の露出が可能になりますが、出血のリスクが高く、皮膚切開の縫合が必要な外眼筋の切断が必要です。同様に、HallasとWellsは、視神経9に到達するためのラット軌道への横方向のアプローチについて説明しています。彼らは、外側の皮膚切開とそれに続く外側結膜切開、および眼を回転させて視神経を露出させるために使用される牽引縫合糸について説明しています9。優れたアプローチと同様に、この技術には皮膚切開が含まれ、その結果、創傷閉鎖が必要になり、感染と出血のリスクが高くなります8,9。ここで紹介する経結膜技術は、皮膚や筋肉の切開の必要性をなくすため、出血や感染のリスクを減らし、皮膚切開を閉じる必要がなくなるため、効率が向上します。この手順は、苦痛を最小限に抑え、忍容性が高く、鎮痛薬や抗炎症薬の長期使用を必要としません。経結膜技術は、以前に発表された表1の技術と比較対照されています。
この研究で提示された技術の限界には、脊髄フックを使用して視神経を分離するための学習曲線が含まれますが、一度習得すると、この技術は神経の効率的で非外傷的な分離を可能にします。この技術には、手術用顕微鏡の使用に精通している必要があります。この技術には学習曲線がありますが、ステップ数が少なく、創傷の縫合の必要性がないため、この技術は他の公開されたアプローチ8,9と比較して習得しやすくなります。神経と鞘を露出させるためには、近くの血管や筋肉組織から出血する可能性があるため、慎重な鈍的解剖が不可欠です。大型ラットでは、眼窩脂肪/組織の増加により視神経の大きな部分を露出させることがより困難になる可能性がありますが、注意して、この組織は通常、神経の視覚化を改善するために鈍的解剖で除去することができます。さらなる研究により、マウスなどの他のモデルシステムでのこの技術の使用に対処し、視神経アクセスのための他の技術と外科的効率を直接比較することができます。
この技術は、実験的研究のためにラット視神経にアクセスする必要がある他のグループでも使用できます。ここで紹介した実験は、神経線維腫症1型(NF1)のラットモデルにおいて、視神経にCRISPR遺伝子修正を行う方法を開発することを目的とした大規模なプロジェクトの一部でした。このプロジェクトの最終的な目的は、NF1 患者の視神経に直接遺伝子治療を送達する方法を見つけて、視力を脅かす視神経膠腫の発症を防ぐことです12。この研究では、インディアインク染料またはAAV-eGFPベクターを視神経に注入して、物質が視神経に送達されていることを確認し、ベクターが視神経を貫通できることを実証しました。
この技術は、視神経の新生物、レーバー遺伝性視神経障害などの変性プロセス、外傷性視神経障害、緑内障、視神経炎などの自己免疫疾患など、さまざまな視力を脅かす状態を治療するために神経にアクセスしたり、新しい治療法を注射したりする必要があるため、他の研究者によってより広く使用される可能性があります13。14.例えば、Singhらは、皮膚切開を用いて神経線維腫症1型のモデルとしてラット視神経へのC6神経膠腫細胞の注入3を、Kwonらは幹細胞による視神経の圧縮と再生を含む研究のために側方皮的アプローチから視神経にアクセスし6、Negishiらは視神経のモデルとしてシュワン細胞移植片留置のためのラット視神経にアクセスした再生15.ここで紹介した技術は、さまざまな実験的な質問に答えるためにラットの視神経へのアクセスを必要とするこのような研究に対して、より効率的で安全なアプローチを提供できる可能性があります。
要約すると、この研究は、スモールゲージニードルアプローチで視神経に入ることの有効性と、皮膚切開を必要とせずに神経鞘を貫通する能力を示しています。代表的な画像は、アデノウイルスベクターが視神経をうまく貫通したことを示しています。この技術は、再生医療、腫瘍学、遺伝性網膜疾患におけるさまざまな視神経実験に応用されています。
開示事項
関連する開示はありません。
謝辞
著者は、このプロジェクトに資金を提供してくれたギルバートファミリー財団に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
参考文献
- Korn, P. et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383 (2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695 (2020).
- Ellouze, S. et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. 99, e52249 (2015).
- Hallas, B.H., Wells, M.R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F. et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. 128, e56272 (2017).
- Han I. H. et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T. et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683 (2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved