Method Article
Transkonjunktivaler Zugang zur Injektion in den Sehnerv der Ratte
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine einzigartige Technik, die einen transkonjunktivalen Ansatz verwendet, um Zugang zum Sehnerv der Ratte für Injektionen zu erhalten.
Zusammenfassung
Die Ratte dient als wichtiges Modell für die Untersuchung von Erkrankungen des Sehnervs, einschließlich vererbbarer, traumatischer, neoplastischer und Autoimmunerkrankungen. Der Zugang zum Sehnerv der Ratte für experimentelle Manipulationen und Injektionen ist aufgrund der geringen Größe der Orbita und der Vaskularität des umgebenden Orbitagewebes eine Herausforderung. Frühere Techniken beinhalteten einen Hautschnitt, der ein höheres Infektionsrisiko birgt und einen Wundverschluss erfordert. Ziel dieser Studie ist es, einen einzigartigen, weniger invasiven und potenziell effizienteren Ansatz für den Zugang zum Sehnerv der Ratte zu beschreiben. Ein transkonjunktivaler Schnitt wird zusammen mit einem Ratten-Rückenmarkhaken verwendet, um den Sehnerv für experimentelle Injektionen zu isolieren. In diesen Experimenten wird ein adenoviraler Vektor in den Sehnerv injiziert, mit dem Ziel, diese Technik in Zukunft für die direkte Gentherapie zu nutzen. Diese Technik kann auch von Forschern angewendet werden, die Zugang zum Sehnerv der Ratte für andere experimentelle Studien benötigen, einschließlich der Arzneimittelverabreichung und der Erforschung von Sehnervenverletzungen.
Einleitung
Die Ratte ist ein wichtiges experimentelles Modell für die Untersuchung von Erkrankungen des Sehnervs, einschließlich Glaukom, traumatischer Optikusneuropathie, hereditärer Optikusneuropathie, demyelinisierender Erkrankung und Tumoren des Sehnervs,2,3,4,5,6,7. Der Zugang zum Sehnerv für experimentelle Injektionen und Manipulationen kann jedoch angesichts der geringen Größe der Orbita und des vaskulären Orbitagewebes schwierig sein.
Die beiden vorangegangenen Techniken, die für den Zugang zum Sehnerv der Ratte für experimentelle Manipulationen beschrieben wurden, verwenden entweder einen superioren orbitalen oder lateralen transkutanen Zugang, um Zugang zur Orbitazu erhalten 8,9. Raykova et al. beschreiben die Injektion von gefärbten Kügelchen in den Sehnerv mit Hilfe eines oberen orbitalen Hautschnitts8. Obwohl ihre Technik effektiv war, erfordert sie eine Blutstillung und die Notwendigkeit einer Traktionsnaht für die Exposition, was bei diesem Ansatz eine größere Herausforderung darstellen kann8. Eine andere Gruppe beschrieb in ähnlicher Weise einen Ansatz, bei dem ein seitlicher Hautschnitt verwendet wurde, um Zugang zur Orbita zu erhalten. Auf diese Weise konnten sie den Sehnerv erfolgreich injizieren, erforderten aber eine Blutstillung und einen Wundverschluss9. Während diese Techniken effektive Ansätze für den Zugang zum Sehnerv für experimentelle Studien sind, beinhalten sie beide einen Hautschnitt, die Notwendigkeit einer Blutstillung und einen Wundverschluss. Diese Schritte sind mit Infektionsrisiken verbunden und können die Zeit unter Narkose aufgrund der Notwendigkeit eines Wundverschlusses verlängern 8,9,10.
Angesichts der Einschränkungen der zuvor beschriebenen Techniken besteht das Ziel dieser Studie darin, einen effizienteren und weniger traumatischen Ansatz für den Zugang zum Nerv für experimentelle Studien zu beschreiben. Ein Rückenmarkshaken wird verwendet, um den Sehnerv zu isolieren, analog zu der Operationstechnik, die beim Menschen verwendet wird, um Muskel- und Augenadnexstrukturen mit einem Muskelhaken zu isolieren. Diese Technik kann von Forschern verwendet werden, die bei vielen Indikationen Zugang zum Sehnerv der Ratte benötigen, von der Medikamentenverabreichung bis zur Gentherapie.
Dieser Artikel beschreibt die neuartige Verwendung eines transkonjunktivalen Zugangs zur Orbita und des Sehnervs der Ratte für experimentelle Untersuchungen mit Hilfe eines Rückenmarkshakens.
Protokoll
Alle Tierverfahren wurden vom Office of the Institutional Animal Care and Use Committee an der University of Iowa genehmigt. Diese Studie wurde von der Gilbert Family Foundation (Fördernummer 913012) finanziert. Für diese Experimente wurde eine Kombination aus männlichen und weiblichen Sprague-Dawley-Ratten im Alter von 4-12 Wochen und einem Gewicht von 100-400 g verwendet. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Anästhesie
- Betäuben Sie Ratten durch Inhalation von Isoflurangas. Setzen Sie das Tier in die Induktionskammer und drehen Sie den Verdampfer auf 4%-5% für die Einleitung der Anästhesie und 2%-3% für die Aufrechterhaltung der Anästhesie.
- Überprüfen Sie die Tiefe der Anästhesie, indem Sie das Fehlen des Pedalzurückzugsreflexes beurteilen, bevor Sie fortfahren.
- Tragen Sie künstliches Tränengel auf die Augenoberfläche auf.
2. Positionierung
- Sobald die Anästhesie eingeleitet ist, legen Sie das Tier auf ein Heizkissen in einer seitlichen Liegeposition. Verwenden Sie einen Nasenkonus, um die Narkose aufrechtzuerhalten.
- Positionieren Sie den Orbit unter dem Operationsmikroskop.
3. Chirurgische Exposition
- Fassen Sie die Bindehaut mit einer Zahnzange im inferotemporalen Quadranten (Abbildung 1).
- Verwenden Sie eine Westcott-Schere, um einen radialen Bindehautschnitt zu erstellen, und öffnen Sie dann die Tenon-Faszie im inferonasalen Quadranten (Abbildung 1). Verwenden Sie eine stumpfe Dissektion, um überliegendes Orbitalgewebe zu entfernen.
4. Isolierung des Sehnervs
- Drehen Sie das Auge mit einer Zahnzange nasal und lassen Sie den Assistenten einen Rückenmarkshaken in den inferotemporalen Quadranten einführen, um den Sehnerv zu isolieren (Abbildung 1). Achten Sie darauf, die Vena ophthalmic ventralis und die extraokulären Muskeln zu vermeiden.
- Entfernen Sie das darüber liegende Orbitalgewebe und die Sehnenfaszie durch stumpfe Dissektion mit einem Applikator oder einer Pinzette mit Wattespitze, um den Sehnerv und die Scheide freizulegen.
5. Injektion
- Verwenden Sie eine 33-G-Nadel, die mit einer 10-μl- oder 1-ml-Spritze verbunden ist, um die Sehnervenscheide zu durchstechen (Abbildung 1).
- Injizieren Sie verschiedene Konzentrationen von Adeno-assoziiertem Virus-eGFP oder Tuschefarbstoff unter direkter Visualisierung in den Sehnerv, um sicherzustellen, dass das Material direkt in den Nerv injiziert wird.
- Zur Beurteilung von AAV-eGFP injizieren Sie eine 10 μl Suspension mit AAV-Viruspartikeln (2 x 1013 Vektorgenome (vg)/ml für eine Gesamtdosis von 2 x 1011 vg).
HINWEIS: Die Prüfärzte können je nach experimentellem Bedarf andere Farbstoffe oder Flecken injizieren.
6. Nachverfahrensrechtliche Schritte
- Nähern Sie sich die Bindehaut wieder dem Limbus an, um die Inzisionsstelle abzudecken, und tragen Sie eine antibiotische Salbe auf die Bindehaut auf (Abbildung 1).
- Lassen Sie die Tiere sich von der Narkose erholen und überwachen Sie sie auf Anzeichen einer Infektion.
7. Fleckenbildung
- Sieben Tage nach der Injektion werden die Tiere durch CO2 -Erstickung mit anschließender Gebärmutterhalsluxation11 nach ethischen Richtlinien getötet. Präpariere den Sehnerv.
- Fixieren Sie die Sehnerven in 4% Paraformaldehyd und spülen Sie sie in erhöhten Konzentrationen von Saccharose aus. Betten Sie Kryoformen in eine 2:1-Lösung aus OCT-Verbindung mit 20 % Saccharose ein. Proben in flüssigem Stickstoff schockgefrieren, bei -80 °C lagern und bei einer Dicke von 7 μm schneiden.
- Blockieren Sie Kryosektionen des Sehnervs für 30 Minuten bei Raumtemperatur in immunzytochemischem (IHC) Puffer und 3 % Rinderserumalbumin. Inkubieren Sie Abschnitte mit einem in IHC-Puffer verdünnten Anti-GFP-Antikörper der Ratte für 2 Stunden bei Raumtemperatur.
- Inkubieren Sie die Abschnitte mit Ziegen-Anti-Ratte in IHC-Puffer für weitere 1 h bei Raumtemperatur. Während der Sekundärantikörper-Inkubation werden Abschnitte mit 4',6-Diamidino-2-phenylindol-dihydrochlorid (DAPI) markiert, um Zellkerne sichtbar zu machen. Spülen Sie die Abschnitte gründlich mit PBS ab und montieren Sie sie mit einem Eindeckmedium.
8. Bildgebung
- Nehmen Sie die beschrifteten Schnitte mit einem aufrechten konfokalen Mikroskopsystem auf.
- Verwenden Sie insbesondere einen 405-nm-Violett-Laser, um die DAPI-Markierung zu visualisieren, und einen 488-nm-Cyan-Laser, um GFP zu visualisieren.
HINWEIS: Die Einstellungen für jeden Laser (d. h. Laserleistung, Intensität/Verstärkung, Hintergrund-/Rauschfilter) sollten von jedem Benutzer für verschiedene konfokale Mikroskopsysteme optimiert werden. Nehmen Sie Bilder mit einem 20-fach-Objektiv auf.
Ergebnisse
Repräsentative experimentelle Ergebnisse mit dieser Technik zur Injektion des Sehnervs der Ratte sind in Abbildung 2 dargestellt. In diesem Beispiel wurde das Adeno-assoziierte Virus-eGFP (AAV-eGFP) mit der oben beschriebenen transkonjunktivalen Technik mit einer 33-G-Nadel, die mit einer 10-μl-Spritze verbunden war, in den Sehnerv der Ratte injiziert. Diese Ergebnisse waren Teil eines Experiments, bei dem diese Technik zur Untersuchung der Injektion von Sehnerven als Teil des ultimativen Ziels verwendet wurde, AAV zur CRISPR-Korrektur der Sehnerven in einem Rattenmodell der Neurofibromatose 1 (NF1) zu verwenden. Eine Kombination aus Farbstoff und AAV-Vektor wurde verwendet, um die Injektionstechnik zu entwickeln. Die Tiere wurden sieben Tage nach der Injektion in den Sehnerv getötet. Anschließend wurden Nerven präpariert und mit Anti-GFP-Antikörpern markiert, um eine Abbildung des Sehnervs mit konfokaler Mikroskopie zu ermöglichen, um zu bestätigen, dass das Material erfolgreich in die Sehnervenscheide eingedrungen und in den Sehnerv eingedrungen war. Die erfolgreiche Einführung von Material in den Sehnerv wurde durch Antikörperfärbung bestätigt und erschien in der konfokalen Mikroskopie grün, wie in Abbildung 2A zu sehen ist. In Fällen, in denen die Penetration durch die Sehnervenscheide nicht vollständig war oder Material aus der Nadelbahn austrat, war die Färbung entlang des Randes der Sehnervenscheide und nicht innerhalb des Nervengewebes zu sehen, wie in Abbildung 2C zu sehen ist.
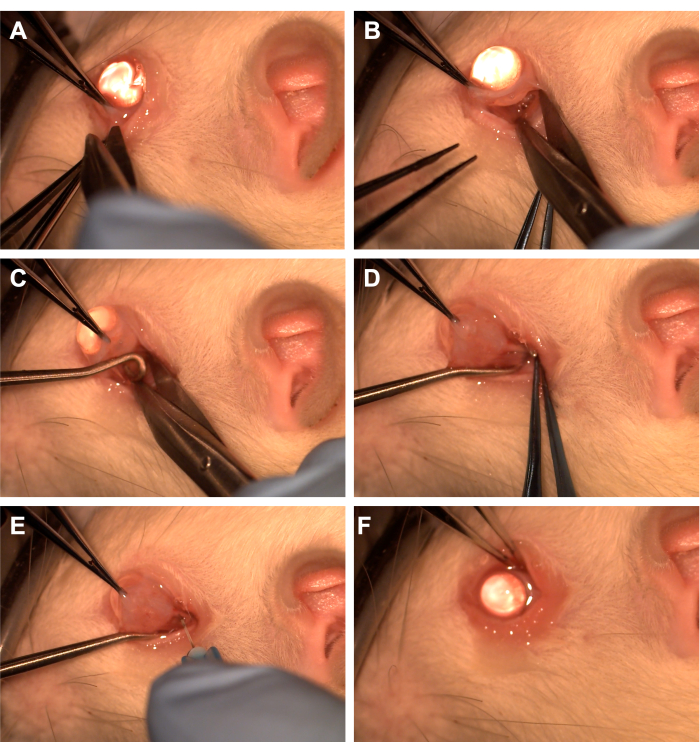
Abbildung 1: Abfolge der Operationsschritte. (A) Die Bindehaut wird mit einer Zahnzange gegriffen und mit einer Westcott-Schere wird eine limbale Peritomie angelegt. (B) Nachdem die Faszie des Zapfens geöffnet und stumpf präpariert wurde, wird die Augenhöhle mit Hilfe einer Westcott-Schere freigelegt. (C) Ein Rückenmarkshaken wird eingeführt und zur Isolierung des Sehnervs verwendet. (D) Nach stumpfer Dissektion des darüber liegenden Orbitagewebes wird der Sehnerv mit dem Rückenmarkshaken freigelegt. (E) Eine 33-G-Nadel wird verwendet, um die Sehnervenscheide zu durchstechen und Adenoviren oder Farbstoffe in den Sehnerv zu injizieren. (F) Der Globus wird in die Orbita zurückversetzt und die Bindehaut wird über der Peritomiestelle neu positioniert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentatives fluoreszierendes konfokales Panoramabild des Sehnervs der Ratte 7 Tage nach erfolgreicher Injektion mit AAV-eGFP (grün), in dem der Vektor Neuronen in der Nähe des Chiasma opticum transduzierte. (A) Die Kerne des Sehnervs sind mit DAPI markiert (blau). ONH mit Pfeil bezeichnet den Sehnervenkopf oder das orbitale Ende des Nervs, während das Chiasma opticum als "Chiasma" bezeichnet wird. (B) Foto eines Sehnervs der Ratte von der Orbita bis zum Chiasma, eingebettet in einen gefrorenen Kryosektionsblock. Der Nerv wird unmittelbar hinter der Augenhöhle (Injektionsstelle durch schwarzen Pfeil gekennzeichnet) mit Tusche injiziert, um den Sehnerv auszurichten. (C) Panorama-Fluoreszenzbild des Sehnervs der Ratte 7 Tage nach erfolgloser Injektion mit AAV-eGFP (grün), bei dem wahrscheinlich der größte Teil der Vektorsuspension aus dem Nerventrakt ausströmte und die Sehscheide transduzierte. Die Kerne des Sehnervs sind mit DAPI (blau) markiert. ONH bezeichnet den Sehnervenkopf unmittelbar hinter der neuralen Netzhaut und der Injektionsstelle, der durch einen weißen Pfeil gekennzeichnet ist. Chiasma und weißer Pfeil grenzen zum Chiasma opticum ab. Maßstabsleisten = 400 μm in (A) und 200 μm in (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Variable | Annähern | ||
| Transkonjunktival | Überlegen | Seitlich | |
| Hautschnitt | Nein | Ja | Ja |
| Bindehautschnitt | Ja | Nein | Nein |
| Mikroskop | Ja | Ja | Ja |
| Durchtrennung des Musculus orbitalis superior | Nein | Ja | Nein |
| Traktionsnaht | Nein | Ja | Ja |
| Haken für das Rückenmark | Ja | Nein | Nein |
| Hautnaht | Nein | Ja | Ja |
Tabelle 1: Vergleich mit zuvor veröffentlichten Techniken zur Isolierung des Sehnervs der Ratte für experimentelle Studien. Variablen, einschließlich der Notwendigkeit eines Hautschnitts, eines Bindehautschnitts, eines Operationsmikroskops, einer Durchtrennung des Musculus orbitalis superior, einer Traktionsnaht, eines Rückenmarkshakens und einer Hautnaht, werden mit dem transkonjunktivalen, superioren und lateralen Zugang verglichen.
Diskussion
Dieser Artikel beschreibt eine neuartige Methode für den Zugang zum Sehnerv der Ratte für experimentelle Studien, ohne dass ein Hautschnitt erforderlich ist. Dieser Ansatz bietet die potenziellen Vorteile der Effizienz und des verringerten Infektions- und Blutungsrisikos, da im Vergleich zu anderen Techniken kein Hautschnitt und weniger Schritte erforderlich sind 8,9. Diese Technik verwendet auch den neuartigen Ansatz, den Sehnerv mit einem Ratten-Rückenmarkhaken zu isolieren, um ein Trauma des Nervs und des umgebenden Gewebes zu vermeiden.
Zu den kritischen Schritten in der Technik gehören die Durchführung eines adäquaten Limbusschnitts für den Zugang zum subkonjunktivalen Raum, die Verwendung des Rückenmarkshakens zur Isolierung des Sehnervs und die Verwendung einer Nadel mit kleiner Bohrung, um die Sehnervenscheide zu durchstechen und Material zum Sehnerv zu transportieren. Es muss darauf geachtet werden, den Rückenmarkshaken zu drehen, um den Nerv zu isolieren. Wenn der Nerv nicht eindeutig isoliert ist, muss der Haken möglicherweise mehrmals eingeführt werden, um sicherzustellen, dass der Nerv isoliert ist, und ein Applikator mit Wattespitze kann verwendet werden, um Bindegewebe aus der Nervenscheide zu entfernen, um eine bessere Visualisierung zu ermöglichen. Der Kontakt mit dieser Technik kann bei größeren Tieren mit einem größeren Volumen an Orbitalfett eine größere Herausforderung darstellen. Die Verwendung eines Assistenten, um das umgebende Gewebe für eine angemessene Exposition zurückzuziehen, kann in diesen Situationen nützlich sein. Es muss darauf geachtet werden, dass der Sehnerv direkt während der Injektion sichtbar gemacht wird. Eine senkrechte Ausrichtung der Nadel durch die Nervenscheide während der Injektion verbessert den Injektionserfolg.
Diese Technik baut auf früheren Arbeiten von Raykova et al. und Hallas und Wellsauf 8,9. Raykova et al. beschrieben den Zugang zum Sehnerv der Ratte unter Verwendung eines superioren Zugangs mit einem Hautschnitt über dem Orbitakamm und der Durchtrennung des Musculus orbitalis superior8. Dieser Ansatz ermöglicht zwar die Freilegung des Nervs, erfordert jedoch die Durchtrennung eines extraookularen Muskels mit einem höheren Blutungsrisiko und der Notwendigkeit einer Naht des Hautschnitts. In ähnlicher Weise beschreiben Hallas und Wells eine laterale Annäherung an die Rattenorbita, um den Sehnervzu erreichen 9. Sie beschreiben einen lateralen Hautschnitt, gefolgt von einem lateralen Bindehautschnitt und einer Traktionsnaht, die zur Rotation des Auges und zur Freilegung des Sehnervsverwendet wird 9. Ähnlich wie beim überlegenen Ansatz handelt es sich bei dieser Technik um einen Hautschnitt, der einen Wundverschluss und ein höheres Risiko für Infektionen und Blutungen erfordert 8,9. Die hier vorgestellte transkonjunktivale Technik macht einen Haut- und Muskelschnitt überflüssig, wodurch das Risiko von Blutungen/Infektionen verringert und die Effizienz verbessert wird, indem ein Hautschnitt nicht geschlossen werden muss. Das Verfahren verursacht nur minimale Belastungen, ist gut verträglich und erfordert keine langfristige Einnahme von schmerzstillenden oder entzündungshemmenden Medikamenten. Die transkonjunktivale Technik wird mit den zuvor veröffentlichten Techniken in Tabelle 1 verglichen und gegenübergestellt.
Zu den Einschränkungen der in dieser Studie vorgestellten Technik gehört eine Lernkurve für die Isolierung des Sehnervs mit Hilfe des Rückenmarkshakens, aber sobald diese Technik beherrscht ist, ermöglicht sie eine effiziente und atraumatische Isolierung des Nervs. Für diese Technik ist die Vertrautheit mit der Verwendung eines Operationsmikroskops erforderlich. Es gibt zwar eine Lernkurve für diese Technik, aber die geringere Anzahl von Schritten und das Fehlen einer Wundnähe machen es im Vergleich zu den anderen veröffentlichten Ansätzen einfacher, diese Technik zu beherrschen 8,9. Eine vorsichtige, stumpfe Dissektion, um den Nerv und die Scheide freizulegen, ist zwingend erforderlich, da es zu Blutungen aus den nahe gelegenen Gefäßen und dem Muskelgewebe kommen kann. Bei größeren Ratten kann es aufgrund des erhöhten orbitalen Fettes/Gewebes schwieriger sein, große Abschnitte des Sehnervs freizulegen, aber mit Vorsicht kann dieses Gewebe im Allgemeinen mit stumpfer Dissektion entfernt werden, um die Sichtbarkeit des Nervs zu verbessern. Weitere Arbeiten könnten sich mit der Verwendung dieser Technik in anderen Modellsystemen, wie z. B. der Maus, befassen und die chirurgische Effizienz direkt mit anderen Techniken für den Zugang zum Sehnerv vergleichen.
Diese Technik kann von anderen Gruppen verwendet werden, die für experimentelle Studien Zugang zum Sehnerv der Ratte benötigen. Die hier vorgestellten Experimente waren Teil eines größeren Projekts, das darauf abzielte, Wege zur CRISPR-Genkorrektur am Sehnerv in Rattenmodellen der Neurofibromatose Typ 1 (NF1) zu entwickeln. Das ultimative Ziel dieses Projekts ist es, Wege zu finden, die Gentherapie bei Patienten mit NF1 direkt an den Sehnerv zu verabreichen, um die Entwicklung von Sehnervengliomen zu verhindern, die das Sehvermögen bedrohen12. In dieser Studie wurde Tuschefarbstoff oder AAV-eGFP-Vektor in den Sehnerv injiziert, um sicherzustellen, dass das Material in den Sehnerv eingebracht wird, und um zu zeigen, dass der Vektor den Sehnerv durchdringen kann.
Diese Technik könnte von anderen Forschern breiter eingesetzt werden, da möglicherweise ein Zugang zum Nerv oder eine Injektion neuartiger Therapeutika erforderlich ist, um eine Vielzahl von sehgefährdenden Erkrankungen zu behandeln, einschließlich Neubildungen des Sehnervs, degenerativer Prozesse wie Leber-hereditäre Optikusneuropathie, traumatische Optikusneuropathie, Glaukom und Autoimmunerkrankungen wie Optikusneuritis13. 14. Urheberrecht Zum Beispiel beschreiben Singh et al. die Injektion von C6-Gliomzellen in den Sehnerv der Ratte als Modell für Neurofibromatose Typ 1, die den Nerv über einen Hautschnitt erreicht3, Kwon et al. haben den Sehnerv über einen lateralen kutanen Zugang für Studien zur Kompression und Regeneration des Sehnervs mit Stammzellenzugänglich gemacht 6, und Negishi et al. haben den Sehnerv der Ratte für die Platzierung von Schwann-Zelltransplantaten als Modell des Sehnervs zugänglich gemacht Regeneration15. Die hier vorgestellte Technik könnte einen effizienteren und sichereren Ansatz für Studien wie diese bieten, die einen Zugang zum Sehnerv der Ratte benötigen, um eine Vielzahl von experimentellen Fragen zu beantworten.
Zusammenfassend lässt sich sagen, dass diese Arbeit die Wirksamkeit beim Eintritt in den Sehnerv mit einer kleinen Nadel und die Fähigkeit zeigt, die Nervenscheide ohne Hautschnitt zu durchdringen. Die repräsentativen Bilder zeigen, dass der adenovirale Vektor erfolgreich in den Sehnerv eingedrungen ist. Diese Technik findet Anwendung bei einer Vielzahl von Sehnervenexperimenten in der regenerativen Medizin, Onkologie und bei erblichen Netzhauterkrankungen.
Offenlegungen
Keine relevanten Angaben.
Danksagungen
Die Autoren danken der Gilbert Family Foundation für die Finanzierung dieses Projekts.
Materialien
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Referenzen
- Korn, P. et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383 (2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695 (2020).
- Ellouze, S. et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. 99, e52249 (2015).
- Hallas, B.H., Wells, M.R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F. et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. 128, e56272 (2017).
- Han I. H. et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T. et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683 (2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten