Method Article
Implante de enxerto vascular de engenharia de tecidos na artéria carótida de camundongo via técnica de manguito
Neste Artigo
Resumo
Aqui, é apresentado um protocolo para o implante de um enxerto vascular de engenharia tecidual na artéria carótida de camundongo usando a técnica do manguito, fornecendo um modelo animal adequado para investigar os mecanismos de regeneração do tecido vascular.
Resumo
O desenvolvimento de enxertos vasculares de pequeno diâmetro tem sido um empreendimento global, com inúmeros grupos de pesquisa contribuindo para esse campo. A experimentação animal desempenha um papel fundamental na avaliação da eficácia e segurança dos enxertos vasculares, particularmente na ausência de aplicações clínicas. Comparado a modelos animais alternativos, o modelo de implantação de camundongo oferece várias vantagens, incluindo um histórico genético bem definido, um método maduro para a construção de modelos de doenças e um procedimento cirúrgico simples. Com base nessas vantagens, o presente estudo desenvolveu uma técnica simples de manguito para o implante de enxertos vasculares de engenharia de tecidos na artéria carótida de camundongo. Essa técnica começou com a confecção de enxertos vasculares de pequeno diâmetro com policaprolactona (PCL) por meio de fiação eletrostática, seguida pela semeadura de macrófagos nos enxertos por adsorção de perfusão. Posteriormente, os enxertos vasculares de engenharia de tecido celular foram transplantados para a artéria carótida de camundongo usando a técnica do manguito para avaliar a permeabilidade e a capacidade regenerativa. Após 30 dias do implante in vivo , a perviedade vascular mostrou-se satisfatória, com evidência de regeneração neotecidual e formação de uma camada endotelial no interior do lúmen dos enxertos. Todos os dados foram analisados por meio de software estatístico e gráfico. Este estudo estabeleceu com sucesso um modelo de implantação da artéria carótida de camundongo que pode ser usado para explorar as fontes celulares de regeneração vascular e os mecanismos de ação das substâncias ativas. Além disso, fornece suporte teórico para o desenvolvimento de novos enxertos vasculares de pequeno diâmetro.
Introdução
A prevalência e a mortalidade das doenças cardiovasculares estão aumentando globalmente, representando um importante problema de saúde pública1. A cirurgia de revascularização do miocárdio é uma intervenção eficaz para doença coronariana grave e doença vascular periférica2. O uso de enxertos vasculares artificiais com diâmetros superiores a 6 mm tem sido bem documentado em ambientes clínicos. Por outro lado, aqueles com diâmetro inferior a 6 mm são propensos a trombose e hiperplasia intimal, o que pode levar a um risco considerável de reestenose3. Apesar dos avanços significativos na pesquisa e desenvolvimento de enxertos vasculares de pequeno diâmetro nos últimos anos, com vários produtos se aproximando da aplicação clínica, vários desafios permanecem 4,5. Isso inclui uma taxa de permeabilidade de longo prazo relativamente baixa, regeneração vascular limitada e uma compreensão insuficiente do mecanismo de regeneração.
A avaliação pré-clínica de novos enxertos vasculares de pequeno diâmetro baseia-se na implantação in vivo em vários modelos animais. Os modelos mais comumente usados incluem os modelos de implante de artéria carótida de ovelha, artéria femoral de cão, artéria carótida de coelho e artéria abdominal de rato 6,7,8,9. A perviedade dos enxertos vasculares pode ser avaliada em animais de médio a grande porte, como ovelhas, porcos e cães. No entanto, esses estudos envolvem custos substanciais devido à experiência e ao equipamento necessários. Além disso, sua complexidade técnica representa um desafio para a implementação. Em contraste, modelos de pequenos animais, como coelhos e ratos, carecem de espécies transgênicas bem estabelecidas com fundos genéticos claramente definidos, apresentando um obstáculo significativo no estudo dos mecanismos de regeneração vascular.
Comparado aos modelos animais mencionados acima, o modelo de camundongo oferece um procedimento cirúrgico relativamente simples, uma metodologia bem estabelecida para gerar camundongos geneticamente modificados e um histórico genético claramente definido. No entanto, o pequeno diâmetro dos vasos sanguíneos de camundongos torna a anastomose término-terminal em enxerto vascular tecnicamente complexa, exigindo experiência significativa e produzindo uma taxa de sucesso relativamente baixa. Para reduzir a complexidade do procedimento e melhorar a taxa de sucesso do implante de enxerto vascular, o presente estudo empregou a técnica do manguito em um modelo de implante de artéria carótida de camundongo.
Após a implantação in vivo , os enxertos vasculares podem recrutar células endógenas que contribuem para a regeneração do tecido vascular. A presença dessas células facilita a endotelização e regeneração da camada de músculo liso dos enxertos. 10. No entanto, a fonte e o tipo de células envolvidas na regeneração do tecido vascular permanecem obscuros, e várias teorias concorrentes estão sob investigação11. Entre estes, a pesquisa se concentrou nos papéis das células-tronco inflamatórias e estaminais. Breuer et al. semearam monócitos derivados da medula óssea humana (hBMCs) em enxertos vasculares e descobriram que as células semeadas recrutaram células hospedeiras para a parede do enxerto por meio da liberação da proteína quimioatraente de monócitos-1 (MCP-1), promovendo assim a regeneração do tecido vascular12. Neste estudo, um método eficiente de semeadura celular por adsorção de perfusão foi proposto e usado com sucesso para semear macrófagos em enxertos vasculares de policaprolactona (PCL) de pequeno diâmetro. Após a implantação, essas células exibiram viabilidade sustentada.
Este artigo detalha a metodologia para a preparação de enxertos vasculares de engenharia de tecidos e o procedimento de implantação da artéria carótida em camundongos usando a técnica do manguito. O processo começa com a fabricação de enxertos vasculares de pequeno diâmetro do LCP com parâmetros definidos por meio de fiação eletrostática. Posteriormente, os enxertos considerados aptos para implantação passam por testes mecânicos. Os macrófagos são então semeados nos enxertos vasculares usando o método de adsorção de perfusão. Finalmente, enxertos vasculares semeados por macrófagos são implantados na artéria carótida de camundongo usando a técnica do manguito, e a permeabilidade e as propriedades regenerativas são analisadas após um mês de implantação in vivo .
Esta técnica tem o potencial de aumentar a eficácia e as taxas de sucesso do enxerto vascular em modelos de camundongos. Além disso, o modelo pode ser usado para investigar os mecanismos subjacentes às fontes celulares, genes essenciais e fatores ativos na regeneração vascular, fornecendo suporte teórico e metodológico para a modificação funcional e o desenvolvimento de novos enxertos vasculares de pequeno diâmetro.
Protocolo
Todos os procedimentos em animais foram aprovados pelo Comitê de Ética em Experimentos com Animais do Instituto de Medicina de Radiação da Academia Chinesa de Ciências Médicas e cumpriram as Diretrizes para o Cuidado e Uso de Animais de Laboratório. Camundongos C57BL/6 machos, de 6 a 8 semanas de idade, com peso corporal de 25 a 30 g, foram utilizados neste estudo. Os detalhes dos reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Fabricação de enxertos vasculares de pequeno diâmetro
NOTA: Confeccionar enxertos vasculares de LCP de pequeno diâmetro usando a técnica de eletrofiação13.
- Prepare soluções de PCL a 10%, 15% e 20% (p / v) em hexafluoroisopropanol (HFIP) à temperatura ambiente (RT) por 12 h.
- Coloque as soluções de PCL em uma seringa de 10 mL e posicione a seringa com uma agulha de aço inoxidável de 21 G.
- Coloque um mandril de aço de tungstênio (0,7 mm de diâmetro, 20 cm de comprimento) no instrumento de coleta.
- Confeccionar nove grupos de enxertos vasculares do LCP usando a técnica de eletrofiação. Conecte um alto voltage fonte de alimentação à agulha. Posicione uma haste de aço de tungstênio com um diâmetro interno de 0.7 mm a uma distância fixa na frente da agulha como um dispositivo receptor.
NOTA: A descrição dos grupos de enxertos vasculares é fornecida na Tabela 1, e os parâmetros dos enxertos vasculares estão detalhados na Tabela 2. - Sujeitar os enxertos vasculares fabricados a um processo de evacuação. Coloque os enxertos vasculares em um forno de secagem a vácuo por 72 h para remover os solventes residuais.
- Esterilize os enxertos mergulhando-os em álcool medicinal por 30 min e expondo-os à luz ultravioleta durante a noite.
- Observar a morfologia microscópica dos enxertos vasculares utilizando um microscópio eletrônico de varredura (MEV). Prenda os enxertos vasculares ao estágio de amostra de MEV com adesivo condutor e coloque-os no dispositivo de pulverização catódica de ouro para revestimento.
- Observe a estrutura e a morfologia das fibras dos enxertos vasculares usando MEV a uma tensão acelerada de 15 kV. Meça o diâmetro da fibra e o tamanho dos poros a partir de imagens SEM (n = 5) usando o software ImageJ.
- Avaliar as propriedades mecânicas (propriedades de tração e elásticas) dos enxertos vasculares usando uma máquina de teste de tração. Clamp as extremidades superior e inferior do enxerto vascular com grampos fixos espaçados de 1 cm.
- Estique o enxerto vascular a uma taxa de 10 mm/min até a ruptura. Colete a curva tensão-deformação da máquina de teste de tração.
- Calcule os parâmetros mecânicos, incluindo carga máxima (2-15 N), tensão na ruptura (5-30 MPa), deformação na ruptura (200%-1500%) e módulo de elasticidade (1-20 MPa)14.
- Realize análises estatísticas usando software estatístico e gráfico. Expresse os dados como média ± desvio padrão. Analisar e comparar diferenças univariadas entre vários grupos usando o teste post hoc de Tukey em ANOVA unidirecional. *P < 0,05, **P < 0,01, ***P < 0,001.
2. Semeadura de macrófagos em enxertos vasculares
NOTA: Certifique-se de que todas as soluções e materiais sejam estéreis. Realize todas as operações dentro da sala de cultura de células.
- Cultura RAW264.7 (macrófago de monócitos de camundongo) em frascos sob condições aderentes (Figura 1A). Preparar o meio de cultura celular utilizando meio de Eagle modificado de Dulbecco completo (DMEM) suplementado com penicilina-estreptomicina a 1% e soro bovino fetal a 10%. Colocar os frascos numa estufa a 37 °C contendo 5% de dióxido de carbono.
- Colete macrófagos usando um raspador de células. Descarte o meio usando uma pipeta de 1 mL e lave as células com PBS.
- Adicione 2 ml de meio fresco ao frasco de cultura e raspe suavemente a superfície com um raspador de células. Transfira as células coletadas para um tubo e centrifugue a 1.000 x g por 5 min em temperatura ambiente. Ressuspenda 5 × 106 células em 100 μL de meio completo.
- Coloque um enxerto vascular PCL (1 cm de comprimento) em um tubo de 15 mL cheio de DMEM e centrifugue a 4.000 x g por 5 min. Repita esse processo várias vezes até que o enxerto afunde no fundo do tubo, garantindo a infiltração completa do material com DMEM.
- Prepare uma placa de Petri de 10 cm forrada com uma camada de papel de filtro. Coloque o enxerto vascular PCL umedecido no papel de filtro e enrole-o para remover o excesso de meio.
- Pegue 10 μL da suspensão celular usando uma pipeta de 10 μL e injete-a em uma extremidade do enxerto vascular. Gire o enxerto vascular sobre o papel de filtro para facilitar a distribuição uniforme da suspensão. Injetar cinco vezes em cada extremidade para um total de dez injecções (Figura 1B,C).
- Coloque o enxerto vascular carregado com macrófagos em uma placa de 24 poços contendo 1 mL de meio completo e incube por 2 h em uma incubadora de cultura de células antes do implante.
- Determine a distribuição das células dentro da parede do enxerto. Incorpore o enxerto vascular carregado de macrófagos no composto de tomografia de coerência óptica (OCT) para criossecção. Núcleos de células coradas com 4',6-diamidino-2-fenilindol (DAPI) e observar ao microscópio de fluorescência.
3. Modelo de implantação da artéria carótida de camundongo
NOTA: Mantenha uma área cirúrgica estéril para procedimentos em animais. Esterilize todos os instrumentos cirúrgicos e descartáveis antes da cirurgia.
- Selecione três camundongos C57BL/6 machos saudáveis, cada um pesando 25-30 g. Jejue os ratos um dia antes da cirurgia. Implante um enxerto vascular em cada animal, totalizando três enxertos.
- Construa os manguitos a partir de um tubo de náilon (Figura 2A) e apresente o diagrama esquemático da técnica do manguito vascular na Figura 2B.
- Anestesiar os camundongos por injeção intraperitoneal de pentobarbital sódico na concentração de 50 mg / kg (seguindo protocolos aprovados institucionalmente). Confirme a anestesia eficaz, garantindo o relaxamento muscular e até mesmo a respiração. Aplique pomada oftálmica de petrolato nos olhos para evitar o ressecamento durante a anestesia.
- Posicione o mouse em decúbito dorsal na mesa de operação e remova os pelos do pescoço. Esterilize a área cirúrgica com iodóforo. Cubra a área não cirúrgica com gaze estéril para manter um ambiente estéril (Figura 3A).
- Use uma tesoura oftálmica para fazer uma incisão na linha média (1,5-2 cm de comprimento) da mandíbula ao esterno. Eleve as glândulas salivares esquerdas e excise o músculo cleidomastóideo esquerdo para aumentar o campo de visão cirúrgico. Expor a artéria carótida comum esquerda com micropinças (Figura 3B).
- Isole a artéria carótida esquerda usando microfórceps (Figura 3C).
- Ligue a artéria carótida em dois locais na porção média usando uma sutura 9-0. Passe a artéria entre as duas ligaduras usando uma microtesoura. Passe o manguito pelas artérias em cada extremidade e prenda a artéria e o manguito juntos usando clipes arteriais (Figura 3D).
- Vire a artéria para fora para cobrir o corpo do manguito e prenda-a ao manguito usando uma sutura 9-0 com micropinças (Figura 3E).
- Implante um enxerto vascular entre as duas extremidades da artéria carótida deslizando as extremidades do enxerto sobre o manguito da artéria e prendendo-as com suturas 9-0 (Figura 3F).
NOTA: Os dados dimensionais do balonete, artéria carótida e enxerto vascular são apresentados na Tabela 3. Embora os diâmetros do enxerto e do manguito correspondam aos das artérias carótidas do camundongo, existe uma incompatibilidade entre o diâmetro do lúmen anastomótico e o diâmetro do enxerto. O diâmetro do lúmen da anastomose é calculado subtraindo-se duas vezes a espessura da parede da artéria carótida (0,1 mm) do diâmetro interno do balonete (0,5 mm), resultando em um diâmetro do lúmen de 0,3 mm. O enxerto vascular tem um diâmetro interno de 0,7 mm, levando a uma incompatibilidade de aproximadamente 2,3 vezes (0,7 mm / 0,3 mm = 2,3). - Remova os clipes arteriais em ambas as extremidades e irrigue o local de implantação com solução salina. Avalie a perviedade do enxerto vascular observando a pulsação arterial distal (Figura 3G).
- Reposicionar a glândula salivar esquerda e fechar o sítio cirúrgico com pontos 6-0 (Figura 3H).
4. Cuidados e análise pós-procedimento
- Transfira o camundongo para uma incubadora a 37 °C e monitore continuamente seus sinais vitais até que ele recupere a consciência.
- Injete 5 mg / kg de carbinol para alívio da dor pós-operatória.
- Monitore o mouse durante o período de recuperação e não o devolva ao alojamento do grupo até que ele esteja totalmente recuperado.
- Anestesiar os camundongos um mês após o implante e colher as amostras de enxerto vascular para análise histológica9.
- Realizar a eutanásia via asfixia por CO2 seguida de luxação cervical seguindo as diretrizes éticas.
Resultados
Enxertos vasculares de pequeno diâmetro com diferentes parâmetros foram preparados com sucesso por eletrospinning. As imagens de MEV revelaram que as fibras estavam uniformemente distribuídas e exibiam um arranjo irregular dentro da parede do enxerto, com a presença de estruturas porosas (Figura 4). À medida que a concentração de PCL aumentava, tanto o diâmetro da fibra quanto o tamanho dos poros aumentavam. Os valores específicos para cada grupo de enxerto vascular são apresentados na Tabela 2. Os resultados dos testes mecânicos demonstraram que todos os enxertos vasculares atenderam aos padrões mecânicos exigidos. A carga máxima e a deformação na ruptura aumentaram com maiores concentrações de PCL e maior espessura da parede vascular (Figura 5A-C), enquanto o módulo de elasticidade diminuiu (Figura 5D). Com base nesses achados, enxertos vasculares de pequeno diâmetro com concentração de PCL de 15% e espessura de parede de 150 μm foram selecionados como enxertos ideais para experimentos subsequentes.
Neste estudo, os macrófagos foram semeados em enxertos vasculares usando o método de adsorção de perfusão. A análise de MEV confirmou que os macrófagos foram semeados com sucesso nos enxertos vasculares e exibiram uma distribuição uniforme (Figura 6A). Os enxertos transversais submetidos à coloração DAPI revelaram que os macrófagos semeados haviam se infiltrado do lúmen do enxerto para a parede do enxerto (Figura 6B).
Trinta dias após o implante in vivo , a taxa de sobrevivência dos animais foi de 100%, e dois dos três enxertos vasculares implantados permaneceram pérvios, o que foi um resultado satisfatório em modelos de camundongos. Não foram observados aneurismas ou encapsulamento fibroso perceptível dos enxertos ao microscópio estereoscópico (Figura 7A). A extensão da infiltração celular e da regeneração tecidual foi avaliada por meio de análise histológica. A coloração de hematoxilina e eosina (H&E) revelou infiltração celular substancial dentro da parede do enxerto e formação de neotecido dentro do lúmen interno do enxerto (Figura 7B). A coloração por imunofluorescência CD31 demonstrou a regeneração de uma única camada de tecido endotelial dentro da luz interna dos enxertos, com cobertura de células endoteliais relativamente intacta (Figura 7C).

Figura 1: Procedimento de semeadura celular. (A) Cultura de células RAW264.7. Barra de escala: 100 μm. (B) Esquema do processo de semeadura celular. (C) Células RAW264.7 semeadas na parede do enxerto usando o método de perfusão-adsorção. Clique aqui para ver uma versão maior desta figura.

Figura 2: Técnica do manguito. (A) Preparação de manguitos vasculares. (B) Representação esquemática da técnica do manguito vascular. Enxertos vasculares foram implantados na artéria carótida usando este método. Clique aqui para ver uma versão maior desta figura.

Figura 3: Procedimento cirúrgico para implante de enxerto vascular em modelo de camundongo. (A) Injeção de anestésicos, posicionamento do camundongo em decúbito dorsal e imobilização das patas. (B) Exposição da área cirúrgica. (C) Isolamento da artéria carótida. (D) Colocação do manguito ao redor da artéria carótida. (E) Eversão da artéria sobre o corpo do manguito e fixação com sutura 9-0. (F) Manga do enxerto vascular sobre o manguito arterial e sutura. (G) Remoção de grampos vasculares. (H) Fechamento da pele. Clique aqui para ver uma versão maior desta figura.
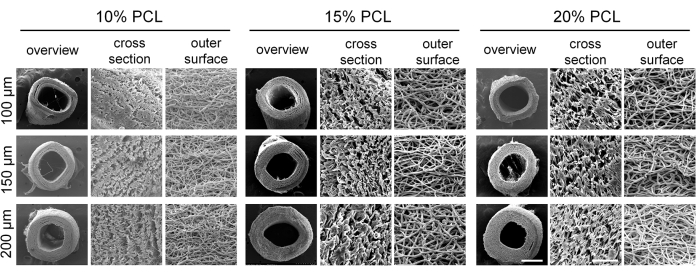
Figura 4: Morfologia dos enxertos vasculares de policaprolactona eletrofiada (PCL). Imagens representativas de microscopia eletrônica de varredura (MEV) demonstrando a estrutura fibrosa bem definida dos enxertos vasculares. Barras de escala: 500 μm e 50 μm (imagens ampliadas). Clique aqui para ver uma versão maior desta figura.
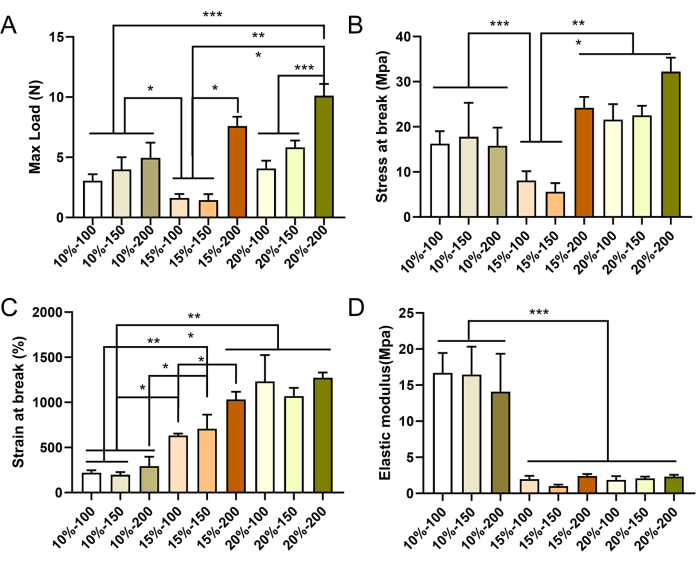
Figura 5: Propriedades mecânicas de enxertos vasculares eletrofiados de LCP. Caracterização mecânica dos enxertos vasculares no sentido longitudinal, mostrando carga máxima (A), tensão máxima (B), deformação na ruptura (C) e módulo de elasticidade (D). Os dados são expressos como média ± desvio padrão (DP) (n = 3). *P < 0,05, **P < 0,01, ***P < 0,001, ANOVA one-way seguida do teste post hoc de Tukey. Clique aqui para ver uma versão maior desta figura.
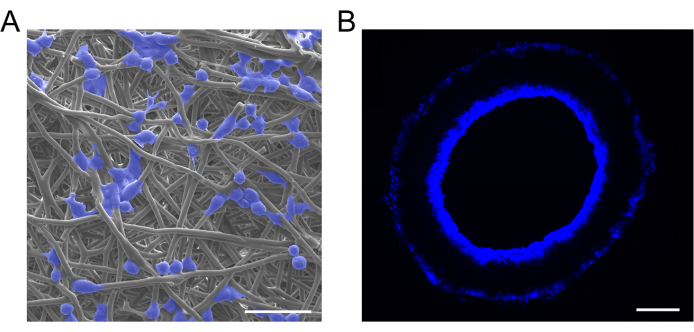
Figura 6: Caracterização dos enxertos carregados de células. (A) Imagens representativas de MEV e (B) coloração de 4',6-diamidino-2-fenilindol (DAPI) de enxertos vasculares carregados de células, mostrando implantação bem-sucedida de macrófagos e distribuição uniforme. Barras de escala: 30 μm e 100 μm. Clique aqui para ver uma versão maior desta figura.
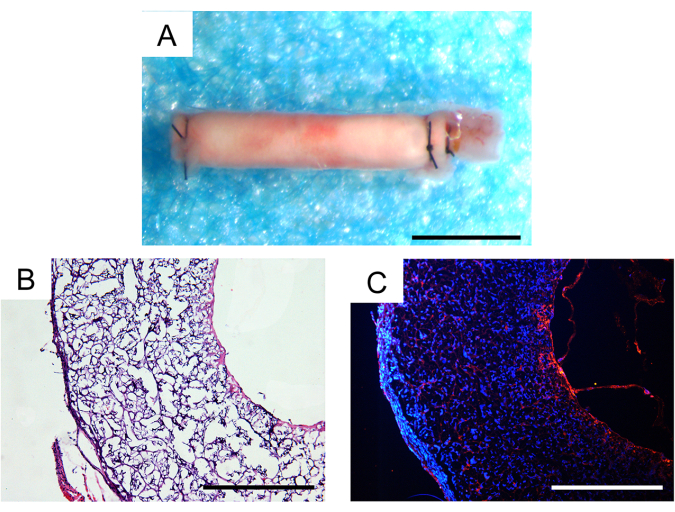
Figura 7: Análise histológica dos enxertos vasculares explantados um mês após o implante. (A) Imagem estereoscópica mostrando ausência de formação de aneurisma ou encapsulamento fibroso. Barra de escala: 500 μm. (B) Coloração de hematoxilina e eosina (H&E) demonstrando boa celularização e regeneração tecidual. Barra de escala: 200 μm. (C) Coloração por imunofluorescência CD31 revelando uma monocamada de células endoteliais na superfície luminal. Barra de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
| Grupo | Concentração de PCL solução (%) | espessura do enxerto vascular (μm) | distância do coletor de agulhas (cm) | Vazão (mL/h) | voltagem (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tabela 1: Descrição dos grupos de enxertos vasculares. PCL, policaprolactona.
| Grupo | Diâmetro da fibra (μm) | Tamanho dos poros (μm) |
| 10%-100 | 0,51±0,12 | 2,48±1,38 |
| 10%-150 | 0,91±0,4 | 1,83±0,84 |
| 10%-200 | 0,73±0,35 | 2,24±0,83 |
| 15%-100 | 1,85±0,3 | 8,91±2,87 |
| 15%-150 | 1,82±0,34 | 8.41±2.72 |
| 15%-200 | 2,18±0,47 | 9.59±3.01 |
| 20%-100 | 3,61±1,02 | 13.95±4.7 |
| 20%-150 | 3,06±0,56 | 13.12±3.36 |
| 20%-200 | 3,46±0,66 | 13.92±4.19 |
Tabela 2: Parâmetros estruturais de diferentes enxertos vasculares.
| Grupo | Diâmetro interno (mm) | diâmetro externo (mm) | espessura de parede (μm) | comprimento (cm) |
| artéria carótida | 0.5-0.6 | 0.6-0.7 | 100 | / |
| enxerto vascular | 0.7 | 1 | 150 | 0.8 |
| algema | 0.5 | 0.63 | 65 | / |
Tabela 3: Dados dimensionais do manguito, artéria carótida e enxerto vascular.
Discussão
O uso da técnica do manguito para implantar enxertos vasculares de engenharia tecidual na artéria carótida de camundongo representa um avanço significativo na pesquisa cardiovascular15. As etapas críticas desta técnica incluem a semeadura celular e a implantação do enxerto. Este estudo empregou uma abordagem de adsorção de perfusão para aumentar a densidade de semeadura de macrófagos para abordar questões relacionadas à semeadura celular não uniforme e baixa viabilidade celular. Esse método permitiu que os macrófagos se infiltrassem na parede do enxerto vascular e a distribuíssem uniformemente.
Em relação ao implante vascular, a técnica do balonete, ao contrário da anastomose término-terminal16, pode estar associada a uma maior incidência de estenose, principalmente quando aplicada em vasos de menor diâmetro. Para minimizar esse efeito, foram selecionados manguitos com diâmetros internos e externos semelhantes aos das artérias carótidas de camundongos. As dimensões relevantes são fornecidas na Tabela 3.
Essa técnica facilita um procedimento cirúrgico mais simples para o implante de enxerto vascular na artéria carótida do camundongo. Os modelos animais mais frequentemente utilizados em estudos anteriores de enxertos vasculares de pequeno diâmetro incluem a fístula arteriovenosa jugular de ovelha e os modelos de implante de artéria abdominal de rato17,18. Esses modelos são eficazes para avaliar a resistência mecânica e a capacidade de remodelação tecidual de enxertos vasculares; no entanto, eles são limitados em sua capacidade de elucidar os mecanismos subjacentes. Camundongos geneticamente modificados surgiram como um modelo importante para a investigação de mecanismos de regeneração vascular, abordando as limitações de outros modelos animais.
Por exemplo, camundongos knockout para apolipoproteína E (ApoE) desenvolvem espontaneamente hipercolesterolemia e lesões ateroscleróticas19, tornando-os um modelo valioso para simular condições clínicas que requerem transplante vascular. A avaliação da permeabilidade e regeneração vascular em camundongos knockout para ApoE fornece dados de referência importantes para a tradução clínica de enxertos vasculares. Além disso, camundongos deficientes em genes podem ser utilizados para investigar os papéis de genes-chave na regeneração vascular. A óxido nítrico sintase endotelial (eNOS), um regulador crítico da função vascular, é uma fonte primária de óxido nítrico20. Camundongos deficientes no gene eNOS servem como modelo de pesquisa para elucidar os mecanismos pelos quais esse gene influencia a remodelação vascular. Além disso, a origem das células envolvidas na regeneração do tecido vascular pode ser explorada por meio de marcação celular in vivo e rastreamento de linhagem usando camundongos repórter21,22.
Esta técnica tem certas limitações quanto ao número de animais utilizados e à duração do transplante. O presente estudo concentrou-se principalmente em avaliar a viabilidade desse método de enxertia usando uma abordagem in vivo de curto prazo. Estudos futuros devem aumentar o tamanho da amostra e realizar avaliações de longo prazo para avaliar de forma abrangente o impacto desse método na formação de aneurismas, perviedade e hiperplasia intimal.
Além disso, a taxa de perviedade do enxerto foi de 66,6%, o que pode ter sido influenciado por uma incompatibilidade de diâmetro (2,3 vezes) no local da anastomose. Essa incompatibilidade pode levar a distúrbios localizados do fluxo sanguíneo, aumentando o risco de trombose. Mais estudos são necessários para otimizar o design do balonete para reduzir as discrepâncias de diâmetro e investigar seus efeitos nas taxas de perviedade.
Em conclusão, o modelo de implante da artéria carótida de camundongo baseado na técnica do manguito fornece um modelo animal simples e eficaz para a avaliação biológica de enxertos vasculares de pequeno diâmetro. Além disso, permite a investigação dos papéis de vários tipos de células na remodelação do tecido vascular e nos mecanismos regenerativos subjacentes.
Divulgações
Os autores não têm interesses financeiros conflitantes.
Agradecimentos
O financiamento para este estudo foi fornecido pelos projetos da Fundação Nacional de Ciências Naturais da China (nº 32101098, 32071356 e 82272158) e pelo Fundo de Inovação CAMS para Ciências Médicas (nº 2022-I2M-1-023).
Materiais
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Referências
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados