Method Article
Impianto di innesto vascolare di ingegneria tissutale nell'arteria carotide di topo tramite tecnica della cuffia
In questo articolo
Riepilogo
Qui, viene presentato un protocollo per l'impianto di un innesto vascolare di ingegneria tissutale nell'arteria carotide di topo utilizzando la tecnica della cuffia, fornendo un modello animale adatto per studiare i meccanismi di rigenerazione del tessuto vascolare.
Abstract
Lo sviluppo di innesti vascolari di piccolo diametro è stato uno sforzo globale, con numerosi gruppi di ricerca che hanno contribuito a questo campo. La sperimentazione animale svolge un ruolo fondamentale nella valutazione dell'efficacia e della sicurezza degli innesti vascolari, in particolare in assenza di applicazioni cliniche. Rispetto ai modelli animali alternativi, il modello di impianto del topo offre diversi vantaggi, tra cui un background genetico ben definito, un metodo maturo per la costruzione del modello di malattia e una procedura chirurgica semplice. Sulla base di questi vantaggi, il presente studio ha ideato una semplice tecnica di cuffia per l'impianto di innesti vascolari di ingegneria tissutale nell'arteria carotide di topo. Questa tecnica è iniziata con la fabbricazione di innesti vascolari di piccolo diametro in policaprolattone (PCL) mediante filatura elettrostatica, seguita dalla semina di macrofagi sugli innesti attraverso l'adsorbimento per perfusione. Successivamente, gli innesti vascolari di ingegneria tissutale cellularizzata sono stati trapiantati nell'arteria carotide di topo utilizzando la tecnica della cuffia per valutare la pervietà e la capacità rigenerativa. Dopo 30 giorni di impianto in vivo , la pervietà vascolare è risultata soddisfacente, con evidenza di rigenerazione neo-tissutale e la formazione di uno strato endoteliale all'interno del lume degli innesti. Tutti i dati sono stati analizzati utilizzando software statistici e grafici. Questo studio ha stabilito con successo un modello di impianto dell'arteria carotide di topo che può essere utilizzato per esplorare le fonti cellulari di rigenerazione vascolare e i meccanismi d'azione delle sostanze attive. Inoltre, fornisce supporto teorico per lo sviluppo di nuovi innesti vascolari di piccolo diametro.
Introduzione
La prevalenza e la mortalità delle malattie cardiovascolari sono in aumento a livello globale, rappresentando un notevole problema per la salute pubblica1. L'innesto di bypass vascolare è un intervento efficace per la malattia coronarica grave e la malattia vascolare periferica2. L'uso di innesti vascolari artificiali con diametri superiori a 6 mm è stato ben documentato in ambito clinico. Al contrario, quelli con un diametro inferiore a 6 mm sono inclini alla trombosi e all'iperplasia intimale, che possono portare a un notevole rischio di restenosi3. Nonostante i significativi progressi nella ricerca e nello sviluppo di innesti vascolari di piccolo diametro negli ultimi anni, con diversi prodotti che si avvicinano all'applicazione clinica, rimangono molteplici sfide 4,5. Questi includono un tasso di pervietà a lungo termine relativamente basso, una rigenerazione vascolare limitata e una comprensione insufficiente del meccanismo di rigenerazione.
La valutazione preclinica di nuovi innesti vascolari di piccolo diametro si basa sull'impianto in vivo in vari modelli animali. I modelli più comunemente usati includono l'arteria carotide di pecora, l'arteria femorale di cane, l'arteria carotide di coniglio e i modelli di impianto dell'arteria addominale di ratto 6,7,8,9. La pervietà degli innesti vascolari può essere valutata in animali di taglia medio-grande, come pecore, suini e cani. Tuttavia, questi studi comportano costi considerevoli a causa delle competenze e delle attrezzature necessarie. Inoltre, la loro complessità tecnica rappresenta una sfida per l'implementazione. Al contrario, i modelli di piccoli animali come conigli e ratti mancano di specie transgeniche ben consolidate con background genetici chiaramente definiti, il che rappresenta un ostacolo significativo nello studio dei meccanismi di rigenerazione vascolare.
Rispetto ai modelli animali sopra citati, il modello murino offre una procedura chirurgica relativamente semplice, una metodologia ben consolidata per la generazione di topi geneticamente modificati e un background genetico chiaramente definito. Tuttavia, il diametro ridotto dei vasi sanguigni di topo rende tecnicamente complessa l'anastomosi end-to-end nell'innesto vascolare, che richiede una notevole esperienza e produce un tasso di successo relativamente basso. Per ridurre la complessità della procedura e migliorare il tasso di successo dell'impianto di innesto vascolare, il presente studio ha impiegato la tecnica della cuffia in un modello di impianto dell'arteria carotide di topo.
Dopo l'impianto in vivo , gli innesti vascolari possono reclutare cellule endogene che contribuiscono alla rigenerazione del tessuto vascolare. La presenza di queste cellule facilita l'endotelizzazione e la rigenerazione dello strato muscolare liscio degli innesti. 10. Tuttavia, l'origine e il tipo di cellule coinvolte nella rigenerazione del tessuto vascolare rimangono poco chiari e sono in fase di studio diverse teorie concorrenti11. Tra queste, la ricerca si è concentrata sui ruoli delle cellule infiammatorie e delle cellule staminali. Breuer et al. hanno seminato monociti derivati dal midollo osseo umano (hBMC) su innesti vascolari e hanno scoperto che le cellule seminate reclutavano cellule ospiti nella parete dell'innesto attraverso il rilascio della proteina chemioattrattiva dei monociti-1 (MCP-1), promuovendo così la rigenerazione del tessuto vascolare12. In questo studio, è stato proposto un efficiente metodo di semina cellulare con adsorbimento di perfusione, utilizzato con successo per seminare macrofagi su innesti vascolari di piccolo diametro di policaprolattone (PCL). Dopo l'impianto, queste cellule hanno mostrato una vitalità sostenuta.
Questo articolo descrive in dettaglio la metodologia per la preparazione di innesti vascolari di ingegneria tissutale e la procedura di impianto dell'arteria carotidea nei topi utilizzando la tecnica della cuffia. Il processo inizia con la fabbricazione di innesti vascolari di piccolo diametro PCL con parametri definiti tramite filatura elettrostatica. Successivamente, gli innesti ritenuti idonei all'impianto vengono sottoposti a test meccanici. I macrofagi vengono quindi seminati sugli innesti vascolari utilizzando il metodo dell'adsorbimento di perfusione. Infine, gli innesti vascolari con seme di macrofagi vengono impiantati nell'arteria carotide di topo utilizzando la tecnica della cuffia e la pervietà e le proprietà rigenerative vengono analizzate dopo un mese dall'impianto in vivo .
Questa tecnica ha il potenziale per migliorare l'efficacia e le percentuali di successo dell'innesto vascolare in modelli murini. Inoltre, il modello può essere utilizzato per studiare i meccanismi alla base delle fonti cellulari, dei geni cardine e dei fattori attivi nella rigenerazione vascolare, fornendo supporto teorico e metodologico per la modifica funzionale e lo sviluppo di nuovi innesti vascolari di piccolo diametro.
Protocollo
Tutte le procedure sugli animali sono state approvate dal Comitato Etico per gli Esperimenti sugli Animali dell'Istituto di Medicina delle Radiazioni, Accademia Cinese delle Scienze Mediche, e sono state conformi alle Linee Guida per la Cura e l'Uso degli Animali da Laboratorio. In questo studio sono stati utilizzati topi maschi C57BL/6, di 6-8 settimane, con un peso corporeo di 25-30 g. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Fabbricazione di innesti vascolari di piccolo diametro
NOTA: Fabbricare innesti vascolari PCL di piccolo diametro utilizzando la tecnica dell'elettrofilatura13.
- Preparare soluzioni PCL al 10%, 15% e 20% (p/v) in esafluoroisopropanolo (HFIP) a temperatura ambiente (RT) per 12 ore.
- Caricare le soluzioni PCL in una siringa da 10 ml e posizionare la siringa con un ago in acciaio inossidabile da 21 G.
- Posizionare un mandrino in acciaio al tungsteno (0,7 mm di diametro, 20 cm di lunghezza) sullo strumento di raccolta.
- Fabbricare nove gruppi di innesti vascolari PCL utilizzando la tecnica dell'elettrofilatura. Collegare un alimentatore ad alta tensione all'ago. Posizionare un'asta di acciaio al tungsteno con un diametro interno di 0,7 mm a una distanza fissa davanti all'ago come dispositivo ricevente.
NOTA: La descrizione dei gruppi di innesti vascolari è fornita nella Tabella 1 e i parametri degli innesti vascolari sono dettagliati nella Tabella 2. - Sottoporre gli innesti vascolari fabbricati a un processo di evacuazione. Porre gli innesti vascolari in un forno di essiccazione sottovuoto per 72 ore per rimuovere i solventi residui.
- Sterilizzare gli innesti immergendoli in alcool medico per 30 minuti ed esponendoli ai raggi UV durante la notte.
- Osservare la morfologia microscopica degli innesti vascolari utilizzando un microscopio elettronico a scansione (SEM). Fissare gli innesti vascolari allo stadio del campione SEM con adesivo conduttivo e posizionarli nel dispositivo di spruzzatura dell'oro per il rivestimento.
- Osservare la struttura e la morfologia delle fibre degli innesti vascolari utilizzando il SEM a una tensione di accelerazione di 15 kV. Misura il diametro delle fibre e la dimensione dei pori dalle immagini SEM (n = 5) utilizzando il software ImageJ.
- Valutare le proprietà meccaniche (proprietà di trazione ed elasticità) degli innesti vascolari utilizzando una macchina per prove di trazione. Bloccare le estremità superiore e inferiore dell'innesto vascolare con pinze fisse distanziate di 1 cm l'una dall'altra.
- Allungare l'innesto vascolare a una velocità di 10 mm/min fino alla rottura. Raccogli la curva sforzo-deformazione dalla macchina per prove di trazione.
- Calcola i parametri meccanici, tra cui il carico massimo (2-15 N), la sollecitazione a rottura (5-30 MPa), la deformazione a rottura (200%-1500%) e il modulo elastico (1-20 MPa)14.
- Esegui analisi statistiche utilizzando software statistici e grafici. Esprimere i dati come media ± deviazione standard. Analizza e confronta le differenze univariate tra più gruppi utilizzando il test post hoc di Tukey in ANOVA unidirezionale. *P < 0,05, **P < 0,01, ***P < 0,001.
2. Semina di macrofagi su innesti vascolari
NOTA: Assicurarsi che tutte le soluzioni e i materiali siano sterili. Condurre tutte le operazioni all'interno della sala di coltura cellulare.
- Coltura RAW264.7 (macrofago monocitario di topo) in fiasche in condizioni aderenti (Figura 1A). Preparare il terreno di coltura cellulare utilizzando il terreno di Eagle's modificato (DMEM) completo di Dulbecco, integrato con l'1% di penicillina-streptomicina e il 10% di siero fetale bovino. Porre i matracci in un'incubatrice a 37 °C contenente il 5% di anidride carbonica.
- Raccogli i macrofagi usando un raschietto cellulare. Eliminare il terreno utilizzando una pipetta da 1 ml e lavare le cellule con PBS.
- Aggiungere 2 ml di terreno fresco al pallone di coltura e raschiare delicatamente la superficie con un raschietto cellulare. Trasferire le cellule raccolte in una provetta e centrifugare a 1.000 x g per 5 minuti a temperatura ambiente. Risospendere 5 × 106 cellule in 100 μl di terreno completo.
- Posizionare un innesto vascolare di LCP (1 cm di lunghezza) in una provetta da 15 ml riempita con DMEM e centrifugare a 4.000 x g per 5 minuti. Ripetere questo processo più volte fino a quando l'innesto non affonda sul fondo del tubo, garantendo la completa infiltrazione del materiale con DMEM.
- Preparare una capsula Petri di 10 cm foderata con uno strato di carta da filtro. Posizionare l'innesto vascolare PCL inumidito sulla carta da filtro e arrotolarlo per rimuovere il terreno in eccesso.
- Prelevare 10 μl della sospensione cellulare utilizzando una pipetta da 10 μl e iniettarla in un'estremità dell'innesto vascolare. Ruotare l'innesto vascolare sulla carta da filtro per facilitare la distribuzione uniforme della sospensione. Iniettare ciascuna estremità cinque volte per un totale di dieci iniezioni (Figura 1B, C).
- Posizionare l'innesto vascolare caricato con macrofagi in una piastra a 24 pozzetti contenente 1 mL di terreno completo e incubare per 2 ore in un incubatore per colture cellulari prima dell'impianto.
- Determinare la distribuzione delle cellule all'interno della parete dell'innesto. Incorporare l'innesto vascolare caricato con macrofagi nel composto per tomografia a coerenza ottica (OCT) per la criosezione. Colorare i nuclei cellulari con 4',6-diamidino-2-fenilindolo (DAPI) e osservare al microscopio a fluorescenza.
3. Modello di impianto dell'arteria carotide di topo
NOTA: Mantenere un'area chirurgica sterile per le procedure sugli animali. Sterilizzare tutti gli strumenti chirurgici e i prodotti monouso prima dell'intervento chirurgico.
- Seleziona tre topi maschi sani C57BL/6, ciascuno del peso di 25-30 g. Digiunare i topi il giorno prima dell'intervento. Impiantare un innesto vascolare in ogni animale, per un totale di tre innesti.
- Costruire le braccia da un tubo di nylon (Figura 2A) e presentare il diagramma schematico della tecnica della cuffia vascolare nella Figura 2B.
- Anestetizzare i topi mediante iniezione intraperitoneale di pentobarbital sodico a una concentrazione di 50 mg/kg (seguendo protocolli istituzionalmente approvati). Confermare l'efficacia dell'anestesia garantendo il rilassamento muscolare e una respirazione uniforme. Applicare un unguento oftalmico di vaselina sugli occhi per prevenire la secchezza durante l'anestesia.
- Posizionare il mouse in posizione supina sul tavolo operatorio e rimuovere i peli del collo. Sterilizzare l'area chirurgica con iodoforo. Coprire l'area non chirurgica con una garza sterile per mantenere un ambiente sterile (Figura 3A).
- Usa le forbici oftalmiche per praticare un'incisione sulla linea mediana (1,5-2 cm di lunghezza) dalla mandibola allo sterno. Sollevare le ghiandole salivari sinistre e asportare il muscolo cleidomastoideo sinistro per aumentare il campo visivo chirurgico. Esporre l'arteria carotide comune sinistra utilizzando una micro pinzetta (Figura 3B).
- Isolare l'arteria carotide sinistra utilizzando una micropinza (Figura 3C).
- Legare l'arteria carotide in due punti nella porzione centrale utilizzando una sutura 9-0. Sezionare l'arteria tra le due legature usando le microforbici. Far passare il bracciale attraverso le arterie a ciascuna estremità e fissare l'arteria e il bracciale insieme utilizzando clip arteriose (Figura 3D).
- Ruotare l'arteria verso l'esterno per coprire il corpo della cuffia e fissarla alla cuffia utilizzando una sutura 9-0 con micropinze (Figura 3E).
- Impiantare un innesto vascolare tra le due estremità dell'arteria carotide facendo scorrere le estremità dell'innesto sulla cuffia dell'arteria e fissandole con suture 9-0 (Figura 3F).
NOTA: I dati dimensionali della cuffia, dell'arteria carotide e dell'innesto vascolare sono presentati nella Tabella 3. Sebbene i diametri dell'innesto e della cuffia corrispondano strettamente a quelli delle arterie carotidi di topo, esiste una discrepanza tra il diametro del lume anastomotico e il diametro dell'innesto. Il diametro del lume anastomotico viene calcolato sottraendo il doppio dello spessore della parete dell'arteria carotide (0,1 mm) dal diametro interno della cuffia (0,5 mm), ottenendo un diametro del lume di 0,3 mm. L'innesto vascolare ha un diametro interno di 0,7 mm, che porta a una discrepanza di circa 2,3 volte (0,7 mm / 0,3 mm = 2,3). - Rimuovere le clip arteriose su entrambe le estremità e irrigare il sito di impianto con soluzione fisiologica. Valutare la pervietà dell'innesto vascolare osservando la pulsazione arteriosa distale (Figura 3G).
- Riposizionare la ghiandola salivare sinistra e chiudere il sito chirurgico utilizzando suture 6-0 (Figura 3H).
4. Cura e analisi post-procedurale
- Trasferire il topo in un'incubatrice a 37 °C e monitorare continuamente i suoi segni vitali fino a quando non riprende conoscenza.
- Iniettare 5 mg/kg di carbinolo per alleviare il dolore postoperatorio.
- Monitorare il mouse durante il periodo di recupero e non rimetterlo nella stabulazione del gruppo fino a quando non si è completamente ripreso.
- Anestetizzare i topi un mese dopo l'impianto e raccogliere i campioni di innesto vascolare per l'analisi istologica9.
- Eseguire l'eutanasia tramite asfissia da CO2 seguita da lussazione cervicale seguendo le linee guida etiche.
Risultati
Gli innesti vascolari di piccolo diametro con parametri diversi sono stati preparati con successo mediante elettrofilatura. Le immagini SEM hanno rivelato che le fibre erano distribuite uniformemente e mostravano una disposizione irregolare all'interno della parete dell'innesto, con la presenza di strutture porose (Figura 4). All'aumentare della concentrazione di PCL, sono aumentati sia il diametro della fibra che la dimensione dei pori. I valori specifici per ciascun gruppo di innesti vascolari sono presentati nella Tabella 2. I risultati dei test meccanici hanno dimostrato che tutti gli innesti vascolari soddisfacevano gli standard meccanici richiesti. Il carico massimo e la deformazione a rottura aumentavano con concentrazioni di PCL più elevate e un maggiore spessore della parete vascolare (Figura 5A-C), mentre il modulo di elasticità diminuiva (Figura 5D). Sulla base di questi risultati, sono stati selezionati innesti vascolari di piccolo diametro con una concentrazione di PCL del 15% e uno spessore della parete di 150 μm come innesti ottimali per gli esperimenti successivi.
In questo studio, i macrofagi sono stati seminati su innesti vascolari utilizzando il metodo dell'adsorbimento per perfusione. L'analisi SEM ha confermato che i macrofagi sono stati seminati con successo sugli innesti vascolari e hanno mostrato una distribuzione uniforme (Figura 6A). Gli innesti in sezione trasversale sottoposti a colorazione DAPI hanno rivelato che i macrofagi seminati si erano infiltrati dal lume dell'innesto nella parete dell'innesto (Figura 6B).
Trenta giorni dopo l'impianto in vivo , il tasso di sopravvivenza degli animali è stato del 100% e due dei tre innesti vascolari impiantati sono rimasti brevettati, il che è stato un risultato soddisfacente nei modelli murini. Non sono stati osservati aneurismi o incapsulamenti fibrosi distinguibili degli innesti allo stereomicroscopio (Figura 7A). L'entità dell'infiltrazione cellulare e della rigenerazione tissutale è stata ulteriormente valutata attraverso l'analisi istologica. La colorazione con ematossilina ed eosina (H&E) ha rivelato una sostanziale infiltrazione cellulare all'interno della parete dell'innesto e la formazione di neotessuti all'interno del lume interno dell'innesto (Figura 7B). La colorazione in immunofluorescenza CD31 ha dimostrato la rigenerazione di un singolo strato di tessuto endoteliale all'interno del lume interno degli innesti, con una copertura di cellule endoteliali relativamente intatta (Figura 7C).

Figura 1: Procedura di semina cellulare. (A) Coltura di cellule RAW264.7. Barra graduata: 100 μm. (B) Schema del processo di semina cellulare. (C) Cellule RAW264.7 seminate sulla parete dell'innesto utilizzando il metodo di perfusione-adsorbimento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Tecnica del polsino. (A) Preparazione di polsini vascolari. (B) Rappresentazione schematica della tecnica della cuffia vascolare. Gli innesti vascolari sono stati impiantati nell'arteria carotide utilizzando questo metodo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Procedura chirurgica per l'impianto di innesto vascolare in un modello murino. (A) Iniezione di anestetici, posizionamento del topo in posizione supina e immobilizzazione delle zampe. (B) Esposizione dell'area chirurgica. (C) Isolamento dell'arteria carotide. (D) Posizionamento della cuffia attorno all'arteria carotide. (E) Eversione dell'arteria sopra il corpo della cuffia e fissazione mediante una sutura 9-0. (F) Guaina dell'innesto vascolare sopra la cuffia arteriosa e sutura. (G) Rimozione di morsetti vascolari. (H) Chiusura cutanea. Clicca qui per visualizzare una versione più grande di questa figura.
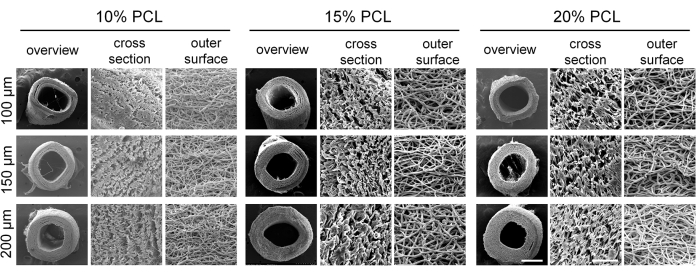
Figura 4: Morfologia degli innesti vascolari di policaprolattone elettrofilato (PCL). Immagini rappresentative al microscopio elettronico a scansione (SEM) che dimostrano la struttura fibrosa ben definita degli innesti vascolari. Barre di scala: 500 μm e 50 μm (immagini ingrandite). Clicca qui per visualizzare una versione più grande di questa figura.
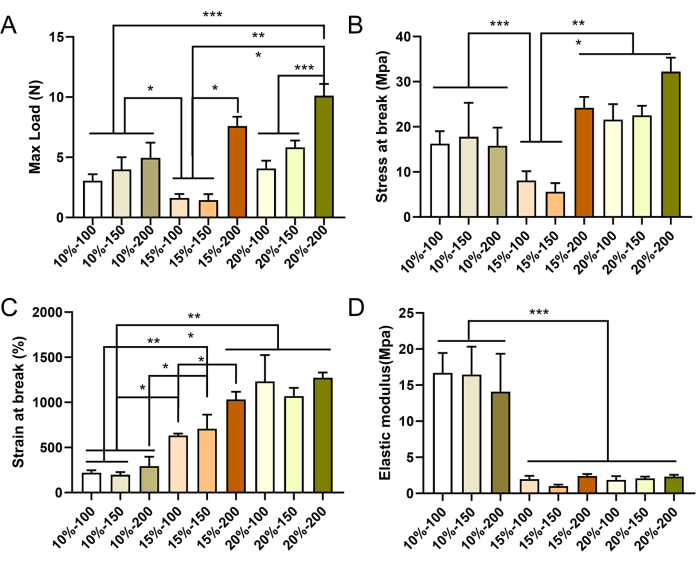
Figura 5: Proprietà meccaniche degli innesti vascolari PCL elettrofilati. Caratterizzazione meccanica degli innesti vascolari in direzione longitudinale, con carico massimo (A), sforzo massimo (B), deformazione a rottura (C) e modulo elastico (D). I dati sono espressi come media ± deviazione standard (SD) (n = 3). *P < 0,05, **P < 0,01, ***P < 0,001, ANOVA unidirezionale seguita dal test post hoc di Tukey. Clicca qui per visualizzare una versione più grande di questa figura.
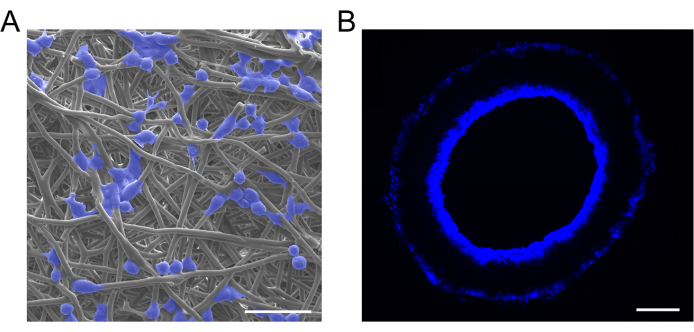
Figura 6: Caratterizzazione di innesti caricati con cellule. (A) Immagini SEM rappresentative e (B) colorazione 4',6-diamidino-2-fenilindolo (DAPI) di innesti vascolari caricati con cellule, che mostrano il successo dell'impianto di macrofagi e la distribuzione uniforme. Barre di scala: 30 μm e 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
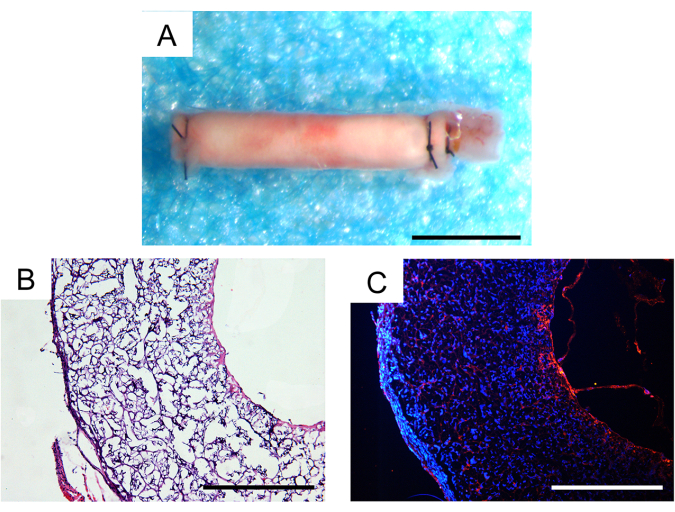
Figura 7: Analisi istologica degli innesti vascolari espiantati un mese dopo l'impianto. (A) Immagine stereoscopica che non mostra la formazione di aneurismi o l'incapsulamento fibroso. Barra graduata: 500 μm. (B) Colorazione con ematossilina ed eosina (H&E) che dimostra una buona cellularizzazione e rigenerazione tissutale. Barra graduata: 200 μm. (C) Colorazione in immunofluorescenza CD31 che rivela un monostrato di cellule endoteliali sulla superficie luminale. Barra della scala: 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Gruppo | Concentrazione di PCL soluzione (%) | Spessore dell'innesto vascolare (μm) | Distanza ago-raccoglitore (cm) | portata (mL/h) | voltaggio (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tabella 1: Descrizione dei gruppi di innesti vascolari. LCP, policaprolattone.
| Gruppo | Diametro della fibra (μm) | Dimensione dei pori (μm) |
| 10%-100 | 0,51±0,12 | 2.48±1.38 |
| 10%-150 | 0,91±0,4 | 1,83±0,84 |
| 10%-200 | 0,73±0,35 | 2,24±0,83 |
| 15%-100 | 1,85±0,3 | 8.91±2.87 |
| 15%-150 | 1,82±0,34 | 8.41±2.72 |
| 15%-200 | 2,18±0,47 | 9.59±3.01 |
| 20%-100 | 3.61±1.02 | 13.95±4.7 |
| 20%-150 | 3,06±0,56 | 13.12±3.36 |
| 20%-200 | 3,46±0,66 | 13.92±4.19 |
Tabella 2: Parametri strutturali di diversi innesti vascolari.
| Gruppo | diametro interno (mm) | diametro esterno (mm) | Spessore della parete (μm) | Lunghezza (cm) |
| carotide | 0.5-0.6 | 0.6-0.7 | 100 | / |
| innesto vascolare | 0.7 | 1 | 150 | 0.8 |
| polsino | 0.5 | 0.63 | 65 | / |
Tabella 3: Dati dimensionali della cuffia, dell'arteria carotide e dell'innesto vascolare.
Discussione
L'uso della tecnica della cuffia per l'impianto di innesti vascolari di ingegneria tissutale nell'arteria carotide di topo rappresenta un progresso significativo nella ricerca cardiovascolare15. Le fasi critiche di questa tecnica includono la semina cellulare e l'impianto dell'innesto. Questo studio ha impiegato un approccio di adsorbimento per perfusione per migliorare la densità di semina dei macrofagi per affrontare i problemi relativi alla semina cellulare non uniforme e alla bassa vitalità cellulare. Questo metodo ha permesso ai macrofagi di infiltrarsi nella parete dell'innesto vascolare e di distribuirla uniformemente.
Per quanto riguarda l'impianto vascolare, la tecnica della cuffia, al contrario dell'anastomosi end-to-end16, può essere associata a una maggiore incidenza di stenosi, in particolare se applicata a vasi con diametri più piccoli. Per ridurre al minimo questo effetto, sono stati selezionati polsini con diametri interni ed esterni strettamente corrispondenti a quelli delle arterie carotidi di topo. Le dimensioni pertinenti sono riportate nella Tabella 3.
Questa tecnica facilita una procedura chirurgica più semplice per l'impianto di innesto vascolare nell'arteria carotide di topo. I modelli animali più frequentemente utilizzati in precedenti studi di innesti vascolari di piccolo diametro includono la fistola arterovenosa giugulare di pecora e i modelli di impianto dell'arteria addominale di ratto17,18. Questi modelli sono efficaci per valutare la resistenza meccanica e la capacità di rimodellamento tissutale degli innesti vascolari; Tuttavia, sono limitati nella loro capacità di chiarire i meccanismi sottostanti. I topi geneticamente modificati sono emersi come un modello importante per lo studio dei meccanismi di rigenerazione vascolare, affrontando i limiti di altri modelli animali.
Ad esempio, i topi knockout per l'apolipoproteina E (ApoE) sviluppano spontaneamente ipercolesterolemia e lesioni aterosclerotiche19, rendendoli un modello prezioso per simulare condizioni cliniche che richiedono il trapianto vascolare. La valutazione della pervietà vascolare e della rigenerazione nei topi knockout per l'ApoE fornisce importanti dati di riferimento per la traduzione clinica degli innesti vascolari. Inoltre, i topi con deficit genetico possono essere utilizzati per studiare il ruolo dei geni chiave nella rigenerazione vascolare. L'ossido nitrico sintasi endoteliale (eNOS), un regolatore critico della funzione vascolare, è una fonte primaria di ossido nitrico20. I topi carenti del gene eNOS fungono da modello di ricerca per chiarire i meccanismi con cui questo gene influenza il rimodellamento vascolare. Inoltre, l'origine delle cellule coinvolte nella rigenerazione del tessuto vascolare può essere esplorata attraverso la marcatura cellulare in vivo e il tracciamento del lignaggio utilizzando lo strumento del gene reporter dei topi21,22.
Questa tecnica presenta alcune limitazioni riguardanti il numero di animali utilizzati e la durata del trapianto. Il presente studio si è concentrato principalmente sulla valutazione della fattibilità di questo metodo di innesto utilizzando un approccio in vivo a breve termine. Gli studi futuri dovrebbero aumentare la dimensione del campione e condurre valutazioni a lungo termine per valutare in modo completo l'impatto di questo metodo sulla formazione dell'aneurisma, sulla pervietà e sull'iperplasia intimale.
Inoltre, il tasso di pervietà del trapianto era del 66,6%, che potrebbe essere stato influenzato da una discrepanza di diametro (2,3 volte) nel sito di anastomosi. Questa mancata corrispondenza può portare a disturbi localizzati del flusso sanguigno, aumentando il rischio di trombosi. Sono necessari ulteriori studi per ottimizzare il design della cuffia per ridurre le discrepanze di diametro e studiare i loro effetti sui tassi di pervietà.
In conclusione, il modello di impianto dell'arteria carotide di topo basato sulla tecnica della cuffia fornisce un modello animale semplice ed efficace per la valutazione biologica di innesti vascolari di piccolo diametro. Inoltre, consente di studiare i ruoli di vari tipi cellulari nel rimodellamento dei tessuti vascolari e i meccanismi rigenerativi sottostanti.
Divulgazioni
Gli autori non hanno interessi finanziari in conflitto.
Riconoscimenti
Il finanziamento per questo studio è stato fornito dai progetti della National Natural Science Foundation of China (n. 32101098, 32071356 e 82272158) e dal CAMS Innovation Fund for Medical Sciences (n. 2022-I2M-1-023).
Materiali
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Riferimenti
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon