Method Article
زرع ترقيع الأوعية الدموية المصمم بالأنسجة في الشريان السباتي للفأر بتقنية الكفة
In This Article
Summary
هنا ، يتم تقديم بروتوكول لزرع طعم وعائي مصمم بالأنسجة في الشريان السباتي للفأر باستخدام تقنية الكفة ، مما يوفر نموذجا حيوانيا مناسبا للتحقيق في آليات تجديد أنسجة الأوعية الدموية.
Abstract
كان تطوير الطعوم الوعائية ذات القطر الصغير مسعى عالميا ، حيث ساهمت العديد من المجموعات البحثية في هذا المجال. تلعب التجارب على دورا محوريا في تقييم فعالية وسلامة الطعوم الوعائية ، لا سيما في حالة عدم وجود تطبيقات سريرية. بالمقارنة مع النماذج الحيوانية البديلة ، يوفر نموذج زرع الفأر العديد من المزايا ، بما في ذلك خلفية وراثية محددة جيدا ، وطريقة ناضجة لبناء نموذج المرض ، وإجراء جراحي مباشر. بناء على هذه المزايا ، ابتكرت الدراسة الحالية تقنية بسيطة للكفة لزرع ترقيع الأوعية الدموية المصممة بالأنسجة في الشريان السباتي للفأر. بدأت هذه التقنية بتصنيع طعوم الأوعية الدموية ذات القطر الصغير من بولي كابرولاكتون (PCL ) عن طريق الغزل الكهروستاتيكي ، متبوعا ببذر الضامة على الطعوم من خلال امتصاص التروية. بعد ذلك ، تم زرع الطعوم الوعائية المهندسة بالأنسجة الخلوية في الشريان السباتي للفأر باستخدام تقنية الكفة لتقييم المباحية والقدرة على التجدد. بعد 30 يوما من الزرع في الجسم الحي ، وجد أن سالكية الأوعية الدموية مرضية ، مع وجود دليل على تجديد الأنسجة الجديدة وتشكيل طبقة بطانية داخل تجويف الطعوم. تم تحليل جميع البيانات باستخدام برامج إحصائية ورسوم بيانية. نجحت هذه الدراسة في إنشاء نموذج زرع الشريان السباتي للفأر الذي يمكن استخدامه لاستكشاف المصادر الخلوية لتجديد الأوعية الدموية وآليات عمل المواد الفعالة. علاوة على ذلك ، فإنه يوفر الدعم النظري لتطوير ترقيع الأوعية الدموية الجديدة ذات القطر الصغير.
Introduction
يتزايد انتشار أمراض القلب والأوعية الدموية والوفيات الناجمة عنها على الصعيد العالمي، مما يمثل شاغلا كبيرا للصحةالعمومية1. يعد تطعيم المجازة الوعائية تدخلا فعالا لأمراض القلب التاجية الشديدة وأمراض الأوعية الدمويةالطرفية 2. تم توثيق استخدام ترقيع الأوعية الدموية الاصطناعية بأقطار تتجاوز 6 مم جيدا في البيئات السريرية. على العكس من ذلك ، فإن أولئك الذين يقل قطرهم عن 6 مم معرضون للتخثر وتضخم الورم الحمي، مما قد يؤدي إلى خطر كبير من تضيقالنفس 3. على الرغم من التقدم الكبير في البحث والتطوير للطعوم الوعائية ذات القطر الصغير في السنوات الأخيرة ، مع اقتراب العديد من المنتجات من التطبيق السريري ، لا تزال هناك تحديات متعددة 4,5. وتشمل هذه معدل سالكية منخفض نسبيا على المدى الطويل ، وتجديد محدود للأوعية الدموية ، وفهم غير كاف لآلية التجديد.
يعتمد التقييم قبل السريري للطعوم الوعائية الجديدة ذات القطر الصغير على الزرع في الجسم الحي في نماذج حيوانية مختلفة. تشمل النماذج الأكثر استخداما الشريان السباتي للأغنام ، والشريان الفخذي للكلاب ، والشريان السباتي للأرانب ، ونماذج زرع الشريان البطنيللفئران 6،7،8،9. يمكن تقييم سالكية الطعوم الوعائية في المتوسطة إلى الكبيرة الحجم ، مثل الأغنام والخنازير. ومع ذلك، تنطوي هذه الدراسات على تكاليف باهظة بسبب الخبرة والمعدات المطلوبة. بالإضافة إلى ذلك ، يشكل تعقيدها التقني تحديا للتنفيذ. في المقابل ، تفتقر النماذج الحيوانية الصغيرة مثل الأرانب والجرذان إلى الأنواع المعدلة وراثيا راسخة ذات خلفيات وراثية محددة بوضوح ، مما يمثل عقبة كبيرة في دراسة آليات تجديد الأوعية الدموية.
بالمقارنة مع النماذج الحيوانية المذكورة أعلاه ، يقدم نموذج الفأر إجراء جراحيا مباشرا نسبيا ، ومنهجية راسخة لتوليد الفئران المعدلة وراثيا ، وخلفية وراثية محددة بوضوح. ومع ذلك ، فإن القطر الصغير للأوعية الدموية للفئران يجعل مفاغرة البداية إلى النهاية في تطعيم الأوعية الدموية معقدة تقنيا ، مما يتطلب خبرة كبيرة وينتج عنه معدل نجاح منخفض نسبيا. لتقليل تعقيد الإجراء وتحسين معدل نجاح زرع الطعم الوعائي ، استخدمت الدراسة الحالية تقنية الكفة في نموذج زرع الشريان السباتي للفأر.
بعد الزرع في الجسم الحي ، يمكن أن تقوم الطعوم الوعائية بتجنيد الخلايا الذاتية التي تساهم في تجديد أنسجة الأوعية الدموية. يسهل وجود هذه الخلايا الظهارة البطانية وتجديد طبقة العضلات الملساء من الطعوم. 10. ومع ذلك ، لا يزال مصدر ونوع الخلايا المشاركة في تجديد أنسجة الأوعية الدموية غير واضح ، وهناك العديد من النظريات المتنافسة قيدالتحقيق 11. من بين هؤلاء ، ركزت الأبحاث على أدوار الخلايا الالتهابية والجذعية. قام Breuer et al. بزرع الخلايا الوحيدة المشتقة من نخاع العظام البشرية (hBMCs) على الطعوم الوعائية ووجدوا أن الخلايا المصنفة جندت الخلايا المضيفة في جدار الكسب غير المشروع من خلال إطلاق بروتين الجاذب الكيميائي أحادي الخلايا -1 (MCP-1) ، وبالتالي تعزيز تجديد أنسجة الأوعيةالدموية 12. في هذه الدراسة ، تم اقتراح طريقة فعالة لبذر خلايا امتصاص التروية واستخدمت بنجاح لبذر البلاعم على طعوم الأوعية الدموية ذات القطر الصغير من بولي كابرولاكتون (PCL). بعد الزرع ، أظهرت هذه الخلايا قابلية مستدامة للبقاء.
توضح هذه المقالة بالتفصيل منهجية إعداد ترقيع الأوعية الدموية المصممة بالأنسجة وإجراء زرع الشريان السباتي في الفئران باستخدام تقنية الكفة. تبدأ العملية بتصنيع ترقيع الأوعية الدموية ذات القطر الصغير PCL بمعلمات محددة عن طريق الغزل الكهروستاتيكي. بعد ذلك ، تخضع الطعوم التي تعتبر مناسبة للزرع لاختبار ميكانيكي. ثم يتم زرع البلاعم على الطعوم الوعائية باستخدام طريقة امتصاص التروية. أخيرا ، يتم زرع ترقيع الأوعية الدموية المصنفة بالبلاعم في الشريان السباتي للفأر باستخدام تقنية الكفة ، ويتم تحليل خصائص المباحية والتجدد بعد شهر واحد من الزرع في الجسم الحي .
هذه التقنية لديها القدرة على تعزيز فعالية ومعدلات نجاح تطعيم الأوعية الدموية في نماذج الفئران. علاوة على ذلك ، يمكن استخدام النموذج للتحقيق في الآليات الكامنة وراء مصادر الخلايا والجينات المحورية والعوامل النشطة في تجديد الأوعية الدموية ، وتوفير الدعم النظري والمنهجي للتعديل الوظيفي وتطوير الطعوم الوعائية الجديدة ذات القطر الصغير.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل اللجنة الأخلاقية للتجارب على التابعة لمعهد الطب الإشعاعي ، الأكاديمية الصينية للعلوم الطبية ، وامتثلت للمبادئ التوجيهية لرعاية واستخدام المختبر. تم استخدام ذكور الفئران C57BL / 6 ، الذين تتراوح أعمارهم بين 6 و 8 أسابيع ، ويبلغ وزن جسمهم 25-30 جم ، في هذه الدراسة. تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تصنيع الطعوم الوعائية ذات القطر الصغير
ملاحظة: قم بتصنيع ترقيع الأوعية الدموية PCL ذات القطر الصغير باستخدام تقنية الغزل الكهربائي13.
- تحضير محاليل PCL عند 10٪ و 15٪ و 20٪ (وزن / حجم) في سداسي فلورو إيزوبروبانول (HFIP) في درجة حرارة الغرفة (RT) لمدة 12 ساعة.
- قم بتحميل محاليل PCL في حقنة سعة 10 مل وضع المحقنة بإبرة من الفولاذ المقاوم للصدأ 21 G.
- ضع مغزل من الصلب التنغستن (قطره 0.7 مم وطول 20 سم) على أداة التجميع.
- قم بتصنيع تسع مجموعات من ترقيع الأوعية الدموية PCL باستخدام تقنية الغزل الكهربائي. قم بتوصيل مصدر طاقة عالي الجهد بالإبرة. ضع قضيبا فولاذيا من التنغستن بقطر داخلي يبلغ 0.7 مم على مسافة ثابتة أمام الإبرة كجهاز استقبال.
ملاحظة: يتم توفير وصف مجموعات الطعوم الوعائية في الجدول 1 ، ويتم تفصيل معلمات الطعوم الوعائية في الجدول 2. - إخضاع الطعوم الوعائية المصنعة لعملية الإخلاء. ضع الطعوم الوعائية في فرن تجفيف بالفراغ لمدة 72 ساعة لإزالة المذيبات المتبقية.
- قم بتعقيم الطعوم عن طريق غمرها في الكحول الطبي لمدة 30 دقيقة وتعريضها للأشعة فوق البنفسجية طوال الليل.
- راقب التشكل المجهري للطعوم الوعائية باستخدام المجهر الإلكتروني الماسح (SEM). قم بتوصيل الطعوم الوعائية بمرحلة عينة SEM بمادة لاصقة موصلة وضعها في جهاز الاخرق الذهبي للطلاء.
- راقب بنية ومورفولوجيا الألياف للطعوم الوعائية باستخدام SEM بجهد متسارع يبلغ 15 كيلو فولت. قم بقياس قطر الألياف وحجم المسام من صور SEM (ن = 5) باستخدام برنامج ImageJ.
- تقييم الخواص الميكانيكية (خصائص الشد والمرنة) للطعوم الوعائية باستخدام آلة اختبار الشد. قم بتثبيت الأطراف العلوية والسفلية للطعم الوعائي بمشابك ثابتة متباعدة بمسافة 1 سم.
- قم بتمديد الطعم الوعائي بمعدل 10 مم / دقيقة حتى التمزق. اجمع منحنى الإجهاد والإجهاد من آلة اختبار الشد.
- احسب المعلمات الميكانيكية ، بما في ذلك الحمل الأقصى (2-15 نيوتن) ، والإجهاد عند الكسر (5-30 ميجا باسكال) ، والإجهاد عند الكسر (200٪ -1500٪) ، ومعامل المرونة (1-20 ميجا باسكال) 14.
- إجراء التحليل الإحصائي باستخدام البرامج الإحصائية والرسوم البيانية. عبر عن البيانات كمتوسط ± انحراف معياري. قم بتحليل ومقارنة الاختلافات أحادية المتغير بين مجموعات متعددة باستخدام اختبار Tukey اللاحق في ANOVA أحادي الاتجاه. * P < 0.05 ، ** P < 0.01 ، ***P < 0.001.
2. بذر البلاعم على الطعوم الوعائية
ملاحظة: تأكد من أن جميع المحاليل والمواد معقمة. إجراء جميع العمليات داخل غرفة زراعة الخلايا.
- ثقافة RAW264.7 (بلاعم الخلية الأحادية للفأر) في قوارير في ظل ظروف ملتصقة (الشكل 1 أ). قم بإعداد وسط زراعة الخلايا باستخدام وسط النسر المعدل (DMEM) الكامل من Dulbecco المكمل ب 1٪ بنسلين ستربتومايسين و 10٪ مصل بقري للجنين. ضع القوارير في حاضنة 37 درجة مئوية تحتوي على 5٪ ثاني أكسيد الكربون.
- اجمع البلاعم باستخدام مكشطة خلوية. تخلص من الوسيط باستخدام ماصة سعة 1 مل واغسل الخلايا باستخدام PBS.
- أضف 2 مل من الوسط الطازج إلى قارورة الثقافة واكشط السطح برفق باستخدام مكشطة الخلية. انقل الخلايا المجمعة إلى أنبوب وجهاز طرد مركزي عند 1,000 × جم لمدة 5 دقائق في درجة حرارة الغرفة. أعد تعليق 5 × 106 خلايا في 100 ميكرولتر من الوسط الكامل.
- ضع طعم الأوعية الدموية PCL (بطول 1 سم) في أنبوب سعة 15 مل مملوء ب DMEM وجهاز طرد مركزي بمعدل 4,000 × جم لمدة 5 دقائق. كرر هذه العملية عدة مرات حتى يغرق الكسب غير المشروع في قاع الأنبوب ، مما يضمن التسلل الكامل للمادة باستخدام DMEM.
- تحضير طبق بتري مقاس 10 سم مبطن بطبقة من ورق الترشيح. ضع الطعم الوعائي المبلل PCL على ورق الترشيح ولفه لإزالة الوسط الزائد.
- خذ 10 ميكرولتر من معلق الخلية باستخدام ماصة سعة 10 ميكرولتر وحقنها في أحد طرفي الطعم الوعائي. قم بتدوير الكسب غير المشروع الوعائي فوق ورق الترشيح لتسهيل التوزيع المنتظم للتعليق. حقن كل طرف خمس مرات ليصبح المجموع عشر حقن (الشكل 1 ب ، ج).
- ضع الطعم الوعائي المحمل بالبلاعم في صفيحة مكونة من 24 بئرا تحتوي على 1 مل من الوسط الكامل واحتضانها لمدة ساعتين في حاضنة زراعة الخلايا قبل الزرع.
- تحديد توزيع الخلايا داخل جدار الكسب غير المشروع. قم بتضمين الطعم الوعائي المحمل بالبلاعم في مركب التصوير المقطعي للتماسك البصري (OCT) للاستئصال بالتبريد. صبغ نوى الخلايا مع 4',6-diamidino-2-phenylindole (DAPI) ومراقبة تحت المجهر الفلوري.
3. نموذج زرع الشريان السباتي للفأر
ملاحظة: الحفاظ على منطقة جراحية معقمة لإجراءات. تعقيم جميع الأدوات الجراحية والمستهلكات قبل الجراحة.
- اختر ثلاثة فئران ذكور C57BL / 6 يتمتعون بصحة جيدة ، يزن كل منها 25-30 جم. قم بتسريع الفئران في اليوم السابق للجراحة. زرع طعم وعائي واحد في كل ، ليصبح المجموع ثلاثة بصيلات.
- قم ببناء أصفاد من أنبوب نايلون (الشكل 2 أ) وقدم الرسم التخطيطي لتقنية الكفة الوعائية في الشكل 2 ب.
- تخدير الفئران عن طريق الحقن داخل الصفاق من البنتوباربيتال الصوديوم بتركيز 50 مجم / كجم (باتباع البروتوكولات المعتمدة مؤسسيا). تأكد من التخدير الفعال من خلال ضمان استرخاء العضلات وحتى التنفس. ضع مرهم الفازلين للعين على العينين لمنع الجفاف أثناء التخدير.
- ضع الماوس في وضع ضعيف على طاولة العمليات وقم بإزالة شعر الرقبة. تعقيم المنطقة الجراحية باليودوفور. قم بتغطية المنطقة غير الجراحية بشاش معقم للحفاظ على بيئة معقمة (الشكل 3 أ).
- استخدم مقص العيون لعمل شق خط الوسط (طوله 1.5-2 سم) من الفك السفلي إلى القص. رفع الغدد اللعابية اليسرى واستئصال العضلة الترقوية الخشائية اليسرى لزيادة مجال الرؤية الجراحي. كشف الشريان السباتي المشترك الأيسر باستخدام ملاقط دقيقة (الشكل 3 ب).
- اعزل الشريان السباتي الأيسر باستخدام الملقط الدقيق (الشكل 3 ج).
- اربط الشريان السباتي في موقعين في الجزء الأوسط باستخدام خياطة 9-0. قم بتمرير الشريان بين الرباطين باستخدام مقص دقيق. مرر الكفة عبر الشرايين في كل طرف وقم بتأمين الشريان والكفة معا باستخدام مشابك الشرايين (الشكل 3D).
- اقلب الشريان للخارج لتغطية جسم الكفة وثبته على الكفة باستخدام خياطة 9-0 باستخدام ملقط دقيق (الشكل 3E).
- زرع طعم وعائي بين طرفي الشريان السباتي عن طريق تحريك نهايات الكسب غير المشروع فوق صفعة الشريان وتثبيتها ب 9-0 خيوط (الشكل 3F).
ملاحظة: يتم عرض بيانات أبعاد الكفة والشريان السباتي والطعم الوعائي في الجدول 3. على الرغم من أن أقطار الكسب غير المشروع والكفة تتطابق بشكل وثيق مع أقطار الشرايين السباتية للفأر ، إلا أن هناك عدم تطابق بين قطر التجويف المفاغرة وقطر الكسب غير المشروع. يتم حساب قطر التجويف المفاغرة عن طريق طرح ضعف سمك جدار الشريان السباتي (0.1 مم) من القطر الداخلي للصفعة (0.5 مم) ، مما ينتج عنه قطر تجويف 0.3 مم. يبلغ قطر الطعم الوعائي الداخلي 0.7 مم ، مما يؤدي إلى عدم تطابق حوالي 2.3 مرة (0.7 مم / 0.3 مم = 2.3). - قم بإزالة المشابك الشريانية من كلا الطرفين وري موقع الزرع بالمحلول الملحي. قم بتقييم سالكية الطعم الوعائي من خلال مراقبة النبض الشرياني البعيد (الشكل 3G).
- أعد وضع الغدة اللعابية اليسرى وأغلق موقع الجراحة باستخدام 6-0 خيوط (الشكل 3H).
4. الرعاية والتحليل اللاحق للإجراءات
- انقل الماوس إلى حاضنة 37 درجة مئوية وراقب علاماته الحيوية باستمرار حتى يستعيد وعيه.
- حقن 5 مجم / كجم من الكربينول لتخفيف الآلام بعد الجراحة.
- راقب الماوس خلال فترة التعافي ولا تعيده إلى السكن الجماعي حتى يتعافى تماما.
- تخدير الفئران بعد شهر واحد من الزرع وحصاد عينات الكسب غير المشروع الوعائي للتحليل النسيجي9.
- إجراء القتل الرحيم عن طريق الاختناق بثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم باتباع الإرشادات الأخلاقية.
النتائج
تم تحضير الطعوم الوعائية ذات القطر الصغير بمعايير مختلفة بنجاح عن طريق الغزل الكهربائي. كشفت صور SEM أن الألياف موزعة بشكل موحد وأظهرت ترتيبا غير منتظم داخل جدار الكسب غير المشروع ، مع وجود هياكل مسام (الشكل 4). مع زيادة تركيز PCL ، زاد قطر الألياف وحجم المسام. يتم عرض قيم محددة لكل مجموعة طعم وعائي في الجدول 2. أظهرت نتائج الاختبارات الميكانيكية أن جميع ترقيع الأوعية الدموية تفي بالمعايير الميكانيكية المطلوبة. زاد الحد الأقصى للحمل والإجهاد عند الكسر مع ارتفاع تركيزات PCL وزيادة سمك جدار الأوعية الدموية (الشكل 5A-C) ، بينما انخفض معامل المرونة (الشكل 5D). بناء على هذه النتائج ، تم اختيار الطعوم الوعائية ذات القطر الصغير بتركيز PCL بنسبة 15٪ وسمك جدار يبلغ 150 ميكرومتر كترقيع مثالي للتجارب اللاحقة.
في هذه الدراسة ، تم زرع البلاعم على ترقيع الأوعية الدموية باستخدام طريقة امتصاص التروية. أكد تحليل SEM أن البلاعم قد تم زرعها بنجاح على الطعوم الوعائية وأظهرت توزيعا موحدا (الشكل 6 أ). كشفت الطعوم المقطعية المعرضة لتلوين DAPI أن البلاعم المصنفة قد تسللت من تجويف الكسب غير المشروع إلى جدار الكسب غير المشروع (الشكل 6 ب).
بعد ثلاثين يوما من الزرع في الجسم الحي ، كان معدل بقاء على قيد الحياة 100٪ ، وظل اثنان من الطعوم الوعائية الثلاثة المزروعة حاصلين على براءة اختراع ، والتي كانت نتيجة مرضية في نماذج الفئران. لم يلاحظ أي تمدد الأوعية الدموية أو تغليف ليفي ملحوظ للطعوم تحت مجهر مجسم (الشكل 7 أ). تم تقييم مدى التسلل الخلوي وتجديد الأنسجة من خلال التحليل النسيجي. كشف تلطيخ الهيماتوكسيلين واليوزين (H & E) عن تسلل خلوي كبير داخل جدار الكسب غير المشروع وتكوين الأنسجة الحديثة داخل التجويف الداخلي للطعم (الشكل 7 ب). أظهر تلطيخ التألق المناعي CD31 تجديد طبقة واحدة من الأنسجة البطانية داخل التجويف الداخلي للطعوم ، مع تغطية الخلايا البطانية السليمة نسبيا (الشكل 7 ج).

الشكل 1: إجراء بذر الخلايا. (أ) ثقافة خلايا RAW264.7. شريط المقياس: 100 ميكرومتر (ب) تخطيطي لعملية بذر الخلايا. (ج) خلايا RAW264.7 البذرة على جدار الكسب غير المشروع باستخدام طريقة التروية والامتزاز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقنية الكفة. (أ) تحضير الأصفاد الوعائية. (ب) التمثيل التخطيطي لتقنية الكفة الوعائية. تم زرع الطعوم الوعائية في الشريان السباتي باستخدام هذه الطريقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: إجراء جراحي لزرع الكسب غير المشروع الوعائي في نموذج الفأر. (أ) حقن التخدير ، ووضع الفأر في وضع ضعيف ، وتثبيت الكفوف. (ب) تعرض المنطقة الجراحية. (ج) عزل الشريان السباتي. (د) وضع الكفة حول الشريان السباتي. (ه) انعكاس الشريان فوق جسم الكفة والتثبيت باستخدام خياطة 9-0. (و) تغطيه الطعم الوعائي فوق الكفة الشريانية والخياطة. (ز) إزالة المشابك الوعائية. (ح) إغلاق الجلد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
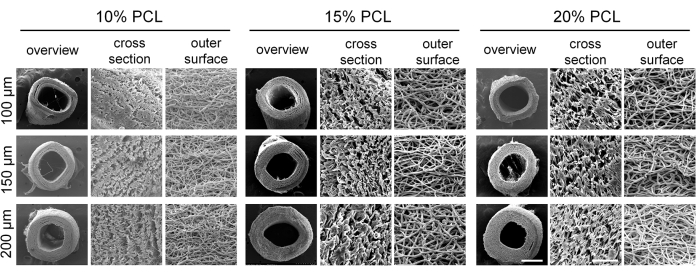
الشكل 4: مورفولوجيا الطعوم الوعائية الكهربائية بولي كابرولاكتون (PCL). صور المجهر الإلكتروني الماسح التمثيلي (SEM) التي توضح البنية الليفية المحددة جيدا للطعوم الوعائية. أشرطة المقياس: 500 ميكرومتر و 50 ميكرومتر (صور مكبرة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
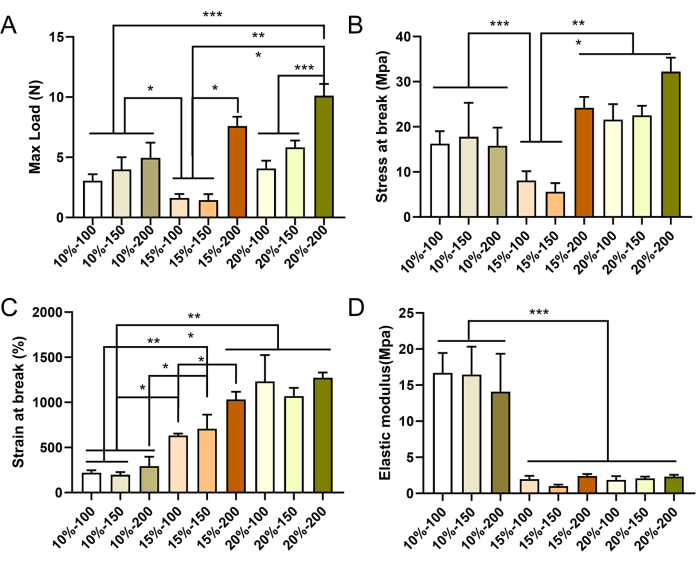
الشكل 5: الخواص الميكانيكية للطعوم الوعائية PCL المغزولة بالكهرباء. التوصيف الميكانيكي للطعوم الوعائية في الاتجاه الطولي ، يظهر الحمل الأقصى (A) ، والضغط الأقصى (B) ، والإجهاد عند الكسر (C) ، ومعامل المرونة (D). يتم التعبير عن البيانات بمتوسط ± الانحراف المعياري (SD) (ن = 3). * P < 0.05 ، ** P < 0.01 ، ***P < 0.001 ، ANOVA أحادي الاتجاه متبوعا باختبار Tukey اللاحق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
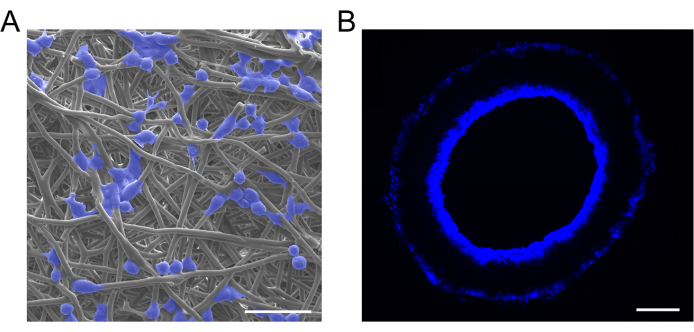
الشكل 6: توصيف الطعوم المحملة بالخلايا. (أ) صور SEM التمثيلية و (ب) تلطيخ 4 ',6-diamidino-2-phenylindole (DAPI) للطعوم الوعائية المحملة بالخلايا ، مما يدل على زرع البلاعم الناجح والتوزيع المنتظم. قضبان المقياس: 30 ميكرومتر و 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
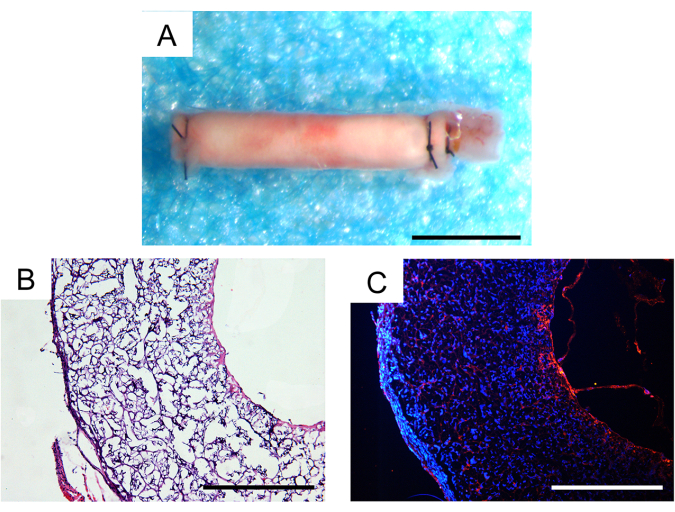
الشكل 7: التحليل النسيجي للطعوم الوعائية المزروعة بعد شهر واحد من الزرع. (أ) صورة مجسمة لا تظهر أي تكوين تمدد الأوعية الدموية أو التغليف الليفي. شريط المقياس: 500 ميكرومتر. (ب) تلطيخ الهيماتوكسيلين واليوزين (H & E) مما يدل على الخلوية الجيدة وتجديد الأنسجة. شريط المقياس: 200 ميكرومتر (C) تلطيخ التألق المناعي CD31 يكشف عن طبقة أحادية من الخلايا البطانية على السطح اللمعي. شريط المقياس: 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
| مجموعة | تركيز PCL الحل (٪) | سمك الكسب غير المشروع الوعائي (ميكرومتر) | مسافة جامع الإبرة (سم) | معدل التدفق (مل / ساعة) | ضغط (كيلو فولت) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
الجدول 1: وصف مجموعات الكسب غير المشروع الوعائية. PCL ، بولي كابرولاكتون.
| مجموعة | قطر الألياف (ميكرومتر) | حجم المسام (ميكرومتر) |
| 10%-100 | 0.51±0.12 | 2.48±1.38 |
| 10%-150 | 0.91±0.4 | 1.83±0.84 |
| 10%-200 | 0.73±0.35 | 2.24±0.83 |
| 15%-100 | 1.85±0.3 | 8.91±2.87 |
| 15%-150 | 1.82±0.34 | 8.41±2.72 |
| 15%-200 | 2.18±0.47 | 9.59±3.01 |
| 20%-100 | 3.61±1.02 | 13.95±4.7 |
| 20%-150 | 3.06±0.56 | 13.12±3.36 |
| 20%-200 | 3.46±0.66 | 13.92±4.19 |
الجدول 2: المعلمات الهيكلية لترقيع الأوعية الدموية المختلفة.
| مجموعة | القطر الداخلي (مم) | القطر الخارجي (مم) | سمك الجدار (ميكرومتر) | الطول (سم) |
| الشريان السباتي | 0.5-0.6 | 0.6-0.7 | 100 | / |
| ترقيع الأوعية الدموية | 0.7 | 1 | 150 | 0.8 |
| الكفه | 0.5 | 0.63 | 65 | / |
الجدول 3: بيانات أبعاد الكفة والشريان السباتي والطعم الوعائي
Discussion
يمثل استخدام تقنية الكفة لزرع ترقيع الأوعية الدموية المصممة بالأنسجة في الشريان السباتي للفأر تقدما كبيرا في أبحاث القلب والأوعية الدموية15. تشمل الخطوات الحاسمة لهذه التقنية بذر الخلايا وزرع الكسب غير المشروع. استخدمت هذه الدراسة نهج امتصاص التروية لتعزيز كثافة بذر البلاعم لمعالجة المشكلات المتعلقة بتلقيح الخلايا غير المنتظم وانخفاض قابلية الخلايا للبقاء. سمحت هذه الطريقة للضامة بالتسلل إلى جدار الكسب غير المشروع الوعائي وتوزيعه بالتساوي.
فيما يتعلق بزرع الأوعية الدموية ، قد تترافق تقنية الكفة ، على عكس مفاغرةالبداية إلى النهاية 16 ، بزيادة حدوث التضيق ، خاصة عند تطبيقها على الأوعية ذات الأقطار الأصغر. لتقليل هذا التأثير ، تم اختيار الأصفاد ذات الأقطار الداخلية والخارجية التي تتطابق بشكل وثيق مع تلك الموجودة في شرايين الشريان السباتي للفأر. وترد الأبعاد ذات الصلة في الجدول 3.
تسهل هذه التقنية إجراء جراحيا أكثر وضوحا لزرع الطعم الوعائي في الشريان السباتي للفأر. تشمل النماذج الحيوانية الأكثر استخداما في الدراسات السابقة للطعوم الوعائية ذات القطر الصغير الناسور الشرياني الوريدي الوداجي للأغنام ونماذج زرع الشريان البطنيللفئران 17،18. هذه النماذج فعالة لتقييم القوة الميكانيكية وقدرة إعادة تشكيل الأنسجة للطعوم الوعائية. ومع ذلك، فهي محدودة في قدرتها على توضيح الآليات الأساسية. برزت الفئران المعدلة وراثيا كنموذج مهم للتحقيق في آليات تجديد الأوعية الدموية ، ومعالجة قيود النماذج الحيوانية الأخرى.
على سبيل المثال ، تصاب الفئران بالضربة القاضية E (ApoE) تلقائيا بفرط كوليسترول الدم وآفات تصلب الشرايين19 ، مما يجعلها نموذجا قيما لمحاكاة الحالات السريرية التي تتطلب زرع الأوعية الدموية. يوفر تقييم سالكية الأوعية الدموية وتجديدها في الفئران ApoE-knockout بيانات مرجعية مهمة للترجمة السريرية للطعوم الوعائية. بالإضافة إلى ذلك ، يمكن استخدام الفئران التي تعاني من نقص الجينات للتحقيق في أدوار الجينات الرئيسية في تجديد الأوعية الدموية. سينسيز أكسيد النيتريك البطاني (eNOS) ، وهو منظم حاسم لوظيفة الأوعية الدموية ، هو مصدر أساسي لأكسيد النيتريك20. تعمل الفئران التي تعاني من نقص الجينات eNOS كنموذج بحثي لتوضيح الآليات التي يؤثر بها هذا الجين على إعادة تشكيل الأوعية الدموية. علاوة على ذلك ، يمكن استكشاف أصل الخلايا المشاركة في تجديد أنسجة الأوعية الدموية من خلال وضع العلامات على الخلايا في الجسم الحي وتتبع النسب باستخدام الفئران21،22 أداة الجينات المراسلة.
هذه التقنية لها قيود معينة فيما يتعلق بعدد المستخدمة ومدة الزرع. ركزت الدراسة الحالية بشكل أساسي على تقييم جدوى طريقة التطعيم هذه باستخدام نهج قصير المدى في الجسم الحي . يجب أن تزيد الدراسات المستقبلية من حجم العينة وتجري تقييمات طويلة الأجل لتقييم تأثير هذه الطريقة على تكوين تمدد الأوعية الدموية ، والمباح ، وتضخم التنسج الحمي.
بالإضافة إلى ذلك ، كان معدل سالكية الكسب غير المشروع 66.6٪ ، والذي ربما تأثر بعدم تطابق القطر (2.3 ضعف) في موقع مفاغرة. يمكن أن يؤدي عدم التطابق هذا إلى اضطرابات موضعية في تدفق الدم ، مما يزيد من خطر تجلط الدم. هناك حاجة إلى مزيد من الدراسات لتحسين تصميم الكفة لتقليل التناقضات في القطر والتحقيق في آثارها على معدلات المباح.
في الختام ، يوفر نموذج زرع الشريان السباتي للفأر القائم على تقنية الكفة نموذجا حيوانيا بسيطا وفعالا للتقييم البيولوجي للطعوم الوعائية ذات القطر الصغير. علاوة على ذلك ، فإنه يتيح التحقيق في أدوار أنواع الخلايا المختلفة في إعادة تشكيل أنسجة الأوعية الدموية وآليات التجدد الأساسية.
Disclosures
وليس لدى أصحاب البلاغ مصالح مالية متضاربة.
Acknowledgements
تم توفير تمويل هذه الدراسة من قبل مشاريع المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 32101098 و 32071356 و 82272158) وصندوق CAMS للابتكار للعلوم الطبية (رقم 2022-I2M-1-023).
Materials
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
References
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved