Method Article
Mapeamento cardíaco em tempo real com um sistema de imagem eletrocardiográfica não invasivo sem imagens
Neste Artigo
Resumo
Este estudo apresenta uma nova abordagem para mapeamento cardíaco em tempo real usando um sistema de imagem eletrocardiográfica não invasivo e sem imagem. Este sistema permite a aquisição de mapas cardíacos eletrofisiológicos sem a necessidade de tomografia computadorizada ou ressonância magnética pré-procedimento, permitindo uma orientação eficiente para procedimentos cardíacos, como implantes de terapia de ablação e ressincronização cardíaca.
Resumo
O mapeamento cardíaco rápido, seguro e eficaz é fundamental para o manejo de arritmias complexas, mas os métodos atuais enfrentam limitações significativas. O eletrocardiograma (ECG) de 12 derivações, embora essencial para o diagnóstico inicial, carece da resolução espacial e da profundidade necessárias para orientar procedimentos avançados, como ablação por cateter ou implante de dispositivo de terapia de ressincronização cardíaca. Por outro lado, as técnicas de mapeamento invasivo fornecem atividade elétrica detalhada, mas requerem múltiplas colocações de cateteres, aumentando os riscos e a complexidade do procedimento. Esses métodos são demorados, caros e oferecem avaliação limitada em tempo real, especialmente em arritmias dinâmicas como fibrilação atrial (FA), arritmia instável e terapia de ressincronização cardíaca (TRC).
Este estudo apresenta um sistema de imagem eletrocardiográfica não invasivo e sem imagem (Imageless-ECGI) projetado para complementar os métodos tradicionais, fornecendo mapas cardíacos batimento a batimento em tempo real. Sem a necessidade de imagens pré-procedimento, este sistema captura a atividade elétrica de alta resolução em todo o coração, oferecendo uma alternativa mais segura e eficiente ao mapeamento invasivo. Ao combinar o imediatismo das gravações de superfície com a precisão espacial dos modelos computacionais modernos, o sistema Imageless-ECGI preenche a lacuna entre o ECG tradicional e o mapeamento invasivo, potencialmente transformando o fluxo de trabalho nos laboratórios de eletrofisiologia.
Introdução
A necessidade de mapeamento eletrofisiológico não invasivo tornou-se cada vez mais importante para avaliar com precisão a atividade cardíaca, particularmente em pacientes submetidos a procedimentos complexos de arritmia, como fibrilação atrial (FA) e ablação de taquicardia ventricular (TV), ou durante o implante de marcapassos e dispositivos de terapia de ressincronização cardíaca (TRC). Atualmente, o mapeamento eletroanatômico tridimensional (3D) (EAM) continua sendo o padrão-ouro para orientar os operadores durante a ablação por cateter1, fornecendo mapas funcionais abrangentes para caracterizar arritmias 2,3. No entanto, o EAM é subótimo para capturar os padrões espaço-temporais dinâmicos de FA, arritmias não sustentadas, e o longo tempo e o procedimento invasivo necessário para o mapeamento o tornam impraticável para uso em procedimentos de TRC.
Os métodos não invasivos tradicionais, como o eletrocardiograma (ECG) de 12 derivações, embora altamente precisos para identificar focos de arritmia específicos (por exemplo, via de saída ou TV de cúspide), oferecem informações limitadas sobre o comportamento elétrico global do coração. Essa limitação é especialmente evidente quando o mapeamento em tempo real é necessário para orientar intervenções em arritmias dinâmicas e complexas, onde a localização precisa de áreas arritmogênicas é crucial para resultados bem-sucedidos. O mapeamento não invasivo pode desempenhar um papel importante no aprimoramento do planejamento pré-procedimento e no fornecimento de feedback em tempo real durante as intervenções eletrofisiológicas.
Para apoiar os eletrofisiologistas pré-procedimento, os avanços nas modalidades de imagem cardíaca, como tomografia computadorizada (TC) e ressonância magnética (RM), têm se mostrado eficazes no fornecimento de informações estruturais detalhadas, incluindo espessura da parede4 e fibrose miocárdica 5,6,7,8 . No entanto, essas modalidades se concentram em características anatômicas e estruturais, deixando uma lacuna no mapeamento elétrico funcional. Além disso, a obtenção de imagens cardíacas de alta qualidade requer protocolos de varredura especializados, pessoal treinado e métodos complexos de pós-processamento, como segmentação avançada e caracterização precisa do tecido, principalmente para detectar fibrose cardíaca.
Os sistemas clássicos de imagem eletrocardiográfica (ECGI) surgiram como uma opção não invasiva, oferecendo resultados promissores ao reconstruir a atividade elétrica cardíaca com base nos potenciais de superfície corporal (BSP)9,10,11,12. Apesar de seu potencial, os sistemas ECGI enfrentam limitações notáveis13,14. Primeiro, eles exigem tomografias computadorizadas pré-procedimento para mapear as posições dos eletrodos nas geometrias cardíacas, tornando seu uso de rotina clínica menos viável. Em segundo lugar, os métodos tradicionais de regularização usados na solução do problema inverso do mapeamento cardíaco geralmente introduzem padrões de propagação não fisiológicos, limitando sua precisão em ambientes clínicos.
O objetivo deste estudo foi descrever as características e procedimentos de um novo sistema de ECGI não invasivo capaz de mapear em tempo real sem a necessidade de TC ou RM15, conhecido como ECGI sem imagem. Exploramos os avanços do ECGI sem imagem e apresentamos possíveis aplicações clínicas para mapeamento eletrofisiológico, superando as limitações das técnicas atuais como EAM, ECG de 12 derivações e ECGI clássico no gerenciamento de procedimentos complexos de arritmia. Essa abordagem permite a criação de mapas cardíacos minutos após a chegada do paciente, simplificando o fluxo de trabalho e reduzindo o tempo de preparação. Além disso, o sistema usa algoritmos avançados de processamento de sinal para gerar padrões de propagação fisiológica precisos, melhorando a localização da arritmia e os resultados do procedimento.
Protocolo
A metodologia foi validada prospectivamente em um estudo clínico observacional multicêntrico. O estudo foi conduzido de acordo com a Declaração de Helsinque e os padrões éticos das instituições envolvidas. O protocolo do estudo, SAVE-COR (NCT05772182), foi aprovado pelos Comitês de Ética do Hospital Universitario Gregorio Marañón, Hospital Clínic de Barcelona e Hospital Universitari i Politècnic La Fe, e o consentimento informado foi obtido de todos os pacientes.
NOTA: As descrições detalhadas dos critérios de inclusão e exclusão são:
Critérios de inclusão: (i) Indicação de estudo eletroanatômico invasivo e/ou implante de marcapasso intracavitário. (ii) Ter obtido e assinado o consentimento informado para inclusão no estudo.
Critérios de exclusão: (i) <18 anos de idade. (ii) Incapacidade de se submeter a cateterismo endocárdico (por exemplo, mulheres grávidas ou amamentando). (iii) Incapacidade física ou mental de entender e aceitar o consentimento informado. (iv) Incapacidade de ficar em pé para permitir a reconstrução 3D do torso necessária para o sistema ECGI. (v) Pacientes com patologias congênitas.
1. Preparação do sistema ECGI sem imagem em tempo real pré-procedimento
- Verifique se o amplificador de biopotencial (Figura 1A) está totalmente carregado e coloque-o no final da mesa da sala de eletrofisiologia (EP), perto de onde os pés do paciente seriam posicionados.
NOTA: O amplificador de biopotencial (ver Tabela de Materiais) é um dispositivo isolado de 128 canais responsável por amplificar e digitalizar os sinais elétricos coletados pelos eletrodos. - Verifique se os cabos direito e esquerdo não estão danificados inspecionando os conectores do amplificador em uma extremidade e os soquetes pretos, onde o colete do sensor está conectado, na outra extremidade (Figura 1B).
NOTA: Os cabos direito e esquerdo (consulte a Tabela de Materiais) têm 1.5 m de comprimento e transmitem sinais elétricos do colete do sensor para o amplificador de biopotencial. - Conecte os cabos conectores direito e esquerdo no amplificador de biopotencial (Figura 1C). Cada cabo está associado a um plugue que é diferenciado por um número, que é o mesmo para o cabo e o amplificador.
- Verifique se a plataforma do scanner 3D está totalmente carregada e abra o aplicativo de digitalização 3D.
NOTA: O aplicativo de digitalização 3D é um software executado em uma plataforma de scanner 3D (consulte a Tabela de Materiais) que utiliza uma câmera de luz estrutural infravermelha para gerar uma reconstrução de modelo 3D do torso do paciente. O aplicativo também detecta automaticamente a localização dos códigos de resposta rápida (QR) do eletrodo. - Verifique se a estação de trabalho do PC (consulte Tabela de materiais) tem a interface do usuário (UI) do software ECGI sem imagem instalada e está totalmente carregada.
NOTA: O software Imageless ECGI (ver Tabela de Materiais) incorpora algoritmos de processamento de sinal para estimar a geometria cardíaca e fornecer informações valiosas para diagnosticar e tratar arritmias cardíacas ou orientar procedimentos de implantação de dispositivos cardíacos 16,17,18,19. A interface do usuário do sistema permite que os usuários visualizem, selecionem e analisem sinais eletrocardiográficos, criando mapas interativos da atividade epicárdica que permitem a avaliação não invasiva da função cardíaca. - Conecte o amplificador de biopotencial à estação de trabalho usando um cabo Ethernet isolado (consulte a Tabela de Materiais). Insira uma extremidade na porta Ethernet do amplificador e a outra na estação de trabalho.
NOTA: O cabo Ethernet isolado transmite sinais elétricos do amplificador de biopotencial para a estação de trabalho. - Selecione um colete sensor (consulte a Tabela de Materiais), inspecione a embalagem e verifique se a vedação não está danificada. Não use o colete do sensor se a embalagem estiver aberta ou danificada.
- Abra a embalagem do colete do sensor e verifique se os quatro componentes do colete estão dentro. Escolha outra embalagem de colete sensor se um dos componentes estiver faltando.
NOTA: O colete do sensor é um conjunto de eletrodos de alta densidade com 128 eletrodos de prata que permitem o mapeamento simultâneo da atividade elétrica da superfície em todo o torso do paciente. O colete é radiolúcido e contém quatro remendos que cobrem as superfícies anterior e posterior esquerda e direita do tronco. Cada eletrodo possui um código QR na frente, permitindo a identificação automática da posição do eletrodo.
2. Preparação pré-procedimento do paciente
- Internar o paciente no hospital no mesmo dia do estudo eletrofisiológico ou implantação do dispositivo.
- Posicione o paciente em pé ou sentado em uma cadeira ou na mesa EP e certifique-se de que toda a área do tronco esteja livre de roupas.
- Faça uma inspeção visual da pele do paciente para verificar se o paciente tem costas, feridas ou qualquer outra condição de pele para evitar a fixação de eletrodos nessas áreas.
- Opcionalmente, limpe o torso para indivíduos com pêlos significativos para minimizar os artefatos de ruído e reduzir o desconforto durante a remoção do colete do sensor.
- Posicione corretamente as quatro partes do colete do sensor (Frente Direita, Frente Esquerda, Traseira Direita e Traseira Esquerda) no tronco do paciente (Figura 2A) e ajuste o colete ao tamanho do paciente dobrando as conexões entre os eletrodos quando necessário.
- Opcionalmente, para procedimentos de TRC, evite colocar eletrodos na área onde o implante cardíaco será inserido, geralmente localizado na parte superior esquerda do tórax.
NOTA: As conexões com traços impressos podem ser interrompidas com segurança, se necessário, pois não há trilhas ativas nessas áreas. - Coloque os eletrodos acionados pela perna direita (RLD) e de referência (REF) do colete sensor nas pernas direita e esquerda, respectivamente, o mais longe possível dos outros eletrodos do colete.
- Garanta a iluminação adequada da sala e certifique-se de que nenhum objeto esteja a menos de 1,5 m de diâmetro ao redor do torso do paciente, pois eles podem interferir ou distorcer a reconstrução 3D do tronco.
- Posicione o paciente com os braços sobre a cabeça para evitar interferência na reconstrução 3D do tronco, como visto na Figura 2C.
- Obtenha a reconstrução 3D do tronco do paciente.
- Pegue a plataforma do scanner 3D e abra o aplicativo de digitalização 3D.
- Digitalize o código QR na lateral do componente do colete dianteiro direito para validar o colete do sensor (Figura 2B), garantindo que seja de uso único e não expirado.
NOTA: Assim que o código QR for detectado, o aplicativo de digitalização 3D permite a aquisição da reconstrução do torso 3D. - Posicione a plataforma do scanner 3D no nível do tronco na frente do paciente, segure-a firmemente com as duas mãos e complete uma rotação de 360° ao redor do paciente para adquirir a reconstrução do tronco 3D (Figura 2C).
NOTA: À medida que a varredura avança, a câmera de luz estruturada infravermelha da plataforma do scanner 3D cria uma malha fechada 3D de cor cinza do tronco, completando o processo em uma rotação completa. Normalmente, o processo de reconstrução do torso 3D requer 1-2 minutos para ser concluído. - Realize uma inspeção visual da reconstrução 3D do tronco para garantir que todo o tronco esteja coberto por uma sombra cinza e que não haja buracos na malha reconstruída.
- Salve a reconstrução do torso 3D no aplicativo assim que a digitalização for concluída.
- Faça com que o paciente se deite na mesa da sala de EP.
- Conecte as quatro partes do colete do sensor aos cabos do conector direito e esquerdo correspondentes (Figura 1D). Conecte os conectores do colete dianteiro direito e traseiro direito ao soquete do cabo direito e os conectores do colete dianteiro esquerdo e traseiro esquerdo ao soquete do cabo esquerdo.
- Ligue o amplificador de biopotencial para permitir que o software ECGI sem imagem receba sinais eletrofisiológicos em tempo real.
3. Estimativa da geometria cardíaca do paciente
- Faça login como usuário no software Imageless ECGI em tempo real instalado na estação de trabalho (Figura 3). Forneça um nome de usuário e senha.
- Clique no botão Adicionar paciente e introduza os detalhes de identificação para registrar um novo paciente na janela inicial da interface do usuário (Figura 4). Em seguida, crie uma nova sessão associada ao paciente, fornecendo o tipo de procedimento e os seguintes dados basais: sexo, idade, altura e peso.
NOTA: Um único paciente pode ter várias sessões. Por exemplo, em estudos clínicos com acompanhamento, se um paciente for submetido a um segundo registro de ECGI, uma nova sessão pode ser criada sem adicionar o paciente novamente. - Conecte a plataforma do scanner 3D à estação de trabalho usando um cabo USB-C.
- Clique no botão Carregar varredura do torso e carregue a reconstrução 3D do torso na janela Geometria do torso (Figura 5).
NOTA: O software detectará automaticamente a localização dos 128 eletrodos do colete do sensor. Cada componente do colete tem diferentes cores de eletrodo: Frente Direita = vermelho, Frente Esquerda = azul, Traseira Direita = rosa e Traseira Esquerda = laranja. - Opcionalmente, ajuste manualmente as posições dos eletrodos clicando em cada eletrodo e reposicionando-o na superfície do tronco.
- Selecione o botão Calcular geometria e a opção Estimar geometria cardíaca para estimar a geometria cardíaca do paciente na janela Geometria do tronco (Figura 5).
NOTA: O software estima a geometria cardíaca usando uma metodologia baseada em um modelo estatístico de forma (SSM) (Figura 6A), conforme detalhado na literatura anterior20. O algoritmo primeiro processa a reconstrução 3D do tronco do paciente e os dados basais (sexo, idade, altura e peso) como entrada. Posteriormente, o SSM, incorporando geometrias cardíacas e de torso baseadas em ressonância magnética, ajusta-se iterativamente para se ajustar à malha 3D do torso do paciente. Isso determina a geometria, posição e orientação ideais do coração dentro do corpo do paciente (Figura 6B). Esse processo elimina a necessidade de tomografia computadorizada ou ressonância magnética pré-procedimento, permitindo a geração do primeiro mapa cardíaco não invasivo em 10 a 15 minutos. É importante observar que uma mensagem pop-up informa ao usuário se a reconstrução 3D do tronco não tiver resolução suficiente ou contiver artefatos que possam afetar a precisão dos resultados da estimativa.
4. Mapeamento ECGI não invasivo sem imagem para orientar o implante de estimulação do sistema de condução para terapia de ressincronização cardíaca (CSP-CRT) em tempo real (caso 4)
- Vá para a janela Amplifier e clique no botão Connect Amplifier para começar a adquirir sinais eletrofisiológicos em tempo real (Figura 7). Clique nos diferentes fios para visualizar os sinais na tela do amplificador.
- Vá para a janela em tempo real (Figura 8) para obter o mapeamento cardíaco não invasivo em tempo real.
NOTA: A janela em tempo real permite a visualização de sinais em tempo real, exclui sinais ruidosos, cria criadores temporais, delineia automaticamente segmentos de análise (por exemplo, onda P e complexo QRS) e calcula e exibe mapas ECGI não invasivos. - Exclua sinais ruidosos clicando no botão de visualização de 128 derivações , selecionando a opção Somente usuário como modo de seleção de eletrodos ruidosos e clicando duas vezes em sinais ruidosos para excluí-los antes de gerar o mapa ECGI. Isso melhora a qualidade da computação do mapeamento, pois o ECGI é um problema mal colocado21.
NOTA: Os cabos do colete do sensor exibidos em verde indicam sinais de boa qualidade e são usados para cálculo de problemas inversos, enquanto os cabos mostrados em vermelho são ruidosos e são excluídos da análise (Figura 8A). - Clique no botão de visualização de 12 derivações para visualizar um ECG estimado de 12 derivações em tempo real (Figura 8B).
- Certifique-se de que o botão RT ON esteja ativo para atualizar automaticamente os sinais na seção de análise de sinal (Figura 8C). Esta opção aciona e define automaticamente o início e o deslocamento do complexo QRS a ser analisado.
NOTA: O botão RT pode ser alternado para o modo RT OFF para congelar os sinais, permitindo que o usuário delineie manualmente o complexo QRS quando o delineamento automático do sistema estiver abaixo do ideal. - Configure a análise de mapeamento de ativação do ECGI clicando no botão Opções para gerar automaticamente um mapa de ritmo basal ideal para o procedimento CSP-CRT:
- Selecione a opção Analisar Ventrículo para mapear apenas os ventrículos.
- Selecione a opção de análise baseada em wavelet17 para o algoritmo de tempos de ativação.
- Selecione a opção Batimento médio para o recurso Tipo de mapeamento para calcular a onda média dos últimos 10 complexos QRS.
- Deixe as configurações padrão para os recursos Correção de deslocamento, Número de batida e Opção de sincronização .
- Selecione a opção de dois painéis na seção de visualização de mapas e certifique-se de que o mapa esquerdo esteja definido para o modo Atualizar , para que ele seja atualizado continuamente com cada novo complexo QRS médio analisado.
- Visualize o mapa de ativação basal biventricular no lado esquerdo (painel esquerdo da Figura 8D). O sistema calcula automaticamente a matriz de transferência entre as malhas do tronco e do coração para reconstruir a atividade elétrica epicárdica do coração com base no método dos elementos de contorno 22,23,24.
NOTA: O mapa de ativação descreve a progressão temporal da despolarização através do epicárdio cardíaco, auxiliando na identificação das origens da ativação e na identificação de padrões reentrantes ou focais. As ativações são calculadas (1) transformando cada eletrograma reconstruído em uma soma de wavelets senoidais para todas as amostras de tempo de inclinação negativa e amplitude proporcional à inclinação naquele momento e (2) selecionando o instante da amplitude máxima do sinal transformado como o instante do tempo de ativação17. - Escreva o nome e salve o mapa basal clicando no botão Salvar mapa e mude o mapa para o modo Congelar quando estiver reproduzível. Um mapa ECGI reproduzível tem duração de ativação consistente e padrões de propagação em pelo menos três mapas consecutivos.
NOTA: Nos procedimentos de CSP-CRT, o mapa basal (Figura 12A) servirá como referência para avaliar a sincronia biventricular durante o processo de aparafusamento do eletrodo na região septal até atingir a área do ramo esquerdo (Figura 12C). - Configure a análise do mapeamento de ativação do ECGI clicando no botão Opções para obter mapas ideais durante o processo de aparafusamento e estimulação na região septal:
- Selecione Analisar Ventrículo para mapear apenas os ventrículos.
- Selecione a opção de análise baseada em wavelet para o Algoritmo de tempos de ativação.
- Selecione a opção de batida única para o Tipo de mapeamento para analisar a onda de uma única batida para capturar alterações nos sinais eletrocardiográficos durante o processo simultâneo de aparafusamento e estimulação em diferentes posições septais.
- Deixe as configurações padrão para os recursos Correção de deslocamento, Número de batida e Opção de sincronização .
- Defina o mapa do painel direito para o modo de atualização para garantir que ele seja atualizado continuamente com cada complexo QRS de batimento único recém-analisado durante o processo de aparafusamento.
- Sincronize o intervalo do mapa de cores do mapa do painel direito com o mapa basal usando o menu Valores vinculados e vincule suas posições de câmera por meio do menu Câmera vinculada (painel direito da Figura 8D).
NOTA: À medida que o eletrodo é aparafusado na região septal, os mapas de ECGI batimento a batimento são gerados automaticamente em várias posições (ou seja, septo ventricular direito, septo médio, septo profundo e ramo esquerdo). Esses mapas são comparados ao mapa basal padronizando a faixa de mapas de cores em todos os mapas ECGI avaliados (Figura 12B, C). Essa configuração permite uma visualização clara das mudanças nos padrões de ativação enquanto o cabo é parafusado. - Escreva o nome e salve cada mapa clicando no botão Salvar mapa sempre que uma mudança no padrão de ativação for observada durante o processo de aparafusamento na região septal, continuando até que a área do ramo esquerdo seja alcançada.
5. Análise adicional de mapeamento de ECGI sem imagem não invasiva
NOTA: Diferentes mapas cardíacos podem ser derivados de sinais de ECGI computados para avaliar o substrato cardíaco, caracterizar arritmias, avaliar TRC ou extrair métricas clinicamente relevantes durante os procedimentos. O tipo de mapas que podem ser gerados depende do ritmo cardíaco específico que está sendo analisado, com abordagens distintas para ritmos regulares e irregulares.
- Use a seção de análise de sinal da janela em tempo real para analisar os diferentes ritmos que os pacientes podem exibir durante o procedimento eletrofisiológico:
- Analise ritmos regulares, definindo a análise de batimento único ou médio como recurso Tipo de mapeamento , quando o paciente estiver em um ritmo estabilizado/regular, como ritmo sinusal, estimulação atrial ou ventricular, flutter atrial ou taquicardia ventricular. Calcule o mapa de ativação e o mapa de velocidade de condução (CV) a partir da análise de ritmo regular.
- Analise o ritmo irregular, usando a análise de batimento de ritmo irregular como recurso de tipo de mapeamento quando o paciente estiver em fibrilação atrial. O sistema permite a seleção de segmentos de AF estendidos (por exemplo, 1 min) para suprimir complexos QRST e capturar os padrões espaço-temporais dinâmicos de AF. Calcule o mapa de fase , o mapa de histograma do rotor e o mapa de frequência dominante da análise de ritmo irregular.
- Opcionalmente, pressione o menu suspenso da seleção de mapa e escolha o mapa de ativação se um ritmo regular tiver sido analisado. Consulte a etapa 4.8 para obter uma descrição detalhada do mapa de ativação .
- Opcionalmente, pressione o menu suspenso da seleção do mapa e escolha o mapa de velocidade de condução se um ritmo regular tiver sido analisado.
NOTA: A velocidade de condução é uma métrica derivada do mapa de ativação. Essa métrica representa o tempo que uma frente de onda leva para percorrer cada área do epicárdio. O cálculo do CV depende de gradientes espaciais de mapas de tempo de ativação nas superfícies cardíacas, com campos vetoriais de velocidade aplicados para identificar regiões de propagação efetiva. Áreas com vetores direcionais uniformes indicaram propagação elétrica estável, enquanto regiões com disparidades angulares, indicando propagação ineficaz, são interpoladas usando uma Função de Base Radial25. A CV permite identificar áreas de desaceleração de condução durante o mapeamento do substrato que estão relacionadas às taxas de recorrência de arritmia17. - Opcionalmente, pressione o menu suspenso da seleção do mapa e escolha o mapa de fase ao analisar um ritmo irregular.
NOTA: O mapa de fase rastreia a progressão de uma região definida do miocárdio através do potencial de ação ao longo do tempo. Esse tipo de mapa é dinâmico, pois representa a progressão do potencial cardíaco. No mapa de fase, a Transformada de Hilbert é aplicada para calcular a fase do sinal ECGI. Cada fase corresponde a um determinado estado do potencial de ação ao longo de cada ciclo do sinal (π para repouso, π/2 para despolarização, 0 para o platô e -π para repolarização)26. - Opcionalmente, pressione o menu suspenso da seleção de mapa e escolha o mapa Histograma do rotor ao analisar um ritmo irregular.
NOTA: Um mapa de histograma de rotor, derivado de um mapa de fase, é uma representação dos locais mais frequentes de singularidades de fase, que são áreas com atividade reentrante concentrada e são exibidas em vermelho. Em resumo, as singularidades de fase são definidas como pontos-chave onde a fase muda de -π para π. PSs que não mostram uma progressão espacial gradual de fases em seus arredores são descartados. Finalmente, o número de voltas para cada rotor é quantificado para obter o mapa do Histograma do Rotor 18. A precisão do algoritmo na identificação de padrões de propagação durante a FA e as regiões específicas que exibem reentradas tem sido sistematicamente avaliada em relação ao mapeamento endocárdico, demonstrando uma correlação de 71%16. - Opcionalmente, pressione o menu suspenso da seleção de mapa e selecione o mapa de Frequência Dominante (DF) ao analisar um ritmo irregular.
NOTA: Os mapas DF exibem a frequência elétrica predominante em cada região cardíaca ao longo do tempo, ajudando a identificar áreas de atividade elétrica rápida que podem servir como condutores de FA. DF são calculados como a frequência com a maior densidade espectral de potência no periodograma de Welch 27,28. Sua análise permite a detecção de áreas com alta estabilidade ou variabilidade na atividade fibrilatória dentro dos átrios. Um histograma é usado para avaliar a distribuição temporal das frequências dominantes, fornecendo uma representação clara e quantitativa da atividade elétrica mais relevante e facilitando a identificação de regiões com comportamento anormal.
Resultados
Caso 1 - Planejamento e orientação da ablação por cateter de flutter atrial atípico
Este caso é um paciente do sexo masculino de 59 anos (índice de massa corporal -IMC- 30) com história de hipertensão, tabagismo, doença valvar cardíaca, classificação EHRA IIb e escore CHA2DS 2-VASc de 1 com indicação de ablação por cateter devido a flutter atrial atípico (AFL) com base em um ECG de 12 derivações (Figura 9A). O paciente não tinha história prévia de ablação por cateter. A ressonância magnética tardia com gadolínio pré-procedimento (LGE-RM) revelou extensa fibrose na parede posterior do átrio esquerdo (AE), com planimetria do AE normal de 24 cm² e fração de ejeção do ventrículo esquerdo (FEVE) preservada de 54%.
O ECGI não invasivo sem imagem foi realizado poucos minutos antes da introdução do cateter por meio de uma bainha femoral. Um ciclo completo do AFL (209 ms), livre de complexos QRST, foi selecionado para análise. O mapeamento revelou um circuito macro-reentrante ao redor da valva mitral (VM), identificando a linha perimitral como o alvo ideal de ablação para o término da arritmia (Figura 9B). Em seguida, foi realizado o EAM baseado em contato (Figura 9C), que confirmou o padrão de propagação observado no ECGI não invasivo sem imagem. A ablação ao longo da linha perimitral encerrou com sucesso a arritmia.
Neste caso clínico, a arritmia foi caracterizada com precisão antes do MAE invasivo, permitindo a localização precisa do padrão de propagação da arritmia e simplificando o procedimento de ablação. No entanto, para taquicardias atriais complexas, como AFL ou taquicardia focal, o Imageless ECGI oferece mapeamento em tempo real e de batimento único, tornando-o particularmente valioso em casos de arritmia não sustentada. Sua adaptabilidade a mudanças nos padrões de arritmia durante um procedimento garante um mapeamento preciso e dinâmico. Além disso, embora o diagnóstico de LFA no sentido anti-horário seja geralmente simples a partir de um ECG de 12 derivações, localizar e identificar com precisão o mecanismo de taquiarritmias complexas pode ser um desafio. Consequentemente, a realização de ECGI sem imagem em consulta médica ou minutos antes pode aumentar a segurança e a eficiência do procedimento, fornecendo orientação a montante para o planejamento da ablação por cateter e eliminando abordagens transeptais desnecessárias.
Caso 2 - Evolução das singularidades de fase durante a ablação por cateter de fibrilação atrial persistente
Trata-se de um paciente do sexo masculino, 63 anos (IMC 31), com fração de ejeção do ventrículo esquerdo (FEVE, 55%) preservada, sem AE dilatado, e a New York Heart Association (NYHA) de I foi indicada para ablação por cateter devido à FA persistente. Nenhuma tomografia computadorizada ou ressonância magnética pré-procedimento foi realizada. O paciente tinha história prévia de ablação por cateter para isolamento de veias pulmonares (IVP) em dezembro de 2019.
Na chegada, o paciente estava em FA. O mapeamento do substrato foi realizado usando ECGI sem imagem durante todo o procedimento de ablação (Figura 10A). No início do estudo, o ECGI identificou singularidades de fase na parede lateral do átrio direito (AD), na base do apêndice atrial direito (AAD), na parede posterior do átrio esquerdo (PW) e na base do apêndice atrial esquerdo (AAE). Esses achados se correlacionaram com EGMs fragmentados e de alta frequência observados usando cateteres endocavitários, e a PVI adequada foi confirmada por meio da reconstrução do LA EAM. A ablação por campo pulsado (PFA) foi iniciada na base do AAE, resultando em uma mudança de ritmo de FA para AFL atípica. O ECGI sem imagem revelou um AFL perimitral, que foi confirmado por arrastamento do polo distal do cateter do seio coronário. Uma linha mitral foi criada; no entanto, a FA foi reinduzida. Posteriormente, o isolamento completo do PW foi alcançado. Apesar disso, o ECGI sem imagem continuou a identificar singularidades de fase significativas na base do RAA. Após várias aplicações de PFA direcionadas a essa área, o ritmo sinusal foi alcançado (Figura 10B).
Este caso clínico é uma representação de como a FA apresenta desafios únicos devido à alta variabilidade da atividade elétrica nos átrios. O ECGI sem imagem capturou efetivamente os padrões espaço-temporais de progressão da FA durante a ablação, com até três mapas não invasivos adquiridos para orientar a modificação do substrato até que a RS fosse alcançada. Os tratamentos padrão, como o isolamento das veias pulmonares, têm taxas de recorrência relativamente altas29. As principais dificuldades no tratamento da FA residem em duas áreas: (1) determinar quais pacientes se beneficiarão apenas do PVI e (2) para aqueles que requerem uma abordagem mais ampla, identificar as regiões fora da área do PVI cuja ablação reduzirá mais efetivamente a recorrência da arritmia. Durante o ritmo sinusal, o Imageless ECGI demonstrou a capacidade de gerar mapas CV, que se mostraram úteis na previsão do sucesso da ablação do PVI17. No entanto, neste caso, o ECGI sem imagem capturou os padrões dinâmicos da FA simultaneamente, fornecendo aos médicos uma visão abrangente de como a FA se propaga e ajudando a identificar as principais regiões que impulsionam a arritmia. A análise de resultados deve se concentrar na correlação entre os drivers de FA detectados por ECGI sem imagem e os desfechos clínicos, como sobrevida livre de arritmia em longo prazo, para validar ainda mais sua utilidade na otimização das estratégias de ablação de FA.
Caso 3 - Orientação da otimização da estimulação biventricular para terapia de ressincronização cardíaca
Este caso é uma paciente do sexo feminino de 67 anos com cardiomiopatia dilatada não isquêmica, FEVE de 25%, sem evidência de realce tardio com gadolínio na ressonância magnética pré-procedimento, com bloqueio de ramo esquerdo (BRE) no ECG basal e duração do QRS de 156 ms. O paciente foi indicado para estimulação biventricular (BiVP) como parte da TRC.
Durante o procedimento de TRC cardíaca, o ECGI sem imagem em tempo real foi usado para avaliar a sincronização ventricular antes e após o implante do marcapasso. No ritmo basal, a última região de ativação do paciente foi identificada na parede basal-lateral do ventrículo esquerdo (VE), conforme ilustrado na Figura 11A. O tempo total de ativação ventricular (TAT) foi medido em 116 ms, indicando assincronia ventricular significativa. Diferentes configurações de dispositivos foram avaliadas usando ECGI, com a configuração ideal determinada como BiVP usando ativação simultânea dos pólos distal e proximal do eletrodo do VE e um atraso atrioventricular de 140 ms. Conforme mostrado na Figura 11B, os três pontos de estimulação ventricular não resultaram em regiões ativadas tardiamente, indicando sincronização bem-sucedida, com um TAT melhorado de 70 ms.
A terapia de ressincronização cardíaca visa restaurar a coordenação elétrica nos ventrículos e melhorar a função cardíaca em pacientes com insuficiência cardíaca e QRS prolongado. Nesse caso, o Imageless ECGI forneceu mapeamento em tempo real que foi fundamental para orientar a otimização do BiVP durante o procedimento de CRT. Permitiu uma avaliação precisa dos padrões de ativação ventricular e ajudou a identificar a configuração ideal do dispositivo, garantindo a sincronização ventricular completa. A natureza não invasiva e o feedback imediato do ECGI permitiram que os médicos refinassem a programação de derivações. Por outro lado, embora os estudos destaquem o valor do ECGI em orientar a colocação do eletrodo do ventrículo esquerdo próximo à última região ativada30, restrições anatômicas podem limitar sua aplicabilidade. Os parâmetros de ressincronização basal e final determinados pelo ECGI, como o TAT, devem estar relacionados aos desfechos clínicos, monitorando a resposta clínica do paciente à TRC ao longo do tempo, incluindo melhora dos sintomas e função ventricular em longo prazo.
Caso 4 - Implante de estimulação do sistema de condução orientador para terapia de ressincronização cardíaca em tempo real
Este caso clínico é uma paciente do sexo feminino, 45 anos, com disfunção ventricular grave (FEVE 15%) e BRE com duração do QRS de 172 ms. O paciente foi indicado para um desfibrilador cardiovertido implantável CRT usando uma abordagem de estimulação do sistema de condução (CSP).
O ECGI sem imagem em tempo real foi utilizado durante o implante do dispositivo para monitorar a sincronia ventricular durante todo o processo de aparafusamento do eletrodo na região septal. Como mostrado na Figura 12, o mapa ECGI basal identificou a parede lateral do VE como a última área ativada, com um TAT de 133 ms. O mapeamento ECGI batimento a batimento durante o aparafusamento do eletrodo demonstrou melhorias progressivas na sincronia ventricular, com sincronização ideal alcançada ao atingir o ramo esquerdo, resultando em um TAT de 95 ms.
Este caso demonstrou o potencial do ECGI sem imagem em tempo real para orientar o implante de LBBP durante um procedimento de CRT. Seus recursos de mapeamento em tempo real de batimento único permitiram a análise do TAT ventricular e a ressincronização em cada etapa do implante do eletrodo na região septal. O sistema forneceu uma métrica rápida, visual e de fácil interpretação, abordando a falta de padronização nos critérios eletrocardiográficos do PSC. Assim como nos procedimentos BiVP-CRT, mais estudos são necessários para determinar se os parâmetros do ECGI sem imagem se correlacionam significativamente com a resposta clínica do CRT e como eles se comparam aos preditores de ECG de 12 derivações.
Caso 5 - Planejamento e orientação da ablação por cateter de taquicardia ventricular
Trata-se de um paciente do sexo masculino, 53 anos (IMC 25,4), portador de cardiomiopatia isquêmica, disfunção ventricular grave (FEVE 15%), e a classe II da NYHA foi encaminhada para procedimento de ablação por cateter devido à TV recorrente. A ressonância magnética pré-procedimento revelou extensa fibrose endocárdica e canais arritmogênicos localizados nos segmentos ínfero-basal e ínfero-medial do ventrículo esquerdo. O paciente tinha história prévia de ablação por cateter de TV em 2018.
Mapeamento simultâneo de ECGI sem imagem (Figura 13A) e EAM invasivo (Figura 13B) foram realizados durante todo o procedimento. O processo de ablação por cateter envolveu mapeamento baseado em substrato durante a estimulação apical do ventrículo direito (VD) e indução de TV usando estimulação programada. O ECGI sem imagem identificou uma região de desaceleração da condução no segmento ínfero-basal do VE durante o mapeamento do ritmo sinusal antes da introdução do cateter. Esse achado foi consistente com a fibrose observada na RM. A estimulação subsequente do ápice do ventrículo direito (VD) confirmou a lentificação da condução nos segmentos basal e medial do VE, identificando essa área como o provável substrato arritmogênico. Um VT com duração de ciclo de 380 ms foi brevemente induzido, necessitando de cardioversão devido à instabilidade hemodinâmica. Consequentemente, apenas um número limitado de pontos EAM foi adquirido. No entanto, usando um único ciclo de TV, o ECGI sem imagem identificou com sucesso o istmo de TV na mesma região onde o apinhamento isomronal foi observado nos mapas estimulados.
O uso de ECGI sem imagem em tempo real neste caso de TV abordou com sucesso dois grandes desafios clínicos no tratamento da TV: (1) a localização precisa de potenciais alvos de ablação durante o ritmo sinusal e (2) a caracterização da TV com instabilidade hemodinâmica. A partir de um único batimento, o istmo VT foi identificado com precisão nos mapas de ativação do substrato e da arritmia. O sistema permitiu que os operadores identificassem substratos arritmogênicos antes ou durante a ablação e caracterizassem vários VTs induzíveis em tempo real a partir de um único ciclo.

Figura 1: Componentes de hardware ECGI sem imagem. (A) Amplificador bipotencial com portas de conexão de cabo específicas. (B) Cabos direito e esquerdo, equipados com ampconectores de amplificador em uma extremidade e conectores de soquete de colete de sensor na outra. (C) Configuração mostrando os cabos direito e esquerdo conectados ao amplificador bipotencial. (D) Fluxo de trabalho esquemático do procedimento para conectar o colete do sensor aos soquetes dos cabos. Clique aqui para ver uma versão maior desta figura.

Figura 2: Procedimento de scanner de reconstrução do torso 3D. (A) O colete sensor de potencial de superfície corporal de 128 derivações, composto por quatro componentes (Frente-Direita, Frente-Esquerda, Trás-Direita, Trás-Esquerda), é colocado no torso do paciente antes da reconstrução 3D. Cada eletrodo possui um código QR exclusivo para identificação automática. As conexões entre os eletrodos podem ser dobradas para acomodar o colete ao formato do corpo do paciente. (B) O código QR no componente frontal direito valida o colete, permitindo que o aplicativo do scanner 3D inicie a reconstrução do tronco. (C) A plataforma do scanner 3D por meio do aplicativo do scanner 3D gera o torso reconstruído usando uma câmera de luz estruturada infravermelha. Abreviaturas: FR: frente-direita; FL: frente-esquerda; BR: atrás-direita; e BL: de trás para a esquerda. Clique aqui para ver uma versão maior desta figura.
Figura 3: Tela de login da interface do usuário ECGI sem imagem que requer um nome de usuário e senha designados para acesso ao software. Clique aqui para ver uma versão maior desta figura.

Figura 4: Janela inicial. A janela Início permite o gerenciamento de pacientes, médicos e usuários, bem como a configuração de sessões de pacientes. Ele também exibe informações sobre as sessões importadas e o status do sistema e do amplificador. Clique aqui para ver uma versão maior desta figura.
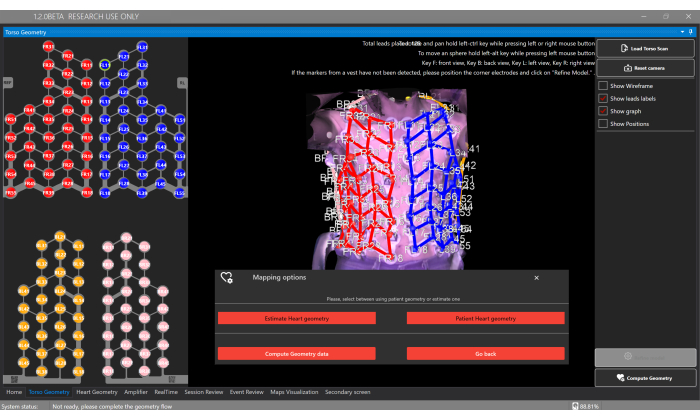
Figura 5: Janela de geometria do tronco. A janela Geometria do tronco permite que os usuários carreguem e visualizem o modelo 3D do tronco, segmentem eletrodos e selecionem o tipo de geometria do coração por meio do botão Calcular geometria , que permite a estimativa ou fornecer uma segmentação a partir de TC/RM personalizada. Clique aqui para ver uma versão maior desta figura.
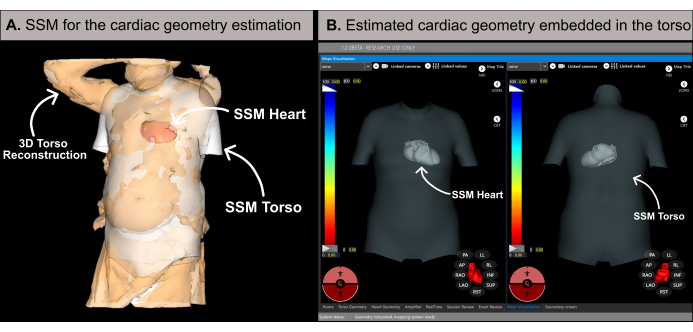
Figura 6: Estimativa da geometria cardíaca. (A) Algoritmo SSM utilizando características basais e a reconstrução 3D do tronco do paciente para estimar a geometria cardíaca. (B) Geometria cardíaca estimada dentro do SSM do tronco exibindo as vistas ântero-posterior (lado esquerdo) e póstero-anterior (lado direito). Abreviaturas: 3D: tridimensional; SSM: modelo estatístico de forma. Clique aqui para ver uma versão maior desta figura.

Figura 7: Janela do amplificador. A janela Amplifier permite a visualização em tempo real dos sinais que estão sendo obtidos de cada eletrodo do Sensor Vest. Clique aqui para ver uma versão maior desta figura.
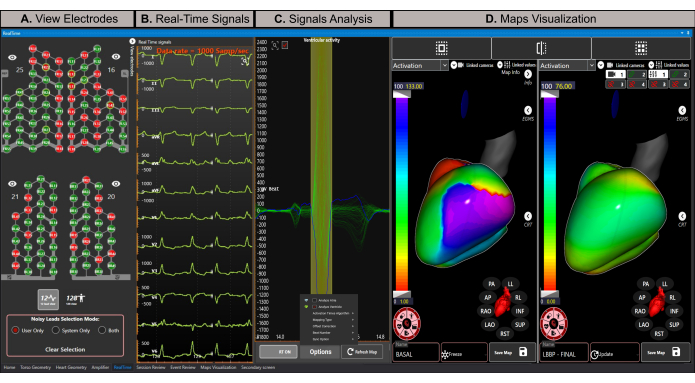
Figura 8: Janela em tempo real. (A) Representação esquemática dos eletrodos ativos do colete de matriz de eletrodos de alta densidade. Os eletrodos verdes contêm sinais de boa qualidade, enquanto os eletrodos vermelhos contêm sinais ruidosos e não participam do cálculo inverso do problema. (B) Estimativa das 12 derivações do eletrocardiograma em tempo real. (C) Disparo automático e delineamento do início e deslocamento do complexo QRS (janela de cor verde). O sinal médio de todos os leads que participam do cálculo do mapeamento é mostrado em azul. (D) A seção de visualização de mapas oferece suporte a visualizações de mapa simples, duplas ou de quatro. Este exemplo mostra uma visualização de mapeamento duplo com mapas de ativação para estados de estimulação de ramo basal e esquerdo (mapa final) durante um procedimento de CRT. O mapa basal está em modo de congelamento, permanecendo estático, enquanto o mapa final está em modo de atualização, recalculando com cada complexo QRS recém-analisado. Clique aqui para ver uma versão maior desta figura.
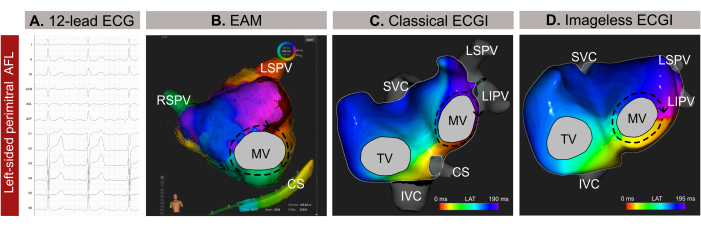
Figura 9: Exemplo gráfico de um AFL atípico do lado esquerdo e as diferentes capacidades diagnósticas do ECG de 12 derivações, ECGI sem imagem e EAM invasivo. (A) Os sinais de ECG de 12 derivações do AFL atípico apresentam ondas supraventriculares positivas em V1. (B) ECGI sem imagem usando uma geometria cardíaca estimada de um SSM e exibindo uma visão ântero-posterior. O circuito de propagação mostra todas as cores ao redor do MV, um padrão típico para um AFL perimitral. (C) O mapeamento de ativação local derivado do EAM e exibindo uma visão ântero-posterior mostra uma macro-reentrada ao redor do MV, confirmando o diagnóstico do ECGI sem imagem. Abreviaturas: ECG: eletrocardiograma; MAE: mapeamento eletroanatômico; ECGI: imagem eletrocardiográfica. VCS: veia cava superior; VCI: veia cava inferior; SC: seio coronário; VPSI: veia pulmonar superior esquerda; VPIQ: veia pulmonar inferior direita; VSP: veia pulmonar superior direita. Clique aqui para ver uma versão maior desta figura.

Figura 10: Acompanhamento da evolução do substrato atrial durante a ablação por cateter de FA usando mapeamento não invasivo de ECGI sem imagem. (A) Vistas póstero-anterior, ântero-póstero e lateral direita de ECGI sem imagem, com locais de PFA marcados por círculos verdes. O mapa PS basal destaca as reentradas na parede lateral do AR, na base do AAD, na parede posterior do AE e na base do AAE. O PFA na base do AAE fez a transição do ritmo para o AFL perimitral. Apesar de completar a linha mitral e o isolamento da parede posterior, a FA foi induzida espontaneamente novamente. O ECGI revelou PS na base do AAR, que se tornou o alvo da ablação. Múltiplas aplicações de PFA foram realizadas nessa área e o ritmo sinusal foi restaurado. (B) O ECG de 12 derivações e os sinais intracardíacos no momento da FA mudaram para SR. Abreviaturas: VCS: veia cava superior; VCI: veia cava inferior; LPVs: veias pulmonares esquerdas; VPR: veias pulmonares direitas; FA: fibrilação atrial, RS: ritmo sinusal, SP: singularidades de fase, LAT: tempos de ativação local, VC: valva tricúspide, VM: valva mitral, PVI: isolamento das veias pulmonares, AFL: flutter atrial, PW: parede posterior e PFA: ablação por campo pulsado. Clique aqui para ver uma versão maior desta figura.
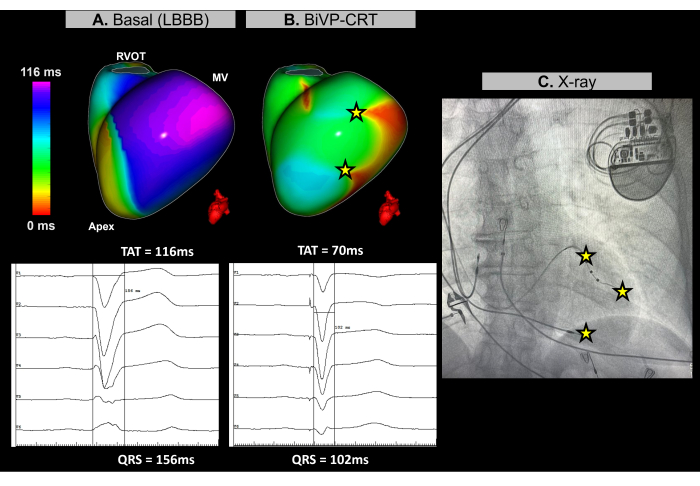
Figura 11: Otimização da estimulação biventricular usando ECGI sem imagem. (A) Ritmo basal do paciente. O mapa de ECGI sem imagem (vista lateral esquerda) revela uma região ativada tardiamente (roxo) na parede lateral do VE, com um TAT de 116 ms, indicando dissincronia ventricular. Isso se alinha com o ECG basal, que mostra um complexo QRS largo (156 ms) com um padrão de BRE. (B) Configuração pós-implante de marcapasso. Após BiVP com ativação simultânea dos polos distal e proximal do eletrodo do VE e um atraso atrioventricular de 140 ms, o mapa de ECGI sem imagem não mostra regiões ativadas tardias (sem área roxa), indicando ativação ventricular síncrona e um TAT reduzido de 70 ms. Isso é consistente com o complexo QRS encurtado observado no ECG final, onde a duração do QRS diminui para 102 ms. (C) Visão de raios-X ântero-posterior do marcapasso implantado, mostrando a localização dos eletrodos do marcapasso. A atividade de estimulação dos pólos distal e proximal da derivação do VE também é refletida no mapa ECGI. Abreviaturas: BRBRE: bloqueio de ramo esquerdo, BiVP: estimulação biventricular, TRC: terapia de ressincronização cardíaca, VSVD: via de saída do ventrículo direito, VM: valva mitral, TAT: tempo total de ativação. Clique aqui para ver uma versão maior desta figura.

Figura 12: Avaliação não invasiva da TRC por meio da estimulação do sistema de condução usando ECGI sem imagem. (A) Ritmo basal do paciente. O mapa ECGI (incidência lateral esquerda) indica uma região de ativação tardia (roxo) na parede lateral do VE, com TAT de 133 ms, sugerindo dissincronia ventricular. Isso corresponde ao ECG basal, que exibe um complexo QRS largo (172 ms) típico de BRE. (B) Fase intermediária (estimulação septal média) durante o implante do eletrodo LBBP. O mapa não invasivo mostra uma correção parcial da região tardia no VE, com a mudança de cor de roxo para azul. Isso é acompanhado por uma redução na duração do complexo QRS. (C) A posição final do cabo LBBP durante o processo de aparafusamento. O mapa demonstra a correção completa da área tardia, com a transição da cor de roxo para verde, indicando ativação síncrona de ambos os ventrículos. Abreviaturas: BRE: bloqueio de ramo esquerdo, BRE: ramo esquerdo, VSVD: via de saída do ventrículo direito, VM: valva mitral, TAT: tempo total de ativação. Clique aqui para ver uma versão maior desta figura.

Figura 13: Avaliação não invasiva do istmo VT usando ECGI sem imagem. (A) O mapeamento de ECGI sem imagem durante o procedimento de ablação de TV identifica o substrato arritmogênico e o istmo de TV nas regiões ínfero-basal e ínfero-medial do VE. A primeira fileira corresponde ao ritmo sinusal, a fileira do meio à estimulação apical do VD e a fileira inferior ao VT. (B) O MAE invasivo obtido durante o procedimento de ablação de TV mostra mapeamento de ativação isócrona nas mesmas regiões identificadas pelo ECGI. A linha superior corresponde à estimulação apical do VD, enquanto a linha inferior representa o VT. Abreviaturas: VD: ventrículo direito, VE: ventrículo esquerdo, SR: ritmo sinusal, VSVD: via de saída do ventrículo direito, VM: valva mitral, VC: valva tricúspide. Clique aqui para ver uma versão maior desta figura.
Discussão
Essa descrição metodológica destaca a utilidade clínica de uma abordagem de ECGI não invasiva, de batimento único e em tempo real, que pode apoiar uma variedade de procedimentos eletrofisiológicos, como ablação por cateter e TRC, sem a necessidade de imagens cardíacas pré-procedimento, como TC ou RM 15,17,31,32 Neste relatório, o Imageless ECGI demonstra as principais características técnicas que podem promover sua adoção clínica. Embora o ECGI já tenha provado ser uma ferramenta poderosa para o mapeamento cardíaco em uma ampla gama de arritmias 19,33,34,35,36, ele continua a enfrentar vários desafios clínicos e técnicos13,14.
Os sistemas ECGI clássicos precisam de uma tomografia computadorizada especificamente no mesmo dia do mapeamento cardíaco, com os eletrodos ECGI no lugar 9,10,12,37,38. Essa abordagem adiciona tempo extra devido à necessidade de segmentação da tomografia computadorizada (coração e eletrodos), atrasando a geração do mapa inicial de ECGI em aproximadamente 1-3 h. Em contraste, o sistema ECGI sem imagem apresentado neste relatório utiliza uma varredura 3D infravermelha do tórax com eletrodos de matriz de alta densidade, que pode ser realizada poucos minutos antes do procedimento ou durante consultas médicas15,17. O sistema segmenta automaticamente os eletrodos torácicos e estima a geometria cardíaca do paciente, simplificando o processo de mapeamento cardíaco não invasivo e reduzindo significativamente o tempo entre a chegada do paciente e a disponibilidade do primeiro mapa de ECGI. A validação anterior da abordagem ECGI sem imagem mostrou que o uso da geometria cardíaca estimada introduz erros mínimos, mantendo a precisão dos mapas não invasivos. Em pacientes com FA, foi observada uma forte correlação entre os sinais de ECGI derivados de geometrias cardíacas estimadas versus reais, mesmo com translações geométricas15. Para arritmias regulares, como taquicardia atrial complexa, as comparações com o MAE demonstraram alta acurácia na identificação da câmara cardíaca envolvida, na determinação do mecanismo (focal ou reentrante) e na inferência do alvo de ablação31. No caso da TV, a abordagem tem sido avaliada para orientar os operadores em direção a áreas de istmos de TV durante o ritmo sinusal (RS)39, o que mostra o potencial de identificar pacientes em risco de TV na prevenção primária. Além disso, foi observada forte congruência regional entre os mapas de ativação de ECGI e EAM sem imagem durante a estimulação do seio coronário, particularmente nos locais de ativação precoce e tardia40.
Na TRC, as alterações morfológicas em tempo real no ECG de 12 derivações são normalmente usadas para confirmar a ressincronização durante o implante do eletrodo, particularmente em procedimentos CSP em que o ECG é avaliado em vários estágios da colocação do eletrodo septal até que a área do BRE seja atingida. No entanto, os algoritmos de ECG publicados são frequentemente complexos, mostram diferenças significativas entre si e, em alguns casos, são difíceis de implementar na prática clínica 41,42,43. Possivelmente devido a essa complexidade, nenhum parâmetro eletrocardiográfico específico para estimulação de ramo esquerdo (LBBP) foi consistentemente identificado que possa prever com segurança se um paciente responderá à ressincronização cardíaca. A abordagem ECGI sem imagem em tempo real oferece mapeamento simples e detalhado, batimento a batimento, durante todo o implante do eletrodo, avaliando a correção da dissincronia avaliando parâmetros como o tempo de ativação do ventrículo esquerdo, conforme demonstrado em pacientes com indicação de TRC32 ou naqueles com bloqueio AV44. Portanto, com uma investigação mais aprofundada, os parâmetros de ECGI em tempo real podem orientar os operadores na otimização da localização do implante do eletrodo ou na previsão da resposta do paciente à TRC.
Embora o potencial do ECGI sem imagem em tempo real tenha sido apresentado neste relatório metodológico, outras novas abordagens de mapeamento não invasivo usando simulações de arritmia também visaram eliminar a necessidade de imagens pré-procedimento. O estudo Vectorcardiographic Mapping of Arrhythmogenic Probability (VMAP) demonstrou acurácia regional significativa na identificação de locais de arritmia ventricular45 e mostra-se promissor na identificação da localização dos drivers de FA além da ablação sem IVP46. O VMAP usa o ECG de 12 derivações em combinação com vários modelos computacionais para identificar alvos de arritmia sem depender de dados geométricos específicos do paciente. No entanto, essa abordagem pode ser abaixo do ideal para arritmias atriais como FA, em que componentes de alta frequência no ECG de superfície são cruciais para identificar os fatores de arritmia de forma não invasiva. Esses componentes são tipicamente captados por eletrodos nas superfícies posterior e ântero-lateral27, que não são representados no ECG padrão de 12 derivações usado na prática clínica.
Apesar da necessidade de mais investigações clínicas, o ECGI sem imagem em tempo real tem o potencial de se tornar uma ferramenta valiosa para o mapeamento cardíaco não invasivo em uma ampla gama de arritmias. Sua simplicidade metodológica e fluxo de trabalho simplificado do paciente em ambientes hospitalares permitem que os médicos coletem mais dados clínicos, o que pode melhorar os resultados dos pacientes e futuros avanços tecnológicos. Em conclusão, o futuro do mapeamento cardíaco não invasivo está no avanço em direção a uma abordagem totalmente sem imagens, permitindo uma integração mais rápida e suave na prática clínica diária, desde consultas de rotina até mapeamento em tempo real durante procedimentos eletrofisiológicos.
Divulgações
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG e AMC receberam honorários da Corify Care SL. AMC, MSG e FA são cofundadores da Corify Care SL e JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG e AMC são acionistas. A TFA recebeu bolsas de pesquisa da Biosense-Webster. IRL recebeu honorários como palestrante e consultor da Abbott e Biosense-Webster. APS recebeu honorários de palestrante e consultor da Bisosense-Webster, Abbott e Boston-Scientific. JMT recebeu honorários como palestrante e consultor da Abbott, Boston-Scientific e Medtronic. A EA recebeu honorários de palestrante e consultor da Biosense-Webster e da Bayer. LM relata honorários como consultor, palestrante e Conselho Consultivo da Boston-Scientific, Abbott, Johnson & Johnson e Medtronic, e é acionista da Galgo Medical SL. A JBG relata honorários como consultor e palestrante da Microport CRM e Abbott, além de apoio irrestrito para uma bolsa da Abbott. A MPL recebeu honorários de palestrante da Medtronic.
Agradecimentos
Esta investigação foi financiada pelo Instituto Europeu de Inovação e Tecnologia (EIT) ao abrigo do acordo de subvenção SAVE-COR n.º 220385 e da subvenção CIAICO/2022/020 financiada pela Generalitat Valenciana (EFICACIA). O apoio adicional veio da Generalitat Valenciana (concessão CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 e FSE Investir no Seu Futuro (concessão RYC2018-024346-I), Instituto de Salud Carlos III (concessão CIBERCV16 CB16/11/00354) e Catalunha, Espanha (concessão 2021_SGR_01350, SGR21/GENCAT). Também agradecemos o apoio do Programa CERCA / Generalitat de Catalunya. MPL financiado (2023-2025) por meio de um contrato de Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fundo Social Europeu (FSE)]. Os autores agradecem a Neus Portella e Sheila Marco pelo apoio de secretariado, e às equipes médica e de enfermagem pelo apoio clínico no Hospital Clínic de Barcelona, Hospital General Universitario Gregorio Marañón, Hospital Universitari i Politècnic La Fe. Eles também se estendem graças a Almudena Albertos da Corify Care SL, Madri, Espanha e Arantxa Carrasco da Universitat Politecnica de Valencia.
Materiais
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Referências
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados