Method Article
رسم خرائط القلب في الوقت الفعلي باستخدام نظام التصوير الكهربائي بدون صورة غير جراحي
In This Article
Summary
تقدم هذه الدراسة نهجا جديدا لرسم خرائط القلب في الوقت الفعلي باستخدام نظام تصوير كهربية القلب غير جراحي وبدون صور. يتيح هذا النظام الحصول على خرائط القلب الفيزيولوجية الكهربية دون الحاجة إلى التصوير المقطعي المحوسب قبل الإجراءات أو فحوصات التصوير بالرنين المغناطيسي ، مما يتيح توجيها فعالا لإجراءات القلب مثل الاستئصال وزراعة علاج إعادة التزامن القلبي.
Abstract
يعد رسم خرائط القلب السريع والآمن والفعال أمرا بالغ الأهمية لإدارة عدم انتظام ضربات القلب المعقدة ، ومع ذلك تواجه الأساليب الحالية قيودا كبيرة. على الرغم من أن مخطط كهربية القلب المكون من 12 رصاصا (ECG) ضروري للتشخيص الأولي ، إلا أنه يفتقر إلى الدقة المكانية والعمق اللازمين لتوجيه الإجراءات المتقدمة مثل استئصال القسطرة أو زرع جهاز العلاج بإعادة التزامن القلبي. من ناحية أخرى ، توفر تقنيات رسم الخرائط الغازية نشاطا كهربائيا مفصلا ولكنها تتطلب وضع قسطرة متعددة ، مما يزيد من المخاطر الإجرائية والتعقيد. تستغرق هذه الطرق وقتا طويلا ومكلفة وتقدم تقييما محدودا في الوقت الفعلي ، خاصة في عدم انتظام ضربات القلب الديناميكي مثل الرجفان الأذيني (AF) ، وعدم انتظام ضربات القلب غير المستقر ، وعلاج إعادة التزامن القلبي (CRT).
تقدم هذه الدراسة نظاما غير جراحي وبدون صورة للتصوير الكهربائي (Imageless-ECGI) مصمما لاستكمال الطرق التقليدية من خلال توفير خرائط قلبية في الوقت الفعلي من النبض إلى النبض. دون الحاجة إلى التصوير قبل الإجراءات، يلتقط هذا النظام نشاطا كهربائيا عالي الدقة عبر القلب بأكمله، مما يوفر بديلا أكثر أمانا وكفاءة لرسم الخرائط الغازية. من خلال الجمع بين فورية التسجيلات السطحية والدقة المكانية للنماذج الحسابية الحديثة ، يعمل نظام Imageless-ECGI على سد الفجوة بين تخطيط القلب التقليدي ورسم الخرائط الغازية ، مما قد يحول سير العمل في مختبرات الفيزيولوجيا الكهربية.
Introduction
أصبحت الحاجة إلى رسم الخرائط الفيزيولوجية الكهربية غير الغازية ذات أهمية متزايدة لتقييم نشاط القلب بدقة ، لا سيما في المرضى الذين يخضعون لإجراءات اضطراب النظم القلبي المعقدة ، مثل الرجفان الأذيني (AF) واستئصال تسرع القلب البطيني (VT) ، أو أثناء زرع أجهزة تنظيم ضربات القلب وأجهزة علاج إعادة التزامن القلبي (CRT). حاليا ، يظل رسم الخرائط التشريحية الكهربية ثلاثي الأبعاد (3D) (EAM) هو المعيار الذهبي لتوجيه المشغلين أثناء استئصال القسطرة1 من خلال توفير خرائط وظيفية شاملة لتوصيف عدم انتظام ضربات القلب2،3. ومع ذلك ، فإن EAM دون المستوى الأمثل لالتقاط الأنماط الزمانية المكانية الديناميكية للرجفان الأذيني ، وعدم انتظام ضربات القلب غير المستمر ، والوقت الطويل والإجراء الغازي المطلوب لرسم الخرائط يجعله غير عملي للاستخدام في إجراءات CRT.
الطرق التقليدية غير الغازية ، مثل مخطط كهربية القلب المكون من 12 رصاصا (ECG) ، على الرغم من دقتها العالية لتحديد بؤر عدم انتظام ضربات القلب المحددة (على سبيل المثال ، جهاز التدفق الخارجي أو نتوء VT) ، تقدم نظرة ثاقبة محدودة للسلوك الكهربائي العالمي للقلب. يتضح هذا القيد بشكل خاص عندما تكون هناك حاجة إلى رسم خرائط في الوقت الفعلي لتوجيه التدخلات في حالات عدم انتظام ضربات القلب الديناميكية والمعقدة ، حيث يكون التوطين الدقيق للمناطق غير المنتظمة أمرا بالغ الأهمية لتحقيق نتائج ناجحة. يمكن أن يلعب رسم الخرائط غير البازوية دورا مهما في تعزيز التخطيط قبل الإجراءات وتقديم التغذية الراجعة في الوقت الفعلي أثناء التدخلات الفيزيولوجية الكهربية.
لدعم علماء الفيزيولوجيا الكهربية قبل الإجرائية ، أثبتت التطورات في طرق تصوير القلب ، مثل التصوير المقطعي المحوسب (CT) والتصوير بالرنين المغناطيسي (MRI) ، فعاليتها في توفير معلومات هيكلية مفصلة ، بما في ذلك سمكالجدار 4 وتليف عضلة القلب5،6،7،8. ومع ذلك ، تركز هذه الطرائق على السمات التشريحية والهيكلية ، مما يترك فجوة في رسم الخرائط الكهربائية الوظيفية. بالإضافة إلى ذلك ، يتطلب الحصول على صور قلبية عالية الجودة بروتوكولات مسح متخصصة ، وموظفين مدربين ، وطرق معالجة لاحقة معقدة مثل التجزئة المتقدمة وتوصيف الأنسجة بدقة ، خاصة للكشف عن تليف القلب.
ظهرت أنظمة التصوير الكهربائي للقلب الكلاسيكية (ECGI) كخيار غير جراحي ، حيث تقدم نتائج واعدة من خلال إعادة بناء النشاط الكهربائي للقلب بناء على إمكانات سطح الجسم (BSP) 9،10،11،12. على الرغم من إمكاناتها ، تواجه أنظمة ECGI قيودا ملحوظة13،14. أولا ، يحتاجون إلى فحوصات التصوير المقطعي المحوسب قبل الإجراءات لتعيين مواضع القطب الكهربائي على هندسة القلب ، مما يجعل استخدامهم الروتيني السريري أقل جدوى. ثانيا ، غالبا ما تقدم طرق التنظيم التقليدية المستخدمة في حل المشكلة العكسية لرسم الخرائط القلبية أنماط انتشار غير فسيولوجية ، مما يحد من دقتها في الإعدادات السريرية.
كان الهدف من هذه الدراسة هو وصف ميزات وإجراءات نظام ECGI جديد غير جراحي قادر على رسم الخرائط في الوقت الفعلي دون الحاجة إلى التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي15 ، والمعروف باسم تخطيط القلب بدون صورة. استكشفنا التطورات في تخطيط القلب بدون صورة وقدمنا تطبيقات سريرية محتملة لرسم الخرائط الفيزيولوجية الكهربية ، والتغلب على قيود التقنيات الحالية مثل EAM ، وتخطيط القلب المكون من 12 رصاصا ، وتخطيط القلب الكلاسيكي في إدارة إجراءات عدم انتظام ضربات القلب المعقدة. يتيح هذا النهج إنشاء خرائط القلب في غضون دقائق من وصول المريض ، مما يبسط سير العمل ويقلل من وقت التحضير. بالإضافة إلى ذلك ، يستخدم النظام خوارزميات معالجة الإشارات المتقدمة لإنشاء أنماط انتشار فسيولوجية دقيقة ، وتحسين توطين عدم انتظام ضربات القلب والنتائج الإجرائية.
Protocol
تم التحقق من صحة المنهجية بشكل مستقبلي في دراسة سريرية رصدية متعددة المراكز. أجريت الدراسة وفقا لإعلان هلسنكي والمعايير الأخلاقية للمؤسسات المعنية. تمت الموافقة على بروتوكول الدراسة ، SAVE-COR (NCT05772182) ، من قبل اللجان الأخلاقية في مستشفى جامعة غريغوريو مارانيون ، ومستشفى عيادة برشلونة ، ومستشفى Universitari i Politècnic La Fe ، وتم الحصول على موافقة مستنيرة من جميع المرضى.
ملاحظة: الوصف التفصيلي لمعايير الإدراج والاستبعاد هي:
معايير الاشتمال: (i) إشارة لدراسة تشريحية كهربائية غازية و / أو زرع أجهزة تنظيم ضربات داخل التجويف. (2) الحصول على الموافقة المستنيرة والتوقيع عليها لإدراجها في الدراسة.
معايير الاستبعاد: (1) <18 سنة. (2) عدم القدرة على الخضوع لقسطرة الشغاف (مثل النساء الحوامل أو المرضعات). (3) عدم القدرة الجسدية أو العقلية على فهم وقبول الموافقة المستنيرة. (رابعا) عدم القدرة على الوقوف في وضع مستقيم لتمكين إعادة بناء الجذع ثلاثي الأبعاد المطلوب لنظام ECGI. (ت) المرضى الذين يعانون من أمراض خلقية.
1. إعداد نظام ECGI بدون صورة في الوقت الحقيقي قبل الإجرائية
- تحقق من أن مضخم الجهد الحيوي (الشكل 1 أ) مشحون بالكامل وضعه في نهاية طاولة غرفة الفيزيولوجيا الكهربية (EP) ، بالقرب من مكان وضع أقدام المريض.
ملاحظة: مضخم الجهد الحيوي (انظر جدول المواد) هو جهاز معزول من 128 قناة مسؤول عن تضخيم ورقمنة الإشارات الكهربائية التي تم جمعها بواسطة الأقطاب الكهربائية. - تحقق من عدم تلف الكبلات اليمنى واليسرى عن طريق فحص موصلات مكبر الصوت في أحد طرفيها والمقابس السوداء ، حيث يتم توصيل سترة المستشعر ، في الطرف الآخر (الشكل 1 ب).
ملاحظة: يبلغ طول الكبلات اليمنى واليسرى (انظر جدول المواد) 1.5 متر وتنقل الإشارات الكهربائية من سترة المستشعر إلى مضخم الجهد الحيوي. - قم بتوصيل كبلات الموصل اليمنى واليسرى بمكبر الصوت الحيوي (الشكل 1C). يرتبط كل كابل بقابس يتميز برقم ، وهو نفسه لكل من الكابل ومكبر الصوت.
- تحقق من أن منصة الماسح الضوئي ثلاثية الأبعاد مشحونة بالكامل وافتح تطبيق المسح الضوئي ثلاثي الأبعاد.
ملاحظة: تطبيق المسح ثلاثي الأبعاد هو برنامج يعمل على منصة ماسح ضوئي ثلاثي الأبعاد (انظر جدول المواد) يستخدم كاميرا ضوء هيكلية بالأشعة تحت الحمراء لإنشاء إعادة بناء نموذج ثلاثي الأبعاد لجذع المريض. يكتشف التطبيق أيضا تلقائيا موقع رموز الاستجابة السريعة للقطب الكهربائي (QR). - تحقق من أن محطة عمل الكمبيوتر (انظر جدول المواد) تحتوي على واجهة مستخدم برنامج ECGI بدون صورة مثبتة ومشحونة بالكامل.
ملاحظة: يشتمل برنامج تخطيط القلب بدون صورة (انظر جدول المواد) على خوارزميات معالجة الإشارات لتقدير هندسة القلب وتقديم معلومات قيمة لتشخيص وعلاج عدم انتظام ضربات القلب أو توجيه إجراءات زرع جهاز القلب16،17،18،19. تسمح واجهة مستخدم النظام للمستخدمين بتصور إشارات تخطيط كهربية القلب وتحديدها وتحليلها ، مما يؤدي إلى إنشاء خرائط تفاعلية لنشاط النخابي التي تتيح التقييم غير الجراحي لوظائف القلب. - قم بتوصيل مضخم الجهد الحيوي بمحطة العمل باستخدام كابل إيثرنت معزول (انظر جدول المواد). أدخل أحد طرفيه في منفذ Ethernet الخاص بمكبر الصوت والآخر في محطة العمل.
ملاحظة: ينقل كابل Ethernet المعزول الإشارات الكهربائية من مضخم الجهد الحيوي إلى محطة العمل. - حدد سترة مستشعر (انظر جدول المواد) ، وافحص العبوة ، وتحقق من أن الختم غير تالف. لا تستخدم سترة المستشعر في حالة فتح العبوة أو تلفها.
- افتح عبوة سترة المستشعر وتحقق من وجود مكونات السترة الأربعة بالداخل. اختر عبوة سترة مستشعر أخرى إذا كان أحد المكونات مفقودا.
ملاحظة: سترة المستشعر عبارة عن مجموعة أقطاب كهربائية عالية الكثافة تحتوي على 128 قطبا فضيا تتيح رسم خرائط متزامنة للنشاط الكهربائي السطحي عبر جذع المريض بالكامل. السترة مشعة وتحتوي على أربع بقع تغطي الأسطح الأمامية والخلفية اليسرى واليمنى للجذع. يتميز كل قطب كهربائي برمز الاستجابة السريعة في المقدمة ، مما يسمح بتحديد موضع القطب الكهربائي تلقائيا.
2. إعداد المريض قبل الإجراء
- إدخال المريض إلى المستشفى في نفس يوم الدراسة الفيزيولوجية الكهربية أو زرع الجهاز.
- ضع المريض إما واقفا أو جالسا على كرسي أو طاولة EP وتأكد من خلو منطقة الجذع بأكملها من الملابس.
- قم بإجراء فحص بصري لجلد المريض للتحقق مما إذا كان المريض يعاني من شواطئ أو جروح أو أي حالة جلدية أخرى لتجنب ربط الأقطاب الكهربائية بهذه المناطق.
- اختياريا ، قم بالعناية بالجذع للأفراد ذوي الشعر الكبير لتقليل الضوضاء وتقليل الانزعاج أثناء إزالة سترة المستشعر.
- ضع الأجزاء الأربعة من سترة المستشعر بشكل صحيح (الأمامي الأيمن ، الأمامي الأيسر ، الخلفي الأيمن ، والخلف الأيسر) على جذع المريض (الشكل 2 أ) واضبط السترة حسب حجم المريض عن طريق طي التوصيلات بين الأقطاب الكهربائية عند الضرورة.
- اختياريا، بالنسبة لإجراءات CRT، تجنب وضع أقطاب كهربائية في المنطقة التي سيتم إدخال غرسة القلب فيها، وغالبا ما تكون موجودة في الجزء العلوي الأيسر من الصدر.
ملاحظة: يمكن قطع التوصيلات ذات الشرطات المطبوعة بأمان إذا لزم الأمر، حيث لا توجد مسارات نشطة في تلك المناطق. - ضع الأقطاب الكهربائية ذات الساق اليمنى (RLD) والمرجعية (REF) لسترة المستشعر على الساقين اليمنى واليسرى ، على التوالي ، بعيدا عن أقطاب السترة الأخرى قدر الإمكان.
- تأكد من إضاءة الغرفة الكافية وتأكد من عدم وجود أشياء بقطر 1.5 متر حول جذع المريض ، لأنها قد تتداخل مع إعادة بناء الجذع ثلاثي الأبعاد أو تشوهها.
- ضع المريض مع ذراعيه فوق الرأس لمنع التداخل مع إعادة بناء الجذع ثلاثي الأبعاد ، كما هو موضح في الشكل 2 ج.
- الحصول على إعادة بناء الجذع 3D للمريض.
- احصل على منصة الماسح الضوئي ثلاثية الأبعاد وافتح تطبيق المسح الضوئي ثلاثي الأبعاد.
- امسح رمز الاستجابة السريعة ضوئيا على الجانب الجانبي لمكون السترة الأمامية اليمنى للتحقق من صحة سترة المستشعر (الشكل 2 ب) ، والتأكد من أنها تستخدم مرة واحدة وليست منتهية الصلاحية.
ملاحظة: بمجرد اكتشاف رمز الاستجابة السريعة ، يتيح تطبيق المسح الضوئي ثلاثي الأبعاد الحصول على إعادة بناء الجذع ثلاثي الأبعاد. - ضع منصة الماسح الضوئي ثلاثية الأبعاد على مستوى الجذع أمام المريض ، وامسكها بقوة بكلتا يديك ، وأكمل الدوران بزاوية 360 درجة حول المريض للحصول على إعادة بناء الجذع ثلاثي الأبعاد (الشكل 2C).
ملاحظة: مع تقدم المسح ، تقوم الكاميرا ذات الضوء الهيكلي بالأشعة تحت الحمراء من منصة الماسح الضوئي ثلاثية الأبعاد بإنشاء شبكة مغلقة ثلاثية الأبعاد باللون الرمادي للجذع ، مما يكمل العملية عند الدوران الكامل. عادة ما تتطلب عملية إعادة بناء الجذع ثلاثية الأبعاد 1-2 دقيقة لإكمالها. - قم بإجراء فحص بصري لإعادة بناء الجذع ثلاثي الأبعاد للتأكد من أن الجذع بأكمله مغطى بظل رمادي وعدم وجود ثقوب في الشبكة المعاد بناؤها.
- احفظ إعادة بناء الجذع ثلاثي الأبعاد في التطبيق بمجرد الانتهاء من الفحص.
- اجعل المريض يستلقي على طاولة غرفة EP.
- قم بتوصيل الأجزاء الأربعة من سترة المستشعر بكبلات الموصل اليمنى واليسرى المقابلة (الشكل 1D). قم بتوصيل موصلات السترة الأمامية اليمنى والخلفية اليمنى بمقبس الكابل الأيمن وموصلات السترة الأمامية واليسرى والخلفية واليسرى بمقبس الكابل الأيسر.
- قم بتشغيل مضخم الجهد الحيوي لتمكين برنامج ECGI بدون صورة من تلقي إشارات الفيزيولوجيا الكهربية في الوقت الفعلي.
3. تقدير هندسة القلب للمريض
- قم بتسجيل الدخول كمستخدم إلى برنامج ECGI بدون صورة في الوقت الفعلي المثبت في محطة العمل (الشكل 3). أدخل اسم مستخدم وكلمة مرور.
- انقر فوق الزر "إضافة مريض " وأدخل تفاصيل التعريف لتسجيل مريض جديد في النافذة الرئيسية لواجهة المستخدم (الشكل 4). بعد ذلك ، قم بإنشاء جلسة جديدة مرتبطة بالمريض ، مع توفير نوع الإجراء والبيانات الأساسية التالية: الجنس والعمر والطول والوزن.
ملاحظة: يمكن لمريض واحد أن يتلقى جلسات متعددة. على سبيل المثال ، في الدراسات السريرية مع المتابعة ، إذا خضع المريض لتسجيل ثان لتخطيط القلب ، فيمكن إنشاء جلسة جديدة دون إضافة المريض مرة أخرى. - قم بتوصيل منصة الماسح الضوئي ثلاثية الأبعاد بمحطة العمل باستخدام كابل USB-C.
- انقر على تحميل مسح الجذع زر وقم بتحميل إعادة بناء الجذع ثلاثي الأبعاد في نافذة هندسة الجذع (الشكل 5).
ملاحظة: سيكتشف البرنامج تلقائيا توطين 128 قطبا كهربائيا من سترة المستشعر. يحتوي كل مكون من مكونات السترة على ألوان قطب كهربائي مختلفة: الأمامي الأيمن = الأحمر ، الجبهة اليسرى = الأزرق ، الخلف الأيمن = الوردي ، والخلف الأيسر = البرتقالي. - اختياريا، اضبط مواضع القطب يدويا عن طريق النقر فوق كل قطب كهربائي وإعادة وضعه على سطح الجذع.
- حدد زر حساب هندسة وخيار تقدير هندسة القلب لتقدير هندسة قلب المريض في نافذة هندسة الجذع (الشكل 5).
ملاحظة: يقدر البرنامج هندسة القلب باستخدام منهجية تستند إلى نموذج الشكل الإحصائي (SSM) (الشكل 6 أ) ، كما هو مفصل في الأدبيات السابقة20. تعالج الخوارزمية أولا إعادة بناء جذع المريض ثلاثي الأبعاد والبيانات القاعدية (الجنس والعمر والطول والوزن) كمدخلات. بعد ذلك ، يتم ضبط SSM ، الذي يتضمن الجذع القائم على التصوير بالرنين المغناطيسي وهندسة القلب ، بشكل متكرر لتناسب شبكة الجذع ثلاثية الأبعاد للمريض. يحدد هذا الهندسة المثلى للقلب ووضعه واتجاهه داخل جسم المريض (الشكل 6 ب). تلغي هذه العملية الحاجة إلى التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي قبل الإجراءة ، مما يتيح إنشاء أول خريطة قلبية غير جراحية في غضون 10-15 دقيقة. من المهم ملاحظة أن الرسالة المنبثقة تعلم المستخدم إذا كانت إعادة بناء الجذع ثلاثي الأبعاد تفتقر إلى الدقة الكافية أو تحتوي على أي عناصر يمكن أن تؤثر على دقة نتائج التقدير.
4. رسم خرائط ECGI غير الغازية بدون صورة لتوجيه غرسة تنظيم نظام التوصيل لعلاج إعادة التزامن القلبي (CSP-CRT) في الوقت الفعلي (الحالة 4)
- انتقل إلى نافذة مكبر الصوت وانقر فوق الزر Connect Amplifier لبدء الحصول على إشارات الفيزيولوجيا الكهربية في الوقت الفعلي (الشكل 7). انقر فوق الخيوط المختلفة لتصور الإشارات في شاشة مكبر الصوت.
- انتقل إلى نافذة الوقت الفعلي (الشكل 8) للحصول على رسم خرائط قلبية غير جراحية في الوقت الفعلي.
ملاحظة: تتيح نافذة الوقت الفعلي تصور إشارات الوقت الفعلي، وتستبعد الإشارات الصاخبة، وتنشئ صانعين زميين، وتحدد مقاطع التحليل تلقائيا (على سبيل المثال، موجة P ومركب QRS)، وتحسب وتعرض خرائط تخطيط القلب (ECGI غير الغازية). - استبعاد الإشارات الصاخبة بالنقر فوق زر عرض 128 عميلا متوقعا ، وتحديد خيار المستخدم فقط كوضع تحديد العملاء المحتملين الصاخبين، والنقر المزدوج على الإشارات الصاخبة لاستبعادها قبل إنشاء خريطة ECGI. هذا يحسن جودة حساب رسم الخرائط ، حيث أن ECGI هي مشكلة سيئة21.
ملاحظة: تشير خيوط سترة المستشعر المعروضة باللون الأخضر إلى إشارات ذات جودة جيدة وتستخدم لحساب المشكلة العكسية، في حين أن الخيوط الموضحة باللون الأحمر صاخبة ويتم استبعادها من التحليل (الشكل 8 أ). - انقر فوق زر العرض المكون من 12 عميلا متوقعا لتصور مخطط كهربية القلب المكون من 12 رصاصا في الوقت الفعلي (الشكل 8 ب).
- تأكد من أن زر RT ON نشط لتحديث الإشارات تلقائيا في قسم تحليل الإشارة (الشكل 8C). يقوم هذا الخيار تلقائيا بتشغيل وتحديد بداية وإزاحة مجمع QRS المراد تحليله.
ملاحظة: يمكن تبديل زر RT إلى وضع RT OFF لتجميد الإشارات، مما يسمح للمستخدم بتحديد مجمع QRS يدويا عندما يكون التحديد التلقائي للنظام دون المستوى الأمثل. - قم بتكوين تحليل تعيين تنشيط ECGI بالنقر فوق الزر خيارات لإنشاء خريطة إيقاع قاعدية مثالية تلقائيا لإجراء CSP-CRT:
- حدد خيار تحليل البطين لتعيين البطينين فقط.
- حدد خيار التحليل 17 المستند إلى المويجة لخوارزمية أوقات التنشيط.
- حدد خيار متوسط الإيقاع لميزة نوع التعيين لحساب متوسط الموجة لآخر 10 مجمعات QRS.
- اترك الإعدادات الافتراضية لميزات تصحيح الإزاحة ورقم الإيقاع وخيار المزامنة .
- حدد خيار لوحتين في قسم تصور الخرائط وتأكد من ضبط الخريطة اليسرى على وضع التحديث ، بحيث يتم تحديثها باستمرار مع كل مجمع QRS متوسط حديث يتم تحليله.
- تصور خريطة التنشيط القاعدي ثنائي البطين على الجانب الأيسر (الشكل 8D اللوحة اليسرى). يقوم النظام تلقائيا بحساب مصفوفة النقل بين الجذع وشبكات القلب لإعادة بناء النشاط الكهربائي النخابي للقلب بناء على طريقة العنصرالحدودي 22،23،24.
ملاحظة: تصور خريطة التنشيط التقدم الزمني لإزالة الاستقطاب عبر النخابة القلبية ، مما يساعد في تحديد أصول التنشيط وتحديد الأنماط المتكررة أو البؤرية. يتم حساب عمليات التنشيط عن طريق (1) تحويل كل مخطط كهربائي معاد بناؤه إلى مجموع المويجات الجيبية لجميع عينات وقت المنحدر السالب والسعة المتناسب مع المنحدر في ذلك الوقت و (2) اختيار لحظة الحد الأقصى للسعة للإشارة المحولة كلحظة وقتالتنشيط 17. - اكتب الاسم واحفظ الخريطة القاعدية بالنقر فوق حفظ الخريطة زر وقم بتبديل الخريطة إلى وضع التجميد بمجرد أن تصبح قابلة للتكرار. تحتوي خريطة ECGI القابلة للتكرار على مدة تنشيط وأنماط انتشار متسقة عبر ثلاث خرائط متتالية على الأقل.
ملاحظة: في إجراءات CSP-CRT ، ستكون الخريطة القاعدية (الشكل 12 أ) بمثابة مرجع لتقييم التزامن ثنائي البطين أثناء عملية شد القطب الكهربائي في منطقة الحاجز حتى الوصول إلى منطقة فرع الحزمة اليسرى (الشكل 12 ج). - قم بتكوين تحليل تعيين تنشيط ECGI بالنقر فوق الزر خيارات للحصول على الخرائط المثلى أثناء عملية الشد والسرعة في منطقة الحاجز:
- حدد تحليل البطين لتعيين البطينين فقط.
- حدد خيار التحليل المستند إلى المويجة لخوارزمية أوقات التنشيط.
- حدد خيار الإيقاع الفردي لنوع الرسم لتحليل موجة نبضة واحدة لالتقاط التغييرات في إشارات تخطيط كهربية القلب أثناء عملية الشد والسرعة المتزامنة في مواضع الحاجز المختلفة.
- اترك الإعدادات الافتراضية لميزات تصحيح الإزاحة ورقم الإيقاع وخيار المزامنة .
- اضبط خريطة اللوحة اليمنى على وضع التحديث لضمان تحديثها باستمرار مع كل مجمع QRS أحادي الضرب تم تحليله حديثا أثناء عملية الشد.
- قم بمزامنة نطاق خريطة الألوان لخريطة اللوحة اليمنى مع الخريطة القاعدية باستخدام قائمة القيم المرتبطة واربط مواضع الكاميرا الخاصة بهم عبر قائمة الكاميرا المرتبطة (الشكل 8D اللوحة اليمنى).
ملاحظة: نظرا لأن الرصاص مشدود في منطقة الحاجز ، يتم إنشاء خرائط ECGI من النبض إلى الbeat تلقائيا في مواضع مختلفة (على سبيل المثال ، الحاجز البطيني الأيمن ، ومنتصف الحاجز ، والحاجز العميق ، وفرع الحزمة اليسرى). تتم مقارنة هذه الخرائط بالخريطة القاعدية من خلال توحيد نطاق خريطة الألوان عبر جميع خرائط ECGI التي تم تقييمها (الشكل 12 ب ، ج). يسمح هذا الإعداد بتصور واضح للتغييرات في أنماط التنشيط أثناء تثبيت الرصاص. - اكتب الاسم واحفظ كل خريطة بالنقر فوق حفظ الخريطة زر كلما لوحظ تغيير في نمط التنشيط أثناء عملية الشد في منطقة الحاجز ، واستمر حتى يتم الوصول إلى منطقة فرع الحزمة اليسرى.
5. تحليل رسم خرائط ECGI إضافي غير جراحي بدون صورة
ملاحظة: يمكن اشتقاق خرائط قلبية مختلفة من إشارات ECGI المحسوبة لتقييم ركيزة القلب ، أو توصيف عدم انتظام ضربات القلب ، أو تقييم CRT ، أو استخراج المقاييس ذات الصلة سريريا أثناء الإجراءات. يعتمد نوع الخرائط التي يمكن إنشاؤها على إيقاع القلب المحدد الذي يتم تحليله ، مع مناهج مميزة لكل من الإيقاعات المنتظمة وغير المنتظمة.
- استخدم قسم تحليل الإشارة في نافذة الوقت الفعلي لتحليل الإيقاعات المختلفة التي قد يظهرها المرضى أثناء إجراء الفيزيولوجيا الكهربية:
- تحليل الإيقاعات المنتظمة ، وتعيين تحليل النبض الفردي أو متوسط النبض كميزة نوع رسم الخرائط ، عندما يكون المريض في إيقاع مستقر / منتظم ، مثل إيقاع الجيوب الأنفية ، أو الإيقاع الأذيني أو البطيني ، أو الرفرفة الأذينية ، أو عدم انتظام دقات القلب البطيني. احسب خريطة التنشيط وخريطة سرعة التوصيل (CV) من تحليل الإيقاع المنتظم.
- تحليل عدم انتظام الإيقاع ، باستخدام تحليل نبضات الإيقاع غير المنتظم كميزة نوع رسم الخرائط عندما يكون المريض في حالة رجفان أذيني. يتيح النظام اختيار مقاطع التركيز البؤري التلقائي الممتدة (على سبيل المثال ، دقيقة واحدة) لقمع مجمعات QRST والتقاط الأنماط الزمانية المكانية الديناميكية للتركيز البؤري التلقائي. خريطة مرحلة الحساب وخريطة الرسم البياني الدوار وخريطة التردد السائد من تحليل الإيقاع غير المنتظم.
- اختياريا، اضغط على القائمة المنسدلة لاختيار الخريطة واختر خريطة التنشيط إذا تم تحليل إيقاع منتظم. راجع الخطوة 4.8 للحصول على وصف تفصيلي لخريطة التنشيط .
- اختياريا، اضغط على القائمة المنسدلة لاختيار الخريطة واختر خريطة سرعة التوصيل إذا تم تحليل إيقاع منتظم.
ملاحظة: سرعة التوصيل هي مقياس مشتق من خريطة التنشيط. يمثل هذا المقياس الوقت الذي تستغرقه واجهة الموجة للانتقال عبر كل منطقة من النخاب. يعتمد حساب السيرة الذاتية على التدرجات المكانية لخرائط وقت التنشيط عبر أسطح القلب ، مع تطبيق حقول متجهة السرعة لتحديد مناطق الانتشار الفعال. تشير المناطق ذات المتجهات الاتجاهية المنتظمة إلى انتشار كهربائي مستقر ، بينما يتم استيفاء المناطق ذات التفاوتات الزاوية ، مما يشير إلى الانتشار غير الفعال ، باستخدام دالة الأساس الشعاعي25. تسمح السيرة الذاتية بتحديد مناطق تباطؤ التوصيل أثناء رسم خرائط الركيزة التي ترتبط بمعدلات تكرار عدم انتظام ضرباتالقلب 17. - اختياريا، اضغط على القائمة المنسدلة لاختيار الخريطة واختر خريطة المرحلة عند تحليل إيقاع غير منتظم.
ملاحظة: تتعقب خريطة المرحلة تقدم منطقة محددة من عضلة القلب من خلال إمكانات الفعل بمرور الوقت. هذا النوع من الخرائط ديناميكي لأنه يمثل تطور إمكانات القلب. في خريطة الطور ، يتم تطبيق تحويل هيلبرت لحساب مرحلة إشارة ECGI. تتوافق كل مرحلة مع حالة معينة من جهد الفعل خلال كل دورة من الإشارة (π للراحة ، و π/2 لإزالة الاستقطاب ، و 0 للهضبة ، و -π لإعادة الاستقطاب)26. - اختياريا، اضغط على القائمة المنسدلة لاختيار الخريطة واختر خريطة الرسم البياني الدوار عند تحليل إيقاع غير منتظم.
ملاحظة: خريطة الرسم البياني الدوار ، المشتقة من خريطة الطور ، هي تمثيل للمواقع الأكثر شيوعا لتفردات الطور ، وهي مناطق ذات نشاط عائد مركز ويتم عرضها باللون الأحمر. باختصار ، يتم تعريف تفردات الطور على أنها نقاط رئيسية حيث تنتقل المرحلة من -π إلى π. يتم تجاهل PSs التي لا تظهر تقدما مكانيا تدريجيا للمراحل في محيطها. أخيرا ، يتم تحديد عدد المنعطفات لكل دوار للحصول على خريطة الرسم البياني للدوار 18. تم تقييم دقة الخوارزمية في تحديد أنماط الانتشار أثناء الرجفان البؤري التلقائي والمناطق المحددة التي تظهر عمليات إعادة الدخول بشكل منهجي مقابل رسم خرائط الشغاف ، مما يدل على ارتباط بنسبة 71٪ 16. - اختياريا، اضغط على القائمة المنسدلة لاختيار الخريطة وحدد خريطة التردد السائد (DF) عند تحليل إيقاع غير منتظم.
ملاحظة: تعرض خرائط تحديد الاتجاه التردد الكهربائي السائد في كل منطقة قلبية بمرور الوقت ، مما يساعد على تحديد مناطق النشاط الكهربائي السريع التي قد تكون بمثابة محركات للرجفان الأذيني. يتم حساب DF على أنه التردد ذو الكثافة الطيفية الأعلى للقدرة في مخطط اللثة27،28 لويلش. يسمح تحليله بالكشف عن المناطق ذات الاستقرار العالي أو التباين في النشاط الليفي داخل الأذينين. يستخدم الرسم البياني لتقييم التوزيع الزمني للترددات السائدة ، مما يوفر تمثيلا واضحا وكميا للنشاط الكهربائي الأكثر صلة وتسهيل تحديد المناطق ذات السلوك غير الطبيعي.
النتائج
الحالة 1 - تخطيط وتوجيه الاستئصال بالقسطرة للرفرفة الأذينية غير النمطية
هذه الحالة هي رجل يبلغ من العمر 59 عاما (مؤشر كتلة الجسم -BMI-30) لديه تاريخ من ارتفاع ضغط الدم والتدخين ومرض صمام القلب وتصنيف EHRA IIb ودرجة CHA2DS 2-VASc 1 مع مؤشر على الاستئصال بالقسطرة بسبب الرفرفة الأذينية غير النمطية (AFL) بناء على مخطط كهربية القلب المكون من 12 رصاصا (الشكل 9 أ). لم يكن لدى المريض تاريخ سابق من الاستئصال بالقسطرة. كشف التصوير بالرنين المغناطيسي المتأخر قبل الإجراء عن تليف واسع النطاق في الجدار الخلفي للأذين الأيسر (LA) ، مع قياس مخطط LA طبيعي يبلغ 24 سم مربع والحفاظ على كسر قذف البطين الأيسر (LVEF) بنسبة 54٪.
تم إجراء تخطيط كهربية القلب غير الجراحي بدون صورة قبل دقائق فقط من إدخال القسطرة عبر غمد الفخذ. تم اختيار دورة كاملة من AFL (209 مللي ثانية) ، خالية من مجمعات QRST ، للتحليل. كشفت الخرائط عن دائرة داخلة كبيرة حول الصمام التاجي (MV) ، وحددت الخط المحيط باعتباره الهدف الأمثل للاستئصال لإنهاء عدم انتظام ضربات القلب (الشكل 9 ب). بعد ذلك ، تم إجراء EAM القائم على التلامس (الشكل 9C) ، والذي أكد نمط الانتشار الذي لوحظ في مخطط كهربية القلب غير الجراحي بدون صورة. نجح الاستئصال على طول الخط المحيط بعدم انتظام ضربات القلب
في هذه الحالة السريرية ، تم تمييز عدم انتظام ضربات القلب بدقة قبل EAM الغازي ، مما يتيح توطين دقيق لنمط انتشار عدم انتظام ضربات القلب وتبسيط إجراء الاستئصال. ومع ذلك ، بالنسبة لتسرع القلب الأذيني المعقد ، مثل AFL أو تسرع القلب البؤري ، يوفر تخطيط القلب بدون صورة رسم خرائط في الوقت الفعلي ، مما يجعله ذا قيمة خاصة في حالات عدم انتظام ضربات القلب غير المستمر. تضمن قدرته على التكيف مع التغيرات في أنماط عدم انتظام ضربات القلب أثناء الإجراء رسم خرائط دقيقة وديناميكية. علاوة على ذلك ، في حين أن تشخيص AFL عكس اتجاه عقارب الساعة عادة ما يكون مباشرا من مخطط كهربية القلب المكون من 12 رصاصا ، فإن تحديد وتحديد آلية عدم انتظام ضربات القلب المعقدة بدقة يمكن أن يكون أمرا صعبا. وبالتالي ، فإن إجراء تخطيط كهربية القلب بدون صورة في الاستشارة الطبية أو قبل دقائق يمكن أن يعزز السلامة والكفاءة الإجرائية من خلال توفير إرشادات أولية لتخطيط استئصال القسطرة والقضاء على مناهج الحاجز غير الضرورية.
الحالة 2 - تطور تفردات الطور أثناء الاستئصال بالقسطرة للرجفان الأذيني المستمر
هذه الحالة هي مريض ذكر يبلغ من العمر 63 عاما (مؤشر كتلة الجسم 31) مع كسر قذف البطين الأيسر المحفوظ (LVEF ، 55٪) ، ولم يشار إلى LAS الموسع ، وتم تحديد جمعية القلب في نيويورك (NYHA) للاستئصال بالقسطرة بسبب الرجفان الأذيني المستمر. لم يتم إجراء تصوير التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي قبل الإجراءات. كان لدى المريض تاريخ سابق من الاستئصال بالقسطرة لعزل الوريد الرئوي (PVI) في ديسمبر 2019.
عند الوصول ، كان المريض في حالة الرجفان الأذيني. تم إجراء رسم خرائط الركيزة باستخدام ECGI بدون صورة طوال إجراء الاستئصال (الشكل 10 أ). في خط الأساس ، حددت ECGI تفردات الطور في الجدار الجانبي الأذيني الأيمن (RA) ، وقاعدة الزائدة الأذينية اليمنى (RAA) ، والجدار الخلفي للأذين الأيسر (PW) ، والزائدة الأذينية اليسرى (LAA) القاعدة. ارتبطت هذه النتائج ب EGMs عالية التردد والمجزأة التي لوحظت باستخدام القسطرة داخل التجويف ، وتم تأكيد PVI الكافي عن طريق إعادة بناء LA EAM. بدأ استئصال المجال النبضي (PFA) في قاعدة LAA ، مما أدى إلى تغيير الإيقاع من AF إلى AFL غير نمطي. كشفت ECGI بدون صورة عن AFL محيطي ، والذي تم تأكيده عن طريق التثبيت من القطب البعيد لقسطرة الجيوب التاجية. تم إنشاء خط تاجي. ومع ذلك ، تم إعادة حث الرجفان الأذيني. بعد ذلك ، تم تحقيق عزل PW الكامل. على الرغم من ذلك ، استمرت ECGI عديمة الصورة في تحديد تفردات الطور المهمة في قاعدة RAA. بعد تطبيقات PFA المتعددة التي تستهدف هذه المنطقة ، تم تحقيق إيقاع الجيوب الأنفية (الشكل 10 ب).
هذه الحالة السريرية هي تمثيل لكيفية تقديم الرجفان الأذيني لتحديات فريدة بسبب التباين الكبير في النشاط الكهربائي في الأذينين. التقطت مخطط كهربية القلب بدون صورة بشكل فعال أنماطا مكانية وزمانية لتقدم الرجفان البؤري التلقائي أثناء الاستئصال ، مع الحصول على ما يصل إلى ثلاث خرائط غير جراحية لتوجيه تعديل الركيزة حتى يتم تحقيق SR. العلاجات القياسية ، مثل عزل الوريد الرئوي ، لها معدلات تكرار عالية نسبيا29. تكمن الصعوبات الرئيسية في علاج الرجفان الأذيني في مجالين: (1) تحديد المرضى الذين سيستفيدون من PVI وحده ، و (2) لأولئك الذين يحتاجون إلى نهج أوسع ، وتحديد المناطق خارج منطقة PVI التي سيقلل استئصالها بشكل أكثر فعالية من تكرار عدم انتظام ضربات القلب. أثناء إيقاع الجيوب الأنفية ، أظهر Imageless ECGI القدرة على إنشاء خرائط السيرة الذاتية ، والتي أثبتت فائدتها في التنبؤ بنجاح استئصال PVI17. ومع ذلك ، في هذه الحالة ، التقطت ECGI بدون صورة أنماط ديناميكيات الرجفان الأذيني بشكل متزامن ، مما يوفر للأطباء رؤية شاملة لكيفية انتشار الرجفان الأذيني والمساعدة في تحديد المناطق الرئيسية التي تؤدي إلى عدم انتظام ضربات القلب. يجب أن يركز تحليل النتائج على العلاقة بين محركات الرجفان الأذيني المكتشفة بتخطيط القلب بدون صورة ونقاط النهاية السريرية ، مثل البقاء على قيد الحياة على المدى الطويل الخالي من عدم انتظام ضربات القلب ، لمزيد من التحقق من فائدته في تحسين استراتيجيات استئصال الرجفان الأذيني.
الحالة 3 - توجيه تحسين سرعة البطينين لعلاج إعادة التزامن القلبي
هذه الحالة هي مريضة تبلغ من العمر 67 عاما مصابة باعتلال عضلة القلب التوسعي غير الإقفاري ، LVEF بنسبة 25٪ ، لا يوجد دليل على تعزيز الجادولينيوم المتأخر في التصوير بالرنين المغناطيسي قبل الإجرائي ، مع إحصار فرع الحزمة اليسرى (LBBB) في تخطيط القلب الأساسي ومدة QRS تبلغ 156 مللي ثانية. تمت الإشارة إلى المريض لتنظيم ضربات البطينين (BiVP) كجزء من CRT.
أثناء إجراء CRT القلبي ، تم استخدام ECGI بدون صورة في الوقت الفعلي لتقييم التزامن البطيني قبل وبعد زرع جهاز تنظيم ضربات القلب. عند الإيقاع الأساسي ، تم تحديد أحدث منطقة تنشيط للمريض في الجدار القاعدي الجانبي للبطين الأيسر (LV) ، كما هو موضح في الشكل 11 أ. تم قياس وقت التنشيط الكلي للبطين (TAT) عند 116 مللي ثانية ، مما يشير إلى عدم التزامن البطيني الكبير. تم تقييم تكوينات الأجهزة المختلفة باستخدام ECGI ، مع تحديد الإعداد الأمثل ليكون BiVP باستخدام التنشيط المتزامن للقطبين البعيد والقريب من الرصاص LV ، وتأخير أذيني بطيني قدره 140 مللي ثانية. كما هو موضح في الشكل 11 ب ، أدت نقاط السرعة البطينية الثلاث إلى عدم تنشيط المناطق المتأخرة ، مما يشير إلى التزامن الناجح ، مع تحسين TAT البالغ 70 مللي ثانية.
يهدف علاج إعادة التزامن القلبي إلى استعادة التنسيق الكهربائي في البطينين وتحسين وظائف القلب لدى المرضى الذين يعانون من قصور القلب وQRS لفترات طويلة. في هذه الحالة ، قدمت Imageless ECGI تعيينا في الوقت الفعلي كان أساسيا في توجيه تحسين BiVP أثناء إجراء CRT. لقد مكن من التقييم الدقيق لأنماط تنشيط البطين وساعد في تحديد التكوين الأمثل للجهاز ، مما يضمن التزامن البطيني الكامل. سمحت الطبيعة غير الغازية والتعليقات الفورية لتخطيط القلب للأطباء بتحسين برمجة الرصاص. في المقابل ، بينما تسلط الدراسات الضوء على قيمة ECGI في توجيه وضع الرصاص في البطين الأيسر بالقرب من أحدث منطقة نشطة30 ، فإن القيود التشريحية قد تحد من قابليتها للتطبيق. يجب أن ترتبط معلمات إعادة التزامن الأساسية والنهائية التي تحددها ECGI ، مثل TAT ، بالنتائج السريرية من خلال مراقبة استجابة المريض السريرية ل CRT بمرور الوقت ، بما في ذلك تحسين الأعراض ووظيفة البطين على المدى الطويل.
الحالة 4 - غرسة تنظيم نظام التوصيل التوجيهي لعلاج إعادة التزامن القلبي في الوقت الفعلي
هذه الحالة السريرية هي مريضة تبلغ من العمر 45 عاما تعاني من خلل وظيفي شديد في البطين (LVEF 15٪) و LBBB مع مدة QRS تبلغ 172 مللي ثانية. تمت الإشارة إلى المريض لمزيل الرجفان القلبي القابل للزرع CRT باستخدام نهج سرعة نظام التوصيل (CSP).
تم استخدام ECGI بدون صورة في الوقت الفعلي أثناء زرع الجهاز لمراقبة التزامن البطيني طوال عملية شد القطب الكهربائي في منطقة الحاجز. كما هو موضح في الشكل 12 ، حددت خريطة ECGI الأساسية الجدار الجانبي ل LV باعتباره أحدث منطقة نشطة ، مع TAT يبلغ 133 مللي ثانية. أظهر رسم خرائط ECGI من النبض إلى الضرب أثناء شد القطب الكهربائي تحسينات تدريجية في تزامن البطين ، مع تحقيق التزامن الأمثل عند الوصول إلى فرع الحزمة الأيسر ، مما أدى إلى TAT يبلغ 95 مللي ثانية.
أظهرت هذه الحالة إمكانات تخطيط القلب المجهول للعضلة بدون صورة في الوقت الفعلي لتوجيه زرع LBBP أثناء إجراء CRT. سمحت قدرات رسم الخرائط أحادية النبض في الوقت الفعلي بتحليل TAT البطيني وإعادة التزامن في كل خطوة من خطوات زرع الرصاص في منطقة الحاجز. قدم النظام مقياسا سريعا ومرئيا وسهل التفسير ، يعالج عدم وجود توحيد قياسي في معايير CSP لتخطيط كهربية القلب. وكذلك في إجراءات BiVP-CRT ، هناك حاجة إلى مزيد من الدراسات لتحديد ما إذا كانت معلمات ECGI بدون صورة ترتبط بشكل كبير باستجابة CRT السريرية وكيف تقارن بتوقعات تخطيط القلب المكونة من 12 رصاصا.
الحالة 5 - تخطيط وتوجيه الاستئصال بالقسطرة لتسرع القلب البطيني
هذه الحالة هي مريض ذكر يبلغ من العمر 53 عاما (مؤشر كتلة الجسم 25.4) مصاب باعتلال عضلة القلب الإقفاري ، وخلل وظيفي البطيني الحاد (LVEF 15٪) ، وتم إحالة NYHA من الفئة الثانية لإجراء استئصال القسطرة بسبب VT المتكرر. كشف التصوير بالرنين المغناطيسي قبل الإجرائي عن تليف شغاف واسع النطاق وقنوات عدم انتظام ضربات القلب موضعية في الأجزاء السفلية القاعدية والسفلية الإنسية للبطين الأيسر. كان لدى المريض تاريخ سابق من الاستئصال بالقسطرة VT في عام 2018.
تم إجراء رسم خرائط ECGI المتزامن بدون صورة (الشكل 13 أ) و EAM الغازي (الشكل 13 ب) طوال الإجراء. تضمنت عملية استئصال القسطرة رسم خرائط قائم على الركيزة أثناء الإيقاع القمي للبطين الأيمن (RV) وتحريض VT باستخدام التحفيز المبرمج. حددت مخطط كهربية القلب بدون صورة منطقة من تباطؤ التوصيل في الجزء القاعدي السفلي من LV أثناء رسم خرائط إيقاع الجيوب الأنفية قبل إدخال القسطرة. كانت هذه النتيجة متسقة مع التليف الذي لوحظ في التصوير بالرنين المغناطيسي. أكدت السرعة اللاحقة من قمة البطين الأيمن (RV) تباطؤ التوصيل في الأجزاء القاعدية والإنسية من LV ، وتحديد هذه المنطقة على أنها الركيزة غير المنتظمة المحتملة. تم إحداث VT بطول دورة 380 مللي ثانية لفترة وجيزة ، مما يتطلب تقويم نظم القلب بسبب عدم استقرار الدورة الدموية. وبالتالي ، تم الحصول على عدد محدود فقط من نقاط EAM. ومع ذلك ، باستخدام دورة VT واحدة ، نجحت ECGI بدون صورة في تحديد برزخ VT في نفس المنطقة حيث لوحظ الازدحام المتساوي في الخرائط ذات الخطى.
نجح استخدام ECGI بدون صورة في الوقت الفعلي في حالة VT هذه في معالجة تحديين سريريين رئيسيين في إدارة VT: (1) التوطين الدقيق لأهداف الاستئصال المحتملة أثناء إيقاع الجيوب الأنفية و (2) توصيف VT مع عدم استقرار الدورة الدموية. من نبضة واحدة ، تم تحديد برزخ VT بدقة في كل من خرائط تنشيط الركيزة وعدم انتظام ضربات القلب. مكن النظام المشغلين من تحديد ركائز عدم انتظام ضربات القلب قبل أو أثناء الاستئصال وتوصيف VTs المتعددة المحفزة في الوقت الفعلي من دورة واحدة.

الشكل 1: مكونات أجهزة ECGI بدون صور. (أ) مكبر صوت ثنائي الجهد يتميز بمنافذ توصيل كبل محددة. (ب) الكابلات اليمنى واليسرى ، المجهزة بموصلات مكبر للصوت من أحد طرفيها وموصلات مقبس سترة المستشعر من جهة أخرى. (ج) التكوين الذي يوضح الكبلات اليمنى واليسرى المتصلين بمكبر الصوت ثنائي الجهد. (د) سير العمل التخطيطي لإجراء توصيل سترة المستشعر بمقابس الكابل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إجراء الماسح الضوئي لإعادة بناء الجذع ثلاثي الأبعاد. (أ) سترة مستشعر محتملة سطح الجسم المكونة من 128 رصاصا ، والتي تتكون من أربعة مكونات (أمامية - يمين ، أمامية - يسرى ، خلفية - يسار) ، على جذع المريض قبل إعادة البناء ثلاثية الأبعاد. يحتوي كل قطب كهربائي على رمز QR فريد لتحديد الهوية التلقائي. يمكن طي الوصلات بين الأقطاب الكهربائية لاستيعاب السترة مع شكل جسم المريض. (ب) يتحقق رمز الاستجابة السريعة الموجود على المكون الأمامي الأيمن من صحة السترة ، مما يمكن تطبيق الماسح الضوئي ثلاثي الأبعاد من بدء إعادة بناء الجذع. (ج) تقوم منصة الماسح الضوئي ثلاثية الأبعاد عبر تطبيق الماسح الضوئي ثلاثي الأبعاد بإنشاء الجذع المعاد بناؤه باستخدام كاميرا ضوئية هيكلية بالأشعة تحت الحمراء. الاختصارات: FR: الأمام الأيمن. FL: من الأمام إلى اليسار. BR: الخلف الأيمن. و BL: الخلف إلى اليسار. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: شاشة تسجيل الدخول لواجهة مستخدم ECGI بدون صورة تتطلب اسم مستخدم وكلمة مرور معينين للوصول إلى البرامج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نافذة الرئيسي. تتيح نافذة الصفحة الرئيسية إدارة المرضى والأطباء والمستخدمين ، بالإضافة إلى تكوين جلسات المرضى. كما يعرض معلومات حول الجلسات المستوردة وحالة النظام ومكبر الصوت. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
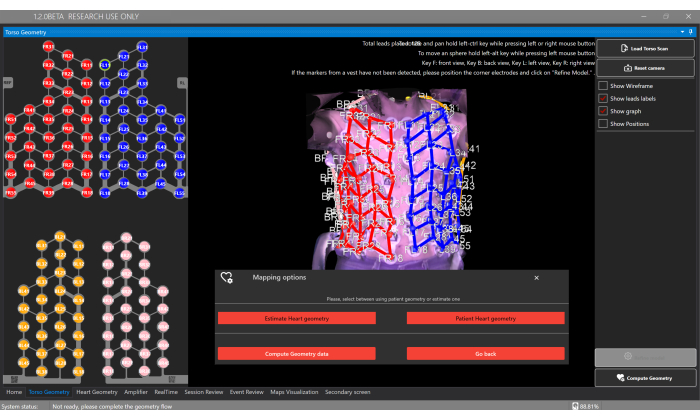
الشكل 5: نافذة هندسة الجذع. تتيح نافذة هندسة الجذع للمستخدمين تحميل وعرض نموذج الجذع ثلاثي الأبعاد ، والأقطاب الكهربائية المقطعية ، وتحديد نوع هندسة القلب عبر زر هندسة الحساب ، والذي يتيح التقدير أو توفير تجزئة من التصوير المقطعي المحوسب / التصوير بالرنين المغناطيسي المخصص. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
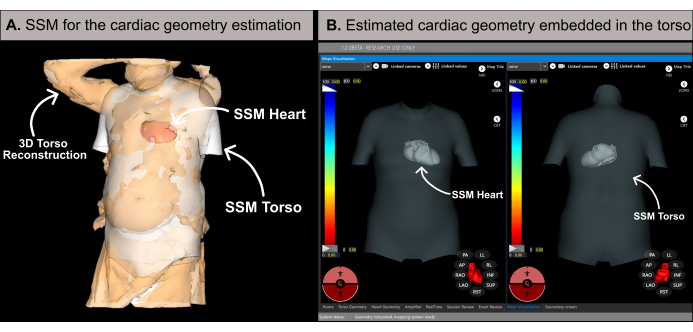
الشكل 6: تقدير هندسة القلب. (أ) خوارزمية SSM باستخدام السمات القاعدية وإعادة بناء جذع المريض ثلاثي الأبعاد لتقدير هندسة القلب. (ب) الهندسة القلبية المقدرة داخل SSM للجذع التي تعرض وجهات النظر الأمامية الخلفية (الجانب الأيسر) والمؤخرة الأمامية (الجانب الأيمن). الاختصارات: 3D: ثلاثي الأبعاد. SSM: نموذج الشكل الإحصائي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: نافذة مكبر للصوت. تسمح نافذة مكبر الصوت بالتصور في الوقت الفعلي للإشارات التي يتم الحصول عليها من كل قطب كهربائي من سترة المستشعر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
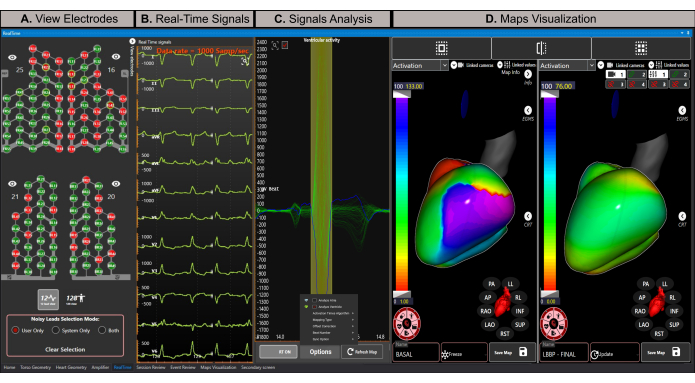
الشكل 8: نافذة الوقت الحقيقي. (أ) تمثيل تخطيطي للخيوط النشطة من سترة مصفوفة الأقطاب الكهربائية عالية الكثافة. تحتوي الأقطاب الكهربائية الخضراء على إشارات ذات جودة جيدة بينما تحتوي الأقطاب الكهربائية الحمراء على إشارات صاخبة ولا تشارك في حساب المشكلة العكسي. (ب) تقدير الخيوط ال 12 لمخطط كهربية القلب في الوقت الفعلي. (ج) التشغيل التلقائي وتحديد بداية وتعويض مجمع QRS (نافذة خضراء اللون). يظهر متوسط إشارة جميع العملاء المتوقعين المشاركين في حساب التعيين باللون الأزرق. (د) يدعم قسم تصور الخرائط طرق عرض الخرائط الفردية أو المزدوجة أو الرباعية. يوضح هذا المثال طريقة عرض رسم الخرائط المزدوجة مع خرائط التنشيط لحالات سرعة فرع الحزمة القاعدية واليسرى (الخريطة النهائية) أثناء إجراء CRT. الخريطة القاعدية في وضع التجميد ، وتظل ثابتة ، بينما تكون الخريطة النهائية في وضع التحديث ، ويتم إعادة الحساب مع كل مجمع QRS تم تحليله حديثا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
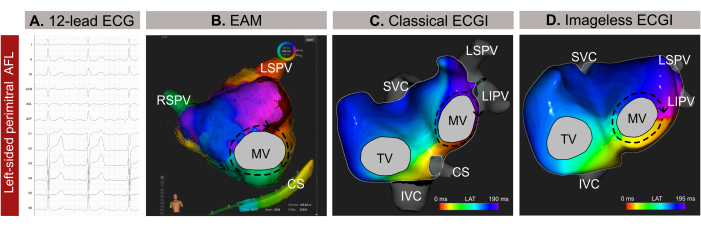
الشكل 9: مثال رسومي لرجم القلقلو الليكوي غير النمطي على الجانب الأيسر والقدرات التشخيصية المختلفة لتخطيط القلب المكون من 12 رصاصا ، وتخطيط القلب بدون صورة ، و EAM الغازي. (أ) تقدم إشارات تخطيط القلب المكونة من 12 رصاصا في AFL غير النمطية موجات إيجابية فوق البطينية في V1. (ب) تخطيط كهربية القلب بدون صورة باستخدام هندسة قلبية تقديرية من SSM وعرض رؤية أمامية خلفية. تظهر دائرة الانتشار جميع الألوان حول MV ، وهو نمط نموذجي ل AFL المحيطي. (ج) يظهر تعيين التنشيط المحلي المستمد من EAM وعرض عرض أمامي خلفي إعادة إدخال ماكرو حول MV ، مما يؤكد التشخيص من تخطيط القلب بدون صورة. الاختصارات: تخطيط القلب: مخطط كهربية القلب. EAM: رسم الخرائط الكهربية التشريحية. ECGI: التصوير الكهربائي للقلب. SVC: الوريد الأجوف الفائق. IVC: الوريد الأجوف السفلي; CS: الجيوب التاجية. LSPV: الوريد الرئوي العلوي الأيسر; RIPV: الوريد الرئوي السفلي الأيمن; RSPV: الوريد الرئوي العلوي الأيمن. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: تتبع تطور الركيزة الأذينية أثناء استئصال قسطرة الرجفان الأذيني باستخدام رسم خرائط ECGI غير الغازية بدون صور. (أ) المناظر الخلفية الأمامية والأمامية والخلفية والجانبية اليمنى لمخطط كهربية القلب بدون صورة ، مع مواقع PFA المميزة بدوائر خضراء. تسلط خريطة PS الأساسية الضوء على عمليات إعادة الدخول في الجدار الجانبي RA ، وقاعدة RAA ، والجدار الخلفي LA ، وقاعدة LAA. نقل PFA في قاعدة LAA الإيقاع إلى AFL المحيطي. على الرغم من إكمال الخط التاجي وعزل الجدار الخلفي ، تم تحفيز الرجفان الأذيني تلقائيا مرة أخرى. كشفت ECGI عن PS في قاعدة RAA ، والتي أصبحت هدف الاستئصال. تم إجراء العديد من تطبيقات PFA في تلك المنطقة ، وتمت استعادة إيقاع الجيوب الأنفية. (ب) مخطط كهربية القلب المكون من 12 رصاصا والإشارات داخل القلب في الوقت الذي تغيرت فيه الرجفان الأجوف إلى SR. الاختصارات: SVC: الوريد الأجوف العلوي. IVC: الوريد الأجوف السفلي; LPVs: الأوردة الرئوية اليسرى. RPVs: الأوردة الرئوية اليمنى. AF: الرجفان الأذيني ، SR: إيقاع الجيوب الأنفية ، PS: تفردات الطور ، LAT: أوقات التنشيط المحلي ، التلفزيون: الصمام ثلاثي الشرف ، MV: الصمام التاجي ، PVI: عزل الوريد الرئوي ، AFL: الرفرفة الأذينية ، PW: الجدار الخلفي ، و PFA: استئصال المجال النبضي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
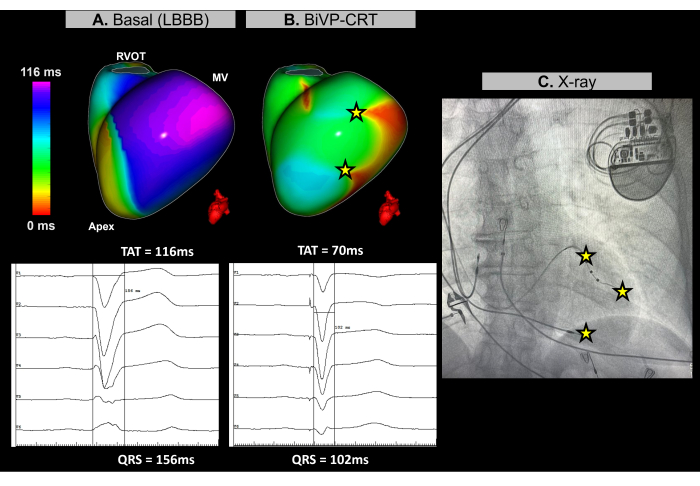
الشكل 11: تحسين سرعة البطينين باستخدام تخطيط القلب بدون صورة. (أ) الإيقاع الأساسي للمريض. تكشف خريطة ECGI بدون صورة (العرض الجانبي الأيسر) عن منطقة تم تنشيطها متأخرا (أرجواني) في الجدار الجانبي ل LV ، مع TAT يبلغ 116 مللي ثانية ، مما يشير إلى عدم التزامن البطيني. يتماشى هذا مع خط الأساس ECG ، والذي يظهر مركب QRS واسع (156 مللي ثانية) بنمط LBBB. (ب) تكوين ما بعد زرع جهاز تنظيم ضربات القلب. بعد BiVP مع التنشيط المتزامن للقطبين البعيدين والقريبين من الرصاص LV وتأخير أذيني بطيني يبلغ 140 مللي ثانية ، لا تظهر خريطة ECGI بدون صورة أي مناطق متأخرة (لا توجد منطقة أرجوانية) ، مما يشير إلى تنشيط البطين المتزامن وانخفاض TAT بمقدار 70 مللي ثانية. يتوافق هذا مع مركب QRS القصير الذي لوحظ في تخطيط القلب النهائي ، حيث تنخفض مدة QRS إلى 102 مللي ثانية. (ج) عرض الأشعة السينية الأمامية الخلفية لجهاز تنظيم ضربات القلب المزروع ، يوضح موقع أقطاب جهاز تنظيم ضربات القلب. ينعكس نشاط السرعة لكل من القطبين البعيد والقريب من الرصاص LV أيضا في خريطة ECGI. الاختصارات: LBBB: كتلة فرع الحزمة اليسرى ، BiVP: الإيقاع ثنائي البطينين ، CRT: علاج إعادة التزامن القلبي ، RVOT: مسار تدفق البطين الأيمن ، MV: الصمام التاجي ، TAT: إجمالي وقت التنشيط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 12: التقييم غير الجراحي ل CRT عبر سرعة نظام التوصيل باستخدام تخطيط القلب بدون صورة. (أ) إيقاع خط الأساس للمريض. تشير خريطة ECGI (العرض الجانبي الأيسر) إلى منطقة من التنشيط المتأخر (الأرجواني) على الجدار الجانبي ل LV ، مع TAT يبلغ 133 مللي ثانية ، مما يشير إلى عدم التزامن البطيني. يتوافق هذا مع خط الأساس ECG ، والذي يعرض مركب QRS واسع (172 مللي ثانية) نموذجي ل LBBB. (ب) المرحلة المتوسطة (سرعة منتصف الحاجز) أثناء زرع رصاص LBBP. تظهر الخريطة غير الغازية تصحيحا جزئيا للمنطقة المتأخرة في LV ، مع تحول اللون من الأرجواني إلى الأزرق. ويرافق ذلك انخفاض في مدة مجمع QRS. (ج) الموضع النهائي لرصاص LBBP أثناء عملية الشد. توضح الخريطة تصحيحا كاملا للمنطقة المتأخرة ، مع انتقال اللون من الأرجواني إلى الأخضر ، مما يشير إلى التنشيط المتزامن لكلا البطينين. الاختصارات: LBBB: كتلة فرع الحزمة اليسرى ، LBB: فرع الحزمة اليسرى ، RVOT: مجرى تدفق البطين الأيمن ، MV: الصمام التاجي ، TAT: إجمالي وقت التنشيط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 13: التقييم غير الجراحي لبرزخ VT باستخدام تخطيط القلب بدون صورة. (أ) يحدد رسم خرائط ECGI بدون صورة أثناء إجراء استئصال VT الركيزة غير المنتظمة وبرزخ VT في المناطق القاعدية والسفلية الإنسية من LV. يتوافق الصف الأول مع إيقاع الجيوب الأنفية ، والصف الأوسط إلى السرعة القمية RV ، والصف السفلي مع VT. (ب) يظهر EAM الغازي الذي تم الحصول عليه أثناء إجراء الاستئصال VT رسم خرائط التنشيط المتساوي الزمني في نفس المناطق التي تم تحديدها بواسطة ECGI. يتوافق الصف العلوي مع السرعة القمية RV ، بينما يمثل الصف السفلي VT. الاختصارات: RV: البطين الأيمن ، LV: البطين الأيسر ، SR: إيقاع الجيوب الأنفية ، RVOT: مجرى تدفق البطين الأيمن ، MV: الصمام التاجي ، التلفزيون: صمام ثلاثي الشرف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يسلط هذا الوصف المنهجي الضوء على الفائدة السريرية لنهج ECGI غير الجراحي ، والنبض الفردي ، وفي الوقت الفعلي ، والذي يمكن أن يدعم مجموعة متنوعة من الإجراءات الفيزيولوجية الكهربية ، مثل استئصال القسطرة و CRT ، دون الحاجة إلى تصوير القلب قبل الإجرائي مثل التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي15،17،31،32 في هذا التقرير ، يوضح تخطيط القلب بدون صورة الميزات التقنية الرئيسية التي قد تعزز اعتماده السريري. في حين أن ECGI قد أثبتت بالفعل أنها أداة قوية لرسم خرائط القلب عبر مجموعة واسعة من عدم انتظام ضرباتالقلب 19،33،34،35،36 ، إلا أنها لا تزال تواجه العديد من التحديات السريرية والتقنية13،14.
تحتاج أنظمة ECGI الكلاسيكية إلى فحص بالأشعة المقطعية على وجه التحديد في نفس يوم رسم خرائط القلب ، مع وجود أقطاب ECGI فيمكانها 9،10،12،37،38. يضيف هذا النهج وقتا إضافيا بسبب الحاجة إلى تجزئة الأشعة المقطعية (القلب والأقطاب الكهربائية) ، مما يؤخر إنشاء خريطة ECGI الأولية بحوالي 1-3 ساعات. في المقابل ، يستخدم نظام ECGI بدون صورة المقدم في هذا التقرير مسحا ثلاثي الأبعاد بالأشعة تحت الحمراء للصدر باستخدام أقطاب كهربائية عالية الكثافة ، والتي يمكن إجراؤها قبل دقائق فقط من الإجراء أو أثناء الاستشاراتالطبية 15،17. يقوم النظام تلقائيا بتقسيم الأقطاب الكهربائية الصدرية وتقدير هندسة القلب للمريض ، مما يبسط عملية رسم خرائط القلب غير الغازية ويقلل بشكل كبير من الوقت بين وصول المريض وتوافر خريطة ECGI الأولى. أظهر التحقق السابق لنهج ECGI بدون صورة أن استخدام هندسة القلب المقدرة يقدم الحد الأدنى من الأخطاء ، مما يحافظ على دقة الخرائط غير الغازية. في المرضى الذين يعانون من الرجفان الأذيني ، لوحظ وجود علاقة قوية بين إشارات ECGI المشتقة من الهندسة القلبية المقدرة مقابل الفعلية ، حتى مع الترجمات الهندسية15. بالنسبة لعدم انتظام ضربات القلب المنتظم ، مثل تسرع القلب الأذيني المعقد ، أظهرت المقارنات مع EAM دقة عالية في تحديد غرفة القلب المعنية ، وتحديد الآلية (البؤرية أو الداخلة) ، واستنتاج هدف الاستئصال31. في حالة VT ، تم تقييم النهج لتوجيه المشغلين نحو مناطق برزخ VT أثناء إيقاع الجيوب الأنفية (SR) 39 ، مما يدل على إمكانية تحديد المرضى المعرضين لخطر الإصابة بالجلطات البطينية في الوقاية الأولية. بالإضافة إلى ذلك ، لوحظ تطابق إقليمي قوي بين خرائط تنشيط ECGI و EAM بدون صورة أثناء سرعة الجيوب الأنفية التاجية ، لا سيما في مواقع التنشيط المبكرة والمتأخرة40.
في CRT ، عادة ما تستخدم التغييرات المورفولوجية في الوقت الفعلي في مخطط كهربية القلب المكون من 12 رصاصا لتأكيد إعادة التزامن أثناء زرع الرصاص ، لا سيما في إجراءات CSP حيث يتم تقييم مخطط كهربية القلب في مراحل مختلفة من وضع الرصاص الحاجز حتى يتم الوصول إلى منطقة LBB. ومع ذلك ، غالبا ما تكون خوارزميات تخطيط القلب المنشورة معقدة ، وتظهر اختلافات كبيرة بينها ، وفي بعض الحالات يصعب تنفيذها في الممارسة السريرية41،42،43. ربما بسبب هذا التعقيد ، لم يتم تحديد معلمة تخطيط كهربية القلب المحددة لإيقاع فرع الحزمة اليسرى (LBBP) باستمرار والتي يمكنها التنبؤ بشكل موثوق بما إذا كان المريض سيستجيب لإعادة التزامن القلبي. يوفر نهج ECGI بدون صورة في الوقت الفعلي تخطيطا بسيطا ومفصلا ، وإيقاعا تلو الآخر طوال عملية زرع الرصاص ، وتقييم تصحيح عدم التزامن من خلال تقييم المعلمات مثل وقت تنشيط البطين الأيسر ، كما هو موضح في المرضى الذين يعانون من مؤشر CRT32 أو أولئك الذين يعانون من كتلة AV44. لذلك ، مع مزيد من التحقيق ، يمكن لمعلمات ECGI في الوقت الفعلي توجيه المشغلين في تحسين موقع زرع الرصاص أو التنبؤ باستجابة المريض ل CRT.
على الرغم من أن إمكانات تخطيط القلب غير المرئي للصور في الوقت الفعلي قد تم تقديمها في هذا التقرير المنهجي ، إلا أن مناهج رسم الخرائط الجديدة غير الغازية الأخرى باستخدام محاكاة عدم انتظام ضربات القلب تهدف أيضا إلى القضاء على الحاجة إلى التصوير قبل الإجراءات. أظهرت دراسة رسم خرائط تخطيط القلب المتجهات لاحتمال عدم انتظام ضربات القلب (VMAP) دقة إقليمية كبيرة في تحديد مواقع عدم انتظام ضربات القلب البطيني45 وتظهر نتائج واعدة في تحديد موقع محركات الرجفان الأذيني بعد الاستئصال غير PVI46. يستخدم VMAP مخطط كهربية القلب المكون من 12 رصاصا جنبا إلى جنب مع نماذج حسابية متعددة لتحديد أهداف عدم انتظام ضربات القلب دون الاعتماد على البيانات الهندسية الخاصة بالمريض. ومع ذلك ، قد يكون هذا النهج دون المستوى الأمثل لعدم انتظام ضربات القلب الأذيني مثل AF ، حيث تكون المكونات عالية التردد على مخطط كهربية القلب على السطح ضرورية لتحديد محركات عدم انتظام ضربات القلب بشكل غير جراحي. عادة ما يتم التقاط هذه المكونات بواسطة أقطاب كهربائية على الأسطح الخلفية والأماميةالجانبية 27 ، والتي لا يتم تمثيلها في مخطط كهربية القلب القياسي المكون من 12 رصاصا المستخدم في الممارسة السريرية.
على الرغم من الحاجة إلى مزيد من التحقيقات السريرية ، فإن تخطيط القلب المجهول بدون صورة في الوقت الفعلي لديه القدرة على أن يصبح أداة قيمة لرسم خرائط القلب غير الغازية عبر مجموعة واسعة من عدم انتظام ضربات القلب. إن بساطتها المنهجية وسير عمل المريض المبسط في إعدادات المستشفى تمكن الأطباء من جمع المزيد من البيانات السريرية ، والتي يمكن أن تحسن نتائج المرضى والتطورات التكنولوجية المستقبلية. في الختام ، يكمن مستقبل رسم الخرائط القلبية غير الغازية في التقدم نحو نهج خال من الصور بالكامل ، مما يسمح بتكامل أسرع وأكثر سلاسة في الممارسة السريرية اليومية ، من الاستشارات الروتينية إلى رسم الخرائط في الوقت الفعلي أثناء الإجراءات الفيزيولوجية الكهربية.
Disclosures
حصلت JRP و BPS و JSC و IHR و RM و CF و EZ و JM و DL و FA و MSG و AMC على شرف من Corify Care SL. AMC و MSG و FA هم مؤسسون مشاركون ل Corify Care SL و JRP و BPS و JSC و IHR و JM و DL و JBG و FA و LM و MSG و AMC هم مساهمون. تلقت TFA منحا بحثية من Biosense-Webster. حصلت IRL على أتعاب كمحاضر ومستشار من Abbott و Biosense-Webster. APS تلقت مكربات المتحدث والمستشار من Bisosense-Webster و Abbott و Boston-Scientific. حصلت JMT على أتعاب كمحاضر ومستشار من Abbott و Boston-Scientific و Medtronic. تلقت EA متحدثا ومستشارا من Biosense-Webster و Bayer. تقدم LM أتعاب كمستشار ومحاضر ومجلس استشاري من Boston-Scientific و Abbott و Johnson & Johnson و Medtronic ، وهي مساهم في Galgo Medical SL. تبلغ JBG عن أتعاب كمستشار ومتحدث من Microport CRM و Abbott ، بالإضافة إلى دعم المنح غير المقيد للزمالة من Abbott. حصلت MPL على مكافأة المتحدث من Medtronic.
Acknowledgements
تم تمويل هذا البحث من قبل المعهد الأوروبي للابتكار والتكنولوجيا (EIT) بموجب اتفاقية منحة SAVE-COR No 220385 ومن منحة CIAICO / 2022/020 بتمويل من Generalitat Valenciana (EFICACIA). جاء الدعم الإضافي من Generalitat Valenciana (منحة CIAPOS/2021/238 و ACIF/2021/205 و CIBEFP/2022/9) و MCIN/AEI/10.13039/501100011033 و ESF Investing in Your Future (منحة RYC2018-024346-I) ومعهد Salud Carlos III (منحة CIBERCV16 CB16 / 11/00354) ، وكاتالونيا ، إسبانيا (منحة 2021_SGR_01350 ، SGR21 / GENCAT). كما نعرب عن تقديرنا للدعم المقدم من برنامج CERCA / Generalitat de Catalunya. MPL ممولة (2023-2025) من خلال عقد Río Hortega CM22 / 00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. يشكر المؤلفان نيوس بورتيلا وشيلا ماركو على تقديم دعم السكرتارية ، وإلى الفرق الطبية والتمريضية على دعمهم السريري في مستشفى Clínic de Barcelona ، ومستشفى الجامعة العامة Gregorio Marañón ، مستشفى Universitari i Politècnic La Fe. كما أنهم يمتدون إلى Almudena Albertos من Corify Care SL ، مدريد ، إسبانيا و Arantxa Carrasco من Universitat Politecnica de Valencia.
Materials
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
References
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved