Method Article
Mapeo cardíaco en tiempo real con un sistema de imágenes electrocardiográficas no invasivo sin imágenes
En este artículo
Resumen
Este estudio presenta un enfoque novedoso para el mapeo cardíaco en tiempo real utilizando un sistema de imágenes electrocardiográficas no invasivo y sin imágenes. Este sistema permite la adquisición de mapas cardíacos electrofisiológicos sin necesidad de tomografías computarizadas previas al procedimiento o exploraciones de resonancia magnética, lo que permite una guía eficiente para procedimientos cardíacos como la ablación y los implantes de terapia de resincronización cardíaca.
Resumen
El mapeo cardíaco rápido, seguro y eficaz es fundamental para el tratamiento de las arritmias complejas, pero los métodos actuales se enfrentan a limitaciones significativas. El electrocardiograma (ECG) de 12 derivaciones, si bien es esencial para el diagnóstico inicial, carece de la resolución espacial y la profundidad necesarias para guiar procedimientos avanzados como la ablación con catéter o el implante de un dispositivo de terapia de resincronización cardíaca. Por otro lado, las técnicas de mapeo invasivas proporcionan una actividad eléctrica detallada, pero requieren la colocación de múltiples catéteres, lo que aumenta los riesgos y la complejidad del procedimiento. Estos métodos requieren mucho tiempo, son costosos y ofrecen una evaluación limitada en tiempo real, especialmente en arritmias dinámicas como la fibrilación auricular (FA), la arritmia inestable y la terapia de resincronización cardíaca (TRC).
Este estudio presenta un sistema de imágenes electrocardiográficas no invasivas y sin imágenes (Imageless-ECGI) diseñado para complementar los métodos tradicionales al proporcionar mapas cardíacos en tiempo real, latido a latido. Sin la necesidad de imágenes previas al procedimiento, este sistema captura la actividad eléctrica de alta resolución en todo el corazón, lo que ofrece una alternativa más segura y eficiente al mapeo invasivo. Al combinar la inmediatez de los registros de superficie con la precisión espacial de los modelos computacionales modernos, el sistema Imageless-ECGI cierra la brecha entre el ECG tradicional y el mapeo invasivo, lo que podría transformar el flujo de trabajo en los laboratorios de electrofisiología.
Introducción
La necesidad de un mapeo electrofisiológico no invasivo se ha vuelto cada vez más importante para evaluar con precisión la actividad cardíaca, particularmente en pacientes sometidos a procedimientos complejos de arritmia, como la fibrilación auricular (FA) y la ablación de taquicardia ventricular (TV), o durante la implantación de marcapasos y dispositivos de terapia de resincronización cardíaca (TRC). En la actualidad, el mapeo electroanatómico (EAM) tridimensional (3D) sigue siendo el estándar de oro para guiar a los operadores durante la ablación con catéter1, ya que proporciona mapas funcionales completos para caracterizar las arritmias 2,3. Sin embargo, la EAM no es óptima para capturar los patrones espacio-temporales dinámicos de la FA, las arritmias no sostenidas, y el largo tiempo y el procedimiento invasivo requerido para el mapeo hacen que sea poco práctico para su uso en procedimientos de TRC.
Los métodos tradicionales no invasivos, como el electrocardiograma (ECG) de 12 derivaciones, si bien son muy precisos para identificar focos específicos de arritmia (p. ej., tracto de salida o VT de cúspide), ofrecen una visión limitada del comportamiento eléctrico global del corazón. Esta limitación es especialmente evidente cuando se requiere un mapeo en tiempo real para guiar las intervenciones en arritmias dinámicas y complejas, donde la localización precisa de las áreas arritmogénicas es crucial para obtener resultados exitosos. El mapeo no invasivo podría desempeñar un papel importante en la mejora de la planificación previa al procedimiento y proporcionar retroalimentación en tiempo real durante las intervenciones electrofisiológicas.
Para apoyar a los electrofisiólogos antes del procedimiento, los avances en las modalidades de imágenes cardíacas, como la tomografía computarizada (TC) y la resonancia magnética (RM), han demostrado ser eficaces para proporcionar información estructural detallada, incluido el grosor de la pared4 y la fibrosis miocárdica 5,6,7,8 . Sin embargo, estas modalidades se centran en las características anatómicas y estructurales, lo que deja un vacío en el mapeo eléctrico funcional. Además, la obtención de imágenes cardíacas de alta calidad requiere protocolos de exploración especializados, personal capacitado y métodos complejos de posprocesamiento como la segmentación avanzada y la caracterización precisa de tejidos, particularmente para detectar la fibrosis cardíaca.
Los sistemas clásicos de imagen electrocardiográfica (ECGI) han surgido como una opción no invasiva, ofreciendo resultados prometedores al reconstruir la actividad eléctrica cardíaca a partir de los potenciales de superficie corporal (BSP)9,10,11,12. A pesar de su potencial, los sistemas ECGI se enfrentan a notables limitaciones13,14. En primer lugar, requieren tomografías computarizadas previas al procedimiento para mapear las posiciones de los electrodos en las geometrías cardíacas, lo que hace que su uso en la rutina clínica sea menos factible. En segundo lugar, los métodos tradicionales de regularización utilizados para resolver el problema inverso del mapeo cardíaco a menudo introducen patrones de propagación no fisiológicos, lo que limita su precisión en entornos clínicos.
El objetivo de este estudio fue describir las características y procedimientos de un novedoso sistema de ECGI no invasivo capaz de mapear en tiempo real sin necesidad de TC o RM15, conocido como ECGI sin imagen. Exploramos los avances de la ECGI sin imágenes y presentamos posibles aplicaciones clínicas para el mapeo electrofisiológico, superando las limitaciones de las técnicas actuales como la EAM, el ECG de 12 derivaciones y la ECGI clásica en el manejo de procedimientos complejos de arritmias. Este enfoque permite la creación de mapas cardíacos a los pocos minutos de la llegada del paciente, lo que agiliza el flujo de trabajo y reduce el tiempo de preparación. Además, el sistema utiliza algoritmos avanzados de procesamiento de señales para generar patrones de propagación fisiológica precisos, lo que mejora la localización de las arritmias y los resultados de los procedimientos.
Protocolo
La metodología ha sido validada prospectivamente en un estudio clínico observacional multicéntrico. El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki y las normas éticas de las instituciones involucradas. El protocolo del estudio, SAVE-COR (NCT05772182), fue aprobado por los Comités de Ética del Hospital Universitario Gregorio Marañón, del Hospital Clínic de Barcelona y del Hospital Universitario y Politécnico La Fe, y se obtuvo el consentimiento informado de todos los pacientes.
NOTA: Las descripciones detalladas de los criterios de inclusión y exclusión son:
Criterios de inclusión: (i) Indicación de estudio electroanatómico invasivo y/o implante de dispositivos de estimulación intracavitaria. (ii) Haber obtenido y firmado el consentimiento informado para su inclusión en el estudio.
Criterios de exclusión: (i) <18 años de edad. (ii) Incapacidad para someterse a un cateterismo endocárdico (p. ej., mujeres embarazadas o en período de lactancia). (iii) Incapacidad física o mental para comprender y aceptar el consentimiento informado. (iv) Incapacidad para mantenerse erguido para permitir la reconstrucción del torso en 3D requerida para el sistema ECGI. (v) Pacientes con patologías congénitas.
1. Preparación del sistema ECGI sin imágenes en tiempo real previo al procedimiento
- Verifique que el amplificador de biopotencial (Figura 1A) esté completamente cargado y colóquelo al final de la mesa de la sala de electrofisiología (EP), cerca de donde se colocarían los pies del paciente.
NOTA: El amplificador de biopotencial (ver Tabla de Materiales) es un dispositivo aislado de 128 canales responsable de amplificar y digitalizar las señales eléctricas recogidas por los electrodos. - Verifique que los cables derecho e izquierdo no estén dañados inspeccionando los conectores del amplificador en un extremo y los enchufes negros, donde está conectado el chaleco del sensor, en el otro extremo (Figura 1B).
NOTA: Los cables derecho e izquierdo (ver Tabla de Materiales) tienen una longitud de 1,5 m y transmiten señales eléctricas desde el chaleco sensor hasta el amplificador de biopotencial. - Conecte los cables conectores derecho e izquierdo en el amplificador de biopotencial (Figura 1C). Cada cable está asociado a un enchufe que se distingue por un número, que es el mismo tanto para el cable como para el amplificador.
- Verifique que la plataforma del escáner 3D esté completamente cargada y abra la aplicación de escaneo 3D.
NOTA: La aplicación de escaneo 3D es un software que se ejecuta en una plataforma de escáner 3D (consulte la Tabla de materiales) que utiliza una cámara de luz estructural infrarroja para generar una reconstrucción del modelo 3D del torso del paciente. La aplicación también detecta automáticamente la ubicación de los códigos de respuesta rápida (QR) del electrodo. - Verifique que la estación de trabajo del PC (consulte la Tabla de materiales) tenga instalada la interfaz de usuario (UI) del software ECGI sin imágenes y que esté completamente cargada.
NOTA: El software Imageless ECGI (ver Tabla de Materiales) incorpora algoritmos de procesamiento de señales para estimar la geometría cardíaca y proporcionar información valiosa para el diagnóstico y tratamiento de arritmias cardíacas o guiar los procedimientos de implantación de dispositivos cardíacos 16,17,18,19. La interfaz de usuario del sistema permite a los usuarios visualizar, seleccionar y analizar señales electrocardiográficas, creando mapas interactivos de la actividad epicárdica que permiten una evaluación no invasiva de la función cardíaca. - Conecte el amplificador de biopotencial a la estación de trabajo mediante un cable Ethernet aislado (consulte la tabla de materiales). Inserte un extremo en el puerto Ethernet del amplificador y el otro en la estación de trabajo.
NOTA: El cable Ethernet aislado transmite señales eléctricas desde el amplificador de biopotencial a la estación de trabajo. - Seleccione un chaleco sensor (consulte la Tabla de materiales), inspeccione el empaque y verifique que el sellado no esté dañado. No utilice el chaleco sensor si el embalaje está abierto o dañado.
- Abra el empaque del chaleco sensor y verifique que los cuatro componentes del chaleco estén adentro. Elija otro embalaje de chaleco sensor si falta uno de los componentes.
NOTA: El chaleco sensor es una guía de electrodos de alta densidad con 128 electrodos de plata que permiten el mapeo simultáneo de la actividad eléctrica de la superficie en todo el torso del paciente. El chaleco es radiolúcido y contiene cuatro parches que cubren las superficies anterior y posterior izquierda y derecha del torso. Cada electrodo cuenta con un código QR en la parte frontal, lo que permite la identificación automática de la posición del electrodo.
2. Preparación del paciente antes del procedimiento
- Ingresar al paciente en el hospital el mismo día del estudio electrofisiológico o de la implantación del dispositivo.
- Coloque al paciente de pie o sentado en una silla o en la mesa de electrofisiología y asegúrese de que toda el área del torso esté libre de ropa.
- Realice una inspección visual de la piel del paciente para verificar si el paciente tiene rasguños, heridas o cualquier otra afección de la piel para evitar colocar electrodos en estas áreas.
- Opcionalmente, cepille el torso para las personas con mucho vello para minimizar los artefactos de ruido y reducir la incomodidad durante la extracción del chaleco del sensor.
- Coloque correctamente las cuatro partes del chaleco sensor (delantero derecho, delantero izquierdo, trasero derecho y trasero izquierdo) en el torso del paciente (Figura 2A) y ajuste el chaleco al tamaño del paciente doblando las conexiones entre los electrodos cuando sea necesario.
- Opcionalmente, para los procedimientos de TRC, evite colocar electrodos en el área donde se insertará el implante cardíaco, a menudo ubicados en la parte superior izquierda del tórax.
NOTA: Las conexiones con guiones impresos se pueden interrumpir de forma segura si es necesario, ya que no hay pistas activas en esas áreas. - Coloque los electrodos accionados por la pierna derecha (RLD) y de referencia (REF) del chaleco sensor en las patas derecha e izquierda, respectivamente, lo más lejos posible de los otros electrodos del chaleco.
- Asegúrese de que la habitación esté iluminada adecuadamente y de que no haya objetos dentro de un diámetro de 1,5 m alrededor del torso del paciente, ya que pueden interferir o distorsionar la reconstrucción 3D del torso.
- Coloque al paciente con los brazos sobre la cabeza para evitar interferencias con la reconstrucción 3D del torso, como se ve en la Figura 2C.
- Obtener la reconstrucción 3D del torso del paciente.
- Tome la plataforma del escáner 3D y abra la aplicación de escaneo 3D.
- Escanee el código QR en el lado lateral del componente del chaleco delantero derecho para validar el chaleco del sensor (Figura 2B), asegurándose de que sea de un solo uso y no esté caducado.
NOTA: Una vez detectado el código QR, la aplicación de escaneo 3D permite la adquisición de la reconstrucción del torso en 3D. - Coloque la plataforma del escáner 3D a la altura del torso frente al paciente, sujétela firmemente con ambas manos y complete una rotación de 360° alrededor del paciente para adquirir la reconstrucción del torso en 3D (Figura 2C).
NOTA: A medida que avanza el escaneo, la cámara de luz estructurada infrarroja de la plataforma del escáner 3D crea una malla cerrada 3D de color gris del torso, completando el proceso con una rotación completa. Por lo general, el proceso de reconstrucción del torso en 3D requiere de 1 a 2 minutos para completarse. - Realice una inspección visual de la reconstrucción del torso en 3D para asegurarse de que todo el torso esté cubierto por una sombra gris y que no haya agujeros en la malla reconstruida.
- Guarde la reconstrucción 3D del torso en la aplicación una vez finalizado el escaneo.
- Haga que el paciente se acueste en la mesa de la sala de electrofisiología.
- Conecte las cuatro partes del chaleco sensor a los cables conectores derecho e izquierdo correspondientes (Figura 1D). Conecte los conectores de chaleco delantero derecho y trasero derecho a la toma de cable derecha y los conectores de chaleco delantero izquierdo y trasero izquierdo a la toma de cable izquierda.
- Encienda el amplificador de biopotencial para permitir que el software ECGI sin imágenes reciba señales electrofisiológicas en tiempo real.
3. Estimación de la geometría cardíaca del paciente
- Inicie sesión como usuario en el software ECGI sin imágenes en tiempo real instalado en la estación de trabajo (Figura 3). Proporcione un nombre de usuario y una contraseña.
- Haga clic en el botón Agregar paciente e introduzca los datos de identificación para registrar a un nuevo paciente en la ventana de inicio de la interfaz de usuario (Figura 4). A continuación, crea una nueva sesión asociada al paciente, proporcionando el tipo de procedimiento y los siguientes datos basales: sexo, edad, altura y peso.
NOTA: Un solo paciente puede tener varias sesiones. Por ejemplo, en estudios clínicos con seguimientos, si un paciente se somete a un segundo registro de ECGI, se puede crear una nueva sesión sin volver a añadir al paciente. - Conecte la plataforma del escáner 3D a la estación de trabajo mediante un cable USB-C.
- Haga clic en el botón Cargar escaneo de torso y cargue la reconstrucción 3D del torso en la ventana de geometría del torso (Figura 5).
NOTA: El software detectará automáticamente la localización de los 128 electrodos del chaleco sensor. Cada componente del chaleco tiene diferentes colores de electrodo: Delantero derecho = rojo, Delantero izquierdo = azul, Trasero derecho = rosa y Trasero izquierdo = naranja. - Opcionalmente, ajuste manualmente las posiciones de los electrodos haciendo clic en cada electrodo y reposicionándolo en la superficie del torso.
- Seleccione el botón Calcular geometría y la opción Estimar geometría cardíaca para estimar la geometría cardíaca del paciente en la ventana Geometría del torso (Figura 5).
NOTA: El software estima la geometría cardíaca utilizando una metodología basada en un modelo estadístico de forma (SSM) (Figura 6A), según se detalla en la literatura previa20. El algoritmo procesa primero la reconstrucción 3D del torso del paciente y los datos basales (sexo, edad, altura y peso) como entrada. Posteriormente, el SSM, que incorpora geometrías cardíacas y del torso basadas en la resonancia magnética, se ajusta de forma iterativa para adaptarse a la malla 3D del torso del paciente. Esto determina la geometría, la posición y la orientación óptimas del corazón dentro del cuerpo del paciente (Figura 6B). Este proceso elimina la necesidad de una tomografía computarizada o una resonancia magnética previas al procedimiento, lo que permite la generación del primer mapa cardíaco no invasivo en 10-15 minutos. Es importante tener en cuenta que un mensaje emergente informa al usuario si la reconstrucción del torso en 3D carece de suficiente resolución o contiene algún artefacto que pueda afectar la precisión de los resultados de la estimación.
4. Mapeo ECGI no invasivo sin imágenes para guiar el implante de estimulación del sistema de conducción para la terapia de resincronización cardíaca (CSP-CRT) en tiempo real (caso 4)
- Vaya a la ventana del amplificador y haga clic en el botón Conectar amplificador para comenzar a adquirir señales electrofisiológicas en tiempo real (Figura 7). Haga clic en los diferentes cables para visualizar las señales en la pantalla del amplificador.
- Vaya a la ventana en tiempo real (Figura 8) para obtener un mapeo cardíaco no invasivo en tiempo real.
NOTA: La ventana en tiempo real permite la visualización de señales en tiempo real, excluye las señales ruidosas, crea creadores temporales, delinea automáticamente los segmentos de análisis (por ejemplo, onda P y complejo QRS) y calcula y muestra mapas ECGI no invasivos. - Excluya las señales ruidosas haciendo clic en el botón de vista de 128 prospectos , seleccionando la opción Solo usuario como modo de selección de prospectos ruidosos y haciendo doble clic en las señales ruidosas para excluirlas antes de generar el mapa ECGI. Esto mejora la calidad del cómputo de la cartografía, ya que la ECGI es un problema mal planteado21.
NOTA: Los cables del chaleco del sensor que se muestran en verde indican señales de buena calidad y se utilizan para el cálculo inverso del problema, mientras que los cables que se muestran en rojo son ruidosos y se excluyen del análisis (Figura 8A). - Haga clic en el botón de vista de 12 derivaciones para visualizar un ECG estimado de 12 derivaciones en tiempo real (Figura 8B).
- Asegúrese de que el botón RT ON esté activo para actualizar automáticamente las señales en la sección de análisis de señales (Figura 8C). Esta opción activa y define automáticamente el inicio y el desplazamiento del complejo QRS que se va a analizar.
NOTA: El botón RT se puede cambiar al modo RT OFF para congelar las señales, lo que permite al usuario delinear manualmente el complejo QRS cuando la delineación automática del sistema no es óptima. - Configure el análisis de mapeo de activación de ECGI haciendo clic en el botón Opciones para generar automáticamente un mapa de ritmo basal óptimo para el procedimiento CSP-CRT:
- Seleccione la opción Analizar ventrículo para mapear solo los ventrículos.
- Seleccione la opción de análisis basado enondículas 17 para el algoritmo de tiempos de activación.
- Seleccione la opción Average Beat para la función Tipo de mapeo para calcular la onda promedio de los últimos 10 complejos QRS.
- Deje la configuración predeterminada para las funciones Corrección de desplazamiento, Número de tiempo y Opción de sincronización .
- Seleccione la opción de dos paneles en la sección de visualización de mapas y asegúrese de que el mapa de la izquierda esté configurado en modo de actualización , de modo que se actualice continuamente con cada nuevo complejo QRS promedio analizado.
- Visualice el mapa de activación basal biventricular en el lado izquierdo (Figura 8D, panel izquierdo). El sistema calcula automáticamente la matriz de transferencia entre el torso y las mallas cardíacas para reconstruir la actividad eléctrica epicárdica del corazón basándose en el método de los elementos límite 22,23,24.
NOTA: El mapa de activación representa la progresión temporal de la despolarización a través del epicardio cardíaco, lo que ayuda a identificar los orígenes de activación e identifica patrones focales o de reentrada. Las activaciones se calculan (1) transformando cada electrograma reconstruido en una suma de ondículas sinusoidales para todas las muestras de tiempo de pendiente negativa y amplitud proporcional a la pendiente en ese momento y (2) seleccionando el instante de la amplitud máxima de la señal transformada como el instante de tiempo de activación17. - Escriba el nombre y guarde el mapa basal haciendo clic en el botón Guardar mapa y cambie el mapa al modo Congelar una vez que sea reproducible. Un mapa ECGI reproducible tiene una duración de activación y patrones de propagación consistentes en al menos tres mapas consecutivos.
NOTA: En los procedimientos de CSP-CRT, el mapa basal (Figura 12A) servirá como referencia para evaluar la sincronía biventricular durante el proceso de atornillado del electrodo en la región septal hasta alcanzar el área de la rama izquierda del haz (Figura 12C). - Configure el análisis de mapeo de activación de ECGI haciendo clic en el botón Opciones para obtener mapas óptimos durante el proceso de atornillado y estimulación en la región septal:
- Seleccione Analizar ventrículo para mapear solo los ventrículos.
- Seleccione la opción de análisis basado en ondículas para el algoritmo de tiempos de activación.
- Seleccione la opción de latido único para el Tipo de mapeo para analizar la onda de un solo latido para capturar los cambios en las señales electrocardiográficas durante el proceso simultáneo de atornillado y estimulación en diferentes posiciones septales.
- Deje la configuración predeterminada para las funciones Corrección de desplazamiento, Número de tiempo y Opción de sincronización .
- Establezca el mapa del panel derecho en modo de actualización para asegurarse de que se actualiza continuamente con cada complejo QRS de un solo latido recién analizado durante el proceso de atornillado.
- Sincronice el rango del mapa de colores del mapa del panel derecho con el mapa basal mediante el menú Valores vinculados y vincule las posiciones de sus cámaras a través del menú Cámara vinculada (panel derecho de la Figura 8D).
NOTA: A medida que el cable se atornilla en la región septal, los mapas de ECGI latido a latido se generan automáticamente en varias posiciones (es decir, tabique ventricular derecho, tabique medio, tabique profundo y rama izquierda del haz). Estos mapas se comparan con el mapa basal estandarizando el rango del mapa de colores en todos los mapas ECGI evaluados (Figura 12B, C). Esta configuración permite una visualización clara de los cambios en los patrones de activación mientras se atornilla el cable. - Escriba el nombre y guarde cada mapa haciendo clic en el botón Guardar mapa cada vez que se observe un cambio en el patrón de activación durante el proceso de atornillado en la región septal, continuando hasta alcanzar el área de la rama izquierda del paquete.
5. Análisis adicional de mapeo ECGI sin imágenes no invasivo
NOTA: Se pueden derivar diferentes mapas cardíacos a partir de señales de ECGI computarizadas para evaluar el sustrato cardíaco, caracterizar arritmias, evaluar CRT o extraer métricas clínicamente relevantes durante los procedimientos. El tipo de mapas que se pueden generar depende del ritmo cardíaco específico que se esté analizando, con distintos enfoques tanto para ritmos regulares como irregulares.
- Utilice la sección de análisis de señales de la ventana en tiempo real para analizar los diferentes ritmos que los pacientes pueden exhibir durante el procedimiento electrofisiológico:
- Analice los ritmos regulares, estableciendo el análisis de latidos promedio o de un solo latido como característica de tipo de mapeo, cuando el paciente está en un ritmo estabilizado/regular, como ritmo sinusal, estimulación auricular o ventricular, aleteo auricular o taquicardia ventricular. Calcule el mapa de activación y el mapa de velocidad de conducción (CV) a partir del análisis de ritmo regular.
- Analice el ritmo irregular, utilizando el análisis de latidos de ritmo irregular como característica de tipo de mapeo cuando el paciente tiene fibrilación auricular. El sistema permite la selección de segmentos de AF extendidos (por ejemplo, 1 min) para suprimir complejos QRST y capturar los patrones espacio-temporales dinámicos de AF. Calcule el mapa de fase, el mapa de histograma de rotor y el mapa de frecuencia dominante a partir de análisis de ritmo irregular.
- Opcionalmente, pulse el menú desplegable de la selección de mapas y elija el mapa de activación si se ha analizado un ritmo regular. Consulte el paso 4.8 para obtener una descripción detallada del mapa de activación .
- Opcionalmente, presione el menú desplegable de la selección de mapa y elija el mapa de Velocidad de Conducción si se ha analizado un ritmo regular.
NOTA: La velocidad de conducción es una métrica derivada del mapa de activación. Esta métrica representa el tiempo que tarda un frente de onda en viajar a través de cada área del epicardio. El cálculo de CV se basa en gradientes espaciales de mapas de tiempo de activación a través de superficies cardíacas, con campos vectoriales de velocidad aplicados para identificar regiones de propagación efectiva. Las áreas con vectores direccionales uniformes indican una propagación eléctrica estable, mientras que las regiones con disparidades angulares, que indican una propagación ineficaz, se interpolan utilizando una función de base radial25. La CV permite identificar áreas de desaceleración de la conducción durante el mapeo del sustrato que se relacionan con las tasas de recurrencia de arritmias17. - Opcionalmente, presione el menú desplegable de la selección de mapa y elija el Mapa de fase al analizar un ritmo irregular.
NOTA: El mapa de fases rastrea la progresión de una región definida del miocardio a través del potencial de acción a lo largo del tiempo. Este tipo de mapa es dinámico ya que representa la progresión del potencial cardíaco. En el mapa de fase, se aplica la transformada de Hilbert para calcular la fase de la señal ECGI. Cada fase corresponde a un estado dado del potencial de acción en cada ciclo de la señal (π para reposo, π/2 para la despolarización, 0 para la meseta y -π para la repolarización)26. - Opcionalmente, presione el menú desplegable de la selección de mapa y elija el mapa de histograma de rotor al analizar un ritmo irregular.
NOTA: Un mapa de histograma de rotor, derivado de un mapa de fase, es una representación de las ubicaciones más frecuentes de singularidades de fase, que son áreas con actividad reentrante concentrada y se muestran en rojo. En resumen, las singularidades de fase se definen como puntos clave en los que la fase cambia de -π a π. Se descartan las PS que no muestran una progresión espacial gradual de las fases en su entorno. Finalmente, se cuantifica el número de vueltas de cada rotor para obtener el mapa del Histograma del Rotor 18. La precisión del algoritmo en la identificación de los patrones de propagación durante la FA y las regiones específicas que presentan reentradas se ha evaluado sistemáticamente contra el mapeo endocárdico, demostrando una correlación del 71%16. - Opcionalmente, presione el menú desplegable de la selección de mapa y seleccione el mapa de Frecuencia Dominante (DF) al analizar un ritmo irregular.
NOTA: Los mapas de radiogoniometría muestran la frecuencia eléctrica predominante en cada región cardíaca a lo largo del tiempo, lo que ayuda a identificar áreas de actividad eléctrica rápida que pueden servir como impulsores de la FA. DF se calculan como la frecuencia con la densidad espectral de mayor potencia en el periodograma de Welch27,28. Su análisis permite la detección de áreas con alta estabilidad o variabilidad en la actividad fibrilar dentro de las aurículas. Un histograma se utiliza para evaluar la distribución temporal de las frecuencias dominantes, proporcionando una representación clara y cuantitativa de la actividad eléctrica más relevante y facilitando la identificación de regiones con comportamiento anormal.
Resultados
Caso 1 - Planificación y orientación de la ablación con catéter de un aleteo auricular atípico
Se trata de un paciente masculino de 59 años (índice de masa corporal -IMC-30) con antecedentes de hipertensión arterial, tabaquismo, valvulopatía, clasificación EHRA IIb y una puntuación CHA2DS 2-VASc de 1 con indicación de ablación con catéter por aleteo auricular atípico (AFL) basado en un ECG de 12 derivaciones (Figura 9A). El paciente no tenía antecedentes de ablación con catéter. La resonancia magnética tardía con realce de gadolinio (LGE-RM) previa al procedimiento reveló una fibrosis extensa en la pared posterior de la aurícula izquierda (AI), con una planimetría de la AI normal de 24 cm² y una fracción de eyección del ventrículo izquierdo (FEVI) conservada del 54%.
La ECGI no invasiva sin imagen se realizó pocos minutos antes de la introducción del catéter a través de una vaina femoral. Se seleccionó para el análisis un ciclo completo de la AFL (209 ms), libre de complejos QRST. El mapeo reveló un circuito macro-reentrante alrededor de la válvula mitral (VM), señalando la línea perimitral como el objetivo óptimo de ablación para la terminación de la arritmia (Figura 9B). A continuación, se llevó a cabo un EAM basado en contacto (Figura 9C), que confirmó el patrón de propagación observado en el ECGI no invasivo sin imágenes. La ablación a lo largo de la línea perimitral terminó con éxito la arritmia.
En este caso clínico, la arritmia se caracterizó con precisión antes de la EAM invasiva, lo que permitió una localización precisa del patrón de propagación de la arritmia y simplificó el procedimiento de ablación. Sin embargo, para las taquicardias auriculares complejas, como la AFL o la taquicardia focal, Imageless ECGI ofrece un mapeo en tiempo real de un solo latido, lo que lo hace particularmente valioso en casos de arritmia no sostenida. Su adaptabilidad a los cambios en los patrones de arritmia durante un procedimiento garantiza un mapeo preciso y dinámico. Además, si bien el diagnóstico de la AFL en sentido contrario a las agujas del reloj suele ser sencillo a partir de un ECG de 12 derivaciones, localizar e identificar con precisión el mecanismo de las taquiarritmias complejas puede ser un desafío. En consecuencia, la realización de ECGI sin imágenes en una consulta médica o minutos antes puede mejorar la seguridad y la eficiencia del procedimiento al proporcionar orientación previa para la planificación de la ablación del catéter y eliminar los abordajes transeptales innecesarios.
Caso 2 - Evolución de las singularidades de fase durante la ablación con catéter de la fibrilación auricular persistente
Se trata de un paciente masculino de 63 años (IMC 31) con fracción de eyección del ventrículo izquierdo (FEVI (FEVI, 55%) conservada, sin AI dilatada y con indicación de ablación con catéter por FA persistente. No se realizaron tomografías computarizadas ni resonancias magnéticas previas al procedimiento. El paciente tenía antecedentes de ablación con catéter para el aislamiento de la vena pulmonar (PVI) en diciembre de 2019.
A su llegada, el paciente se encontraba en FA. El mapeo del sustrato se realizó mediante ECGI sin imágenes durante todo el procedimiento de ablación (Figura 10A). Al inicio del estudio, el ECGI identificó singularidades de fase en la pared lateral de la aurícula derecha (AR), la base de la orejuela derecha (RAA), la pared posterior de la aurícula izquierda (PW) y la base de la orejuela izquierda (LAA). Estos hallazgos se correlacionaron con las EGM fragmentadas y de alta frecuencia observadas mediante catéteres endocavitarios, y se confirmó una VAV adecuada mediante la reconstrucción de la EAM de EEM. Se inició la ablación de campo pulsado (PFA) en la base de la AIA, lo que resultó en un cambio de ritmo de FA a AFL atípica. El ECGI sin imágenes reveló una AFL perimitral, que se confirmó mediante arrastre desde el polo distal del catéter del seno coronario. Se creó una línea mitral; sin embargo, se reinició la fibrilación auricular. Posteriormente, se logró el aislamiento completo de PW. A pesar de esto, el ECGI sin imágenes continuó identificando singularidades de fase significativas en la base de RAA. Después de múltiples aplicaciones de PFA dirigidas a esta área, se logró el ritmo sinusal (Figura 10B).
Este caso clínico es una representación de cómo la FA presenta desafíos únicos debido a la alta variabilidad de la actividad eléctrica en las aurículas. El ECGI sin imágenes capturó eficazmente los patrones espacio-temporales de la progresión de la FA durante la ablación, con hasta tres mapas no invasivos adquiridos para guiar la modificación del sustrato hasta que se logró la RS. Los tratamientos estándar, como el aislamiento de las venas pulmonares, tienen tasas de recurrencia relativamente altas29. Las dificultades clave en el tratamiento de la FA radican en dos áreas: (1) determinar qué pacientes se beneficiarán de la IVV sola, y (2) para aquellos que requieren un enfoque más amplio, identificar las regiones fuera del área de la IVP cuya ablación reducirá de manera más efectiva la recurrencia de la arritmia. Durante el ritmo sinusal, la ECGI sin imágenes ha demostrado la capacidad de generar mapas CV, que han demostrado ser útiles para predecir el éxito de la ablación de PVI17. Sin embargo, en este caso, el ECGI sin imágenes capturó los patrones dinámicos de la FA al mismo tiempo, proporcionando a los médicos una visión completa de cómo se propaga la FA y ayudando a identificar las regiones clave que impulsan la arritmia. El análisis de los resultados debe centrarse en la correlación entre los impulsores de la FA ablacionados con detección de ECGI sin imágenes y los criterios de valoración clínicos, como la supervivencia libre de arritmias a largo plazo, para validar aún más su utilidad en la optimización de las estrategias de ablación de la FA.
Caso 3 - Optimización de la estimulación biventricular guiada para la terapia de resincronización cardíaca
Se trata de una paciente femenina de 67 años con miocardiopatía dilatada no isquémica, FEVI del 25%, sin evidencia de realce tardío de gadolinio en la resonancia magnética preprocedimiento, con bloqueo de rama izquierda (BCRI) en el ECG basal y una duración del QRS de 156 ms. El paciente fue indicado para estimulación biventricular (BiVP) como parte de la TRC.
Durante el procedimiento de TRC cardíaca, se utilizó ECGI sin imágenes en tiempo real para evaluar la sincronización ventricular antes y después de la implantación del marcapasos. Al ritmo basal, la región de activación más reciente del paciente se identificó en la pared basal-lateral del ventrículo izquierdo (VI), como se muestra en la figura 11A. El tiempo total de activación ventricular (TAT) se midió a 116 ms, lo que indica una asincronía ventricular significativa. Se evaluaron diferentes configuraciones de dispositivos mediante ECGI, y se determinó que la configuración óptima era BiVP mediante la activación simultánea de los polos distal y proximal del cable del VI y un retraso auriculoventricular de 140 ms. Como se muestra en la Figura 11B, los tres puntos de estimulación ventricular no dieron lugar a regiones de activación tardía, lo que indica una sincronización exitosa, con un TAT mejorado de 70 ms.
La terapia de resincronización cardíaca tiene como objetivo restaurar la coordinación eléctrica en los ventrículos y mejorar la función cardíaca en pacientes con insuficiencia cardíaca y QRS prolongado. En este caso, Imageless ECGI proporcionó un mapeo en tiempo real que fue clave para guiar la optimización de BiVP durante el procedimiento de CRT. Permitió una evaluación precisa de los patrones de activación ventricular y ayudó a identificar la configuración óptima del dispositivo, asegurando una sincronización ventricular completa. La naturaleza no invasiva y la retroalimentación inmediata de la ECGI permitieron a los médicos refinar la programación de derivación. Por el contrario, si bien los estudios destacan el valor de la ECGI para guiar la colocación del cable ventricular izquierdo cerca de la región30 activada más reciente, las restricciones anatómicas pueden limitar su aplicabilidad. Los parámetros de resincronización basal y final determinados por ECGI, como el TAT, deben relacionarse con los resultados clínicos mediante el seguimiento de la respuesta clínica del paciente a la TRC a lo largo del tiempo, incluida la mejoría de los síntomas y la función ventricular a largo plazo.
Caso 4 - Implante de estimulación del sistema de conducción guiado para la terapia de resincronización cardíaca en tiempo real
Se trata de una paciente femenina de 45 años con disfunción ventricular severa (FEVI 15%) y BCRI con una duración del QRS de 172 ms. Al paciente se le indicó un desfibrilador cardiovertido implantable CRT mediante un enfoque de estimulación del sistema de conducción (CSP).
Se utilizó ECGI sin imágenes en tiempo real durante la implantación del dispositivo para monitorear la sincronía ventricular durante todo el proceso de atornillado del electrodo en la región septal. Como se muestra en la Figura 12, el mapa de ECGI de línea base identificó la pared lateral del VI como el área activada más reciente, con un TAT de 133 ms. El mapeo de ECGI latido a latido durante el atornillado del electrodo demostró mejoras progresivas en la sincronía ventricular, con una sincronización óptima lograda al llegar a la rama izquierda del haz, lo que resultó en un TAT de 95 ms.
Este caso demostró el potencial del ECGI sin imágenes en tiempo real para guiar la implantación de LBBP durante un procedimiento de TRC. Sus capacidades de mapeo en tiempo real de un solo latido permitieron el análisis de la TAT ventricular y la resincronización en cada paso de la implantación de cables en la región septal. El sistema proporcionó una métrica rápida, visual y fácil de interpretar, abordando la falta de estandarización en los criterios electrocardiográficos de CSP. Al igual que en los procedimientos BiVP-CRT, se necesitan más estudios para determinar si los parámetros de ECGI sin imágenes se correlacionan significativamente con la respuesta clínica de CRT y cómo se comparan con los predictores de ECG de 12 derivaciones.
Caso 5 - Planificación y orientación de la ablación con catéter de la taquicardia ventricular
Se trata de un paciente masculino de 53 años (IMC 25,4) con miocardiopatía isquémica, disfunción ventricular grave (FEVI 15%) y NYHA clase II que fue remitido para un procedimiento de ablación con catéter por TV recurrente. La resonancia magnética previa al procedimiento reveló fibrosis endocárdica extensa y canales arritmogénicos localizados en los segmentos infero-basal e infero-medial del ventrículo izquierdo. El paciente tenía antecedentes de ablación con catéter VT en 2018.
Se realizó un mapeo simultáneo de ECGI sin imágenes (Figura 13A) y EAM invasivo (Figura 13B) durante todo el procedimiento. El proceso de ablación con catéter implicó un mapeo basado en sustrato durante la estimulación apical del ventrículo derecho (VD) y la inducción de TV mediante estimulación programada. El ECGI sin imágenes identificó una región de enlentecimiento de la conducción en el segmento infero-basal del VI durante el mapeo del ritmo sinusal antes de la introducción del catéter. Este hallazgo fue consistente con la fibrosis observada en la resonancia magnética. La estimulación posterior desde el ápex del ventrículo derecho (VD) confirmó un enlentecimiento de la conducción en los segmentos basal y medial del VI, identificando esta área como el probable sustrato arritmogénico. Se indujo brevemente una TV con un ciclo de 380 ms, que requirió cardioversión debido a la inestabilidad hemodinámica. En consecuencia, solo se adquirió un número limitado de puntos EAM. Sin embargo, utilizando un solo ciclo de TV, la ECGI sin imágenes identificó con éxito el istmo de la TV en la misma región donde se observó el hacinamiento isócrono en los mapas de ritmo.
El uso de la ECGI sin imágenes en tiempo real en este caso de TV abordó con éxito dos desafíos clínicos importantes en el manejo de la TV: (1) la localización precisa de los posibles objetivos de ablación durante el ritmo sinusal y (2) la caracterización de la TV con inestabilidad hemodinámica. A partir de un solo latido, el istmo de la TV se identificó con precisión tanto en el sustrato como en los mapas de activación de arritmias. El sistema permitió a los operadores identificar sustratos arritmogénicos antes o durante la ablación y caracterizar múltiples VT inducibles en tiempo real a partir de un solo ciclo.

Figura 1: Componentes de hardware de ECGI sin imagen. (A) Amplificador bipotencial con puertos de conexión de cable específicos. (B) Cables derecho e izquierdo, equipados con conectores de amplificador en un extremo y conectores de enchufe de chaleco de sensor en el otro. (C) Configuración que muestra los cables derecho e izquierdo conectados al amplificador bipotencial. (D) Flujo de trabajo esquemático del procedimiento para conectar el chaleco sensor a las tomas de cable. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento del escáner de reconstrucción 3D del torso. (A) El chaleco sensor de potencial de superficie corporal de 128 derivaciones, que consta de cuatro componentes (Frente-Derecha, Frente-Izquierda, Atrás-Derecha, Atrás-Izquierda), se coloca en el torso del paciente antes de la reconstrucción 3D. Cada electrodo tiene un código QR único para la identificación automática. Las conexiones entre los electrodos se pueden plegar para acomodar el chaleco a la forma del cuerpo del paciente. (B) El código QR en el componente delantero derecho valida el chaleco, lo que permite que la aplicación del escáner 3D inicie la reconstrucción del torso. (C) La plataforma de escáner 3D a través de la aplicación de escáner 3D, genera el torso reconstruido utilizando una cámara de luz estructurada infrarroja. Abreviaturas: FR: frente-derecha; FL: frente a la izquierda; BR: atrás a la derecha; y BL: atrás-izquierda. Haga clic aquí para ver una versión más grande de esta figura.
Figura 3: Pantalla de inicio de sesión de la interfaz de usuario ECGI sin imágenes que requiere un nombre de usuario y una contraseña designados para el acceso al software. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ventana de inicio. La ventana de inicio permite la gestión de pacientes, médicos y usuarios, así como la configuración de las sesiones de los pacientes. También muestra información sobre las sesiones importadas y el estado del sistema y del amplificador. Haga clic aquí para ver una versión más grande de esta figura.
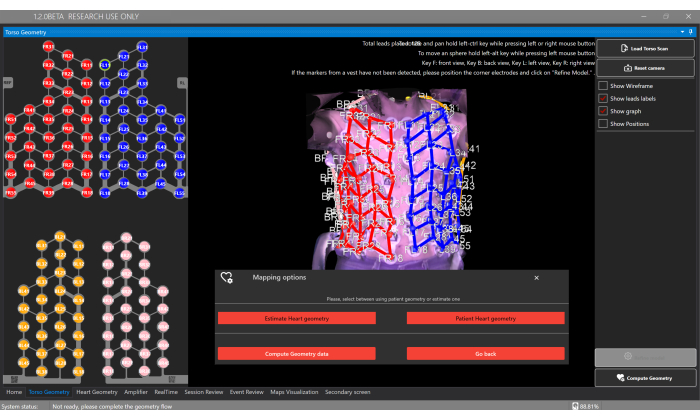
Figura 5: Ventana de geometría del torso. La ventana Geometría del torso permite a los usuarios cargar y ver el modelo 3D del torso, segmentar los electrodos y seleccionar el tipo de geometría del corazón a través del botón Calcular geometría , que permite la estimación o proporciona una segmentación a partir de una tomografía computarizada / resonancia magnética personalizada. Haga clic aquí para ver una versión más grande de esta figura.
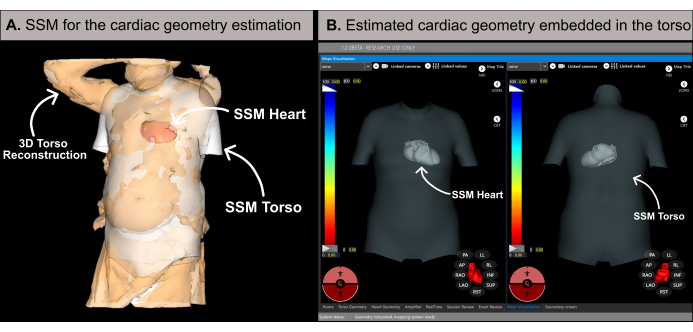
Figura 6: Estimación de la geometría cardíaca. (A) Algoritmo SSM que utiliza las características basales y la reconstrucción 3D del torso del paciente para estimar la geometría cardíaca. (B) Geometría cardíaca estimada dentro del SSM del torso que muestra vistas antero-posterior (lado izquierdo) y postero-anterior (lado derecho). Abreviaturas: 3D: tridimensional; SSM: modelo estadístico de forma. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Ventana del amplificador. La ventana del Amplificador permite la visualización en tiempo real de las señales que se están obteniendo de cada electrodo del Sensor Vest. Haga clic aquí para ver una versión más grande de esta figura.
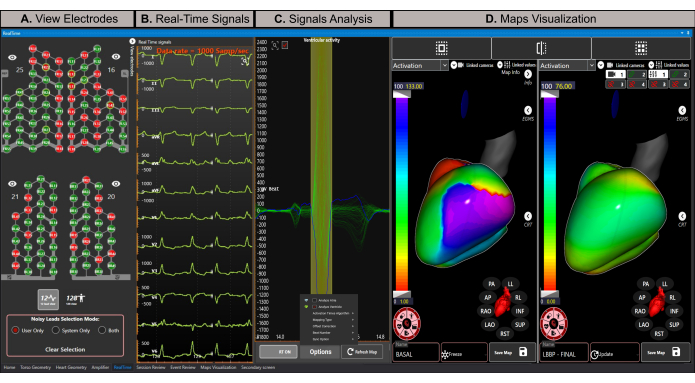
Figura 8: Ventana en tiempo real. (A) Representación esquemática de los cables activos del chaleco de guía de electrodos de alta densidad. Los electrodos verdes contienen señales de buena calidad, mientras que los electrodos rojos contienen señales ruidosas y no participan en el cálculo del problema inverso. (B) Estimación de las 12 derivaciones del electrocardiograma en tiempo real. (C) Activación automática y delineación del inicio y desplazamiento del complejo QRS (ventana de color verde). La señal promedio de todos los prospectos que participan en el cálculo del mapeo se muestra en azul. (D) La sección de visualización de mapas admite vistas de mapa simples, dobles o cuatro. En este ejemplo se muestra una vista de mapeo dual con mapas de activación para los estados de estimulación de rama basal e izquierda (mapa final) durante un procedimiento CRT. El mapa basal está en modo de congelación, permaneciendo estático, mientras que el mapa final está en modo de actualización, recalculando con cada complejo QRS recién analizado. Haga clic aquí para ver una versión más grande de esta figura.
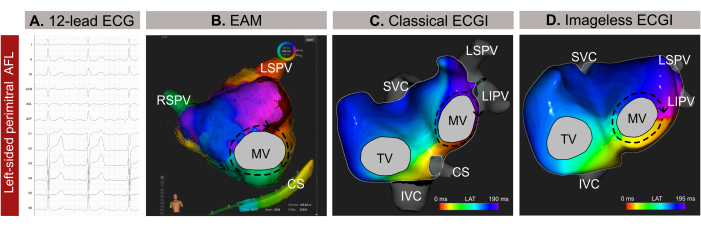
Figura 9: Ejemplo gráfico de una AFL atípica del lado izquierdo y las diferentes capacidades diagnósticas del ECG de 12 derivaciones, la ECGI sin imagen y la EAM invasiva. (A) Las señales de ECG de 12 derivaciones de la AFL atípica presentan ondas supraventriculares positivas en V1. (B) ECGI sin imagen utilizando una geometría cardíaca estimada a partir de un MUS y mostrando una vista antero-posterior. El circuito de propagación muestra todos los colores alrededor del MV, un patrón típico para un AFL perimitral. (C) El mapeo de activación local derivado de EAM y que muestra una vista antero-posterior muestra una macro-reentrada alrededor de la MV, confirmando el diagnóstico del ECGI sin imagen. Abreviaturas: ECG: electrocardiograma; EAM: mapeo electroanatómico; ECGI: imágenes electrocardiográficas. VCS: vena cava superior; VCI: vena cava inferior; CS: seno coronario; LSPV: vena pulmonar superior izquierda; RIPV: vena pulmonar inferior derecha; RSPV: vena pulmonar superior derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Seguimiento de la evolución del sustrato auricular durante la ablación con catéter de FA mediante mapeo no invasivo de ECGI sin imágenes. (A) Vistas postero-anteriores, antero-postero y laterales derechas de ECGI sin imágenes, con sitios de PFA marcados con círculos verdes. El mapa de PS de referencia destaca las reentradas en la pared lateral de la AR, la base de la RAA, la pared posterior de la LA y la base de la LAA. La PFA en la base de la LAA cambió el ritmo a la AFL perimitral. A pesar de completar la línea mitral y el aislamiento de la pared posterior, la FA fue inducida espontáneamente de nuevo. El ECGI reveló PS en la base RAA, que se convirtió en el objetivo de la ablación. Se realizaron múltiples aplicaciones de PFA en esa área y se restableció el ritmo sinusal. (B) El ECG de 12 derivaciones y las señales intracardíacas en el momento de la FA cambiaron a SR. Abreviaturas: VCS: vena cava superior; VCI: vena cava inferior; LPVs: venas pulmonares izquierdas; RPV: venas pulmonares derechas; FA: fibrilación auricular, SR: ritmo sinusal, PS: singularidades de fase, LAT: tiempos de activación local, TV: válvula tricúspide, VM: válvula mitral, PVI: aislamiento de la vena pulmonar, AFL: aleteo auricular, PW: pared posterior y PFA: ablación de campo pulsado. Haga clic aquí para ver una versión más grande de esta figura.
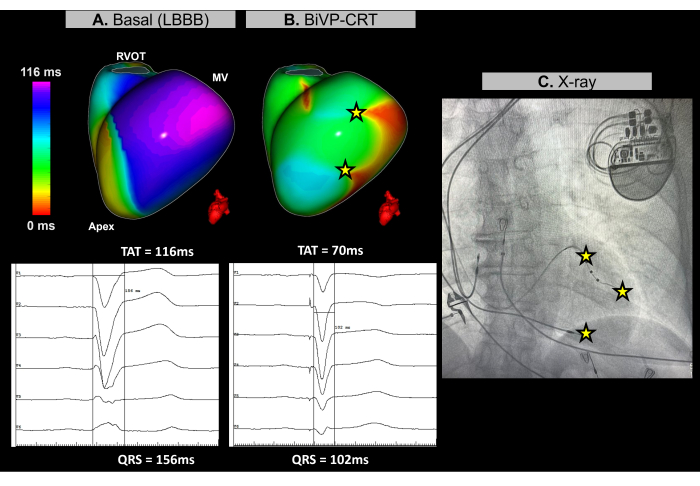
Figura 11: Optimización de la estimulación biventricular mediante ECGI sin imagen. (A) Ritmo basal del paciente. El mapa de ECGI sin imágenes (vista lateral izquierda) revela una región de activación tardía (púrpura) en la pared lateral del VI, con un TAT de 116 ms, lo que indica disincronía ventricular. Esto se alinea con el ECG basal, que muestra un complejo QRS amplio (156 ms) con un patrón de BCRI. (B) Configuración post-implante del marcapasos. Después de la BiVP con activación simultánea de los polos distal y proximal de la derivación del VI y un retraso auriculoventricular de 140 ms, el mapa de ECGI sin imágenes no muestra regiones de activación retardada (sin área púrpura), lo que indica una activación ventricular sincrónica y un TAT reducido de 70 ms. Esto es consistente con el complejo QRS acortado que se observa en el ECG final, donde la duración del QRS disminuye a 102 ms. (C) Vista radiográfica antero-posterior del marcapasos implantado, que muestra la ubicación de los electrodos del marcapasos. La actividad de estimulación de los polos distal y proximal de la derivación del VI también se refleja en el mapa ECGI. Abreviaturas: BCRI: bloqueo de rama izquierda, BiVP: estimulación biventricular, TRC: terapia de resincronización cardíaca, TSVD: tracto de salida del ventrículo derecho, VM: válvula mitral, TAT: tiempo total de activación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12: Evaluación no invasiva de la TRC mediante estimulación del sistema de conducción mediante ECGI sin imagen. (A) Ritmo basal del paciente. El mapa ECGI (vista lateral izquierda) indica una región de activación retardada (púrpura) en la pared lateral del VI, con un TAT de 133 ms, lo que sugiere disincronía ventricular. Esto se corresponde con el ECG basal, que muestra un complejo QRS amplio (172 ms) típico del BCRI. (B) Fase intermedia (estimulación septal media) durante la implantación del electrodo LBBP. El mapa no invasivo muestra una corrección parcial de la región retardada en el VI, con el cambio de color de púrpura a azul. Esto se acompaña de una reducción de la duración del complejo QRS. (C) La posición final del cable LBBP durante el proceso de atornillado. El mapa muestra una corrección completa del área retrasada, con la transición de color de púrpura a verde, lo que indica la activación sincrónica de ambos ventrículos. Abreviaturas: BCRI: bloqueo de rama izquierda, LBB: rama izquierda, TSVD: tracto de salida del ventrículo derecho, VM: válvula mitral, TAT: tiempo total de activación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13: Evaluación no invasiva del istmo de TV mediante ECGI sin imagen. (A) El mapeo de ECGI sin imágenes durante el procedimiento de ablación de TV identifica el sustrato arritmogénico y el istmo de TV en las regiones infero-basal e infero-medial del VI. La primera fila corresponde al ritmo sinusal, la fila del medio a la estimulación apical del VD y la fila inferior a la TV. (B) El EAM invasivo obtenido durante el procedimiento de ablación de VT muestra un mapeo de activación isócrona en las mismas regiones identificadas por ECGI. La fila superior corresponde a la estimulación apical del VD, mientras que la fila inferior representa el VT. Abreviaturas: VD: ventrículo derecho, VI: ventrículo izquierdo, SR: ritmo sinusal, TSVD: tracto de salida del ventrículo derecho, VM: válvula mitral, TV: válvula tricúspide. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Esta descripción metodológica destaca la utilidad clínica de un abordaje de ECGI no invasivo, de un solo latido y en tiempo real, que puede respaldar una variedad de procedimientos electrofisiológicos, como la ablación con catéter y la TRC, sin la necesidad de imágenes cardíacas previas al procedimiento como TC o RM 15,17,31,32 En este informe, Imageless ECGI demuestra características técnicas clave que pueden promover su adopción clínica. Si bien el ECGI ya ha demostrado ser una herramienta poderosa para el mapeo cardíaco en una amplia gama de arritmias 19,33,34,35,36, continúa enfrentando varios desafíos clínicos y técnicos 13,14.
Los sistemas clásicos de ECGI necesitan una tomografía computarizada específicamente el mismo día que el mapeo cardíaco, con los electrodos de ECGI en su lugar 9,10,12,37,38. Este enfoque agrega tiempo adicional debido a la necesidad de segmentación de la tomografía computarizada (corazón y electrodos), lo que retrasa la generación del mapa ECGI inicial en aproximadamente 1-3 h. Por el contrario, el sistema de ECGI sin imagen presentado en este informe utiliza una exploración infrarroja 3D del tórax con electrodos de matriz de alta densidad, que puede realizarse solo minutos antes del procedimiento o durante las consultas médicas15,17. El sistema segmenta automáticamente los electrodos torácicos y estima la geometría cardíaca del paciente, lo que agiliza el proceso de mapeo cardíaco no invasivo y reduce significativamente el tiempo entre la llegada del paciente y la disponibilidad del primer mapa ECGI. La validación previa del enfoque de ECGI sin imágenes ha demostrado que el uso de la geometría cardíaca estimada introduce errores mínimos, manteniendo la precisión de los mapas no invasivos. En los pacientes con FA, se observó una fuerte correlación entre las señales de ECGI derivadas de las geometrías cardíacas estimadas frente a las reales, incluso con traducciones geométricas15. En el caso de las arritmias regulares, como la taquicardia auricular compleja, las comparaciones con EAM demostraron una alta precisión en la identificación de la cámara cardíaca afectada, la determinación del mecanismo (focal o reentrante) y la inferencia del objetivo de ablación31. En el caso de la TV, se ha evaluado el abordaje para guiar a los operadores hacia áreas de istmos de TV durante el ritmo sinusal (RS)39, lo que muestra el potencial para identificar a los pacientes con riesgo de TV en la prevención primaria. Además, se observó una fuerte congruencia regional entre los mapas de activación de ECGI y EAM sin imagen durante la estimulación del seno coronario, particularmente en los sitios de activación temprana y tardía40.
En la TRC, los cambios morfológicos en tiempo real en el ECG de 12 derivaciones se utilizan normalmente para confirmar la resincronización durante la implantación de la derivación, especialmente en los procedimientos de CSP en los que el ECG se evalúa en varias etapas de la colocación de la derivación septal hasta que se alcanza el área del LBB. Sin embargo, los algoritmos de ECG publicados suelen ser complejos, muestran diferencias significativas entre ellos y, en algunos casos, son difíciles de implementar en la práctica clínica 41,42,43. Posiblemente debido a esta complejidad, no se ha identificado de manera consistente ningún parámetro electrocardiográfico específico para la estimulación de la rama izquierda (LBBP) que pueda predecir de manera confiable si un paciente responderá a la resincronización cardíaca. El abordaje de ECGI sin imágenes en tiempo real ofrece un mapeo simple y detallado, latido a latido, a lo largo de la implantación de electrodos, evaluando la corrección de la disincronía mediante la evaluación de parámetros como el tiempo de activación del ventrículo izquierdo, como se demostró en pacientes con indicación de TRC32 o aquellos con bloqueo AV44. Por lo tanto, con más investigación, los parámetros de ECGI en tiempo real podrían guiar a los operadores en la optimización de la ubicación del implante de cables o en la predicción de la respuesta del paciente a la TRC.
Aunque en este informe metodológico se ha presentado el potencial de la ECGI sin imágenes en tiempo real, otros nuevos enfoques de mapeo no invasivos que utilizan simulaciones de arritmias también han tenido como objetivo eliminar la necesidad de imágenes previas al procedimiento. El estudio de Mapeo Vectorcardiográfico de la Probabilidad Arritmogénica (VMAP) demostró una precisión regional significativa en la identificación de los sitios de arritmia ventricular45 y se muestra prometedor en la identificación de la ubicación de los impulsores de la FA más allá de la ablación no VPI46. VMAP utiliza el ECG de 12 derivaciones en combinación con múltiples modelos computacionales para identificar objetivos de arritmia sin depender de datos geométricos específicos del paciente. Sin embargo, este enfoque puede ser subóptimo para arritmias auriculares como la FA, donde los componentes de alta frecuencia en el ECG de superficie son cruciales para identificar los impulsores de la arritmia de forma no invasiva. Estos componentes suelen ser captados por electrodos en las superficies posterior y anterolateral27, que no están representados en el ECG estándar de 12 derivaciones utilizado en la práctica clínica.
A pesar de la necesidad de más investigación clínica, el ECGI sin imágenes en tiempo real tiene el potencial de convertirse en una herramienta valiosa para el mapeo cardíaco no invasivo en una amplia gama de arritmias. Su simplicidad metodológica y la simplificación del flujo de trabajo de los pacientes en los entornos hospitalarios permiten a los médicos recopilar más datos clínicos, lo que podría mejorar tanto los resultados de los pacientes como los futuros avances tecnológicos. En conclusión, el futuro del mapeo cardíaco no invasivo radica en avanzar hacia un enfoque totalmente sin imágenes, que permita una integración más rápida y fluida en la práctica clínica diaria, desde las consultas rutinarias hasta el mapeo en tiempo real durante los procedimientos electrofisiológicos.
Divulgaciones
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG y AMC recibieron honorarios de Corify Care SL. AMC, MSG y FA son cofundadores de Corify Care SL y JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG y AMC son accionistas. TFA ha recibido becas de investigación de Biosense-Webster. IRL ha recibido honorarios como conferencista y consultor de Abbott y Biosense-Webster. APS ha recibido honorarios de orador y consultor de Bisosense-Webster, Abbott y Boston-Scientific. JMT ha recibido honorarios como conferencista y consultor de Abbott, Boston-Scientific y Medtronic. EA ha recibido honorarios de ponente y consultor de Biosense-Webster y Bayer. LM reporta honorarios como consultor, conferencista y miembro del Consejo Asesor de Boston-Scientific, Abbott, Johnson & Johnson y Medtronic, y es accionista de Galgo Medical SL. JBG reporta honorarios como consultor y orador de Microport CRM y Abbott, además de apoyo de subvenciones sin restricciones para una beca de Abbott. MPL ha recibido honorarios de orador de Medtronic.
Agradecimientos
Esta investigación ha sido financiada por el Instituto Europeo de Innovación y Tecnología (EIT) bajo el convenio de subvención SAVE-COR Nº 220385 y por la subvención CIAICO/2022/020 financiada por la Generalitat Valenciana (EFICACIA). El apoyo adicional provino de la Generalitat Valenciana (subvención CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 y FSE Investing in Your Future (subvención RYC2018-024346-I), Instituto de Salud Carlos III (subvención CIBERCV16 CB16/11/00354) y Cataluña, España (subvención 2021_SGR_01350, SGR21/GENCAT). También agradecemos el apoyo del Programa CERCA/Generalitat de Catalunya. MPL financiado (2023-2025) a través de un contrato Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FSE)]. Los autores agradecen a Neus Portella y Sheila Marco su apoyo secretarial, y a los equipos médicos y de enfermería su apoyo clínico en el Hospital Clínic de Barcelona, Hospital General Universitario Gregorio Marañón, Hospital Universitari i Politècnic La Fe. También se extienden gracias a Almudena Albertos de Corify Care SL, Madrid, España y Arantxa Carrasco de la Universitat Politècnica de València.
Materiales
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Referencias
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados