Method Article
Visualização bidimensional de super-resolução da microvasculatura cerebral de ratos usando microscopia de localização por ultrassom
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para microscopia de localização por ultrassom (ULM), que atinge resolução espacial de 12,5 μm para obter imagens da microvasculatura cerebral em ratos. Ele permite a visualização detalhada da direção e velocidade do fluxo sanguíneo, oferecendo uma ferramenta poderosa para o avanço dos estudos da circulação cerebral e distúrbios vasculares.
Resumo
A microvasculatura cerebral forma uma rede complexa de vasos essenciais para manter a função cerebral. Doenças como acidente vascular cerebral, doença de Alzheimer, gliomas e demência vascular podem perturbar profundamente o sistema microvascular. Infelizmente, as modalidades atuais de imagens médicas oferecem apenas observações indiretas nessa escala. Inspirada na microscopia óptica, a microscopia de localização por ultrassom (ULM) supera o trade-off clássico entre profundidade de penetração e resolução espacial. Ao localizar e rastrear microbolhas injetadas individuais (MBs) com precisão de subcomprimento de onda, mapas vasculares e de velocidade podem ser gerados na escala micrométrica. Aqui, apresentamos um protocolo robusto para imagens de super-resolução da microvasculatura cerebral in vivo em ratos usando uma plataforma de ultrassom comercial. Este método atinge resolução espacial de 12,5 μm, reconstruindo a arquitetura microvascular e fornecendo informações detalhadas sobre a direção e velocidade do fluxo sanguíneo, melhorando muito nossa compreensão da microcirculação cerebral. O protocolo pode ser estendido a modelos de doenças de ratos, oferecendo uma ferramenta poderosa para o diagnóstico precoce e tratamento de doenças neurovasculares.
Introdução
A microvasculatura cerebral, composta por capilares, arteríolas e vênulas, é essencial para manter a função cerebral, facilitando o fornecimento de nutrientes, a troca de oxigênio e a remoção de resíduos 1,2. Interrupções nessa rede estão implicadas em distúrbios neurológicos, como acidente vascular cerebral3, doença de Alzheimer4, gliomas5 e demência vascular6, levando a deficiências na fisiologia cerebral. As alterações microvasculares frequentemente precedem o início dos sintomas clínicos, tornando-as um alvo crítico para intervenções diagnósticas e terapêuticas 7,8. Uma compreensão abrangente das alterações vasculares nos níveis estrutural e funcional é fundamental para o avanço das estratégias de pesquisa e tratamento.
No entanto, a imagem da microvasculatura cerebral é particularmente desafiadora devido ao tamanho pequeno e à localização parcialmente profunda dentro do cérebro. As modalidades convencionais de imagem, como ressonância magnética (RM)9 e tomografia computadorizada (TC)10, embora adequadas para capturar alterações vasculares em grande escala, oferecem uma resolução espacial (~100 μm) que é muito grosseira para visualizar pequenos vasos. Métodos ópticos como a microscopia de dois fótons11 fornecem excelente resolução espacial (até 1 μm) para obter imagens de capilares individuais, mas são prejudicados pelo campo de visão limitado e profundidade de penetração (menos de 1 mm), restringindo sua capacidade de obter imagens de regiões cerebrais profundas. Como uma técnica baseada em ultrassom, o Doppler12, embora ofereça avaliação do fluxo sanguíneo em tempo real, permanece limitado por uma resolução de 50-200 μm, insuficiente para detalhes microvasculares. No geral, nenhum método único atende atualmente ao duplo requisito de alta resolução espacial e penetração cerebral suficiente necessária para imagens de microvasculatura cerebral.
Inspirada na microscopia óptica 13,14, a microscopia de localização ultrassônica (ULM) permite a visualização de estruturas finas na escala de mícrons, localizando microbolhas (MBs) injetadas individualmente e rastreando seu deslocamento com resolução de comprimento de onda15. Ele ignora o compromisso clássico entre penetração e resolução na imagem de ultrassom16. Este estudo detalha um protocolo robusto para implementar o ULM em um modelo de rato vivo e, assim, permitir imagens de super-resolução da microvasculatura cerebral por meio da plataforma de ultrassom disponível comercialmente. O protocolo não apenas fornece uma reconstrução abrangente da estrutura microvascular, mas também fornece informações detalhadas sobre a direção e a velocidade do fluxo sanguíneo, o que não é possível com as técnicas convencionais de imagem. Embora o protocolo tenha sido validado em ratos normais, ele é extensível a modelos de doenças em ratos, oferecendo possibilidades para estudos personalizados em diferentes condições patológicas.
Protocolo
Todos os experimentos em animais realizados neste trabalho são aprovados pelo Comitê de Ética da Universidade de Fudan (Número de Aprovação: 2022JS-004). O protocolo segue rigorosamente as diretrizes de cuidados com os animais da Universidade de Fudan para garantir o tratamento humano dos animais. Antes do início experimental, os ratos devem ter um período de 1 semana para aclimatação ambiental, durante o qual recebem ração e água suficientes. O fotoperíodo é cuidadosamente regulado de acordo com seus ritmos biológicos para garantir a manutenção de estados fisiológicos normais. No final do experimento, a eutanásia é realizada com uma overdose de isoflurano inalado.
NOTA: A configuração experimental é mostrada na Figura 1A-H.
1. Preparação animal para imagens ULM
- Anestesia
- Induza a anestesia no rato administrando uma mistura de isoflurano a 3,5% e oxigênio a 100% a uma taxa de fluxo de 3 L / min. Após aproximadamente 4 min, retire o animal da câmara e coloque-o de bruços sobre uma plataforma de imagem pré-aquecida a 37 °C. Confirme a profundidade da anestesia pela ausência de um reflexo de retirada na pinça firme do dedo do pé do membro posterior do rato.
- Coloque o nariz do rato em uma máscara respiratória conectada ao sistema de anestesia. Mantenha uma sedação estável administrando uma mistura de 1,5% de isoflurano e 100% de oxigênio a uma taxa de fluxo de 1,5 L / min.
NOTA: Os métodos e dosagens de anestesia seguem rigorosamente as diretrizes do fabricante.
- Preparação pré-cirúrgica do animal
- Prenda os incisivos superiores do rato no entalhe da barra incisiva, posicionando a mandíbula inferior abaixo da barra. Use barras auriculares para estabilizar a cabeça do rato, posicionando-as na reentrância óssea ligeiramente anterior e superior ao canal auditivo (palpável com a mão), garantindo que toda a superfície craniana permaneça horizontal (Figura 1A).
- Sonde suavemente a estabilidade da fixação aplicando uma pequena quantidade de pressão em diferentes partes da cabeça. Certifique-se de que não haja movimento ou deslizamento da posição original.
- Ajuste a altura da plataforma de imagem e ajuste meticulosamente o ângulo da cabeça do rato levantando ou abaixando o entalhe da barra incisiva para garantir uma respiração desobstruída.
- Aplique pomada de eritromicina ou solução de glicerina a 30% nos olhos do rato para evitar danos causados pela exposição prolongada a luzes cirúrgicas e para manter os olhos úmidos sob anestesia. Além disso, use uma pinça de ponta redonda para puxar suavemente a língua do rato para um lado da boca para evitar asfixia durante a cirurgia.
- Use um aparador elétrico portátil e raspe a cabeça do rato na direção contrária ao crescimento do cabelo (de trás para a frente), geralmente entre as orelhas, dos olhos até o início do pescoço (Figura 1B). Limpe a área raspada com solução de iodo a 1% para se preparar para a incisão cirúrgica.
- Craniotomia de rato
- Faça uma incisão ao longo da sutura sagital do crânio do rato, começando logo atrás do osso occipital e estendendo-se aproximadamente 4 cm anteriormente. Use hemostáticos para retrair a pele em ambos os lados (Figura 1C). Opcionalmente, excise totalmente a pele sobre o crânio para fornecer maior acesso cirúrgico, mas isso pode aumentar o risco de infecção.
- Use uma tesoura pequena para remover o periósteo do crânio, expondo totalmente a camada óssea dura.
- Realize a craniotomia usando uma mini broca craniana portátil equipada com uma broca esférica (Figura 1D). Comece com uma broca grossa (2,5 mm de diâmetro) e bata suavemente para lixar o osso, aplicando a broca por 2-3 s de cada vez. Comece na área central e progrida em direção às áreas mais grossas nas laterais.
NOTA: O sangramento excessivo durante a craniotomia afeta a circulação sanguínea, resultando em falta de reconstrução vascular nas áreas corticais (Figura 1H). - Faça uma pausa a cada 2-3 s para evitar superaquecimento e, a cada 2 minutos, injete aproximadamente 1 mL de NaCl a 0,9% na área de perfuração usando uma seringa para resfriar e enxaguar os detritos.
- Quando o tecido ósseo branco não parecer mais conectado de forma consistente, mude para uma broca mais fina (1 mm de diâmetro). Continue perfurando até que os principais vasos sanguíneos centrais sejam claramente visíveis como marrom escuro e a área circundante pareça rosa, com microvasos visíveis ligeiramente avermelhados (Figura 1F).
NOTA: A faixa final de craniotomia é de Bregma +3 mm a Lambda ântero-posterior e 7 mm de cada lado ao longo da linha média do crânio (Figura 1E). Após a conclusão da cirurgia, deixe o rato descansar por aproximadamente 10 minutos para garantir condições fisiológicas relativamente estáveis antes de iniciar a coleta de dados.
2. Configuração antes da coleta de dados
- Preparação e injeção do agente de contraste
- Dissolva o agente de contraste (um frasco contendo 59 mg de gás SF6 e 25 mg de pó liofilizado), de acordo com as diretrizes oficiais, em 5 mL de NaCl a 0,9%. Agite vigorosamente a mistura para formar uma suspensão MB. A concentração final de SF6 na suspensão é de 8 μL/mL.
- Retire 0,8 mL da suspensão MB em uma seringa de 1 mL e prenda-a a uma bomba de microinjeção programada para infundir a 100 μL / min.
- Insira uma agulha de demora de 26 G com um cateter conectado à veia da cauda do rato (Figura 1G).
- Selecionando o plano de imagem
- Monte uma sonda com frequência central de 15,625 MHz no braço manipulador do instrumento estereotáxico cerebral, equipada com uma pinça (faixa de movimento: vertical, horizontal e ântero-posterior até 80 mm; precisão de leitura: 0,1 mm).
- Posicione a sonda de ultrassom diretamente acima do cérebro do rato exposto. Aplique gel de acoplamento na superfície cerebral exposta para garantir a transmissão ideal do sinal.
- Abra a interface principal do software, que integra um atlas do cérebro de ratos com programas de controle de movimento motor.
- Defina o ponto Bregma como a origem. A interface do software fornece uma exibição em tempo real da trajetória da sonda e a localização correspondente da fatia do cérebro do rato. Selecione o plano de imagem alvo; por exemplo, Bregma -1 mm.
3. Coleta de dados (tempo ~ 20 min)
NOTA: Verasonics (sistema de ultrassom) fornece os scripts MATLAB originais para uso com o sistema Vantage e não foi modificado.
- Inicialização do software
- Inicie o software MATLAB 2021a.
- Insira o script de aquisição de dados no MATLAB 2021a.
- No diretório raiz, digite activate na janela da linha de comando para ativar o ambiente de tempo de execução.
- Configuração de parâmetros e aquisição de sinais de RF
- Defina as profundidades inicial e final da coleta de dados em 5 e 120 comprimentos de onda, respectivamente, para capturar efetivamente a região de interesse.
NOTA: Os ajustes devem ser feitos com base no plano de imagem e no animal específico que está sendo estudado. - Defina os ângulos de direção da transmissão de ondas planas de -5° a 5° em incrementos de 2.5° para melhorar a resolução e o contraste da imagem.
NOTA: Ajuste essas configurações com base nos requisitos específicos de imagem e nas características do alvo. - Defina a tensão de transmissão para 20 V para garantir uma penetração adequada e uma relação sinal-ruído ideal para a região de interesse.
- Clique no botão Executar para iniciar a coleta de dados e salvar os sinais de radiofrequência (RF) no formato de arquivo .mat.
NOTA: Comece a coleta de dados 30 s após iniciar a bomba de microinjeção para garantir uma distribuição uniforme e estável de MB no corpo do rato.
- Defina as profundidades inicial e final da coleta de dados em 5 e 120 comprimentos de onda, respectivamente, para capturar efetivamente a região de interesse.
4. Processamento e análise de dados (Tempo ~ 8 h)
- Processamento de dados
- Importe os dados de RF para o MATLAB 2021a e demodule-os para gerar dados em fase e quadratura (I/Q) (consulte a Tabela de Materiais).
- Clique no botão Executar para utilizar o algoritmo Delay-and-Sum (DAS) para beamforming nos dados I/Q (consulte Tabela de materiais).
NOTA: Taxa de quadros pós-composição de 800 Hz, com um total de 120.000 quadros.
- Imagem ULM
- Aplique o algoritmo de filtragem espaço-temporal de Decomposição de Valor Singular (SVD)17 aos dados de QI para remover o ruído de fundo e a desordem. Cada 800 quadros é armazenado como um bloco de dados e o limite de SVD é definido como [15, 800].
- Localize o centro de cada MB usando o algoritmo de ajuste gaussiano18.
- Utilize o algoritmo de Kuhn-Munkres para rastrear trajetórias de MB em quadros consecutivos com base em suas posições (consulte a Tabela de Materiais).
- Mapeie as trajetórias de MB em uma grade com aumento de amostragem de 8x, usando um mapa de cores quente para exibir o número de trajetórias de MB e um mapa de cores de jato para codificar a velocidade do fluxo, mapeando a velocidade calculada em cada posição dentro da microvasculatura.
- Aplique um esquema de cores personalizado para distinguir as direções do fluxo para cima e para baixo, resultando em imagens de alta resolução para visualização aprimorada.
- Divida aleatoriamente as trajetórias MB originais em dois grupos para criar duas subimagens, execute uma transformada de Fourier em cada uma e calcule a Correlação do Anel de Fourier (FRC) como a correlação normalizada de seus espectros. Defina a resolução como o inverso da frequência espacial em que o FRC cai abaixo do limite19.
Resultados
A Figura 1 ilustra a configuração detalhada para imagens ULM microvasculares cerebrais in vivo em ratos, com cada elemento cuidadosamente projetado para minimizar a variabilidade experimental e garantir a aquisição de dados precisos para resultados confiáveis de imagem de super-resolução.
A Figura 2A mostra a estrutura reconstruída pelo ULM da microvasculatura no cérebro do rato, posicionada a -1 mm do ponto de Bregma, com uma profundidade de imagem próxima a 12 mm. A espessura efetiva do corte ao longo do plano de imagem varia de 0,1 mm a 0,3 mm. Tanto os microvasos mais rasos quanto os mais profundos são claramente visíveis e a qualidade da imagem não se deteriora com o aumento da profundidade (Figura 2B). Calculando a largura total na metade máxima (FWHM) da distribuição de intensidade ao longo da linha tracejada nas regiões de interesse (ROI), vasos de vários diâmetros podem ser detectados, sendo o menor de 13 μm (Figura 2C). Aplicando a correlação do anel de Fourier (FRC) para avaliação da resolução, a resolução espacial da imagem da microvasculatura do cérebro de rato é quantificada em 12,5 μm (Figura 2D).
As informações do fluxo sanguíneo são cruciais para refletir as respostas fisiológicas e diagnosticar doenças. A Figura 3A ilustra as direções do fluxo sanguíneo em uma fatia transversal do cérebro do rato, onde azul indica fluxo em direção à sonda e vermelho indica fluxo para longe da sonda. Com base nisso, regiões cerebrais específicas, como pequenas artérias no córtex fluindo para baixo e pequenas veias fluindo para cima, podem ser diferenciadas20 (Figura 3B). A Figura 3C mostra um mapa de velocidade do fluxo sanguíneo cerebral codificado em cores diferentes, com vasos maiores exibindo taxas de fluxo visivelmente mais altas. A distribuição das velocidades varia de 1 a 80 mm/s, concentrada predominantemente na faixa de 10-25 mm/s (Figura 3D), o que representa 81,57% de toda a faixa de velocidade. Essa proporção é calculada determinando o número de pontos de dados de velocidade dentro da faixa de 5 a 25 mm/s em relação ao número total de pontos de dados na matriz de velocidade.
A Figura 4 apresenta os resultados de imagem de um modelo de glioblastoma em rato utilizando o protocolo proposto. As células de glioblastoma C6 foram implantadas no cérebro de ratos. A Figura 4A mostra a estrutura microvascular no cérebro de um modelo de rato glioblastoma, com dilatação vascular anormal e irregularidades estruturais observadas ao redor do tumor. Os vasos da região tumoral apresentam maior tortuosidade em comparação com a área normal do lado esquerdo. A Figura 4B fornece informações sobre a direção do fluxo sanguíneo, permitindo uma compreensão dos padrões de fluxo dentro da região do tumor. A Figura 4C exibe um mapa de velocidade do fluxo sanguíneo, revelando heterogeneidade no fluxo vascular dentro e ao redor do tumor.
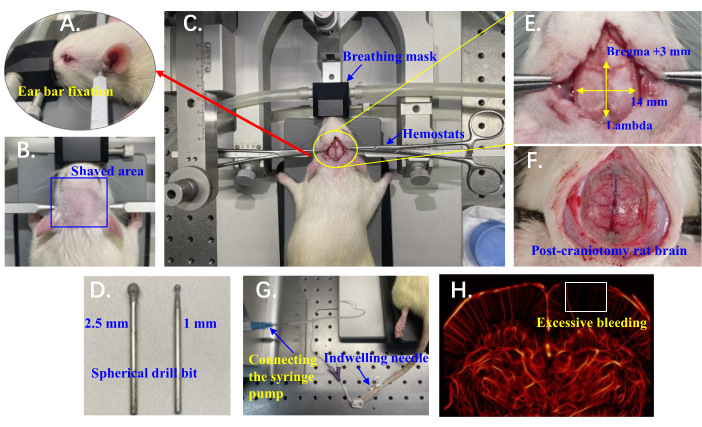
Figura 1: Detalhes da configuração experimental para imagens ULM in vivo da microvasculatura cerebral de ratos. (A) Posição das barras auriculares usadas para estabilizar a cabeça do rato. (B) A área raspada na cabeça do rato preparada para acesso cirúrgico. (C) Rato posicionado sobre o instrumento estereotáxico com máscara respiratória; Os hemostáticos são usados para retrair a pele em ambos os lados. (D) Brocas esféricas (2,5 mm e 1 mm) montadas na broca craniana para craniotomia. (E) Área de craniotomia marcada em relação a Bregma e Lambda. (F) Cérebro de rato exposto após craniotomia. (G) Uma agulha de demora inserida na veia da cauda do rato e conectada a uma bomba de seringa para microinjeção. (H) Exemplo de vasculatura cerebral de rato com sangramento excessivo; A caixa branca destaca uma região carente de reconstrução vascular. Clique aqui para ver uma versão maior desta figura.
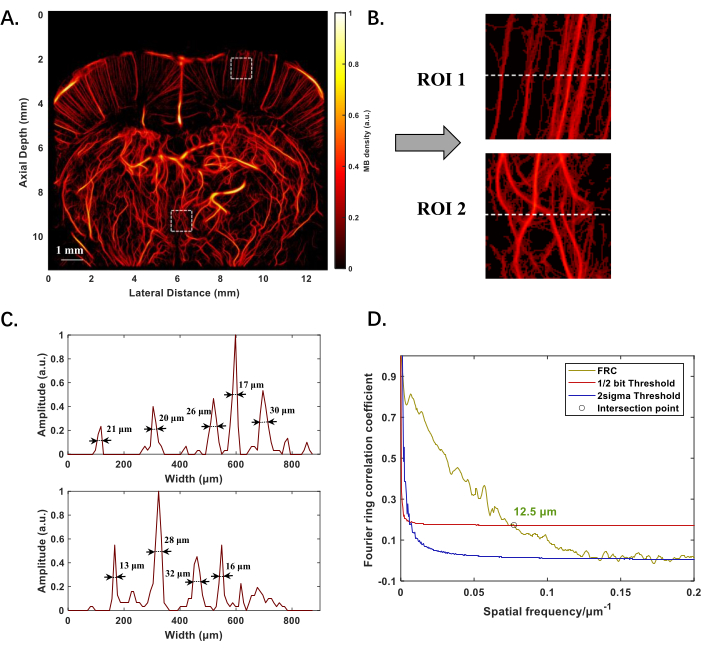
Figura 2: Resultados experimentais da reconstrução ULM da estrutura microvascular do cérebro de ratos in vivo. (A) Estrutura microvascular do cérebro do rato a -1 mm do ponto de Bregma. (B) Imagens ampliadas de duas regiões de interesse (ROI) em locais mais rasos e profundos em A, para destacar a morfologia de pequenos vasos. (C) Distribuição de intensidade ao longo da linha tracejada em B, com valores numéricos indicando diâmetros de vasos medidos usando largura total na metade do máximo (FWHM). (D) Avaliação do desempenho da reconstrução do ULM usando a técnica do anel de Fourier, o 1/2 bit foi escolhido para padronizar a resolução sem sacrificar a qualidade da imagem, que define a maior frequência espacial onde a correlação ainda indica informações estatisticamente significativas. O "○" marca o ponto de interseção da curva de correlação e o limite de 1/2 bit, indicando o limite de resolução. Clique aqui para ver uma versão maior desta figura.

Figura 3: Resultados experimentais da reconstrução ULM da direção e velocidade do fluxo sanguíneo microvascular no cérebro de ratos in vivo. (A) Direção do fluxo sanguíneo no cérebro do rato. Azul indica fluxo ascendente em direção à sonda e vermelho indica fluxo descendente para longe da sonda. (B) Pequenas artérias e veias nas regiões corticais do cérebro de ratos delineadas com base na direção do fluxo sanguíneo. (C) Velocidade do fluxo sanguíneo no cérebro do rato. (D) Histograma de velocidade do fluxo sanguíneo no cérebro de ratos, mostrando a distribuição de 1 mm / s a 80 mm / s. As barras azuis claras representam a faixa de velocidade de 5 a 25 mm/s. A linha vermelha representa a curva ajustada aos dados, ilustrando o perfil típico de distribuição de velocidade. Clique aqui para ver uma versão maior desta figura.

Figura 4: Resultados experimentais da reconstrução ULM da estrutura microvascular no modelo de glioblastoma cerebral de rato in vivo. (A) Estrutura microvascular do cérebro de rato. (B) Direção do fluxo sanguíneo no cérebro do rato. (C) Velocidade do fluxo sanguíneo no cérebro do rato. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo utilizou com sucesso o ULM para realizar imagens de super-resolução da microvasculatura cerebral de ratos in vivo. Em comparação com outras modalidades de imagem, o ULM acomoda simultaneamente a resolução espacial e a profundidade de penetração. O cérebro do rato exposto foi fotografado e não através do crânio, evitando atenuação e distorção causadas pela presença de osso. Sob um transdutor com frequência central de 15,625 MHz, foram captadas estruturas vasculares a uma profundidade de aproximadamente 12 mm, com resolução espacial de até 12,5 μm. A direção do fluxo sanguíneo facilitou a diferenciação de regiões específicas de pequenas artérias e veias. Além disso, a técnica suporta uma ampla gama de medições de velocidade de fluxo (1-80 mm/s).
A craniotomia realizada em ratos é fundamental neste protocolo. Durante a cirurgia, é essencial minimizar o sangramento excessivo. Por um lado, o sangramento excessivo pode afetar a circulação sanguínea, sendo uma manifestação típica a ausência de reconstrução vascular nas áreas corticais. Por outro lado, também pode causar alterações fisiológicas ou até mesmo a morte nos animais experimentais. O dispositivo estereotáxico usado no procedimento apresenta um programa de craniotomia automatizado que pode reduzir o trauma e aumentar a taxa de sucesso, mas depende muito da experiência do médico. Isso ocorre porque a determinação precisa da localização e profundidade do local da broca é necessária para evitar causar danos ou lesões secundárias ao cérebro do rato. Embora a craniotomia nem sempre seja necessária, a imagem transcraniana do ULM mostra-se promissora, mas requer algoritmos robustos de compensação ou correção de distorção. Além disso, uma bomba de microinjeção é empregada para administrar MBs de forma constante, garantindo que permaneçam esparsos e estáveis dentro do sistema vascular do rato. Essa abordagem é amigável para técnicas convencionais de localização, pois facilita reconstruções ULM de alta qualidade. No entanto, ele estende a aquisição de dados e a duração da imagem, tornando a imagem ULM um processo prolongado. Uma estratégia alternativa envolve o uso de injeções de MB de alta densidade, o que requer a implementação de algoritmos avançados, como aprendizado profundo21,22, para manter a resolução da imagem sem degradação.
A anestesia com isoflurano foi utilizada seguindo a dosagem recomendada pelo fabricante do equipamento para manter a estabilidade fisiológica no rato. No entanto, conforme documentado em estudos anteriores, a anestesia com isoflurano tem efeitos conhecidos no sistema circulatório, potencialmente influenciando parâmetros cardiovasculares, como pressão arterial e frequência cardíaca23,24. Essas alterações podem introduzir variabilidade na dinâmica do fluxo sanguíneo, afetando potencialmente a precisão das medições do fluxo sanguíneo.
Em conclusão, este protocolo demonstra o amplo potencial de aplicação do ULM, fornecendo uma referência para pesquisas prospectivas de doenças cerebrais baseadas em modelos de pequenos animais. Possui valor significativo para a compreensão das alterações fisiopatológicas no nível microvascular e para avaliar a resposta da progressão da doença aos tratamentos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado em parte pelo Programa Nacional de Pesquisa e Desenvolvimento da China sob a Concessão 2023YFC2410903, a Fundação Nacional de Ciências Naturais da China (Bolsas 12274092, 12034005), o Programa Explorer de Xangai (Concessão 21TS1400200), o Programa Internacional de Cooperação em Ciência e Tecnologia de Xangai (Concessão 24490710400) e a Fundação AI for Science da Universidade de Fudan (Concessão FudanX24AI016).
Materiais
| Name | Company | Catalog Number | Comments |
| Alcohol | DICHANG | https://www.dehsm.com/goods-17187.html | 75% |
| Beamforming program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Body temperature maintenance device | RWD Life Science Co., Ltd. | 69026 | |
| Brain stereotaxic instrument | RWD Life Science Co., Ltd. | 71000-R | Adaptable to breathing mask |
| Cranial Microinjection Surgical Instrument Kit | RWD Life Science Co., Ltd. | SP0005-R | |
| Digital microscope | RWD Life Science Co., Ltd. | DOM-1001 | |
| Drug delivery catheter | RWD Life Science Co., Ltd. | https://www.rwdls.com/product-solutions/life-sciences/administration/draw-blood | |
| Erythromycin ointment | Renhe Pharma | H36020018 | 1% x 15 g |
| Gas anesthesia machine | RWD Life Science Co., Ltd. | R500IE | Includes breathing mask |
| Handheld electric clipper | GUAZHOUMU | MJD-DTJ02 | |
| Handheld mini cranial drill | RWD Life Science Co., Ltd. | 78001 | |
| Indwelling needle | Kindly EnterpriseDevelopment Group Co., LTD | Positive Pressure Model | 26 G |
| Iodine solution | HYNAUT | https://www.hainuocn.com/index/detail/524.html | 4.5–5.5 g/L |
| IQ demodulation program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Isoflurane | RWD Life Science Co., Ltd. | R510-22-10 | |
| MATLAB software | MathWorks | Version R2021a | |
| Microinjection pump | RWD Life Science Co., Ltd. | R462 | |
| Sodium chloride injection | SHENG'AO animals pharmaceutical Co., Ltd. | 270071460 | 0.90% |
| SonoVue | Bracco | https://www.bracco.com/en-se/product/sonovue | |
| Spherical drill bit | RWD Life Science Co., Ltd. | HM1027/HM1010 | |
| Supporting Positioning Software | RWD Life Science Co., Ltd. | V2.0.0.30400 | |
| Syringe | Kindly EnterpriseDevelopment Group Co., Ltd. | RWLB | 1 mL |
| Tracking program | Jean-Yves Tinevez | 2016 version | |
| Ultrasound gel | Junkang Medical Equipment Co., Ltd. | Model DS-1 | |
| Ultrasound probe | VERASONICS, INC. | L22-14vX LF | |
| Verasonics Ultrasound System | VERASONICS, INC. | Vantage-256 | ultrasound platform |
Referências
- Sweeney, M. D., Ayyadurai, S., Zlokovic, B. V. Pericytes of the neurovascular unit: Key functions and signaling pathways. Nat Neurosci. 19 (6), 771-783 (2016).
- Wardlaw, J. M., Smith, C., Dichgans, M. Mechanisms of sporadic cerebral small vessel disease: Insights from neuroimaging. Lancet Neurol. 12 (5), 483-497 (2013).
- Fang, J., Wang, Z., Miao, C. -Y. Angiogenesis after ischemic stroke. Acta Pharmacol Sin. 44 (7), 1305-1321 (2023).
- Zlokovic, B. V. Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders. Nat Rev Neurosci. 12 (12), 723-738 (2011).
- Kane, J. R. The role of brain vasculature in glioblastoma. Mol Neurobiol. 56 (9), 6645-6653 (2019).
- Iadecola, C. The pathobiology of vascular dementia. Neuron. 80 (4), 844-866 (2013).
- Ren, B., et al. Cerebral small vessel disease: Neuroimaging features, biochemical markers, influencing factors, pathological mechanism and treatment. Front Neurol. 13, 843953(2022).
- Bradley, C. P., Berry, C. Microvascular arterial disease of the brain and the heart: A shared pathogenesis. QJM. 116 (10), 829-834 (2023).
- Baltes, C., Radzwill, N., Bosshard, S., Marek, D., Rudin, M. Micro MRI of the mouse brain using a novel 400 MHz cryogenic quadrature RF probe. NMR Biomed. 22 (8), 834-842 (2009).
- Brancaccio, R., Bettuzzi, M., Morigi, M. P., Casali, F., Ragazzini, L. Image quality and dose assessment in inner ear computed tomography imaging with a flat panel-based system. J Comput Assist Tomogr. 39 (2), 232-239 (2015).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Osmanski, B. -F., et al. Ultrafast Doppler imaging of blood flow dynamics in the myocardium. IEEE T Med Imaging. 31 (8), 1661-1668 (2012).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (storm). Nat Methods. 3 (10), 793-796 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91 (11), 4258-4272 (2006).
- Christensen-Jeffries, K., et al. Super-resolution ultrasound imaging. Ultrasound Med Biol. 46 (4), 865-891 (2020).
- Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., Tanter, M. Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Trans Ultrason Ferroelectr Freq Control. 65 (8), 1304-1320 (2018).
- Demené, C., et al. Spatiotemporal clutter filtering of ultrafast ultrasound data highly increases Doppler and fUltrasound sensitivity. IEEE Trans Med Imaging. 34 (11), 2271-2285 (2015).
- Errico, C., et al. Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature. 527 (7579), 499-502 (2015).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. J Struct Biol. 183 (3), 363-367 (2013).
- Lowerison, M. R., et al. Super-resolution ultrasound reveals cerebrovascular impairment in a mouse model of Alzheimer's disease. J Neurosci. 44 (9), e1251232024(2024).
- Zhang, G., et al. ULM-MBCNRT: In vivo ultrafast ultrasound localization microscopy by combining multi-branch CNN and recursive transformer. IEEE Trans Ultrason Ferroelectr Freq Control. , (2024).
- Zhang, G., et al. In vivo ultrasound localization microscopy for high-density microbubbles. Ultrasonics. 143, 107410(2024).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Lab Anim. 48 (1), 6-14 (2014).
- Lenz, C., Rebel, A., Van Ackern, K., Kuschinsky, W., Waschke, K. F. Local cerebral blood flow, local cerebral glucose utilization, and flow-metabolism coupling during sevoflurane versus isoflurane anesthesia in rats. Anesthesiology. 89 (6), 1480-1488 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
