Method Article
Visualisation bidimensionnelle en super-résolution de la microvascularisation du cerveau de rat à l’aide de la microscopie de localisation par ultrasons
Dans cet article
Résumé
Ici, nous décrivons un protocole de microscopie de localisation par ultrasons (ULM), qui atteint une résolution spatiale de 12,5 μm pour imager la microvascularisation cérébrale chez le rat. Il permet une visualisation détaillée de la direction et de la vitesse du flux sanguin, offrant un outil puissant pour faire progresser les études sur la circulation cérébrale et les troubles vasculaires.
Résumé
La microvascularisation cérébrale forme un réseau complexe de vaisseaux essentiels au maintien de la fonction cérébrale. Des maladies telles que les accidents vasculaires cérébraux, la maladie d’Alzheimer, les gliomes et la démence vasculaire peuvent profondément perturber le système microvasculaire. Malheureusement, les modalités actuelles d’imagerie médicale n’offrent que des observations indirectes à cette échelle. Inspirée de la microscopie optique, la microscopie de localisation par ultrasons (ULM) surmonte le compromis classique entre la profondeur de pénétration et la résolution spatiale. En localisant et en suivant les microbulles injectées individuelles avec une précision inférieure à la longueur d’onde, des cartes vasculaires et de vitesse peuvent être générées à l’échelle micrométrique. Ici, nous présentons un protocole robuste pour l’imagerie à super-résolution de la microvascularisation cérébrale in vivo chez le rat à l’aide d’une plateforme d’échographie commerciale. Cette méthode atteint une résolution spatiale de 12,5 μm, reconstruisant l’architecture microvasculaire et fournissant des informations détaillées sur la direction et la vitesse du flux sanguin, améliorant considérablement notre compréhension de la microcirculation cérébrale. Le protocole peut être étendu à des modèles de maladies chez le rat, offrant ainsi un outil puissant pour le diagnostic précoce et le traitement des maladies neurovasculaires.
Introduction
La microvascularisation cérébrale, qui comprend les capillaires, les artérioles et les veinules, est essentielle au maintien de la fonction cérébrale en facilitant l’apport de nutriments, l’échange d’oxygène et l’élimination des déchets 1,2. Les perturbations de ce réseau sont impliquées dans des troubles neurologiques tels que l’accident vasculaire cérébral3, la maladie d’Alzheimer4, les gliomes5 et la démence vasculaire6, entraînant des altérations de la physiologie cérébrale. Les modifications microvasculaires précèdent souvent l’apparition des symptômes cliniques, ce qui en fait une cible critique pour les interventions diagnostiques et thérapeutiques 7,8. Une compréhension complète des altérations vasculaires aux niveaux structurel et fonctionnel est essentielle pour faire progresser la recherche et les stratégies de traitement.
Cependant, l’imagerie de la microvascularisation cérébrale est particulièrement difficile en raison de sa petite taille et de son emplacement partiellement profond dans le cerveau. Les modalités d’imagerie conventionnelles telles que l’imagerie par résonance magnétique (IRM)9 et la tomodensitométrie (TDM)10, bien qu’adéquates pour capturer des changements vasculaires à grande échelle, offrent une résolution spatiale (~100 μm) qui est beaucoup trop grossière pour visualiser de petits vaisseaux. Les méthodes optiques telles que la microscopie à deux photons11 offrent une excellente résolution spatiale (jusqu’à 1 μm) pour imager des capillaires individuels, mais sont entravées par un champ de vision et une profondeur de pénétration limités (moins de 1 mm), ce qui limite leur capacité à imager les régions profondes du cerveau. En tant que technique basée sur l’échographie, le Doppler12, tout en offrant une évaluation du flux sanguin en temps réel, reste limité par une résolution de 50-200 μm, insuffisante pour les détails microvasculaires. Dans l’ensemble, aucune méthode ne répond actuellement à la double exigence d’une résolution spatiale élevée et d’une pénétration cérébrale suffisante nécessaire à l’imagerie par microvascularisation cérébrale.
Inspirée de la microscopie optique 13,14, la microscopie de localisation par ultrasons (ULM) permet de visualiser des structures fines à l’échelle du micron en localisant les microbulles injectées (MB) individuelles et en suivant leur déplacement avec une résolution inférieure à la longueur d’onde15. Il contourne le compromis classique entre pénétration et résolution en imagerie par ultrasons16. Cette étude détaille un protocole robuste pour mettre en œuvre l’ULM dans un modèle de rat vivant et permettre ainsi l’imagerie à super-résolution de la microvascularisation cérébrale grâce à la plate-forme d’échographie disponible dans le commerce. Le protocole fournit non seulement une reconstruction complète de la structure microvasculaire, mais fournit également des informations détaillées sur la direction et la vitesse du flux sanguin, ce qui n’est pas possible avec les techniques d’imagerie conventionnelles. Bien que le protocole ait été validé chez des rats normaux, il peut être étendu à des modèles de maladies chez le rat, offrant des possibilités d’études personnalisées dans différentes conditions pathologiques.
Protocole
Toutes les expériences sur les animaux effectuées dans le cadre de ce travail sont approuvées par le comité d’éthique de l’Université Fudan (numéro d’approbation : 2022JS-004). Le protocole suit strictement les directives de soins aux animaux de l’Université Fudan pour assurer le traitement humain des animaux. Avant le début de l’expérience, les rats doivent bénéficier d’une période d’acclimatation environnementale d’une semaine, au cours de laquelle ils reçoivent suffisamment de nourriture et d’eau. La photopériode est soigneusement régulée en fonction de leurs rythmes biologiques pour assurer le maintien d’états physiologiques normaux. À la fin de l’expérience, l’euthanasie est réalisée à l’aide d’une surdose d’isoflurane inhalé.
REMARQUE : La configuration expérimentale est illustrée à la figure 1A-H.
1. Préparation de l’animal pour l’imagerie ULM
- Anesthésie
- Induire l’anesthésie chez le rat en administrant un mélange de 3,5 % d’isoflurane et de 100 % d’oxygène à un débit de 3 L/min. Après environ 4 minutes, retirez l’animal de la chambre et placez-le sur le ventre sur une plate-forme d’imagerie préchauffée à 37 °C. Confirmer la profondeur de l’anesthésie par l’absence de réflexe de retrait sur le pincement ferme de l’orteil de la patte postérieure du rat.
- Placez le nez du rat dans un masque respiratoire relié au système d’anesthésie. Maintenez une sédation stable en administrant un mélange de 1,5 % d’isoflurane et de 100 % d’oxygène à un débit de 1,5 L/min.
REMARQUE : Les méthodes d’anesthésie et les dosages suivent strictement les directives du fabricant.
- Préparation pré-chirurgicale de l’animal
- Fixez les incisives supérieures du rat dans l’encoche de la barre d’incisive, en positionnant la mâchoire inférieure sous la barre. À l’aide de barres auriculaires, stabilisez la tête du rat en les positionnant dans l’échancrure osseuse légèrement en avant et au-dessus du conduit auditif (palpable à la main), en veillant à ce que toute la surface crânienne reste horizontale (Figure 1A).
- Sondez doucement la stabilité de la fixation en appliquant une petite pression sur différentes parties de la tête. Assurez-vous qu’il n’y a pas de mouvement ou de glissement par rapport à la position d’origine.
- Ajustez avec précision la hauteur de la plateforme d’imagerie et ajustez méticuleusement l’angle de la tête du rat en levant ou en abaissant l’encoche de la barre incisive pour assurer une respiration sans obstruction.
- Appliquez une pommade à l’érythromycine ou une solution de glycérine à 30 % sur les yeux du rat pour prévenir les dommages causés par une exposition prolongée aux lumières chirurgicales et pour garder les yeux humides sous anesthésie. De plus, utilisez une pince à épiler à bout rond pour tirer doucement la langue du rat d’un côté de la bouche afin d’éviter l’asphyxie pendant la chirurgie.
- À l’aide d’une tondeuse électrique portative, rasez la tête du rat dans le sens inverse de la pousse des poils (de l’arrière vers l’avant), généralement entre les oreilles, des yeux jusqu’au début du cou (figure 1B). Nettoyez la zone rasée avec une solution d’iode à 1 % pour préparer l’incision chirurgicale.
- craniotomie chez le rat
- Faites une incision le long de la suture sagittale du crâne du rat, en commençant juste derrière l’os occipital et en s’étendant sur environ 4 cm vers l’avant. Utilisez des hémostats pour rétracter la peau des deux côtés (Figure 1C). Si vous le souhaitez, excisez entièrement la peau du crâne pour faciliter l’accès chirurgical, mais cela peut augmenter le risque d’infection.
- Utilisez de petits ciseaux pour retirer le périoste du crâne, exposant complètement la couche osseuse dure.
- Effectuez la craniotomie à l’aide d’une mini-perceuse crânienne portative équipée d’un foret sphérique (Figure 1D). Commencez avec un foret grossier (2,5 mm de diamètre) et tapotez doucement pour abraser l’os, en appliquant la perceuse pendant 2 à 3 s à la fois. Commencez par la zone centrale et progressez vers les zones plus épaisses sur les côtés.
REMARQUE : Les saignements excessifs pendant la craniotomie ont un impact sur la circulation sanguine, entraînant un manque de reconstruction vasculaire dans les zones corticales (Figure 1H). - Faites une pause toutes les 2 à 3 s pour éviter la surchauffe et, toutes les 2 minutes, injectez environ 1 mL de NaCl à 0,9 % dans la zone de forage à l’aide d’une seringue pour refroidir et rincer les débris.
- Une fois que le tissu osseux blanc n’apparaît plus de manière constante, passez à un foret plus fin (1 mm de diamètre). Poursuivez le forage jusqu’à ce que les principaux vaisseaux sanguins centraux soient clairement visibles en brun foncé et que la zone environnante apparaisse rose, avec des microvaisseaux légèrement rougeâtres (figure 1F).
REMARQUE : L’amplitude finale de la craniotomie va de Bregma +3 mm à Lambda antéro-postérieurement et 7 mm de chaque côté le long de la ligne médiane du crâne (Figure 1E). Une fois l’opération terminée, laissez le rat se reposer pendant environ 10 minutes pour assurer des conditions physiologiques relativement stables avant de commencer la collecte de données.
2. Configuration avant la collecte des données
- Préparation et injection d’agent de contraste
- Dissoudre l’agent de contraste (un flacon contenant 59 mg de gaz SF6 et 25 mg de poudre lyophilisée), conformément aux directives officielles, dans 5 mL de NaCl à 0,9 %. Agitez vigoureusement le mélange pour former une suspension MB. La concentration finale de SF6 dans la suspension est de 8 μL/mL.
- Prélevez 0,8 mL de la suspension MB dans une seringue de 1 mL et fixez-la à une pompe de micro-injection programmée pour perfuser à 100 μL/min.
- Insérez une aiguille à demeure de 26 G avec un cathéter fixé dans la veine de la queue du rat (Figure 1G).
- Sélection du plan d’imagerie
- Montez une sonde avec une fréquence centrale de 15,625 MHz sur le bras manipulateur de l’instrument stéréotaxique cérébral, équipé d’une pince (amplitude de mouvement : verticale, horizontale et antéro-postérieure jusqu’à 80 mm ; précision de lecture : 0,1 mm).
- Placez la sonde à ultrasons directement au-dessus du cerveau de rat exposé. Appliquez du gel de couplage sur la surface cérébrale exposée pour assurer une transmission optimale du signal.
- Ouvrez l’interface principale du logiciel, qui intègre un atlas de cerveau de rat avec des programmes de contrôle de mouvement moteur.
- Définissez le point Bregma comme origine. L’interface logicielle fournit un affichage en temps réel de la trajectoire de la sonde et de l’emplacement correspondant de la tranche de cerveau de rat. Sélectionnez le plan d’imagerie cible ; par exemple, Bregma -1 mm.
3. Collecte de données (Timing ~ 20 min)
REMARQUE : Verasonics (système d’échographie) fournit les scripts MATLAB originaux à utiliser avec le système Vantage et n’a pas été modifié.
- Démarrage du logiciel
- Lancez le logiciel MATLAB 2021a.
- Entrez le script d’acquisition de données dans MATLAB 2021a.
- Dans le répertoire racine, tapez activate dans la fenêtre de ligne de commande pour activer l’environnement d’exécution.
- Configuration des paramètres et acquisition des signaux RF
- Réglez les profondeurs de début et de fin de la collecte de données à 5 et 120 longueurs d’onde, respectivement, pour capturer efficacement la région d’intérêt.
REMARQUE : Les ajustements doivent être effectués en fonction du plan d’imagerie et de l’animal spécifique étudié. - Réglez les angles de braquage de transmission des ondes planes de -5° à 5° par incréments de 2,5° pour améliorer la résolution et le contraste de l’image.
REMARQUE : Ajustez ces paramètres en fonction des exigences spécifiques en matière d’imagerie et des caractéristiques de la cible. - Réglez la tension d’émission sur 20 V pour assurer une pénétration adéquate et un rapport signal/bruit optimal pour la région d’intérêt.
- Cliquez sur le bouton Exécuter pour démarrer la collecte de données et enregistrer les signaux de radiofréquence (RF) au format de fichier .mat.
REMARQUE : Commencer la collecte des données 30 s après le démarrage de la pompe de micro-injection pour assurer une distribution uniforme et stable du MB dans le corps du rat.
- Réglez les profondeurs de début et de fin de la collecte de données à 5 et 120 longueurs d’onde, respectivement, pour capturer efficacement la région d’intérêt.
4. Traitement et analyse des données (Timing ~ 8 h)
- Traitement des données
- Importez les données RF dans MATLAB 2021a et démodulez-les pour générer des données en phase et en quadrature (I/Q) (voir le Tableau des matériaux).
- Cliquez sur le bouton Exécuter pour utiliser l’algorithme DAS (Delay-and-Sum) pour la formation de faisceaux sur les données I/Q (voir Tableau des matériaux).
REMARQUE : Fréquence d’images post-composition de 800 Hz, avec un total de 120 000 images.
- Imagerie ULM
- Appliquez l’algorithme de filtrage spatio-temporel SVD (Singular Value Decomposition)17 aux données IQ pour supprimer le bruit de fond et l’encombrement. Chaque 800 trames est stockée sous la forme d’un bloc de données et le seuil SVD est défini sur [15, 800].
- Localisez le centre de chaque Mo à l’aide de l’algorithme d’ajustement gaussien18.
- Utilisez l’algorithme de Kuhn-Munkres pour suivre les trajectoires MB sur des images consécutives en fonction de leurs positions (voir Tableau des matériaux).
- Cartographiez les trajectoires MB sur une grille suréchantillonnée 8x, à l’aide d’une palette de couleurs chaudes pour afficher le nombre de trajectoires MB et d’une palette de couleurs de jet pour coder la vitesse d’écoulement en cartographiant la vitesse calculée à chaque position dans la microvascularisation.
- Appliquez une combinaison de couleurs personnalisée pour distinguer les directions d’écoulement vers le haut et vers le bas, ce qui permet d’obtenir des images haute résolution pour une visualisation améliorée.
- Divisez de manière aléatoire les trajectoires MB d’origine en deux groupes pour créer deux sous-images, effectuez une transformée de Fourier sur chacune d’elles et calculez la corrélation en anneau de Fourier (FRC) en tant que corrélation normalisée de leurs spectres. Définissez la résolution comme l’inverse de la fréquence spatiale où la FRC tombe en dessous du seuil19.
Résultats
La figure 1 illustre la configuration détaillée de l’imagerie microvasculaire microvasculaire cérébrale ULM in vivo chez le rat, chaque élément étant soigneusement conçu pour minimiser la variabilité expérimentale et assurer une acquisition de données précise pour des résultats d’imagerie fiables à super-résolution.
La figure 2A montre la structure reconstruite par ULM de la microvascularisation dans le cerveau du rat, positionnée à -1 mm du point Bregma, avec une profondeur d’imagerie proche de 12 mm. L’épaisseur effective de la tranche sur le plan d’imagerie varie de 0,1 mm à 0,3 mm. Les microvaisseaux moins profonds et plus profonds sont clairement visibles, et la qualité de l’image ne se détériore pas avec l’augmentation de la profondeur (figure 2B). En calculant la largeur totale à mi-maximum (FWHM) de la distribution d’intensité le long de la ligne pointillée dans les régions d’intérêt (ROI), des récipients de différents diamètres peuvent être détectés, le plus petit étant de 13 μm (Figure 2C). En appliquant la corrélation en anneau de Fourier (FRC) pour l’évaluation de la résolution, la résolution spatiale de l’imagerie microvasculaire du cerveau de rat est quantifiée à 12,5 μm (Figure 2D).
Les informations sur le flux sanguin sont cruciales pour refléter les réponses physiologiques et diagnostiquer les maladies. La figure 3A illustre les directions du flux sanguin dans une coupe transversale du cerveau du rat, où le bleu indique le flux vers la sonde et le rouge indique le flux vers l’extérieur de la sonde. Sur cette base, des régions cérébrales spécifiques telles que les petites artères du cortex qui s’écoulent vers le bas et les petites veines qui s’écoulent vers le haut peuvent être différenciées20 (Figure 3B). La figure 3C montre une carte de vitesse du flux sanguin cérébral codée en différentes couleurs, avec des vaisseaux plus grands affichant des débits nettement plus élevés. La distribution des vitesses varie de 1 à 80 mm/s, principalement concentrée dans la plage de 10 à 25 mm/s (figure 3D), ce qui représente 81,57 % de toute la plage de vitesses. Cette proportion est calculée en déterminant le nombre de points de données de vitesse dans la plage de 5 à 25 mm/s par rapport au nombre total de points de données dans la matrice de vitesse.
La figure 4 présente les résultats d’imagerie d’un modèle de glioblastome chez le rat à l’aide du protocole proposé. Les cellules de glioblastome C6 ont été implantées dans le cerveau du rat. La figure 4A montre la structure microvasculaire dans le cerveau d’un modèle de rat glioblastome, avec une dilatation vasculaire anormale et des irrégularités structurelles observées autour de la tumeur. Les vaisseaux de la région tumorale présentent une plus grande tortuosité par rapport à la zone normale du côté gauche. La figure 4B fournit des informations sur la direction du flux sanguin, ce qui permet de comprendre les modèles de flux dans la région tumorale. La figure 4C présente une carte de la vitesse du flux sanguin, révélant l’hétérogénéité du flux vasculaire à l’intérieur et autour de la tumeur.
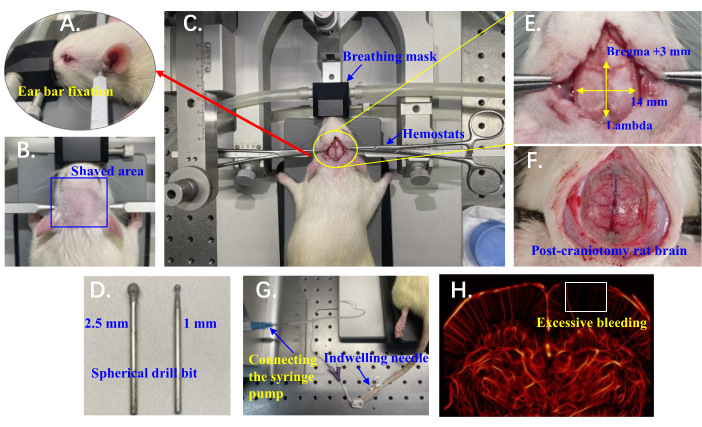
Figure 1 : Détails du dispositif expérimental pour l’imagerie ULM in vivo de la microvascularisation du cerveau de rat. (A) Position des barres d’oreille utilisées pour stabiliser la tête du rat. (B) La zone rasée de la tête du rat préparée pour l’accès chirurgical. (C) Rat positionné sur l’instrument stéréotaxique avec un masque respiratoire ; Les hémostats sont utilisés pour rétracter la peau des deux côtés. (D) Mèches sphériques (2,5 mm et 1 mm) montées sur la perceuse crânienne pour craniotomie. (E) Zone de craniotomie marquée par rapport à Bregma et Lambda. (F) Cerveau de rat exposé à la suite d’une craniotomie. (G) Une aiguille à demeure insérée dans la veine de la queue du rat et reliée à un pousse-seringue pour la micro-injection. (H) Exemple de système vasculaire cérébral de rat avec saignement excessif ; La boîte blanche met en évidence une région dépourvue de reconstruction vasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
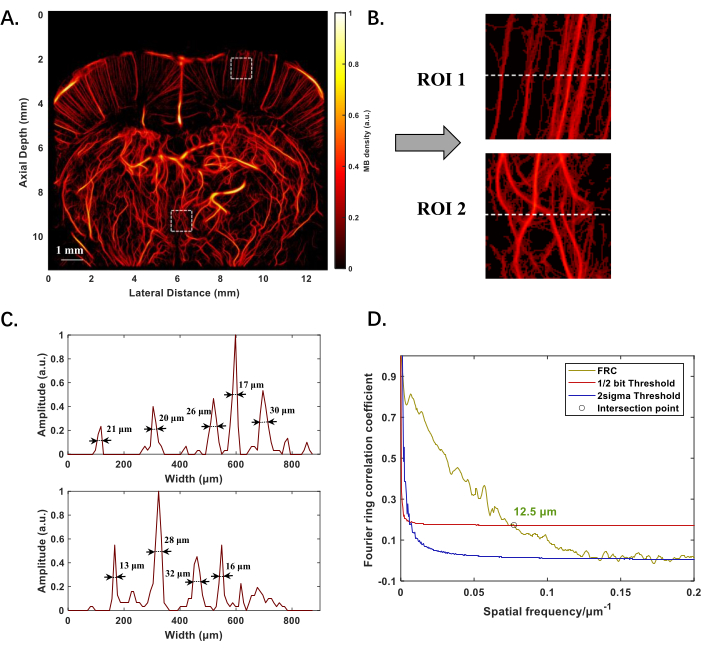
Figure 2 : Résultats expérimentaux de la reconstruction ULM de la structure microvasculaire du cerveau du rat in vivo. (A) Structure microvasculaire du cerveau du rat à -1 mm du point Bregma. (B) Images agrandies de deux régions d’intérêt (ROI) à des endroits moins profonds et plus profonds dans A, pour mettre en évidence la morphologie des petits vaisseaux. (C) Distribution de l’intensité le long de la ligne pointillée en B, avec des valeurs numériques indiquant les diamètres des récipients mesurés en utilisant la largeur maximale à mi-hauteur (FWHM). (D) Évaluation des performances de reconstruction ULM à l’aide de la technique de l’anneau de Fourier, le 1/2 bit a été choisi pour normaliser la résolution sans sacrifier la qualité de l’image, qui définit la fréquence spatiale la plus élevée où la corrélation indique toujours des informations statistiquement significatives. Le « ○ » marque le point d’intersection de la courbe de corrélation et du seuil de 1/2 bit, indiquant la limite de résolution. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Résultats expérimentaux de la reconstruction ULM de la direction et de la vitesse du flux sanguin microvasculaire dans le cerveau du rat in vivo. (A) Direction du flux sanguin dans le cerveau du rat. Le bleu indique un écoulement ascendant vers la sonde et le rouge indique un écoulement descendant loin de la sonde. (B) Petites artères et veines dans les régions corticales du cerveau du rat délimitées en fonction de la direction du flux sanguin. (C) Vitesse du flux sanguin dans le cerveau du rat. (D) Histogramme de vitesse du flux sanguin dans le cerveau du rat, montrant la distribution de 1 mm/s à 80 mm/s. Les barres bleu clair représentent la plage de vitesse de 5 à 25 mm/s. La ligne rouge représente la courbe ajustée aux données, illustrant le profil de distribution de vitesse typique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Résultats expérimentaux de la reconstruction ULM de la structure microvasculaire dans le modèle de glioblastome cérébral de rat in vivo. (A) Structure microvasculaire du cerveau de rat. (B) Direction du flux sanguin dans le cerveau du rat. (C) Vitesse du flux sanguin dans le cerveau du rat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole a utilisé avec succès l’ULM pour effectuer une imagerie à super-résolution de la microvascularisation cérébrale in vivo du rat. Par rapport à d’autres modalités d’imagerie, l’ULM s’adapte simultanément à la fois à la résolution spatiale et à la profondeur de pénétration. Le cerveau de rat exposé a été imagé plutôt qu’à travers le crâne, évitant ainsi l’atténuation et la distorsion causées par la présence d’os. Sous un transducteur d’une fréquence centrale de 15,625 MHz, des structures vasculaires à une profondeur d’environ 12 mm ont été capturées, avec une résolution spatiale allant jusqu’à 12,5 μm. La direction du flux sanguin a facilité la différenciation de régions spécifiques de petites artères et de veines. De plus, la technique prend en charge une large gamme de mesures de vitesse d’écoulement (1-80 mm/s).
La craniotomie pratiquée sur des rats est essentielle dans ce protocole. Pendant la chirurgie, il est essentiel de minimiser les saignements excessifs. D’une part, des saignements excessifs peuvent avoir un impact sur la circulation sanguine, une manifestation typique étant l’absence de reconstruction vasculaire dans les zones corticales. D’autre part, il peut également provoquer des changements physiologiques ou même la mort chez les animaux de laboratoire. L’appareil stéréotaxique utilisé dans la procédure comprend un programme de craniotomie automatisé qui peut réduire les traumatismes et augmenter le taux de réussite, mais dépend fortement de l’expérience du praticien. En effet, une détermination précise de l’emplacement et de la profondeur du site de forage est nécessaire pour éviter de causer des dommages ou des blessures secondaires au cerveau du rat. Bien que la craniotomie ne soit pas toujours nécessaire, l’imagerie transcrânienne ULM est prometteuse mais nécessite des algorithmes robustes de compensation ou de correction de la distorsion. De plus, une pompe de micro-injection est utilisée pour administrer les MB de manière régulière, en veillant à ce qu’ils restent clairsemés et stables dans le système vasculaire du rat. Cette approche est favorable aux techniques de localisation conventionnelles, car elle facilite les reconstructions ULM de haute qualité. Cependant, il prolonge à la fois l’acquisition de données et la durée de l’imagerie, ce qui rend l’imagerie ULM un processus prolongé. Une stratégie alternative implique l’utilisation d’injections de MB à haute densité, ce qui nécessite la mise en œuvre d’algorithmes avancés, tels que l’apprentissage profond21,22, pour maintenir la résolution de l’image sans dégradation.
L’anesthésie à l’isoflurane a été utilisée en suivant la posologie recommandée par le fabricant de l’équipement pour maintenir la stabilité physiologique chez le rat. Cependant, comme documenté dans des études antérieures, l’anesthésie à l’isoflurane a des effets connus sur le système circulatoire, influençant potentiellement des paramètres cardiovasculaires tels que la pression artérielle et la fréquence cardiaque23,24. Ces changements peuvent introduire une variabilité dans la dynamique du flux sanguin, ce qui peut affecter la précision des mesures du débit sanguin.
En conclusion, ce protocole démontre le vaste potentiel d’application de l’ULM, fournissant une référence pour la recherche prospective sur les maladies du cerveau basée sur de petits modèles animaux. Il a une valeur significative pour comprendre les changements physiopathologiques au niveau microvasculaire et pour évaluer la réponse de la progression de la maladie aux traitements.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu en partie par le Programme national de recherche et de développement clés de la Chine dans le cadre de la subvention 2023YFC2410903, la Fondation nationale des sciences naturelles de Chine (subventions 12274092, 12034005), le programme Explorer de Shanghai (subvention 21TS1400200), le Programme de coopération scientifique et technologique internationale de Shanghai (subvention 24490710400) et la Fondation AI for Science de l’Université Fudan (subvention FudanX24AI016).
matériels
| Name | Company | Catalog Number | Comments |
| Alcohol | DICHANG | https://www.dehsm.com/goods-17187.html | 75% |
| Beamforming program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Body temperature maintenance device | RWD Life Science Co., Ltd. | 69026 | |
| Brain stereotaxic instrument | RWD Life Science Co., Ltd. | 71000-R | Adaptable to breathing mask |
| Cranial Microinjection Surgical Instrument Kit | RWD Life Science Co., Ltd. | SP0005-R | |
| Digital microscope | RWD Life Science Co., Ltd. | DOM-1001 | |
| Drug delivery catheter | RWD Life Science Co., Ltd. | https://www.rwdls.com/product-solutions/life-sciences/administration/draw-blood | |
| Erythromycin ointment | Renhe Pharma | H36020018 | 1% x 15 g |
| Gas anesthesia machine | RWD Life Science Co., Ltd. | R500IE | Includes breathing mask |
| Handheld electric clipper | GUAZHOUMU | MJD-DTJ02 | |
| Handheld mini cranial drill | RWD Life Science Co., Ltd. | 78001 | |
| Indwelling needle | Kindly EnterpriseDevelopment Group Co., LTD | Positive Pressure Model | 26 G |
| Iodine solution | HYNAUT | https://www.hainuocn.com/index/detail/524.html | 4.5–5.5 g/L |
| IQ demodulation program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Isoflurane | RWD Life Science Co., Ltd. | R510-22-10 | |
| MATLAB software | MathWorks | Version R2021a | |
| Microinjection pump | RWD Life Science Co., Ltd. | R462 | |
| Sodium chloride injection | SHENG'AO animals pharmaceutical Co., Ltd. | 270071460 | 0.90% |
| SonoVue | Bracco | https://www.bracco.com/en-se/product/sonovue | |
| Spherical drill bit | RWD Life Science Co., Ltd. | HM1027/HM1010 | |
| Supporting Positioning Software | RWD Life Science Co., Ltd. | V2.0.0.30400 | |
| Syringe | Kindly EnterpriseDevelopment Group Co., Ltd. | RWLB | 1 mL |
| Tracking program | Jean-Yves Tinevez | 2016 version | |
| Ultrasound gel | Junkang Medical Equipment Co., Ltd. | Model DS-1 | |
| Ultrasound probe | VERASONICS, INC. | L22-14vX LF | |
| Verasonics Ultrasound System | VERASONICS, INC. | Vantage-256 | ultrasound platform |
Références
- Sweeney, M. D., Ayyadurai, S., Zlokovic, B. V. Pericytes of the neurovascular unit: Key functions and signaling pathways. Nat Neurosci. 19 (6), 771-783 (2016).
- Wardlaw, J. M., Smith, C., Dichgans, M. Mechanisms of sporadic cerebral small vessel disease: Insights from neuroimaging. Lancet Neurol. 12 (5), 483-497 (2013).
- Fang, J., Wang, Z., Miao, C. -. Y. Angiogenesis after ischemic stroke. Acta Pharmacol Sin. 44 (7), 1305-1321 (2023).
- Zlokovic, B. V. Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders. Nat Rev Neurosci. 12 (12), 723-738 (2011).
- Kane, J. R. The role of brain vasculature in glioblastoma. Mol Neurobiol. 56 (9), 6645-6653 (2019).
- Iadecola, C. The pathobiology of vascular dementia. Neuron. 80 (4), 844-866 (2013).
- Ren, B., et al. Cerebral small vessel disease: Neuroimaging features, biochemical markers, influencing factors, pathological mechanism and treatment. Front Neurol. 13, 843953 (2022).
- Bradley, C. P., Berry, C. Microvascular arterial disease of the brain and the heart: A shared pathogenesis. QJM. 116 (10), 829-834 (2023).
- Baltes, C., Radzwill, N., Bosshard, S., Marek, D., Rudin, M. Micro MRI of the mouse brain using a novel 400 MHz cryogenic quadrature RF probe. NMR Biomed. 22 (8), 834-842 (2009).
- Brancaccio, R., Bettuzzi, M., Morigi, M. P., Casali, F., Ragazzini, L. Image quality and dose assessment in inner ear computed tomography imaging with a flat panel-based system. J Comput Assist Tomogr. 39 (2), 232-239 (2015).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Osmanski, B. -. F., et al. Ultrafast Doppler imaging of blood flow dynamics in the myocardium. IEEE T Med Imaging. 31 (8), 1661-1668 (2012).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (storm). Nat Methods. 3 (10), 793-796 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91 (11), 4258-4272 (2006).
- Christensen-Jeffries, K., et al. Super-resolution ultrasound imaging. Ultrasound Med Biol. 46 (4), 865-891 (2020).
- Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., Tanter, M. Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Trans Ultrason Ferroelectr Freq Control. 65 (8), 1304-1320 (2018).
- Demené, C., et al. Spatiotemporal clutter filtering of ultrafast ultrasound data highly increases Doppler and fUltrasound sensitivity. IEEE Trans Med Imaging. 34 (11), 2271-2285 (2015).
- Errico, C., et al. Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature. 527 (7579), 499-502 (2015).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. J Struct Biol. 183 (3), 363-367 (2013).
- Lowerison, M. R., et al. Super-resolution ultrasound reveals cerebrovascular impairment in a mouse model of Alzheimer's disease. J Neurosci. 44 (9), e1251232024 (2024).
- Zhang, G., et al. ULM-MBCNRT: In vivo ultrafast ultrasound localization microscopy by combining multi-branch CNN and recursive transformer. IEEE Trans Ultrason Ferroelectr Freq Control. , (2024).
- Zhang, G., et al. In vivo ultrasound localization microscopy for high-density microbubbles. Ultrasonics. 143, 107410 (2024).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Lab Anim. 48 (1), 6-14 (2014).
- Lenz, C., Rebel, A., Van Ackern, K., Kuschinsky, W., Waschke, K. F. Local cerebral blood flow, local cerebral glucose utilization, and flow-metabolism coupling during sevoflurane versus isoflurane anesthesia in rats. Anesthesiology. 89 (6), 1480-1488 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon