Method Article
Visualizzazione bidimensionale a super-risoluzione della microvascolarizzazione del cervello di ratto mediante microscopia di localizzazione ecografica
In questo articolo
Riepilogo
Qui, descriviamo un protocollo per la microscopia di localizzazione ecografica (ULM), che raggiunge una risoluzione spaziale di 12,5 μm per visualizzare la microvascolarizzazione cerebrale nei ratti. Consente la visualizzazione dettagliata della direzione e della velocità del flusso sanguigno, offrendo un potente strumento per far progredire gli studi sulla circolazione cerebrale e sui disturbi vascolari.
Abstract
La microvascolarizzazione cerebrale forma una complessa rete di vasi essenziali per il mantenimento della funzione cerebrale. Malattie come l'ictus, il morbo di Alzheimer, i gliomi e la demenza vascolare possono interrompere profondamente il sistema microvascolare. Sfortunatamente, le attuali modalità di imaging medico offrono solo osservazioni indirette su questa scala. Ispirata alla microscopia ottica, la microscopia di localizzazione a ultrasuoni (ULM) supera il classico compromesso tra profondità di penetrazione e risoluzione spaziale. Localizzando e tracciando le singole microbolle iniettate (MB) con precisione inferiore alla lunghezza d'onda, è possibile generare mappe vascolari e di velocità su scala micrometrica. Qui, presentiamo un robusto protocollo per l'imaging a super-risoluzione della microvascolarizzazione cerebrale in vivo nei ratti utilizzando una piattaforma ecografica commerciale. Questo metodo raggiunge una risoluzione spaziale di 12,5 μm, ricostruendo l'architettura microvascolare e fornendo informazioni dettagliate sulla direzione e la velocità del flusso sanguigno, migliorando notevolmente la nostra comprensione della microcircolazione cerebrale. Il protocollo può essere esteso ai modelli di malattia del ratto, offrendo un potente strumento per la diagnosi precoce e il trattamento delle malattie neurovascolari.
Introduzione
La microvascolarizzazione cerebrale, che comprende capillari, arteriole e venule, è essenziale per il mantenimento della funzione cerebrale facilitando l'apporto di nutrienti, lo scambio di ossigeno e la rimozione dei rifiuti 1,2. Le interruzioni in questa rete sono implicate in disturbi neurologici come l'ictus3, il morbo di Alzheimer4, i gliomi5 e la demenza vascolare6, portando a menomazioni nella fisiologia del cervello. Le alterazioni microvascolari precedono frequentemente l'insorgenza dei sintomi clinici, rendendole un bersaglio critico per gli interventi diagnostici e terapeutici 7,8. Una comprensione completa delle alterazioni vascolari sia a livello strutturale che funzionale è fondamentale per far progredire la ricerca e le strategie di trattamento.
Tuttavia, l'imaging della microvascolarizzazione cerebrale è particolarmente impegnativo a causa delle dimensioni ridotte e della posizione parzialmente profonda all'interno del cervello. Le modalità di imaging convenzionali come la risonanza magnetica (MRI)9 e la tomografia computerizzata (CT)10, sebbene adeguate per catturare i cambiamenti vascolari su larga scala, offrono una risoluzione spaziale (~100 μm) troppo grossolana per la visualizzazione di piccoli vasi. I metodi ottici come la microscopia a due fotoni11 forniscono un'eccellente risoluzione spaziale (fino a 1 μm) per l'imaging dei singoli capillari, ma sono ostacolati da un campo visivo limitato e da una profondità di penetrazione (inferiore a 1 mm), limitando la loro capacità di visualizzare le regioni cerebrali profonde. Come tecnica basata sugli ultrasuoni, il Doppler12, pur offrendo una valutazione del flusso sanguigno in tempo reale, rimane vincolato da una risoluzione di 50-200 μm, insufficiente per i dettagli microvascolari. Nel complesso, nessun singolo metodo soddisfa attualmente il duplice requisito di un'elevata risoluzione spaziale e di una sufficiente penetrazione cerebrale necessaria per l'imaging della microvascolarizzazione cerebrale.
Ispirata alla microscopia ottica13,14, la microscopia di localizzazione ultrasonica (ULM) consente la visualizzazione di strutture fini su scala micron localizzando le singole microbolle iniettate (MB) e tracciando il loro spostamento con una risoluzione inferiore alla lunghezza d'onda15. Aggira il classico compromesso tra penetrazione e risoluzione nell'imaging ecografico16. Questo studio descrive in dettaglio un protocollo robusto per l'implementazione dell'ULM in un modello di ratto vivente e quindi per consentire l'imaging a super-risoluzione della microvascolarizzazione cerebrale attraverso la piattaforma ecografica disponibile in commercio. Il protocollo non solo fornisce una ricostruzione completa della struttura microvascolare, ma fornisce anche informazioni dettagliate sulla direzione e la velocità del flusso sanguigno, cosa che non è possibile con le tecniche di imaging convenzionali. Sebbene il protocollo sia stato convalidato in ratti normali, è estendibile a modelli di malattia del ratto, offrendo possibilità di studi personalizzati in diverse condizioni patologiche.
Protocollo
Tutti gli esperimenti sugli animali eseguiti in questo lavoro sono approvati dal Comitato Etico dell'Università di Fudan (Numero di approvazione: 2022JS-004). Il protocollo segue rigorosamente le linee guida per la cura degli animali dell'Università Fudan per garantire il trattamento umano degli animali. Prima dell'inizio della sperimentazione, ai ratti deve essere concesso un periodo di 1 settimana per l'acclimatazione ambientale, durante il quale viene fornita loro alimentazione e acqua sufficienti. Il fotoperiodo viene attentamente regolato in base ai loro ritmi biologici per garantire il mantenimento di normali stati fisiologici. Al termine dell'esperimento, l'eutanasia viene eseguita utilizzando un sovradosaggio di isoflurano per via inalatoria.
NOTA: La configurazione sperimentale è mostrata nella Figura 1A-H.
1. Preparazione degli animali per l'imaging ULM
- Anestesia
- Indurre l'anestesia nel ratto somministrando una miscela di isoflurano al 3,5% e ossigeno al 100% a una velocità di flusso di 3 L/min. Dopo circa 4 minuti, rimuovere l'animale dalla camera e posizionarlo prono su una piattaforma di imaging preriscaldata a 37 °C. Confermare la profondità dell'anestesia con l'assenza di un riflesso di ritiro sul fermo pizzicamento dell'arto posteriore del ratto.
- Posizionare il naso del ratto in una maschera respiratoria collegata al sistema di anestesia. Mantenere una sedazione stabile somministrando una miscela di isoflurano all'1,5% e ossigeno al 100% a una velocità di flusso di 1,5 L/min.
NOTA: I metodi e i dosaggi dell'anestesia seguono rigorosamente le linee guida del produttore.
- Preparazione pre-chirurgica degli animali
- Fissare gli incisivi superiori del ratto nella tacca della barra incisiva, posizionando la mascella inferiore sotto la barra. Utilizzare le barre auricolari per stabilizzare la testa del ratto posizionandole nella rientranza ossea leggermente anteriore e superiore al condotto uditivo (palpabile a mano), assicurandosi che l'intera superficie cranica rimanga orizzontale (Figura 1A).
- Sondare delicatamente la stabilità della fissazione applicando una piccola quantità di pressione su diverse parti della testa. Assicurarsi che non vi siano movimenti o scivolamenti dalla posizione originale.
- Regola con precisione l'altezza della piattaforma di imaging e regola meticolosamente l'angolo della testa del ratto alzando o abbassando la tacca della barra incisiva per garantire una respirazione senza ostacoli.
- Applicare unguento all'eritromicina o una soluzione di glicerina al 30% sugli occhi del ratto per prevenire danni dovuti all'esposizione prolungata alle luci chirurgiche e per mantenere gli occhi umidi sotto anestesia. Inoltre, usa una pinzetta a punta tonda per tirare delicatamente la lingua del ratto su un lato della bocca per prevenire l'asfissia durante l'intervento chirurgico.
- Utilizzare un tagliacapelli elettrico portatile e radere la testa del ratto contro la direzione di crescita dei peli (da dietro in avanti), tipicamente tra le orecchie, dagli occhi all'inizio del collo (Figura 1B). Pulire l'area rasata con una soluzione di iodio all'1% per prepararsi all'incisione chirurgica.
- Craniotomia di ratto
- Praticare un'incisione lungo la sutura sagittale del cranio del ratto, partendo da appena dietro l'osso occipitale ed estendendosi di circa 4 cm anteriormente. Utilizzare gli emostatici per ritrarre la pelle su entrambi i lati (Figura 1C). Facoltativamente, asportare completamente la pelle sopra il cranio per fornire un maggiore accesso chirurgico, ma ciò può aumentare il rischio di infezione.
- Usa piccole forbici per rimuovere il periostio dal cranio, esponendo completamente lo strato di osso duro.
- Eseguire la craniotomia utilizzando un mini trapano cranico portatile dotato di una punta sferica (Figura 1D). Iniziare con una punta grossolana (2,5 mm di diametro) e picchiettare delicatamente per abradere l'osso, applicando il trapano per 2-3 secondi alla volta. Inizia dalla zona centrale e procedi verso le zone più spesse sui lati.
NOTA: Un sanguinamento eccessivo durante la craniotomia influisce sulla circolazione sanguigna, con conseguente mancanza di ricostruzione vascolare nelle aree corticali (Figura 1H). - Mettere in pausa ogni 2-3 s per evitare il surriscaldamento e, ogni 2 minuti, iniettare circa 1 mL di NaCl allo 0,9% nell'area di perforazione utilizzando una siringa per raffreddare e sciacquare via i detriti.
- Una volta che il tessuto osseo bianco non appare più collegato in modo coerente, passare a una punta più fine (1 mm di diametro). Continuare a perforare fino a quando i vasi sanguigni principali centrali sono chiaramente visibili in marrone scuro e l'area circostante appare rosa, con microvasi visibili leggermente rossastri (Figura 1F).
NOTA: L'intervallo finale della craniotomia va da Bregma +3 mm a Lambda antero-posteriore e 7 mm su ciascun lato lungo la linea mediana del cranio (Figura 1E). Dopo aver completato l'intervento chirurgico, lasciare riposare il ratto per circa 10 minuti per garantire condizioni fisiologiche relativamente stabili prima di iniziare la raccolta dei dati.
2. Configurazione prima della raccolta dei dati
- Preparazione e iniezione del mezzo di contrasto
- Sciogliere il mezzo di contrasto (un flaconcino contenente 59 mg di gas SF6 e 25 mg di polvere liofilizzata), secondo le linee guida ufficiali, in 5 ml di NaCl allo 0,9%. Agitare energicamente il composto fino a formare una sospensione MB. La concentrazione finale di SF6 nella sospensione è di 8 μL/mL.
- Aspirare 0,8 mL della sospensione MB in una siringa da 1 mL e fissarla a una pompa di microiniezione programmata per l'infusione a 100 μL/min.
- Inserire un ago a permanenza da 26 G con un catetere inserito nella vena caudale del ratto (Figura 1G).
- Selezione del piano di imaging
- Montare una sonda con frequenza centrale di 15,625 MHz sul braccio manipolatore dello strumento stereotassico cerebrale, dotato di morsetto (campo di movimento: verticale, orizzontale e antero-posteriore fino a 80 mm; precisione di lettura: 0,1 mm).
- Posizionare la sonda ecografica direttamente sopra il cervello di ratto esposto. Applicare il gel di accoppiamento sulla superficie cerebrale esposta per garantire una trasmissione ottimale del segnale.
- Apri l'interfaccia principale del software, che integra un atlante del cervello di ratto con i programmi di controllo del movimento del motore.
- Impostate il punto Bregma come origine. L'interfaccia software fornisce una visualizzazione in tempo reale della traiettoria della sonda e della corrispondente posizione della fetta di cervello di ratto. Selezionare il piano di imaging di destinazione; ad esempio, Bregma -1 mm.
3. Raccolta dati (Timing ~ 20 min)
NOTA: Verasonics (sistema a ultrasuoni) fornisce gli script MATLAB originali da utilizzare con il sistema Vantage e non è stato modificato.
- Avvio del software
- Avvia il software MATLAB 2021a.
- Inserisci lo script di acquisizione dati in MATLAB 2021a.
- Nella directory principale, digitare activate nella finestra della riga di comando per attivare l'ambiente di runtime.
- Configurazione dei parametri e acquisizione dei segnali RF
- Imposta le profondità di inizio e fine della raccolta dei dati rispettivamente a 5 e 120 lunghezze d'onda, per catturare efficacemente la regione di interesse.
NOTA: Le regolazioni devono essere effettuate in base al piano di imaging e all'animale specifico da studiare. - Imposta gli angoli di sterzata della trasmissione dell'onda piana da -5° a 5° con incrementi di 2,5° per migliorare la risoluzione e il contrasto dell'immagine.
NOTA: Regolare queste impostazioni in base ai requisiti di imaging specifici e alle caratteristiche del target. - Impostare la tensione di trasmissione su 20 V per garantire un'adeguata penetrazione e un rapporto segnale/rumore ottimale per la regione di interesse.
- Fare clic sul pulsante Esegui per avviare la raccolta dei dati e salvare i segnali a radiofrequenza (RF) in formato file .mat.
NOTA: Iniziare la raccolta dei dati 30 secondi dopo l'avvio della pompa di microiniezione per garantire una distribuzione uniforme e stabile dei MB all'interno del corpo del ratto.
- Imposta le profondità di inizio e fine della raccolta dei dati rispettivamente a 5 e 120 lunghezze d'onda, per catturare efficacemente la regione di interesse.
4. Elaborazione e analisi dei dati (Timing ~ 8 h)
- Elaborazione dati
- Importa i dati RF in MATLAB 2021a e demodulali per generare dati in fase e in quadratura (I/Q) (vedi Tabella dei materiali).
- Fare clic sul pulsante Esegui per utilizzare l'algoritmo DAS (Delay-and-Sum) per il beamforming sui dati I/Q (vedere la Tabella dei materiali).
NOTA: frame rate post-compounding di 800 Hz, per un totale di 120.000 fotogrammi.
- Imaging ULM
- Applica l'algoritmo di filtraggio spazio-temporale SVD (Singular Value Decomposition)17 ai dati IQ per rimuovere il rumore di fondo e il disordine. Ogni 800 fotogrammi viene memorizzato come blocco di dati e la soglia SVD è impostata su [15, 800].
- Individua il centro di ogni MB utilizzando l'algoritmo di adattamento gaussiano18.
- Utilizza l'algoritmo di Kuhn-Munkres per tracciare le traiettorie MB attraverso fotogrammi consecutivi in base alle loro posizioni (vedi Tabella dei materiali).
- Mappa le traiettorie MB su una griglia sovracampionata 8x, utilizzando una mappa a colori caldi per visualizzare il numero di traiettorie MB e una mappa a colori a getto per codificare la velocità del flusso mappando la velocità calcolata in ogni posizione all'interno della microvascolarizzazione.
- Applica una combinazione di colori personalizzata per distinguere le direzioni del flusso verso l'alto e verso il basso, ottenendo immagini ad alta risoluzione per una migliore visualizzazione.
- Dividi casualmente le traiettorie MB originali in due gruppi per creare due sottoimmagini, esegui una trasformata di Fourier su ciascuna e calcola la correlazione dell'anello di Fourier (FRC) come correlazione normalizzata dei loro spettri. Definisci la risoluzione come l'inverso della frequenza spaziale in cui l'FRC scende al di sotto della soglia19.
Risultati
La Figura 1 illustra la configurazione dettagliata per l'imaging ULM microvascolare cerebrale in vivo nei ratti, con ogni elemento accuratamente progettato per ridurre al minimo la variabilità sperimentale e garantire un'acquisizione accurata dei dati per risultati di imaging affidabili a super-risoluzione.
La Figura 2A mostra la struttura ricostruita ULM della microvascolarizzazione nel cervello di ratto, posizionata a -1 mm dal punto di Bregma, con una profondità di imaging vicina a 12 mm. Lo spessore effettivo della fetta sul piano di imaging varia da 0,1 mm a 0,3 mm. Sia i microvasi meno profondi che quelli più profondi sono chiaramente visibili e la qualità dell'immagine non si deteriora con l'aumentare della profondità (Figura 2B). Calcolando l'intera larghezza a metà massimo (FWHM) della distribuzione dell'intensità lungo la linea tratteggiata nelle regioni di interesse (ROI), è possibile rilevare recipienti di vari diametri, con il più piccolo di 13 μm (Figura 2C). Applicando la correlazione dell'anello di Fourier (FRC) per la valutazione della risoluzione, la risoluzione spaziale dell'imaging della microvascolarizzazione del cervello di ratto è quantificata in 12,5 μm (Figura 2D).
Le informazioni sul flusso sanguigno sono fondamentali per riflettere le risposte fisiologiche e diagnosticare le malattie. La Figura 3A illustra le direzioni del flusso sanguigno in una sezione trasversale del cervello di ratto, dove il blu indica il flusso verso la sonda e il rosso indica il flusso lontano dalla sonda. Sulla base di ciò, è possibile differenziare regioni cerebrali specifiche come le piccole arterie della corteccia che scorrono verso il basso e le piccole vene che scorrono verso l'alto20 (Figura 3B). La Figura 3C mostra una mappa della velocità del flusso sanguigno cerebrale codificata in diversi colori, con vasi più grandi che mostrano velocità di flusso notevolmente più elevate. La distribuzione delle velocità varia da 1 a 80 mm/s, prevalentemente concentrata nell'intervallo 10-25 mm/s (Figura 3D), che rappresenta l'81,57% dell'intero intervallo di velocità. Questa proporzione viene calcolata determinando il numero di punti dati di velocità nell'intervallo 5-25 mm/s rispetto al numero totale di punti dati nella matrice di velocità.
La Figura 4 presenta i risultati dell'imaging di un modello di ratto con glioblastoma utilizzando il protocollo proposto. Le cellule di glioblastoma C6 sono state impiantate nel cervello di ratto. La Figura 4A mostra la struttura microvascolare nel cervello di un modello di ratto con glioblastoma, con dilatazione vascolare anomala e irregolarità strutturali osservate intorno al tumore. I vasi nella regione tumorale mostrano una maggiore tortuosità rispetto all'area normale sul lato sinistro. La Figura 4B fornisce informazioni sulla direzione del flusso sanguigno, consentendo una comprensione dei modelli di flusso all'interno della regione tumorale. La Figura 4C mostra una mappa della velocità del flusso sanguigno, rivelando l'eterogeneità del flusso vascolare all'interno e intorno al tumore.
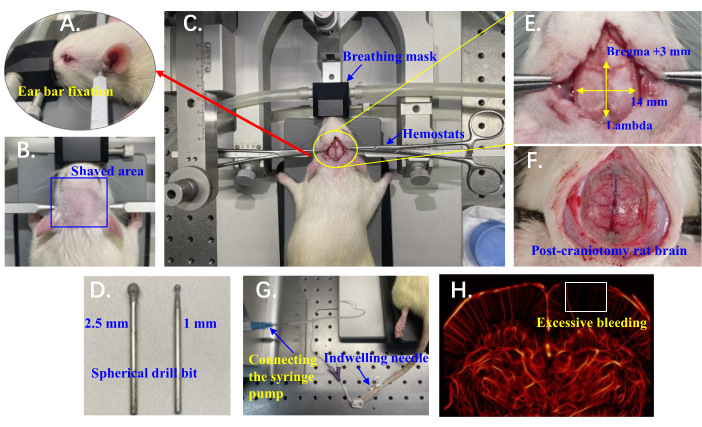
Figura 1: Dettagli della configurazione sperimentale per l'imaging ULM in vivo della microvascolarizzazione del cervello di ratto. (A) Posizione delle barre auricolari utilizzate per stabilizzare la testa del ratto. (B) L'area rasata sulla testa del ratto preparata per l'accesso chirurgico. (C) Ratto posizionato sullo strumento stereotassico con una maschera respiratoria; Gli emostatici vengono utilizzati per ritrarre la pelle su entrambi i lati. (D) Punte da trapano sferiche (2,5 mm e 1 mm) montate sul trapano cranico per craniotomia. (E) Area di craniotomia marcata rispetto a Bregma e Lambda. (F) Cervello di ratto esposto dopo craniotomia. (G) Un ago a permanenza inserito nella vena caudale del ratto e collegato a una pompa a siringa per microiniezione. (H) Esempio di vascolarizzazione cerebrale di ratto con sanguinamento eccessivo; Il riquadro bianco evidenzia una regione priva di ricostruzione vascolare. Clicca qui per visualizzare una versione più grande di questa figura.
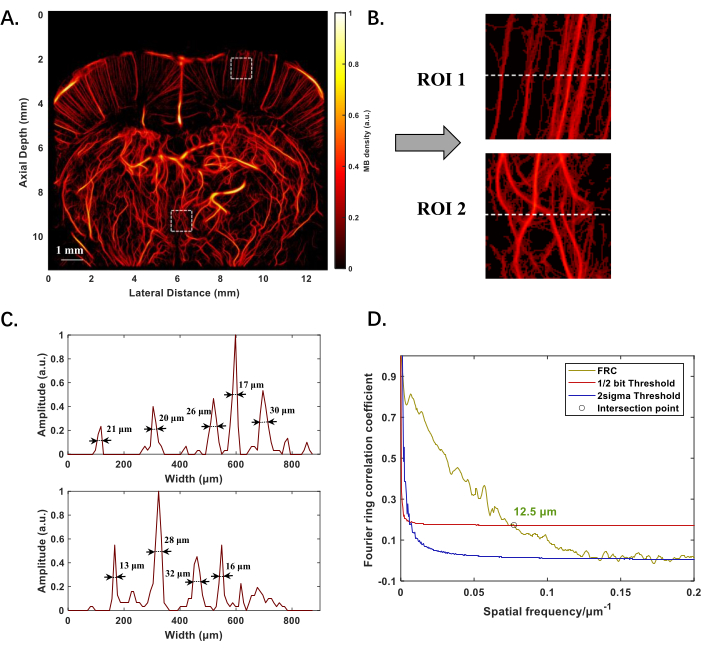
Figura 2: Risultati sperimentali della ricostruzione ULM della struttura microvascolare del cervello di ratto in vivo. (A) Struttura microvascolare del cervello di ratto a -1 mm dal punto di Bregma. (B) Immagini ingrandite di due regioni di interesse (ROI) in posizioni meno profonde e meno profonde in A, per evidenziare la morfologia di piccoli vasi. (C) Distribuzione dell'intensità lungo la linea tratteggiata in B, con valori numerici che indicano i diametri delle navi misurati utilizzando l'intera larghezza a metà del massimo (FWHM). (D) Valutazione delle prestazioni di ricostruzione ULM utilizzando la tecnica dell'anello di Fourier, è stato scelto il 1/2 bit per standardizzare la risoluzione senza sacrificare la qualità dell'immagine, che definisce la frequenza spaziale più alta in cui la correlazione indica ancora informazioni statisticamente significative. Il "○" segna il punto di intersezione della curva di correlazione e la soglia di 1/2 bit, indicando il limite di risoluzione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Risultati sperimentali della ricostruzione ULM della direzione e della velocità del flusso sanguigno microvascolare nel cervello di ratto in vivo. (A) Direzione del flusso sanguigno nel cervello di ratto. Il blu indica il flusso verso l'alto verso la sonda e il rosso indica il flusso verso il basso lontano dalla sonda. (B) Piccole arterie e vene nelle regioni corticali del cervello di ratto delineate in base alla direzione del flusso sanguigno. (C) Velocità del flusso sanguigno nel cervello di ratto. (D) Istogramma della velocità del flusso sanguigno nel cervello di ratto, che mostra la distribuzione da 1 mm/s a 80 mm/s. Le barre azzurre rappresentano l'intervallo di velocità 5-25 mm/s. La linea rossa rappresenta la curva adattata ai dati, illustrando il tipico profilo di distribuzione della velocità. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Risultati sperimentali della ricostruzione ULM della struttura microvascolare nel modello di glioblastoma cerebrale di ratto in vivo. (A) Struttura microvascolare del cervello di ratto. (B) Direzione del flusso sanguigno nel cervello di ratto. (C) Velocità del flusso sanguigno nel cervello di ratto. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo ha utilizzato con successo l'ULM per eseguire l'imaging a super-risoluzione della microvascolarizzazione cerebrale di ratto in vivo. Rispetto ad altre modalità di imaging, l'ULM si adatta contemporaneamente sia alla risoluzione spaziale che alla profondità di penetrazione. Il cervello di ratto esposto è stato ripreso piuttosto che attraverso il cranio, evitando l'attenuazione e la distorsione causate dalla presenza di osso. Sotto un trasduttore con una frequenza centrale di 15,625 MHz, sono state catturate strutture vascolari a una profondità di circa 12 mm, con una risoluzione spaziale fino a 12,5 μm. La direzione del flusso sanguigno ha facilitato la differenziazione di regioni specifiche di piccole arterie e vene. Inoltre, la tecnica supporta un'ampia gamma di misure della velocità del flusso (1-80 mm/s).
La craniotomia eseguita sui ratti è fondamentale in questo protocollo. Durante l'intervento chirurgico, è essenziale ridurre al minimo il sanguinamento eccessivo. Da un lato, un sanguinamento eccessivo può influire sulla circolazione sanguigna, una manifestazione tipica è l'assenza di ricostruzione vascolare nelle aree corticali. D'altra parte, può anche causare cambiamenti fisiologici o addirittura la morte negli animali da esperimento. Il dispositivo stereotassico utilizzato nella procedura è dotato di un programma di craniotomia automatizzato che può ridurre il trauma e aumentare il tasso di successo, ma si basa molto sull'esperienza del professionista. Questo perché è necessaria una determinazione precisa della posizione e della profondità del sito di perforazione per evitare di causare danni o lesioni secondarie al cervello del ratto. Sebbene la craniotomia non sia sempre necessaria, l'imaging ULM transcranico si dimostra promettente, ma richiede robusti algoritmi di compensazione o correzione della distorsione. Inoltre, viene impiegata una pompa di microiniezione per somministrare costantemente i MB, assicurando che rimangano radi e stabili all'interno del sistema vascolare del ratto. Questo approccio è facile da usare per le tecniche di localizzazione convenzionali, in quanto facilita le ricostruzioni ULM di alta qualità. Tuttavia, prolunga sia l'acquisizione dei dati che la durata dell'imaging, rendendo l'imaging ULM un processo prolungato. Una strategia alternativa prevede l'uso di iniezioni di MB ad alta densità, che richiede l'implementazione di algoritmi avanzati, come il deep learning21,22, per mantenere la risoluzione dell'immagine senza degradazione.
L'anestesia con isoflurano è stata utilizzata seguendo il dosaggio raccomandato dal produttore dell'apparecchiatura per mantenere la stabilità fisiologica nel ratto. Tuttavia, come documentato in studi precedenti, l'anestesia con isoflurano ha effetti noti sul sistema circolatorio, influenzando potenzialmente parametri cardiovascolari come la pressione sanguigna e la frequenza cardiaca23,24. Questi cambiamenti possono introdurre variabilità nella dinamica del flusso sanguigno, influenzando potenzialmente l'accuratezza delle misurazioni del flusso sanguigno.
In conclusione, questo protocollo dimostra l'ampio potenziale applicativo dell'ULM, fornendo un riferimento per la ricerca prospettica sulle malattie cerebrali basata su modelli di piccoli animali. Ha un valore significativo per comprendere i cambiamenti fisiopatologici a livello microvascolare e per valutare la risposta della progressione della malattia ai trattamenti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto in parte dal National Key Research and Development Program of China nell'ambito della sovvenzione 2023YFC2410903, dalla National Natural Science Foundation of China (Grants 12274092, 12034005), dall'Explorer Program di Shanghai (Grant 21TS1400200), dall'International Science and Technology Cooperation Program di Shanghai (Grant 24490710400) e dall'AI for Science Foundation dell'Università Fudan (Grant FudanX24AI016).
Materiali
| Name | Company | Catalog Number | Comments |
| Alcohol | DICHANG | https://www.dehsm.com/goods-17187.html | 75% |
| Beamforming program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Body temperature maintenance device | RWD Life Science Co., Ltd. | 69026 | |
| Brain stereotaxic instrument | RWD Life Science Co., Ltd. | 71000-R | Adaptable to breathing mask |
| Cranial Microinjection Surgical Instrument Kit | RWD Life Science Co., Ltd. | SP0005-R | |
| Digital microscope | RWD Life Science Co., Ltd. | DOM-1001 | |
| Drug delivery catheter | RWD Life Science Co., Ltd. | https://www.rwdls.com/product-solutions/life-sciences/administration/draw-blood | |
| Erythromycin ointment | Renhe Pharma | H36020018 | 1% x 15 g |
| Gas anesthesia machine | RWD Life Science Co., Ltd. | R500IE | Includes breathing mask |
| Handheld electric clipper | GUAZHOUMU | MJD-DTJ02 | |
| Handheld mini cranial drill | RWD Life Science Co., Ltd. | 78001 | |
| Indwelling needle | Kindly EnterpriseDevelopment Group Co., LTD | Positive Pressure Model | 26 G |
| Iodine solution | HYNAUT | https://www.hainuocn.com/index/detail/524.html | 4.5–5.5 g/L |
| IQ demodulation program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Isoflurane | RWD Life Science Co., Ltd. | R510-22-10 | |
| MATLAB software | MathWorks | Version R2021a | |
| Microinjection pump | RWD Life Science Co., Ltd. | R462 | |
| Sodium chloride injection | SHENG'AO animals pharmaceutical Co., Ltd. | 270071460 | 0.90% |
| SonoVue | Bracco | https://www.bracco.com/en-se/product/sonovue | |
| Spherical drill bit | RWD Life Science Co., Ltd. | HM1027/HM1010 | |
| Supporting Positioning Software | RWD Life Science Co., Ltd. | V2.0.0.30400 | |
| Syringe | Kindly EnterpriseDevelopment Group Co., Ltd. | RWLB | 1 mL |
| Tracking program | Jean-Yves Tinevez | 2016 version | |
| Ultrasound gel | Junkang Medical Equipment Co., Ltd. | Model DS-1 | |
| Ultrasound probe | VERASONICS, INC. | L22-14vX LF | |
| Verasonics Ultrasound System | VERASONICS, INC. | Vantage-256 | ultrasound platform |
Riferimenti
- Sweeney, M. D., Ayyadurai, S., Zlokovic, B. V. Pericytes of the neurovascular unit: Key functions and signaling pathways. Nat Neurosci. 19 (6), 771-783 (2016).
- Wardlaw, J. M., Smith, C., Dichgans, M. Mechanisms of sporadic cerebral small vessel disease: Insights from neuroimaging. Lancet Neurol. 12 (5), 483-497 (2013).
- Fang, J., Wang, Z., Miao, C. -. Y. Angiogenesis after ischemic stroke. Acta Pharmacol Sin. 44 (7), 1305-1321 (2023).
- Zlokovic, B. V. Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders. Nat Rev Neurosci. 12 (12), 723-738 (2011).
- Kane, J. R. The role of brain vasculature in glioblastoma. Mol Neurobiol. 56 (9), 6645-6653 (2019).
- Iadecola, C. The pathobiology of vascular dementia. Neuron. 80 (4), 844-866 (2013).
- Ren, B., et al. Cerebral small vessel disease: Neuroimaging features, biochemical markers, influencing factors, pathological mechanism and treatment. Front Neurol. 13, 843953 (2022).
- Bradley, C. P., Berry, C. Microvascular arterial disease of the brain and the heart: A shared pathogenesis. QJM. 116 (10), 829-834 (2023).
- Baltes, C., Radzwill, N., Bosshard, S., Marek, D., Rudin, M. Micro MRI of the mouse brain using a novel 400 MHz cryogenic quadrature RF probe. NMR Biomed. 22 (8), 834-842 (2009).
- Brancaccio, R., Bettuzzi, M., Morigi, M. P., Casali, F., Ragazzini, L. Image quality and dose assessment in inner ear computed tomography imaging with a flat panel-based system. J Comput Assist Tomogr. 39 (2), 232-239 (2015).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Osmanski, B. -. F., et al. Ultrafast Doppler imaging of blood flow dynamics in the myocardium. IEEE T Med Imaging. 31 (8), 1661-1668 (2012).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (storm). Nat Methods. 3 (10), 793-796 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91 (11), 4258-4272 (2006).
- Christensen-Jeffries, K., et al. Super-resolution ultrasound imaging. Ultrasound Med Biol. 46 (4), 865-891 (2020).
- Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., Tanter, M. Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Trans Ultrason Ferroelectr Freq Control. 65 (8), 1304-1320 (2018).
- Demené, C., et al. Spatiotemporal clutter filtering of ultrafast ultrasound data highly increases Doppler and fUltrasound sensitivity. IEEE Trans Med Imaging. 34 (11), 2271-2285 (2015).
- Errico, C., et al. Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature. 527 (7579), 499-502 (2015).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. J Struct Biol. 183 (3), 363-367 (2013).
- Lowerison, M. R., et al. Super-resolution ultrasound reveals cerebrovascular impairment in a mouse model of Alzheimer's disease. J Neurosci. 44 (9), e1251232024 (2024).
- Zhang, G., et al. ULM-MBCNRT: In vivo ultrafast ultrasound localization microscopy by combining multi-branch CNN and recursive transformer. IEEE Trans Ultrason Ferroelectr Freq Control. , (2024).
- Zhang, G., et al. In vivo ultrasound localization microscopy for high-density microbubbles. Ultrasonics. 143, 107410 (2024).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Lab Anim. 48 (1), 6-14 (2014).
- Lenz, C., Rebel, A., Van Ackern, K., Kuschinsky, W., Waschke, K. F. Local cerebral blood flow, local cerebral glucose utilization, and flow-metabolism coupling during sevoflurane versus isoflurane anesthesia in rats. Anesthesiology. 89 (6), 1480-1488 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon