Method Article
Ressecção laparoscópica por via de acesso esquerdo do lobo caudado
Neste Artigo
Resumo
Aqui, apresentamos um protocolo cirúrgico que descreve a ressecção laparoscópica de um tumor situado próximo à porção paracava dentro do lobo caudado, utilizando uma abordagem do lado esquerdo.
Resumo
A lobectomia caudada laparoscópica (LCL) é um dos tipos mais desafiadores de ressecções hepáticas laparoscópicas. A principal dificuldade está na posição anatômica profunda do lobo caudado, que é adjacente ao primeiro e segundo portos hepáticos e à veia cava inferior, aumentando o risco de sangramento importante durante a cirurgia. Além de uma compreensão completa da anatomia do tumor do lobo caudado, avaliação abrangente por imagem e reconstrução tridimensional, a escolha flexível da abordagem cirúrgica também é fundamental para reduzir a dificuldade cirúrgica e melhorar a segurança. Realizamos lobectomia caudada laparoscópica usando uma abordagem do lado esquerdo, especialmente quando o tumor está localizado na área do lobo caudado próximo à veia cava inferior. Este método evita a etapa de dividir a substância hepática para expor o campo de visão exigido pela abordagem anterior tradicional, com as vantagens de maior espaço operacional e menor tempo de operação. Ao mesmo tempo, combinado com a tecnologia de reconstrução tridimensional pré-operatória, reduzimos significativamente o risco de danificar vasos sanguíneos importantes e aumentamos a taxa de sucesso da ressecção de tumores no lobo caudado.
Introdução
O lobo caudado está situado profundamente no fígado, com sua cobertura específica estendendo-se da frente da veia cava inferior, alcançando atrás das veias hepáticas esquerda, média e direita, para cima até onde as três veias hepáticas principais convergem para a veia cava inferior e para baixo até o hilo hepático1.
Desde o relato pioneiro de Dulucq et al. em 2006 sobre ressecções laparoscópicas do lobo caudado hepático, numerosos casos envolvendo ressecções isoladas do lobo caudado e ressecções segmentares foram documentados 2,3,4,5,6,7. No entanto, a complexidade técnica da lobectomia caudada laparoscópica está sujeita a uma infinidade de fatores. Isso inclui adesão rigorosa às indicações cirúrgicas, avaliação pré-operatória abrangente dos dados de imagem, domínio das técnicas cirúrgicas laparoscópicas, conhecimento íntimo da anatomia local do lobo caudado e seleção criteriosa das abordagens cirúrgicas. Atualmente, existem quatro abordagens predominantes para a ressecção do lobo caudado: a abordagem do lado esquerdo, a abordagem do lado direito, a abordagem combinada esquerda-direita e a abordagem anterior. A abordagem do lado esquerdo é normalmente empregada para a ressecção do lobo de Spiegel ou quando é necessária uma ressecção combinada do segmento lateral esquerdo ou do hemifígado esquerdo. Por outro lado, a abordagem do lado direito é favorecida para a ressecção do processo caudado ou, nos casos que necessitam de ressecção do hemifígado direito. Nos casos em que o tumor é desproporcionalmente grande ou se infiltra extensivamente no lobo caudado, complicando assim a exposição por meio da abordagem esquerda ou direita, uma abordagem combinada esquerda-direita pode se tornar indispensável. Para a ressecção de tumores próximos à veia cava inferior, a abordagem anterior é geralmente preferida, pois facilita a exposição e visualização ideais.
O segmento paracavo, uma parte crucial do lobo caudado, é amplamente reconhecido como o segmento IX de Couinaud. Está estrategicamente posicionado atrás do segmento IV, essencialmente o epicentro da anatomia do fígado. Sua superfície dorsal está em contato íntimo com a veia cava inferior, enquanto seu limite inferior está estreitamente alinhado com o primeiro portal hepático. A extremidade cefálica desse segmento é contígua às origens das veias hepáticas média e direita, e seu aspecto ventral está em aposição direta ao tronco principal da veia hepática média. Dada a sua localização oculta e sua adjacência às principais estruturas vasculares do fígado, as intervenções cirúrgicas nessa área são inerentemente arriscadas e tecnicamente desafiadoras. Historicamente, os procedimentos cirúrgicos direcionados ao segmento paracavo do lobo caudado têm utilizado predominantemente abordagens laparoscópicas anteriores ou do lado direito 8,9,10. Há uma escassez de literatura sobre abordagens do lado esquerdo, provavelmente devido à profundidade profunda dessa região e ao campo de visão restrito da esquerda, agravado pela intrincada arquitetura vascular nas proximidades. Tais complexidades exigem que o cirurgião possua um profundo conhecimento da anatomia e uma riqueza de conhecimentos cirúrgicos. Os avanços na tecnologia de reconstrução de visualização tridimensional (3D) permitiram a criação de modelos tridimensionais precisos e vívidos do fígado11. Esses modelos oferecem uma representação clara do fígado, do tumor, do sistema vascular hepático e das relações espaciais entre o fígado e os órgãos vizinhos. Essa tecnologia é fundamental para fornecer uma compreensão pré-operatória abrangente das condições específicas do fígado, a localização precisa do tumor e a intrincada interação dos vasos sanguíneos.
Neste artigo, apresentamos uma estratégia cirúrgica inovadora: alavancar avaliações tridimensionais pré-operatórias e empregar uma abordagem laparoscópica do lado esquerdo para a excisão de tumores na região paracaval. Essa abordagem visa aumentar a precisão e a segurança cirúrgicas, capitalizando os insights anatômicos detalhados fornecidos pelas modernas técnicas de imagem.
Uma paciente de 30 anos foi internada no hospital de Zhujiang com um achado incidental de uma lesão no fígado que ocupa espaço, detectada há mais de um mês. A tomografia computadorizada (TC) aprimorada revelou uma massa com sombra de baixa densidade, medindo aproximadamente 37 mm x 34 mm. Os diagnósticos preliminares incluíram hiperplasia nodular focal ou adenoma hepático, que requerem maior diferenciação (Figura 1). A reconstrução pré-operatória de visualização tridimensional está representada na Figura 2. O hemograma completo do paciente, o perfil de coagulação e os testes de função hepática estavam todos dentro dos limites normais. Ela não tinha história médica significativa e as avaliações pré-operatórias não confirmaram contraindicações à cirurgia. Dado o risco potencial de malignidade associado aos adenomas hepáticos, os cirurgiões se envolveram em discussões detalhadas com a paciente e sua família, garantindo que estivessem totalmente informados. Após uma compreensão completa dos riscos cirúrgicos e dos possíveis resultados terapêuticos, a paciente e sua família tomaram uma decisão informada de prosseguir com o tratamento cirúrgico. Eles forneceram consentimento assinando o termo de consentimento informado cirúrgico, demonstrando sua compreensão clara do procedimento e compromisso com a saúde e o bem-estar do paciente.
Protocolo
O procedimento cirúrgico recebeu autorização do Comitê de Ética do Hospital Zhujiang, Southern Medical University. Além disso, a paciente e sua família forneceram consentimento informado para compartilhar publicamente informações e dados pertinentes ao processo de tratamento. Isso garante transparência e respeita a autonomia do paciente no processo de tomada de decisão médica.
1. Preparo pré-operatório
- Faça com que o paciente jejue por 8 h e evite beber por 4 h antes da cirurgia.
- Administrar anestesia geral e realizar intubação endotraqueal12.
NOTA: Avalie a eficácia da anestesia avaliando a condição do paciente tanto no pós-operatório quanto no intraoperatório. Os principais indicadores incluem alcançar um bloqueio completo da sensação, não necessitar de medicação adicional durante o procedimento e manter os sinais vitais estáveis durante toda a cirurgia. - Desinfetar a área cirúrgica, desde os mamilos até a sínfise púbica e o terço superior das coxas, com tintura de iodo três vezes, estendendo-se até a linha axilar média.
2. Técnica cirúrgica
- Coloque o paciente em decúbito dorsal com as pernas afastadas, a cabeça elevada e uma inclinação de 15° para a direita.
- Estabeleça o pneumoperitônio com uma agulha de Veress13. Ajuste a pressão do pneumoperitônio para 12-14 mmHg (1 mmHg = 0,133 kPa).
- Faça uma incisão de 1 cm com uma lâmina de bisturi cirúrgico nº 10 na borda umbilical para uma porta de observação, com um trocarte de 10 mm inserido (ver Tabela de Materiais).
- Inserir os trocartes, medindo 5 mm e 10 mm de diâmetro, nos seguintes pontos anatômicos: 2 cm abaixo da borda da costela ao longo da linha axilar anterior direita, 8 cm abaixo da borda da costela ao longo da linha hemiclavicular direita e 2 cm e 6 cm abaixo da borda da costela ao longo da linha hemiclavicular esquerda, respectivamente (Figura 3).
- Realize a avaliação laparoscópica inicial para determinar a viabilidade de uma abordagem do lado esquerdo para a ressecção do lobo caudado. Observe o grau de adesão intraperitoneal do omento, a textura da superfície do fígado e a posição dos ligamentos triangulares esquerdo e direito e dos ligamentos falcados.
- Use o bisturi ultrassônico (consulte a Tabela de Materiais) para transeccionar o ligamento falciforme, revelando o triângulo da vesícula biliar. Em seguida, ligue o ducto cístico e disseque a vesícula biliar.
- Use o bisturi ultrassônico para limpar o pequeno forame omental, expor o hilo hepático e permitir o estabelecimento de uma fita de oclusão hilar hepática.
- Vire o lobo direito do fígado para expor a veia cava inferior e ligue e corte as veias curtas hepáticas com 3-0 Hem-o-lok (ver Tabela de Materiais) (Figura 4).
- Exponha a área de Spiegel do lobo caudado, seguida de oclusão hilar hepática e, em seguida, passe o parênquima hepático ao longo da incisura do lobo caudado usando o bisturi ultrassônico (Figura 5).
- Use o bisturi ultrassônico e a pinça cirúrgica para ressecar o parênquima hepático para expor o tumor adjacente à veia cava inferior (Figura 6 e Figura 7).
- Dissecar cuidadosamente o tumor, usar bisturi ultrassônico com equipamento de congelamento para coagular pequenas veias e expor a veia hepática média (Figura 8).
- Exponha e ligue a veia porta ao lobo caudado direito com Hem-o-lok 3-0, seguido de mobilização tumoral (Figura 9, Figura 10 e Figura 11).
- Use eletrocoagulação bipolar para hemostasia e recuperação de amostras. Use 800 mL de solução de NaCl a 0,9% para irrigar a cavidade abdominal (Figura 12) e feche com o tubo de drenagem colocado dentro da cavidade abdominal (ver Tabela de Materiais).
- Feche a ferida camada por camada usando material de sutura não absorvível (ver Tabela de Materiais).
3. Enfermagem e acompanhamento pós-operatório
- Nas primeiras 24 horas após a cirurgia, realize monitoramento cardíaco (consulte a Tabela de Materiais) e forneça oxigenoterapia contínua de baixo fluxo a 3 L/min, monitorando de perto os sinais vitais.
- No primeiro dia de pós-operatório, dê ao paciente uma dieta semissólida e instrua-o a realizar exercícios de giro e na cama.
NOTA: Os cuidados pós-operatórios incluem tratamentos hepatoprotetores, anti-infecciosos, anti-hemorrágicos, analgésicos, albumina e gastroprotetores. - Monitore os tubos de drenagem quanto à cor, volume e alterações nos níveis de bilirrubina. Remova o tubo de drenagem assim que os níveis de bilirrubina voltarem ao normal e a drenagem for inferior a 50 mL.
Resultados
A cirurgia (Vídeo 1) durou 372 min com perda de sangue de 300 mL, e nenhuma transfusão de sangue foi necessária. Houve cinco casos de oclusão do portal hepático, totalizando 70 min. O paciente não apresentou complicações pós-operatórias e teve uma recuperação tranquila, permanecendo no hospital por 8 dias após a cirurgia. O exame anatomopatológico indicou hiperplasia nodular focal (HNF) do fígado. O nível de bilirrubina no fluido de drenagem diminuiu de 30,1 μmol/L no terceiro dia de pós-operatório para 21,4 μmol/L no quinto dia de pós-operatório (ver Tabela 1), com o tubo de drenagem removido no sexto dia de pós-operatório. As imagens pós-operatórias e anatomopatológicas são mostradas na Figura 13.
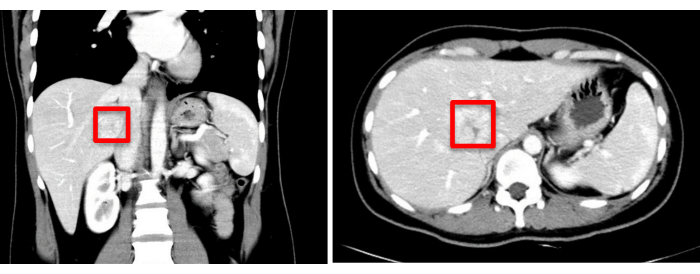
Figura 1: A avaliação por imagem pré-operatória (TC) indica a localização do tumor, marcada com um quadrado vermelho. Clique aqui para ver uma versão maior desta figura.
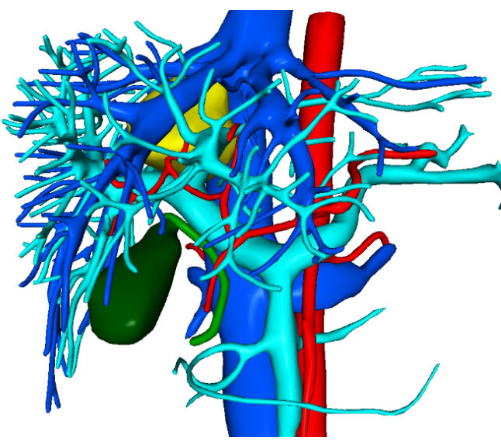
Figura 2: Imagens de reconstrução de visualização tridimensional pré-operatória. Clique aqui para ver uma versão maior desta figura.
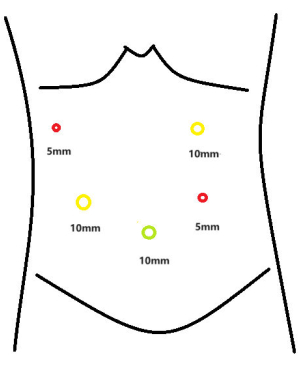
Figura 3: Mapa de distribuição do trocarte. Clique aqui para ver uma versão maior desta figura.
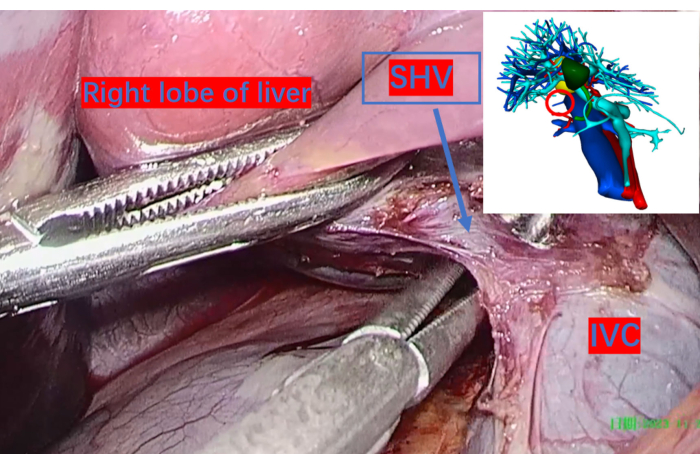
Figura 4: A veia cava inferior exposta do espaço hepático direito e as veias hepáticas curtas maiores ligadas com clipes de Hem-o-lok e seccionadas. O círculo vermelho na imagem de reconstrução tridimensional indica suas posições correspondentes. Abreviatura: SHV: veia hepática curta. VCI: veia cava inferior. Clique aqui para ver uma versão maior desta figura.

Figura 5: O parênquima hepático seccionado ao longo do processo caudado usando um bisturi ultrassônico. Clique aqui para ver uma versão maior desta figura.

Figura 6: A veia porta exposta até o primeiro ramo do lobo caudado esquerdo (G1L). G1L é o primeiro ramo da veia porta para o lobo caudado esquerdo. Clique aqui para ver uma versão maior desta figura.

Figura 7: Tumor cuidadosamente exposto, proporcionando uma visão clara de sua localização e facilitando as manobras cirúrgicas subsequentes. Clique aqui para ver uma versão maior desta figura.
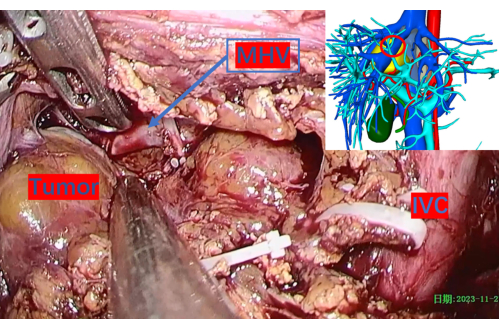
Figura 8: Veia hepática média cautelosamente exposta. O círculo vermelho indica sua posição correspondente na imagem de reconstrução 3D. Abreviaturas: MHV: veia hepática média, VCI: veia cava inferior. Clique aqui para ver uma versão maior desta figura.
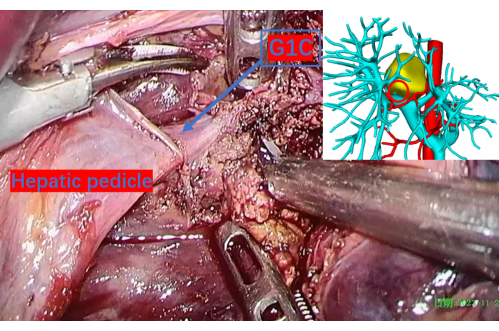
Figura 9: Parênquima hepático cuidadosamente seccionado revelando a veia porta até o primeiro ramo do lobo caudado direito, denotado como G1C. Um círculo vermelho na imagem de reconstrução 3D corresponde a este local, fornecendo um ponto de referência preciso. G1C é o primeiro ramo da veia porta para o lobo caudado direito. Clique aqui para ver uma versão maior desta figura.

Figura 10: O sistema de Glisson responsável pelo suprimento sanguíneo do tumor. Este sistema foi exposto, preso e cortado. Clique aqui para ver uma versão maior desta figura.

Figura 11: Tronco principal exposto da veia hepática direita durante a dissecção do tumor. O círculo vermelho marca sua localização na imagem de reconstrução 3D. Abreviaturas: RHV: veia hepática direita. Clique aqui para ver uma versão maior desta figura.

Figura 12: Campo cirúrgico completamente irrigado e limpo após hemostasia. Abreviaturas: MHV: veia hepática média. RHV: veia hepática direita. VCI: veia cava inferior. Clique aqui para ver uma versão maior desta figura.
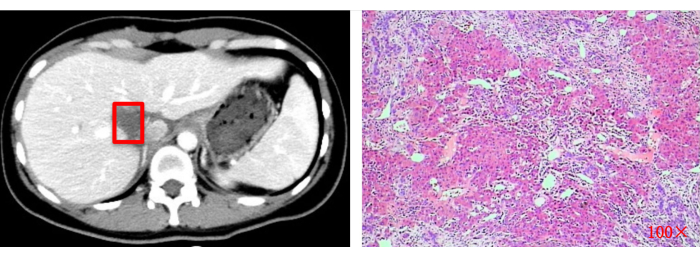
Figura 13: Avaliação por imagem (TC) e exame histopatológico pós-operatório (100x). Quadrados vermelhos indicam o local original de ressecção do tumor. Clique aqui para ver uma versão maior desta figura.
| Itens | Resultados |
| Tempo de operação (min) | 372 |
| Volume de sangramento intraoperatório (mL) | 300 |
| Volume de transfusão de sangue (mL) | 0 |
| Número de oclusão do portal hepático | 5 |
| Tempo de oclusão do portal hepático | 70 |
| Complicação pós-operatória | Nenhum |
| Internação pós-operatória (dia) | 8 |
| Drene os níveis de bilirrubina em POD3 (U/L) | 30.1 |
| Drene os níveis de bilirrubina em POD5 (U/L) | 21.4 |
Tabela 1: Resultados relevantes do paciente. Abreviaturas: DPO = dia de pós-operatório.
Vídeo 1: Ressecção laparoscópica por via esquerda do lobo caudado (técnica cirúrgica). Abreviaturas e definições: SHV: veia hepática curta. G1L: o primeiro ramo da veia porta para o lobo caudado esquerdo. MHV: veia hepática média. G1C: o primeiro ramo da veia porta para o lobo caudado direito. RHV: veia hepática direita. VCI: veia cava inferior. Clique aqui para baixar este vídeo.
Discussão
O fígado é um órgão crucial envolvido no metabolismo, função imunológica e desintoxicação14. Os hepatócitos, as células primárias do fígado, são tipicamente estáveis, mas podem se tornar instáveis quando acionados, iniciando a regeneração do tecido hepático. Após a ressecção hepática, o volume residual insuficiente do fígado pode levar a complicações pós-operatórias graves, como insuficiência hepática aguda. Assim, a avaliação rigorosa da função hepática pós-hepatectomia é de suma importância 15,16. Pesquisas indicam que o lobo caudado constitui cerca de 2% a 3% do volume do fígado em um corpo humano típico17. Dada a avaliação pré-operatória das reservas da função hepática, a ressecção do lobo caudado isoladamente geralmente não diminui significativamente o volume hepático remanescente, mitigando assim o risco de complicações pós-operatórias, como insuficiência hepática aguda.
O estudo de Kumon etal.18 elucida a anatomia vascular do lobo caudado do fígado, identificando dois pedículos hepáticos primários: o esquerdo e o direito. O pedículo esquerdo é posicionado de forma mais consistente, entrando no lobo caudado ao redor do terço médio e inferior do lobo de Spiegel. Por outro lado, o pedículo direito é mais variável, potencialmente estendendo-se para as áreas de processo paracavo ou caudado, e pode até estar ausente. Os ramos venosos portais no lobo caudado exibem complexidade, muitas vezes manifestando-se como ramos independentes ou um tronco compartilhado. A veia porta do lobo de Spiegel é mais estável, originando-se predominantemente de um ramo dorsal robusto (G1L) da veia porta esquerda. Em contraste, as veias portais que servem o processo caudado direito e a região paracava originam-se principalmente de ramos da veia porta principal direita, denominada primeiro ramo para o lobo caudado direito (G1C)19. As20 descrições de Cho et al detalham as artérias do lobo caudado em três tipos principais: ramos independentes, troncos comuns e aqueles decorrentes de anastomoses arteriais hepáticas. A drenagem biliar no lobo caudado geralmente envolve dois ductos principais, com 2 a 3 ramos no lobo de Spiegel convergindo para o ducto hepático esquerdo. A região paracava geralmente tem de 2 a 3 ductos que se fundem no ducto setorial posterior direito, com ocorrência significativa de anastomoses interductais18. A drenagem venosa do lobo caudado é principalmente através das veias hepáticas curtas para a veia cava inferior. A veia do processo caudado atravessa entre o processo caudado e o lobo posterior direito, drenando principalmente o processo caudado e unindo-se à borda inferior direita da veia cava inferior posterior, delineando o limite entre essas regiões. A veia hepática do lobo caudado principal corre entre o lobo de Spiegel e a área paracava, entrando na borda esquerda média da veia cava inferior posterior, servindo como uma demarcação anatômica entre o lobo de Spiegel e a região paracaval. Pinçamos e seccionamos meticulosamente os principais vasos e seus ramos, incluindo as veias hepáticas curtas, G1L, G1C e o pedículo hepático que alimenta o tumor. Essa precisão garante a segurança e a eficácia das intervenções cirúrgicas.
A anatomia distinta do lobo caudado, aninhada profundamente no fígado e adjacente à vasculatura chave, incluindo a veia cava inferior, a veia hepática média e a veia hepática direita, apresenta um desafio cirúrgico. Seu envoltório pelos hilos hepáticos eleva o risco de hemorragia, tornando a ressecção tecnicamente exigente. Pesquisas anteriores21 indicaram que uma hepatectomia esquerda estendida associada à ressecção do lobo caudado é preferível para malignidades no lobo caudado adjacente às veias hepáticas. No entanto, os avanços em nossa compreensão desses tumores levaram a uma maior adoção de ressecções diretas do lobo caudado e ressecções parciais. Essas abordagens facilitam a remoção radical do tumor enquanto conservam a função hepática22. Para neoplasias hepáticas primárias e secundárias no lobo caudado, a cirurgia é indicada quando tecnicamente viável. Tumores benignos do lobo caudado, como hemangiomas cavernosos, hiperplasia nodular focal (HNF), cálculos intra-hepáticos do ducto biliar e adenomas hepáticos, também são passíveis de ressecção total ou parcial, oferecendo opções de tratamento eficazes.
A ressecção hepática laparoscópica emergiu como uma técnica prevalente na cirurgia hepatobiliar 23,24,25. A visão de túnel e as capacidades de ampliação do procedimento oferecem vantagens distintas para a excisão do lobo caudado. Dentro dessa estrutura visual, a dissecção ao redor da veia cava inferior é facilitada, mesmo em espaços apertados, e a visualização de veias curtas hepáticas mais finas é aprimorada. No entanto, a técnica tem seus desafios, como a ausência de feedback tátil, capacidades limitadas de retração e as restrições dos planos de dissecação. Superá-los requer um cirurgião com considerável experiência, particularmente em ressecções parciais do lobo caudado. As abordagens comuns para ressecção do lobo caudado incluem as abordagens esquerda, direita, esquerda-direita combinada e anterior. A abordagem esquerda é normalmente usada para a ressecção do lobo de Spiegel ou em conjunto com a ressecção do segmento lateral esquerdo ou hemifígado esquerdo. A abordagem correta é indicada para a ressecção do processo caudado ou para os casos em que se considera a ressecção do hemifígado direito. Nos casos em que um tumor é extenso ou envolve todo o lobo caudado, necessitando de exposição difícil, uma abordagem combinada esquerda-direita pode ser empregada. A abordagem anterior é frequentemente utilizada para a ressecção da região paracaval, que envolve a divisão do tecido hepático normal. Este método pode levar a uma maior área de superfície de trauma hepático, aumentando o risco de lesões vasculares e do ducto biliar, além de aumentar a probabilidade de sangramento pós-operatório e vazamento biliar.
Tradicionalmente, os tumores paracavos têm sido tratados por meio de abordagens laparoscópicas anteriores ou do lado direito, com escassa literatura sobre procedimentos do lado esquerdo 8,9,10. Feng et al., em seu relato de caso publicado26, realizaram com sucesso ressecções abertas do lado esquerdo em dois casos de hemangiomas benignos no lobo caudado. Este estudo se concentrou na ressecção em bloco do lobo caudado, em vez de ressecções segmentares das três partes do lobo caudado. Para lesões benignas, esse método não reduziu de forma mais eficaz a ressecção desnecessária do parênquima hepático, diminuindo assim o risco de vazamento biliar. Atualmente, considerando a complexa estrutura vascular do lobo caudado, a cirurgia laparoscópica pode exibir mais claramente as estruturas vasculares sutis, reduzindo assim o risco de sangramento. Além disso, Zheng et al. realizaram um estudo no qual introduziram o "método de dissecção de Huaxi" pela primeira vez27. Eles usaram de forma inovadora uma abordagem laparoscópica do lado esquerdo para ressecar com sucesso tumores complexos no lobo caudado. Durante a cirurgia, eles empregaram um método de dissecção e estratificação no sentido anti-horário, progredindo de simples para complexo em uma sequência fixa. Essa abordagem simplifica o processo cirúrgico usando a curva de aprendizado, que é mais propícia ao aprendizado e domínio dos estudiosos, confirmando ainda mais a viabilidade da abordagem do lado esquerdo para ressecção do lobo caudado.
Essa escassez de casos do lado esquerdo pode ser atribuída à natureza profunda dos tumores paracavos, o que dificulta a exposição total do lado esquerdo devido à intrincada anatomia vascular circundante. No entanto, utilizando imagens pré-operatórias, realizamos um diagnóstico diferencial de hiperplasia nodular focal e adenomas hepáticos em tumores paracavos, mitigando as preocupações com a adequação da margem tumoral. Ao contrário do "método de dissecção de Huaxi", nosso centro emprega uma técnica de ressecção laparoscópica do lado esquerdo especificamente para tumores adjacentes à veia cava no lobo caudado. No pré-operatório, usamos a reconstrução 3D para avaliação para garantir a segurança cirúrgica. Além disso, o método cirúrgico aqui descrito evita a exposição da veia hepática esquerda, reduzindo o risco de ruptura e sangramento da veia hepática esquerda. Este método também minimiza danos desnecessários ao parênquima hepático, reduzindo assim a probabilidade de vazamento biliar pós-operatório. Com essas estratégias cirúrgicas refinadas, pretendemos alcançar uma ressecção mais segura e eficaz dos tumores do lobo caudado. Essa técnica evita a necessidade de dividir o tecido hepático, como na abordagem anterior. Oferece vantagens como um campo operatório mais espaçoso e menor duração operatória em comparação com a abordagem do lado direito. Além disso, o uso da tecnologia de reconstrução tridimensional pré-operatória minimizou significativamente o risco de lesão vascular importante e aumentou a viabilidade da ressecção do tumor. A operação foi concluída com eficiência em 372 min com uma perda de sangue de apenas 300 mL. O paciente teve uma evolução pós-operatória sem complicações, recebeu alta sem problemas no oitavo dia de pós-operatório e teve uma recuperação rápida.
Devemos reconhecer claramente que a necessidade de ressecção de tumores benignos depende de seu potencial de degeneração maligna e da presença de sintomas compressivos devido ao grande tamanho do tumor, que são críticos na determinação das indicações cirúrgicas. Para tumores malignos, a adequação de uma abordagem cirúrgica do lado esquerdo e a garantia de exposição adequada e margens de ressecção suficientes são questões que requerem investigação adicional. No entanto, com base em nossa pesquisa e experiência clínica, chegamos à conclusão de que a abordagem laparoscópica do lado esquerdo para a ressecção de tumores paracavos benignos é totalmente viável, especialmente com uma sólida compreensão do conhecimento anatômico e ampla experiência cirúrgica. Essa técnica cirúrgica não apenas oferece aos pacientes uma opção de tratamento minimamente invasiva, mas também garante a segurança da excisão do tumor, minimizando o trauma cirúrgico e encurtando os períodos de recuperação pós-operatória.
Divulgações
Os autores não têm conflitos ou vínculos financeiros a divulgar.
Agradecimentos
Este estudo foi apoiado pela Fundação de Pesquisa Básica e Aplicada de Guangdong da China (2021B1515230011), Projetos de Ciência e Tecnologia em Guangzhou da China (2023B03J1247) e o Programa de Pesquisa e Desenvolvimento de Área-Chave da Província de Guangdong (2023B1111020008).
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
Referências
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados