Method Article
Resezione laparoscopica con approccio sinistro del lobo caudato
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo chirurgico che descrive la resezione laparoscopica di un tumore situato vicino alla porzione paracavale all'interno del lobo caudato, utilizzando un approccio sinistro.
Abstract
La lobectomia caudata laparoscopica (LCL) è uno dei tipi più impegnativi di resezioni epatiche laparoscopiche. La difficoltà principale risiede nella posizione anatomica profonda del lobo caudato, che è strettamente adiacente alla prima e alla seconda porta epatica e alla vena cava inferiore, aumentando il rischio di sanguinamento maggiore durante l'intervento chirurgico. Oltre a una comprensione approfondita dell'anatomia del tumore del lobo caudato, alla valutazione completa dell'imaging e alla ricostruzione tridimensionale, la scelta flessibile dell'approccio chirurgico è anche la chiave per ridurre la difficoltà chirurgica e migliorare la sicurezza. Eseguiamo la lobectomia caudata laparoscopica utilizzando un approccio sinistro, soprattutto quando il tumore si trova nell'area del lobo caudato vicino alla vena cava inferiore. Questo metodo evita la fase di scissione della sostanza epatica per esporre il campo visivo richiesto dall'approccio anteriore tradizionale, con i vantaggi di uno spazio operativo più ampio e di un tempo di intervento più breve. Allo stesso tempo, in combinazione con la tecnologia di ricostruzione tridimensionale preoperatoria, abbiamo ridotto significativamente il rischio di danneggiare importanti vasi sanguigni e aumentato il tasso di successo della resezione dei tumori nel lobo caudato.
Introduzione
Il lobo caudato è situato in profondità all'interno del fegato, con la sua copertura specifica che si estende dalla parte anteriore della vena cava inferiore, raggiungendo dietro le vene epatiche sinistra, media e destra, verso l'alto fino al punto in cui le tre vene epatiche principali convergono nella vena cava inferiore e verso il basso fino all'ilo epatico1.
Dal rapporto pionieristico di Dulucq et al. nel 2006 sulle resezioni laparoscopiche del lobo caudato epatico, sono stati documentati numerosi casi di resezioni isolate del lobo caudato e resezioni segmentali 2,3,4,5,6,7. Tuttavia, la complessità tecnica della lobectomia caudataria laparoscopica è soggetta a una moltitudine di fattori. Questi includono la stretta aderenza alle indicazioni chirurgiche, la valutazione preoperatoria completa dei dati di imaging, la padronanza delle tecniche chirurgiche laparoscopiche, la conoscenza approfondita dell'anatomia locale del lobo caudato e la selezione oculata degli approcci chirurgici. Attualmente, ci sono quattro approcci prevalenti per la resezione del lobo caudato: l'approccio del lato sinistro, l'approccio del lato destro, l'approccio combinato sinistro-destro e l'approccio anteriore. L'approccio sinistro è tipicamente impiegato per la resezione del lobo di Spiegel o quando è richiesta una resezione combinata del segmento laterale sinistro o dell'emifegato sinistro. Al contrario, l'approccio destro è favorito per la resezione del processo caudato o, nei casi che richiedono una resezione emifegato destra. Nei casi in cui il tumore è sproporzionatamente grande o si infiltra ampiamente nel lobo caudato, complicando così l'esposizione attraverso l'approccio sinistro o destro, un approccio combinato sinistra-destra può diventare indispensabile. Per la resezione dei tumori vicino alla vena cava inferiore, l'approccio anteriore è generalmente preferito, in quanto facilita l'esposizione e la visualizzazione ottimali.
Il segmento paracavale, una parte cruciale del lobo caudato, è ampiamente riconosciuto come il segmento IX di Couinaud. È posizionato strategicamente dietro il segmento IV, essenzialmente l'epicentro dell'anatomia del fegato. La sua superficie dorsale è in stretto contatto con la vena cava inferiore, mentre il suo limite inferiore è strettamente allineato con la prima porta epatica. L'estremità cefalica di questo segmento è contigua alle origini delle vene epatiche medie e destre, e il suo aspetto ventrale è in diretta apposizione al tronco principale della vena epatica media. Data la sua posizione nascosta e la sua adiacenza alle principali strutture vascolari del fegato, gli interventi chirurgici in quest'area sono intrinsecamente rischiosi e tecnicamente impegnativi. Storicamente, le procedure chirurgiche mirate al segmento paracavale del lobo caudato hanno utilizzato prevalentemente approcci laparoscopici anteriori o destri 8,9,10. C'è una carenza di letteratura sugli approcci sul lato sinistro, probabilmente a causa della profonda profondità di questa regione e del campo visivo ristretto da sinistra, aggravato dall'intricata architettura vascolare nelle vicinanze. Tali complessità richiedono che il chirurgo operante possieda una profonda comprensione dell'anatomia e una vasta esperienza chirurgica. I progressi nella tecnologia di ricostruzione con visualizzazione tridimensionale (3D) hanno permesso la creazione di modelli epatici tridimensionali precisi e vividi11. Questi modelli offrono una chiara rappresentazione del fegato, del tumore, del sistema vascolare epatico e delle relazioni spaziali tra il fegato e gli organi vicini. Questa tecnologia è fondamentale per fornire una comprensione preoperatoria completa delle condizioni specifiche del fegato, della posizione precisa del tumore e dell'intricata interazione dei vasi sanguigni.
In questo articolo, introduciamo una strategia chirurgica innovativa: sfruttare le valutazioni tridimensionali preoperatorie e impiegare un approccio laparoscopico del lato sinistro per l'escissione dei tumori nella regione paracavale. Questo approccio mira a migliorare la precisione e la sicurezza chirurgica, capitalizzando le dettagliate intuizioni anatomiche fornite dalle moderne tecniche di imaging.
Una paziente di 30 anni è stata ricoverata all'ospedale di Zhujiang con il ritrovamento accidentale di una lesione epatica che occupa spazio, rilevata più di un mese fa. Le scansioni di tomografia computerizzata (TC) hanno rivelato una massa con un'ombra a bassa densità, che misura circa 37 mm x 34 mm. Le diagnosi preliminari si basavano sull'iperplasia nodulare focale o sull'adenoma epatico, che richiedono un'ulteriore differenziazione (Figura 1). La ricostruzione della visualizzazione tridimensionale preoperatoria è illustrata nella Figura 2. L'emocromo completo, il profilo della coagulazione e i test di funzionalità epatica del paziente erano tutti entro i limiti normali. Non aveva una storia medica significativa e le valutazioni preoperatorie hanno confermato l'assenza di controindicazioni alla chirurgia. Dato il potenziale rischio di malignità associato agli adenomi epatici, i chirurghi si sono impegnati in discussioni dettagliate con la paziente e la sua famiglia, assicurandosi che fossero pienamente informate. Dopo una comprensione approfondita dei rischi chirurgici e dei possibili esiti terapeutici, la paziente e la sua famiglia hanno preso una decisione informata di procedere con il trattamento chirurgico. Hanno fornito il consenso firmando il modulo di consenso informato chirurgico, dimostrando la loro chiara comprensione della procedura e l'impegno per la salute e il benessere del paziente.
Protocollo
La procedura chirurgica ha ricevuto l'autorizzazione dal Comitato Etico dell'Ospedale di Zhujiang, Southern Medical University. Inoltre, la paziente e la sua famiglia hanno fornito il consenso informato alla condivisione pubblica di informazioni e dati pertinenti al processo di trattamento. Ciò garantisce la trasparenza e rispetta l'autonomia del paziente nel processo decisionale medico.
1. Preparazione preoperatoria
- Far digiunare il paziente per 8 ore e astenersi dal bere per 4 ore prima dell'intervento chirurgico.
- Somministrare l'anestesia generale ed eseguire l'intubazione endotracheale12.
NOTA: Valutare l'efficacia dell'anestesia valutando le condizioni del paziente sia dopo l'anestesia che intraoperatoriamente. Gli indicatori chiave includono il raggiungimento di un blocco completo della sensazione, l'assenza di farmaci aggiuntivi durante la procedura e il mantenimento di segni vitali stabili durante l'intervento chirurgico. - Disinfettare l'area chirurgica, dai capezzoli alla sinfisi pubica e al terzo superiore delle cosce, con la tintura di iodio per tre volte, estendendosi fino alla linea medio-ascellare.
2. Tecnica chirurgica
- Posizionare il paziente in posizione supina con le gambe divaricate, la testa sollevata e un'inclinazione di 15° verso destra.
- Stabilire il pneumoperitoneo con un ago di Veress13. Impostare la pressione del pneumoperitoneo a 12-14 mmHg (1 mmHg = 0,133 kPa).
- Praticare un'incisione di 1 cm con una lama di bisturi chirurgico n. 10 sul bordo ombelicale per una porta di osservazione, con un trocar da 10 mm inserito (vedi Tabella dei materiali).
- Inserire i trocar, di 5 mm e 10 mm di diametro, nei seguenti punti di riferimento anatomici: 2 cm sotto il bordo della costola lungo la linea ascellare anteriore destra, 8 cm sotto il bordo della costola lungo la linea medioclavicolare destra e 2 cm e 6 cm sotto il bordo della costola lungo la linea medioclavicolare sinistra, rispettivamente (Figura 3).
- Eseguire la valutazione laparoscopica iniziale per determinare la fattibilità di un approccio del lato sinistro alla resezione del lobo caudato. Osservare il grado di adesione intraperitoneale dell'omento, la struttura superficiale del fegato e la posizione dei legamenti triangolari sinistro e destro e dei legamenti falcati.
- Utilizzare il bisturi a ultrasuoni (vedi Tabella dei materiali) per sezionare il legamento falciforme, rivelando il triangolo della cistifellea. Successivamente, legare il dotto cistico e sezionare la cistifellea.
- Utilizzare il bisturi a ultrasuoni per eliminare il piccolo forame omentale, esporre l'ilo epatico e consentire la creazione di un nastro di occlusione ilare epatica.
- Capovolgere il lobo epatico destro per esporre la vena cava inferiore e legare e sezionare le vene corte epatiche con 3-0 Hem-o-lok (vedi Tabella dei materiali) (Figura 4).
- Esporre l'area di Spiegel del lobo caudato, seguita dall'occlusione ilare epatica, quindi sezionare il parenchima epatico lungo la tacca del lobo caudato utilizzando il bisturi a ultrasuoni (Figura 5).
- Utilizzare il bisturi a ultrasuoni e le pinze operative per resecare il parenchima epatico per esporre il tumore adiacente alla vena cava inferiore (Figura 6 e Figura 7).
- Sezionare con cura il tumore, utilizzare un bisturi a ultrasuoni con un dispositivo di congelamento per coagulare le piccole vene ed esporre la vena epatica media (Figura 8).
- Esporre e legare la vena porta al lobo caudato destro con 3-0 Hem-o-lok, seguito dalla mobilizzazione del tumore (Figura 9, Figura 10 e Figura 11).
- Utilizzare l'elettrocoagulazione bipolare per l'emostasi e il prelievo dei campioni. Utilizzare 800 mL di soluzione di NaCl allo 0,9% per irrigare la cavità addominale (Figura 12) e chiudere con il tubo di drenaggio posizionato all'interno della cavità addominale (vedere la Tabella dei materiali).
- Chiudere la ferita strato per strato utilizzando materiale di sutura non assorbibile (vedi Tabella dei materiali).
3. Infermieristica e monitoraggio postoperatorio
- Entro le prime 24 ore dopo l'intervento, eseguire il monitoraggio cardiaco (vedere la Tabella dei Materiali) e fornire ossigenoterapia continua a basso flusso a 3 L/min, monitorando attentamente i segni vitali.
- Il primo giorno postoperatorio, somministrare al paziente una dieta semisolida e istruire il paziente a eseguire esercizi di rotazione e a letto.
NOTA: L'assistenza postoperatoria comprende trattamenti epatoprotettivi, antinfettivi, antiemorragici, analgesici, albumina e gastroprotettivi. - Monitorare i tubi di drenaggio per colore, volume e variazioni dei livelli di bilirubina. Rimuovere il tubo di drenaggio una volta che i livelli di bilirubina tornano alla normalità e il drenaggio è inferiore a 50 ml.
Risultati
L'intervento chirurgico (Video 1) è durato 372 minuti con una perdita di sangue di 300 ml e non è stata necessaria alcuna trasfusione di sangue. Ci sono stati cinque casi di occlusione portale epatica per un totale di 70 minuti. Il paziente non ha avuto complicanze postoperatorie e ha avuto un recupero regolare, rimanendo in ospedale per 8 giorni dopo l'intervento. L'esame patologico indicava iperplasia nodulare focale (FNH) del fegato. Il livello di bilirubina nel liquido di drenaggio è diminuito da 30,1 μmol/L il terzo giorno postoperatorio a 21,4 μmol/L il quinto giorno postoperatorio (vedi Tabella 1), con la rimozione del tubo di drenaggio il sesto giorno postoperatorio. L'imaging postoperatorio e le immagini patologiche sono mostrate nella Figura 13.
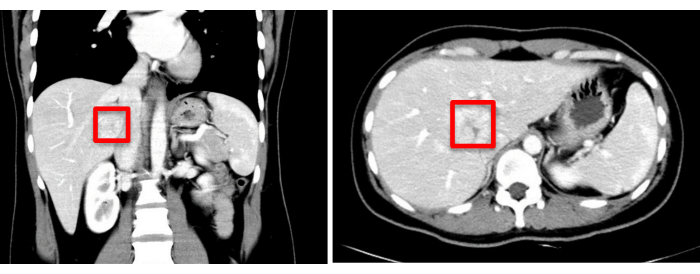
Figura 1: La valutazione dell'imaging preoperatorio (TC) indica la posizione del tumore, contrassegnata da un quadrato rosso. Fare clic qui per visualizzare una versione più grande di questa figura.
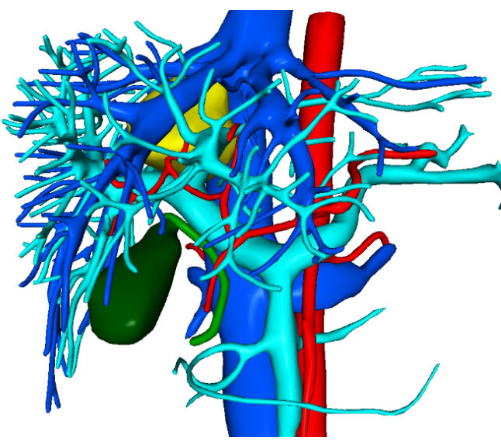
Figura 2: Immagini di ricostruzione tridimensionale preoperatoria. Fare clic qui per visualizzare una versione più grande di questa figura.
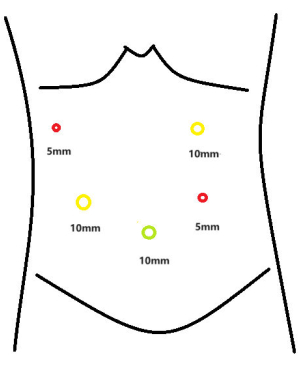
Figura 3: Mappa della distribuzione dei trocari. Clicca qui per visualizzare una versione più grande di questa figura.
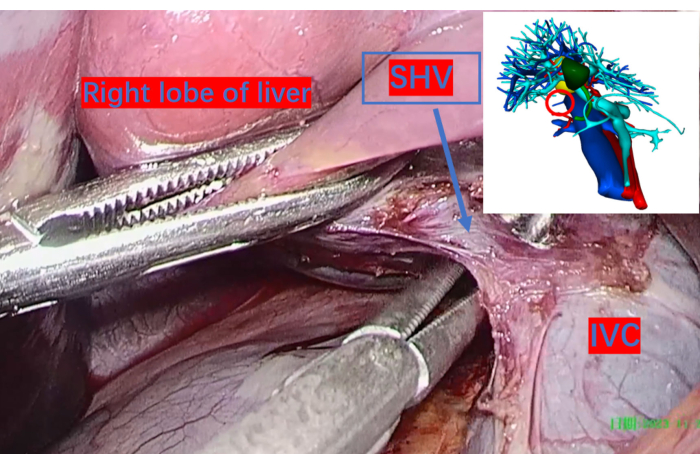
Figura 4: La vena cava inferiore esposta dallo spazio epatico destro e le vene epatiche corte più grandi legate con clip di Hem-o-lok e sezionate. Il cerchio rosso sull'immagine di ricostruzione tridimensionale indica le posizioni corrispondenti. Abbreviazione: SHV: vena epatica corta. IVC: vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Il parenchima epatico sezionato lungo il processo caudato utilizzando un bisturi ad ultrasuoni. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: La vena porta esposta fino al primo ramo del lobo caudato sinistro (G1L). G1L è il primo ramo della vena porta al lobo caudato sinistro. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Tumore accuratamente esposto, che fornisce una visione chiara della sua posizione e facilita le successive manovre chirurgiche. Fare clic qui per visualizzare una versione più grande di questa figura.
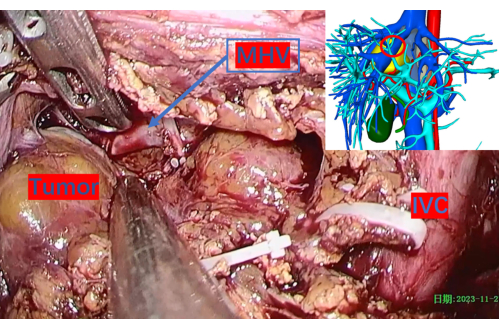
Figura 8: Vena epatica media esposta con cautela. Il cerchio rosso indica la posizione corrispondente sull'immagine di ricostruzione 3D. Abbreviazioni: MHV: vena epatica media, IVC: vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
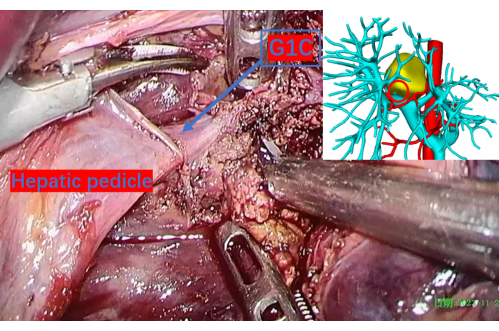
Figura 9: Parenchima epatico accuratamente sezionato che rivela la vena porta fino al primo ramo del lobo caudato destro, indicato come G1C. Un cerchio rosso sull'immagine di ricostruzione 3D corrisponde a questa posizione, fornendo un punto di riferimento preciso. G1C è il primo ramo della vena porta al lobo caudato destro. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 10: Il sistema di Glisson responsabile dell'afflusso di sangue al tumore. Questo sistema è stato esposto, bloccato e reciso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 11: Tronco principale esposto della vena epatica destra durante la dissezione del tumore. Il cerchio rosso ne segna la posizione sull'immagine di ricostruzione 3D. Abbreviazioni: RHV: vena epatica destra. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 12: Campo chirurgico accuratamente irrigato e pulito dopo l'emostasi. Abbreviazioni: MHV: vena epatica media. RHV: vena epatica destra. IVC: vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
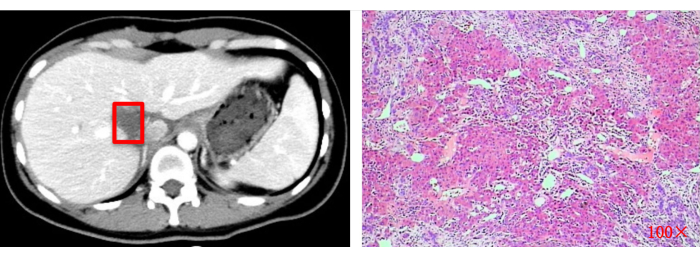
Figura 13: Valutazione dell'imaging postoperatorio (TC) ed esame istopatologico (100x). I quadrati rossi indicano il sito di resezione del tumore originale. Clicca qui per visualizzare una versione più grande di questa figura.
| Elementi | Risultati |
| Tempo di funzionamento (min) | 372 |
| Volume di sanguinamento intraoperatorio (mL) | 300 |
| Volume delle trasfusioni di sangue (mL) | 0 |
| Numero di occlusioni del portale epatico | 5 |
| Tempo di occlusione del portale epatico | 70 |
| Complicanza postoperatoria | Nessuno |
| Degenza ospedaliera postoperatoria (giorno) | 8 |
| Drenare i livelli di bilirubina su POD3 (U/L) | 30.1 |
| Drenare i livelli di bilirubina su POD5 (U/L) | 21.4 |
Tabella 1: Esiti rilevanti del paziente. Abbreviazioni: POD = giorno postoperatorio.
Video 1: Resezione laparoscopica con approccio sinistro del lobo caudato (tecnica chirurgica). Abbreviazioni e definizioni: SHV: vena epatica corta. G1L: il primo ramo della vena porta al lobo caudato sinistro. MHV: vena epatica media. G1C: il primo ramo della vena porta al lobo caudato destro. RHV: vena epatica destra. IVC: vena cava inferiore. Clicca qui per scaricare questo video.
Discussione
Il fegato è un organo cruciale coinvolto nel metabolismo, nella funzione immunitaria e nella disintossicazione14. Gli epatociti, le cellule primarie del fegato, sono in genere stabili ma possono diventare instabili quando attivati, avviando la rigenerazione del tessuto epatico. Dopo la resezione epatica, un volume epatico residuo insufficiente può portare a gravi complicanze postoperatorie come l'insufficienza epatica acuta. Pertanto, una valutazione rigorosa della funzionalità epatica post-epatectomia è di fondamentale importanza15,16. La ricerca indica che il lobo caudato costituisce circa il 2%-3% del volume del fegato in un tipico corpo umano17. Data la valutazione preoperatoria delle riserve di funzionalità epatica, la resezione del lobo caudato da sola generalmente non diminuisce significativamente il volume epatico rimanente, mitigando così il rischio di complicanze postoperatorie come l'insufficienza epatica acuta.
Lo studio18 di Kumon et al. chiarisce l'anatomia vascolare del lobo caudato del fegato, identificando due peduncoli epatici primari: il sinistro e il destro. Il peduncolo sinistro è posizionato in modo più coerente, entrando nel lobo caudato intorno al terzo medio-inferiore del lobo di Spiegel. Al contrario, il peduncolo destro è più variabile, potenzialmente estendendosi nelle aree di processo paracavale o caudato, e può anche essere assente. I rami venosi portali nel lobo caudato mostrano complessità, spesso manifestandosi come rami indipendenti o un tronco condiviso. La vena porta del lobo di Spiegel è più stabile, prevalentemente originata da un robusto ramo dorsale (G1L) della vena porta sinistra. Al contrario, le vene portatrici che servono il processo caudato destro e la regione paracavale originano principalmente dai rami della vena porta principale destra, chiamata il primo ramo del lobo caudato destro (G1C)19. Le20 descrizioni di Cho et al. descrivono in dettaglio le arterie del lobo caudato in tre tipi principali: rami indipendenti, tronchi comuni e quelli derivanti da anastomosi arteriose epatiche. Il drenaggio biliare nel lobo caudato coinvolge tipicamente due dotti principali, con 2 o 3 rami nel lobo di Spiegel che convergono nel dotto epatico sinistro. La regione paracavale ha generalmente da 2 a 3 dotti che si fondono nel dotto settoriale posteriore destro, con un'incidenza significativa di anastomosi interduttali18. Il drenaggio venoso dal lobo caudato avviene principalmente attraverso le vene epatiche corte nella vena cava inferiore. La vena del processo caudato attraversa il processo caudato e il lobo posteriore destro, drenando principalmente il processo caudato e unendo il bordo inferiore destro della vena cava inferiore posteriore, delineando il confine tra queste regioni. La vena epatica del lobo caudato principale corre tra il lobo di Spiegel e l'area paracavale, entrando infine nel bordo medio sinistro della vena cava inferiore posteriore, fungendo da demarcazione anatomica tra il lobo di Spiegel e la regione paracavale. Abbiamo meticolosamente bloccato e sezionato i vasi chiave e i loro rami, comprese le vene epatiche corte, G1L, G1C e il peduncolo epatico che alimenta il tumore. Questa precisione garantisce la sicurezza e l'efficacia degli interventi chirurgici.
L'anatomia distintiva del lobo caudato, annidato in profondità all'interno del fegato e adiacente al sistema vascolare chiave, tra cui la vena cava inferiore, la vena epatica media e la vena epatica destra, rappresenta una sfida chirurgica. Il suo rivestimento da parte dell'ila epatica aumenta il rischio di emorragia, rendendo la resezione tecnicamente impegnativa. Ricerche precedenti21 hanno indicato che un'epatectomia sinistra estesa accoppiata a resezione del lobo caudato è preferibile per le neoplasie maligne nel lobo caudato adiacente alle vene epatiche. Tuttavia, i progressi nella nostra comprensione di questi tumori hanno portato a una maggiore adozione di resezioni semplici del lobo caudato e resezioni parziali. Questi approcci facilitano la rimozione radicale del tumore conservando la funzionalità epatica22. Sia per le neoplasie epatiche primitive che secondarie nel lobo caudato, la chirurgia è indicata quando tecnicamente fattibile. Anche i tumori benigni del lobo caudato, come gli emangiomi cavernosi, l'iperplasia nodulare focale (FNH), i calcoli del dotto biliare intraepatico e gli adenomi epatici, sono suscettibili di resezione totale o parziale, offrendo opzioni di trattamento efficaci.
La resezione epatica laparoscopica è emersa come tecnica prevalente nella chirurgia epatobiliare 23,24,25. La visione a tunnel e le capacità di ingrandimento della procedura offrono vantaggi distinti per l'escissione del lobo caudato. All'interno di questo quadro visivo, la dissezione intorno alla vena cava inferiore è facilitata, anche in spazi ristretti, e la visualizzazione delle vene corte epatiche più fini è migliorata. Tuttavia, la tecnica non è priva di sfide, come l'assenza di feedback tattile, le limitate capacità di retrazione e i vincoli dei piani di dissezione. Per superarli è necessario un chirurgo con una notevole esperienza, in particolare nelle resezioni parziali del lobo caudato. Gli approcci comuni per la resezione del lobo caudato includono gli approcci sinistro, destro, combinato sinistra-destra e anteriore. L'approccio sinistro è tipicamente utilizzato per la resezione del lobo di Spiegel o in combinazione con la resezione del segmento laterale sinistro o dell'emifoglio sinistro. L'approccio corretto è indicato per la resezione del processo caudato o per i casi in cui si considera una resezione dell'emiliver destro. Nei casi in cui un tumore è esteso o coinvolge l'intero lobo caudato, richiedendo un'esposizione difficile, può essere impiegato un approccio combinato sinistra-destra. L'approccio anteriore è spesso utilizzato per la resezione della regione paracavale, che comporta la divisione del tessuto epatico normale. Questo metodo può portare a una superficie più ampia di trauma epatico, aumentando il rischio di lesioni del dotto biliare e vascolari, oltre ad aumentare la probabilità di sanguinamento postoperatorio e perdita di bile.
Tradizionalmente, i tumori paracatali sono stati affrontati utilizzando approcci laparoscopici anteriori o del lato destro, con scarsa letteratura sulle procedure del lato sinistro 8,9,10. Feng et al., nel loro case reportpubblicato 26, hanno eseguito con successo resezioni aperte con approccio sinistro su due casi di emangiomi benigni nel lobo caudato. Questo studio si è concentrato sulla resezione in blocco del lobo caudato piuttosto che sulle resezioni segmentali delle tre parti del lobo caudato. Per le lesioni benigne, questo metodo non ha ridotto più efficacemente la resezione del parenchima epatico non necessaria, diminuendo così il rischio di perdita di bile. Attualmente, considerando la complessa struttura vascolare del lobo caudato, la chirurgia laparoscopica può mostrare più chiaramente le strutture vascolari sottili, riducendo così il rischio di sanguinamento. Inoltre, Zheng et al. hanno condotto uno studio in cui hanno introdotto per la prima volta il "metodo di dissezione Huaxi"27. Hanno utilizzato in modo innovativo un approccio laparoscopico sul lato sinistro per resecare con successo tumori complessi nel lobo caudato. Durante l'intervento, hanno impiegato un metodo di dissezione e stratificazione in senso antiorario, progredendo da semplice a complesso in una sequenza fissa. Questo approccio semplifica il processo chirurgico utilizzando la curva di apprendimento, che è più favorevole all'apprendimento e alla padronanza degli studiosi, confermando ulteriormente la fattibilità dell'approccio del lato sinistro per la resezione del lobo caudato.
Questa carenza di casi sul lato sinistro può essere attribuita alla natura profonda dei tumori paracavali, che pone difficoltà nel raggiungere la piena esposizione da una vista sul lato sinistro a causa dell'intricata anatomia vascolare circostante. Tuttavia, utilizzando l'imaging preoperatorio, abbiamo condotto una diagnosi differenziale di iperplasia nodulare focale e adenomi epatici nei tumori paracavali, mitigando le preoccupazioni sull'adeguatezza del margine tumorale. A differenza del "metodo di dissezione di Huaxi", il nostro centro impiega una tecnica di resezione laparoscopica con approccio sinistro specifica per i tumori adiacenti alla vena cavale nel lobo caudato. Prima dell'intervento, utilizziamo la ricostruzione 3D per la valutazione per garantire la sicurezza chirurgica. Inoltre, il metodo chirurgico qui descritto evita l'esposizione della vena epatica sinistra, riducendo il rischio di lacerazione e sanguinamento dalla vena epatica sinistra. Questo metodo riduce anche al minimo i danni non necessari al parenchima epatico, riducendo così la probabilità di perdite biliari postoperatorie. Con queste raffinate strategie chirurgiche, miriamo a ottenere una resezione più sicura ed efficace dei tumori del lobo caudato. Questa tecnica evita la necessità di dividere il tessuto epatico, come nell'approccio anteriore. Offre vantaggi come un campo operatorio più spazioso e una durata operativa più breve rispetto all'approccio sul lato destro. Inoltre, l'uso della tecnologia di ricostruzione tridimensionale preoperatoria ha ridotto significativamente il rischio di lesioni vascolari maggiori e ha migliorato la fattibilità della resezione del tumore. L'operazione è stata completata in modo efficiente in 372 minuti con una perdita di sangue di soli 300 ml. Il paziente ha avuto un decorso postoperatorio senza complicazioni, è stato dimesso senza problemi l'ottavo giorno postoperatorio e si è ripreso rapidamente.
Dobbiamo riconoscere chiaramente che la necessità di resecare i tumori benigni dipende dal loro potenziale di degenerazione maligna e dalla presenza di sintomi compressivi dovuti alle grandi dimensioni del tumore, che sono fondamentali nel determinare le indicazioni chirurgiche. Per i tumori maligni, l'adeguatezza di un approccio chirurgico sul lato sinistro e la garanzia di un'adeguata esposizione e di margini di resezione sufficienti sono questioni che richiedono ulteriori indagini. Ciononostante, sulla base della nostra ricerca e della nostra esperienza clinica, siamo giunti alla conclusione che l'approccio laparoscopico sinistro per la resezione dei tumori paracavali benigni è del tutto praticabile, soprattutto con una solida conoscenza anatomica e una vasta esperienza chirurgica. Questa tecnica chirurgica non solo fornisce ai pazienti un'opzione di trattamento minimamente invasiva, ma garantisce anche la sicurezza dell'escissione del tumore, riducendo al minimo il trauma chirurgico e accorciando i periodi di recupero postoperatorio.
Divulgazioni
Gli autori non hanno conflitti o legami finanziari da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dalla Guangdong Basic and Applied Basic Research Foundation of China (2021B1515230011), dai progetti scientifici e tecnologici a Guangzhou in Cina (2023B03J1247) e dal Key-Area Research and Development Program della provincia del Guangdong (2023B1111020008).
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
Riferimenti
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon