Method Article
Extração de feromônios sexuais voláteis e ensaio de quimioatração em Caenorhabditis elegans
Neste Artigo
Resumo
Este protocolo estabelece métodos para extrair e quantificar as respostas ao feromônio sexual volátil em C. elegans, fornecendo ferramentas para estudar a comunicação química e a trajetória de navegação.
Resumo
A comunicação química é vital para a saúde do organismo, a reprodução e o bem-estar geral. Compreender as vias moleculares, os processos neurais e os cálculos que regem esses sinais continua sendo uma área ativa de pesquisa. O nematóide Caenorhabditis elegans fornece um modelo poderoso para estudar esses processos, pois produz um feromônio sexual volátil. Este feromônio é sintetizado por fêmeas virgens ou hermafroditas empobrecidos em esperma e serve como atrativo para os machos.
Este protocolo descreve um método detalhado para isolar o feromônio sexual volátil de várias cepas de C. elegans (WT cepa N2, daf-22 e fog-2) e C. remanei. Também fornecemos um protocolo para quantificar a resposta da quimiotaxia masculina ao feromônio sexual volátil. Nossa análise utiliza medições como índice de quimiotaxia (CI), tempo de chegada (AT) e um gráfico de trajetória para comparar as respostas masculinas sob várias condições com precisão. Este método permite comparações robustas entre machos de diferentes origens genéticas ou estágios de desenvolvimento. Além disso, a configuração experimental descrita aqui é adaptável à investigação de outros produtos químicos de quimioatração.
Introdução
A interação entre a comunicação química e o sucesso reprodutivo é um princípio fundamental em todo o reino animal 1,2,3,4,5,6,7,8,9,10. Os feromônios sexuais desencadeiam uma ampla gama de comportamentos sexualmente dimórficos essenciais para localizar parceiros, coordenar as etapas envolvidas na busca e atração de um parceiro e, finalmente, promover a propagação de uma espécie 11,12,13,14,15,16,17. Um progresso significativo foi feito na compreensão da sinalização de feromônios, mas os mecanismos moleculares, circuitos neurais e processos computacionais que regem essas interações muitas vezes permanecem incompletamente definidos 18,19,20,21,22,23,24,25,26.
O nematóide Caenorhabditis elegans fornece um modelo poderoso para dissecar essas questões. Notavelmente, C. elegans exibe uma estratégia reprodutiva incomum - hermafroditas podem se autofertilizar, mas também cruzar com os machos 27,28,29,30,31,32,33. Essa flexibilidade requer um sistema de comunicação robusto para sinalizar o status reprodutivo. C. elegans é conhecido por seus feromônios solúveis em água bem caracterizados, os ascarosídeos, que desempenham papéis variados no desenvolvimento, comportamento e interações sociais. Descobertas recentes revelaram uma classe distinta de feromônios sexuais voláteis empregados pelos nematóides. Esses feromônios são produzidos especificamente por fêmeas virgens sexualmente maduras de C. elegans e C. remanei e hermafroditas depletados de esperma, servindo como atrativo para machos adultos 29,34,35. Este atrativo exibe notável dimorfismo sexual em sua produção e percepção. A gônada somática feminina governa a síntese desse feromônio sexual volátil, e a produção reflete dinamicamente o estado reprodutivo, cessando após o acasalamento e retomando várias horas depois29,34.
Compreender a comunicação do feromônio sexual dos nematóides fornece informações sobre a evolução dos sistemas de comunicação química, a interação entre o estado reprodutivo e o comportamento e os mecanismos subjacentes ao processamento neural sexualmente dimórfico 24,26,36,37,38,39 . Estudos implicam o neurônio anfido AWA em homens como crítico para a detecção de feromônios, com o receptor acoplado à proteína G SRD-1 desempenhando um papel fundamental na detecção de feromônios em homens24. C. elegans é adequado para estudar a comunicação química animal, especialmente a sinalização de feromônios sexuais, devido à sua dependência do sistema olfativo para a busca de parceiros. Embora muito se saiba sobre a sinalização de ascarosídeo, o sistema de feromônios sexuais voláteis oferece oportunidades únicas de comparação 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Além disso, C. elegans é um poderoso organismo modelo genético devido ao seu genoma totalmente sequenciado, linhagem celular claramente definida e mutantes olfativos bem caracterizados.
No entanto, o circuito neural completo envolvido no processamento desse feromônio, os cálculos que traduzem sua percepção em comportamentos de busca de parceiros direcionados e sua regulação da biossíntese ainda precisam ser totalmente elucidados. Investigações adicionais sobre esses processos são cruciais para a compreensão dos diversos mecanismos que regem a comunicação animal e os comportamentos reprodutivos. A identificação de genes-chave envolvidos na síntese, secreção e percepção de feromônios promete revelar novos atores moleculares na comunicação animal. Os ensaios descritos aqui fornecem uma base para abordar essas questões.
Protocolo
1. Extração bruta de feromônios sexuais de fêmeas e hermafroditas
- Protocolo para sincronização de C. elegans
- Preparação de fêmeas adultas ou hermafroditas
- Monitore as placas de cultura diariamente até que exista uma grande população de fêmeas adultas/hermafroditas e a fonte de alimento OP50 se esgote. Usando fêmeas de C. elegans e WT C. remanei para extração de feromônio sexual bruto, prepare ovos sincronizados das fêmeas acasaladas.
NOTA: Neste protocolo, os animais XX mutantes de C. elegans fog-2 , que não produzem espermatozóides, são chamados de fêmeas de C. elegans .
- Monitore as placas de cultura diariamente até que exista uma grande população de fêmeas adultas/hermafroditas e a fonte de alimento OP50 se esgote. Usando fêmeas de C. elegans e WT C. remanei para extração de feromônio sexual bruto, prepare ovos sincronizados das fêmeas acasaladas.
- Lavagem e peletização de minhocas
- Lave os vermes adultos de uma placa de população mista com tampão M9. Colete a suspensão sem-fim em um tubo de microcentrífuga de 1,5 mL. Centrifugue a 1.500 × g por 0,5-1 min para peletar as minhocas.
NOTA: Pré-limpeza para contaminação pesada (opcional): Deixe os vermes se depositarem no tubo se estiverem muito contaminados. Pipetar o sobrenadante para remover as bactérias e repetir até que o sobrenadante fique claro.
- Lave os vermes adultos de uma placa de população mista com tampão M9. Colete a suspensão sem-fim em um tubo de microcentrífuga de 1,5 mL. Centrifugue a 1.500 × g por 0,5-1 min para peletar as minhocas.
- Branqueamento
- Adicione 200 μL de tampão M9 ao pellet de minhoca. Prepare o tampão de lise misturando alvejante doméstico e NaOH 1 M na proporção de 1:1. Adicione 500 μL desse tampão de lise à mistura, vórtice por 10 s e, em seguida, faça uma pausa para monitorar a condição de lise sob um microscópio de dissecação. Repita este processo de vórtices de 10 s seguido de observação até que os vermes adultos estejam totalmente lisados.
- Parar de branquear e peletizar os embriões
- Quando os vermes adultos são lisados em pequenos fragmentos (mas não completamente dissolvidos), adicione imediatamente 500 μL de tampão M9 para retardar a reação. Centrifugue a 15.000 × g por 30-60 s para pellet os embriões.
NOTA: A lise excessiva pode danificar os embriões. Pare a reação quando os corpos dos vermes adultos se decomporem em pequenos fragmentos. A lise continua durante as etapas de centrifugação e lavagem até que todo o tampão de lise seja removido.
- Quando os vermes adultos são lisados em pequenos fragmentos (mas não completamente dissolvidos), adicione imediatamente 500 μL de tampão M9 para retardar a reação. Centrifugue a 15.000 × g por 30-60 s para pellet os embriões.
- Lave os embriões 5x com 1 mL de tampão M9, centrifugando a 15.000 × g por 30-60 s após cada lavagem. Remover o sobrenadante após centrifugação.
- Sincronização
- Ressuspenda os embriões em 800 μL de tampão M9 em um tubo de microcentrífuga de 1,5 mL. Gire o tubo a 20 °C por 12-15 h para incubação L1 e travamento de vermes no estágio L1 devido à falta de suprimento de alimento. Solte e cultive os vermes a 20° C por 3 dias até atingirem o estágio L4.
- Preparação de fêmeas adultas ou hermafroditas
2. Extração bruta de feromônios sexuais de fêmeas virgens de um dia de idade (Figura 1A)
NOTA: Adotamos um protocolo24 previamente estabelecido para extrair feromônios sexuais de fêmeas mutantes de fog-2 virgem (feminização da linha germinativa) de um dia de C . elegans e fêmeas WT de C. remanei.
- Preparação de fêmeas adultas
- Selecione e isole aproximadamente 200 fêmeas de neblina de estágio L4-2 1 dia antes da extração do feromônio. Para garantir que apenas fêmeas virgens sejam coletadas, separe essas fêmeas L4 fog-2 cuidadosamente por sexo e distribua-as em três placas separadas de 6 cm OP50 NGM. Coloque uma pequena quantidade de bactérias OP50 no centro de cada placa.
NOTA: Distribua 200 vermes fêmeas L4 em três placas separadas para evitar o risco de introduzir acidentalmente um verme macho na placa. Se um macho for escolhido, é provável que acasale com muitas fêmeas, resultando na fertilização da maioria das fêmeas no dia seguinte, quando se tornarem adultas. As fêmeas fertilizadas não emitem feromônios sexuais voláteis até que o esperma se esgote, o que afeta os resultados da extração. A fonte de alimento limitada restringe os hermafroditas a uma área menor no centro da placa, minimizando a chance de escapar da placa durante o período de isolamento.
- Selecione e isole aproximadamente 200 fêmeas de neblina de estágio L4-2 1 dia antes da extração do feromônio. Para garantir que apenas fêmeas virgens sejam coletadas, separe essas fêmeas L4 fog-2 cuidadosamente por sexo e distribua-as em três placas separadas de 6 cm OP50 NGM. Coloque uma pequena quantidade de bactérias OP50 no centro de cada placa.
- Processo de extração
- No dia da extração (dia 1 da maturidade reprodutiva, 3 dias após os vermes terem sido liberados da parada L1), pegue e isole 100 fêmeas virgens de 1 dia de idade em um tubo de microcentrífuga contendo 1 mL de tampão M9. Lave as fêmeas 5x com tampão M9 para minimizar a contaminação bacteriana e incube-as em 100 μL de tampão M9 por 6 h a 20 °C para permitir a produção e acúmulo de feromônios no meio.
- Realize um processo de extração semelhante para fêmeas de C. remanei , usando apenas 15-20 fêmeas do estágio L4 isoladas no dia anterior à extração em três placas e, no dia seguinte, incube cinco fêmeas virgens em 100 μL de tampão M9 por 6 h a 25 ° C (temperatura ideal de crescimento para C. remanei) 58 .
NOTA: As fêmeas de C. remanei produzem uma quantidade maior de feromônios sexuais voláteis em comparação com as fêmeas de C. elegans . Portanto, apenas cinco fêmeas são suficientes para extrair 100 μL de feromônio sexual volátil bruto.
- Armazenamento
- Centrifugue amostras a 15.000 × g por 30-60 s para peletar os vermes. Pipete cuidadosamente a transferência do sobrenadante (contendo feromônios) para um tubo limpo e descarte o tubo que contém o pellet de minhoca. Armazene o sobrenadante isolado para ensaios de quimioatração subsequentes.
NOTA: O extrato bruto de feromônio sexual volátil pode ser armazenado por pelo menos 1 ano a -80 °C em um tubo de microcentrífuga envolto em parafilme para minimizar a evaporação.
- Centrifugue amostras a 15.000 × g por 30-60 s para peletar os vermes. Pipete cuidadosamente a transferência do sobrenadante (contendo feromônios) para um tubo limpo e descarte o tubo que contém o pellet de minhoca. Armazene o sobrenadante isolado para ensaios de quimioatração subsequentes.
- Controle de qualidade
- Antes de utilizar o extracto, efectuar um ensaio de controlo de qualidade utilizando machos N2 ou machos him-5 para verificar a sua quimioatractividade (ver secção 4).
3. Uma grande quantidade de extração bruta de feromônios sexuais de hermafroditas virgens de 6 dias (Figura 1A)
- Cultura de minhocas
- Para obter aproximadamente 20 mL de feromônio sexual bruto de C. elegans , sincronize vinte placas NGM de 10 cm contendo vermes adultos saudáveis de C. elegans (mutante N2 ou daf-22 ) usando o protocolo de alvejante mencionado acima e, em seguida, lave-os 5x com tampão M9.
NOTA: Este processo prepara embriões suficientes para a extração de feromônios. N2: A cepa padrão WT C. elegans que produz feromônios de ascarosídeo solúveis em água e feromônios sexuais voláteis não ascarosídeos. mutante daf-22 : Um mutante sem a capacidade de produzir muitos feromônios de ascarosídeo, tornando-os úteis no estudo de feromônios sexuais voláteis não ascarosídeos isoladamente. - Para sincronizar vermes no estágio L1, gire os embriões no tampão M9 por 12-15 h para interromper o desenvolvimento. Transferir os vermes L1 presos para placas de cultura NGM de 10 cm semeadas com bactérias OP50 para crescimento e desenvolvimento.
- Para minimizar a presença de machos nas placas hermafroditas, verifique as placas 2 dias após a liberação do verme, no estágio L4, e remova todos os machos observados (muito raro).
- Após três dias de desenvolvimento, procure o aparecimento de embriões indicando que os vermes se tornaram adultos reprodutivamente maduros.
NOTA: as fêmeas mutantesfog-2 de C. elegans e as fêmeas WT de C. remanei são inadequadas para extração de feromônios sexuais voláteis em massa. Os mutantes de névoa-2 C. elegans e C. remanei têm uma alta proporção de machos em suas populações, e os machos acasalam continuamente com as fêmeas. As fêmeas fertilizadas não produzem feromônios sexuais voláteis. A presença masculina complica a extração desses compostos.
- Para obter aproximadamente 20 mL de feromônio sexual bruto de C. elegans , sincronize vinte placas NGM de 10 cm contendo vermes adultos saudáveis de C. elegans (mutante N2 ou daf-22 ) usando o protocolo de alvejante mencionado acima e, em seguida, lave-os 5x com tampão M9.
- Lavagem de vermes e separação de embriões
- Lavar os embriões repetidamente com tampão M9 e deixá-los repousar (1 g de sedimentação) até que a maioria dos adultos esteja no fundo do tubo; repita 5-7x. Permitir que os tubos de microcentrífuga assentem sem perturbações num rack durante vários minutos para facilitar a sedimentação dos vermes adultos e permitir a separação da população de vermes adultos dos embriões, que permanecem suspensos no sobrenadante.
- Pipete os adultos separados e transfira-os para novas placas NGM com sementes OP50.
- Repita este processo de lavagem por 5-6 dias para esgotar o auto-esperma.
NOTA: Para a extração de feromônios sexuais voláteis, utilize hermafroditas com 5-6 dias de idade. Esse tempo garante que seu autoespermatozóide provavelmente se esgote, pois os hermafroditas com espermatozóides disponíveis não produzem feromônios sexuais voláteis. Numerosos embriões mortos ou não eclodidos na placa no dia 5 ou 6 indicam um momento apropriado para iniciar a extração de feromônios.
- Extração de feromônios sexuais
- Extrair a feromona sexual conforme descrito na secção 1 com modificações.
- Em vez de adicionar 100 fêmeas de C. elegans por 100 μL, adicione tampão M9 com base no volume final do pellet de verme. Adicione 1 mL de tampão M9 por 50 μL de vermes compactados.
- Controle de qualidade e homogeneização
- Lotes de teste de controle de qualidade de feromônio extraído usando o ensaio de quimioatração com machos N2 ou machos him-5 (ver seção 4).
- Misture todos os lotes para criar um feromônio sexual volátil bruto homogêneo para experimentos que precisam de uma grande quantidade de feromônio, como triagem ou experimentos microfluídicos. Armazene o extrato bruto de feromônio sexual por pelo menos 1 ano a -80 ° C em tubos de 50 mL envoltos em parafilme para minimizar a evaporação.
- Método de titulação baseado em ensaio de quimioatração para padronização do extrato bruto de feromônio sexual
- Realize um ensaio de titulação testando diluições seriadas de cada extrato de feromônio em Wt N2 e elegans machos him-5. Determinar a diluição mais elevada (concentração mais baixa) que provoca consistentemente uma resposta quimiotaxia robusta e reprodutível em estirpes de controlo.
- Preparar uma série de diluições de cada extracto bruto (por exemplo, 1:2, 1:4, 1:8, etc.) em tampão M9.
- Ensaios de quimiotaxia
- Realizar ensaios de quimiotaxia normalizados (ver secção 4) utilizando cada diluição na estirpe de referência dos machos. Execute três réplicas para garantir a reprodutibilidade. Compare as diluições ideais em diferentes lotes de extração para avaliar a consistência na concentração de feromônios.
NOTA: Isso estabelece um ponto de referência para avaliar a bioatividade de cada extrato. No ensaio de quimioatração de feromônio sexual padrão, os extratos originais não diluídos serão usados para experimentos subsequentes, com a titulação servindo como uma etapa de controle de qualidade para garantir uma atividade consistente de feromônios entre os lotes. A série de diluições pode ser ajustada com base em necessidades experimentais específicas. Dado que o protocolo de extração padrão produz consistentemente extratos de feromônios brutos saturados, um teste de titulação para padronizar o extrato pode não ser necessário para a maioria dos experimentos. Recomenda-se usar o mesmo lote de feromônio sexual bruto em um conjunto de experimentos relacionados para manter a consistência e minimizar a variabilidade na atividade do feromônio.
- Realizar ensaios de quimiotaxia normalizados (ver secção 4) utilizando cada diluição na estirpe de referência dos machos. Execute três réplicas para garantir a reprodutibilidade. Compare as diluições ideais em diferentes lotes de extração para avaliar a consistência na concentração de feromônios.
4. Ensaio de quimioatração de feromônio sexual volátil
NOTA: O ensaio de quimioatração de feromônios sexuais voláteis foi adaptado de métodos previamente estabelecidos usados em outros estudos de quimioatração 24,29,59,60,61. Essas modificações foram implementadas para otimizar a sensibilidade e especificidade do ensaio para detectar respostas a feromônios sexuais voláteis. Essa abordagem personalizada aumenta a aplicabilidade do ensaio a necessidades específicas de pesquisa.
- Observe as placas de cultura diariamente até que as fêmeas adultas/hermafroditas sejam abundantes. A saúde dos vermes influencia sua resposta ao feromônio sexual.
- Preparação dele-5 machos
- Utilize o protocolo de alvejante padrão para sincronizá-lo-5 vermes. Após a sincronização, lave os worms 5x com buffer M9. Isolar os machos L4 no dia anterior ao ensaio; em seguida, transferir os vermes machos adultos de um dia das suas placas semeadas e enxaguá-los em tampão M9 antes do ensaio. Coloque-os em placas NGM não semeadas antes do ensaio para eliminar bactérias residuais e evitar a interferência de alimentos durante o ensaio.
NOTA: Não deixe os vermes morrerem de fome por mais de uma hora antes do ensaio, pois isso pode alterar seu estado interno e influenciar os resultados do ensaio de quimioatração de feromônios sexuais. Portanto, se você pretende realizar mais de 10 ensaios em um único dia, substitua as amostras de vermes a cada hora. Além disso, alterne entre um ensaio experimental e um ensaio de controle repetidamente.
- Utilize o protocolo de alvejante padrão para sincronizá-lo-5 vermes. Após a sincronização, lave os worms 5x com buffer M9. Isolar os machos L4 no dia anterior ao ensaio; em seguida, transferir os vermes machos adultos de um dia das suas placas semeadas e enxaguá-los em tampão M9 antes do ensaio. Coloque-os em placas NGM não semeadas antes do ensaio para eliminar bactérias residuais e evitar a interferência de alimentos durante o ensaio.
- Preparação de placas de ensaio de ágar quimioatração
- Prepare placas de ensaio de quimioatração com ágar 1,5%, NaCl 25 mM, Tris-base 1,5 mM e Tris-Cl 3,5 mM, conforme descrito na literatura relevante24.
- Aquecer o ágar-ágar na solução de quimioatração no micro-ondas até dissolver completamente. Deixe a solução esfriar em temperatura ambiente por 5 min.
- Use um auxiliar de pipeta para distribuir uniformemente a solução de ágar quimioatração em placas de Petri: despeje 30 mL em cada placa de 10 cm e 20 mL em cada placa de 6 cm.
- Depois de despejar a solução de ágar quimioatração nas placas de Petri, deixe as tampas abertas em uma área limpa por pelo menos 40 minutos para permitir que a superfície do ágar seque ligeiramente. Assim que a superfície secar adequadamente, feche as tampas.
NOTA: Este tempo de secagem pode variar dependendo da umidade e temperatura do ambiente do laboratório.
- Armazenamento em placas e preparação pré-ensaio
- Embale e armazene as placas de ensaio preparadas em uma câmara fria por até 1 semana. Antes de usar, remova as placas do armazenamento refrigerado e deixe-as se aclimatar à temperatura ambiente por mais de uma hora. Abra as tampas para permitir que qualquer umidade residual evapore do ágar 20 minutos antes do ensaio em uma área limpa, garantindo que não haja água óbvia na superfície antes de fazer o ensaio.
- Desenho experimental e ensaio de quimioatração
- Para realizar o ensaio de quimioatração, marque três pontos distintos na tampa e na parte inferior da placa de Petri ou use um gabarito impresso em papel plástico transparente colocado sob a placa ou anexado ao microscópio de dissecação. Essas marcações incluem um ponto do meio (•) como ponto de partida para os vermes, um sinal de mais (+) para o local experimental (2 μL de feromônio sexual na tampa e 2 μL de azida sódica 1 M na placa) e um sinal de menos (-) para o ponto de controle (2 μL de tampão M9 na tampa e 2 μL de azida sódica 1 M) (Figura 2A). Ajuste a distância entre essas marcas de acordo com o tamanho do prato e as necessidades experimentais específicas. Normalmente, para placas de Petri de 6 cm, definir uma distância fixa de 1,5 cm do ponto de partida para cada substância de ensaio para os testes de controlo positivo.
- Etapas detalhadas para realizar o ensaio (Figura 2)
- Aplique 2 μL de azida sódica 1 M em cada ponto experimental e de controle na placa.
- Escolha 20 minhocas machos saudáveis e que se movem livremente com um selecionador de minhocas. Solte simultaneamente 20 vermes machos no ponto de partida sob um microscópio de dissecação.
- Adicione rapidamente 2 μL de feromônio sexual e 2 μL de tampão M9 aos pontos experimentais e de controle na tampa, respectivamente.
- Feche suavemente a tampa e coloque a placa de ensaio em uma área silenciosa e estável à temperatura ao lado do microscópio.
- Após 30 min, marque o ensaio contando o número de vermes em cada ponto.
NOTA: O processo de colheita de 20 minhocas não deve exceder 1-2 min para evitar que as minhocas colhidas precocemente sequem e se tornem insalubres, o que pode afetar os resultados. Todo o processo, desde a escolha dos machos até o fechamento da tampa, deve levar entre 2 e 5 minutos.
- Triagem de controle positivo
- Teste os vermes machos em uma solução diluída de 1.000 vezes de diacetil (dissolvido em etanol a 10% e tampão M9 a 90%) para confirmar sua capacidade de resposta à quimiotaxia. Avalie os resultados do ensaio de quimioatração 30 min após o início do teste. Marque os vermes que estão paralisados nos pontos designados com base em sua localização: 'C' para aqueles no local de controle e 'E' para aqueles no local experimental. Pontue os vermes em nenhum dos pontos como 'N' (Figura 2C).
- Para calcular o Índice de Quimioatração (IC), use a seguinte fórmula:

- Selecione apenas amostras masculinas com um índice de quimiotaxia ≥ 0,4 (CI, consulte a Figura 2C). Use o macho do mesmo lote para o teste de feromônio sexual subsequente.
NOTA: Realize três ensaios separados, cada um envolvendo 20 vermes, para garantir a consistência e confiabilidade dos resultados experimentais. Três ensaios são normalmente suficientes para inferir consistência.
5. Diretrizes de tempo e pontuação para ensaio de quimioatração
- Avalie a resposta de quimioatração dos vermes com base em suas localizações finais. Marque o número de vermes em cada ponto na conclusão do ensaio, geralmente 30 minutos após o início.
NOTA: O uso de azida sódica em pontos experimentais e de controle paralisa os vermes que chegam, facilitando a pontuação precisa. A maioria dos machos WT N2 e him-5 são capazes de localizar a fonte de feromônio dentro de 6-8 min em uma placa de 6 cm com uma configuração de distância de 1,5 cm. - Para capturar defeitos na eficiência da quimiotaxia, especialmente para detectar defeitos sutis, considere monitorar o ensaio em intervalos regulares de 3-5 min.
NOTA: Esta observação frequente permite documentar os horários em que os vermes chegam aos pontos de teste. Esse rastreamento detalhado pode revelar casos em que os vermes exibem diminuição da eficiência da quimiotaxia, mas ainda conseguem chegar ao local de teste dentro da janela de exame.
6. Modificações opcionais
- Para uma avaliação aprimorada da quimiotaxia, empregue uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
NOTA: Esta modificação permite uma análise abrangente de seus padrões de movimento, fornecendo uma visão mais profunda do comportamento e da trajetória da quimioatração (Figura 3).
7. Análise dos dados
- Pontuação e cálculo do Índice de Quimioatração (I.C.)
- Siga as etapas 4.7.1 e 4.7.2.
- Gráfico de tempo de chegada
- Para uma análise mais abrangente dos ensaios de quimioatração, considere monitorar o ensaio em intervalos de 3-5 minutos ou empregar uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
NOTA: Essas abordagens não só permitem pontuar os tempos de chegada das minhocas nos pontos de projeto, mas também comparar os tempos médios de chegada e analisar a distribuição desses tempos.
- Para uma análise mais abrangente dos ensaios de quimioatração, considere monitorar o ensaio em intervalos de 3-5 minutos ou empregar uma câmera posicionada acima da placa para registrar as trajetórias dos vermes ao longo do ensaio.
- Análise de trajetória baseada em vídeo e visualização de dados
NOTA: Para analisar os padrões de movimento de C. elegans durante os ensaios de quimioatração, registre e extraia trajetórias (consulte o Tabela de Materiais) e uma análise mais aprofundada (Figura 3).- Configure o sistema de gravação.
- Inicie uma nova gravação e acesse a janela de configurações de gravação .
- Defina os parâmetros de gravação desejados:
- Prefixo do arquivo: Escolha um nome descritivo para os arquivos de vídeo (por exemplo, "experiment1_").
- Taxa de quadros (FPS): Selecione os quadros apropriados por segundo para capturar o movimento do verme (por exemplo, 7,5 FPS para vermes na placa de ágar e 30 FPS para minhocas nadadoras ).
- Duração: Defina a duração da gravação em segundos (por exemplo, 1.800 s [30 min] para ensaio de quimioatração em massa).
- Otimize a qualidade da imagem: Ajuste a intensidade da iluminação para garantir que os vermes sejam claramente visíveis contra o fundo e ajuste o foco para obter uma imagem nítida dos vermes.
- Para preparar a placa de ensaio, primeiro dispense a solução de controle no ponto de controle designado. Em seguida, pegue cuidadosamente o (s) verme (s) e solte-os suavemente no centro da placa. Uma vez que o(s) verme(s) tenha(m) se acomodado(s), aplique a solução de feromônio sexual no local experimental designado.
- Posicione a placa: Coloque cuidadosamente a placa contendo os vermes no centro do campo de gravação para maximizar a área de captura.
- Para reduzir o estresse nos vermes durante os ensaios de quimiotaxia, considere as duas abordagens a seguir.
- Para ensaio de verme único, coloque o verme na placa de ensaio e deixe-o aclimatar por 5 minutos antes de introduzir a solução de feromônio sexual na distância designada (a posição baseada na localização atual do verme).
NOTA: Isso minimiza o manuseio e fornece ao worm tempo para se ajustar ao seu novo ambiente. - Ensaio de quimioatração em massa: Deixe os vermes assentarem e se dispersarem naturalmente na placa por 5 min. Após este período de aclimatação, introduza a solução de feromônio na posição fixa designada. Durante a análise pós-vídeo, meça a distância inicial de cada verme do feromônio e agrupe-os de acordo para uma análise posterior.
- Para ensaio de verme único, coloque o verme na placa de ensaio e deixe-o aclimatar por 5 minutos antes de introduzir a solução de feromônio sexual na distância designada (a posição baseada na localização atual do verme).
- Procedimento de análise de vídeo
- Importação e configuração: Importe o vídeo gravado para o software. Configure as informações da sequência (por exemplo, taxa de quadros); Especifique a escala de imagem (pixels por unidade de medida).
- Ajuste de imagem: Para otimizar a detecção de worms, ajuste o limite de detecção até que o rótulo verde contorne firmemente os worms sem capturar ruídos ou artefatos de fundo. Além disso, aplique algoritmos de suavização de fundo para reduzir o ruído e a irregularidade na imagem, aumentando o contraste entre os vermes e o fundo. Experimente diferentes níveis de suavização para encontrar o equilíbrio ideal entre redução de ruído e preservação dos detalhes do worm.
NOTA: O limite ideal deve cobrir a maior parte do corpo de cada verme, excluindo elementos estranhos. - Otimização do parâmetro de detecção: Selecione um worm representativo para gerar automaticamente os parâmetros de detecção. Verifique a precisão da detecção inspecionando visualmente de 5 a 10 quadros aleatórios. Se a detecção for insatisfatória, refine os parâmetros de detecção manualmente, revise as configurações de ajuste de imagem, se necessário, e prossiga para rastrear quando a detecção for confiável.
- Revisão e reparo de trajetórias de rastreamento: Após a conclusão do processo de rastreamento automatizado, execute uma revisão manual das trajetórias geradas. Se forem encontradas inconsistências durante a revisão, use a função de reparo para corrigir a trajetória e execute as seguintes operações: Unir: Conecte segmentos de trajetória que foram atribuídos incorretamente a identificadores diferentes, mas pertencem ao mesmo indivíduo. Dividir: Segmentos de trajetória separados que receberam incorretamente o mesmo identificador, mas pertencem a indivíduos diferentes.
NOTA: O objetivo é garantir que cada identificador exclusivo (número) seja atribuído consistentemente ao mesmo indivíduo durante todo o período de rastreamento.
Exemplo: Se um worm for rotulado como "3" por um período e, em seguida, rotulado incorretamente como "7" por um período subsequente, a função de reparo unirá esses dois segmentos sob o identificador "3". Por outro lado, se dois worms forem rotulados como "12" por um período, a função de reparo dividirá esse segmento em duas trajetórias separadas, cada uma com um identificador exclusivo. Ao revisar cuidadosamente e aplicar os reparos necessários, a precisão e a confiabilidade dos dados de rastreamento podem ser significativamente melhoradas. - Visualização e exportação de resultados: Utilize software para visualização e análise básica. Exporte dados como arquivos CSV para análise posterior com as ferramentas ou código preferidos. Esse método fornece um código básico (consulte https://github.com/edmondztt/pheromone-traj-analysis.git) para visualizar a trajetória do movimento do verme com base em cinco parâmetros principais (Figura 3). Tempo: A progressão da trajetória, codificada por cores para indicar a passagem do tempo desde o início do experimento. Distância até o feromônio: A distância entre o verme e a fonte de feromônio em cada ponto de tempo. Velocidade: A velocidade do worm em cada ponto, que também indicava os eventos de giro e parada. Retidão: Quão reto é o caminho do verme. Correção de direção: Quão alinhado o movimento do verme está com a direção do alvo do feromônio? Esse código fornece uma visualização básica para entender o comportamento do worm e pode ser personalizado e expandido para uma análise mais profunda.
NOTA: Esta abordagem avançada fornece uma alternativa abrangente ao índice de quimioatração tradicional, detalhando a trajetória de navegação do verme em resposta aos feromônios sexuais. Ele permite entender os padrões de movimento sem depender de pontos finais arbitrários da navegação e da determinação da janela de tempo, oferecendo insights mais profundos sobre a dinâmica comportamental do ensaio. Os dados foram calculados em média em 20 quadros, que podem ser ajustados com base em necessidades experimentais específicas, para filtrar o movimento causado pela torção do corpo.
Resultados
Análise da trajetória da cepa defeituosa de percepção de feromônio sexual volátil no ensaio de quimioatração
Este ensaio de quimioatração diferencia de forma confiável entre cepas selvagens e mutantes de C. elegans em sua resposta a feromônios sexuais voláteis. Experimentos bem-sucedidos com machos him-5 demonstram consistentemente quimiotaxia robusta em direção à fonte de feromônios. Isso se reflete em um alto índice de quimiotaxia (CI) (Figura 2), muitas vezes excedendo 0,5, indicando uma forte preferência pela fonte de feromônio. Por outro lado, experimentos com o mutante do receptor de feromônio srd-1 produzem consistentemente resultados negativos. O CI para machos srd-1 é tipicamente em torno de zero24. Isso confirma a capacidade do ensaio de detectar a ausência de uma resposta quimiotática
Em experimentos abaixo do ideal, vários fatores podem afetar os resultados. Por exemplo, a concentração insuficiente de feromônios pode levar a respostas fracas em machos him-5 , enquanto a contaminação ou manuseio inadequado pode causar movimentos imprevisíveis em ambas as cepas. Esses cenários resultam em valores de CI mais baixos para homens him-5 e valores diferentes de zero potencialmente enganosos para homens srd-1 . Portanto, a implementação bem-sucedida deste protocolo é marcada por uma clara distinção nos índices de quimiotaxia entre cepas selvagens e mutantes, apoiada pela análise de trajetória que confirma visualmente as diferenças comportamentais (Figura 3). A análise dos dados deve incluir comparações estatísticas dos valores de IC para garantir que as diferenças observadas sejam significativas.
Demonstração da análise e visualização de dados do ensaio de quimioatração baseada em vídeo
Resultados bem-sucedidos do ensaio: A Figura 3 mostra a resposta quimiotática robusta dos machos him-5 a um feromônio sexual volátil. As trajetórias codificadas por cores revelam (A) custo de tempo, (B) distância: aumentando a proximidade com a fonte de feromônio ao longo do tempo, confirmando a atração dos vermes. (C) velocidade: velocidades variáveis ao longo das trajetórias, fornecendo informações sobre a dinâmica das respostas quimiotáxicas. (D) retidão: quão diretamente os vermes se movem em direção à fonte de feromônios. Quanto mais reto o caminho, mais eficiente e direcionado é o movimento em resposta ao atrativo químico. (E) Exatidão de direção: Isso mostra a capacidade dos vermes de se orientar e se mover com precisão em direção à fonte do feromônio, o atrativo químico. Ele mede essencialmente o quão bem os vermes podem sentir o gradiente químico e navegar ao longo dele para atingir seu alvo.
Uma queda na velocidade para zero normalmente indica uma parada ou curva. A combinação de informações de velocidade com dados de retilinidade pode ajudar a identificar eventos de curva. Especificamente, um evento de giro é indicado quando a velocidade cai para zero e a retidão também é muito baixa. Em contraste, experimentos com mutantes sensoriais defeituosos ou conduzidos em condições abaixo do ideal (por exemplo, baixa concentração de feromônios, densidade inadequada de vermes) podem produzir resultados diferentes.
Ao comparar trajetórias e quantificar parâmetros como direcionalidade, velocidade e retidão, os pesquisadores podem obter informações sobre os mecanismos subjacentes da quimiotaxia. Experimentos bem-sucedidos com trajetórias claras e direcionadas em direção à fonte de feromônios validam a capacidade do ensaio de detectar estímulos atraentes. Por outro lado, a ausência de tais padrões em controles negativos ou cepas mutantes confirma a especificidade do ensaio e a capacidade de identificar defeitos sensoriais. O ensaio de quimioatração em massa baseado em vídeo, conforme ilustrado na Figura 3, fornece uma ferramenta poderosa para dissecar os detalhes do comportamento da quimiotaxia do verme. Ao analisar trajetórias individuais, os pesquisadores podem descobrir não apenas a presença ou ausência de atração, mas também a diferença na resposta, oferecendo uma compreensão mais profunda dos mecanismos genéticos e neurais subjacentes que regem a quimiotaxia.
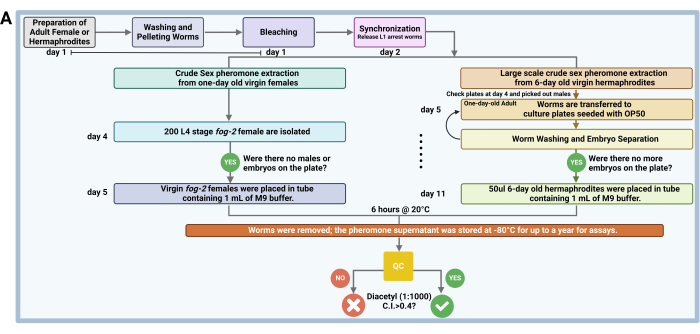
Figura 1: Fluxo de trabalho de extração de feromônio sexual bruto. O feromônio sexual bruto é extraído de fêmeas mutantes de névoa-2 virgem sincronizadas de um dia de C . elegans e fêmeas WT de C. remanei, onde os vermes são sincronizados, lavados, isolados e incubados em tampão M9 para produção de feromônios. O sobrenadante contendo feromônio extraído é armazenado a -80 ° C por até 1 ano para uso em ensaios de quimioatração, com testes de controle de qualidade conduzidos usando machos N2 ou him-5 para verificar a atratividade. Para extração em larga escala de hermafroditas virgens de C. elegans de 6 dias, os vermes são sincronizados e lavados repetidamente por 6 dias, com feromônio sexual extraído de forma semelhante, mas modificado com base no volume de pellets de minhoca e misturado homogeneamente para uso experimental. Clique aqui para ver uma versão maior desta figura.

Figura 2: O ensaio de quimioatração de feromônios sexuais voláteis e o cálculo do índice de quimioatração. (A) Este ensaio envolve a preparação de machos WT N2 ou him-5 com um protocolo padronizado de sincronização de alvejante, testando sua resposta a uma substância de controle positivo antes do ensaio de quimioatração de feromônios sexuais voláteis. O experimento inclui marcar as placas para pontos de controle e teste e usar sódio para imobilizar vermes nesses pontos para uma pontuação precisa. Os resultados são normalmente pontuados 30 minutos após o início do experimento (indicado pelo fechamento da tampa). (B) Vista lateral da configuração do ensaio de quimioatração com duas distâncias distintas. (C) Cálculo e interpretação do CI. CI é uma medida quantitativa da atratividade ou repulsividade de um estímulo de teste. O CI varia de 1, indicando forte atração, a -1, indicando forte repulsão. Um baixo valor de CI pode surgir de dois cenários: um pequeno número de vermes nos pontos experimental e de controle ou uma distribuição igual de vermes entre os dois pontos. (D) Índices de quimioatração para machos ele-5 e srd-1 de C. elegans em resposta a feromônios sexuais voláteis de fêmeas de C. remanei e C. elegans . Machos de diferentes origens genéticas respondem de maneira diferente ao estímulo do feromônio sexual. Os machos him-5 exibem uma resposta a ambos os feromônios, com um índice notavelmente mais alto de feromônios de fêmeas de C. remanei . Em contraste, os machos da cepa mutante quimiorreceptora srd-1 não apresentam resposta a nenhum dos feromônios nesta análise. p < 0,01. Abreviaturas: WT = tipo selvagem; CI = índice de quimioatração. Clique aqui para ver uma versão maior desta figura.
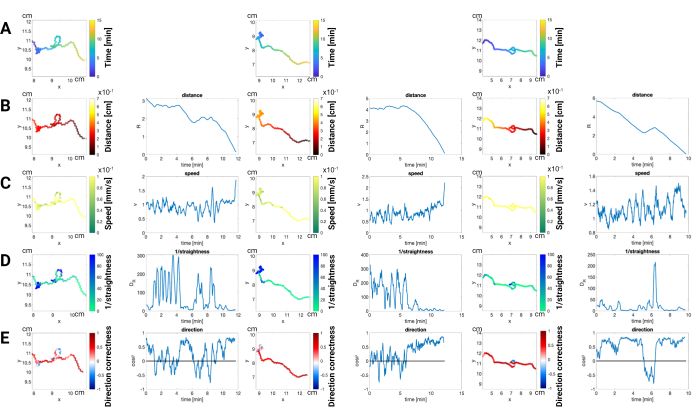
Figura 3: Análise da trajetória de machos him-5 em resposta ao feromônio sexual volátil. Esta figura ilustra os padrões de movimento dos vermes machos dele-5 durante um ensaio de quimioatração com um estímulo de feromônio sexual volátil. As trajetórias individuais são codificadas por cores para representar (A) Tempo: Progressão da trajetória ao longo do experimento. A cor representa o tempo decorrido desde o início do ensaio. (B) Distância até o feromônio: Proximidade da fonte de feromônio em cada ponto de tempo. (C) Velocidade: Velocidade do sem-fim em cada ponto. (D) Retidão: Franqueza do caminho percorrido pelo verme. (E) Correção de direção: Alinhamento do movimento com a direção da fonte de feromônio. Em todos os três exemplos, os vermes machos alcançaram com sucesso a localização do feromônio. Os dados foram calculados em média em 20 quadros para filtrar o movimento causado pela torção do corpo. Os experimentos são realizados em uma placa de Petri de 10 cm e seguem o método de ensaio de quimioatração em massa baseado em vídeo (consulte a seção 7.3.7.2 do protocolo) mencionado neste protocolo. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo fornece uma metodologia robusta para a extração de feromônios sexuais voláteis de C. elegans, juntamente com o estabelecimento de um ensaio robusto de quimioatração para medir as respostas de quimioatração masculina. Informações adicionais podem ser encontradas no guia do usuário do WormLab (consulte a Tabela de Materiais); Para obter um código básico para visualizar a trajetória do movimento do worm, consulte a seção 7.3.8.5 do protocolo. Várias etapas cruciais do protocolo são importantes para o resultado. Em primeiro lugar, a sincronização cuidadosa das populações de vermes é essencial para controlar a idade e o estado reprodutivo, garantindo a extração bem-sucedida de feromônios sexuais voláteis de fêmeas virgens ou hermafroditas empobrecidos em esperma29,34. Em segundo lugar, etapas repetidas de lavagem são necessárias para remover completamente as bactérias, minimizando a contaminação que pode interferir na sinalização de feromônios em ensaios de quimiotaxia subsequentes. Em seguida, a escolha dos parâmetros do ensaio, como concentração de atrativos, tamanho da placa e duração do ensaio, pode influenciar os resultados e deve ser adaptada aos objetivos experimentais específicos.
Tempos de secagem precisos e espaçamento consistente dos pontos de teste são essenciais para resultados confiáveis de ensaios de quimiotaxia. As placas úmidas afetam significativamente o índice de quimiotaxia. Se uma camada de água permanecer na superfície do ágar, as forças capilares podem prender os vermes no ponto de partida. Isso pode dificultar seu movimento, levando a resultados falsos negativos no ensaio. Além disso, tempos de secagem prolongados representam um desafio diferente para aqueles liberados posteriormente. À medida que a placa seca, os componentes voláteis do feromônio evaporam e se difundem, criando um gradiente de concentração menos distinto. Isso torna difícil para os vermes liberados posteriormente localizar o feromônio alvo, mesmo que estejam livres para se mover mais tarde. Portanto, certifique-se de que as placas estejam suficientemente secas para eliminar qualquer umidade da superfície que possa afetar os resultados do experimento.
O volume de solução de ágar adicionado às placas deve ser ajustado de acordo com os requisitos específicos do experimento, garantindo condições ideais de ensaio. A espessura da camada de ágar, ajustada variando a quantidade de solução de ágar derramada no prato. Normalmente, uma distância mais curta entre o atrativo e a placa de ágar leva a resultados mais robustos. Por outro lado, uma distância maior pode ajudar a eliminar os efeitos de componentes não voláteis, fornecendo uma avaliação mais clara da influência do atrativo volátil. A espessura do ágar pode ser adaptada às necessidades experimentais específicas, conforme mostrado na Figura 2B.
O processo de colheita de 20 minhocas não deve exceder 1-2 min para evitar que as minhocas colhidas precocemente sequem e se tornem insalubres, o que pode afetar os resultados. Certifique-se de que os vermes sejam liberados na placa de ensaio simultaneamente para evitar que os vermes liberados precocemente caminhem aleatoriamente muito longe do ponto de partida. Atrasos nesta etapa podem levar a posições iniciais variáveis entre as amostras, resultando em comparações injustas. Todo o processo, desde a escolha dos machos até o fechamento da tampa, deve levar entre 2 e 5 minutos.
Adapte o espaçamento entre os pontos experimentais/de controle e o ponto de partida na placa de ensaio de acordo com o tamanho da placa e os objetivos específicos do experimento. Aumentar a distância entre os pontos pode tornar o ensaio mais desafiador, o que é benéfico para detectar efeitos sutis. Por outro lado, a redução da distância cria um teste de ensaio mais robusto que destaca defeitos graves.
A solução de problemas pode ser necessária em vários pontos do protocolo. Se o feromônio extraído não induzir uma resposta de quimiotaxia, verifique cuidadosamente a idade e o status reprodutivo das fêmeas e hermafroditas de origem. Apenas fêmeas virgens ou hermafroditas empobrecidos em esperma produzirão o feromônio alvo. Devido à alta eficiência de acasalamento dos machos de C. elegans , a presença de um único macho na placa de isolamento da fêmea L4 pode afetar drasticamente os resultados. Além disso, garanta o controle da contaminação bacteriana durante todo o processo de extração. Embora este protocolo de extração ofereça uma maneira direta de obter feromônios sexuais voláteis brutos, ele tem certas limitações. O extrato bruto de feromônio pode conter vestígios de outras moléculas sinalizadoras, dificultando o isolamento definitivo dos efeitos específicos do próprio feromônio sexual. Os componentes funcionais do feromônio sexual volátil ainda não foram identificados. Embora nenhuma diferença funcional tenha sido relatada entre os feromônios sexuais de fêmeas virgens de um dia e hermafroditas de seis dias, a possibilidade de uma diferença sutil não pode ser descartada.
No ensaio de quimioatração, um baixo índice de quimiotaxia pode indicar um problema com a saúde ou o estágio de desenvolvimento dos machos testados. Para garantir os melhores resultados, use machos adultos saudáveis de um dia cultivados a 20 ° C em uma placa OP50 limpa e sem contaminação. Mudanças abruptas de temperatura de temperaturas de armazenamento mais baixas (como 15 °C) a 20 °C podem afetar negativamente o comportamento da quimioatração por até três gerações. Para as melhores práticas, permita que as estirpes recentemente descongeladas ou mantidas a temperaturas mais baixas se adaptem a 20 °C durante mais de três gerações antes da utilização. Embora seja recomendado o isolamento de machos de teste no estágio L4 no dia anterior ao dia do ensaio, não é estritamente necessário. A pré-exposição a hermafroditas adultos não afeta significativamente os resultados do ensaio de quimioatração. Os hermafroditas de um dia não produzem feromônios sexuais voláteis devido à existência de espermatozóides próprios. Portanto, o isolamento masculino L4 pode ser ignorado ao realizar triagem em larga escala. No entanto, para estudos que investigam especificamente os efeitos da experiência anterior de acasalamento ou outros estudos relacionados, é necessário isolar os machos no estágio L4 1 dia antes do dia do ensaio.
A mutação him-5 em C. elegans causa uma alta incidência de machos devido a um aumento da taxa de não disjunção do cromossomo X durante a meiose nos pais dos machos. Assim, o sistema quimiossensorial dos machos necessário para a quimiotaxia ainda está intacto. Isso facilita a obtenção de um grande número de machos para o ensaio. Consequentemente, os machos him-5 exibem quimiotaxia robusta comparável aos machos WT N2, tornando-os um controle adequado em ensaios de quimiotaxia de feromônios sexuais.
Considerações adicionais:
Reposição de azida sódica: A azida de sódio usada para paralisar vermes durante a gravação de vídeo pode ser evitada. Em vez disso, use uma gota de solução M9 para imobilizar temporariamente os vermes, embora a tensão superficial seja suficiente para o ensaio baseado em vídeo.
Densidade do verme: Limite o número de minhocas por placa para evitar superlotação e manter as condições ideais. A superlotação afetará a análise pós-vídeo, pois o programa terá dificuldade em identificar vermes se eles se sobrepuserem uns aos outros. Recomenda-se um máximo de 20 minhocas para uma placa de Petri de 6 cm e 100 minhocas para uma placa de 10 cm.
Os ensaios tradicionais de quimioatração oferecem uma abordagem direta, exigindo um esforço mínimo para aquisição de dados. Embora esses ensaios forneçam uma visão geral rápida da resposta da quimiotaxia, eles capturam apenas o ponto final de uma resposta comportamental complexa. Isso limita sua capacidade de revelar os detalhes da percepção do feromônio e da resposta locomotora. Em contraste, a análise avançada de trajetória fornece insights sobre padrões de movimento individuais e coletivos. Essa abordagem revela diferenças perdidas apenas por medidas baseadas em endpoints. Ao permitir a exploração de padrões cinéticos detalhados e variabilidade de resposta dentro das populações de teste em detalhes, este método aumenta significativamente nossa compreensão dos mecanismos quimiossensoriais. Isso destaca a aplicabilidade do ensaio a diversas questões de pesquisa e ressalta a importância de considerar a variabilidade individual no projeto experimental.
Esta metodologia oferece uma estrutura para estudar feromônios sexuais voláteis em C. elegans. Pode facilitar a descoberta de genes relacionados à síntese, secreção e percepção de feromônios sexuais voláteis, promovendo nossa compreensão da comunicação química no nível do circuito molecular e neural. Além disso, o ensaio de quimioatração e a análise de dados de trajetória podem ser usados para investigar outros quimioatraentes em C. elegans.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Somos gratos ao Dr. Tingtao Zhou por projetar e escrever o código para as visualizações de trajetória usadas em nossa análise. Este trabalho foi apoiado por financiamento: R01 NS113119 (PWS), bolsa de pós-doutorado sênior Chen e o Instituto de Neurociência Tianqiao e Chrissy Chen.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Referências
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados