Method Article
Estrazione di feromoni sessuali volatili e test di chemioattrazione in Caenorhabditis elegans
In questo articolo
Riepilogo
Questo protocollo stabilisce metodi per estrarre e quantificare le risposte al feromone sessuale volatile in C. elegans, fornendo strumenti per studiare la comunicazione chimica e la traiettoria di navigazione.
Abstract
La comunicazione chimica è vitale per la salute, la riproduzione e il benessere generale dell'organismo. La comprensione dei percorsi molecolari, dei processi neurali e dei calcoli che governano questi segnali rimane un'area di ricerca attiva. Il nematode Caenorhabditis elegans fornisce un potente modello per lo studio di questi processi in quanto produce un feromone sessuale volatile. Questo feromone è sintetizzato da femmine vergini o ermafroditi impoveriti di sperma e funge da attrattivo per i maschi.
Questo protocollo descrive un metodo dettagliato per isolare il feromone sessuale volatile da diversi ceppi di C. elegans (ceppo WT N2, daf-22 e fog-2) e C. remanei. Forniamo anche un protocollo per quantificare la risposta della chemiotassi maschile al feromone sessuale volatile. La nostra analisi utilizza misurazioni come l'indice di chemiotassi (C.I.), il tempo di arrivo (A.T.) e un grafico della traiettoria per confrontare accuratamente le risposte maschili in varie condizioni. Questo metodo consente di effettuare confronti robusti tra maschi di diverso background genetico o stadi di sviluppo. Inoltre, la configurazione sperimentale qui delineata è adattabile allo studio di altre sostanze chimiche di chemioattrazione.
Introduzione
L'interazione tra comunicazione chimica e successo riproduttivo è un principio fondamentale in tutto il regno animale 1,2,3,4,5,6,7,8,9,10. I feromoni sessuali innescano una vasta gamma di comportamenti sessualmente dimorfici essenziali per localizzare i compagni, coordinare i passaggi coinvolti nella ricerca e nell'attrazione di un partner e, infine, promuovere la propagazione di una specie 11,12,13,14,15,16,17. Sono stati compiuti progressi significativi nella comprensione della segnalazione dei feromoni, ma i meccanismi molecolari, i circuiti neurali e i processi computazionali che governano queste interazioni rimangono spesso definiti in modo incompleto 18,19,20,21,22,23,24,25,26.
Il nematode Caenorhabditis elegans fornisce un potente modello per sezionare queste domande. In particolare, C. elegans mostra un'insolita strategia riproduttiva: gli ermafroditi possono autofecondarsi ma anche incrociarsi con i maschi 27,28,29,30,31,32,33. Questa flessibilità richiede un robusto sistema di comunicazione per segnalare lo stato riproduttivo. C. elegans è noto per i suoi feromoni idrosolubili ben caratterizzati, gli ascarosidi, che svolgono vari ruoli nello sviluppo, nel comportamento e nelle interazioni sociali. Recenti scoperte hanno svelato una classe distinta di feromoni sessuali volatili impiegati dai nematodi. Questi feromoni sono prodotti specificamente da femmine vergini di C. elegans e C. remanei sessualmente mature e da ermafroditi impoveriti di sperma, fungendo da attrattivo per i maschi adulti 29,34,35. Questo attrattivo mostra un notevole dimorfismo sessuale nella sua produzione e percezione. La gonade somatica femminile governa la sintesi di questo feromone sessuale volatile e la produzione riflette dinamicamente lo stato riproduttivo, cessando dopo l'accoppiamento e riprendendo diverse ore dopo29,34.
La comprensione della comunicazione dei feromoni sessuali dei nematodi fornisce informazioni sull'evoluzione dei sistemi di comunicazione chimica, sull'interazione tra stato riproduttivo e comportamento e sui meccanismi alla base dell'elaborazione neurale sessualmente dimorfica 24,26,36,37,38,39 . Gli studi implicano che il neurone anfido AWA nei maschi sia fondamentale per la rilevazione dei feromoni, con il recettore accoppiato alla proteina G SRD-1 che svolge un ruolo chiave nella rilevazione dei feromoni nei maschi24. C. elegans è adatto per studiare la comunicazione chimica animale, in particolare la segnalazione dei feromoni sessuali, grazie alla sua dipendenza dal sistema olfattivo per la ricerca del compagno. Sebbene si sappia molto sulla segnalazione dell'ascaroside, il sistema volatile dei feromoni sessuali offre opportunità uniche di confronto 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. Inoltre, C. elegans è un potente organismo modello genetico grazie al suo genoma completamente sequenziato, al lignaggio cellulare chiaramente definito e ai mutanti olfattivi ben caratterizzati.
Tuttavia, l'intero circuito neurale coinvolto nell'elaborazione di questo feromone, i calcoli che traducono la sua percezione in comportamenti mirati di ricerca del compagno e la sua regolazione della biosintesi rimangono da chiarire completamente. Ulteriori indagini su questi processi sono fondamentali per comprendere i diversi meccanismi che regolano la comunicazione animale e i comportamenti riproduttivi. L'identificazione di geni chiave coinvolti nella sintesi, nella secrezione e nella percezione dei feromoni promette di svelare nuovi attori molecolari nella comunicazione animale. I saggi qui descritti forniscono una base per rispondere a queste domande.
Protocollo
1. Estrazione di feromoni sessuali grezzi da femmine ed ermafroditi
- Protocollo per la sincronizzazione di C. elegans
- Preparazione di femmine adulte o ermafroditi
- Monitorare quotidianamente le piastre di coltura fino a quando non esiste una grande popolazione di femmine adulte/ermafrodite e la fonte di cibo OP50 si esaurisce. Utilizzando le femmine di fog-2 C. elegans e WT C. remanei per l'estrazione di feromoni sessuali grezzi, preparare uova sincronizzate dalle femmine accoppiate.
NOTA: In questo protocollo, gli animali XX mutanti di C. elegans fog-2 , che non producono autospermatozoi, sono indicati come femmine di C. elegans .
- Monitorare quotidianamente le piastre di coltura fino a quando non esiste una grande popolazione di femmine adulte/ermafrodite e la fonte di cibo OP50 si esaurisce. Utilizzando le femmine di fog-2 C. elegans e WT C. remanei per l'estrazione di feromoni sessuali grezzi, preparare uova sincronizzate dalle femmine accoppiate.
- Viti senza fine per lavaggio e pellettatura
- Lavare i vermi adulti da una piastra di popolazione mista con tampone M9. Raccogliere la sospensione a vite senza fine in una provetta per microcentrifuga da 1,5 mL. Centrifugare a 1.500 × g per 0,5-1 min per pellettare i vermi.
NOTA: Prepulizia in caso di forte contaminazione (opzionale): lasciare che le viti si depositino nel tubo se fortemente contaminate. Pipettare il surnatante per rimuovere i batteri e ripetere l'operazione fino a quando il surnatante non diventa limpido.
- Lavare i vermi adulti da una piastra di popolazione mista con tampone M9. Raccogliere la sospensione a vite senza fine in una provetta per microcentrifuga da 1,5 mL. Centrifugare a 1.500 × g per 0,5-1 min per pellettare i vermi.
- Candeggio
- Aggiungere 200 μl di tampone M9 al pellet a vite senza fine. Preparare il tampone di lisi mescolando candeggina per uso domestico e 1 M NaOH in un rapporto 1:1. Aggiungere 500 μl di questo tampone di lisi alla miscela, agitare per 10 s e quindi fare una pausa per monitorare le condizioni di lisi al microscopio da dissezione. Ripetere questo processo di vortici di 10 s seguito dall'osservazione fino a quando i vermi adulti non sono completamente lisati.
- Fermare lo sbiancamento e pellettare gli embrioni
- Quando i vermi adulti vengono lisati in piccoli frammenti (ma non completamente disciolti), aggiungere immediatamente 500 μl di tampone M9 per rallentare la reazione. Centrifugare a 15.000 × g per 30-60 s per pellettare gli embrioni.
NOTA: L'eccessiva lisi può danneggiare gli embrioni. Interrompere la reazione quando i corpi dei vermi adulti si sono scomposti in piccoli frammenti. La lisi continua durante le fasi di centrifugazione e lavaggio fino a rimuovere tutto il tampone di lisi.
- Quando i vermi adulti vengono lisati in piccoli frammenti (ma non completamente disciolti), aggiungere immediatamente 500 μl di tampone M9 per rallentare la reazione. Centrifugare a 15.000 × g per 30-60 s per pellettare gli embrioni.
- Lavare gli embrioni 5 volte con 1 mL di tampone M9, centrifugando a 15.000 × g per 30-60 s dopo ogni lavaggio. Rimuovere il surnatante dopo la centrifugazione.
- Sincronizzazione
- Risospendere gli embrioni in 800 μL di tampone M9 in una provetta da microcentrifuga da 1,5 mL. Ruotare il tubo a 20 °C per 12-15 ore per la schiusa L1 e l'arresto dei vermi allo stadio L1 a causa dell'assenza di cibo. Rilasciare e coltivare i vermi a 20° C per 3 giorni fino a raggiungere lo stadio L4.
- Preparazione di femmine adulte o ermafroditi
2. Estrazione di feromoni sessuali grezzi da femmine vergini di un giorno (Figura 1A)
NOTA: Adottiamo un protocollo24 precedentemente stabilito per estrarre feromoni sessuali da femmine mutanti vergini di nebbia-2 (femminilizzazione della linea germinale) di C . elegans e femmine WT di C. remanei.
- Preparazione delle femmine adulte
- Selezionare e isolare circa 200 femmine di nebbia-2 allo stadio L4 1 giorno prima dell'estrazione dei feromoni. Per garantire che vengano raccolte solo femmine vergini, separare attentamente queste femmine di nebbia-2 L4 per sesso e distribuirle su tre piastre separate OP50 NGM da 6 cm. Posizionare una piccola quantità di batteri OP50 al centro di ogni piatto.
NOTA: Distribuire 200 vermi femmina L4 su tre piastre separate per evitare il rischio di introdurre accidentalmente un verme maschio nella piastra. Se un maschio viene scelto, è probabile che si accoppi con molte femmine, con il risultato che la maggior parte delle femmine viene fecondata entro il giorno successivo, quando diventano adulte. Le femmine fecondate non emettono feromoni sessuali volatili fino all'esaurimento degli spermatozoi, il che influisce sui risultati dell'estrazione. La limitata fonte di cibo limita gli ermafroditi a un'area più piccola al centro della piastra, riducendo al minimo la possibilità di fuga dalla piastra durante il periodo di isolamento.
- Selezionare e isolare circa 200 femmine di nebbia-2 allo stadio L4 1 giorno prima dell'estrazione dei feromoni. Per garantire che vengano raccolte solo femmine vergini, separare attentamente queste femmine di nebbia-2 L4 per sesso e distribuirle su tre piastre separate OP50 NGM da 6 cm. Posizionare una piccola quantità di batteri OP50 al centro di ogni piatto.
- Processo di estrazione
- Il giorno dell'estrazione (giorno 1 della maturità riproduttiva, 3 giorni dopo che i vermi sono stati rilasciati dall'arresto L1), raccogliere e isolare 100 femmine vergini di nebbia-2 di 1 giorno in una provetta da microcentrifuga contenente 1 mL di tampone M9. Lavare le femmine 5 volte con il tampone M9 per ridurre al minimo la contaminazione batterica e incubarle in 100 μl di tampone M9 per 6 ore a 20 °C per consentire la produzione e l'accumulo di feromoni nel terreno.
- Eseguire un processo di estrazione simile per le femmine di C. remanei , utilizzando solo 15-20 femmine allo stadio L4 isolate il giorno prima dell'estrazione su tre piastre e, il giorno successivo, incubare cinque femmine vergini in 100 μL di tampone M9 per 6 ore a 25 °C (temperatura di crescita ottimale per C. remanei)58.
NOTA: Le femmine di C. remanei producono una quantità maggiore di feromoni sessuali volatili rispetto alle femmine di C. elegans . Pertanto, solo cinque femmine sono sufficienti per estrarre 100 μL di feromone sessuale volatile grezzo.
- Immagazzinamento
- Centrifugare i campioni a 15.000 × g per 30-60 s per pellettare i vermi. Trasferire con cautela il surnatante (contenente feromoni) in una provetta pulita ed eliminare la provetta contenente il pellet di verme. Conservare il surnatante isolato per i successivi saggi di chemioattrazione.
NOTA: L'estratto grezzo di feromoni sessuali volatili può essere conservato per almeno 1 anno a -80 °C in una provetta da microcentrifuga avvolta con parafilm per ridurre al minimo l'evaporazione.
- Centrifugare i campioni a 15.000 × g per 30-60 s per pellettare i vermi. Trasferire con cautela il surnatante (contenente feromoni) in una provetta pulita ed eliminare la provetta contenente il pellet di verme. Conservare il surnatante isolato per i successivi saggi di chemioattrazione.
- Controllo qualità
- Prima di utilizzare l'estratto, eseguire un test di controllo qualità utilizzando maschi N2 o maschi lui-5 per verificarne la chemioattrattiva (vedere paragrafo 4).
3. Una grande quantità di estrazione di feromoni sessuali grezzi da ermafroditi vergini di 6 giorni (Figura 1A)
- Coltura di vermi
- Per ottenere circa 20 ml di feromone sessuale grezzo di C. elegans , sincronizzare venti piastre NGM da 10 cm contenenti vermi adulti sani di C. elegans (mutanti N2 o daf-22 ) utilizzando il suddetto protocollo di candeggina e quindi lavarli 5 volte con tampone M9.
NOTA: Questo processo prepara un numero sufficiente di embrioni per l'estrazione dei feromoni. N2: Il ceppo standard di WT C. elegans che produce sia feromoni ascarosidici idrosolubili che feromoni sessuali volatili non ascaroside. mutante daf-22 : un mutante privo della capacità di produrre molti feromoni ascarosidei, il che li rende utili nello studio dei feromoni sessuali volatili non ascarosidi in isolamento. - Per sincronizzare i vermi allo stadio L1, ruotare gli embrioni nel tampone M9 per 12-15 ore per arrestare lo sviluppo. Trasferire i vermi L1 arrestati su piastre di coltura NGM da 10 cm seminate con batteri OP50 per la crescita e lo sviluppo.
- Per ridurre al minimo la presenza di maschi sulle placche ermafrodite, controllare le placche 2 giorni dopo il rilascio del verme, allo stadio L4, e rimuovere tutti i maschi osservati (molto rari).
- Dopo tre giorni di sviluppo, cerca l'aspetto degli embrioni che indicano che i vermi sono diventati adulti maturi dal punto di vista riproduttivo.
NOTA: le femmine mutantifog-2 di C. elegans e le femmine WT di C. remanei non sono adatte per l'estrazione di feromoni sessuali volatili di massa. I mutanti fog-2 C. elegans e C. remanei hanno un'alta percentuale di maschi nelle loro popolazioni e i maschi si accoppiano continuamente con le femmine. Le femmine fecondate non producono feromoni sessuali volatili. La presenza maschile complica l'estrazione di questi composti.
- Per ottenere circa 20 ml di feromone sessuale grezzo di C. elegans , sincronizzare venti piastre NGM da 10 cm contenenti vermi adulti sani di C. elegans (mutanti N2 o daf-22 ) utilizzando il suddetto protocollo di candeggina e quindi lavarli 5 volte con tampone M9.
- Lavaggio dei vermi e separazione degli embrioni
- Lavare ripetutamente gli embrioni con tampone M9 e lasciarli riposare (1 g di sedimentazione) fino a quando la maggior parte degli adulti non si trova sul fondo della provetta; Ripeti 5-7 volte. Lasciare che le provette della microcentrifuga si depositino indisturbate in un rack per diversi minuti per facilitare la sedimentazione dei vermi adulti e consentire la separazione della popolazione di vermi adulti dagli embrioni, che rimangono sospesi nel surnatante.
- Pipettare gli adulti separati e trasferirli in nuove piastre NGM con semi OP50.
- Ripeti questo processo di lavaggio per 5-6 giorni per esaurire lo sperma autonomo.
NOTA: Per l'estrazione dei feromoni sessuali volatili, utilizzare ermafroditi che hanno 5-6 giorni. Questo tempismo assicura che il loro autosperma sia probabilmente esaurito, poiché gli ermafroditi con autospermatozoi disponibili non producono feromoni sessuali volatili. Numerosi embrioni morti o non schiusi sulla piastra entro il giorno 5 o 6 indicano un momento appropriato per iniziare l'estrazione dei feromoni.
- Estrazione di feromoni sessuali
- Estrarre il feromone sessuale come descritto nella sezione 1 con modifiche.
- Invece di aggiungere 100 femmine di C. elegans per 100 μl, aggiungere un tampone M9 in base al volume finale del pellet di verme. Aggiungere 1 mL di tampone M9 per 50 μL di vermi impaccati.
- Controllo qualità e omogeneizzazione
- Lotti di test di controllo qualità del feromone estratto utilizzando il test di chemioattrazione con maschi N2 o maschi him-5 (vedere paragrafo 4).
- Mescolare tutti i lotti per creare un feromone sessuale volatile grezzo omogeneo per esperimenti che richiedono una grande quantità di feromone, come esperimenti di screening o microfluidici. Conservare l'estratto grezzo di feromoni sessuali per almeno 1 anno a -80 °C in provette da 50 ml avvolte con parafilm per ridurre al minimo l'evaporazione.
- Metodo di titolazione basato su test di chemioattrazione per la standardizzazione dell'estratto grezzo di feromoni sessuali
- Eseguire un saggio di titolazione testando le diluizioni seriali di ciascun estratto di feromoni sia su WT N2 che su C . elegans maschio him-5. Determinare la diluizione più alta (concentrazione più bassa) che susciti costantemente una risposta chemiotassica robusta e riproducibile nei ceppi di controllo.
- Preparare una serie di diluizioni da ciascun estratto grezzo (ad esempio, 1:2, 1:4, 1:8, ecc.) in tampone M9.
- Saggi di chemiotassi
- Eseguire saggi chemiotassici standardizzati (vedere paragrafo 4) utilizzando ciascuna diluizione sul ceppo di riferimento dei maschi. Eseguire tre repliche per garantire la riproducibilità. Confrontare le diluizioni ottimali tra diversi lotti di estrazione per valutare la coerenza della concentrazione di feromoni.
NOTA: Questo stabilisce un punto di riferimento per valutare la bioattività di ogni estratto. Nel test standard di chemioattrazione dei feromoni sessuali, gli estratti originali non diluiti verranno utilizzati per gli esperimenti successivi, con la titolazione che funge da fase di controllo della qualità per garantire un'attività costante dei feromoni tra i lotti. La serie di diluizioni può essere regolata in base alle specifiche esigenze sperimentali. Dato che il protocollo di estrazione standard produce costantemente estratti di feromoni grezzi saturi, un test di titolazione per standardizzare l'estratto potrebbe non essere necessario per la maggior parte degli esperimenti. Si raccomanda di utilizzare lo stesso lotto di feromone sessuale grezzo in una serie di esperimenti correlati per mantenere la coerenza e ridurre al minimo la variabilità dell'attività dei feromoni.
- Eseguire saggi chemiotassici standardizzati (vedere paragrafo 4) utilizzando ciascuna diluizione sul ceppo di riferimento dei maschi. Eseguire tre repliche per garantire la riproducibilità. Confrontare le diluizioni ottimali tra diversi lotti di estrazione per valutare la coerenza della concentrazione di feromoni.
4. Saggio di chemioattrazione dei feromoni sessuali volatili
NOTA: Il test di chemioattrazione dei feromoni sessuali volatili è stato adattato da metodi precedentemente stabiliti utilizzati in altri studi di chemioattrazione 24,29,59,60,61. Queste modifiche sono state implementate per ottimizzare la sensibilità e la specificità del test per rilevare le risposte ai feromoni sessuali volatili. Questo approccio personalizzato migliora l'applicabilità del test a specifiche esigenze di ricerca.
- Osservare le piastre di coltura ogni giorno fino a quando le femmine adulte/ermafroditi non sono abbondanti. La salute dei vermi influenza la loro risposta al feromone sessuale.
- Preparazione di lui-5 maschi
- Utilizza il protocollo standard di candeggina per sincronizzare i vermi lui-5 . Dopo la sincronizzazione, lavare le viti senza fine 5 volte con un tampone M9. Isolare i maschi L4 il giorno prima del test; quindi, trasferire i vermi maschi adulti di un giorno dalle loro piastre seminate e sciacquarli in tampone M9 prima del saggio. Posizionarli su piastre NGM non seminate prima del test per eliminare i batteri residui e prevenire interferenze dal cibo durante il test.
NOTA: Non far morire di fame i vermi per più di un'ora prima del test, poiché ciò può alterare il loro stato interno e influenzare i risultati del test di chemioattrazione con feromoni sessuali. Pertanto, se si intende condurre più di 10 saggi in un solo giorno, sostituire i campioni di vermi ogni ora. Inoltre, alternare ripetutamente tra un test sperimentale e un test di controllo.
- Utilizza il protocollo standard di candeggina per sincronizzare i vermi lui-5 . Dopo la sincronizzazione, lavare le viti senza fine 5 volte con un tampone M9. Isolare i maschi L4 il giorno prima del test; quindi, trasferire i vermi maschi adulti di un giorno dalle loro piastre seminate e sciacquarli in tampone M9 prima del saggio. Posizionarli su piastre NGM non seminate prima del test per eliminare i batteri residui e prevenire interferenze dal cibo durante il test.
- Preparazione delle piastre per il saggio dell'agar di chemioattrazione
- Preparare piastre per saggi di chemioattrazione con agar all'1,5%, 25 mM di NaCl, 1,5 mM di Tris-base e 3,5 mM di Tris-Cl come descritto nella letteratura pertinente24.
- Riscaldare l'agar nella soluzione di chemioattrazione usando un forno a microonde fino a completa dissoluzione. Lasciare raffreddare la soluzione a temperatura ambiente per 5 minuti.
- Utilizzare un pipetta per distribuire uniformemente la soluzione di agar chemioattrattiva nelle piastre di Petri: versare 30 ml in ciascuna piastra da 10 cm e 20 ml in ciascuna piastra da 6 cm.
- Dopo aver versato la soluzione di agar chemioattrattivo nelle piastre di Petri, lasciare i coperchi aperti in un'area pulita per almeno 40 minuti per consentire alla superficie dell'agar di asciugarsi leggermente. Una volta che la superficie si è asciugata adeguatamente, chiudere i coperchi.
NOTA: Questo tempo di asciugatura può variare a seconda dell'umidità e della temperatura dell'ambiente di laboratorio.
- Conservazione su piastra e preparazione pre-test
- Confezionare e conservare le piastre di analisi preparate in una cella frigorifera per un massimo di 1 settimana. Prima dell'uso, rimuovere le piastre dalla cella frigorifera e lasciarle acclimatare a temperatura ambiente per oltre un'ora. Aprire i coperchi per far evaporare l'umidità residua dall'agar 20 minuti prima del test in un'area pulita, assicurandosi che non vi sia acqua evidente sulla superficie prima di eseguire il test.
- Disegno sperimentale e saggio di chemioattrazione
- Per eseguire il test di chemioattrazione, segnare tre punti distinti sul coperchio e sul lato inferiore della capsula di Petri o utilizzare una sagoma stampata su carta di plastica trasparente posta sotto la piastra o attaccata al microscopio da dissezione. Questi segni includono un punto centrale (•) come punto di partenza per i vermi, un segno più (+) per il punto sperimentale (2 μL di feromone sessuale sul coperchio e 2 μL di azoturo di sodio 1 M sulla piastra) e un segno meno (-) per il punto di controllo (2 μL di tampone M9 sul coperchio e 2 μL di azoturo di sodio 1 M) (Figura 2A). Regolare la distanza tra questi segni in base alle dimensioni del piatto e alle specifiche esigenze sperimentali. In genere, per le piastre di Petri da 6 cm, impostare una distanza fissa di 1,5 cm dal punto di partenza per ciascuna sostanza in esame per i test di controllo positivi.
- Passaggi dettagliati per eseguire il test (Figura 2)
- Applicare 2 μl di azoturo di sodio 1 M su ciascun punto sperimentale e di controllo sulla piastra.
- Scegli 20 vermi maschi sani e che si muovono liberamente con un raccoglitore di vermi. Rilasciare contemporaneamente 20 vermi maschi al punto di partenza sotto un microscopio da dissezione.
- Aggiungere rapidamente 2 μL di feromone sessuale e 2 μL di tampone M9 rispettivamente ai punti sperimentali e di controllo sul coperchio.
- Chiudere delicatamente il coperchio e posizionare la piastra del test in un'area silenziosa e stabile alla temperatura accanto al microscopio.
- Dopo 30 minuti, valutare il test contando il numero di vermi in ogni punto.
NOTA: Il processo di raccolta di 20 vermi non deve superare 1-2 minuti per evitare che i vermi raccolti in anticipo si secchino e diventino malsani, il che potrebbe influire sui risultati. L'intero processo, dalla raccolta degli uomini alla chiusura del coperchio, dovrebbe durare tra i 2 e i 5 minuti.
- Screening dei controlli positivi
- Testare i vermi maschi con una soluzione diluita 1.000 volte di diacetile (disciolto in etanolo al 10% e tampone M9 al 90%) per confermare la loro reattività alla chemiotassi. Valutare i risultati del test di chemioattrazione 30 minuti dopo l'inizio del test. Segna i vermi che sono paralizzati nei punti designati in base alla loro posizione: 'C' per quelli sul punto di controllo ed 'E' per quelli sul punto sperimentale. Segna i vermi su nessuno dei due punti come 'N' (Figura 2C).
- Per calcolare l'indice di chemioattrazione (C.I.), utilizzare la seguente formula:

- Selezionare solo campioni maschili con un indice di chemiotassi ≥ 0,4 (C.I., vedere Figura 2C). Utilizzare il maschio dello stesso lotto per il successivo test dei feromoni sessuali.
NOTA: Condurre tre test separati, ciascuno dei quali coinvolge 20 vermi, per garantire la coerenza e l'affidabilità dei risultati sperimentali. Tre saggi sono in genere sufficienti per dedurre la coerenza.
5. Linee guida per la tempistica e il punteggio del test di chemioattrazione
- Valuta la risposta alla chemioattrazione dei vermi in base alla loro posizione finale. Segnare il numero di vermi in ogni punto alla conclusione del test, di solito 30 minuti dopo il suo inizio.
NOTA: L'uso di sodio azide nei punti sperimentali e di controllo paralizza i vermi in arrivo, facilitando un punteggio accurato. La maggior parte dei maschi WT N2 e him-5 sono in grado di localizzare la fonte di feromoni entro 6-8 minuti in una piastra di 6 cm con una distanza di 1,5 cm. - Per rilevare i difetti in termini di efficienza della chemiotassi, in particolare per rilevare difetti sottili, è consigliabile monitorare il test a intervalli regolari di 3-5 minuti.
NOTA: Questa osservazione frequente consente di documentare i tempi in cui i vermi arrivano ai punti di prova. Un monitoraggio così dettagliato può rivelare casi in cui i vermi mostrano una ridotta efficienza della chemiotassi, ma riescono comunque a raggiungere il punto del test all'interno della finestra dell'esame.
6. Modifiche facoltative
- Per una valutazione avanzata della chemiotassi, utilizzare una telecamera posizionata sopra la piastra per registrare le traiettorie dei vermi durante il test.
NOTA: Questa modifica consente un'analisi completa dei loro modelli di movimento, fornendo una visione più approfondita del comportamento e della traiettoria della chemioattrazione (Figura 3).
7. Analisi dei dati
- Punteggio e calcolo dell'indice di chemioattrazione (C.I.)
- Seguire i passaggi 4.7.1 e 4.7.2.
- Grafico dell'orario di arrivo
- Per un'analisi più completa dei saggi di chemioattrazione, prendere in considerazione il monitoraggio del test a intervalli di 3-5 minuti o l'utilizzo di una telecamera posizionata sopra la piastra per registrare le traiettorie dei vermi durante il test.
NOTA: Questi approcci non solo consentono di valutare i tempi di arrivo dei vermi nei punti di progettazione, ma anche di confrontare i tempi medi di arrivo e analizzare la distribuzione di questi tempi.
- Per un'analisi più completa dei saggi di chemioattrazione, prendere in considerazione il monitoraggio del test a intervalli di 3-5 minuti o l'utilizzo di una telecamera posizionata sopra la piastra per registrare le traiettorie dei vermi durante il test.
- Analisi della traiettoria basata su video e visualizzazione dei dati
NOTA: Per analizzare i modelli di movimento di C. elegans durante i test di chemioattrazione, registrare ed estrarre le traiettorie (vedere la Tabella dei materiali) e ulteriori analisi (Figura 3).- Configurare il sistema di registrazione.
- Avvia una nuova registrazione e accedi alla finestra delle impostazioni di registrazione .
- Definire i parametri di registrazione desiderati:
- Prefisso file: scegli un nome descrittivo per i file video (ad esempio, "experiment1_").
- Frame Rate (FPS): seleziona i fotogrammi al secondo appropriati per catturare il movimento del verme (ad esempio, 7,5 FPS per i vermi sulla piastra di agar e 30 FPS per i vermi che nuotano ).
- Durata: Impostare la durata della registrazione in secondi (ad esempio, 1.800 s [30 min] per il test di chemioattrazione di massa).
- Ottimizza la qualità dell'immagine: regola l'intensità dell'illuminazione per assicurarti che i vermi siano chiaramente visibili sullo sfondo e ottimizza la messa a fuoco per acquisire un'immagine nitida dei vermi.
- Per preparare la piastra di analisi, erogare prima la soluzione di controllo sul punto di controllo designato. Quindi, raccogli con cura i vermi e rilasciali delicatamente al centro del piatto. Una volta che i vermi si sono depositati, applicare la soluzione di feromoni sessuali nel punto sperimentale designato.
- Posizionare la piastra: Posizionare con cura la piastra contenente i vermi al centro del campo di registrazione per massimizzare l'area di cattura.
- Per ridurre lo stress sui vermi durante i test di chemiotassi, considerare i seguenti due approcci.
- Per il test su un singolo verme, posizionare il verme sulla piastra del saggio e lasciarlo acclimatare per 5 minuti prima di introdurre la soluzione di feromoni sessuali alla distanza designata (la posizione in base alla posizione attuale del verme).
NOTA: Ciò riduce al minimo la manipolazione e fornisce al worm il tempo di adattarsi al nuovo ambiente. - Saggio di chemioattrazione di massa: Lasciare che i vermi si depositino e si disperdano naturalmente sulla piastra per 5 minuti. Dopo questo periodo di acclimatazione, introdurre la soluzione di feromoni nella posizione fissa designata. Durante l'analisi post-video, misura la distanza iniziale di ciascun verme dal feromone e raggruppali di conseguenza per ulteriori analisi.
- Per il test su un singolo verme, posizionare il verme sulla piastra del saggio e lasciarlo acclimatare per 5 minuti prima di introdurre la soluzione di feromoni sessuali alla distanza designata (la posizione in base alla posizione attuale del verme).
- Procedura di analisi video
- Importazione e configurazione: Importa il video registrato nel software. Configurare le informazioni sulla sequenza (ad esempio, frame rate); Specificare la scala di imaging (pixel per unità di misura).
- Regolazione dell'immagine: per ottimizzare il rilevamento dei worm, regolare la soglia di rilevamento fino a quando l'etichetta verde non delinea strettamente i worm senza catturare rumori di fondo o artefatti. Inoltre, applica algoritmi di levigatura dello sfondo per ridurre il rumore e le irregolarità nell'immagine, migliorando il contrasto tra i vermi e lo sfondo. Sperimenta diversi livelli di levigatura per trovare l'equilibrio ottimale tra la riduzione del rumore e la conservazione dei dettagli delle viti senza fine.
NOTA: La soglia ideale dovrebbe coprire la maggior parte del corpo di ogni verme, escludendo gli elementi estranei. - Ottimizzazione dei parametri di rilevamento: selezionare un worm rappresentativo per generare automaticamente i parametri di rilevamento. Verifica l'accuratezza del rilevamento ispezionando visivamente 5-10 fotogrammi casuali. Se il rilevamento non è soddisfacente, perfezionare manualmente i parametri di rilevamento, rivedere le impostazioni di regolazione dell'immagine se necessario e procedere con il monitoraggio una volta che il rilevamento è affidabile.
- Correzione di bozze e riparazione delle traiettorie di tracciamento: al termine del processo di tracciamento automatizzato, eseguire una correzione di bozze manuale delle traiettorie generate. Se vengono rilevate incongruenze durante la correzione di bozze, utilizzare la funzione di riparazione per correggere la traiettoria ed eseguire le seguenti operazioni: Unisci: collega i segmenti di traiettoria a cui sono stati assegnati in modo errato identificatori diversi ma appartengono alla stessa persona. Dividi: segmenti di traiettoria separati a cui è stato assegnato erroneamente lo stesso identificatore ma che appartengono a individui diversi.
NOTA: L'obiettivo è garantire che ogni identificatore univoco (numero) sia assegnato in modo coerente alla stessa persona durante l'intero periodo di tracciamento.
Esempio: se un worm viene etichettato come "3" per un periodo, quindi erroneamente etichettato come "7" per un periodo successivo, la funzione di riparazione unirà questi due segmenti sotto l'identificatore "3". Al contrario, se due worm sono entrambi etichettati come "12" per un periodo, la funzione di riparazione dividerà questo segmento in due traiettorie separate, ciascuna con un identificatore univoco. Correggendo attentamente le bozze e applicando le riparazioni necessarie, l'accuratezza e l'affidabilità dei dati di tracciamento possono essere notevolmente migliorate. - Visualizzazione ed esportazione dei risultati: utilizza il software per la visualizzazione e l'analisi di base. Esporta i dati come file CSV per ulteriori analisi con gli strumenti o il codice preferiti. Questo metodo fornisce un codice di base (vedere https://github.com/edmondztt/pheromone-traj-analysis.git) per visualizzare la traiettoria del movimento del verme in base a cinque parametri chiave (Figura 3). Tempo: La progressione della traiettoria, codificata a colori per indicare il passare del tempo dall'inizio dell'esperimento. Distanza dal feromone: La distanza tra il verme e la fonte di feromone in ogni momento. Velocità: la velocità del verme in ogni punto, che indicava anche gli eventi di svolta e arresto. Rettilineità: quanto è dritto il percorso del verme. Correttezza della direzione: quanto è allineato il movimento del verme con la direzione del feromone bersaglio? Questo codice fornisce una visualizzazione di base per comprendere il comportamento dei worm e può essere personalizzato ed espanso per un'analisi più approfondita.
NOTA: Questo approccio avanzato fornisce un'alternativa completa al tradizionale indice di chemioattrazione, dettagliando la traiettoria di navigazione dei vermi in risposta ai feromoni sessuali. Consente di comprendere i modelli di movimento senza fare affidamento su endpoint arbitrari della navigazione e della determinazione della finestra temporale, offrendo informazioni più approfondite sulle dinamiche comportamentali del test. I dati sono stati mediati su 20 fotogrammi, che possono essere regolati in base a specifiche esigenze sperimentali, per filtrare il movimento causato dalla torsione del corpo.
Risultati
Analisi della traiettoria del ceppo difettoso della percezione del feromone sessuale volatile nel saggio di chemioattrazione
Questo test di chemioattrazione distingue in modo affidabile tra ceppi wild-type e mutanti di C. elegans nella loro risposta ai feromoni sessuali volatili. Esperimenti di successo con maschi lui-5 dimostrano costantemente una robusta chemiotassi verso la fonte di feromoni. Ciò si riflette in un alto indice di chemiotassi (C.I.) (Figura 2), spesso superiore a 0,5, indica una forte preferenza per la fonte di feromoni. Al contrario, gli esperimenti con il mutante del recettore dei feromoni srd-1 producono costantemente risultati negativi. L'IC per i maschi srd-1 è tipicamente intorno a zero24. Ciò conferma la capacità del test di rilevare l'assenza di una risposta chemiotattica.
Negli esperimenti non ottimali, numerosi fattori possono influenzare i risultati. Ad esempio, una concentrazione insufficiente di feromoni può portare a risposte deboli nei maschi him-5 , mentre la contaminazione o la manipolazione impropria potrebbero causare movimenti imprevedibili in entrambi i ceppi. Questi scenari si traducono in valori di C.I. più bassi per i maschi lui-5 e valori potenzialmente fuorvianti diversi da zero per i maschi srd-1 . Pertanto, il successo dell'implementazione di questo protocollo è caratterizzato da una chiara distinzione negli indici di chemiotassi tra ceppi wild-type e mutanti, supportata dall'analisi della traiettoria che conferma visivamente le differenze comportamentali (Figura 3). L'analisi dei dati dovrebbe includere confronti statistici dei valori di IC per garantire che le differenze osservate siano significative.
Dimostrazione dell'analisi e visualizzazione dei dati del saggio di chemioattrazione basato su video
Risultati positivi del test: la Figura 3 mostra la robusta risposta chemiotattica dei maschi him-5 a un feromone sessuale volatile. Le traiettorie codificate a colori rivelano (A) il costo del tempo, (B) la distanza: aumentando la vicinanza alla fonte di feromoni nel tempo, confermando l'attrazione dei vermi. (C) velocità: variare le velocità lungo le traiettorie, fornendo informazioni sulla dinamica delle risposte chemiotattiche. (D) rettilineità: quanto direttamente i vermi si muovono verso la fonte di feromoni. Più il percorso è rettilineo, più efficiente e mirato è il loro movimento in risposta all'attrattivo chimico. (E) Correttezza della direzione: mostra la capacità dei vermi di orientarsi con precisione e di muoversi verso la fonte del feromone, l'attrattivo chimico. Essenzialmente misura quanto bene i vermi possono percepire il gradiente chimico e navigare lungo di esso per raggiungere il loro obiettivo.
Un calo della velocità a zero indica in genere un arresto o una svolta. La combinazione delle informazioni sulla velocità con i dati sulla rettilineità può aiutare a identificare gli eventi di svolta. In particolare, un evento di svolta è indicato quando la velocità scende a zero e anche la rettilineità è molto bassa. Al contrario, gli esperimenti con mutanti difettosi sensoriali o quelli condotti in condizioni non ottimali (ad esempio, bassa concentrazione di feromoni, densità del verme inappropriata) possono produrre risultati diversi.
Confrontando le traiettorie e quantificando parametri come la direzionalità, la velocità e la rettilineità, i ricercatori possono ottenere informazioni sui meccanismi alla base della chemiotassi. Esperimenti riusciti con traiettorie chiare e dirette verso la fonte di feromoni convalidano la capacità del test di rilevare stimoli attraenti. Al contrario, l'assenza di tali pattern nei controlli negativi o nei ceppi mutanti conferma la specificità del test e la capacità di identificare i difetti sensoriali. Il test di chemioattrazione di massa basato su video, come illustrato nella Figura 3, fornisce un potente strumento per sezionare i dettagli del comportamento della chemiotassi dei vermi. Analizzando le traiettorie individuali, i ricercatori possono scoprire non solo la presenza o l'assenza di attrazione, ma anche la differenza nella risposta, offrendo una comprensione più profonda dei meccanismi genetici e neurali sottostanti che regolano la chemiotassi.
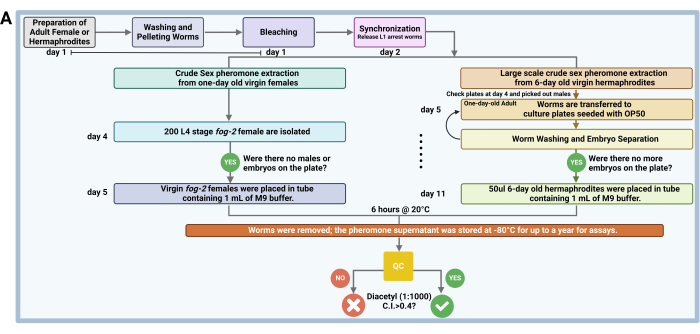
Figura 1: Flusso di lavoro dell'estrazione del feromone sessuale grezzo. Il feromone sessuale grezzo viene estratto da femmine mutanti vergini fog-2 sincronizzate di un giorno di C. elegans e femmine WT di C. remanei, dove i vermi vengono sincronizzati, lavati, isolati e incubati in tampone M9 per la produzione di feromoni. Il surnatante estratto contenente feromoni viene conservato a -80 °C per un massimo di 1 anno per l'uso in saggi di chemioattrazione, con test di controllo qualità condotti utilizzando maschi N2 o him-5 per verificare l'attrattiva. Per l'estrazione su larga scala da ermafroditi vergini di C. elegans di 6 giorni, i vermi vengono sincronizzati e lavati ripetutamente per 6 giorni, con feromoni sessuali estratti in modo simile ma modificati in base al volume dei pellet di vermi e mescolati in modo omogeneo per uso sperimentale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Il test di chemioattrazione dei feromoni sessuali volatili e il calcolo dell'indice di chemioattrazione. (A) Questo test prevede la preparazione di maschi WT N2 o him-5 con un protocollo standardizzato di sincronizzazione della candeggina, testando la loro risposta a una sostanza di controllo positiva prima del test di chemioattrazione dei feromoni sessuali volatili. L'esperimento include la marcatura delle piastre per il controllo e i punti di prova e l'uso del sodio da parte per immobilizzare i vermi in questi punti per un punteggio accurato. I risultati vengono in genere valutati 30 minuti dopo l'inizio dell'esperimento (indicato dalla chiusura del coperchio). (B) Vista laterale della configurazione del saggio di chemioattrazione con due distanze distinte. (C) Calcolo C.I. e interpretazione. L'I.C. è una misura quantitativa dell'attrattiva o della repulsività di uno stimolo di prova. L'IC varia da 1, che indica una forte attrazione, a -1, che indica una forte repulsione. Un basso valore di C.I. può derivare da due scenari: o un piccolo numero di vermi sia nel punto sperimentale che in quello di controllo o una distribuzione uguale di vermi tra i due punti. (D) Indici di chemioattrazione per i maschi di C. elegans lui-5 e srd-1 in risposta ai feromoni sessuali volatili delle femmine di C. remanei e C. elegans. I maschi di diverso background genetico rispondono in modo diverso allo stimolo dei feromoni sessuali. I maschi di him-5 mostrano una risposta a entrambi i feromoni, con un indice notevolmente più alto ai feromoni delle femmine di C. remanei. Al contrario, i maschi del ceppo mutante chemocettore srd-1 non mostrano alcuna risposta a nessuno dei due feromoni in questa analisi. p < 0,01. Abbreviazioni: WT = wild type; C.I. = indice di chemioattrazione. Clicca qui per visualizzare una versione più grande di questa figura.
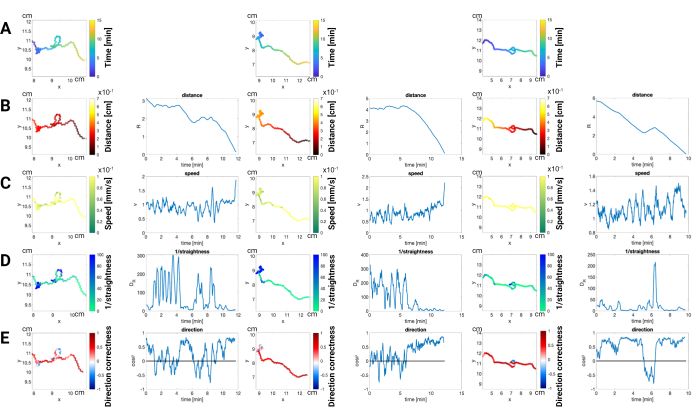
Figura 3: Analisi della traiettoria dei maschi lui-5 in risposta al feromone sessuale volatile. Questa figura illustra i modelli di movimento dei vermi maschi him-5 durante un test di chemioattrazione con uno stimolo volatile a feromoni sessuali. Le traiettorie individuali sono codificate a colori per rappresentare (A) Tempo: progressione della traiettoria nel corso dell'esperimento. Il colore rappresenta il tempo trascorso dall'inizio del saggio. (B) Distanza dal feromone: vicinanza alla fonte di feromone in ogni momento. (C) Velocità: Velocità del verme in ogni punto. (D) Rettilineità: Immediatezza del percorso intrapreso dal verme. (E) Correttezza della direzione: Allineamento del movimento con la direzione della sorgente di feromoni. In tutti e tre gli esempi, i vermi maschi hanno raggiunto con successo la posizione del feromone. I dati sono stati calcolati in media su 20 fotogrammi per filtrare il movimento causato dalla torsione del corpo. Gli esperimenti vengono eseguiti su una piastra di Petri da 10 cm e seguono il metodo del saggio di chemioattrazione di massa basato su video (vedere la sezione 7.3.7.2 del protocollo) menzionato in questo protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo fornisce una solida metodologia per l'estrazione di feromoni sessuali volatili da C. elegans, oltre a stabilire un robusto test di chemioattrazione per misurare le risposte di chemioattrazione maschile. Ulteriori informazioni sono disponibili nella guida per l'utente di WormLab (vedere la Tabella dei materiali); Per un codice di base per visualizzare la traiettoria del movimento del worm, vedere la sezione 7.3.8.5 del protocollo. Diversi passaggi cruciali del protocollo sono importanti per il risultato. In primo luogo, un'attenta sincronizzazione delle popolazioni di vermi è essenziale per controllare l'età e lo stato riproduttivo, garantendo il successo dell'estrazione di feromoni sessuali volatili da femmine vergini o ermafroditi impoveriti di sperma29,34. In secondo luogo, sono necessarie ripetute fasi di lavaggio per rimuovere completamente i batteri, riducendo al minimo la contaminazione che potrebbe interferire con la segnalazione dei feromoni nei successivi test di chemiotassi. Successivamente, la scelta dei parametri del saggio, come la concentrazione dell'attrattivo, la dimensione della piastra e la durata del saggio, può influenzare i risultati e deve essere adattata agli obiettivi sperimentali specifici.
Tempi di essiccazione accurati e una spaziatura costante dei punti di prova sono fondamentali per ottenere risultati affidabili dei test di chemiotassi. Le piastre bagnate influenzano significativamente l'indice di chemiotassi. Se uno strato d'acqua rimane sulla superficie dell'agar, le forze capillari possono intrappolare i vermi al punto di partenza. Questo può ostacolare il loro movimento, portando a risultati falsi negativi nel test. Inoltre, i tempi di asciugatura prolungati rappresentano una sfida diversa per coloro che vengono rilasciati più tardi. Quando la piastra si asciuga, i componenti volatili dei feromoni evaporano e si diffondono, creando un gradiente di concentrazione meno distinto. Ciò rende difficile per i vermi rilasciati in seguito localizzare il feromone bersaglio, anche se sono liberi di muoversi in seguito. Pertanto, assicurarsi che le piastre siano sufficientemente asciutte per eliminare l'umidità superficiale che potrebbe influire sui risultati dell'esperimento.
Il volume della soluzione di agar aggiunto alle piastre deve essere regolato in base ai requisiti specifici dell'esperimento, garantendo condizioni di analisi ottimali. Lo spessore dello strato di agar, regolato variando la quantità di soluzione di agar versata nel piatto. In genere, una distanza più breve tra l'attrattivo e la piastra di agar porta a risultati più robusti. Al contrario, una distanza maggiore può aiutare a eliminare gli effetti dei componenti non volatili, fornendo una valutazione più chiara dell'influenza dell'attrattivo volatile. Lo spessore dell'agar può essere adattato alle specifiche esigenze sperimentali, come mostrato nella Figura 2B.
Il processo di raccolta di 20 vermi non deve superare 1-2 minuti per evitare che i vermi raccolti in anticipo si secchino e diventino malsani, il che potrebbe influire sui risultati. Assicurarsi che i vermi vengano rilasciati contemporaneamente sulla piastra del saggio per evitare che i vermi rilasciati precocemente camminino in modo casuale troppo lontano dal punto di partenza. I ritardi in questa fase possono portare a posizioni di partenza variabili tra i campioni, con conseguenti confronti inequi. L'intero processo, dalla raccolta degli uomini alla chiusura del coperchio, dovrebbe durare tra i 2 e i 5 minuti.
Personalizzare la spaziatura tra i punti sperimentali/di controllo e il punto di partenza sulla piastra del saggio in base alle dimensioni della piastra e agli obiettivi specifici dell'esperimento. L'aumento della distanza tra i punti può rendere il test più impegnativo, il che è vantaggioso per rilevare effetti sottili. Al contrario, la riduzione della distanza crea un test di analisi più robusto che evidenzia gravi difetti.
La risoluzione dei problemi può essere necessaria in vari punti del protocollo. Se il feromone estratto non induce una risposta chemiotassica, verificare attentamente l'età e lo stato riproduttivo delle femmine e degli ermafroditi di origine. Solo le femmine vergini o gli ermafroditi impoveriti di sperma produrranno il feromone bersaglio. A causa dell'elevata efficienza di accoppiamento dei maschi di C. elegans , la presenza anche di un solo maschio sulla placca di isolamento femmina L4 può influire drasticamente sui risultati. Inoltre, garantire il controllo della contaminazione batterica durante tutto il processo di estrazione. Sebbene questo protocollo di estrazione offra un modo semplice per ottenere feromoni sessuali volatili grezzi, presenta alcune limitazioni. L'estratto grezzo di feromone può contenere tracce di altre molecole di segnalazione, rendendo difficile isolare definitivamente gli effetti specifici del feromone sessuale stesso. I componenti funzionali del feromone sessuale volatile non sono ancora stati identificati. Sebbene non sia stata riportata alcuna differenza funzionale tra i feromoni sessuali delle femmine vergini di un giorno e degli ermafroditi di sei giorni, la possibilità di una sottile differenza non può essere esclusa.
Nel test di chemioattrazione, un basso indice di chemiotassi potrebbe indicare un problema con la salute o lo stadio di sviluppo dei maschi testati. Per garantire risultati ottimali, utilizzare maschi adulti sani di un giorno cresciuti a 20 °C su una piastra OP50 pulita e priva di contaminazione. Variazioni brusche di temperatura da temperature di conservazione più basse (come 15 °C) a 20 °C possono influenzare negativamente il comportamento di chemioattrazione per un massimo di tre generazioni. Per le migliori pratiche, lasciare che i ceppi scongelati di recente o mantenuti a temperature più basse si adattino a 20 °C per oltre tre generazioni prima dell'uso. Sebbene sia consigliabile isolare i maschi in prova allo stadio L4 il giorno prima del giorno del test, non è strettamente necessario. La pre-esposizione agli ermafroditi adulti non influisce in modo significativo sui risultati del test di chemioattrazione. Gli ermafroditi di un giorno non producono feromoni sessuali volatili a causa dell'esistenza di autospermatozoi. Pertanto, l'isolamento maschile L4 può essere saltato quando si esegue uno screening su larga scala. Tuttavia, per gli studi che indagano specificamente gli effetti di precedenti esperienze di accoppiamento o altri studi correlati, è necessario isolare i maschi allo stadio L4 1 giorno prima del giorno del test.
La mutazione him-5 in C. elegans causa un'alta incidenza di maschi a causa di un aumento del tasso di non disgiunzione del cromosoma X durante la meiosi nel genitore dei maschi. Pertanto, il sistema chemiosensoriale dei maschi necessario per la chemiotassi è ancora intatto. Ciò rende più facile ottenere un gran numero di maschi per il test. Di conseguenza, i maschi him-5 mostrano una robusta chemiotassi paragonabile ai maschi WT N2, il che li rende un controllo adatto nei saggi di chemiotassi con feromoni sessuali.
Considerazioni aggiuntive:
Sostituzione dell'azide di sodio: L'azide di sodio utilizzata per paralizzare i vermi durante la registrazione video può essere evitata. Utilizzare invece una goccia di soluzione M9 per immobilizzare temporaneamente i vermi, anche se la tensione superficiale è sufficiente per il saggio basato su video.
Densità del coclea: Limitare il numero di vermi per piatto per evitare il sovraffollamento e mantenere condizioni ottimali. Il sovraffollamento influenzerà l'analisi post-video in quanto il programma avrà difficoltà a identificare i worm se si sovrappongono tra loro. Si consiglia un massimo di 20 vermi per una capsula di Petri di 6 cm e 100 vermi per una piastra di 10 cm.
I test di chemioattrazione tradizionali offrono un approccio semplice, che richiede uno sforzo minimo per l'acquisizione dei dati. Sebbene questi test forniscano una rapida panoramica della risposta chemiotassica, catturano solo il punto finale di una risposta comportamentale complessa. Ciò limita la loro capacità di rivelare i dettagli della percezione dei feromoni e della risposta locomotoria. Al contrario, l'analisi avanzata della traiettoria fornisce informazioni sui modelli di movimento individuali e collettivi. Questo approccio scopre le differenze che non si notano solo le misure basate sugli endpoint. Consentendo l'esplorazione dettagliata dei modelli cinetici e della variabilità della risposta all'interno delle popolazioni di test, questo metodo migliora significativamente la nostra comprensione dei meccanismi chemiosensoriali. Ciò evidenzia l'applicabilità del test a diverse domande di ricerca e sottolinea l'importanza di considerare la variabilità individuale nel disegno sperimentale.
Questa metodologia offre un quadro per lo studio dei feromoni sessuali volatili in C. elegans. Può facilitare la scoperta di geni correlati alla sintesi, alla secrezione e alla percezione dei feromoni sessuali volatili, migliorando la nostra comprensione della comunicazione chimica a livello molecolare e di circuito neurale. Inoltre, il saggio di chemioattrazione e l'analisi dei dati di traiettoria possono essere utilizzati per studiare altri chemioattrattivi in C. elegans.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Siamo grati al Dr. Tingtao Zhou per aver progettato e scritto il codice per le visualizzazioni delle traiettorie utilizzate nella nostra analisi. Questo lavoro è stato sostenuto da finanziamenti: R01 NS113119 (PWS), borsa di studio post-dottorato senior Chen e Tianqiao e Chrissy Chen Institute for Neuroscience.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Riferimenti
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon