Method Article
Extraction de phéromones sexuelles volatiles et test de chimioattraction chez Caenorhabditis elegans
Dans cet article
Résumé
Ce protocole établit des méthodes pour extraire et quantifier les réponses à la phéromone sexuelle volatile chez C. elegans, fournissant des outils pour étudier la communication chimique et la trajectoire de navigation.
Résumé
La communication chimique est vitale pour la santé de l’organisme, la reproduction et le bien-être général. La compréhension des voies moléculaires, des processus neuronaux et des calculs régissant ces signaux reste un domaine de recherche actif. Le nématode Caenorhabditis elegans fournit un modèle puissant pour étudier ces processus car il produit une phéromone sexuelle volatile. Cette phéromone est synthétisée par les femelles vierges ou les hermaphrodites appauvris en spermatozoïdes et sert d’attractif pour les mâles.
Ce protocole décrit une méthode détaillée pour isoler la phéromone sexuelle volatile de plusieurs souches de C. elegans (souche WT N2, daf-22 et fog-2) et C. remanei. Nous fournissons également un protocole pour quantifier la réponse chimiotaxique masculine à la phéromone sexuelle volatile. Notre analyse utilise des mesures telles que l’indice de chimiotaxie (C.I.), le temps d’arrivée (A.T.) et un tracé de trajectoire pour comparer avec précision les réponses masculines dans diverses conditions. Cette méthode permet d’établir des comparaisons robustes entre des mâles de différents antécédents génétiques ou stades de développement. De plus, le dispositif expérimental décrit ici est adaptable à l’étude d’autres produits chimiques de chimioattraction.
Introduction
L’interaction entre la communication chimique et le succès de la reproduction est un principe fondamental dans le règne animal 1,2,3,4,5,6,7,8,9,10. Les phéromones sexuelles déclenchent un large éventail de comportements sexuellement dimorphes essentiels pour localiser les partenaires, coordonner les étapes impliquées dans la recherche et l’attraction d’un partenaire, et finalement favoriser la propagation d’une espèce 11,12,13,14,15,16,17. Des progrès significatifs ont été réalisés dans la compréhension de la signalisation des phéromones, mais les mécanismes moléculaires, les circuits neuronaux et les processus informatiques régissant ces interactions restent souvent incomplètement définis 18,19,20,21,22,23,24,25,26.
Le nématode Caenorhabditis elegans fournit un modèle puissant pour disséquer ces questions. Notamment, C. elegans présente une stratégie de reproduction inhabituelle - les hermaphrodites peuvent s’autoféconder mais aussi se croiser avec les mâles 27,28,29,30,31,32,33. Cette flexibilité nécessite un système de communication robuste pour signaler l’état reproducteur. C. elegans est connu pour ses phéromones hydrosolubles bien caractérisées, les ascarosides, qui jouent des rôles variés dans le développement, le comportement et les interactions sociales. Des découvertes récentes ont révélé une classe distincte de phéromones sexuelles volatiles employées par les nématodes. Ces phéromones sont spécifiquement produites par les femelles vierges sexuellement matures de C. elegans et C. remanei et les hermaphrodites appauvris en spermatozoïdes, servant d’attractif pour les mâles adultes 29,34,35. Cet attractif présente un dimorphisme sexuel remarquable dans sa production et sa perception. La gonade somatique femelle régit la synthèse de cette phéromone sexuelle volatile, et la production reflète dynamiquement l’état reproducteur, cessant lors de l’accouplement et reprenant plusieurs heures plus tard29,34.
Comprendre la communication des phéromones sexuelles des nématodes donne un aperçu de l’évolution des systèmes de communication chimique, de l’interaction entre l’état reproducteur et le comportement, et des mécanismes sous-jacents au traitement neuronal sexuellement dimorphe 24,26,36,37,38,39 . Des études impliquent que le neurone amphide AWA chez les mâles est essentiel pour la détection des phéromones, le récepteur couplé aux protéines G SRD-1 jouant un rôle clé dans la détection des phéromones chez les mâles24. C. elegans est bien adapté à l’étude de la communication chimique animale, en particulier de la signalisation des phéromones sexuelles, en raison de sa dépendance au système olfactif pour la recherche de partenaire. Bien que l’on sache beaucoup de choses sur la signalisation des ascarosides, le système de phéromones sexuelles volatiles offre des possibilités uniques de comparaison 25,26,36,40,41,42,43,44,45,46,47,48,49,50,
51,52,53,54,55,56,57. De plus, C. elegans est un puissant organisme modèle génétique en raison de son génome entièrement séquencé, de sa lignée cellulaire clairement définie et de ses mutants olfactifs bien caractérisés.
Cependant, l’ensemble des circuits neuronaux impliqués dans le traitement de cette phéromone, les calculs qui traduisent sa perception en comportements ciblés de recherche de partenaire et la régulation de sa biosynthèse restent à élucider. Des recherches plus approfondies sur ces processus sont cruciales pour comprendre les divers mécanismes régissant la communication animale et les comportements reproductifs. L’identification de gènes clés impliqués dans la synthèse, la sécrétion et la perception des phéromones promet de dévoiler de nouveaux acteurs moléculaires dans la communication animale. Les analyses décrites ici fournissent une base pour répondre à ces questions.
Protocole
1. Extraction brute de phéromones sexuelles chez les femelles et les hermaphrodites
- Protocole pour la synchronisation de C. elegans
- Préparation des femelles adultes ou hermaphrodites
- Surveiller quotidiennement les plaques de culture jusqu’à ce qu’il y ait une grande population de femelles adultes/hermaphrodites et que la source de nourriture OP50 s’épuise. À l’aide de femelles fog-2 C. elegans et WT C. remanei pour l’extraction brute des phéromones sexuelles, préparez des œufs synchronisés à partir des femelles accouplées.
REMARQUE : Dans ce protocole, les animaux C . elegans fog-2 mutant XX, qui ne produisent pas d’auto-spermatozoïdes, sont appelés femelles C. elegans .
- Surveiller quotidiennement les plaques de culture jusqu’à ce qu’il y ait une grande population de femelles adultes/hermaphrodites et que la source de nourriture OP50 s’épuise. À l’aide de femelles fog-2 C. elegans et WT C. remanei pour l’extraction brute des phéromones sexuelles, préparez des œufs synchronisés à partir des femelles accouplées.
- Lavage et granulation des vers
- Laver les vers adultes d’une plaque de population mixte avec un tampon M9. Prélever la suspension de vis sans fin dans un tube de microcentrifugation de 1,5 ml. Centrifuger à 1 500 × g pendant 0,5 à 1 min pour granuler les vers.
REMARQUE : Prénettoyage pour une contamination importante (facultatif) : Laissez les vers se déposer dans le tube s’ils sont fortement contaminés. Pipetez le surnageant pour éliminer les bactéries et répétez l’opération jusqu’à ce qu’il devienne clair.
- Laver les vers adultes d’une plaque de population mixte avec un tampon M9. Prélever la suspension de vis sans fin dans un tube de microcentrifugation de 1,5 ml. Centrifuger à 1 500 × g pendant 0,5 à 1 min pour granuler les vers.
- Blanchiment
- Ajoutez 200 μL de tampon M9 à la pastille de ver. Préparez le tampon de lyse en mélangeant de l’eau de Javel domestique et 1 M de NaOH dans un rapport de 1:1. Ajoutez 500 μL de ce tampon de lyse au mélange, agitez le tourbillon pendant 10 s, puis faites une pause pour surveiller l’état de lyse à l’aide d’un microscope à dissection. Répétez ce processus de vortex de 10 s suivi d’une observation jusqu’à ce que les vers adultes soient complètement lysés.
- Arrêt du blanchiment et de la granulation des embryons
- Lorsque les vers adultes sont lysés en petits fragments (mais pas complètement dissous), ajoutez immédiatement 500 μL de tampon M9 pour ralentir la réaction. Centrifugeuse à 15 000 × g pendant 30 à 60 s pour granuler les embryons.
REMARQUE : Une lyse excessive peut endommager les embryons. Arrêtez la réaction lorsque les corps des vers adultes se sont décomposés en petits fragments. La lyse se poursuit pendant les étapes de centrifugation et de lavage jusqu’à ce que tout le tampon de lyse soit éliminé.
- Lorsque les vers adultes sont lysés en petits fragments (mais pas complètement dissous), ajoutez immédiatement 500 μL de tampon M9 pour ralentir la réaction. Centrifugeuse à 15 000 × g pendant 30 à 60 s pour granuler les embryons.
- Lavez les embryons 5 fois avec 1 ml de tampon M9, en centrifugeant à 15 000 × g pendant 30 à 60 s après chaque lavage. Retirer le surnageant après centrifugation.
- Synchronisation
- Remettre les embryons en suspension dans 800 μL de tampon M9 dans un tube de microcentrifugation de 1,5 mL. Faites pivoter le tube à 20 °C pendant 12 à 15 h pour l’éclosion de L1 et l’arrêt des vers au stade L1 en raison de l’absence d’alimentation alimentaire. Relâchez et cultivez les vers à 20° C pendant 3 jours jusqu’à ce qu’ils atteignent le stade L4.
- Préparation des femelles adultes ou hermaphrodites
2. Extraction brute de phéromones sexuelles chez des femelles vierges d’un jour (figure 1A)
REMARQUE : Nous adoptons un protocole24 précédemment établi pour extraire les phéromones sexuelles des femelles mutantes vierges fog-2 (féminisation de la lignée germinale) d’un jour de C. elegans et des femelles WT de C. remanei.
- Préparation des femelles adultes
- Sélectionner et isoler environ 200 femelles de brouillard de stade L4 2 1 jour avant l’extraction des phéromones. Pour vous assurer que seules les femelles vierges sont recueillies, séparez soigneusement ces femelles L4 fog-2 par sexe et répartissez-les sur trois plaques distinctes OP50 NGM de 6 cm. Placez une petite quantité de bactéries OP50 au centre de chaque plaque.
REMARQUE : Répartissez 200 vers femelles L4 sur trois plaques distinctes pour éviter le risque d’introduire accidentellement un ver mâle dans la plaque. Si un mâle est choisi, il est probable qu’il s’accouplera avec de nombreuses femelles, ce qui fait que la plupart des femelles sont fécondées le lendemain lorsqu’elles deviennent adultes. Les femelles fécondées n’émettent pas de phéromones sexuelles volatiles jusqu’à ce que les spermatozoïdes soient épuisés, ce qui affecte les résultats de l’extraction. La source de nourriture limitée restreint les hermaphrodites à une zone plus petite au centre de la plaque, minimisant ainsi les chances de s’échapper de la plaque pendant la période d’isolement.
- Sélectionner et isoler environ 200 femelles de brouillard de stade L4 2 1 jour avant l’extraction des phéromones. Pour vous assurer que seules les femelles vierges sont recueillies, séparez soigneusement ces femelles L4 fog-2 par sexe et répartissez-les sur trois plaques distinctes OP50 NGM de 6 cm. Placez une petite quantité de bactéries OP50 au centre de chaque plaque.
- Processus d’extraction
- Le jour de l’extraction (jour 1 de la maturité reproductive, 3 jours après que les vers ont été libérés de l’arrêt L1), prélever et isoler 100 femelles vierges de 1 jour dans un tube de microcentrifugation contenant 1 mL de tampon M9. Laver les femelles 5 fois avec un tampon M9 pour minimiser la contamination bactérienne et les incuber dans 100 μL de tampon M9 pendant 6 h à 20 °C pour permettre la production et l’accumulation de phéromones dans le milieu.
- Effectuer un processus d’extraction similaire pour les femelles de C. remanei , en utilisant seulement 15 à 20 femelles de stade L4 isolées la veille de l’extraction sur trois plaques, et le lendemain, incuber cinq femelles vierges dans 100 μL de tampon M9 pendant 6 h à 25 °C (température de croissance optimale pour C. remanei)58.
REMARQUE : Les femelles de C. remanei produisent une quantité plus élevée de phéromones sexuelles volatiles que les femelles de C. elegans . Par conséquent, seules cinq femelles suffisent pour extraire 100 μL de phéromone sexuelle volatile brute.
- Stockage
- Centrifuger des échantillons à 15 000 × g pendant 30 à 60 s pour granuler les vers. Transférez soigneusement le surnageant (contenant des phéromones) dans un tube propre et jetez le tube contenant la pastille de ver. Conservez le surnageant isolé pour les tests de chimioattraction ultérieurs.
REMARQUE : L’extrait brut de phéromones sexuelles volatiles peut être stocké pendant au moins 1 an à -80 °C dans un tube de microcentrifugation enveloppé de parafilm pour minimiser l’évaporation.
- Centrifuger des échantillons à 15 000 × g pendant 30 à 60 s pour granuler les vers. Transférez soigneusement le surnageant (contenant des phéromones) dans un tube propre et jetez le tube contenant la pastille de ver. Conservez le surnageant isolé pour les tests de chimioattraction ultérieurs.
- Contrôle qualité
- Avant d’utiliser l’extrait, effectuez un test de contrôle de la qualité avec des mâles N2 ou him-5 mâles pour vérifier son attractivité chimiologique (voir rubrique 4).
3. Une grande quantité d’extraction brute de phéromones sexuelles à partir d’hermaphrodites vierges âgés de 6 jours (Figure 1A)
- Culture de vers
- Pour obtenir environ 20 ml de phéromone sexuelle brute de C. elegans , synchronisez vingt plaques NGM de 10 cm contenant des vers adultes sains de C. elegans (N2 ou mutant daf-22 ) en utilisant le protocole d’eau de Javel susmentionné, puis lavez-les 5 fois avec un tampon M9.
REMARQUE : Ce processus prépare suffisamment d’embryons pour l’extraction de phéromones. N2 : La souche standard de WT C. elegans qui produit à la fois des phéromones ascarosides hydrosolubles et des phéromones sexuelles volatiles non ascarrosidiques. Mutant daf-22 : Un mutant n’ayant pas la capacité de produire de nombreuses phéromones ascarosides, ce qui les rend utiles pour étudier isolément les phéromones sexuelles volatiles non ascarrosidiques. - Pour synchroniser les vers au stade L1, faites pivoter les embryons dans le tampon M9 pendant 12 à 15 h pour arrêter le développement. Transférez les vers L1 arrêtés dans des plaques de culture NGM de 10 cm ensemencées avec la bactérie OP50 pour la croissance et le développement.
- Pour minimiser la présence de mâles sur les plaques hermaphrodites, vérifiez les plaques 2 jours après la libération du vers, au stade L4, et retirez tous les mâles observés (très rare).
- Après trois jours de développement, recherchez l’apparition d’embryons indiquant que les vers sont devenus des adultes matures sur le plan reproductif.
REMARQUE : les femelles mutantesfog-2 de C. elegans et les femelles WT de C. remanei ne conviennent pas à l’extraction de phéromones sexuelles volatiles en vrac. C. elegans et C. remanei ont une forte proportion de mâles dans leurs populations, et les mâles s’accouplent continuellement avec les femelles. Les femelles fécondées ne produisent pas de phéromones sexuelles volatiles. La présence masculine complique l’extraction de ces composés.
- Pour obtenir environ 20 ml de phéromone sexuelle brute de C. elegans , synchronisez vingt plaques NGM de 10 cm contenant des vers adultes sains de C. elegans (N2 ou mutant daf-22 ) en utilisant le protocole d’eau de Javel susmentionné, puis lavez-les 5 fois avec un tampon M9.
- Lavage des vers et séparation des embryons
- Lavez les embryons à plusieurs reprises avec le tampon M9 et laissez-les se déposer (sédimentation de 1 g ) jusqu’à ce que la plupart des adultes soient au fond du tube ; Répétez l’opération 5 à 7 fois. Laissez les tubes de microcentrifugation se déposer sans être dérangés dans un rack pendant plusieurs minutes pour faciliter la sédimentation des vers adultes et permettre la séparation de la population de vers adultes des embryons, qui restent en suspension dans le surnageant.
- Pipeter les adultes séparés et les transférer dans de nouvelles plaques NGM ensemencées d’OP50.
- Répétez ce processus de lavage pendant 5 à 6 jours pour épuiser l’auto-sperme.
REMARQUE : Pour l’extraction des phéromones sexuelles volatiles, utilisez des hermaphrodites âgés de 5 à 6 jours. Ce moment garantit que leur auto-spermatozoïde est susceptible d’être épuisé, car les hermaphrodites avec l’auto-spermatozoïde disponible ne produisent pas de phéromones sexuelles volatiles. De nombreux embryons morts ou non éclos sur la plaque au jour 5 ou 6 indiquent un moment approprié pour commencer l’extraction des phéromones.
- Extraction de phéromones sexuelles
- Extraire la phéromone sexuelle comme décrit dans la rubrique 1 avec des modifications.
- Au lieu d’ajouter 100 femelles de C. elegans par 100 μL, ajoutez un tampon M9 en fonction du volume final de pastilles de ver. Ajouter 1 mL de tampon M9 par 50 μL de vers tassés.
- Contrôle de la qualité et homogénéisation
- Lots d’essai de contrôle de la qualité de la phéromone extraite à l’aide du test de chimioattraction avec des mâles N2 ou him-5 mâles (voir rubrique 4).
- Mélangez tous les lots pour créer une phéromone sexuelle volatile brute homogène pour les expériences qui nécessitent une grande quantité de phéromones, telles que le criblage ou les expériences microfluidiques. Conservez l’extrait brut de phéromones sexuelles pendant au moins 1 an à -80 °C dans des tubes de 50 mL enveloppés de parafilm pour minimiser l’évaporation.
- Méthode de titrage basée sur un test de chimioattraction pour la standardisation d’un extrait de phéromones sexuelles brutes
- Effectuez un test de titrage en testant des dilutions en série de chaque extrait de phéromones sur WT N2 et him-5 mâle C. elegans. Déterminer la dilution la plus élevée (concentration la plus faible) qui permet d’obtenir une réponse chimiotaxique robuste et reproductible dans les souches témoins.
- Préparez une série de dilutions de chaque extrait brut (p. ex., 1:2, 1:4, 1:8, etc.) dans un tampon M9.
- Dosages de chimiotaxie
- Effectuer des tests de chimiotaxie standardisés (voir rubrique 4) en utilisant chaque dilution sur la souche de référence des mâles. Effectuez trois répétitions pour garantir la reproductibilité. Comparez les dilutions optimales entre différents lots d’extraction pour évaluer la cohérence de la concentration en phéromones.
REMARQUE : Cela établit un point de référence pour évaluer la bioactivité de chaque extrait. Dans le test standard de chimioattraction des phéromones sexuelles, les extraits non dilués originaux seront utilisés pour les expériences ultérieures, le titrage servant d’étape de contrôle de la qualité pour assurer une activité constante des phéromones entre les lots. La série de dilution peut être ajustée en fonction des besoins expérimentaux spécifiques. Étant donné que le protocole d’extraction standard produit systématiquement des extraits de phéromones brutes saturées, un test de titrage pour normaliser l’extrait peut ne pas être nécessaire pour la plupart des expériences. Il est recommandé d’utiliser le même lot de phéromones sexuelles brutes tout au long d’une série d’expériences connexes afin de maintenir l’uniformité et de minimiser la variabilité de l’activité des phéromones.
- Effectuer des tests de chimiotaxie standardisés (voir rubrique 4) en utilisant chaque dilution sur la souche de référence des mâles. Effectuez trois répétitions pour garantir la reproductibilité. Comparez les dilutions optimales entre différents lots d’extraction pour évaluer la cohérence de la concentration en phéromones.
4. Test de chimioattraction des phéromones sexuelles volatiles
REMARQUE : Le test de chimioattraction des phéromones sexuelles volatiles a été adapté des méthodes précédemment établies utilisées dans d’autres études de chimioattraction 24,29,59,60,61. Ces modifications ont été mises en œuvre pour optimiser la sensibilité et la spécificité du test pour la détection des réponses aux phéromones sexuelles volatiles. Cette approche personnalisée améliore l’applicabilité du test à des besoins de recherche spécifiques.
- Observez les plaques de culture quotidiennement jusqu’à ce que les femelles adultes/hermaphrodites soient abondantes. La santé des vers influence leur réponse à la phéromone sexuelle.
- Préparation de lui-5 mâles
- Utilisez le protocole standard de bleach pour synchroniser les vers him-5 . Après la synchronisation, lavez les vers 5 fois avec le tampon M9. Isoler les mâles L4 la veille du dosage ; ensuite, transférez des vers mâles adultes d’un jour de leurs plaques ensemencées et rincez-les dans un tampon M9 avant le test. Placez-les sur des plaques NGM non ensemencées avant l’essai afin d’éliminer les bactéries résiduelles et d’éviter l’interférence des aliments pendant l’essai.
REMARQUE : Ne laissez pas les vers affamés plus d’une heure avant le test, car cela peut modifier leur état interne et influencer les résultats du test de chimioattraction des phéromones sexuelles. Par conséquent, si vous avez l’intention d’effectuer plus de 10 tests en une seule journée, remplacez les échantillons de vers toutes les heures. De plus, alternez entre un essai expérimental et un essai de contrôle à plusieurs reprises.
- Utilisez le protocole standard de bleach pour synchroniser les vers him-5 . Après la synchronisation, lavez les vers 5 fois avec le tampon M9. Isoler les mâles L4 la veille du dosage ; ensuite, transférez des vers mâles adultes d’un jour de leurs plaques ensemencées et rincez-les dans un tampon M9 avant le test. Placez-les sur des plaques NGM non ensemencées avant l’essai afin d’éliminer les bactéries résiduelles et d’éviter l’interférence des aliments pendant l’essai.
- Préparation des plaques de dosage de gélose à chimioattraction
- Préparer des plaques d’essai de chimioattraction avec 1,5 % de gélose, 25 mM de NaCl, 1,5 mM de Tris-base et 3,5 mM de Tris-Cl, comme décrit dans la littérature pertinente24.
- Chauffer la gélose dans la solution de chimioattraction à l’aide d’un micro-ondes jusqu’à ce qu’elle soit complètement dissoute. Laisser refroidir la solution à température ambiante pendant 5 min.
- À l’aide d’une pipette, répartissez uniformément la solution de gélose de chimioattraction dans des boîtes de Pétri : versez 30 ml dans chaque boîte de 10 cm et 20 ml dans chaque boîte de 6 cm.
- Après avoir versé la solution de gélose chimioattirée dans les boîtes de Pétri, laissez les couvercles ouverts dans un endroit propre pendant au moins 40 minutes pour permettre à la surface de la gélose de sécher légèrement. Une fois que la surface a bien séché, fermez les couvercles.
REMARQUE : Ce temps de séchage peut varier en fonction de l’humidité et de la température de l’environnement du laboratoire.
- Stockage des plaques et préparation du pré-dosage
- Emballez et conservez les plaques de dosage préparées dans une chambre froide jusqu’à 1 semaine. Avant utilisation, retirez les plaques de la chambre froide et laissez-les s’acclimater à la température ambiante pendant plus d’une heure. Ouvrez les couvercles pour laisser toute humidité résiduelle s’évaporer de la gélose 20 minutes avant le test dans un endroit propre, en vous assurant qu’il n’y a pas d’eau évidente à la surface avant de faire le test.
- Conception expérimentale et test de chimioattraction
- Pour effectuer le test de chimioattraction, marquez trois points distincts sur le couvercle et le dessous de la boîte de Pétri ou utilisez un gabarit imprimé sur du papier plastique transparent placé sous la boîte ou fixé au microscope de dissection. Ces marques comprennent un point central (•) comme point de départ pour les vers, un signe plus (+) pour le point expérimental (2 μL de phéromone sexuelle sur le couvercle et 2 μL d’azoture de sodium 1 M sur la plaque) et un signe moins (-) pour le point de contrôle (2 μL de tampon M9 sur le couvercle et 2 μL d’azoture de sodium 1 M) (figure 2A). Ajustez la distance entre ces marques en fonction de la taille de l’antenne et des besoins expérimentaux spécifiques. En règle générale, pour les boîtes de Pétri de 6 cm, fixez une distance fixe de 1,5 cm entre le point de départ et chaque substance d’essai pour les tests de contrôle positif.
- Étapes détaillées pour effectuer le test (Figure 2)
- Appliquer 2 μL d’azoture de sodium 1 M à chaque point d’expérimentation et de contrôle de la plaque.
- Choisissez 20 vers mâles en bonne santé et se déplaçant librement avec un ramasseur de vers. Relâchez simultanément 20 vers mâles au point de départ sous un microscope de dissection.
- Ajoutez rapidement 2 μL de phéromone sexuelle et 2 μL de tampon M9 aux points d’expérimentation et de contrôle sur le couvercle, respectivement.
- Fermez doucement le couvercle et placez la plaque de test dans un endroit calme et stable à la température à côté du microscope.
- Après 30 min, notez le test en comptant le nombre de vers à chaque endroit.
REMARQUE : Le processus de cueillette de 20 vers ne doit pas dépasser 1 à 2 minutes pour éviter que les vers cueillis tôt ne se dessèchent et ne deviennent malsains, ce qui pourrait affecter les résultats. L’ensemble du processus, de la cueillette des mâles à la fermeture du couvercle, devrait prendre entre 2 et 5 minutes.
- Dépistage de contrôle positif
- Testez les vers mâles dans une solution diluée de diacétyle 1 000 fois (dissoute dans de l’éthanol à 10 % et un tampon M9 à 90 %) pour confirmer leur réponse à la chimiotaxie. Évaluez les résultats du test de chimioattraction 30 minutes après le début du test. Évaluez les vers qui sont paralysés aux endroits désignés en fonction de leur emplacement : « C » pour ceux qui se trouvent au point de contrôle et « E » pour ceux qui se trouvent au point expérimental. Noter les vers à l’un ou l’autre endroit par « N » (figure 2C).
- Pour calculer l’indice de chimioattraction (IC), utilisez la formule suivante :

- Ne sélectionner que des échantillons mâles dont l’indice de chimiotaxie ≥ 0,4 (C.I., voir figure 2C). Utilisez le mâle du même lot pour le test de phéromone sexuelle suivant.
REMARQUE : Effectuer trois essais distincts, chacun impliquant 20 vers, afin d’assurer l’uniformité et la fiabilité des résultats expérimentaux. Trois essais sont généralement suffisants pour inférer la cohérence.
5. Lignes directrices sur le moment et la notation pour le test de chimioattraction
- Évaluez la réponse chimio-attraction des vers en fonction de leur emplacement final. Notez le nombre de vers à chaque endroit à la fin de l’essai, généralement 30 minutes après son début.
REMARQUE : L’utilisation d’azoture de sodium aux points expérimentaux et de contrôle paralyse les vers qui arrivent, facilitant un marquage précis. La plupart des mâles WT N2 et him-5 sont capables de localiser la source de phéromones en 6 à 8 minutes dans une plaque de 6 cm avec une configuration de distance de 1,5 cm. - Pour détecter les défauts sur l’efficacité de la chimiotaxie, en particulier pour détecter les défauts subtils, envisagez de surveiller le test à intervalles réguliers de 3 à 5 minutes.
REMARQUE : Cette observation fréquente permet de documenter les moments auxquels les vers arrivent aux points d’essai. Un suivi aussi détaillé peut révéler des cas où les vers présentent une efficacité chimiotaxique réduite tout en parvenant à atteindre le point de test dans la fenêtre d’examen.
6. Modifications facultatives
- Pour une meilleure évaluation de la chimiotaxie, utilisez une caméra positionnée au-dessus de la plaque pour enregistrer les trajectoires des vers tout au long de l’essai.
REMARQUE : Cette modification permet une analyse complète de leurs mouvements, ce qui permet de mieux comprendre le comportement et la trajectoire de la chimioattraction (Figure 3).
7. Analyse des données
- Notation et calcul de l’indice de chimioattraction (C.I.)
- Suivez les étapes 4.7.1 et 4.7.2.
- Graphique de l’heure d’arrivée
- Pour une analyse plus complète des essais de chimioattraction, envisagez de surveiller l’essai à des intervalles de 3 à 5 minutes ou d’utiliser une caméra placée au-dessus de la plaque pour enregistrer les trajectoires des vers tout au long de l’essai.
REMARQUE : Ces approches permettent non seulement de noter les temps d’arrivée des vers aux points de conception, mais aussi de comparer les temps d’arrivée moyens et d’analyser la distribution de ces temps.
- Pour une analyse plus complète des essais de chimioattraction, envisagez de surveiller l’essai à des intervalles de 3 à 5 minutes ou d’utiliser une caméra placée au-dessus de la plaque pour enregistrer les trajectoires des vers tout au long de l’essai.
- Analyse de trajectoire et visualisation de données par vidéo
REMARQUE : Pour analyser les schémas de mouvement de C. elegans Lors des essais de chimioattraction, consignez et extrayez les trajectoires (voir le Table des matériaux) et une analyse plus poussée (Graphique 3).- Configurez le système d’enregistrement.
- Lancez un nouvel enregistrement et accédez à la fenêtre des paramètres d’enregistrement .
- Définissez les paramètres d’enregistrement souhaités :
- Préfixe de fichier : choisissez un nom descriptif pour les fichiers vidéo (par exemple, « experiment1_ »).
- Fréquence d’images (FPS) : Sélectionnez les images par seconde appropriées pour capturer le mouvement du ver (par exemple, 7,5 FPS pour les vers sur la plaque de gélose et 30 FPS pour les vers nageurs ).
- Durée : Réglez la durée de l’enregistrement en secondes (par exemple, 1 800 s [30 min] pour le test de chimioattraction en vrac).
- Optimisez la qualité de l’image : ajustez l’intensité de l’éclairage pour vous assurer que les vers sont clairement visibles sur l’arrière-plan et affinez la mise au point pour obtenir une image nette des vers.
- Pour préparer la plaque de test, versez d’abord la solution de contrôle sur le point de contrôle désigné. Ensuite, ramassez soigneusement le(s) ver(s) et relâchez-les doucement au centre de la plaque. Une fois que le ou les vers se sont installés, appliquez la solution de phéromones sexuelles à l’endroit expérimental désigné.
- Positionnez la plaque : Placez soigneusement la plaque contenant les vers au centre du champ d’enregistrement pour maximiser la zone de capture.
- Pour réduire le stress sur les vers pendant les tests de chimiotaxie, envisagez les deux approches suivantes.
- Pour un test à un seul ver, placez le ver sur la plaque de test et laissez-le s’acclimater pendant 5 minutes avant d’introduire la solution de phéromones sexuelles à la distance désignée (la position basée sur l’emplacement actuel du ver).
REMARQUE : Cela minimise la manipulation et donne au ver le temps de s’adapter à son nouvel environnement. - Test de chimioattraction en vrac : Laisser les vers se déposer et se disperser naturellement sur la plaque pendant 5 min. Après cette période d’acclimatation, introduisez la solution de phéromones à la position fixe désignée. Au cours de l’analyse post-vidéo, mesurez la distance de départ de chaque ver par rapport à la phéromone et regroupez-les en conséquence pour une analyse plus approfondie.
- Pour un test à un seul ver, placez le ver sur la plaque de test et laissez-le s’acclimater pendant 5 minutes avant d’introduire la solution de phéromones sexuelles à la distance désignée (la position basée sur l’emplacement actuel du ver).
- Procédure d’analyse vidéo
- Importation et configuration : importez la vidéo enregistrée dans le logiciel. Configurer les informations de séquence (par exemple, la fréquence d’images) ; Spécifiez l’échelle d’imagerie (pixels par unité de mesure).
- Réglage de l’image : pour optimiser la détection des vers, ajustez le seuil de détection jusqu’à ce que l’étiquette verte délimite étroitement les vers sans capturer le bruit de fond ou les artefacts. De plus, appliquez des algorithmes de lissage de l’arrière-plan pour réduire le bruit et les irrégularités de l’image, améliorant ainsi le contraste entre les vers et l’arrière-plan. Expérimentez avec différents niveaux de lissage pour trouver l’équilibre optimal entre la réduction du bruit et la préservation des détails des vers.
REMARQUE : Le seuil idéal doit couvrir la majeure partie du corps de chaque ver tout en excluant les éléments étrangers. - Optimisation des paramètres de détection : sélectionnez un ver représentatif pour générer automatiquement les paramètres de détection. Vérifiez la précision de la détection en inspectant visuellement 5 à 10 trames aléatoires. Si la détection n’est pas satisfaisante, affinez les paramètres de détection manuellement, réexaminez les paramètres de réglage de l’image si nécessaire et procédez au suivi une fois que la détection est fiable.
- Relecture et réparation des trajectoires de suivi : Une fois le processus de suivi automatisé terminé, effectuez une relecture manuelle des trajectoires générées. Si des incohérences sont détectées lors de la relecture, utilisez la fonction de réparation pour corriger la trajectoire et effectuez les opérations suivantes : Joindre : connectez des segments de trajectoire qui ont été attribués à tort à des identifiants différents, mais qui appartiennent à la même personne. Fractionner : séparez les segments de trajectoire qui ont été attribués de manière incorrecte au même identifiant, mais qui appartiennent à des individus différents.
REMARQUE : L’objectif est de s’assurer que chaque identificateur unique (numéro) est attribué de manière cohérente à la même personne tout au long de la période de suivi.
Exemple : Si un ver est étiqueté « 3 » pendant une période, puis incorrectement étiqueté « 7 » pour une période ultérieure, la fonction de réparation joindra ces deux segments sous l’identificateur « 3 ». À l’inverse, si deux vers sont tous deux étiquetés comme « 12 » pendant une période, la fonction de réparation divisera ce segment en deux trajectoires distinctes, chacune avec un identifiant unique. En relisant attentivement et en appliquant les réparations nécessaires, la précision et la fiabilité des données de suivi peuvent être considérablement améliorées. - Visualisation et exportation des résultats : utilisez un logiciel pour la visualisation et l’analyse de base. Exportez les données sous forme de fichiers CSV pour une analyse plus approfondie avec les outils ou le code préférés. Cette méthode fournit un code de base (voir https://github.com/edmondztt/pheromone-traj-analysis.git) pour visualiser la trajectoire du mouvement du ver en fonction de cinq paramètres clés (Figure 3). Temps : La progression de la trajectoire, codée par couleur pour indiquer le passage du temps depuis le début de l’expérience. Distance jusqu’à la phéromone : La distance entre le ver et la source de phéromones à chaque point temporel. Vitesse : La vitesse du ver à chaque point, qui indiquait également les événements de virage et d’arrêt. Rectitude : À quel point la trajectoire du ver est droite. Exactitude de la direction : Dans quelle mesure le mouvement du ver est-il aligné avec la direction de la cible de la phéromone ? Ce code fournit une visualisation de base pour comprendre le comportement des vers et peut être personnalisé et étendu pour une analyse plus approfondie.
REMARQUE : Cette approche avancée offre une alternative complète à l’indice de chimioattraction traditionnel en détaillant la trajectoire de navigation du ver en réponse aux phéromones sexuelles. Il permet de comprendre les modèles de mouvement sans s’appuyer sur des points finaux arbitraires de la navigation et de la détermination de la fenêtre temporelle, offrant ainsi des informations plus approfondies sur la dynamique comportementale du test. La moyenne des données a été calculée sur 20 images, qui peuvent être ajustées en fonction des besoins expérimentaux spécifiques, afin d’éliminer les mouvements causés par la torsion du corps.
Résultats
Analyse de trajectoire de la perception des phéromones sexuelles volatiles : souche défectueuse dans le test de chimioattraction
Ce test de chimioattraction différencie de manière fiable les souches de type sauvage et mutantes de C. elegans dans leur réponse aux phéromones sexuelles volatiles. Les expériences réussies avec les mâles him-5 démontrent systématiquement une chimiotaxie robuste envers la source de phéromones. Cela se traduit par un indice de chimiotaxie (C.I.) élevé (Figure 2), dépassant souvent 0,5, indiquant une forte préférence pour la source de phéromones. À l’inverse, les expériences avec le récepteur des phéromones mutant SRD-1 donnent systématiquement des résultats négatifs. L’IC pour les mâles srd-1 est généralement d’environ zéro24. Cela confirme la capacité du test à détecter l’absence de réponse chimiotactique.
Dans les expériences sous-optimales, de nombreux facteurs peuvent affecter les résultats. Par exemple, une concentration insuffisante de phéromones peut entraîner de faibles réponses chez les mâles him-5 , tandis qu’une contamination ou une manipulation inappropriée peut provoquer des mouvements imprévisibles dans les deux souches. Ces scénarios se traduisent par des valeurs C.I. plus faibles pour les mâles him-5 et des valeurs non nulles potentiellement trompeuses pour les mâles srd-1 . Par conséquent, la mise en œuvre réussie de ce protocole est marquée par une distinction claire dans les indices de chimiotaxie entre les souches de type sauvage et mutantes, étayée par l’analyse de trajectoire confirmant visuellement les différences comportementales (Figure 3). L’analyse des données devrait inclure des comparaisons statistiques des valeurs C.I. pour s’assurer que les différences observées sont significatives.
Démonstration de l’analyse et de la visualisation des données du test de chimioattraction par vidéo
Résultats positifs du test : La figure 3 présente la réponse chimiotactique robuste des mâles him-5 à une phéromone sexuelle volatile. Les trajectoires codées en couleur révèlent (A) le coût en temps, (B) la distance : en augmentant la proximité de la source de phéromones au fil du temps, confirmant l’attraction des vers. (C) vitesse : vitesses variables le long des trajectoires, fournissant des informations sur la dynamique des réponses chimiotactiques. (D) rectitude : la façon dont les vers se déplacent directement vers la source de phéromones. Plus le chemin est droit, plus leur mouvement est efficace et ciblé en réponse à l’attractif chimique. (E) Exactitude de la direction : Cela montre la capacité des vers à s’orienter et à se déplacer avec précision vers la source de la phéromone, l’attractif chimique. Il mesure essentiellement la capacité des vers à détecter le gradient chimique et à naviguer le long de celui-ci pour atteindre leur cible.
Une baisse de vitesse à zéro indique généralement un arrêt ou un virage. La combinaison des informations de vitesse et des données de rectitude peut aider à identifier les événements de virage. Plus précisément, un événement de virage est indiqué lorsque la vitesse tombe à zéro et que la rectitude est également très faible. En revanche, les expériences avec des mutants sensoriels défectueux ou celles menées dans des conditions sous-optimales (par exemple, une faible concentration de phéromones, une densité de vers inappropriée) peuvent donner des résultats différents.
En comparant les trajectoires et en quantifiant des paramètres tels que la directionnalité, la vitesse et la rectitude, les chercheurs peuvent mieux comprendre les mécanismes sous-jacents de la chimiotaxie. Des expériences réussies avec des trajectoires claires et dirigées vers la source de phéromones valident la capacité du test à détecter des stimuli attrayants. À l’inverse, l’absence de tels motifs chez les témoins négatifs ou les souches mutantes confirme la spécificité du test et sa capacité à identifier les défauts sensoriels. Le test de chimioattraction en vrac basé sur la vidéo, comme illustré à la figure 3, fournit un outil puissant pour disséquer les détails du comportement de la chimiotaxie des vers. En analysant les trajectoires individuelles, les chercheurs peuvent découvrir non seulement la présence ou l’absence d’attraction, mais aussi la différence dans la réponse, offrant ainsi une compréhension plus profonde des mécanismes génétiques et neuronaux sous-jacents régissant la chimiotaxie.
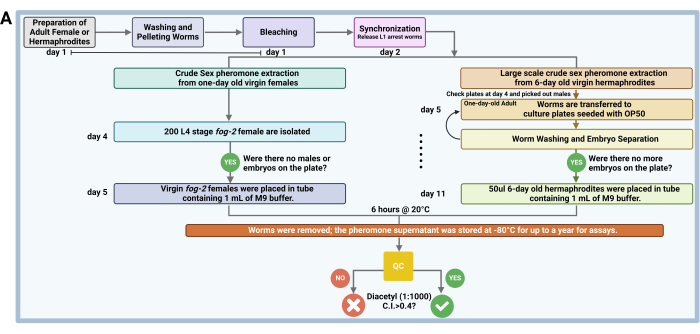
Figure 1 : Déroulement de l’extraction des phéromones sexuelles brutes. La phéromone sexuelle brute est extraite de femelles mutantes vierges fog-2 synchronisées âgées d’un jour de C. elegans et de femelles WT de C. remanei, où les vers sont synchronisés, lavés, isolés et incubés dans un tampon M9 pour la production de phéromones. Le surnageant contenant des phéromones extrait est stocké à -80 °C pendant une période pouvant aller jusqu’à 1 an pour être utilisé dans des essais de chimioattraction, et des tests de contrôle de la qualité ont été effectués sur des mâles N2 ou him-5 pour vérifier l’attractivité. Pour l’extraction à grande échelle de C. elegans hermaphrodites vierges âgés de 6 jours, les vers sont synchronisés et lavés à plusieurs reprises pendant 6 jours, la phéromone sexuelle étant extraite de la même manière, mais modifiée en fonction du volume de granulés de vers et mélangée de manière homogène à des fins expérimentales. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : L’essai de chimioattraction des phéromones sexuelles volatiles et le calcul de l’indice de chimioattraction. (A) Cet essai consiste à préparer des mâles WT N2 ou him-5 à l’aide d’un protocole normalisé de synchronisation de l’eau de Javel, en testant leur réponse à une substance témoin positive avant l’essai de chimioattraction des phéromones sexuelles volatiles. L’expérience comprend le marquage des plaques pour les points de contrôle et d’essai et l’utilisation de sodium de côté pour immobiliser les vers à ces endroits afin d’obtenir un marquage précis. Les résultats sont généralement notés 30 minutes après le début de l’expérience (indiqués par la fermeture du couvercle). (B) Vue latérale de la configuration du test de chimioattraction avec deux distances distinctes. (C) Calcul et interprétation de l’C.I. C.I. est une mesure quantitative de l’attractivité ou de la répulsion d’un stimulus de test. Le C.I. varie de 1, indiquant une forte attraction, à -1, indiquant une forte répulsion. Une faible valeur de C.I. peut résulter de deux scénarios : soit un petit nombre de vers dans les points expérimentaux et de contrôle, soit une répartition égale des vers entre les deux points. (D) Indices de chimioattraction pour les mâles de C. elegans him-5 et srd-1 en réponse aux phéromones sexuelles volatiles des femelles de C. remanei et C. elegans. Les mâles de différents antécédents génétiques réagissent différemment au stimulus de la phéromone sexuelle. Les mâles him-5 présentent une réponse aux deux phéromones, avec un indice nettement plus élevé pour les phéromones des femelles de C. remanei. En revanche, les mâles de la souche srd-1 de la souche mutante du chimiorécepteur ne présentent aucune réponse à l’une ou l’autre des phéromones dans cette analyse. p < 0,01. Abréviations : WT = type sauvage ; C.I. = indice de chimioattraction. Veuillez cliquer ici pour voir une version agrandie de cette figure.
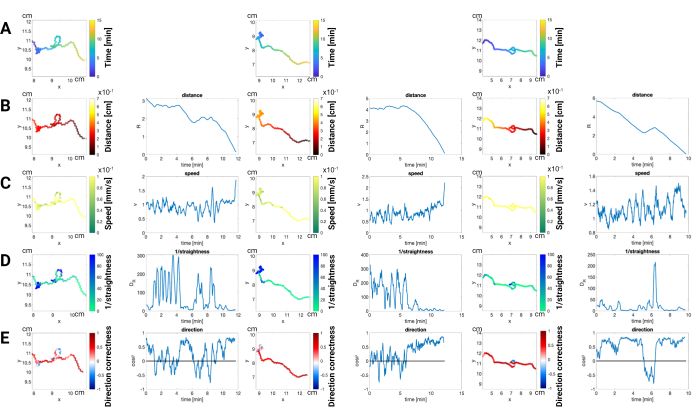
Figure 3 : Analyse de la trajectoire des mâles him-5 en réponse à la phéromone sexuelle volatile. Cette figure illustre les schémas de mouvement des vers mâles him-5 au cours d’un essai de chimioattraction avec un stimulus de phéromone sexuelle volatile. Les trajectoires individuelles sont codées en couleur pour représenter (A) le temps : progression de la trajectoire au cours de l’expérience. La couleur représente le temps écoulé depuis le début du test. (B) Distance à la phéromone : Proximité de la source de phéromones à chaque point temporel. (C) Vitesse : Vitesse de la vis sans fin en chaque point. (D) Rectitude : Caractère direct du chemin emprunté par la vis sans fin. (E) Exactitude de la direction : Alignement du mouvement avec la direction de la source de phéromones. Dans les trois exemples, les vers mâles ont réussi à atteindre l’emplacement de la phéromone. La moyenne des données a été calculée sur 20 images afin de filtrer les mouvements causés par la torsion du corps. Les expériences sont réalisées sur une boîte de Pétri de 10 cm et suivent la méthode de test de chimioattraction en vrac basée sur la vidéo (voir le protocole section 7.3.7.2) mentionnée dans ce protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole fournit une méthodologie robuste pour l’extraction des phéromones sexuelles volatiles de C. elegans, ainsi que l’établissement d’un test de chimioattraction robuste pour mesurer les réponses de chimioattraction masculine. Des informations supplémentaires peuvent être trouvées dans le guide d’utilisation de WormLab (voir la table des matériaux) ; Pour un code de base permettant de visualiser la trajectoire du mouvement du ver, reportez-vous à la section 7.3.8.5 du protocole. Plusieurs étapes cruciales du protocole sont importantes pour le résultat. Tout d’abord, une synchronisation minutieuse des populations de vers est essentielle pour contrôler l’âge et l’état reproducteur, assurant ainsi l’extraction réussie des phéromones sexuelles volatiles des femelles vierges ou des hermaphrodites appauvris en spermatozoïdes29,34. Deuxièmement, des étapes de lavage répétées sont nécessaires pour éliminer complètement les bactéries, minimisant ainsi la contamination qui pourrait interférer avec la signalisation des phéromones dans les tests de chimiotaxie ultérieurs. Ensuite, le choix des paramètres de l’essai, tels que la concentration de l’attractif, la taille de la plaque et la durée de l’essai, peut tous influencer les résultats et doit être adapté aux objectifs expérimentaux spécifiques.
Des temps de séchage précis et un espacement constant des points de test sont essentiels pour des résultats fiables des tests de chimiotaxie. Les plaques humides affectent considérablement l’indice de chimiotaxie. S’il reste une couche d’eau à la surface de la gélose, les forces capillaires peuvent piéger les vers au point de départ. Cela peut entraver leur mouvement, conduisant à des résultats faussement négatifs dans le test. De plus, les temps de séchage prolongés posent un défi différent pour ceux qui sont libérés plus tard. Au fur et à mesure que la plaque sèche, les composants organiques des phéromones s’évaporent et se diffusent, créant un gradient de concentration moins distinct. Il est donc difficile pour les vers relâchés plus tard de localiser la phéromone cible, même s’ils sont libres de se déplacer plus tard. Par conséquent, assurez-vous que les plaques sont suffisamment sèches pour éliminer toute humidité de surface qui pourrait affecter les résultats de l’expérience.
Le volume de solution de gélose ajouté aux plaques doit être ajusté en fonction des exigences spécifiques de l’expérience, afin d’assurer des conditions de dosage optimales. L’épaisseur de la couche de gélose, ajustée en faisant varier la quantité de solution de gélose versée dans le plat. En règle générale, une distance plus courte entre l’attractif et la plaque de gélose permet d’obtenir des résultats plus robustes. À l’inverse, une distance plus longue peut aider à éliminer les effets des composants non volatils, ce qui permet une évaluation plus claire de l’influence de l’attractif volatil. L’épaisseur de la gélose peut être adaptée aux besoins expérimentaux spécifiques, comme le montre la figure 2B.
Le processus de cueillette de 20 vers ne doit pas dépasser 1 à 2 minutes pour éviter que les vers cueillis tôt ne se dessèchent et ne deviennent malsains, ce qui pourrait affecter les résultats. Assurez-vous que les vers sont libérés simultanément sur la plaque de test pour éviter que les vers libérés tôt ne s’éloignent trop du point de départ. Les retards dans cette étape peuvent entraîner des positions de départ variables parmi les échantillons, ce qui entraîne des comparaisons injustes. L’ensemble du processus, de la cueillette des mâles à la fermeture du couvercle, devrait prendre entre 2 et 5 minutes.
Adaptez l’espacement entre les points d’expérience/de contrôle et le point de départ sur la plaque d’essai en fonction de la taille de la plaque et des objectifs spécifiques de l’expérience. L’augmentation de la distance entre les points peut rendre le test plus difficile, ce qui est bénéfique pour détecter des effets subtils. À l’inverse, la réduction de la distance crée un test d’essai plus robuste qui met en évidence les défauts graves.
Un dépannage peut être nécessaire à différents points du protocole. Si la phéromone extraite n’induit pas de réponse chimiotaxique, vérifiez soigneusement l’âge et l’état reproducteur des femelles et des hermaphrodites sources. Seules les femelles vierges ou les hermaphrodites appauvris en sperme produiront la phéromone cible. En raison de l’efficacité sexuelle élevée des mâles C . elegans , la présence d’un seul mâle sur la plaque d’isolement femelle L4 peut affecter considérablement les résultats. De plus, assurez le contrôle de la contamination bactérienne tout au long du processus d’extraction. Bien que ce protocole d’extraction offre un moyen simple d’obtenir des phéromones sexuelles volatiles brutes, il présente certaines limites. L’extrait de phéromone brute peut contenir des traces d’autres molécules de signalisation, ce qui rend difficile l’isolement définitif des effets spécifiques de la phéromone sexuelle elle-même. Les composants fonctionnels de la phéromone sexuelle volatile n’ont pas encore été identifiés. Bien qu’aucune différence fonctionnelle n’ait été signalée entre les phéromones sexuelles des femelles vierges d’un jour et des hermaphrodites de six jours, la possibilité d’une différence subtile ne peut être exclue.
Dans le test de chimioattraction, un faible indice de chimiotaxie pourrait indiquer un problème de santé ou de développement chez les mâles testés. Pour garantir des résultats optimaux, utilisez des mâles adultes sains d’un jour élevés à 20 °C sur une plaque OP50 propre et sans contamination. Des changements brusques de température allant de températures d’entreposage plus basses (comme 15 °C) à 20 °C peuvent avoir un effet négatif sur le comportement de chimioattraction jusqu’à trois générations. Pour une meilleure pratique, laissez les souches récemment décongelées ou maintenues à des températures plus basses s’adapter à 20 °C pendant plus de trois générations avant de les utiliser. Bien qu’il soit recommandé d’isoler les mâles d’essai au stade L4 la veille du jour du test, ce n’est pas strictement nécessaire. La préexposition aux hermaphrodites adultes n’a pas d’impact significatif sur les résultats des tests de chimioattraction. Les hermaphrodites d’un jour ne produisent pas de phéromones sexuelles volatiles en raison de l’existence de l’auto-sperme. Par conséquent, l’isolement masculin L4 peut être évité lors d’un dépistage à grande échelle. Cependant, pour les études portant spécifiquement sur les effets d’une expérience d’accouplement antérieure ou d’autres études connexes, il est nécessaire d’isoler les mâles au stade L4 1 jour avant le jour du test.
La mutation him-5 chez C. elegans provoque une forte incidence de mâles en raison d’un taux accru de non-disjonction du chromosome X pendant la méiose chez le parent des mâles. Ainsi, le système chimiosensoriel des mâles requis pour la chimiotaxie est toujours intact. Il est ainsi plus facile d’obtenir un grand nombre de mâles pour le dosage. Par conséquent, les mâles him-5 présentent une chimiotaxie robuste comparable à celle des mâles WT N2, ce qui en fait un contrôle approprié dans les dosages de chimiotaxie aux phéromones sexuelles.
Considérations supplémentaires :
Remplacement de l’azoture de sodium : L’azoture de sodium utilisé pour paralyser les vers pendant l’enregistrement vidéo peut être évité. Au lieu de cela, utilisez une goutte de solution M9 pour immobiliser temporairement les vers, bien que la tension superficielle soit suffisante pour un test vidéo.
Densité des vers : Limitez le nombre de vers par plaque pour éviter l’encombrement et maintenir des conditions optimales. La surpopulation affectera l’analyse post-vidéo, car le programme aura de la difficulté à identifier les vers s’ils se chevauchent. Un maximum de 20 vers est recommandé pour une boîte de Pétri de 6 cm, et 100 vers pour une boîte de Pétri de 10 cm.
Les tests de chimioattraction traditionnels offrent une approche simple, nécessitant un effort minimal pour l’acquisition de données. Bien que ces tests fournissent un aperçu rapide de la réponse à la chimiotaxie, ils ne capturent que le point final d’une réponse comportementale complexe. Cela limite leur capacité à révéler les détails de la perception des phéromones et de la réponse locomotrice. En revanche, l’analyse avancée de la trajectoire donne un aperçu des mouvements individuels et collectifs. Cette approche met en évidence les différences qui ne sont pas prises par les seules mesures fondées sur les paramètres. En permettant d’explorer en détail les modèles cinétiques détaillés et la variabilité de la réponse au sein des populations testées, cette méthode améliore considérablement notre compréhension des mécanismes chimiosensoriels. Cela met en évidence l’applicabilité de l’essai à diverses questions de recherche et souligne l’importance de tenir compte de la variabilité individuelle dans la conception expérimentale.
Cette méthodologie offre un cadre pour l’étude des phéromones sexuelles volatiles chez C. elegans. Il peut faciliter la découverte de gènes liés à la synthèse, à la sécrétion et à la perception des phéromones sexuelles volatiles, approfondissant ainsi notre compréhension de la communication chimique au niveau des circuits moléculaires et neuronaux. De plus, le test de chimioattraction et l’analyse des données de trajectoire peuvent être utilisés pour étudier d’autres chimioattractants chez C. elegans.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous sommes reconnaissants au Dr Tingtao Zhou d’avoir conçu et écrit le code pour les visualisations de trajectoire utilisées dans notre analyse. Ce travail a été soutenu par le financement de R01 NS113119 (PWS), de la bourse postdoctorale senior Chen et de l’Institut Tianqiao et Chrissy Chen pour les neurosciences.
matériels
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dishes | Falcon | 25373-100 | Falcon bacteriological Petri dish 100 x 15 mm |
| 6 cm Petri dishes | Falcon | 25373-085 | Falcon bacteriological Petri dish 60 x 15 mm |
| C. remanei (EM464) | CGC | ||
| Centrifuge | Eppendorf | centrifuge 5418 | Any brand should work. |
| Chemoattraction assay plates | Homemade solution | N/A | 1.5% agar, 25 mM NaCl, 1.5 mM Tris-base, and 3.5 mM Tris-Cl |
| Cholesterol | Alfa Aesar | 57-88-5 | |
| Dissecting Microscope | Leica | LeicaMZ75 | Any brand should work. |
| E. Coli OP50 | CGC | ||
| Ethanol | Koptec | 64-17-5 | |
| fog-2(q71) (JK574) | CGC | ||
| him-5(e1490)(CB4088) | CGC | ||
| Household bleach | Clorox Germicidal bleach concentrated | Bleach | |
| M9 buffer | Homemade solution | N/A | 3 g KH2PO4, 11.3 g Na2HPO4.7H2O, 5 g NaCl, H2O to 1 L. Sterilize by autoclaving. Add 1 mL 1 M MgSO4 after cool down to room temperature. |
| Magnesium Sulfate, Anhydrous, Powder | Macron | M1063-500GM-EA | |
| Microwave | TOSHIBA | N/A | Any brand should work. |
| N2 | CGC | ||
| NaOH | Sigma-aldrich | S318-3 | 1 M |
| NGM plates solution | Homemade solution | N/A | 2.5 g Peptone, 18 g agar, 3 g NaCl, H2O to 1 L.Sterilize by autoclaving. Once the autoclave is done (2 h), wait until the temperature of the medium drops to 65 °C. Put on a hotplate at 65 °C and stir. Then add the following, waiting 5 min between each to avoid crystallization: 1 mL CaCl2 (1 M), 1 mL MgSO4 (1 M), 25 mL K3PO4 (1 M, pH=6), 1 mL Cholesterol ( 5 mg/mL in ethanol). |
| Parafilm | Bemis | 13-374-10 | Bemis Parafilm M Laboratory Wrapping Film |
| Peptone | VWR | 97063-324 | |
| Pipet- aid | Drummond Scientific | 4-000-100 | Any brand should work. |
| Plastic paper | Octago | Waterproof Screen Printing Inkjet Transparency Film | https://www.amazon.com/Octago-Waterproof-Transparency-Printing-Printers/dp/B08HJQWFGD |
| Potassium chloride | Sigma-aldrich | SLBP2366V | |
| Potassium phosphate | Spectrum | 7778-77-0 | |
| Pipette | Eppendorf | SKU: EPPR4331; MFG#: 2231300006 | 20 - 200 µL, 100 - 1000 µL, any brand should work. |
| Rotator | Labnet | SKU: LI-H5500 | Labnet H5500 Mini LabRoller with Dual Direction Rotator. Any brand should work. |
| Sodium chloride | VWR | 7647-14-5 | |
| sodium phosphate dibasic | Sigma-aldrich | SLCG3888 | |
| Tris-base | Sigma-aldrich | 77-86-1 | |
| Tris-Cl | Roche | 1185-53-1 | |
| Tryptone | VWR | 97063-390 | |
| Vortex | Scientific industries | Vortex-Genie 2 | Any brand should work. |
| WormLab system | MBF Bioscience | N/A | https://www.mbfbioscience.com/help/WormLab/Content/home.htm; https://www.mbfbioscience.com/products/wormlab/ |
| Wormpicker | Homemade | N/A | made with platinum and glass pipet tips |
Références
- Audesirk, T. E. Chemoreception in Alphysia californica. Iii. Evidence for pheromones influencing reproductive behavior. Behav Biol. 20 (2), 235-243 (1977).
- Traynor, K. S., Le Conte, Y., Page, R. E. Queen and young larval pheromones impact nursing and reproductive physiology of honey bee (Apis mellifera) workers. Behav Ecol Sociobiol. 68 (12), 2059-2073 (2014).
- Cowley, J. J., Wise, D. R. Pheromones, growth and behaviour. Ciba Found Study Group. 35, 144-170 (1970).
- Epple, G. Pheromones in primate reproduction and social behavior. Adv Behav Biol. 11, 131-155 (1974).
- Levinson, H. Z. Possibilities of using insectistatics and pheromones in pest control. Naturwissenschaften. 62 (6), 272-282 (1975).
- Roelofs, W. Manipulating sex pheromones for insect suppression. Environ Lett. 8 (1), 41-59 (1975).
- Marchlewska-Koj, A. Pheromones and mammalian reproduction. Oxf Rev Reprod Biol. 6, 266-302 (1984).
- Keverne, E. B. Neuroendocrinology briefings 11: Pheromones and reproduction. J Neuroendocrinol. 12 (11), 1045-1046 (2000).
- Rekwot, P. I., Ogwu, D., Oyedipe, E. O., Sekoni, V. O. The role of pheromones and biostimulation in animal reproduction. Anim Reprod Sci. 65 (3-4), 157-170 (2001).
- Gomez-Diaz, C., Benton, R. The joy of sex pheromones. EMBO reports. 14 (10), 874-883 (2013).
- Shorey, H. H., Gaston, L. K., Jefferson, R. N. Insect sex pheromones. Adv Pest Control Res. 8, 57-126 (1968).
- Bruce, H. M. Pheromones and behavior in mice. Acta Neurol Psychiatr Belg. 69 (7), 529-538 (1969).
- Shorey, H. H., Bartell, R. J. Role of a volatile female sex pheromone in stimulating male courtship behaviour in Drosophila melanogaster. Anim Behav. 18 (1), 159-164 (1970).
- Bobadoye, B., et al. Evidence of aggregation-sex pheromone use by longhorned beetles (coleoptera: Cerambycidae) species native to Africa. Environ Entomol. 48 (1), 189-192 (2019).
- Saunders, J. R. Sex pheromones in bacteria. Nature. 275 (5682), 692-694 (1978).
- Schulz, S., Toft, S. Identification of a sex pheromone from a spider. Science. 260 (5114), 1635-1637 (1993).
- Finnegan, D. E., Chambers, J. Identification of the sex pheromone of the guernsey carpet beetle, Anthrenussarnicus mroczkowski (coleoptera: Dermestidae). J Chem Ecol. 19 (5), 971-983 (1993).
- Vaillancourt, L. J., Raudaskoski, M., Specht, C. A., Raper, C. A. Multiple genes encoding pheromones and a pheromone receptor define the b beta 1 mating-type specificity in Schizophyllum commune. Genetics. 146 (2), 541-551 (1997).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook : the online review of C. elegans biology. , 1-22 (2013).
- Sakai, N., et al. A sexually conditioned switch of chemosensory behavior in C. elegans. PLoS One. 8 (7), e68676 (2013).
- Sengupta, S., Smith, D. P., Mucignat-Caretta, C. How Drosophila detect volatile pheromones: signaling, circuits, and behavior. Neurobiology of chemical communication. , (2014).
- Zhang, Y. K., Reilly, D. K., Yu, J., Srinivasan, J., Schroeder, F. C. Photoaffinity probes for nematode pheromone receptor identification. Org Biomol Chem. 18 (1), 36-40 (2019).
- Aprison, E. Z., Ruvinsky, I. Dynamic regulation of adult-specific functions of the nervous system by signaling from the reproductive system. Curr Biol. 29 (23), 4116-4123.e3 (2019).
- Wan, X., et al. SRD-1 in AWA neurons is the receptor for female volatile sex pheromones in C. elegans males. EMBO Rep. 20 (3), e46288 (2019).
- Peckol, E. L., Troemel, E. R., Bargmann, C. I. Sensory experience and sensory activity regulate chemosensory receptor gene expression in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 98 (20), 11032-11038 (2001).
- Jang, H., et al. Neuromodulatory state and sex specify alternative behaviors through antagonistic synaptic pathways in. C. elegans. Neuron. 75 (4), 585-592 (2012).
- Liu, K. S., Sternberg, P. W. Sensory regulation of male mating behavior in Caenorhabditis elegans. Neuron. 14 (1), 79-89 (1995).
- Chasnov, J. R., Chow, K. L. Why are there males in the hermaphroditic species Caenorhabditis elegans. Genetics. 160 (3), 983-994 (2002).
- Chasnov, J. R., So, W. K., Chan, C. M., Chow, K. L. The species, sex, and stage specificity of a Caenorhabditis sex pheromone. Proc Natl Acad Sci U S A. 104 (16), 6730-6735 (2007).
- Susoy, V., et al. Natural sensory context drives diverse brain-wide activity during C. elegans mating. Cell. 184 (20), 5122-5137.e17 (2021).
- Barriere, A., Felix, M. A. High local genetic diversity and low outcrossing rate in Caenorhabditis elegans natural populations. Curr Biol. 15 (13), 1176-1184 (2005).
- Click, A., Savaliya, C. H., Kienle, S., Herrmann, M., Pires-Dasilva, A. Natural variation of outcrossing in the hermaphroditic nematode Pristionchus pacificus. BMC Evol Biol. 9, 75 (2009).
- Anderson, J. L., Morran, L. T., Phillips, P. C. Outcrossing and the maintenance of males within C. elegans populations. J Hered. 101 (suppl_1), S62-S74 (2010).
- Leighton, D. H., Choe, A., Wu, S. Y., Sternberg, P. W. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 111 (50), 17905-17910 (2014).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Fagan, K. A., et al. A single-neuron chemosensory switch determines the valence of a sexually dimorphic sensory behavior. Curr Biol. 28 (6), 902-914.e5 (2018).
- Lipton, J., Kleemann, G., Ghosh, R., Lints, R., Emmons, S. W. Mate searching in Caenorhabditis elegans: A genetic model for sex drive in a simple invertebrate. J Neurosci. 24 (34), 7427-7434 (2004).
- Frady, E. P., Palmer, C. R., Kristan, W. B. Sexual attraction: Sex-specific wiring of neural circuitry. Curr Biol. 22 (22), R953-R956 (2012).
- Liu, Q., et al. Two preputial gland-secreted pheromones evoke sexually dimorphic neural pathways in the mouse vomeronasal system. Front Cell Neurosci. 13, 455 (2019).
- Ludewig, A. H., et al. Pheromone sensing regulates Caenorhabditis elegans lifespan and stress resistance via the deacetylase sir-2.1. Proc Natl Acad Sci U S A. 110 (14), 5522-5527 (2013).
- Golden, J. W., Riddle, D. L. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Butcher, R. A., Fujita, M., Schroeder, F. C., Clardy, J. Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat Chem Biol. 3 (7), 420-422 (2007).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Butcher, R. A., Ragains, J. R., Kim, E., Clardy, J. A potent dauer pheromone component in Caenorhabditis elegans that acts synergistically with other components. Proc Natl Acad Sci U S A. 105 (38), 14288-14292 (2008).
- Aprison, E. Z., Ruvinsky, I. Counteracting ascarosides act through distinct neurons to determine the sexual identity of C. elegans pheromones. Curr Biol. 27 (17), 2589-2599.e3 (2017).
- Aprison, E. Z., Ruvinsky, I. Sex pheromones of C. elegans males prime the female reproductive system and ameliorate the effects of heat stress. PLoS Genet. 11 (12), e1005729 (2015).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Kaplan, F., et al. Ascaroside expression in Caenorhabditis elegans is strongly dependent on diet and developmental stage. PLoS One. 6 (3), e17804 (2011).
- Pungaliya, C., et al. A shortcut to identifying small molecule signals that regulate behavior and development in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 106 (19), 7708-7713 (2009).
- Srinivasan, J., et al. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biol. 10 (1), e1001237 (2012).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Von Reuss, S. H., et al. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. J Am Chem Soc. 134 (3), 1817-1824 (2012).
- Choe, A., et al. Sex-specific mating pheromones in the nematode panagrellus redivivus. Proc Natl Acad Sci U S A. 109 (51), 20949-20954 (2012).
- Hsueh, Y. P., Mahanti, P., Schroeder, F. C., Sternberg, P. W. Nematode-trapping fungi eavesdrop on nematode pheromones. Curr Biol. 23 (1), 83-86 (2013).
- Hong, M., et al. Early pheromone experience modifies a synaptic activity to influence adult pheromone responses of C. elegans. Curr Biol. 27 (20), 3168-3177.e3 (2017).
- Ryu, L., et al. Feeding state regulates pheromone-mediated avoidance behavior via the insulin signaling pathway in Caenorhabditis elegans. EMBO J. 37 (15), e98402 (2018).
- Diaz, S. A., Lindström, J., Haydon, D. T. Basic demography of Caenorhabditis remanei cultured under standard laboratory conditions. J Nematol. 40 (3), 167 (2008).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook : the online review of C.elegans biology. , 1-29 (2006).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. JoVE: J Vis Exp. (74), e50069 (2013).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon