Method Article
Perfusão de Langendorff modificada para tempos de perfusão prolongados de enxertos cardíacos de roedores
Neste Artigo
Resumo
Este artigo demonstra a viabilidade de alcançar tempos de perfusão mais longos (4 h) de enxertos cardíacos murinos sem perda de função, empregando pressões de perfusão mais baixas (30-35 mmHg) do que fisiológicas (60-80 mmHg) durante Langendorff.
Resumo
Apesar dos importantes avanços no diagnóstico e tratamento de doenças cardiovasculares (DCV), o campo precisa urgentemente de mais pesquisas e avanços científicos. Como resultado, a inovação, melhoria e/ou reaproveitamento do conjunto de ferramentas de pesquisa disponíveis pode fornecer bancos de testes aprimorados para o avanço da pesquisa. A perfusão de Langendorff é uma técnica de pesquisa extremamente valiosa para o campo da pesquisa de DCV que pode ser modificada para acomodar uma ampla gama de necessidades experimentais. Essa adaptação pode ser obtida personalizando um grande número de parâmetros de perfusão, incluindo pressão de perfusão, fluxo, perfusato, temperatura, etc. Este protocolo demonstra a versatilidade da perfusão de Langendorff e a viabilidade de alcançar tempos de perfusão mais longos (4 h) sem perda da função do enxerto, utilizando pressões de perfusão mais baixas (30-35 mmHg). Alcançar tempos de perfusão prolongados sem danos ao enxerto e/ou perda de função causada pela própria técnica tem o potencial de eliminar elementos de confusão dos resultados experimentais. Com efeito, em circunstâncias científicas em que tempos de perfusão mais longos são relevantes para as necessidades experimentais (ou seja, tratamentos medicamentosos, análise de resposta imunológica, edição de genes, preservação do enxerto, etc.), pressões de perfusão mais baixas podem ser fundamentais para o sucesso científico.
Introdução
O campo da pesquisa cardiovascular tem visto avanços importantes no diagnóstico e tratamento de doenças cardiovasculares (DCVs). No entanto, apesar da diminuição geral das taxas de incidência e mortalidade, as DCV continuam sendo a principal causa de morte em todo o mundo 1,2. Este facto alarmante evidencia a necessidade de uma maior investigação e de um avanço científico, que depende, sem dúvida, do rigor e da previsibilidade dos instrumentos de investigação disponíveis. Como resultado, há uma necessidade constante de inovação, melhoria e/ou reaproveitamento do conjunto de ferramentas de pesquisa. Por exemplo, a perfusão cardíaca retrógrada ou de Langendorff, uma técnica disponível no campo há mais de um século, pode ser facilmente modificada para cobrir um escopo maior de necessidades científicas e alcançar uma gama mais ampla de aplicações.
O isolamento do enxerto cardíaco do resto do organismo durante a perfusão de Langendorff fornece um importante grau de controle sobre uma ampla gama de parâmetros experimentais, incluindo temperatura, solução circulante, pressões de perfusão coronariana, etc.3,4,5,6,7. A manipulação desses parâmetros facilita a simulação de um grande número de cenários cardíacos que podem ser aproveitados para novos avanços científicos 5,8,9,10. Dentre esses parâmetros, a pressão de perfusão é provavelmente o cenário experimental mais negligenciado11.
Durante o Langendorff, as pressões de perfusão apresentam correlação direta com a frequência cardíaca, as pressões sistólica/diastólica de pico e o consumo de oxigênio11. Essa correlação fornece controle direto e preciso sobre a quantidade de trabalho produzido pelos enxertos cardíacos, que pode ser ajustado para atender às necessidades experimentais individuais. Apesar dessa valiosa capacidade de controle, o campo tem historicamente gravitado em direção ao uso de pressões de perfusão mais altas (60-80 mmHg), submetendo todos os enxertos cardíacos a alta demanda de trabalho, independentemente das necessidades experimentais 8,12,13,14,15. As consequências dessa demanda desnecessariamente alta de trabalho surgem do princípio geral de que o excesso de trabalho tende a resultar em fracasso prematuro. Isso parece ser particularmente verdadeiro para enxertos cardíacos perfundidos via Langendorff, pois a natureza não fisiológica desse método e a falta de suporte de recuperação presente in vivo parecem exacerbar a falha do enxerto. Essa perda prematura da função do enxerto limita significativamente a perfusão e os tempos experimentais. Com efeito, em circunstâncias em que tempos de perfusão mais longos são mais relevantes para as necessidades experimentais (ou seja, tratamentos medicamentosos, análise de resposta imunológica, edição de genes, preservação do enxerto, etc.), menor trabalho cardíaco pode ser proporcionado em troca de maior durabilidade do enxerto.
Este protocolo demonstra a viabilidade de utilizar pressões de perfusão mais baixas (30-35 mmHg) durante o Langendorff, bem como o efeito significativo que elas representam para a função do enxerto cardíaco ao longo do tempo quando comparadas a pressões de perfusão mais altas (60-80 mmHg). Além disso, os achados deste manuscrito destacam a importância de priorizar a personalização da ampla gama de parâmetros de perfusão para melhor atender às necessidades experimentais.
Protocolo
Este estudo é conduzido seguindo o Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Hospital Geral de Massachusetts.
1. Projeto do sistema
- Monte o sistema com os três componentes de camisa dupla, incluindo um coletor de bolhas, um reservatório, um oxigenador, uma bomba peristáltica e um circulador de água.
- Conecte todos os componentes revestidos a um clamp suporte. Conecte os componentes em sequência com tubos de silicone em duas sequências diferentes (Figura 1A).
- Sequência 1 - Padrão de fluxo de água através da camisa (linhas sólidas na Figura 1A):
- Conecte a saída do circulador de água à entrada inferior da camisa do coletor de bolhas usando um tubo de 36 G. Isso garantirá que o perfusato seja mantido na temperatura adequada (37 °C) antes de chegar ao coração, pois a água perderá calor à medida que percorre os outros componentes do sistema.
- Conecte a entrada superior da jaqueta do coletor de bolhas à entrada inferior da capa do reservatório usando a tubulação do mesmo tamanho.
- Em seguida, conecte a entrada superior da camisa do reservatório à entrada inferior da camisa do oxigenador.
- Por fim, conecte a entrada superior do oxigenador à entrada do circulador de água.
- Sequência 2 - Padrão de fluxo do perfusato através do sistema (linhas tracejadas na Figura 1A)
- Conecte os conectores luer em ambos os lados da tubulação de 16 G. Conecte a primeira extremidade à base do reservatório e alimente-a através do cabeçote da bomba peristáltica. Conecte a outra extremidade a uma das entradas da bobina de silicone dentro do oxigenador.
- Conecte um segundo pedaço de tubo de 16 G, equipado com conectores luer lock em ambas as extremidades, na segunda entrada da bobina de silicone do oxigenador à entrada no coletor de bolhas com a saliência longa.
- Conecte um pedaço mais curto de tubulação de 16 G, equipado com conectores luer, à saída não utilizada do coletor de bolhas a uma válvula luer lock de três vias.
- No lado oposto da válvula de três vias, conecte um pedaço de tubo de 16 G com uma segunda válvula luer na outra extremidade. Esta segunda válvula fica imediatamente acima do reservatório. Conecte o lado oposto da válvula a mais tubos de 16 G, seguido pelo sensor de pressão.
- Conecte um tubo de menor diâmetro ( ̃3,7 mm) à porta vertical da válvula de três vias com um conector à cânula (angiocath 14 G). O perfusato flui do reservatório para o oxigenador através do coletor de bolhas antes de recircular de volta para o reservatório através da conexão da cânula aórtica.
- Sequência 1 - Padrão de fluxo de água através da camisa (linhas sólidas na Figura 1A):
2. Preparação de perfusato
- Prepare perfusato de base, tampão Krebs-Henseleit a 0,96%, dextrano a 9,915 mM, bicarbonato de sódio a 25 mM, albumina de soro bovino a 1,054 mM, estreptococos a 1%, insulina a 0,13%, hidrocortisona a 0,02%, heparina a 0,5% e cloreto de cálcio a 2,75 mM e reproduza volume com água destilada.
3. Configuração do sistema de perfusão
- Conecte duas seringas de 10 mL às portas de ventilação superior e lateral do coletor de bolhas.
- Adicione o perfusato de base (75 mL) ao reservatório. Ligue a bomba peristáltica e ajuste o circulador de água para 37 °C.
- Conecte uma linha de oxigênio (95% O2 e 5% CO2) à terceira entrada do oxigenador e oxigene o perfusato a um pO2 mínimo de 400 mmHg.
- Prenda uma porta de injeção à porta vertical da válvula de três vias imediatamente após o coletor de bolhas. Ligue uma agulha de perfusão alada com uma seringa de 1 ml à porta de injeção (utilizada para amostragem). Bata suavemente na porta de injeção ou aspire perfusato com a seringa de 1 mL para limpar quaisquer bolhas introduzidas no circuito.
- Uma vez que o perfusato de base esteja até a temperatura e o nível de oxigênio, faça uma leitura inicial dos parâmetros bioquímicos para garantir a concentração correta de íons (Tabela 1) e a oxigenação adequada.
NOTA: Os níveis de íons e pH devem ser lidos após a solução ter atingido a temperatura (37 ° C) e oxigenado com a mistura de gases adequada (95% O2, 5% CO2). - Zere o sensor de pressão desapertando o tubo conectado e permita que o fluxo de perfusato através do sensor aberto e da cânula se equilibre. Uma vez equilibrado, pressione o botão zero na caixa do sensor e prenda novamente a tubulação. Registre as pressões basais antes da conexão do coração ao sistema para fluxos que variam de 1 mL / min a 15 mL / min.
- Perfusão de baixa pressão
- Gotejamento de adenosina: Faça um estoque inicial de 20 mM de adenosina no perfusato de base. Dissolva a adenosina colocando o tubo em banho-maria morno e misturando por inversão.
- Diluir a adenosina estoque até uma concertação de 0,06 mg / mL em perfusato de base e adicioná-la a uma seringa de 50 mL.
- Conecte uma agulha de infusão alada à seringa de 50 mL e conecte-a à porta de injeção na válvula de três vias. Fixe a seringa a uma bomba de seringa e ajuste-a para uma velocidade de perfusão de 166,6 μL/min.
NOTA: As bolhas são liberadas da porta de infusão tocando levemente ou sacudindo a porta.
- Perfusão de alta pressão:
- Isolamento de concentrado de glóbulos vermelhos (pRBCs):
- Colete 10-12 mL de sangue total de rato por punção cardíaca de um rato doador.
- Centrifugue o sangue a 2000 x g por 10 min.
- Remova a camada de plasma e buffy coat por meio de pipetagem.
- Ressuspenda os glóbulos vermelhos em perfusato sem cloreto de cálcio na proporção de 1:1 (por exemplo, 5 mL de eritrócitos: 5 mL de perfusato) por mistura de inversão.
- Repita as etapas 3.8.1.2-3.8.1.4 duas vezes para um total de 3 lavagens.
- Após a última lavagem, ressuspender as células em perfusato na proporção de 1:1 e adicionar a mistura ao sistema de perfusão, já contendo os 75 mL de perfusato de base.
- Permita que as células se distribuam uniformemente pelo sistema e meça o hematócrito do perfusato usando uma máquina de hematologia. O hematócrito varia de 5% a 7%.
- Isolamento de concentrado de glóbulos vermelhos (pRBCs):
4. Preparação para aquisição de enxerto cardíaco
- Prepare completamente o sistema de perfusão antes do início da captação para minimizar o tempo de isquemia fria.
- Prepare as ferramentas cirúrgicas. As ferramentas cirúrgicas incluem almofadas azuis, fita cirúrgica, suturas de seda 5-0, cotonetes, seringas salinas (50 mL e 10 mL), tesouras cirúrgicas, pinças, microtesouras, micropinças, pinça Halstead, 30 U de heparina, tubo 16 G para lavagem portal, tubo 14 G para canulação do coração, 16 G angiocath, 14 G angiocath modificado com manguito, sensor de pressão, balde de gelo com gelo, placa de Petri de 47 mm, gaze.
- Crie uma cânula modificada inserindo um anel fino de tubo (diâmetro interno [ID] 0,167 mm, diâmetro externo [OD] 2,42 mm) na cânula de 14 G, criando um efeito de braçadeira.
- Remova a agulha da cânula e adicione uma gota de super cola abaixo do anel. Deslize cuidadosamente o anel para 1/4 de polegada acima da base da cânula. Deixe a cola secar antes de usar.
- Corte a cânula o mais próximo possível do manguito em ângulo e remova as bordas afiadas.
- Encha uma seringa de 60 mL com solução salina heparinizada (0,03 U/mL) para lavagem da veia porta. Conecte a seringa ao sensor de pressão, seguido pelo tubo de lavagem de 16 G.
- Conecte uma seringa de 10 mL de solução salina heparinizada (0,03 U/mL) ao tubo de 14 G. Conecte a outra extremidade do tubo à cânula aórtica e lave para remover quaisquer bolhas de ar.
- Colocar a cânula aórtica numa placa de Petri de 47 mm com gaze e cheia de soro fisiológico. Deixe a placa de Petri no gelo até que o coração esteja conectado ao sistema de perfusão.
5. Aquisição de enxerto cardíaco
- Anestesiar os ratos em câmara anestésica com isoflurano a 3%.
- Uma vez que os reflexos não são notados, remova o rato da câmara, coloque-o no espaço cirúrgico e administre isoflurano contínuo (3%) via máscara facial.
- Após o teste de pinça do dedo do pé, heparinizar o animal através da veia peniana com 30 U de heparina.
- Raspe o rato em todo o abdômen e na parte superior do tórax. Remova as aparas de pele do campo cirúrgico. Prenda cada membro para garantir que não haja movimento durante a cirurgia.
- Faça uma incisão horizontal na linha média na pele do abdômen inferior, expondo os músculos abdominais.
- Faça uma segunda incisão horizontal na linha média nos músculos abdominais, expondo os órgãos internos.
- Revele o esterno, prenda-o com um hemostático e retraia-o cranialmente para expor o fígado e a veia porta. Canular a veia porta usando um angiocateter de calibre 16.
- Conecte a seringa de 60 mL de solução salina heparinizada ao angiocath e faça uma incisão na veia cava inferior e na aorta abdominal para ventilação. Lave toda a quantidade de solução salina através da veia porta.
NOTA: A pressão de lavagem deve permanecer em torno de 10 mmHg. - Faça um corte horizontal no diafragma, seguido por um corte proximal nas costelas em ambos os lados do esterno para revelar a cavidade torácica.
- Retire o coração da cavidade e coloque-o imediatamente na placa de Petri com solução salina no gelo.
- Identifique o arco aórtico, clampeie com hemostáticos e exponha a aorta descendente limpando qualquer tecido conjuntivo remanescente.
- Faça um corte horizontal a meio caminho da aorta descendente e canule com o angiocátex 14 G.
NOTA: Não rompa a válvula aórtica com a cânula. - Prenda a cânula por meio de uma sutura acima do manguito e solte o hemostático.
- Deixe o coração permanecer no gelo até ser colocado no sistema de perfusão.
6. Iniciação da perfusão
- Defina o fluxo da bomba peristáltica para 1.0 mL/min.
NOTA: A cânula aórtica é sempre manuseada em um ângulo de 90° em relação ao coração para evitar a introdução de bolhas nas coronárias (Figura 1B). - Pese o coração com a cânula antes de conectar o coração ao sistema.
NOTA: A cânula aórtica deve estar completamente livre de bolhas de ar. - Conecte a cânula ao conector no sistema e inicie um temporizador.
- Quando o coração tiver uma contração completa, aumente o fluxo em incrementos de 0,2 mL / min enquanto observa de perto as pressões.
- Pare os aumentos de fluxo quando as pressões desejadas forem atingidas ou até que um mínimo de 3,5 mL / min seja atingido.
- Perfusão de baixa pressão
- Para pressões entre 30-35 mmHg, use um fluxo de 4.5 mL/min.
- Ligue a bomba de seringa de adenosina.
- Perfusão de alta pressão
- Para pressões entre 70-80 mmHg, use um fluxo mínimo de 5.0 mL/min.
- Ligue a bomba de seringa de adenosina.
- Perfusão de baixa pressão
7. Balão intraventricular:
- Anexe um pequeno balão de látex (50 μL) a um cateter de balão (2 mm de diâmetro, 15 cm de comprimento) com uma ponta cônica (1,4 mm de diâmetro).
- Conecte o cateter a um sensor de pressão por meio de um conector luer lock e prenda toda a configuração a um suporte de grampo.
- Encha o balão/cateter/sensor de pressão com aproximadamente 200 μL de solução salina por meio de uma seringa presa à extremidade superior do sensor de pressão e remova as bolhas de dentro do sensor, cateter e balão.
- Calibre o sensor de pressão usando um esfigmômetro.
- Faça uma pequena incisão horizontal acima do átrio esquerdo. Esvazie o balão puxando a seringa na parte superior do sensor de pressão e inserindo-a no ventrículo esquerdo.
- Inicie a aquisição de dados e encha o balão até que as pressões diastólicas sejam de 0 mmHg.
8. Amostragem
- Colete a frequência cardíaca, o fluxo aórtico e as pressões coronárias após os primeiros 20 minutos de perfusão e a cada hora a partir de então.
9. Fim/limpeza
- Ao final da perfusão, retirar o coração do sistema e pesá-lo para estimativa do edema.
- Corte o ápice do coração por meio de um corte circunferencial e congele rapidamente em nitrogênio líquido para análises pós-perfusão.
- Corte um pedaço circunferencial do coração para imagens histológicas e coloração. Descarte o resto do coração e da cânula.
- Enxágue todos os componentes do sistema adicionando grandes quantidades de água deionizada (DI) no reservatório e operando a bomba peristáltica. Colete a água em um balde externo.
- Repita a etapa 9.4 duas a três vezes.
- Enxágue bem todas as portas de amostra e a tubulação do sensor de pressão.
- Encha o reservatório com 600 mL de água DI e 3 mL de bomba de detergente de laboratório em todo o sistema.
- Desligue o aquecedor de água, o tanque de oxigênio e a bomba peristáltica.
Resultados
Corações de ratos Lewis machos adultos (250-300 g de peso corporal) foram colhidos e perfundidos em altas (70-80 mmHg) ou baixas (30-35 mmHg) pressões de perfusão (n = 3 por grupo). Os efeitos da pressão de perfusão na função cardíaca geral e na saúde foram determinados pela coleta de frequência cardíaca, edema e função ventricular esquerda.
Foi determinada uma correlação clara entre a frequência cardíaca e as pressões de perfusão (Figura 2). A frequência cardíaca foi estatisticamente maior em corações de alta pressão quando comparados a corações de baixa pressão para todos os momentos, exceto o primeiro (60 min, Figura 2A,B). Curiosamente, os corações de baixa pressão parecem passar por um período de ajuste no início da perfusão, onde demorou cerca de 30 minutos para que a frequência cardíaca se estabilizasse e atingisse os níveis que foram mantidos durante o restante da perfusão (Figura 2A). Uma grande diferença na pressão de pulso do ventrículo esquerdo (PPVE) também foi observada entre os grupos, com a PPVE dos corações de alta pressão sendo estatisticamente maior do que a dos corações de baixa pressão em todos os momentos (Figura 3B). Essa alta demanda sustentada por trabalho resultou em uma perda progressiva de função em corações de alta pressão, com uma diminuição estatística na PPVE observada após 2 h de perfusão (Figura 3A, B). Alternativamente, nenhuma perda de função estava presente em corações perfundidos com baixas pressões, com a PPVE permanecendo inalterada durante todo o tempo de perfusão (Figura 3A,B). Semelhante à PPVE, os corações de alta pressão exibiram maior contração do músculo cardíaco (dP/dtmáx) e relaxamento (dP/dtmin) durante todo o tempo de perfusão quando comparados aos corações de baixa pressão (Figura 3C,D). De acordo, os corações de alta pressão sofreram perda progressiva da contratilidade e da capacidade de relaxamento, sendo ambos os parâmetros estatisticamente maiores 1 h no tempo de perfusão quando comparados à última hora de perfusão. Diferentemente, a contratilidade do músculo cardíaco e as capacidades de relaxamento foram comparativamente baixas no grupo de baixa pressão e permaneceram inalteradas ao longo de 4 h de tempo de perfusão (Figura 3C, D). Além dos efeitos funcionais, altas pressões de perfusão por longos períodos de tempo também exacerbam a retenção de líquido intersticial dentro dos enxertos cardíacos, levando ao edema. Esse edema foi semiquantificado em variação percentual de peso e resultou em corações de alta pressão com ganho de peso estatisticamente maior quando comparados aos corações perfundidos em baixas pressões (Figura 2C).

Figura 1: Configuração do sistema de perfusão. (A) Configuração geral da perfusão. As linhas tracejadas representam a ordem em que os componentes do sistema foram conectados para otimizar a circulação do perfusato. Linhas sólidas e coloridas representam a ordem em que os componentes foram conectados para otimizar a temperatura do perfusato. (B) A maneira correta de manusear o coração após a canulação para evitar o esvaziamento do cateter e a introdução de ar nas coronárias. Clique aqui para ver uma versão maior desta figura.
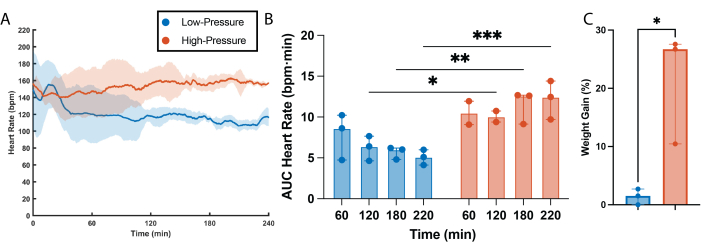
Figura 2: Efeitos da pressão sobre a frequência cardíaca e edema. (A) Frequência cardíaca obtida a partir das medidas do balão intraventricular. A linha sólida é a mediana dos grupos experimentais. A área sombreada é o intervalo interquartil. (B) Área sob a curva (AUC) dos dados de frequência cardíaca para cada hora de perfusão. (C) Porcentagem de peso ganho após 4 h de perfusão em baixas e altas pressões. Todos os dados são expressos como mediana ± intervalo interquartil (IIQ). *p < 0,01, **p < 0,05, ***p < 0,001. Clique aqui para ver uma versão maior desta figura.

Figura 3: Efeitos da pressão na função ventricular esquerda. (A) Pressão sistólica máxima plotada ao longo do tempo, denotada como pressão de pulso do ventrículo esquerdo (PPVE). A linha sólida é a mediana dos grupos experimentais. A área sombreada é o intervalo interquartil. (B) A área sob a curva LVPP (AUC) para cada hora de perfusão. (C) Contratilidade do músculo cardíaco quantificada a partir da derivada máxima do pulso de pressão. (D) Relaxamento do músculo cardíaco quantificado a partir da derivada mínima do pulso de pressão. Todos os dados são expressos como mediana ± intervalo interquartil. *p < 0,01, **p < 0,05, ***p < 0,001, ****p < 0,0001. Clique aqui para ver uma versão maior desta figura.
| Íon | Concentração (mmol/L) |
| Na+ | 135–145 |
| K + | <6.00 |
| Ca +2 | 1.0–1.3 |
| Cl - | 96–106 |
Tabela 1: Faixa aceitável de concentração de íons no perfusato.
Discussão
A perfusão de Langendorff é uma técnica extremamente flexível que permite uma adaptação e ajuste impressionantes para atender a uma ampla gama de necessidades experimentais. Essa adaptação é permitida pela capacidade de ajuste significativa da maioria dos parâmetros de perfusão, incluindo pressões de perfusão. Devido à natureza retrógrada de Langendorff, as pressões de perfusão são equivalentes às pressões de perfusão coronariana, que desempenham um papel essencial na função cardíaca. Sabe-se que as pressões de perfusão coronariana (PPC) controlam diretamente o trabalho cardíaco, pois uma ampla gama de índices cardíacos (ou seja, pressão ventricular esquerda, contratilidade (dP/dtmáx), tensão da parede, rigidez ventricular) são diretamente proporcionais à PPC 16,17,18. Historicamente, o campo utilizou pressões de perfusão e, de fato, PPC, entre 60 mmHg e 80 mmHg, na tentativa de mimetizar as condições fisiológicas 5,8,15,19,20,21. No entanto, a natureza não fisiológica da perfusão retrógrada ex vivo da máquina, combinada com a alta demanda de trabalho, leva a uma perda da função cardíaca ao longo do tempo (Figura 3). Alternativamente, pressões de perfusão mais baixas (30-35 mmHg), apesar de não replicarem com precisão as condições fisiológicas dos corações de ratos in vivo, inerentemente diminuem a demanda de trabalho cardíaco e alcançam tempos de perfusão prolongados (4 h) sem a perda de função ao longo do tempo (Figura 3) e diminuição do edema do enxerto (Figura 2C). O uso de pressões de perfusão mais baixas, embora signifique um desvio da PPC fisiológica, parece fornecer vantagens importantes sobre o uso de pressões de perfusão fisiológicas, pois a eliminação da perda de função dependente da técnica existente durante a perfusão de Langendorff melhora a técnica em um sistema modelo mais preciso e previsível com potencial significativo para avançar na pesquisa cardiovascular. Particularmente, as áreas de pesquisa que beneficiam e/ou requerem tempos de perfusão prolongados para alcançar relevância científica (ou seja, tratamentos medicamentosos, análise de resposta imunológica, edição de genes, preservação normotérmica de enxertos, etc.) estão se tornando cada vez mais importantes na batalha contra as DCVs.
A perfusão de Langendorff é indiscutivelmente uma ferramenta essencial para o campo da pesquisa cardiovascular. Portanto, juntamente com os benefícios significativos que essa técnica científica representa para a comunidade de pesquisa, ela vem com um nível importante de complexidade científica. Com efeito, existem várias etapas críticas dentro deste protocolo que requerem padronização cuidadosa, principalmente para evitar danos ao enxerto cardíaco antes, durante e imediatamente após o início da perfusão. A primeira chance de dano ao enxerto é imperceptível durante a lavagem da veia porta. Essa lavagem com solução salina heparinizada visa remover o máximo possível de sangue total do enxerto cardíaco com dupla finalidade. Primeiro, serve como uma forma de eutanásia via exsanguinação. Em segundo lugar, minimiza as chances de coagulação dentro do enxerto cardíaco durante a recuperação, canulação e transporte, pois o sangue total de rato é conhecido por ter tempos de roupa extremamente curtos22,23. No entanto, após centenas de perfusões cardíacas bem-sucedidas, tornou-se evidente que a pressão aplicada ao organismo do rato durante a lavagem é de extrema importância, com a pressão ideal de descarga em torno de 10 mmHg. Pressões de flush da veia porta mais altas parecem resultar em danos à vasculatura do enxerto cardíaco, levando ao aumento da resistência vascular (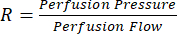 ). Maior resistência vascular resulta em pressões de perfusão alvo sendo alcançadas em taxas de fluxo mais baixas. Esse desequilíbrio entre a pressão e o fluxo coronariano é transmitido na pressão de pulso ventricular esquerdo (PPVE) produzida, resultando em variabilidade significativa.
). Maior resistência vascular resulta em pressões de perfusão alvo sendo alcançadas em taxas de fluxo mais baixas. Esse desequilíbrio entre a pressão e o fluxo coronariano é transmitido na pressão de pulso ventricular esquerdo (PPVE) produzida, resultando em variabilidade significativa.
O próximo exemplo de possível dano cardíaco ao enxerto é durante a conexão do enxerto ao sistema por meio da introdução de bolhas de ar nas coronárias. Bolhas de ar podem ser facilmente introduzidas pelo manuseio incorreto do coração canulado (Figura 1B) ou remoção inadequada de bolhas do sistema de perfusão a montante da armadilha de bolhas24. Devido à natureza retrógrada dessa configuração, qualquer introdução de ar resultará em embolia gasosa cardíaca, levando a insultos isquêmicos, fibrilação e, muito comumente, morte do enxerto. Finalmente, a última etapa crítica para garantir o sucesso do protocolo ocorre durante o início da perfusão. Diferentemente da grande maioria dos manuscritos que relatam utilizar Langendorff como técnica, o início da perfusão neste protocolo é realizado em fluxos relativamente baixos (1 mL/min) com aumentos incrementais (+0,2 mL/min), o que garante o controle completo das pressões de perfusão 5,8,15,19,20,21 . Esse aumento incremental no fluxo e, portanto, na pressão, é crítico, pois mudanças abruptas na pressão aumentam irreversivelmente a resistência vascular e alteram o delicado equilíbrio fluxo/pressão.
A alta resistência vascular nas perfusões de Langendorff controladas por pressão é muito importante, pois as pressões de perfusão alvo são atingidas em fluxos mais baixos e os enxertos resultam em subperfusão. A grande dependência desse equilíbrio perfeito entre fluxo e pressão é provavelmente a maior limitação desse protocolo, pois qualquer dano prévio ao enxerto, intencional (ou seja, preservação prolongada do frio, insulto de isquemia quente, infarto do miocárdio, etc.) ou não intencional, leva ao aumento da resistência vascular. Com efeito, este protocolo é particularmente útil para pesquisas em que o experimento começa após o início da perfusão (ou seja, tratamentos medicamentosos, análise de resposta imunológica, edição de genes, preservação normotérmica do enxerto, etc.), mas não antes. Essa limitação é um exemplo perfeito de um Langendorff que não se encaixa em todos os propósitos e cuidados especiais devem ser tomados para adaptar os parâmetros de perfusão para melhor atender às necessidades experimentais.
Divulgações
A SNT tem pedidos de patentes relevantes para este estudo e atua no Conselho Consultivo Científico da Sylvatica Biotech Inc., uma empresa focada no desenvolvimento de tecnologia de preservação de órgãos. Todos os interesses conflitantes são administrados pelo MGH e pela Partners HealthCare de acordo com suas políticas de conflito de interesses.
Agradecimentos
Este trabalho foi apoiado por um generoso financiamento para SNT dos Institutos Nacionais de Saúde dos EUA (K99 / R00 HL1431149; R01HL157803) e American Heart Association (18CDA34110049). Também agradecemos o financiamento do Instituto Nacional de Saúde dos EUA (R01DK134590; R24OD034189), National Science Foundation (EEC 1941543), Harvard Medical School Eleanor e Miles Shore Fellowship, Polsky Family Foundation, Claflin Distinguished Scholar Award em nome do Comitê Executivo de Pesquisa do MGH e Shriners Children's Boston (Grant #BOS-85115).
Materiais
| Name | Company | Catalog Number | Comments |
| 5-0 Suture | Fine Scientific Tools | 18020-50 | |
| 14 G Angiocath | Becton Dickinson | 381867 | |
| 16 G Angiocath | Becton Dickinson | 381957 | |
| 24 mm Heart Chamber adaptors | Radnoti | 140132 | |
| Balloon Catheter | Radnoti | 170423 | |
| BD Slip Tip Sterile Syringes- 10 mL | Fisher Scientific | 14-823-16E | |
| BD Slip Tip Sterile Syringes- 1 mL | Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes- 50 mL | Fisher Scientific | 14-820-11 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride | Sigma | C7902 | |
| Clamp Holder | United Scientic | RTCLMP1 | |
| Dextran | Sigma | 31389 | |
| DIN8 Extension Cable | Iworx | SKU C-DIN-EXT | |
| Falcon High Clarity 50 mL conical tubes | Fisher Scientific | 14-432-22 | |
| GSC Go Science Crazy Cast Iron Support Ring Stand | Fisher Scientific | S13748 | |
| Heart Chamber | Radnoti | 140160 | |
| Heated Water Circulator bath | Cole Parmer | N/A | |
| Heparin sodium Injection | Medplus | G-0409-2720-0409-2721 | |
| Hydrocortisone | Solu-Cortef | MGH Pharmacy | |
| Insulin | Humulin R | MGH Pharmacy | |
| Insvasive Fluid Filled Blood Pressure Sensor | Iworx | SKU BP-10x | |
| Iworx Data Acquisition System | Iworx | IX-RA-834 | |
| Krebs-Henseleit Buffer | Sigma | K3753 | |
| Left Ventricular Pressure Balloon | Radnoti | 170404 | |
| Masterflex L/S Easy-Load II Pump Head for Precision Tubing, PPS Housing, SS Rotor | VWR | MFLX77200-60 | |
| Masterflex L/S Standard Digital Pump Systems | VWR | MFLX07551-30 | |
| Membrane Oxygenating Chamber | Radnoti | 130144 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Polyethylene Tubing | Fisher Scientific | 14-170-12H | |
| Precision Pump Tubing-16 | VWR | MFLX96410-16 | |
| Sodium Bicarobonate | Sigma | 5761 | |
| Standard PHD ULTRA CP Syringe Pump | Harvard Aparatus | 88-3015 | |
| Tygon Transfer Tubing | VWR | MFLX95702-03 |
Referências
- Cardiovascular Diseases (cvds). World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2021)
- Amini, M., Zayeri, F., Salehi, M. Trend analysis of cardiovascular disease mortality, incidence, and mortality-to-incidence ratio: Results from global burden of disease study 2017. BMC Public Health. 21 (1), 401 (2021).
- Aune, S. E., Yeh, S. T., Zelinski, D. P., Angelos, M. G. Measurement of hydrogen peroxide and oxidant stress in a recirculating whole blood-perfused rat heart model. Resuscitation. 82 (2), 222-227 (2011).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. Int J Basic Clin Pharmacol. 4 (6), 1314-1322 (2015).
- Herr, D. J., Aune, S. E., Menick, D. R. Induction and assessment of ischemia-reperfusion injury in Langendorff-perfused rat hearts. J Vis Exp. (101), e52908 (2015).
- Vervoorn, M., et al. Extended normothermic ex situ heart perfusion without functional decline. J Heart Lung Transplant. 43 (4), S156 (2024).
- Moeslund, N., et al. Ex-situ oxygenated hypothermic machine perfusion in donation after circulatory death heart transplantation following either direct procurement or in-situ normothermic regional perfusion. J Heart Lung Transplant. 42 (6), 730-740 (2023).
- Testai, L., Martelli, A., Cristofaro, M., Breschi, M. C., Calderone, V. Cardioprotective effects of different flavonoids against myocardial ischaemia/reperfusion injury in Langendorff-perfused rat hearts. J Pharm Pharmacol. 65 (5), 750-756 (2013).
- Watanabe, M., Okada, T. Langendorff perfusion method as an ex vivo model to evaluate heart function in rats. Methods Mol Biol. 1816, 107-116 (2018).
- Chang, X., et al. Cardioprotective effects of salidroside on myocardial ischemia-reperfusion injury in coronary artery occlusion-induced rats and Langendorff-perfused rat hearts. Int J Cardiol. 215, 532-544 (2016).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212 (4), 804-814 (1967).
- Matsuura, H., et al. Positive inotropic effects of atp released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Front Cell Dev Biol. 9, 597997 (2021).
- Louradour, J., et al. Simultaneous assessment of mechanical and electrical function in Langendorff-perfused ex-vivo mouse hearts. Front Cardiovasc Med. 10, 1293032 (2023).
- Ueoka, A., et al. Testosterone does not shorten action potential duration in Langendorff-perfused rabbit ventricles. Heart Rhythm. 19 (11), 1864-1871 (2022).
- Reichelt, M. E., Willems, L., Hack, B. A., Peart, J. N., Headrick, J. P. Cardiac and coronary function in the Langendorff-perfused mouse heart model. Exp Physiol. 94 (1), 54-70 (2009).
- Abel, R. M., Reis, R. L. Effects of coronary blood flow and perfusion pressure on left ventricular contractility in dogs. Circ Res. 27 (6), 961-971 (1970).
- Arnold, G., Morgenstern, C., Lochner, W. The autoregulation of the heart work by the coronary perfusion pressure. Pflugers Arch. 321 (1), 34-55 (1970).
- Iwamoto, T., Bai, X. J., Downey, H. F. Coronary perfusion related changes in myocardial contractile force and systolic ventricular stiffness. Cardiovasc Res. 28 (9), 1331-1336 (1994).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: Impact of ischemia and reperfusion length on infarct size and LDH release. J Cardiovasc Pharmacol Ther. 21 (3), 286-295 (2016).
- Headrick, J. P., Peart, J., Hack, B., Flood, A., Matherne, G. P. Functional properties and responses to ischaemia-reperfusion in Langendorff perfused mouse heart. Exp Physiol. 86 (6), 703-716 (2001).
- Noly, P. E., Naik, S., Tang, P., Lei, I. Assessment of ex vivo murine biventricular function in a Langendorff model. J Vis Exp. (190), e64384 (2022).
- Garcia-Manzano, A., Gonzalez-Llaven, J., Lemini, C., Rubio-Poo, C. Standardization of rat blood clotting tests with reagents used for humans. Proc West Pharmacol Soc. 44, 153-155 (2001).
- Lewis, J. H., Van Thiel, D. H., Hasiba, U., Spero, J. A., Gavaler, J. Comparative hematology and coagulation: Studies on rodentia (rats). Comp Biochem Physiol A Comp Physiol. 82 (1), 211-215 (1985).
- Motayagheni, N. Modified Langendorff technique for mouse heart cannulation: Improved heart quality and decreased risk of ischemia. MethodsX. 4, 508-512 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.