Method Article
Modifizierte Langendorff-Perfusion zur Verlängerung der Perfusionszeiten von Nagetier-Herztransplantaten
In diesem Artikel
Zusammenfassung
Dieser Artikel zeigt die Machbarkeit, längere Perfusionszeiten (4 h) von murinen Herztransplantaten ohne Funktionsverlust zu erreichen, indem während des Langendorff-Prozesses niedrigere (30-35 mmHg) als physiologische (60-80 mmHg) Perfusionsdrücke verwendet werden.
Zusammenfassung
Trotz wichtiger Fortschritte bei der Diagnose und Behandlung von Herz-Kreislauf-Erkrankungen (CVDs) besteht ein dringender Bedarf an verstärkter Forschung und wissenschaftlichem Fortschritt. Infolgedessen können Innovationen, Verbesserungen und/oder die Umwidmung des verfügbaren Forschungsinstrumentariums verbesserte Testumgebungen für den Forschungsfortschritt bieten. Die Langendorff-Perfusion ist eine äußerst wertvolle Forschungstechnik für die CVD-Forschung, die modifiziert werden kann, um einer Vielzahl von experimentellen Anforderungen gerecht zu werden. Diese Anpassung kann durch die Personalisierung einer großen Anzahl von Perfusionsparametern erreicht werden, darunter Perfusionsdruck, Durchfluss, Perfusat, Temperatur usw. Dieses Protokoll demonstriert die Vielseitigkeit der Langendorff-Perfusion und die Machbarkeit, längere Perfusionszeiten (4 h) ohne Verlust der Transplantatfunktion durch niedrigere Perfusionsdrücke (30-35 mmHg) zu erreichen. Das Erreichen verlängerter Perfusionszeiten ohne Transplantatschäden und/oder Funktionsverluste, die durch die Technik selbst verursacht werden, hat das Potenzial, störende Elemente aus den experimentellen Ergebnissen zu eliminieren. In der Tat kann unter wissenschaftlichen Umständen, in denen längere Perfusionszeiten für den experimentellen Bedarf relevant sind (z. B. medikamentöse Behandlungen, immunologische Reaktionsanalysen, Geneditierung, Konservierung von Transplantaten usw.), ein niedrigerer Perfusionsdruck der Schlüssel zum wissenschaftlichen Erfolg sein.
Einleitung
Im Bereich der kardiovaskulären Forschung wurden wichtige Fortschritte bei der Diagnose und Behandlung von Herz-Kreislauf-Erkrankungen (CVDs) erzielt. Trotz des allgemeinen Rückgangs der Inzidenz- und Mortalitätsraten sind Herz-Kreislauf-Erkrankungen jedoch nach wie vor die häufigste Todesursache weltweit 1,2. Diese alarmierende Tatsache unterstreicht die Notwendigkeit einer verstärkten Forschung und eines wissenschaftlichen Fortschritts, der zweifellos von der Genauigkeit und Vorhersehbarkeit der verfügbaren Forschungsinstrumente abhängt. Infolgedessen besteht ein ständiger Bedarf an Innovation, Verbesserung und/oder Umwidmung des Forschungsinstrumentariums. So kann beispielsweise die retrograde oder Langendorff-Herzperfusion, eine Technik, die seit über einem Jahrhundert auf diesem Gebiet zur Verfügung steht, leicht modifiziert werden, um einen größeren wissenschaftlichen Bedarf abzudecken und ein breiteres Anwendungsspektrum zu erreichen.
Die Isolierung des Herztransplantats vom Rest des Organismus während der Langendorff-Perfusion bietet ein wichtiges Maß an Kontrolle über eine Vielzahl von experimentellen Parametern, einschließlich Temperatur, zirkulierende Lösung, koronare Perfusionsdrücke usw.3,4,5,6,7. Die Manipulation dieser Parameter erleichtert die Simulation einer großen Anzahl von kardialen Szenarien, die für weitere wissenschaftliche Fortschritte genutzt werden können 5,8,9,10. Unter diesen Parametern ist der Perfusionsdruck wahrscheinlich die am meisten übersehene Versuchsanordnung11.
Während der Langendorff-Studie zeigt der Perfusionsdruck eine direkte Korrelation mit der Herzfrequenz, dem systolischen/diastolischen Spitzendruck und dem Sauerstoffverbrauch11. Diese Korrelation ermöglicht eine direkte und präzise Kontrolle über den Arbeitsaufwand der Herztransplantate, der an die individuellen experimentellen Anforderungen angepasst werden kann. Trotz dieser wertvollen Kontrollmöglichkeit hat sich das Feld in der Vergangenheit zur Verwendung höherer Perfusionsdrücke (60-80 mmHg) hingezogen, wodurch alle Herztransplantate unabhängig von den experimentellen Anforderungen einem hohen Arbeitsaufwand ausgesetzt sind 8,12,13,14,15. Die Folgen dieses unnötig hohen Arbeitsbedarfs ergeben sich aus dem übergeordneten Grundsatz, dass Überarbeitung tendenziell zu vorzeitigem Scheitern führt. Dies scheint insbesondere für Herztransplantate zu gelten, die über Langendorff perfundiert wurden, da die unphysiologische Natur dieser Methode und der Mangel an Wiederherstellungsunterstützung in vivo das Versagen des Transplantats zu verschlimmern scheinen. Dieser vorzeitige Verlust der Transplantatfunktion schränkt die Perfusion und die Versuchszeiten erheblich ein. In der Tat kann unter Umständen, unter denen längere Perfusionszeiten für die experimentellen Bedürfnisse relevanter sind (d. h. medikamentöse Behandlungen, immunologische Reaktionsanalysen, Geneditierung, Transplantatkonservierung usw.), eine geringere kardiale Arbeit im Austausch für eine längere Haltbarkeit des Transplantats geleistet werden.
Dieses Protokoll zeigt die Machbarkeit der Verwendung niedrigerer Perfusionsdrücke (30-35 mmHg) während der Langendorff-Behandlung sowie den signifikanten Effekt, den diese im Vergleich zu höheren Perfusionsdrücken (60-80 mmHg) auf die Funktion des Herztransplantats im Laufe der Zeit haben. Darüber hinaus unterstreichen die Ergebnisse in diesem Manuskript, wie wichtig es ist, die Anpassung des breiten Spektrums von Perfusionsparametern zu priorisieren, um den experimentellen Anforderungen besser gerecht zu werden.
Protokoll
Diese Studie wird in Anlehnung an das Institutional Animal Care and Use Committee (IACUC) des Massachusetts General Hospital durchgeführt.
1. Systemdesign
- Montieren Sie das System mit den drei doppelwandigen Komponenten, darunter eine Blasenfalle, ein Reservoir, ein Oxygenator, eine Peristaltikpumpe und ein Wasserumwälzsystem.
- Befestigen Sie alle ummantelten Komponenten an einem Klemmständer. Verbinden Sie die Komponenten nacheinander mit Silikonschläuchen in zwei verschiedenen Sequenzen (Abbildung 1A).
- Sequenz 1 - Strömungsmuster des Wassers durch den Mantel (durchgezogene Linien in Abbildung 1A):
- Verbinden Sie den Auslauf des Wasserzirkulators mit einem 36-G-Schlauch mit dem unteren Einlass des Blasenfallenmantels. Dadurch wird gewährleistet, dass das Perfusat auf der richtigen Temperatur (37 °C) gehalten wird, bevor es das Herz erreicht, da das Wasser beim Durchströmen der anderen Komponenten des Systems Wärme verliert.
- Verbinden Sie den oberen Einlass des Blasenfallenmantels mit dem unteren Einlass des Behältermantels mit einem Schlauch der gleichen Größe.
- Verbinden Sie anschließend den oberen Einlass des Reservoirmantels mit dem unteren Einlass des Oxygenatormantels.
- Verbinden Sie abschließend den oberen Einlass des Oxygenators mit dem Zufluss des Wasserzirkulators.
- Sequenz 2 - Strömungsmuster des Perfusats durch das System (gestrichelte Linien in Abbildung 1A)
- Befestigen Sie die Luer-Anschlüsse an beiden Seiten des 16-G-Schlauchs. Befestigen Sie das erste Ende am Boden des Reservoirs und führen Sie es durch den peristaltischen Pumpenkopf. Verbinden Sie das andere Ende mit einem der Einlässe der Silikonspule im Oxygenator.
- Verbinden Sie ein zweites Stück 16-G-Schlauch, das an beiden Enden mit Luer-Lock-Anschlüssen versehen ist, am zweiten Einlass der Silikonspule des Oxygenators mit dem Einlass in der Blasenfalle mit dem langen Vorsprung.
- Verbinden Sie ein kürzeres Stück 16-G-Schlauch mit Luer-Anschlüssen mit dem ungenutzten Auslass der Blasenfalle mit einem Dreiwege-Luer-Lock-Ventil.
- Verbinden Sie auf der gegenüberliegenden Seite des Dreiwegeventils ein Stück 16-G-Schlauch mit einem zweiten Luer-Ventil am anderen Ende. Dieses zweite Ventil befindet sich unmittelbar über dem Behälter. Verbinden Sie die gegenüberliegende Seite des Ventils mit weiteren 16-G-Schläuchen, gefolgt vom Drucksensor.
- Verbinden Sie einen Schlauch mit kleinerem Durchmesser ( ̃3,7 mm) mit einem Konnektor mit der Kanüle (14 G Angiokath) mit dem vertikalen Anschluss des Dreiwegeventils. Das Perfusat fließt durch die Blasenfalle vom Reservoir zum Oxygenator, bevor es durch den Anschluss der Aortenkanüle wieder in das Reservoir zurückfließt.
- Sequenz 1 - Strömungsmuster des Wassers durch den Mantel (durchgezogene Linien in Abbildung 1A):
2. Perfusat-Vorbereitung
- Bereiten Sie Basenperfusat, 0,96 % Krebs-Henseleit-Puffer, 9,915 mM Dextran, 25 mM Natriumbicarbonat, 1,054 mM Rinderserumalbumin, 1 % Pen-Strepto, 0,13 % Insulin, 0,02 % Hydrocortison, 0,5 % Heparin und 2,75 mM Calciumchlorid vor und bringen Sie es mit destilliertem Wasser auf Volumen.
3. Einrichtung des Perfusionssystems
- Verbinden Sie zwei 10-ml-Spritzen mit den oberen und seitlichen Entlüftungsöffnungen der Blasenfalle.
- Geben Sie das Basisperfusat (75 mL) in das Reservoir. Schalten Sie die Schlauchpumpe ein und stellen Sie die Wasserumwälzpumpe auf 37 °C ein.
- Schließen Sie eine Sauerstoffleitung (95 % O2 und 5 % CO2) an den dritten Einlass des Oxygenators an und sauerstoffisieren Sie das Perfusat mit einem Mindestgehalt vonpO 2 von 400 mmHg.
- Befestigen Sie eine Injektionsöffnung an der vertikalen Öffnung des Dreiwegeventils unmittelbar hinter der Blasenfalle. Verbinden Sie eine geflügelte Infusionsnadel mit einer 1-ml-Spritze mit dem Injektionsanschluss (der für die Probenahme verwendet wird). Klopfen Sie vorsichtig auf die Injektionsöffnung oder ziehen Sie Perfusat mit der 1-ml-Spritze, um alle Blasen zu entfernen, die in den Kreislauf gelangen.
- Sobald das Basisperfusat die Temperatur und den Sauerstoffgehalt erreicht hat, führen Sie eine erste Messung der biochemischen Parameter durch, um die korrekte Ionenkonzentration (Tabelle 1) und die richtige Sauerstoffversorgung sicherzustellen.
HINWEIS: Der Ionen- und pH-Wert muss abgelesen werden, nachdem die Lösung auf Temperatur (37 °C) gebracht und mit dem richtigen Gasgemisch (95 % O2, 5 % CO2) mit Sauerstoff angereichert wurde. - Stellen Sie den Drucksensor auf Null, indem Sie den angeschlossenen Schlauch lösen, und lassen Sie den Perfusatfluss durch den offenen Sensor und die Kanüle ausgleichen. Drücken Sie nach dem Gleichäquirieren die Nulltaste in der Sensorbox und klemmen Sie den Schlauch wieder fest. Zeichnen Sie den Basisdruck auf, bevor das Herz an das System angeschlossen wird, für einen Messwert von 1 ml/min bis 15 mL/min.
- Niederdruck-Perfusion
- Adenosin-Tropf: Stellen Sie eine erste Brühe von 20 mM Adenosin im Basisperfusat her. Lösen Sie das Adenosin auf, indem Sie das Röhrchen in ein warmes Wasserbad legen und durch Inversion mischen.
- Verdünnen Sie das Stammadenosin weiter auf eine Konzertierung von 0,06 mg/ml in Base Perfusat und geben Sie es in eine 50 mL Spritze.
- Befestigen Sie eine geflügelte Infusionsnadel an der 50-ml-Spritze und verbinden Sie sie mit dem Injektionsanschluss im Dreiwegeventil. Befestigen Sie die Spritze an einer Spritzenpumpe und stellen Sie sie auf eine Infusionsgeschwindigkeit von 166,6 μl/min ein.
HINWEIS: Blasen werden durch leichtes Klopfen oder Schnippen aus dem Infusionsanschluss freigesetzt.
- Hochdruck-Perfusion:
- Isolierung von gepackten roten Blutkörperchen (pRBCs):
- Entnahme von 10-12 ml Vollblut der Ratte durch Herzpunktion einer Spenderratte.
- Das Blut bei 2000 x g 10 min zentrifugieren.
- Entfernen Sie die Plasma- und Buffy-Coat-Schicht durch Pipettieren.
- Resuspendieren Sie die pRBCs in Perfusat ohne Calciumchlorid im Verhältnis 1:1 (z. B. 5 mL pRBCs: 5 mL Perfusat) durch Inversionsmischung.
- Wiederholen Sie die Schritte 3.8.1.2-3.8.1.4 zweimal für insgesamt 3 Wäschen.
- Nach der letzten Wäsche resuspendieren Sie die Zellen im Verhältnis 1:1 in Perfusat und geben Sie die Mischung in das Perfusionssystem, das bereits die 75 ml Baseperfusat enthält.
- Lassen Sie die Zellen gleichmäßig im System verteilen und messen Sie den Hämatokrit des Perfusats mit einem Hämatologiegerät. Der Hämatokrit liegt zwischen 5 % und 7 %.
- Isolierung von gepackten roten Blutkörperchen (pRBCs):
4. Vorbereitung der Beschaffung von Herztransplantaten
- Grundieren Sie das Perfusionssystem vollständig, bevor Sie mit der Beschaffung beginnen, um die Zeit der kalten Ischämie zu minimieren.
- Bereiten Sie die chirurgischen Instrumente vor. Zu den chirurgischen Instrumenten gehören blaue Pads, chirurgisches Klebeband, 5-0-Seidennähte, Wattestäbchen, Kochsalzspritzen (50 mL und 10 mL), Operationsscheren, Pinzetten, Mikroscheren, Mikrozangen, Halstead-Klemme, 30 U Heparin, 16 G Schläuche für die Portalspülung, 14 G Schläuche für die Kanulation des Herzens, 16 G Angiokath, modifizierte 14 G Angiokath mit Manschette, Drucksensor, Eiskübel mit Eis, 47 mm Petrischale, Gaze.
- Erstellen Sie eine modifizierte Kanüle, indem Sie einen dünnen Schlauchring (Innendurchmesser [ID] 0,167 mm, Außendurchmesser [OD] 2,42 mm) auf die 14-G-Kanüle einführen, um einen Manschetteneffekt zu erzeugen.
- Entfernen Sie die Nadel der Kanüle und geben Sie einen Tropfen Sekundenkleber unter den Ring. Schieben Sie den Ring vorsichtig bis zu 1/4 Zoll über die Basis der Kanüle. Lassen Sie den Kleber vor dem Gebrauch trocknen.
- Schneiden Sie die Kanüle so nah wie möglich an der Manschette schräg ab und entfernen Sie scharfe Kanten.
- Füllen Sie eine 60-ml-Spritze mit heparinisierter Kochsalzlösung (0,03 U/ml) für die Pfortaderspülung. Schließen Sie die Spritze an den Drucksensor an, gefolgt von dem 16-G-Spülschlauch.
- Schließen Sie eine 10-ml-Spritze mit heparinisierter Kochsalzlösung (0,03 U/ml) an die 14-G-Sonde an. Verbinden Sie das andere Ende des Schlauchs mit der Aortenkanüle und spülen Sie, um Luftblasen zu entfernen.
- Legen Sie die Aortenkanüle in eine 47 mm Petrischale, die mit Gaze gefüllt und mit Kochsalzlösung gefüllt ist. Lassen Sie die Petrischale auf Eis, bis das Herz mit dem Perfusionssystem verbunden ist.
5. Beschaffung von Herztransplantaten
- Betäuben Sie die Ratten in einer Narkosekammer mit 3% Isofluran.
- Sobald die Reflexe nicht bemerkt werden, nehmen Sie die Ratte aus der Kammer, setzen Sie sie in den Operationsraum und geben Sie kontinuierlich Isofluran (3%) über eine Gesichtsmaske ab.
- Nach dem Zehenkneiftest heparinisieren Sie das Tier durch die Penisvene mit 30 U Heparin.
- Rasieren Sie die Ratte über den gesamten Bauch und den oberen Brustbereich. Entfernen Sie die Fellspäne aus dem Operationsfeld. Kleben Sie jedes Glied ab, um sicherzustellen, dass sich während der Operation keine Bewegungen bewegen.
- Machen Sie einen horizontalen Schnitt in der Mittellinie in der Haut des Unterbauchs, wodurch die Bauchmuskeln freigelegt werden.
- Machen Sie einen zweiten horizontalen Schnitt in der Mittellinie in den Bauchmuskeln, der die inneren Organe freilegt.
- Legen Sie das Brustbein frei, sichern Sie es mit einem Hämostatat und ziehen Sie es kranial zurück, um die Leber und die Pfortader freizulegen. Kanülieren Sie die Pfortader mit einem 16-Gauge-Angiokath.
- Befestigen Sie die 60-ml-Spritze mit heparinisierter Kochsalzlösung am Angiokath und erstellen Sie einen Schnitt in der unteren Hohlvene und der Bauchschlagader zur Entlüftung. Spülen Sie die volle Menge Kochsalzlösung durch die Pfortader.
HINWEIS: Der Spüldruck sollte bei etwa 10 mmHg bleiben. - Machen Sie einen horizontalen Schnitt im Zwerchfell, gefolgt von einem proximalen Schnitt durch die Rippen auf beiden Seiten des Brustbeins, um die Brusthöhle freizulegen.
- Nehmen Sie das Herz aus dem Hohlraum und legen Sie es sofort mit Kochsalzlösung auf Eis auf die Petrischale.
- Identifizieren Sie den Aortenbogen, klemmen Sie mit Hämostaten und legen Sie die absteigende Aorta frei, indem Sie das verbleibende Bindegewebe reinigen.
- Machen Sie einen horizontalen Schnitt auf halber Höhe der absteigenden Aorta und kanülieren Sie mit dem 14 G Angiokath.
HINWEIS: Brechen Sie die Aortenklappe nicht mit der Kanüle auf. - Sichern Sie die Kanüle über eine Naht oberhalb der Manschette und lösen Sie den Hämostat.
- Lassen Sie das Herz auf Eis bleiben, bis es in das Perfusionssystem gelegt wird.
6. Einleitung der Perfusion
- Stellen Sie den Durchfluss der Schlauchpumpe auf 1,0 mL/min ein.
HINWEIS: Die Aortenkanüle wird immer in einem 90°-Winkel zum Herzen geführt, um das Einbringen von Blasen in die Herzkranzgefäße zu vermeiden (Abbildung 1B). - Wiegen Sie das Herz mit der Kanüle, bevor Sie das Herz am System befestigen.
HINWEIS: Die Aortenkanüle sollte vollständig frei von Luftblasen sein. - Befestigen Sie die Kanüle an dem Konnektor im System und starten Sie einen Timer.
- Sobald das Herz eine vollständige Kontraktion hat, erhöhen Sie den Fluss in Schritten von 0,2 ml/min, während Sie den Druck genau beobachten.
- Stoppen Sie den Anstieg des Durchflusses, wenn der gewünschte Druck erreicht ist oder bis ein Minimum von 3,5 mL/min erreicht ist.
- Niederdruck-Perfusion
- Für Drücke zwischen 30 und 35 mmHg ist ein Durchfluss von 4,5 ml/min zu verwenden.
- Starten Sie die Adenosin-Spritzenpumpe.
- Hochdruck-Perfusion
- Für Drücke zwischen 70 und 80 mmHg ist ein Mindestdurchfluss von 5,0 ml/min zu verwenden.
- Starten Sie die Adenosin-Spritzenpumpe.
- Niederdruck-Perfusion
7. Intraventrikulärer Ballon:
- Befestigen Sie einen kleinen (50 μl) Latexballon an einem Ballonkatheter (2 mm Durchmesser, 15 cm lang) mit einer konischen Spitze (1,4 mm Durchmesser).
- Verbinden Sie den Katheter über einen Luer-Lock-Anschluss mit einem Drucksensor und befestigen Sie das gesamte Setup an einem Klemmständer.
- Füllen Sie den Ballon/Katheter/Drucksensor mit ca. 200 μl Kochsalzlösung über eine Spritze, die am oberen Ende des Drucksensors angebracht ist, und entfernen Sie Blasen aus dem Inneren des Sensors, des Katheters und des Ballons.
- Kalibrieren Sie den Drucksensor mit einem Blutdruckmessgerät.
- Machen Sie einen kleinen horizontalen Schnitt über dem linken Vorhof. Entleeren Sie den Ballon, indem Sie die Spritze an der Oberseite des Drucksensors ziehen und in den linken Ventrikel einführen.
- Starten Sie die Datenerfassung und blasen Sie den Ballon auf, bis der diastolische Druck 0 mmHg anzeigt.
8. Probenahme
- Erfassen Sie die Herzfrequenz, den Aortenfluss und den Koronardruck nach den ersten 20 Minuten der Perfusion und danach jede Stunde.
9. Ende/Aufräumen
- Am Ende der Perfusion nehmen Sie das Herz aus dem System und wiegen es zur Ödemabschätzung.
- Schneiden Sie die Herzspitze über einen umlaufenden Schnitt und frieren Sie sie in flüssigem Stickstoff für die Postperfusionsanalyse ein.
- Schneiden Sie ein umlaufendes Stück des Herzens für die histologische Bildgebung und Färbung. Entsorgen Sie den Rest des Herzens und der Kanüle.
- Spülen Sie alle Komponenten des Systems, indem Sie große Mengen deionisiertes (DI) Wasser in den Behälter geben und die Schlauchpumpe laufen lassen. Sammle das Wasser in einem externen Eimer.
- Wiederholen Sie Schritt 9.4 zwei- bis dreimal.
- Spülen Sie alle Messanschlüsse und Drucksensorschläuche gründlich aus.
- Füllen Sie den Behälter mit 600 mL DI-Wasser und 3 mL Waschmittelpumpe in Laborqualität im gesamten System.
- Schalten Sie den Warmwasserbereiter, den Sauerstofftank und die Schlauchpumpe aus.
Ergebnisse
Herzen von adulten männlichen Lewis-Ratten (250-300 g Körpergewicht) wurden entnommen und bei hohem (70-80 mmHg) oder niedrigem (30-35 mmHg) Perfusionsdruck (n = 3 pro Gruppe) perfundiert. Die Auswirkungen des Perfusionsdrucks auf die allgemeine Herzfunktion und Gesundheit wurden durch die Erfassung von Herzfrequenz, Ödemen und linksventrikulärer Funktion bestimmt.
Es wurde ein deutlicher Zusammenhang zwischen Herzfrequenz und Perfusionsdruck festgestellt (Abbildung 2). Die Herzfrequenz war bei Hochdruckherzen statistisch höher als bei Niederdruckherzen für alle Zeitpunkte, mit Ausnahme des ersten (60 min, Abbildung 2A,B). Interessanterweise scheinen Niederdruckherzen zu Beginn der Perfusion eine Anpassungsphase zu durchlaufen, in der es etwa 30 Minuten dauerte, bis sich die Herzfrequenz stabilisierte und das Niveau erreichte, das während des restlichen Durchgangs der Perfusion aufrechterhalten wurde (Abbildung 2A). Zwischen den Gruppen wurde auch ein großer Unterschied im linksventrikulären Pulsdruck (LVPP) beobachtet, wobei der LVPP von Hochdruckherzen zu jedem Zeitpunkt statistisch höher war als von Niederdruckherzen (Abbildung 3B). Dieser anhaltend hohe Arbeitsbedarf führte zu einem fortschreitenden Funktionsverlust bei Hochdruckherzen mit einer statistischen Abnahme der LVPP nach 2 Stunden Perfusion (Abbildung 3A, B). Alternativ war bei Herzen, die mit niedrigem Druck durchblutet wurden, kein Funktionsverlust vorhanden, wobei das LVPP während der gesamten Perfusionszeit unverändert blieb (Abbildung 3A,B). Ähnlich wie bei LVPP zeigten Hochdruckherzen im Vergleich zu Niederdruckherzen eine höhere Herzmuskelkontraktion (dP/dtmax) und Entspannung (dP/dtmin) während der Perfusionszeit (Abbildung 3C,D). Dementsprechend erfuhren Hochdruckherzen einen fortschreitenden Verlust der Kontraktilität und Entspannungskapazität, wobei beide Parameter statistisch gesehen 1 h nach Beginn der Perfusionszeit im Vergleich zur letzten Stunde der Perfusion höher waren. Im Gegensatz dazu waren die Kontraktilität und die Entspannungsfähigkeit des Herzmuskels in der Niederdruckgruppe vergleichsweise gering und blieben über 4 h Perfusionszeit unverändert (Abbildung 3C,D). Zusätzlich zu den funktionellen Effekten verschlimmert ein hoher Perfusionsdruck über längere Zeiträume auch die interstitielle Flüssigkeitsretention in den Herztransplantaten, was zu Ödemen führt. Dieses Ödem war in Prozent der Gewichtsveränderung semi-quantifiziert und führte dazu, dass Hochdruckherzen im Vergleich zu Herzen, die bei niedrigem Druck perfundiert wurden, statistisch eine höhere Gewichtszunahme aufwiesen (Abbildung 2C).

Abbildung 1: Aufbau des Perfusionssystems. (A) Gesamter Perfusionsaufbau. Gestrichelte Linien stellen die Reihenfolge dar, in der die Komponenten des Systems verbunden wurden, um die Perfusatzirkulation zu optimieren. Durchgezogene, farbige Linien stellen die Reihenfolge dar, in der die Komponenten verbunden wurden, um die Perfusattemperatur zu optimieren. (B) Die richtige Art und Weise, das Herz nach der Kanülierung zu behandeln, um eine Entleerung des Katheters und das Einleiten von Luft in die Herzkranzgefäße zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
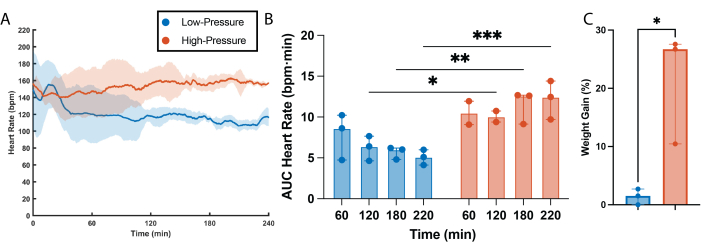
Abbildung 2: Auswirkungen des Drucks auf die Herzfrequenz und das Ödem. (A) Herzfrequenz aus den intraventrikulären Ballonmessungen. Die durchgezogene Linie ist der Median der Versuchsgruppen. Der schattierte Bereich ist der Interquartilsbereich. (B) Fläche unter der Kurve (AUC) der Herzfrequenzdaten für jede Stunde Perfusion. (C) Gewichtszunahme in Prozent nach 4 h Perfusion bei niedrigem und hohem Druck. Alle Daten werden als Median ± Interquartilsabstand (IQR) ausgedrückt. *p < 0,01, **p < 0,05, ***p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Auswirkungen des Drucks auf die linksventrikuläre Funktion. (A) Maximaler systolischer Druck über die Zeit, bezeichnet als linksventrikulärer Pulsdruck (LVPP). Die durchgezogene Linie ist der Median der Versuchsgruppen. Der schattierte Bereich ist der Interquartilsbereich. (B) Die Fläche unter der LVPP-Kurve (AUC) für jede Stunde Perfusion. (C) Kontraktilität des Herzmuskels, quantifiziert aus der maximalen Ableitung des Druckimpulses. (D) Herzmuskelentspannung, quantifiziert aus der minimalen Ableitung des Druckimpulses. Alle Daten werden als Median ± Interquartilsabstand ausgedrückt. *p < 0,01, **p < 0,05, ***p < 0,001, ****p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Ion | Konzentration (mmol/L) |
| Na+ | 135–145 |
| K + | <6,00 Uhr |
| ca +2 | 1.0–1.3 |
| Kl - | 96–106 |
Tabelle 1: Akzeptabler Bereich der Ionenkonzentration im Perfusat.
Diskussion
Die Langendorff-Perfusion ist eine extrem biegsame Technik, die eine beeindruckende Anpassung und Anpassung an ein breites Spektrum experimenteller Anforderungen ermöglicht. Diese Anpassung wird durch die signifikante Einstellbarkeit der meisten Perfusionsparameter, einschließlich des Perfusionsdrucks, ermöglicht. Aufgrund des retrograden Charakters von Langendorff entspricht der Perfusionsdruck dem koronaren Perfusionsdruck, der eine wesentliche Rolle für die Herzfunktion spielt. Es ist bekannt, dass der koronare Perfusionsdruck (CPP) die Herzarbeit direkt steuert, da eine Vielzahl von kardialen Indizes (d. h. linksventrikulärer Druck, Kontraktilität (dP/dtmax), Wandspannung, ventrikuläre Steifigkeit) direkt proportional zu CPPsind 16,17,18. In der Vergangenheit hat das Feld Perfusionsdrücke und in der Tat CPP zwischen 60 mmHg und 80 mmHg verwendet, um physiologische Bedingungen nachzuahmen 5,8,15,19,20,21. Die nicht-physiologische Natur der retrograden ex vivo Maschinenperfusion in Kombination mit dem hohen Arbeitsbedarf führt jedoch im Laufe der Zeit zu einem Verlust der Herzfunktion (Abbildung 3). Alternativ dazu verringern niedrigere Perfusionsdrücke (30-35 mmHg), obwohl sie die physiologischen Bedingungen von Rattenherzen in vivo nicht genau replizieren, von Natur aus den Bedarf an Herzarbeit und erreichen verlängerte Perfusionszeiten (4 h) ohne den Funktionsverlust im Laufe der Zeit (Abbildung 3) und verringern das Transplantatödem (Abbildung 2C). Die Verwendung niedrigerer Perfusionsdrücke scheint zwar eine Abweichung vom physiologischen CPP zu bedeuten, aber wichtige Vorteile gegenüber der Verwendung physiologischer Perfusionsdrücke zu bieten, da die Eliminierung des bestehenden technikabhängigen Funktionsverlusts während der Langendorff-Perfusion die Technik zu einem genaueren und vorhersagbareren Modellsystem mit erheblichem Potenzial für die Weiterentwicklung der kardiovaskulären Forschung macht. Insbesondere die Forschungsbereiche, die von verlängerten Perfusionszeiten profitieren und/oder verlängerte Perfusionszeiten benötigen, um wissenschaftliche Relevanz zu erreichen (z. B. medikamentöse Behandlungen, immunologische Response-Analyse, Gen-Editing, normotherme Transplantatkonservierung usw.), werden im Kampf gegen Herz-Kreislauf-Erkrankungen immer wichtiger.
Die Langendorff-Perfusion ist unbestritten ein wesentliches Werkzeug für die Herz-Kreislauf-Forschung. Neben den erheblichen Vorteilen, die diese wissenschaftliche Technik für die Forschungsgemeinschaft bietet, bringt sie daher ein hohes Maß an wissenschaftlicher Komplexität mit sich. In der Tat gibt es mehrere kritische Schritte innerhalb dieses Protokolls, die eine sorgfältige Standardisierung erfordern, vor allem, um Schäden an Herztransplantaten vor, während und unmittelbar nach Beginn der Perfusion zu vermeiden. Die erste Chance auf eine Beschädigung des Transplantats besteht unauffällig bei der Pfortaderspülung. Diese Spülung mit heparinisierter Kochsalzlösung zielt darauf ab, so viel Vollblut wie möglich aus dem Herztransplantat zu entfernen, mit einem doppelten Zweck. Erstens dient es als eine Art der Euthanasie durch Entblutung. Zweitens minimiert es die Wahrscheinlichkeit einer Gerinnung innerhalb des Herztransplantats während der Entnahme, Kanülierung und des Transports, da bekannt ist, dass Rattenvollblut extrem kurze Bekleidungszeiten aufweist22,23. Nach Hunderten von erfolgreichen Herzperfusionen zeigte sich jedoch, dass der Druck, der während der Spülung auf den Rattenorganismus ausgeübt wird, von äußerster Bedeutung ist, wobei der ideale Spüldruck bei etwa 10 mmHg liegt. Höhere Pfortaderspüldrücke scheinen zu einer Schädigung des Gefäßsystems des Herztransplantats zu führen, was zu einem erhöhten Gefäßwiderstand führt (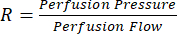 ). Ein höherer Gefäßwiderstand führt dazu, dass der Zielperfusionsdruck bei niedrigeren Flussraten erreicht wird. Dieses Ungleichgewicht zwischen Druck und koronarem Fluss wird im erzeugten linksventrikulären Pulsdruck (LVPP) übertragen, was zu einer erheblichen Variabilität führt.
). Ein höherer Gefäßwiderstand führt dazu, dass der Zielperfusionsdruck bei niedrigeren Flussraten erreicht wird. Dieses Ungleichgewicht zwischen Druck und koronarem Fluss wird im erzeugten linksventrikulären Pulsdruck (LVPP) übertragen, was zu einer erheblichen Variabilität führt.
Der nächste Fall einer möglichen Schädigung eines Herztransplantats ist während der Verbindung des Transplantats mit dem System durch das Einbringen von Luftblasen in die Herzkranzgefäße. Luftblasen können leicht durch unsachgemäße Handhabung des kanülierten Herzens (Figur 1B) oder durch unsachgemäße Blasenentfernung aus dem Perfusionssystem vor der Blasenfalle24 eingeführt werden. Aufgrund des retrograden Charakters dieses Aufbaus führt jede Einführung von Luft zu einer kardialen Luftembolie, die zu ischämischen Beleidigungen, Flimmern und sehr häufig zum Tod des Transplantats führt. Der letzte kritische Schritt, um den Erfolg des Protokolls sicherzustellen, erfolgt während der Einleitung der Perfusion. Anders als bei der großen Mehrheit der Manuskripte, die berichten, dass Langendorff als Technik verwendet wird, wird die Initiierung der Perfusion in diesem Protokoll bei relativ niedrigen Flüssen (1 mL/min) mit inkrementellen Erhöhungen (+0,2 mL/min) durchgeführt, die eine vollständige Kontrolle über den Perfusionsdruck rechtfertigen 5,8,15,19,20,21 . Diese schrittweise Erhöhung des Durchflusses und damit des Drucks ist von entscheidender Bedeutung, da abrupte Druckänderungen den Gefäßwiderstand irreversibel erhöhen und das empfindliche Fluss-/Druckgleichgewicht verändern.
Ein hoher Gefäßwiderstand bei druckgesteuerten Langendorff-Perfusionen ist sehr konsequent, da bei niedrigeren Flüssen der Zielperfusionsdruck erreicht wird und die Transplantate zu wenig durchblutet werden. Die große Abhängigkeit von diesem perfekten Gleichgewicht zwischen Fluss und Druck ist wahrscheinlich die größte Einschränkung dieses Protokolls, da jede vorherige Beschädigung des Transplantats, absichtlich (d. h. verlängerte Kältekonservierung, warme Ischämie, Myokardinfarkt usw.) oder unbeabsichtigt, zu einem erhöhten Gefäßwiderstand führt. In der Tat ist dieses Protokoll besonders nützlich für die Forschung, bei der das Experiment nach Beginn der Perfusion beginnt (d. h. medikamentöse Behandlungen, immunologische Reaktionsanalysen, Geneditierung, normotherme Transplantatkonservierung usw.), aber nicht vorher. Diese Einschränkung ist ein perfektes Beispiel dafür, dass ein Langendorff nicht für alle Zwecke geeignet ist, und es sollte besonders darauf geachtet werden, die Perfusionsparameter besser an die experimentellen Anforderungen anzupassen.
Offenlegungen
SNT verfügt über Patentanmeldungen, die für diese Studie relevant sind, und ist Mitglied des wissenschaftlichen Beirats von Sylvatica Biotech Inc., einem Unternehmen, das sich auf die Entwicklung von Technologien zur Organkonservierung konzentriert. Alle konkurrierenden Interessen werden von der MGH und Partners HealthCare in Übereinstimmung mit ihren Richtlinien für Interessenkonflikte verwaltet.
Danksagungen
Diese Arbeit wurde durch eine großzügige Finanzierung von S.N.T. durch die US National Institutes of Health (K99/R00 HL1431149; R01HL157803) und der American Heart Association (18CDA34110049). Wir danken auch der Finanzierung durch das US National Institute of Health (R01DK134590; R24OD034189), National Science Foundation (EEC 1941543), Harvard Medical School Eleanor and Miles Shore Fellowship, Polsky Family Foundation, der Claflin Distinguished Scholar Award im Namen des MGH Executive Committee on Research und Shriners Children's Boston (Grant #BOS-85115).
Materialien
| Name | Company | Catalog Number | Comments |
| 5-0 Suture | Fine Scientific Tools | 18020-50 | |
| 14 G Angiocath | Becton Dickinson | 381867 | |
| 16 G Angiocath | Becton Dickinson | 381957 | |
| 24 mm Heart Chamber adaptors | Radnoti | 140132 | |
| Balloon Catheter | Radnoti | 170423 | |
| BD Slip Tip Sterile Syringes- 10 mL | Fisher Scientific | 14-823-16E | |
| BD Slip Tip Sterile Syringes- 1 mL | Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes- 50 mL | Fisher Scientific | 14-820-11 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride | Sigma | C7902 | |
| Clamp Holder | United Scientic | RTCLMP1 | |
| Dextran | Sigma | 31389 | |
| DIN8 Extension Cable | Iworx | SKU C-DIN-EXT | |
| Falcon High Clarity 50 mL conical tubes | Fisher Scientific | 14-432-22 | |
| GSC Go Science Crazy Cast Iron Support Ring Stand | Fisher Scientific | S13748 | |
| Heart Chamber | Radnoti | 140160 | |
| Heated Water Circulator bath | Cole Parmer | N/A | |
| Heparin sodium Injection | Medplus | G-0409-2720-0409-2721 | |
| Hydrocortisone | Solu-Cortef | MGH Pharmacy | |
| Insulin | Humulin R | MGH Pharmacy | |
| Insvasive Fluid Filled Blood Pressure Sensor | Iworx | SKU BP-10x | |
| Iworx Data Acquisition System | Iworx | IX-RA-834 | |
| Krebs-Henseleit Buffer | Sigma | K3753 | |
| Left Ventricular Pressure Balloon | Radnoti | 170404 | |
| Masterflex L/S Easy-Load II Pump Head for Precision Tubing, PPS Housing, SS Rotor | VWR | MFLX77200-60 | |
| Masterflex L/S Standard Digital Pump Systems | VWR | MFLX07551-30 | |
| Membrane Oxygenating Chamber | Radnoti | 130144 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Polyethylene Tubing | Fisher Scientific | 14-170-12H | |
| Precision Pump Tubing-16 | VWR | MFLX96410-16 | |
| Sodium Bicarobonate | Sigma | 5761 | |
| Standard PHD ULTRA CP Syringe Pump | Harvard Aparatus | 88-3015 | |
| Tygon Transfer Tubing | VWR | MFLX95702-03 |
Referenzen
- Cardiovascular Diseases (cvds). World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2021)
- Amini, M., Zayeri, F., Salehi, M. Trend analysis of cardiovascular disease mortality, incidence, and mortality-to-incidence ratio: Results from global burden of disease study 2017. BMC Public Health. 21 (1), 401 (2021).
- Aune, S. E., Yeh, S. T., Zelinski, D. P., Angelos, M. G. Measurement of hydrogen peroxide and oxidant stress in a recirculating whole blood-perfused rat heart model. Resuscitation. 82 (2), 222-227 (2011).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. Int J Basic Clin Pharmacol. 4 (6), 1314-1322 (2015).
- Herr, D. J., Aune, S. E., Menick, D. R. Induction and assessment of ischemia-reperfusion injury in Langendorff-perfused rat hearts. J Vis Exp. (101), e52908 (2015).
- Vervoorn, M., et al. Extended normothermic ex situ heart perfusion without functional decline. J Heart Lung Transplant. 43 (4), S156 (2024).
- Moeslund, N., et al. Ex-situ oxygenated hypothermic machine perfusion in donation after circulatory death heart transplantation following either direct procurement or in-situ normothermic regional perfusion. J Heart Lung Transplant. 42 (6), 730-740 (2023).
- Testai, L., Martelli, A., Cristofaro, M., Breschi, M. C., Calderone, V. Cardioprotective effects of different flavonoids against myocardial ischaemia/reperfusion injury in Langendorff-perfused rat hearts. J Pharm Pharmacol. 65 (5), 750-756 (2013).
- Watanabe, M., Okada, T. Langendorff perfusion method as an ex vivo model to evaluate heart function in rats. Methods Mol Biol. 1816, 107-116 (2018).
- Chang, X., et al. Cardioprotective effects of salidroside on myocardial ischemia-reperfusion injury in coronary artery occlusion-induced rats and Langendorff-perfused rat hearts. Int J Cardiol. 215, 532-544 (2016).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212 (4), 804-814 (1967).
- Matsuura, H., et al. Positive inotropic effects of atp released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Front Cell Dev Biol. 9, 597997 (2021).
- Louradour, J., et al. Simultaneous assessment of mechanical and electrical function in Langendorff-perfused ex-vivo mouse hearts. Front Cardiovasc Med. 10, 1293032 (2023).
- Ueoka, A., et al. Testosterone does not shorten action potential duration in Langendorff-perfused rabbit ventricles. Heart Rhythm. 19 (11), 1864-1871 (2022).
- Reichelt, M. E., Willems, L., Hack, B. A., Peart, J. N., Headrick, J. P. Cardiac and coronary function in the Langendorff-perfused mouse heart model. Exp Physiol. 94 (1), 54-70 (2009).
- Abel, R. M., Reis, R. L. Effects of coronary blood flow and perfusion pressure on left ventricular contractility in dogs. Circ Res. 27 (6), 961-971 (1970).
- Arnold, G., Morgenstern, C., Lochner, W. The autoregulation of the heart work by the coronary perfusion pressure. Pflugers Arch. 321 (1), 34-55 (1970).
- Iwamoto, T., Bai, X. J., Downey, H. F. Coronary perfusion related changes in myocardial contractile force and systolic ventricular stiffness. Cardiovasc Res. 28 (9), 1331-1336 (1994).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: Impact of ischemia and reperfusion length on infarct size and LDH release. J Cardiovasc Pharmacol Ther. 21 (3), 286-295 (2016).
- Headrick, J. P., Peart, J., Hack, B., Flood, A., Matherne, G. P. Functional properties and responses to ischaemia-reperfusion in Langendorff perfused mouse heart. Exp Physiol. 86 (6), 703-716 (2001).
- Noly, P. E., Naik, S., Tang, P., Lei, I. Assessment of ex vivo murine biventricular function in a Langendorff model. J Vis Exp. (190), e64384 (2022).
- Garcia-Manzano, A., Gonzalez-Llaven, J., Lemini, C., Rubio-Poo, C. Standardization of rat blood clotting tests with reagents used for humans. Proc West Pharmacol Soc. 44, 153-155 (2001).
- Lewis, J. H., Van Thiel, D. H., Hasiba, U., Spero, J. A., Gavaler, J. Comparative hematology and coagulation: Studies on rodentia (rats). Comp Biochem Physiol A Comp Physiol. 82 (1), 211-215 (1985).
- Motayagheni, N. Modified Langendorff technique for mouse heart cannulation: Improved heart quality and decreased risk of ischemia. MethodsX. 4, 508-512 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten