Method Article
Rastreamento da fibrinólise de coágulos sanguíneos totais formados por alça de Chandler sob fluxo de cisalhamento em um modelo de trombólise in vitro
Neste Artigo
Resumo
Os ensaios de trombólise in vitro muitas vezes têm lutado para replicar as condições in vivo, seja no trombo modelo que está sendo digerido ou no ambiente em que a trombólise está ocorrendo. Aqui, exploramos como o acoplamento do loop de Chandler e do ensaio de fibrinólise de fluxo fluorométrico em tempo real (RT-FluFF) é usado para monitoramento de lise de coágulo de alta fidelidade, ex-vivo.
Resumo
O tromboembolismo e as complicações relacionadas são uma das principais causas de morbidade e mortalidade em todo o mundo e vários ensaios foram desenvolvidos para testar a eficiência dos medicamentos trombolíticos in vitro e in vivo. Há uma demanda crescente por modelos de coágulos in vitro fisiologicamente mais relevantes para o desenvolvimento de medicamentos devido à complexidade e ao custo associados aos modelos animais, além de sua frequentemente falta de traduzibilidade para a fisiologia humana. Fluxo, pressão e taxa de cisalhamento são características importantes do sistema circulatório, com coágulos formados sob fluxo exibindo morfologia e características de digestão diferentes dos coágulos formados estaticamente. Esses fatores geralmente não são representados em ensaios convencionais de digestão de coágulos in vitro , o que pode ter implicações farmacológicas que afetam as taxas de sucesso da tradução de medicamentos.
O ensaio defluorólise orométrica de Flowing (RT-FluFF) foi desenvolvido como uma plataforma de teste de trombólise de alta fidelidade que usa coágulos marcados com fluorescência formados sob fluxo de cisalhamento, que são então digeridos usando plasma circulante na presença ou ausência de agentes farmacêuticos fibrinolíticos. Modificar as taxas de fluxo das etapas de formação e digestão do coágulo permite que o sistema imite as condições arteriais, pulmonares e venosas em configurações experimentais altamente diversas. As medições podem ser feitas continuamente usando um fluorômetro em linha ou tomando pontos de tempo discretos, bem como uma medição convencional da massa do coágulo do ponto final. O ensaio RT-FluFF é um sistema flexível que permite o rastreamento em tempo real da digestão do coágulo sob condições de fluxo que representam com mais precisão as condições fisiológicas in vivo, mantendo o controle e a reprodutibilidade de um sistema de teste in vitro.
Introdução
As doenças decorrentes fundamentalmente de etiologias tromboembólicas apresentam uma importante fonte de morbidade e mortalidade na sociedade atual. As manifestações da patogênese tromboembólica incluem, mas não estão limitadas a, infartos do miocárdio, acidentes vasculares cerebrais isquêmicos, tromboses venosas profundas e embolia pulmonar1. Uma enorme quantidade de pesquisas em andamento, abrangendo várias disciplinas, gira em torno do desenvolvimento de métodos seguros e eficazes para lidar com a trombose patogênica. Variações nas manifestações arteriais e venosas da trombose e localizações anatômicas variadas resultaram no desenvolvimento de diferentes abordagens de tratamento. No entanto, o tratamento agudo geralmente depende do uso de trombólise farmacológica via ativadores de plasminogênio com potencial para trombectomia mecânica em certas circunstâncias clínicas2.
O desenvolvimento de novas estratégias de tratamento farmacológico depende fundamentalmente de modelos animais in vivo e modelos de digestão in vitro para testes pré-clínicos 3,4. Os modelos in vivo se beneficiam naturalmente de sua capacidade de capturar a complexa interação de vários parâmetros fisiológicos na eficácia do tratamento, que incluem a depuração de agentes farmacêuticos, bem como interações celulares com medicamentos. No entanto, essa mesma complexidade geralmente torna esses modelos bastante caros e introduz problemas adicionais ao tentar isolar a farmacodinâmica / cinética subjacente em animais que diferem significativamente da fisiologia humana. O desenvolvimento de modelos in vitro ajudou a facilitar um ambiente de teste destilado no qual o desenvolvimento e a triagem de medicamentos podem ser realizados, mas muitas vezes carecem da fidelidade necessária para recapitular o estado da doença que está sendo estudado.
Protocolos in vitro comumente encontrados para testar novos trombolíticos dependem da utilização de coágulos formados e lisados sob condições estáticas, em que a massa residual do coágulo serve como desfecho primário 5,6. Infelizmente, essas técnicas não levam em conta os aspectos mecânicos da lise do coágulo, como fluxo turbulento e quedas de pressão transtrombo, que podem alterar significativamente a farmacodinâmica dos medicamentos em teste. Além disso, os coágulos formados sob condições estáticas contêm microarquitetura que difere dos coágulos fisiológicos. A presença de cisalhamento durante a formação do coágulo demonstrou reprodutivelmente afetar as características do coágulo resultante, como ativação plaquetária e reticulação da fibrina. Os coágulos produzidos sob fluxo de cisalhamento exibem heterogeneidade complexa da ponta à cauda que está ausente em coágulos formados estaticamente 7,8. Tais desvios da arquitetura fisiológica do coágulo podem afetar a importante caracterização do desenvolvimento de medicamentos que inclui a penetração do medicamento dentro de um trombo e a subsequente eficiência da lise9.
Para abordar algumas dessas limitações associadas ao uso de modelos estáticos de coagulação / lise de coágulo, a adoção da alça de Chandler para formação de coágulos e lise de coágulos na presença de cisalhamento ressurgiu10. Embora tais sistemas permitam uma melhor representação da dinâmica do fluxo e gerem coágulos com arquitetura fisiologicamente mais relevante em comparação com ensaios relativamente estáticos, suas condições de fluxo simplificadas ainda representam um desvio das condições fisiológicas. Por fim, abordagens microfluídicas também foram realizadas devido à sua facilidade de imagem e padrões de fluxo uniformes; no entanto, eles permanecem uma remoção significativa das condições fisiológicas esperadas dentro dos vasos maiores afetados principalmente na maioria dos distúrbios tromboembólicos clinicamente relevantes 11,12.
Com a discussão acima em mente, desenvolvemos um modelo de trombólise in vitro de alta fidelidade para triagem pré-clínica de drogas trombolíticas. O modelo visa abordar algumas das armadilhas atuais detalhadas acima no domínio da nova triagem de terapia trombolítica e foi validado quanto à reprodutibilidade e sensibilidade em concentrações variadas de ativador de plasminogênio tecidual (tPA). O sistema aqui descrito oferece fluxos de cisalhamento fisiológicos utilizando uma bomba peristáltica, um amortecedor de pressão, um reservatório aquecido, dois sensores de pressão, um fluorômetro em linha e um análogo de coágulo formado por cisalhamento de Chandler marcado com fluorescência para facilitar o rastreamento em tempo real da fibrinólise13. Em conjunto, o sistema geral é chamado de Ensaio de Fibrinólise de Fluxo Fluorométrico em Tempo Real (RT-FluFF Assay)14 e este manuscrito discutirá os meandros da configuração e execução bem-sucedidas de ensaios neste modelo de trombólise in vitro de alta fidelidade.
Protocolo
Todos os métodos mencionados abaixo estão de acordo com os protocolos do conselho de revisão institucional (IRB) e do comitê institucional de ética em pesquisa humana. Todos os voluntários saudáveis forneceram consentimento informado e por escrito antes da doação de sangue. É importante observar que todos os materiais referenciados no protocolo podem ser encontrados na Tabela de Materiais. Embora o WB e o plasma humanos sejam discutidos ao longo deste protocolo, o uso de sangue animal de pesquisa e produtos sanguíneos com fator depletado pode ser comprado e substituído.
1. Coleta de sangue total
- Colete sangue total venoso (WB) de voluntários saudáveis consentidos usando técnicas padrão de flebotomia.
CUIDADO: Certifique-se de que as precauções universais sejam seguidas para reduzir o risco de contato com sangue ou outros materiais potencialmente infecciosos em todo este protocolo. O uso de luvas, jaleco e protetor facial são necessários. - Colete ~ 50 mL de WB diretamente em tubos de citrato de sódio a 3,2% e agrupe imediatamente em tubos de 50 mL para uso subsequente.
NOTA: Um tubo de descarte antes da coleta de sangue no tubo de citrato é necessário, além de garantir que os tubos sejam preenchidos até o volume recomendado pelo fabricante. WB recém-coletado recapitulará melhor a dinâmica de coagulação do hospedeiro. O armazenamento de curto prazo de WB em temperatura ambiente (≤4 h antes do uso) é permitido. WB não é armazenado durante a noite, pois isso demonstrou afetar a dinâmica de coagulação quando examinado por tromboelastografia15.
2. Formação de coágulos
- Em 3 mL de sangue total citrato, adicione fibrinogênio marcado com fluorescência (isotiocianato de fluoresceína [FITC]) (FITC-Fg) a uma concentração final de 60 μg / mL (proporção de 1:50 fibrinogênio marcado com fluorescência para fibrinogênio não modificado assumindo uma concentração plasmática endógena de fibrinogênio de 3 mg / mL).
NOTA: Esta proporção pode ser aumentada para até 1:10 com impacto mínimo na morfologia do coágulo. 13,14 O fibrinogênio marcado com fluorescência pode ser comprado ou gerado pela reação do fibrinogênio com isotiocianato de fluoresceína (FITC). A mistura de fibrinogênio deve ser feita ≤5 minutos antes do início da corrida.- Se o fibrinogênio tiver sido previamente aliquotado e congelado, inspecione o FITC-Fg descongelado para garantir que a polimerização não tenha começado prematuramente, tornando-o inutilizável (certifique-se da ausência de partículas ou fibras na solução).
- Preparar a configuração do laço de Chandler com um tambor de 120 mm de diâmetro em banho-maria a 37 °C (figura 1). Certifique-se de que o dispositivo de loop de Chandler seja capaz de girar a uma taxa de rotação fixa de 0-90 rpm durante todo o processo de formação do coágulo.
NOTA: Configuração e modificações adicionais do loop de Chandler podem ser encontradas em Zeng et al.16. - Corte a tubulação (diâmetro interno 5/32", diâmetro externo 7/32") e forme laços que se encaixem firmemente, mas não firmemente ao redor do tambor. Para o tamanho de tubo recomendado discutido aqui, corte um tubo PCR padrão de 200 μL para uso como encaixe para conectar as extremidades do tubo para formar o circuito fechado.
NOTA: Diferentes tamanhos de tubos podem ser utilizados para produzir coágulos de tamanhos diferentes16. - Inicie a coagulação do sangue adicionando 200 mM de solução de cloreto de cálcio na proporção de 1:17 de solução de cálcio ao sangue total. Carregue o sangue no tubo (preencha ~ 50% do volume do tubo) usando uma seringa de 3 mL. Coloque imediatamente o laço no tambor de laço Chandler conectando as extremidades e comece a rotação.
- Garanta a mistura adequada com uma inversão suave antes do carregamento para evitar problemas decorrentes do assentamento dos componentes WB.
- Certifique-se de que uma quantidade igual de sangue seja adicionada a cada tubo a cada corrida, pois isso pode afetar o tamanho do coágulo se não for mantido consistente.
- Como as bolhas dentro da coluna de sangue também podem afetar a coagulação do sangue, remova-as movendo suavemente o tubo de maneira semelhante a uma "gangorra" para facilitar a fuga das bolhas antes de carregá-las no tambor.
- Gire o tambor parcialmente submerso no banho-maria a uma taxa de rotação de 40 RPM para atingir uma taxa de cisalhamento calculada de ~ 450 s-1.
NOTA: Consulte Zeng et al. para obter informações sobre tesouras calculadas com base no tamanho da tubulação e na velocidade de rotação (20 a 60 RPM)16. As taxas de cisalhamento venoso e arterial típicas são 20-200 s-1 e 300-1.000 s-1, respectivamente, com ~ 400-500 s-1 sendo representativos da artéria pulmonar. - Deixe os coágulos se formarem por 40-60 min em condições de pouca luz para minimizar o fotobranqueamento do fibrinogênio marcado com fluorescência.
- Depois que o tempo de coagulação desejado for atingido, remova os coágulos da tubulação e use-os imediatamente. Para garantir a remoção suave dos coágulos sem comprometer a estrutura, inverta suavemente o tubo para permitir que o coágulo deslize lentamente para fora do tubo para um pequeno recipiente.
NOTA: O armazenamento de coágulos formados em plasma citrato ou PBS durante a noite a 4 °C pode afetar a análise subsequente da digestão do coágulo no circuito de fluxo.
3. Configuração do instrumento RT-FluFF
- Certifique-se de que o aparelho de loop de fluxo esteja conectado conforme mostrado na Figura 2 e que todas as conexões estejam seguras. Em suma, o aparelho de loop de fluxo inclui, na ordem da direção do fluxo: Bomba > Amortecedor > Sensor de Pressão de Entrada > Coágulo > Sensor de Pressão de Saída > Fluorômetro > Reservatório Aquecido > Bomba. Ajuste a seleção da capacidade da bomba, vazão experimental, diâmetro e comprimento da tubulação, temperatura, volume do reservatório e tamanho/geometria do coágulo para atender às necessidades experimentais exclusivas de cada estudo.
NOTA: Para este exemplo, a tubulação de mesmo diâmetro usada no loop de Chandler foi usada para RT-FluFF. A tubulação pode ser usada para várias execuções no mesmo dia, mas precisa ser monitorada quanto a degradação ou vazamento e trocada/enxaguada conforme necessário. Recomenda-se o enxágue com água destilada morna entre as corridas. Dependendo do projeto experimental, pode ser necessário substituir a tubulação após cada execução. - Assim que toda a tubulação estiver presa, ligue o monitor de pressão. Verifique se o monitor de pressão lê 0 mmHg para os sensores de entrada e saída. Caso contrário, abra as válvulas para garantir que os sensores de pressão estejam abertos à pressão atmosférica e zere os sensores.
- Ligue o bloco de aquecimento ou banho-maria que está sendo usado e monitore a temperatura ao longo do experimento. Mantenha a temperatura próxima a 37 °C para imitar a temperatura fisiológica do corpo humano.
- Ligue a bomba na vazão desejada para verificar se há vazamentos e verificar se os sensores de pressão estão funcionando.
NOTA: Uma taxa de fluxo de ~ 160 mL / min neste tamanho de tubulação representará uma taxa de cisalhamento de ~ 500 s-1. - Desligue a bomba para facilitar o carregamento do coágulo.
4. Carregando o coágulo no circuito de fluxo
- Se um coágulo feito anteriormente que foi armazenado estiver sendo usado, certifique-se de levar o coágulo à temperatura ambiente antes de carregá-lo no sistema de loop de fluxo.
- A perda de massa do coágulo é uma importante medida de desfecho para ensaios de trombólise. É uma prática recomendada medir a massa do coágulo antes de carregá-lo no circuito de fluxo, em vez de confiar em medições anteriores.
- As medições da massa do coágulo devem sempre ser feitas da mesma maneira todas as vezes para garantir a consistência entre as amostras e os dias de ensaio, pois o conteúdo líquido dentro e sobre os coágulos pode afetar significativamente sua massa. A melhor prática é secar suavemente os coágulos nos lenços de laboratório até que eles não liberem mais uma quantidade significativa de líquido no lenço, tomando cuidado para não comprimir o coágulo durante o processo de medição.
- Mergulhe o coágulo no plasma (autólogo ou com correspondência de tipo) ou outra solução de fase móvel usada no circuito de fluxo (como PBS ou meio definido) em um recipiente raso, como um prato de pesagem. A solução em fase móvel deve ser retirada diretamente do reservatório do sistema de 50 mL para controlar o volume total do sistema. Nenhum agente de teste trombolítico ou farmacêutico deve estar presente durante o estágio de carga do coágulo. Recomenda-se que o volume total da fase móvel para executar o loop de fluxo seja de ≥50 mL e deve ser consistente em todas as amostras.
- Remova a seção central da tubulação do loop de fluxo (entre os sensores de entrada e saída) e conecte uma seringa de 10 mL a uma extremidade da tubulação.
- Usando a extremidade livre do tubo, coloque-o no plasma (ou fase móvel) e pegue um pequeno volume da solução para preparar o tubo. Em seguida, coloque a entrada do tubo perto do coágulo, examinando cuidadosamente o coágulo para identificar a cabeça (normalmente a extremidade ligeiramente mais grossa do coágulo) e a cauda (extremidade oposta à cabeça). A cabeça do coágulo deve ser posicionada em direção ao sensor de pressão de entrada e longe da saída. Coloque o tubo na extremidade da "cauda" do coágulo e aspire-o para dentro do tubo com a seringa.
NOTA: nos casos em que a direcionalidade da cabeça/cauda do coágulo não pode ser determinada visualmente, a direcionalidade pode ser melhor atribuída com base no conhecimento da direção de rotação do loop de Chandler - a cabeça do coágulo está voltada para a direção oposta da rotação do tambor. - Conecte a tubulação de volta ao aparelho principal de forma que o coágulo fique mais próximo do sensor de pressão de saída (a cabeça do coágulo deve estar voltada para longe do sensor de saída). Prenda o coágulo em sua posição perfurando o tubo e a cabeça do coágulo com duas agulhas de 30 G em um padrão "X". Deixe essas agulhas durante a corrida.
NOTA: Dependendo do dampener e das configurações da bomba, agulhas adicionais podem ser necessárias para garantir que o coágulo não se fragmente prematuramente. Se necessário, uma tela pode ser adicionada à tubulação a jusante do coágulo para evitar que fragmentos de coágulo circulem no sistema. Uma vez que um número definido de agulhas tenha sido estabelecido para reter o coágulo, mantenha-o consistente em todas as condições. - Pegue o restante da solução de fase móvel e coloque-o em um tubo de 50 mL como reservatório.
- Coloque o reservatório no banho-maria e coloque a tubulação de entrada e saída (a saída é do fluorômetro e a entrada vai para o cabeçote da bomba).
- Verifique se o fluorômetro que está sendo usado está conectado e monitorado. Verifique se o valor inicial é apropriado em comparação com uma linha de base do sistema somente de fase móvel no início do experimento.
NOTA: Se um fluorômetro em linha não estiver disponível, a amostragem periódica em série do reservatório pode ser realizada em intervalos definidos durante todo o período de análise do loop de fluxo. As frações coletadas podem ser lidas usando uma placa de 96 poços imediatamente após a conclusão do experimento em qualquer espectrofotômetro disponível comercialmente. - Adicione 500 μL de 100.000 ng/mL de tPA diretamente ao volume do reservatório para atingir uma concentração final de 1.000 ng/mL de tPA em 50 mL. O volume, a concentração e o medicamento específico adicionado dependerão da concentração circulante desejada e do volume do reservatório do sistema.
- Verifique o seguinte antes de ligar a bomba:
- Todos os cruzamentos são seguros.
- As duas válvulas acima dos sensores de pressão estão na posição fechada apropriada.
- Qualquer plasma residual (ou fluido) foi reposto no reservatório.
- O trombolítico foi adicionado ao reservatório e devidamente misturado.
- A tubulação de entrada está perto do fundo do reservatório (isso garante bolhas mínimas).
- A tubulação de saída está segura e na altura apropriada para a pressão desejada (dependendo da localização do vaso que está sendo modelada).
- O sentido de rotação da bomba está correto (Ordem de fluxo: Bomba > Dampener > Coágulo > Fluorômetro > Reservatório > Bomba).
- Se as RPMs da bomba forem muito altas (>150 rpm), comece em uma velocidade mais lenta e aumente para garantir que a rápida mudança de pressão não fragmente o coágulo ou cause vazamento na tubulação.
- Certifique-se de que o sistema esteja registrando os dados adequadamente do fluorômetro e/ou que os suprimentos estejam preparados para amostragem periódica da fase móvel para leituras de ponto de tempo pós-experimento.
- Ligue a bomba e ajuste-a para atingir a vazão volumétrica desejada de 160 mL/min ou aumente a vazão até que a pressão desejada seja alcançada. O sistema se encherá de fluido e bolhas. As bolhas aumentarão artificialmente as leituras fluorométricas, portanto, observe se as bolhas se dissiparem. Quando o fizerem, apague as luzes e comece a aquisição de dados.
- Deixe a bomba funcionando até que o coágulo esteja significativamente degradado ou o tempo experimental desejado tenha decorrido (≥60 min). Adicione reagentes, conforme necessário, ao sistema durante todo o experimento através do reservatório para criar condições experimentais únicas testando uma variedade de variações trombolíticas.
NOTA: O tempo experimental dependerá da vazão da bomba (nível de cisalhamento) e da concentração de trombolítico. - Uma vez concluído o ensaio, reduza a vazão volumétrica e remova a tubulação de entrada enquanto a bomba ainda estiver funcionando para empurrar a maior parte do fluido do sistema para o reservatório (alguma fase móvel permanecerá na tubulação). Desconecte a seção da tubulação contendo coágulo no lado do sensor de pressão de saída da tubulação e abaixe-a em um barco de pesagem.
- Remova as agulhas que prendem o coágulo no lugar para coletar o fluido remanescente de dentro do sistema e os fragmentos do coágulo/coágulo. Use uma seringa para ajudar a limpar o sistema conforme necessário.
- Pesar e processar o coágulo restante para análise adicional, como o cálculo da porcentagem de massa perdida ou para histologia.
5. Limpando o sistema
- Entre as amostras, enxágue todo o sistema com água morna em alta rotação (>150 rpm). Carregue a água no reservatório e passe pelo sistema por pelo menos 2 min, esvazie e corra novamente para dois enxágues completos do sistema. Após esses enxágues, se a leitura do fluorômetro não retornar à linha de base, repita o processo de enxágue por um ciclo adicional. Se ainda não tiver retornado à linha de base, troque completamente a tubulação antes de analisar a próxima amostra.
NOTA: Durante os experimentos, a tubulação pode ser reutilizada entre as amostras; No entanto, devido à perfuração com agulhas usadas para manter o coágulo no lugar, a seção da tubulação entre os sensores de pressão de entrada e saída deve ser substituída após cada execução. Em algumas condições experimentais, pode ser necessário substituir todo o conjunto de tubos após cada execução ou ensaios de agrupamento para eliminar qualquer contaminação cruzada da amostra. - Depois que todas as amostras tiverem sido executadas para a experimentação daquele dia, remova todos os tubos e descarte. Esfregue as junções em T com água quente e uma escova de cerdas até ficarem limpas e deixe secar e enxágue a seringa dampeners com água quente. Use 70% de EtOH para ajudar na esterilidade.
Resultados
Formação de coágulo de alça de Chandler
Na formação de coágulos, geralmente buscamos quadruplicados para garantir que, se existissem outliers de coágulos (com base na morfologia bruta e na massa), ainda tivéssemos a capacidade de executar ensaios de trombólise triplicada. Assumindo condições ideais de carga, os coágulos devem ser todos bastante uniformes em comprimento (~ 3,3 cm), peso (~ 100 mg) e aparência, conforme representado na Figura 3. Ao empregar o FITC-Fg, também pretendemos examinar coágulos sob luz ultravioleta para garantir uma dispersão relativamente uniforme da fluorescência em oposição a áreas irregulares de marcação hiperfluorescente dentro do coágulo. Variar o grau de FITC-Fg no sangue total não deve alterar o peso ou a aparência dos coágulos dentro de nossas concentrações exploradas; no entanto, a arquitetura do micro coágulo foi impactada nas concentrações mais altas de FITC-Fg (1:5 FITC-Fg para Fg não modificado). Trabalhos anteriores feitos por Zeng et al. captura a ampla gama de fenótipos de coágulos esperados na alça de Chandler, dependendo do nível de cisalhamento escolhido16.
Às vezes, pode ocorrer coagulação aberrante. Os problemas mais comuns de formação de coágulos se enquadram em uma das duas categorias: (i) coagulação prematura e (ii) coagulação prejudicada. Na coagulação prematura, todo o volume de sangue se solidifica dentro do tubo de alça de Chandler. Isso se tornará aparente quando a rotação do tambor for ligada, pois o sangue não "fluirá", mas grudará nas paredes do tubo e girará em uníssono. Em tais circunstâncias, esses coágulos não são utilizáveis e devem ser descartados. Para evitar isso, certifique-se de que, uma vez ativada a coagulação com a adição de cloreto de cálcio, o circuito seja imediatamente fechado e colocado no tambor rotativo para que a coagulação ocorra. A segunda circunstância, ou coagulação prejudicada, ocorre quando as amostras não foram adequadamente misturadas ou se o sangue começou a coagular antes do início da rotação, mas não tão significativa quanto na circunstância (i). Coágulos com os problemas acima tendem a parecer fibrosos e frágeis quando manuseados e geralmente têm massas de coágulos significativamente elevadas. Fenotipicamente, eles se aproximam de coágulos observados em cisalhamentos venosos muito baixos, pois isso representa essencialmente a coagulação no cenário de estase. Coágulos irregulares devem ser esperados ocasionalmente e descartados.
Calibração do fluorômetro RT-FluFF
Uma característica importante do sistema RT-FluFF é o fluorômetro, ou espectrofotômetro, usado para rastrear a trombólise durante o período de digestão do coágulo decorrido. Antes de qualquer experimento ser executado, é fundamental garantir o funcionamento adequado do fluorômetro, ou espectrofotômetro. Para nossos propósitos, uma vez que projetamos nosso fluorômetro especificamente para o aparelho RT-FluFF, precisávamos garantir que ele se correlacionasse bem com o espectrofotômetro na presença de quantidades conhecidas de diluições FITC-Fg em uma solução estática (Figura 4A). Uma vez que fomos capazes de determinar com confiança a faixa linear de nosso fluorômetro, em seguida visamos ver como o fluorômetro se comportaria na presença de fluxo. Verificamos a funcionalidade injetando fluoresceína de forma incremental na solução de fluxo para monitorar um aumento gradual na fluorescência para entender melhor a reprodutibilidade da leitura do fluorômetro e determinar a rapidez com que a fluorescência se equilibrou dentro do sistema de fluxo ( Figura 4B ). Experimentos de acompanhamento foram realizados injetando constantemente fluoresceína e FITC-Fg na solução de maneira contínua para melhor imitar a liberação fluorescente contínua esperada dos experimentos de fibrinólise ( Figura 4C ). Acredita-se que as diferenças na inclinação representadas entre FITC-Fg e FITC surjam dos efeitos da têmpera que ocorre quando o FITC é conjugado próximo a si mesmo, como quando muitas moléculas de FITC são conjugadas a uma única proteína (fibrinogênio neste caso). Naturalmente, os aumentos e inclinações graduais serão diferentes não apenas com base nas concentrações de FITC / FITC-Fg utilizadas, mas também no número de moléculas de FITC por fibrinogênio. Por extensão, torna-se fundamental controlar o grau de conjugação de FITC para fibrinogênio ao realizar experimentos utilizando o RT-FluFF se a esperança for comparar dados em vários lotes de coágulos. Por meio de extensa experimentação, descobrimos que ~ 14 conjugações FITC por fibrinogênio fornecem um bom sinal fluorescente para rastrear a digestão do coágulo, permanecendo estáveis em solução (agregação prematura limitada) e com impacto mínimo na microestrutura do coágulo resultante. É importante notar que sempre que o FITC-Fg puro e não coagulado é executado através do aparelho RT-FluFF, a exposição do FITC-Fg a alto cisalhamento pode promover sua agregação. Este fenômeno é mais frequentemente observado nas junções das conexões da tubulação e dentro da tubulação do cabeçote da bomba e, com o tempo, pode afetar a fluorescência disponível na solução.
Ao coletar amostras do loop de fluxo em pontos de tempo discretos para ler a fluorescência em um espectrofotômetro, muitas dessas considerações associadas à calibração do fluorômetro não são necessárias. No entanto, ainda é necessário explorar a faixa dinâmica do espectrofotômetro específico que está sendo utilizado para garantir a marcação FITC-Fg, a quantidade de FITC-Fg no coágulo formado pela alça de Chandler e o tamanho do coágulo são todos otimizados em seu sistema. Recomenda-se que as amostras sejam lidas imediatamente após o isolamento do sistema ou colocadas em uma placa de 96 poços para leituras multiplex após a conclusão do experimento. Se necessário, as amostras podem ser acidificadas diretamente após a coleta para eliminar a atividade enzimática adicional antes de serem analisadas.
Lise de coágulo RT-FluFF
Para validar o sistema RT-FluFF utilizando coágulos formados sob cisalhamento arterial na alça de Chandler, empregamos plasma humano como fase móvel no aparelho com tPA (Alteplase) como agente fibrinolítico. As concentrações de tPA exploradas variaram de 0 a 1.000 ng/mL. Para imitar as condições de fluxo pulmonar humano, a temperatura do reservatório de plasma foi mantida a 37 ° C e fisicamente elevada a 8 cm acima do nível do coágulo para dar uma pressão de fluxo média de 12 mmHg com a taxa de bomba ajustada para gerar um fluxo de cisalhamento de ~ 500 s-1 na ausência de coágulo. Amortecedores de fluxo pulsátil foram adicionados ao sistema para garantir uma variação mínima entre as pressões de pico e vale da bomba peristáltica para atingir uma taxa de cisalhamento quase constante (Figura 4D). Na ausência de um amortecedor de pressão, a pressão de saída da bomba peristáltica flutua significativamente devido à natureza de como ela produz fluxo ejetando pequenos pacotes de líquido através do sistema à medida que o cabeçote da bomba gira. A lise do coágulo foi observada ao longo de 60 minutos. Como esperado, o aumento das concentrações de tPA aumentou as taxas de lise do coágulo (RFU/minuto) e aumentou a perda de massa em comparação com condições com menos ou nenhum tPA. A uma concentração de tPA de 1.000 ng/mL, ~ 85% de lise do coágulo foi alcançada em um período de digestão de 60 minutos. Examinando imagens macroscópicas de coágulos submetidos a lise, pode-se apreciar que a lise ocorrerá principalmente nas regiões da cauda do coágulo antes de impactar a cabeça mais densamente estruturada, como visto tanto pela degradação física da arquitetura do coágulo quanto pela perda de fluorescência da superfície. O alongamento esperado dos coágulos também ocorrerá com base na perda de integridade mecânica ao longo do tempo de maneira dependente da taxa de cisalhamento.
Embora diferenças significativas nas taxas de lise do coágulo possam ser apreciadas, grosseiramente e com base na liberação de fluorescência, não há correlação perfeitamente linear entre a liberação de fluorescência e a quantidade de fibrinolítico presente. Isso é melhor apreciado na Figura 5. A fibrinólise em coágulos à base de WB leva naturalmente à liberação não apenas de fragmentos de FITC-Fg, mas também de glóbulos vermelhos (RBCs) que ficam presos nas redes de fibrina durante a formação do coágulo. A liberação dessas hemácias em circulação dentro do aparelho RT-FluFF começará a tingir visivelmente o plasma circulante de vermelho como resultado. Essa mudança colorimétrica no plasma circulante pode afetar negativamente a emissão fluorescente do FITC-Fg circulante que está sendo lido pelo sensor do fluorômetro. À medida que as concentrações fibrinolíticas atingem os limites superiores, o grau de liberação de FITC-Fg na solução supera os efeitos das hemácias nas emissões de fluorescência.

Figura 1: Representação esquemática da configuração do Chandler Loop. Os tubos cheios de sangue carregados no tambor de loop Chandler são submersos em banho-maria a 37 °C durante todo o processo de formação do coágulo com as luzes apagadas. O tambor é girado a uma taxa de rotação constante por meio de um motor DC, eixo de acionamento e placa de controle. Esta figura foi modificada de Zeng et al14. Clique aqui para ver uma versão maior desta figura.

Figura 2: Representação esquemática do sistema RT-FluFF. Componentes importantes do sistema são identificados na imagem. Um único amortecedor de grande volume é retratado na imagem para minimizar as pulsações no fluxo associadas ao uso de uma bomba peristáltica. Na ausência de um fluorômetro em linha, duas opções adicionais para amostragem periódica incluem: 1) amostragem diretamente do reservatório; ou 2) incorporando uma porta de amostragem em linha para extrair a fase móvel. Esta figura foi modificada de Zeng et al14. Abreviatura: RT-FluFF = Ensaio de Fibrinólise de Fluxo Fluorométrico em Tempo Real. Clique aqui para ver uma versão maior desta figura.

Figura 3: Características do coágulo WB marcado com FITC-Fg da alça de Chandler macroscópica, incluindo massa e aparência física sob luz ambiente e UV. (A) A formação consistente de coágulos sob diversas condições de coagulação é alcançável por meio do ajuste fino do protocolo de formação de coágulos de alça de Chandler. É importante observar que as massas e aparências do coágulo variam significativamente dependendo do diâmetro do tubo, da velocidade de rotação e do tempo de formação do coágulo. Os coágulos retratados foram formados a 37 ° C por 1 h a uma taxa de cisalhamento de 506 s-1. Barras de escala = 20 mm. (B) Massas de coágulos formados na alça de Chandler utilizando as respectivas proporções de FITC-Fg. Os dados representam a média ± desvio padrão para pontos de dados maiores ou iguais a triplicados. Esta figura foi modificada de Zeng et al14. Abreviaturas: FITC-Fg = fibrinogênio marcado com isotiocianato de fluoresceína; WB = sangue total. Clique aqui para ver uma versão maior desta figura.

Figura 4: Caracterização do fluorômetro. (A) Comparação do fluorômetro em linha RT-FluFF com um espectrofotômetro no contexto de quantidades conhecidas de diluições FITC-Fg. (B) Introdução gradual de fluoresceína no sistema RT-FluFF para determinar a reprodutibilidade do fluorômetro e o tempo de equilíbrio de fluorescência no plasma humano em fluxo. (C) Infusões contínuas comparando fluoresceína e FITC-Fg na plataforma RT-FluFF. As diferenças na inclinação provavelmente decorrem da extinção por fluorescência no grupo FITC-Fg. (D) Formas de onda do sensor de pressão de saída (pós-coágulo) associadas ao uso de amortecedores de tamanhos diferentes sob as mesmas condições de vazão volumétrica. Esta figura foi modificada de Zeng et al14. Abreviaturas: FITC-Fg = fibrinogênio marcado com isotiocianato de fluoresceína; RT-FluFF = Ensaio de Fibrinólise de Fluxo Fluorométrico em Tempo Real. Clique aqui para ver uma versão maior desta figura.
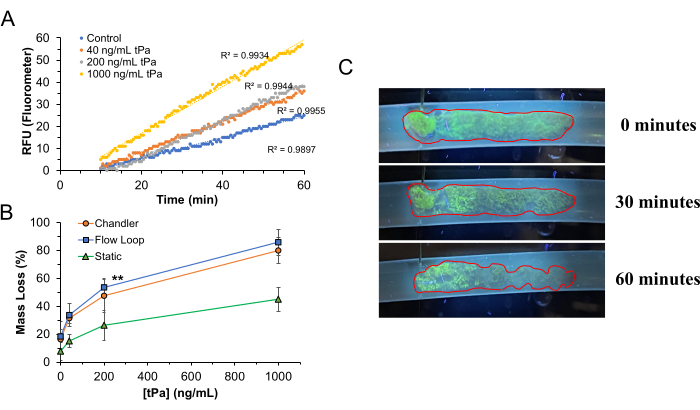
Figura 5: Trombólise na plataforma RT-FluFF. (A) Inclinações representativas de fluorescência aumentam ao longo de 60 minutos de digestão do coágulo na presença de tPA circulante. Observe o tempo de atraso inicial da trombólise, pois a ativação do plasminogênio e da digestão do coágulo por tPA não é instantânea. (B) Porcentagem de massa de coágulo perdida em várias concentrações de tPa e modalidades variadas de trombólise que incluem: o sistema RT-FluFF, digestão de coágulos de alça de Chandler sob cisalhamento constante e digestão estática (sem cisalhamento) de coágulos. Os dados representam a média ± desvio padrão para pontos de dados maiores ou iguais a triplicados com asteriscos duplos denotando um valor de p < 0,01 e asteriscos triplos significando um valor de p < 0,001. (C) Características macroscópicas da trombólise a 200 ng/mL de tPA. Essa figura foi modificada a partir de Zeng et al.14. Abreviaturas: RT-FluFF = Ensaio de Fibrinólise de Fluxo Fluorométrico em Tempo Real; tPA = ativador do plasminogênio tecidual. Clique aqui para ver uma versão maior desta figura.
Discussão
Formação e rotulagem de coágulos
A alça de Chandler demonstrou fornecer um meio fácil e eficaz de gerar coágulos de forma reprodutível que imitam trombos in vivo 16. Parâmetros de ajuste fino, como tamanho da tubulação, velocidades de rotação, diâmetro do tambor e tempo de coagulação, permitem a rápida geração de coágulos sob diferentes condições de cisalhamento que podem capturar características arquitetônicas apreciadas em uma variedade de trombos que imitam fontes arteriais e venosas. A flexibilidade adicional de poder introduzir marcadores como o FITC-Fg expande os usos potenciais desses trombos, como demonstramos no sistema RT-FluFF. Por mais rudimentares que sejam os princípios subjacentes da alça de Chandler, permanece uma curva de aprendizado inicial íngreme associada à formação consistente de coágulos, ao mesmo tempo em que lida com sangue e hemoderivados durante todo o processo de formação de coágulos. Isso decorre do fato de que a coagulação do WB é extremamente sensível ao manuseio nos momentos anteriores e posteriores ao início da coagulação. De particular importância é a seleção do tubo usado durante a etapa de formação do coágulo na alça de Chandler, pois as interações da superfície sanguínea podem afetar a progressão da formação do coágulo. A tubulação deve ser de grau médico ou cirúrgico (não pirogênica e não hemolítica) exibindo baixa biorreatividade. Conforme discutido em nossos resultados, a variação nos coágulos formados é esperada nas fases iniciais de aprendizado da técnica, enquanto se desenvolve o fluxo de trabalho ideal com base na escala experimental e modificações únicas do ensaio. A eventual obtenção da reprodutibilidade é fundamental, dado o impacto da arquitetura do coágulo no comportamento de um coágulo quando submetido à fibrinólise. Por fim, a variação na coagulação, mesmo entre voluntários saudáveis, também é esperada e deve ser levada em consideração durante o projeto experimental.
Ensaio RT-FluFF
A quantificação fluorométrica/espectrofotométrica da fibrinólise com FITC-Fg como marcador oferece inúmeros benefícios em relação às técnicas clássicas que se basearam principalmente na avaliação da massa do coágulo final. A capacidade de monitorar, em tempo real ou quase em tempo real, a dinâmica da fibrinólise em um ambiente que se aproxima dos parâmetros fisiológicos de fluxo representa uma melhoria significativa em relação aos ensaios tradicionais de triagem de drogas fibrinolíticas. Este ensaio foi intencionalmente projetado na escala apresentada para se assemelhar mais de perto aos tamanhos de coágulos, campo de fluxo, taxa de fluxo volumétrico e carga de massa de coágulos clinicamente relevantes, em vez de adotar uma abordagem microfluídica totalmente miniaturizada. Reduzir o aparelho RT-FluFF significaria que tubos de diâmetro menor e/ou distâncias mais curtas de tubos teriam que ser utilizados. Como resultado, o sistema começaria a se desviar dos padrões de fluxo desejados e da relevância fisiológica. Semelhante ao loop de Chandler, o sistema RT-FluFF permite o controle de parâmetros como taxa de cisalhamento, modulando as pressões de fluxo sob fluxo constante e controle sobre qual meio de fluxo é utilizado. Além disso, o sistema RT-Fluff também pode acomodar fluxo pulsátil e geometrias exclusivas de digestão de coágulos, permitindo a amostragem periódica da fase móvel durante todo o processo de digestão, o que não é possível em um circuito de Chandler devido à sua configuração de digestão fechada rotativa. O impacto desses parâmetros na lise do coágulo foi explorado em profundidade como parte de Zeng et al.14.
Juntos, os coágulos formados em alça de Chandler e o tubo de ensaio RT-FluFF podem ter o mesmo diâmetro ou variar nas etapas de formação e digestão do coágulo para atingir diferentes níveis de oclusão, modelando até a oclusão quase total do vaso para imitar o tromboembolismo. Todos os ensaios aqui descritos utilizaram o mesmo diâmetro de tubulação tanto no circuito de Chandler quanto no sistema RT-FluFF. Com o aumento do diâmetro da tubulação no sistema RT-FluFF, o volume do reservatório de fase móvel pode precisar ser aumentado para acomodar o volume adicional necessário para encher o sistema. Aumentar o volume do reservatório também pode aumentar a quantidade necessária de trombolítico / medicamento necessário para ser adicionado ao sistema e também aumentaria as necessidades de plasma ou fase móvel. Embora o uso de plasma autólogo seja ideal, seria necessário que quantidades extremamente grandes de sangue fossem retiradas de doadores individuais para acomodar a formação do coágulo da alça de Chandler e os volumes de fase móvel RT-FluFF em todos os ensaios e réplicas necessários para completar um experimento inteiro. Por esse motivo, o plasma combinado com o tipo de combinação adquirido de um centro de doação de sangue ou comprado de um fornecedor comercial era comumente empregado. Embora a tubulação geral do ensaio RT-FluFF possa ser encurtada até certo ponto, existem limitações de modo que todos os componentes tenham espaço suficiente para permanecer no circuito para executar os experimentos de digestão. De particular importância é a longa porção de tubulação utilizada a montante do próprio coágulo que precisa exceder um comprimento mínimo, calculado com base no diâmetro e na vazão da tubulação, de modo que o fluxo laminar seja alcançado no momento em que o fluxo atinge o coágulo suspenso. Independentemente da seleção do tamanho da tubulação, as mesmas considerações detalhadas na etapa de formação do coágulo de alça de Chandler também devem ser aplicadas à tubulação do sistema RT-FluFF. É importante reiterar que a tubulação entre os sensores de pressão, onde o coágulo formado pela alça de Chandler é fixado no lugar por meio de duas agulhas inseridas em um padrão "X", deve ser substituída após cada ensaio para evitar que vazamentos ocorram nos locais de punção da agulha. O uso de agulhas para manter o coágulo no lugar durante a digestão sob fluxo limita o agrupamento de coágulos e fornece recursos de orientação do coágulo em relação à direção do fluxo para melhorar a consistência ensaio a ensaio. Embora um único ensaio representativo de digestão de coágulos usando tPA seja descrito aqui, o ensaio de alça de Chandler e RT-FluFF fornece um alto grau de personalização para acomodar uma ampla variedade de estruturas de coágulos, moléculas repórteres, taxas de cisalhamento e condições de digestão para testar novos fibrinolíticos.
Limitações
Tal como acontece com qualquer uma das plataformas ou métodos atuais utilizados para rastrear medicamentos fibrinolíticos, o ensaio RT-FluFF também sofre de certas fraquezas que devem ser reconhecidas. Primeiro, os coágulos formados na alça de Chandler, embora exibam motivos comumente presentes em coágulos in vivo , ainda são formados em um ambiente diferente dos coágulos in vivo , onde existe o fluxo pulsátil e a interação com o endotélio17 Além disso, embora as concentrações de FITC-Fg tenham sido otimizadas para minimizar os efeitos na arquitetura do coágulo, a adição do fibrinogênio modificado ainda representa um afastamento das condições fisiológicas. A escolha do plasma em meio de fase móvel pode afetar o uso de um fluorômetro, pois haverá uma pequena quantidade de sinal de fundo associado ao conteúdo de proteínas e lipídios do plasma que pode variar de doador para doador. Uma limitação potencialmente significativa da configuração do RT-FluFF é o impacto negativo das hemácias nas leituras fluorométricas, o que restringe o uso de WB como uma fase móvel ao utilizar o FITC como um marcador fluorescente de digestão de coágulos. Um método viável para mitigar isso é introduzir uma etapa de centrifugação para grânulos eritrocitários antes de ler pontos de tempo discretos em um espectrofotômetro ou utilizar uma etiqueta repórter de digestão de coágulo diferente que seja menos afetada pela presença de hemácias18. Deve-se considerar cuidadosamente com base no projeto do ensaio para garantir que variáveis importantes sejam controladas. Por exemplo, se o plasma for a fase móvel de escolha, é melhor agrupar o plasma em muitos doadores para minimizar a coagulação de doador para doador e a variabilidade da fibrinólise. Por fim, como acontece com qualquer proteína marcada com fluorescência, a questão da extinção surge naturalmente devido à presença da marca FITC em relativa proximidade uma da outra na superfície do fibrinogênio19.
Conclusões e direções futuras
Estudar um processo dinâmico como a trombólise requer um ambiente igualmente dinâmico no qual as condições fisiológicas possam ser replicadas e vários parâmetros possam ser controlados simultaneamente. O sistema RT-FluFF de alta fidelidade preenche essa lacuna e servirá como uma ferramenta importante no futuro desenvolvimento e triagem de novos trombolíticos antes de sua tradução em modelos animais. O RT-FluFF é uma plataforma altamente versátil, com múltiplas habilidades que não foram discutidas aqui, mas certamente podem ser incorporadas aos protocolos, dependendo das necessidades exclusivas de design de medicamentos farmacêuticos, modo de ação ou replicação de diversos estados de doença de coagulação. Os benefícios que pudemos apreciar no sistema RT-FluFF são os seguintes: (a) geometrias e configurações variáveis da tubulação, (b) monitoramento de pressão em tempo real correlacionado ao grau de oclusão do lúmen, (c) medições de fluorescência em tempo real sem necessidade de intervenção do usuário, (d) duração do ensaio e flexibilidade da frequência da amostra, (e) uso de um reservatório para imitar condições in vivo , (f) padrões de fluxo de cisalhamento semelhantes in vivo , (g) opção para incluir fluxo pulsátil, (h) flexibilidade significativa na formação da alça de Chandler de análogos de coágulos representativos de doenças distintas, (i) a capacidade de testar os impactos do medicamento na formação ou digestão do coágulo, e (j) imagem direta do substrato do coágulo para rastrear a digestão do coágulo a granel através do tubo transparente, além disso, permite a pós-digestão, análise longitudinal de vídeo.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
A pesquisa relatada nesta publicação foi apoiada pelo Instituto Nacional do Coração, Pulmão e Sangue dos Institutos Nacionais de Saúde sob o Prêmio Número R01HL167877. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 30 G Disposable Hypodermic Needles | Exel International | 26439 | Other Consumables |
| 6 mm HSS Lathe Bar Stock Tool 150 mm Long | uxcell | B07SXGSQ82 | Chandler loop, |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Other Consumables, Non-treated acrylic copolymer, non-sterile |
| Air-Tite Luer-lock Unsterile 60 mL Syringes | Air-Tite | MLB3 | RT-FluFF Apparatus , dampeners |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Calcium Chloride | Millipore Sigma | C5670 | Other Consumables |
| Disposable BP Transducers | AD Instruments | MLT0670 | RT-FluFF Apparatus |
| Drager Siemans HemoMed Pod | Drager | 5588822 | RT-FluFF Apparatus |
| Drager Siemans Patient Monitor | Drager | SC 7000 | RT-FluFF Apparatus |
| Drum (cylinder, diameter 120 mm, width 85 mm) | Chandler loop, | ||
| Face Shield | Moxe | SHIELDS10 | Chandler loop, |
| Fibrinogen From Human Plasma, Alexa Fluor 488 Conjugate | Thermo Scientific | F13191 | Other Consumables |
| Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile | Masterflex | 30600-04 | RT-FluFF Apparatus |
| Fluorescein (FITC) | Thermo Scientific | 119245000 | Other Consumables |
| General-Purpose Water Bath | Thermo Scientific | 2839 | Chandler loop, |
| Hotplate 4 × 4 | Fisher Scientific | 1152016H | RT-FluFF Apparatus |
| Human Source Plasma Fresh-Frozen | Zen-Bio | SER-SPL | Other Consumables, CPDA-1 anticoagulant |
| Human Whole Blood | Zen-Bio | SER-WB-SDS | Other Consumables, CPDA-1 anticoagulant |
| L/S Easy-Load II Pump Head for High-Performance Precision Tubing, PPS Housing, SS Rotor | Masterflex | 77200-62 | RT-FluFF Apparatus, Pump Head |
| L/S Variable-Speed Digital Drive Pump with Remote I/O, 6 to 600 rpm; 90 to 260 VAC | Masterflex | 7528-10 | RT-FluFF Apparatus, Pump |
| Motor Speed Controller | CoCocina | ZK-MG | Chandler loop, |
| Nalgene Tubing T-Type Connectors | Thermo Scientific | 6151-0312 | RT-FluFF Apparatus |
| Peristaltic pump tubing | Masterflex | 06424-15 | Other Consumables |
| Phosphate buffered saline | Millipore Sigma | P3813 | Other Consumables, Powder, pH 7.4, for preparing 1 L solutions |
| Switching Power Supply | SoulBay | UC03U | Chandler loop, |
| Thermo Scientific National Target All-Plastic Disposable Syringes 10 mL | Thermo Scientific | S751010 | Other Consumables |
| Tissue plasminogen activator, human | Millipore Sigma | T0831 | Other Consumables |
| Tubing ID 1/4'', OD 3/8'' | Fisher Scientific | AGL00017 | Other Consumables, cut into 1.5cm sections use to connect tubing to T-type connectors |
| Tubing ID 5/32", OD 7/32" | Tygon | ND-100-65, ADF 00009 | Other Consumables |
| V3 365 nm Mini - Black Light UV Flashlight | uvBeast | uvB-V3-365-MINI | Chandler loop, used to check completed clots |
| ZGA37RG ZYTD520 DC Motor, 12 V, 100 rpm | Pangyoo | ZGA37RG | Chandler loop, |
Referências
- Ali, M. R., et al. Aspect of thrombolytic therapy: a review. Scientific World Journal. 2014, 586510 (2014).
- Bhogal, P., Andersson, T., Maus, V., Mpotsaris, A., Yeo, L. Mechanical thrombectomy-A brief review of a revolutionary new treatment for thromboembolic stroke. Clin Neuroradiol. 28 (3), 313-326 (2018).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Kaiser, E. E., West, F. D. Large animal ischemic stroke models: replicating human stroke pathophysiology. Neural Regen Res. 15 (8), 1377-1387 (2020).
- Elnager, A., et al. In vitro whole blood clot lysis for fibrinolytic activity study using d-dimer and confocal microscopy. Adv Hematol. 2014, 814684 (2014).
- Prasad, S., et al. Development of an in vitro model to study clot lysis activity of thrombolytic drugs. Thromb J. 4, 14 (2006).
- Robbie, L. A., Young, S. P., Bennett, B., Booth, N. A. Thrombi formed in a Chandler loop mimic human arterial thrombi in structure and RAI-1 content and distribution. Thromb Haemost. 77 (3), 510-515 (1997).
- Mutch, N. J., et al. Model thrombi formed under flow reveal the role of factor XIII-mediated cross-linking in resistance to fibrinolysis. J Thromb Haemost. 8 (9), 2017-2024 (2010).
- Blinc, A., Kennedy, S. D., Bryant, R. G., Marder, V. J., Francis, C. W. Flow through clots determines the rate and pattern of fibrinolysis. Thromb Haemost. 71 (2), 230-235 (1994).
- Mutch, N. J., et al. The use of the Chandler loop to examine the interaction potential of NXY-059 on the thrombolytic properties of rtPA on human thrombi in vitro. Br J Pharmacol. 153 (1), 124-131 (2008).
- Herbig, B. A., Yu, X., Diamond, S. L. Using microfluidic devices to study thrombosis in pathological blood flows. Biomicrofluidics. 12 (4), 042201 (2018).
- Jigar Panchal, H., Kent, N. J., Knox, A. J. S., Harris, L. F. Microfluidics in haemostasis: A review. Molecules. 25 (4), 833 (2020).
- Zeng, Z., et al. Fluorescently conjugated annular fibrin clot for multiplexed real-time digestion analysis. J Mater Chem B. 9 (45), 9295-9307 (2021).
- Zeng, Z., Christodoulides, A., Alves, N. J. Real-time tracking of fibrinolysis under constant wall shear and various pulsatile flows in an in-vitro thrombolysis model. Bioeng Transl Med. 8 (3), e10511 (2023).
- Christodoulides, A., Zeng, Z., Alves, N. J. In-vitro thromboelastographic characterization of reconstituted whole blood utilizing cryopreserved platelets. Blood Coagul Fibrinolysis. 32 (8), 556-563 (2021).
- Zeng, Z., Nallan Chakravarthula, T., Christodoulides, A., Hall, A., Alves, N. J. Effect of Chandler loop shear and tubing size on thrombus architecture. J Mater Sci Mater Med. 34 (5), 24 (2023).
- Touma, H., Sahin, I., Gaamangwe, T., Gorbet, M. B., Peterson, S. D. Numerical investigation of fluid flow in a chandler loop. J Biomech Eng. 136 (7), (2014).
- Wojdyla, M., Raj, S., Petrov, D. Absorption spectroscopy of single red blood cells in the presence of mechanical deformations induced by optical traps. J Biomed Opt. 17 (9), (2012).
- Wu, J. H., Diamond, S. L. A fluorescence quench and dequench assay of fibrinogen polymerization, fibrinogenolysis, or fibrinolysis. Anal Biochem. 224 (1), 83-91 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados