Method Article
Monitoraggio della fibrinolisi di coaguli di sangue intero formati ad ansa di Chandler sotto flusso di taglio in un modello di trombolisi in vitro
In questo articolo
Riepilogo
I test di trombolisi in vitro hanno spesso faticato a replicare le condizioni in vivo, sia nel trombo modello da digerire che nell'ambiente in cui si verifica la trombolisi. In questo articolo, esploriamo come l'accoppiamento del ciclo di Chandler e del saggio di fibrinolisi a flusso fluorimetrico in tempo reale (RT-FluFF) viene utilizzato per il monitoraggio della lisi del coagulo ex-vivo ad alta fedeltà.
Abstract
Il tromboembolismo e le complicanze correlate sono una delle principali cause di morbilità e mortalità in tutto il mondo e sono stati sviluppati vari test per testare l'efficacia dei farmaci trombolitici sia in vitro che in vivo. C'è una crescente domanda di modelli di coaguli in vitro fisiologicamente più rilevanti per lo sviluppo di farmaci a causa della complessità e del costo associati ai modelli animali, oltre alla loro spesso mancanza di traducibilità nella fisiologia umana. Il flusso, la pressione e la velocità di taglio sono caratteristiche importanti del sistema circolatorio, con coaguli che si formano sotto il flusso che mostrano caratteristiche morfologiche e digestive diverse rispetto ai coaguli formati staticamente. Questi fattori sono spesso non rappresentati nei saggi convenzionali in vitro di digestione dei coaguli, che possono avere implicazioni farmacologiche che influiscono sui tassi di successo della traduzione dei farmaci.
Il test Real-T ime Fluorometric Flowing Fibrinolysis (RT-FluFF) è stato sviluppato come piattaforma di test della trombolisi ad alta fedeltà che utilizza coaguli marcati in fluorescenza formati sotto flusso di taglio, che vengono poi digeriti utilizzando plasma circolante in presenza o assenza di agenti farmaceutici fibrinolitici. La modifica delle velocità di flusso sia delle fasi di formazione del coagulo che di digestione del coagulo consente al sistema di imitare le condizioni arteriose, polmonari e venose in configurazioni sperimentali molto diverse. Le misurazioni possono essere effettuate in modo continuo utilizzando un fluorimetro in linea o prendendo punti temporali discreti, nonché una misurazione convenzionale della massa del coagulo del punto finale. Il test RT-FluFF è un sistema flessibile che consente il monitoraggio in tempo reale della digestione del coagulo in condizioni di flusso che rappresentano in modo più accurato le condizioni fisiologiche in vivo, pur mantenendo il controllo e la riproducibilità di un sistema di test in vitro.
Introduzione
Le malattie che derivano fondamentalmente da eziologie tromboemboliche rappresentano una delle principali fonti di morbilità e mortalità nella società odierna. Le manifestazioni della patogenesi trombo-embolica includono, ma non sono limitate a, infarti del miocardio, ictus ischemici, trombosi venose profonde ed emboli polmonari1. Un'enorme quantità di ricerca in corso, che abbraccia più discipline, ruota attorno allo sviluppo di metodi sicuri ed efficaci per affrontare la trombosi patogena. Le variazioni nelle manifestazioni arteriose e venose della trombosi e le diverse sedi anatomiche hanno portato allo sviluppo di diversi approcci terapeutici. Tuttavia, il trattamento acuto si basa generalmente sull'uso della trombolisi farmacologica tramite attivatori del plasminogeno con il potenziale di trombectomia meccanica in determinate circostanze cliniche2.
Lo sviluppo di nuove strategie di trattamento farmacologico si basa fondamentalmente sia su modelli animali in vivo che su modelli di digestione in vitro per i test preclinici 3,4. I modelli in vivo beneficiano naturalmente della loro capacità di catturare la complessa interazione di vari parametri fisiologici sull'efficacia del trattamento, che includono l'eliminazione degli agenti farmaceutici e le interazioni cellulari con i farmaci. Tuttavia, questa stessa complessità rende spesso tali modelli piuttosto costosi e introduce ulteriori problemi quando si tenta di isolare le farmacodinamiche/cinetiche sottostanti negli animali che differiscono significativamente dalla fisiologia umana. Lo sviluppo di modelli in vitro ha contribuito facilitando un ambiente di test distillato in cui lo sviluppo e lo screening dei farmaci possono essere eseguiti, ma spesso manca della fedeltà necessaria per ricapitolare lo stato della malattia oggetto di studio.
I protocolli in vitro comunemente presenti per testare nuovi trombolitici si basano sull'utilizzo di coaguli formati e lisati in condizioni statiche, in cui la massa residua del coagulo funge da endpoint primario 5,6. Sfortunatamente, tali tecniche non tengono conto degli aspetti meccanici della lisi del coagulo, come il flusso turbolento e le cadute di pressione trans-trombo che possono alterare significativamente la farmacodinamica dei farmaci in esame. Inoltre, i coaguli formati in condizioni statiche contengono una microarchitettura che differisce dai coaguli fisiologici. È stato dimostrato che la presenza di taglio durante la formazione del coagulo influisce in modo riproducibile sulle caratteristiche del coagulo risultanti, come l'attivazione piastrinica e la reticolazione della fibrina. I coaguli prodotti sotto flusso di taglio mostrano una complessa eterogeneità dalla punta alla coda che è assente nei coaguli formati staticamente 7,8. Tali deviazioni dall'architettura fisiologica del coagulo possono influire su un'importante caratterizzazione dello sviluppo di farmaci che include la penetrazione del farmaco all'interno di un trombo e la successiva efficienza della lisi9.
Per affrontare alcune di queste limitazioni associate all'uso di modelli statici di coagulazione/lisi del coagulo, l'adozione del ciclo di Chandler sia per la formazione del coagulo che per la lisi del coagulo in presenza di taglio ha visto una rinascita10. Sebbene tali sistemi consentano una migliore rappresentazione della dinamica del flusso e generino coaguli con un'architettura fisiologicamente più rilevante rispetto ai saggi relativamente statici, le loro condizioni di flusso semplificate rappresentano ancora una deviazione dalle condizioni fisiologiche. Infine, sono stati intrapresi anche approcci microfluidici grazie alla loro facilità di imaging e ai modelli di flusso uniformi; tuttavia, rimangono una significativa rimozione dalle condizioni fisiologiche attese all'interno dei vasi più grandi principalmente colpiti nella maggior parte dei disturbi tromboembolici clinicamente rilevanti11,12.
Tenendo presente la discussione di cui sopra, abbiamo sviluppato un modello di trombolisi in vitro ad alta fedeltà per lo screening preclinico dei farmaci trombolitici. Il modello mira ad affrontare alcune delle attuali insidie descritte sopra nell'ambito dello screening di nuove terapie trombolitiche ed è stato convalidato per la riproducibilità e la sensibilità a concentrazioni variabili dell'attivatore tissutale del plasminogeno (tPA). Il sistema qui descritto offre flussi di taglio fisiologici utilizzando una pompa peristaltica, uno smorzatore di pressione, un serbatoio riscaldato, due sensori di pressione, un fluorimetro in linea e un analogo del coagulo formato da taglio ad anello Chandler etichettato in fluorescenza per facilitare il monitoraggio in tempo reale della fibrinolisi13. Nel complesso, l'intero sistema è chiamato Real-Time Fluorometric Flowing Fibrinolilysis Assay (RT-FluFF Assay)14 e questo manoscritto discuterà le complessità dell'impostazione e dell'esecuzione di test di successo in questo modello di trombolisi in vitro ad alta fedeltà.
Protocollo
Tutti i metodi menzionati di seguito sono conformi ai protocolli dell'Institutional Review Board (IRB) e al comitato etico istituzionale per la ricerca umana. Tutti i volontari sani hanno fornito il consenso scritto e informato prima della donazione di sangue. Da notare che tutti i materiali a cui si fa riferimento all'interno del protocollo sono disponibili nella Tabella dei materiali. Mentre il WB e il plasma umano sono discussi in questo protocollo, l'uso di sangue animale da ricerca e di emoderivati impoveriti di fattori può essere acquistato e sostituito.
1. Prelievo di sangue intero
- Raccogliere sangue intero venoso (WB) da volontari sani consenzienti utilizzando tecniche di flebotomia standard.
ATTENZIONE: Assicurarsi che vengano seguite le precauzioni universali per ridurre il rischio di contatto con sangue o altri materiali potenzialmente infettivi durante questo protocollo. È necessario l'uso di guanti, camice da laboratorio e visiera. - Raccogliere ~50 mL di WB direttamente in provette di citrato di sodio al 3,2% e raccoglierle immediatamente in provette da 50 mL per un uso successivo.
NOTA: È necessaria una provetta di smaltimento prima del prelievo del sangue nella provetta di citrato, oltre a garantire che le provette siano riempite al volume raccomandato dal produttore. Il WB appena raccolto ricapitolerà al meglio le dinamiche di coagulazione dell'ospite. È consentita la conservazione a breve termine del WB a temperatura ambiente (≤4 ore prima dell'uso). Il WB non viene conservato durante la notte poiché è stato dimostrato che influisce sulla dinamica della coagulazione quando esaminato tramite tromboelastografia15.
2. Formazione di coaguli
- In 3 mL di sangue intero cittrato, aggiungere fibrinogeno marcato con fluorescenza (isotiocianato di fluoresceina [FITC]) (FITC-Fg) a una concentrazione finale di 60 μg/mL (rapporto tra fibrinogeno marcato in fluorescenza 1:50 e fibrinogeno non modificato assumendo una concentrazione di fibrinogeno plasmatico endogeno di 3 mg/mL).
NOTA: Questo rapporto può essere aumentato fino a 1:10 con un impatto minimo sulla morfologia del coagulo. 13,14 Il fibrinogeno marcato in fluorescenza può essere acquistato o generato facendo reagire il fibrinogeno con l'isotiocianato di fluoresceina (FITC). La miscelazione del fibrinogeno deve essere eseguita ≤5 minuti prima dell'inizio della corsa.- Se il fibrinogeno è stato precedentemente aliquotato e congelato, ispezionare il FITC-Fg scongelato per assicurarsi che la polimerizzazione non sia iniziata prematuramente, rendendolo così inutilizzabile (assicurarsi dell'assenza di particolato o fibre nella soluzione).
- Preparare la configurazione Chandler loop con un tamburo di 120 mm di diametro in un bagno d'acqua a 37 °C (Figura 1). Assicurarsi che il dispositivo ad anello Chandler sia in grado di ruotare a una velocità di rotazione fissa di 0-90 giri/min durante l'intero processo di formazione del coagulo.
NOTA: Ulteriori impostazioni e modifiche del ciclo di Chandler possono essere trovate in Zeng et al.16. - Tagliare il tubo (diametro interno 5/32", diametro esterno 7/32") e formare anelli che si adattino saldamente ma non strettamente attorno al tamburo. Per le dimensioni consigliate del tubo discusse qui, tagliare una provetta PCR standard da 200 μL da utilizzare come raccordo per collegare le estremità del tubo per formare il circuito chiuso.
NOTA: È possibile utilizzare tubi di diverse dimensioni per produrre coaguli di dimensioni diverse16. - Iniziare la coagulazione del sangue aggiungendo 200 mM di soluzione di cloruro di calcio in un rapporto di soluzione di calcio 1:17 per sangue intero. Caricare il sangue nel tubo (riempire ~50% del volume del tubo) utilizzando una siringa da 3 ml. Posizionare immediatamente l'anello sul tamburo ad anello Chandler collegando le estremità e iniziare la rotazione.
- Garantire una miscelazione adeguata con un'inversione delicata prima del caricamento per evitare problemi derivanti dall'assestamento dei componenti WB.
- Assicurarsi che venga aggiunta una quantità uguale di sangue a ciascuna provetta a ogni corsa, in quanto ciò può influire sulla dimensione del coagulo se non viene mantenuta costante.
- Poiché anche le bolle all'interno della colonna di sangue possono influire sulla coagulazione del sangue, rimuoverle muovendo delicatamente il tubo in modo "altalenante" per facilitare la fuoriuscita delle bolle prima di caricarle sul tamburo.
- Ruotare il tamburo parzialmente immerso nel bagno d'acqua a una velocità di rotazione di 40 giri/min per ottenere una velocità di taglio calcolata di ~450 s-1.
NOTA: Fare riferimento a Zeng et al. per informazioni sulle cesoie calcolate in base alle dimensioni del tubo e alla velocità di rotazione (da 20 a 60 giri/min)16. Le tipiche frequenze di taglio venoso e arterioso sono rispettivamente di 20-200 s-1 e 300-1.000 s-1, con ~400-500 s-1 rappresentativo dell'arteria polmonare. - Lasciare che si formino coaguli per 40-60 minuti in condizioni di scarsa illuminazione per ridurre al minimo il fotosbiancamento del fibrinogeno marcato con fluorescenza.
- Dopo aver raggiunto il tempo di coagulazione desiderato, rimuovere i coaguli dal tubo e utilizzarli immediatamente. Per garantire una rimozione delicata dei coaguli senza compromettere la struttura, capovolgere delicatamente il tubo per consentire al coagulo di scivolare lentamente fuori dal tubo in un piccolo contenitore.
NOTA: La conservazione dei coaguli formati nel plasma citrato o nel PBS durante la notte a 4 °C può influire sulla successiva analisi della digestione dei coaguli nel ciclo di flusso.
3. Configurazione dello strumento RT-FluFF
- Assicurarsi che l'apparato ad anello di flusso sia collegato come mostrato nella Figura 2 e che tutti i collegamenti siano sicuri. In breve, l'apparato ad anello di flusso comprende, nell'ordine della direzione del flusso: pompa > smorzatore > sensore di pressione in ingresso > sensore di pressione in uscita > coagulo > fluorimetro > serbatoio riscaldato > pompa. Regolare la selezione della capacità della pompa, della portata sperimentale, del diametro e della lunghezza del tubo, della temperatura, del volume del serbatoio e della dimensione/geometria del coagulo in base alle esigenze sperimentali uniche di ogni studio.
NOTA: Per questo esempio, per RT-FluFF è stato utilizzato lo stesso diametro del tubo utilizzato nel circuito Chandler. Il tubo può essere utilizzato per più corse nello stesso giorno, ma deve essere monitorato per verificare la presenza di degrado o perdite e sostituito/risciacquato secondo necessità. Si consiglia di risciacquare con acqua distillata tiepida tra una corsa e l'altra. A seconda del progetto sperimentale, potrebbe essere necessario sostituire il tubo dopo ogni corsa. - Una volta fissati tutti i tubi, accendere il monitor della pressione. Verificare che il misuratore di pressione indichi 0 mmHg sia per i sensori di ingresso che di uscita. In caso contrario, aprire le valvole per assicurarsi che i sensori di pressione siano aperti alla pressione atmosferica e azzerare i sensori.
- Accendi il blocco riscaldante o il bagno d'acqua in uso e monitora la temperatura nel corso dell'esperimento. Mantenere la temperatura vicino a 37 °C per imitare la temperatura fisiologica del corpo umano.
- Accendere la pompa alla portata desiderata per verificare la presenza di perdite e verificare che i sensori di pressione funzionino.
NOTA: Una velocità di flusso di ~160 mL/min in questa dimensione del tubo rappresenterà una velocità di taglio di ~500 s-1. - Spegnere la pompa per facilitare il caricamento del coagulo.
4. Caricamento del coagulo nel circuito di flusso
- Se viene utilizzato un coagulo precedentemente prodotto che è stato conservato, assicurarsi di portare il coagulo a temperatura ambiente prima di caricarlo nel sistema ad anello di flusso.
- La perdita di massa del coagulo è un'importante misura del punto finale per i test di trombolisi. È buona norma misurare la massa del coagulo appena prima di caricarlo nel circuito di flusso, invece di fare affidamento su misurazioni precedenti.
- Le misurazioni della massa del coagulo devono essere eseguite sempre allo stesso modo ogni volta per garantire la coerenza tra i campioni e tra i giorni di analisi, poiché il contenuto di liquido all'interno e sui coaguli può influire in modo significativo sulla loro massa. La migliore pratica consiste nel tamponare delicatamente i coaguli sulle salviette da laboratorio fino a quando non rilasciano più una quantità significativa di liquido sulla salvietta, facendo attenzione a non comprimere il coagulo durante il processo di misurazione.
- Immergere il coagulo nel plasma (autologo o di tipo corrispondente) o in un'altra soluzione in fase mobile utilizzata nel circuito di flusso (come PBS o mezzi definiti) in un contenitore poco profondo come un piatto di pesata. La soluzione in fase mobile deve essere prelevata direttamente dal serbatoio del sistema da 50 ml per controllare il volume totale del sistema. Nessun agente di test trombolitico o farmaceutico deve essere presente durante la fase di caricamento del coagulo. Si raccomanda che il volume totale della fase mobile per l'esecuzione del ciclo di flusso sia di ≥50 mL e che sia costante in tutti i campioni.
- Rimuovere la sezione centrale del tubo dell'anello di flusso (tra i sensori di ingresso e di uscita) e collegare una siringa da 10 ml a un'estremità del tubo.
- Utilizzando l'estremità libera del tubo, posizionarlo nel plasma (o fase mobile) e prelevare un piccolo volume di soluzione per adescare il tubo. Quindi posizionare l'ingresso del tubo vicino al coagulo, esaminando attentamente il coagulo per identificare la testa (in genere l'estremità leggermente più spessa del coagulo) e la coda (estremità opposta alla testa). La testa del coagulo deve essere posizionata verso il sensore di pressione di ingresso e lontano dall'uscita. Posizionare il tubo all'estremità "coda" del coagulo e aspirarlo nel tubo con la siringa.
NOTA: nei casi in cui la direzionalità della testa/coda del coagulo non può essere determinata visivamente, la direzionalità può essere assegnata al meglio in base alla conoscenza del senso di rotazione dall'anello di Chandler: la testa del coagulo è rivolta nella direzione opposta alla rotazione del tamburo. - Ricollegare il tubo all'apparecchio principale in modo che il coagulo sia il più vicino possibile al sensore di pressione di uscita (la testa del coagulo deve essere rivolta lontano dal sensore di uscita). Fissare il coagulo nella sua posizione perforando il tubo e la testa del coagulo con due aghi da 30 G a "X". Lascia questi aghi per tutta la durata della corsa.
NOTA: A seconda delle impostazioni dello smorzatore e della pompa, potrebbero essere necessari aghi aggiuntivi per garantire che il coagulo non si framprenda prematuramente. Se necessario, è possibile aggiungere uno schermo al tubo a valle del coagulo per evitare che frammenti di coagulo circolino nel sistema. Una volta stabilito un determinato numero di aghi per trattenere il coagulo, mantenerlo costante in tutte le condizioni. - Prendere il resto della soluzione in fase mobile e metterla in una provetta da 50 mL come serbatoio.
- Posizionare il serbatoio nel bagnomaria e inserire i tubi di ingresso e uscita (l'uscita proviene dal fluorimetro e l'ingresso entra nella testa della pompa).
- Verificare che il fluorimetro in uso sia collegato e monitorato. Verificare che il valore iniziale sia appropriato rispetto a una linea di base del sistema mobile di sola fase all'inizio dell'esperimento.
NOTA: Se non è disponibile un fluorimetro in linea, è possibile eseguire il campionamento periodico seriale del serbatoio a intervalli definiti durante il periodo di analisi del ciclo di flusso. Le frazioni raccolte possono essere lette utilizzando una piastra a 96 pozzetti immediatamente dopo il completamento dell'esperimento su qualsiasi spettrofotometro disponibile in commercio. - Aggiungere 500 μl di 100.000 ng/mL di tPA direttamente al volume del serbatoio per ottenere una concentrazione finale di 1.000 ng/mL di tPA in 50 mL. Il volume, la concentrazione e il farmaco specifico aggiunto dipenderanno dalla concentrazione circolante target desiderata e dal volume del serbatoio del sistema.
- Controllare quanto segue prima di avviare la pompa:
- Tutti gli incroci sono sicuri.
- Le due valvole sopra i sensori di pressione si trovano nella posizione di chiusura appropriata.
- L'eventuale residuo di plasma (o fluido) è stato sostituito nel serbatoio.
- Il trombolitico è stato aggiunto al serbatoio e miscelato correttamente.
- Il tubo di ingresso si trova vicino al fondo del serbatoio (questo garantisce bolle minime).
- Il tubo di uscita è sicuro e all'altezza appropriata per la pressione desiderata (a seconda della posizione del recipiente che viene modellata).
- Il senso di rotazione della pompa è corretto (ordine di flusso: pompa > smorzatore > coagulo > fluorimetro > serbatoio > pompa).
- Se i giri della pompa sono impostati su un valore molto alto (>150 giri/min), avviare a una velocità inferiore e aumentare la rampa per garantire che la rapida variazione di pressione non frammenti il coagulo o causi perdite dai tubi.
- Assicurarsi che il sistema registri i dati in modo appropriato dal fluorimetro e/o che i materiali di consumo siano preparati per il campionamento periodico della fase mobile per le letture dei punti temporali post-esperimento.
- Accendere la pompa e impostarla in modo da raggiungere la portata volumetrica desiderata di 160 ml/min o aumentare la portata fino a raggiungere la pressione desiderata. Il sistema si riempirà di liquido e bolle. Le bolle aumenteranno artificialmente le letture fluorometriche, quindi fai attenzione che le bolle si liberino. Una volta fatto, spegni le luci e inizia l'acquisizione dei dati.
- Lasciare la pompa in funzione fino a quando il coagulo non si è degradato in modo significativo o non è trascorso il tempo sperimentale desiderato (≥60 min). Aggiungere reagenti, se necessario, al sistema durante l'esperimento attraverso il serbatoio per creare condizioni sperimentali uniche che testano una varietà di variazioni trombolitiche.
NOTA: Il tempo sperimentale dipenderà dalla portata della pompa (livello di taglio) e dalla concentrazione di trombolitico. - Una volta completato il saggio, ridurre la portata volumetrica e rimuovere il tubo di ingresso mentre la pompa è ancora in funzione per spingere la maggior parte del fluido nel sistema nel serbatoio (una parte della fase mobile rimarrà nel tubo). Scollegare la sezione del tubo contenente coaguli sul lato del sensore di pressione di uscita del tubo e abbassarla in una barca di pesatura.
- Rimuovere gli aghi che tengono il coagulo in posizione per raccogliere il liquido residuo dall'interno del sistema e i frammenti di coagulo/coagulo. Utilizzare una siringa per aiutare a pulire il sistema secondo necessità.
- Pesare ed elaborare il coagulo rimanente per ulteriori analisi, come il calcolo della percentuale di massa persa o per l'istologia.
5. Pulizia del sistema
- Tra un campione e l'altro, sciacquare l'intero sistema con acqua tiepida ad un numero di giri elevato (>150 giri/min). Caricare l'acqua nel serbatoio e far scorrere il sistema per almeno 2 minuti, svuotare e ripetere per due risciacqui completi del sistema. Dopo questi risciacqui, se la lettura del fluorimetro non torna alla linea di base, ripetere il processo di risciacquo per un ulteriore ciclo. Se non è ancora tornato al basale, sostituire completamente il tubo prima di analizzare il campione successivo.
NOTA: Durante gli esperimenti, i tubi possono essere riutilizzati tra i campioni; Tuttavia, a causa della perforazione con aghi utilizzati per tenere il coagulo in posizione, la sezione del tubo tra i sensori di pressione di ingresso e uscita deve essere sostituita dopo ogni corsa. In alcune condizioni sperimentali, potrebbe essere necessario sostituire l'intero set di tubi dopo ogni corsa o saggi di clustering per eliminare qualsiasi contaminazione incrociata del campione. - Dopo che tutti i campioni sono stati analizzati per l'esperimento di quel giorno, rimuovere tutti i tubi e gettarli. Strofinare i raccordi a T con acqua calda e una spazzola a setole fino a renderli puliti e lasciare asciugare e sciacquare gli smorzatori della siringa con acqua calda. Usa il 70% di EtOH per aiutare con la sterilità.
Risultati
Formazione di coaguli ad ansa di Chandler
Nella formazione dei coaguli, in genere abbiamo mirato ai quadruplicati per garantire che, se esistevano valori anomali del coagulo (in base alla morfologia e alla massa grossolana), avessimo ancora la capacità di eseguire saggi di trombolisi triplicata. Supponendo condizioni di carico ottimali, i coaguli dovrebbero essere tutti abbastanza uniformi in lunghezza (~3,3 cm), peso (~100 mg) e aspetto, come rappresentato nella Figura 3. Quando abbiamo impiegato FITC-Fg, abbiamo anche mirato a esaminare i coaguli sotto luce UV per garantire una dispersione relativamente uniforme della fluorescenza rispetto alle aree irregolari di marcatura iperfluorescente all'interno del coagulo. Variare il grado di FITC-Fg all'interno del sangue intero non dovrebbe alterare il peso o l'aspetto dei coaguli all'interno delle nostre concentrazioni esplorate; tuttavia, l'architettura dei microcoaguli è stata influenzata alle concentrazioni più elevate di FITC-Fg (da 1:5 FITC-Fg a Fg non modificato). Il lavoro precedente svolto da Zeng et al. ha catturato l'ampia gamma di fenotipi di coaguli attesi nel ciclo di Chandler a seconda del livello di taglio scelto16.
A volte, può verificarsi una coagulazione aberrante. I problemi più comuni di formazione di coaguli rientrano in una delle due categorie: (i) coagulazione prematura e (ii) coagulazione compromessa. Nella coagulazione prematura, l'intero volume di sangue si solidificherà all'interno del tubo dell'ansa Chandler. Ciò diventerà evidente quando la rotazione del tamburo sarà attivata poiché il sangue non "scorrerà" ma piuttosto si attaccherà alle pareti del tubo e ruoterà all'unisono. In tali circostanze, questi coaguli non sono utilizzabili e devono essere scartati. Per evitare ciò, assicurarsi che una volta attivata la coagulazione con l'aggiunta di cloruro di calcio, l'anello venga immediatamente chiuso e posizionato sul tamburo rotante per la coagulazione che ne consegue. La seconda circostanza, o alterazione della coagulazione, si verifica quando i campioni non sono stati adeguatamente miscelati o se il sangue ha iniziato a coagulare prima dell'inizio della rotazione, ma non è così significativo come nella circostanza (i). I coaguli con i problemi di cui sopra tenderanno ad apparire filamentosi e fragili quando vengono maneggiati e spesso hanno masse di coaguli significativamente elevate. Fenotipicamente, si avvicineranno ai coaguli osservati a tagli venosi molto bassi poiché ciò rappresenta essenzialmente la coagulazione nell'impostazione della stasi. A volte ci si devono aspettare coaguli irregolari e scartarli.
Calibrazione del fluorimetro RT-FluFF
Una caratteristica importante del sistema RT-FluFF è il fluorimetro, o spettrofotometro, utilizzato per monitorare la trombolisi durante il periodo di digestione del coagulo trascorso. Prima di eseguire qualsiasi esperimento, è fondamentale garantire il corretto funzionamento del fluorimetro, o spettrofotometro. Per i nostri scopi, poiché abbiamo progettato il nostro fluorimetro specificamente per l'apparato RT-FluFF, dovevamo assicurarci che si correlasse bene con lo spettrofotometro in presenza di quantità note di diluizioni FITC-Fg in una soluzione statica (Figura 4A). Una volta che siamo stati in grado di determinare con sicurezza l'intervallo lineare del nostro fluorimetro, abbiamo cercato di vedere come si sarebbe comportato il fluorimetro in presenza di flusso. Abbiamo verificato la funzionalità iniettando in modo incrementale la fluoresceina nella soluzione che scorre per monitorare un aumento graduale della fluorescenza per comprendere meglio la riproducibilità della lettura del fluorimetro e determinare la rapidità con cui la fluorescenza si equilibra all'interno del sistema che scorre (Figura 4B). Gli esperimenti di follow-up sono stati eseguiti iniettando costantemente sia la fluoresceina che il FITC-Fg nella soluzione in modo continuo per imitare meglio il rilascio continuo di fluorescenza atteso dagli esperimenti di fibrinolisi (Figura 4C). Si ritiene che le differenze di pendenza rappresentate tra FITC-Fg e FITC derivino dagli effetti del quenching che si verifica quando FITC è coniugato in prossimità di se stesso, come quando molte molecole di FITC sono coniugate a una singola proteina (fibrinogeno in questo caso). Naturalmente, gli aumenti e le pendenze graduali differiranno non solo in base alle concentrazioni di FITC/FITC-Fg utilizzate, ma anche al numero di molecole FITC per fibrinogeno. Per estensione, diventa fondamentale controllare il grado di coniugazione tra FITC e fibrinogeno quando si eseguono esperimenti che utilizzano RT-FluFF se la speranza è quella di confrontare i dati di numerosi lotti di coaguli. Attraverso un'ampia sperimentazione, abbiamo scoperto che ~14 coniugazioni FITC per fibrinogeno forniscono un buon segnale fluorescente per tracciare la digestione del coagulo pur rimanendo stabile in soluzione (aggregazione prematura limitata) e con un impatto minimo sulla microstruttura del coagulo risultante. È importante notare che ogni volta che FITC-Fg puro, non coagulato, viene fatto passare attraverso l'apparato RT-FluFF, l'esposizione di FITC-Fg ad alto taglio può favorirne l'aggregazione. Questo fenomeno si osserva più spesso nelle giunzioni delle connessioni dei tubi e all'interno del tubo della testa della pompa e nel tempo può influire sulla fluorescenza disponibile in soluzione.
Quando si raccolgono campioni dal circuito di flusso in punti temporali discreti per leggere la fluorescenza su uno spettrofotometro, molte di queste considerazioni associate alla calibrazione del fluorimetro non sono necessarie. Tuttavia, è ancora necessario esplorare la gamma dinamica dello spettrofotometro specifico utilizzato per garantire che la marcatura FITC-Fg, la quantità di FITC-Fg nel coagulo formato dal loop di Chandler e la dimensione del coagulo siano tutti ottimizzati nel sistema. Si raccomanda che i campioni vengano letti immediatamente dopo l'isolamento dal sistema o collocati in una piastra a 96 pozzetti per letture multiplex dopo il completamento dell'esperimento. Se necessario, i campioni possono essere acidificati direttamente dopo la raccolta per eliminare ulteriori attività enzimatiche prima di essere analizzati.
Lisi del coagulo RT-FluFF
Per convalidare il sistema RT-FluFF utilizzando coaguli formati sotto cesoie arteriose nel ciclo di Chandler, abbiamo impiegato plasma umano come fase mobile nell'apparato con tPA (Alteplase) come agente fibrinolitico. Le concentrazioni di tPA esplorate variavano da 0 a 1.000 ng/mL. Per imitare le condizioni di flusso polmonare umano, la temperatura del serbatoio del plasma è stata mantenuta a 37 °C e aumentata fisicamente a 8 cm sopra il livello del coagulo per fornire una pressione media del flusso di 12 mmHg con la velocità della pompa regolata per generare un flusso di taglio di ~500 s-1 in assenza di coagulo. Al sistema sono stati aggiunti smorzatori di flusso pulsatile per garantire una variazione minima tra le pressioni di picco e di valle della pompa peristaltica per ottenere una velocità di taglio quasi costante (Figura 4D). In assenza di uno smorzatore di pressione, la pressione di uscita della pompa peristaltica fluttua in modo significativo a causa della natura del modo in cui produce il flusso espellendo piccoli pacchetti di liquido attraverso il sistema mentre la testa della pompa ruota. La lisi del coagulo è stata osservata nel corso di 60 minuti. Come previsto, l'aumento delle concentrazioni di tPA ha comportato un aumento dei tassi di lisi del coagulo (RFU/minuto) e una maggiore perdita di massa rispetto alle condizioni con tPA inferiore o assente. A una concentrazione di tPA di 1.000 ng/mL, è stata raggiunta una lisi del coagulo del ~85% in un periodo di digestione di 60 minuti. Esaminando le immagini grossolane dei coaguli sottoposti a lisi, si può apprezzare che la lisi si verificherà principalmente nelle regioni della coda del coagulo prima di colpire la testa più densamente strutturata, come si vede sia dalla degradazione fisica dell'architettura del coagulo che dalla perdita di fluorescenza superficiale. L'allungamento previsto dei coaguli si verificherà anche in base alla perdita di integrità meccanica nel tempo in modo dipendente dalla velocità di taglio.
Sebbene si possano apprezzare differenze significative nei tassi di lisi del coagulo, grossolanamente e in base al rilascio di fluorescenza, non esiste una correlazione perfettamente lineare tra il rilascio di fluorescenza e la quantità di fibrinolitico presente. Questo è meglio apprezzato nella Figura 5. La fibrinolisi nei coaguli a base di WB-WB porta naturalmente al rilascio non solo di frammenti di FITC-Fg, ma anche di globuli rossi (RBC) che sono intrappolati all'interno delle reti di fibrina durante la formazione del coagulo. Di conseguenza, il rilascio di questi globuli rossi in circolazione all'interno dell'apparato RT-FluFF inizierà a tingere notevolmente di rosso il plasma circolante. Questo cambiamento colorimetrico nel plasma circolante può avere un impatto negativo sull'emissione fluorescente del FITC-Fg circolante che viene letto dal sensore fluorimetrico. Quando le concentrazioni fibrinolitiche raggiungono i limiti superiori, il grado di rilascio di FITC-Fg in soluzione supera gli effetti dei globuli rossi sulle emissioni di fluorescenza.

Figura 1: Rappresentazione schematica della configurazione del Chandler Loop. I tubi riempiti di sangue caricati sul tamburo ad anello Chandler vengono immersi in un bagno d'acqua a 37 °C durante tutto il processo di formazione del coagulo con le luci attenuate. Il tamburo viene ruotato a una velocità di rotazione costante tramite un motore a corrente continua, un albero di trasmissione e una scheda di controllo. Questa cifra è stata modificata da Zeng et al14. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Rappresentazione schematica del sistema RT-FluFF. I componenti importanti del sistema sono identificati sull'immagine. Nell'immagine è raffigurato un singolo smorzatore di grande volume per ridurre al minimo le pulsazioni nel flusso associate all'uso di una pompa peristaltica. In assenza di un fluorimetro in linea, due opzioni aggiuntive per il campionamento periodico includono: 1) campionamento direttamente dal serbatoio; o 2) incorporando una porta di campionamento in linea per estrarre la fase mobile. Questa cifra è stata modificata da Zeng et al14. Abbreviazione: RT-FluFF = Real-Time Fluorometric Flowing Fibrinolilysis Assay. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Caratteristiche del coagulo di WB marcato con FITC-Fg con loop di Chandler lordo, tra cui massa e aspetto fisico alla luce ambientale e UV. (A) La formazione costante di coaguli in diverse condizioni di coagulazione è ottenibile attraverso la messa a punto del protocollo di formazione del coagulo con loop di Chandler. È importante notare che le masse e l'aspetto dei coaguli variano in modo significativo a seconda del diametro del tubo, della velocità di rotazione e della durata del tempo di formazione dei coaguli. I coaguli raffigurati si sono formati a 37 °C per 1 ora a una velocità di taglio di 506 s-1. Barre della scala = 20 mm. (B) Masse di coaguli formate nell'anello di Chandler utilizzando i rispettivi rapporti di FITC-Fg. I dati rappresentano la media ± la deviazione standard per punti dati maggiori o uguali a triplicati. Questa cifra è stata modificata da Zeng et al14. Abbreviazioni: FITC-Fg = fibrinogeno marcato con isotiocianato di fluoresceina; WB = sangue intero. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Caratterizzazione del fluorimetro. (A) Confronto del fluorimetro in linea RT-FluFF con uno spettrofotometro nel contesto di quantità note di diluizioni FITC-Fg. (B) Introduzione graduale della fluoresceina nel sistema RT-FluFF per determinare la riproducibilità del fluorimetro e il tempo di equilibrio della fluorescenza nel plasma umano in flusso. (C) Infusioni continue che confrontano fluoresceina e FITC-Fg nella piattaforma RT-FluFF. Le differenze di pendenza derivano probabilmente dal quenching della fluorescenza nel gruppo FITC-Fg. (D) Forme d'onda del sensore di pressione in uscita (post coagulo) associate all'uso di smorzatori di dimensioni diverse nelle stesse condizioni di portata volumetrica. Questa cifra è stata modificata da Zeng et al14. Abbreviazioni: FITC-Fg = fibrinogeno marcato con isotiocianato di fluoresceina; RT-FluFF = Saggio di fibrinolisi a flusso fluorimetrico in tempo reale. Clicca qui per visualizzare una versione più grande di questa figura.
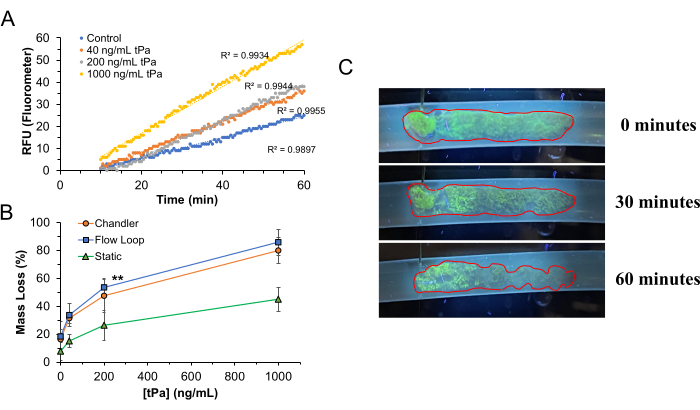
Figura 5: Trombolisi nella piattaforma RT-FluFF. (A) Le pendenze rappresentative della fluorescenza aumentano nel corso di 60 minuti di digestione del coagulo in presenza di tPA circolante. Si noti il ritardo iniziale della trombolisi poiché l'attivazione del plasminogeno da parte del tPA e la digestione del coagulo non sono istantanee. (B) Percentuale di massa del coagulo persa a varie concentrazioni di tPa e modalità di trombolisi variabili che includono: il sistema RT-FluFF, la digestione del coagulo ad anello di Chandler sotto taglio costante e la digestione statica (senza taglio) del coagulo. I dati rappresentano la media ± la deviazione standard per punti dati maggiori o uguali a triplicati con doppi asterischi che indicano un valore p < 0,01 e tripli asterischi che indicano un valore p < 0,001. (C) Caratteristiche macroscopiche della trombolisi a 200 ng/mL di tPA. Questa cifra è stata modificata da Zeng et al.14. Abbreviazioni: RT-FluFF = Real-Time Fluorometric Flowing Fibrinolilysis Assay; tPA = attivatore tissutale del plasminogeno. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Formazione e marcatura del coagulo
È stato dimostrato che l'ansa di Chandler fornisce un mezzo semplice ed efficace per generare in modo riproducibile coaguli che imitano i trombi 16 in vivo. Parametri di messa a punto come le dimensioni del tubo, la velocità di rotazione, il diametro del tamburo e il tempo di coagulazione consentono la rapida generazione di coaguli in diverse condizioni di taglio in grado di catturare caratteristiche architettoniche apprezzate in una gamma di trombi che imitano sia le fonti arteriose che venose. La flessibilità aggiuntiva di poter introdurre marcatori come FITC-Fg amplia i potenziali usi di questi trombi, come abbiamo dimostrato nel sistema RT-FluFF. Per quanto rudimentali siano i principi alla base del ciclo di Chandler, rimane una ripida curva di apprendimento iniziale associata alla formazione costante di coaguli mentre si maneggia contemporaneamente sangue ed emoderivati durante tutto il processo di formazione del coagulo. Ciò deriva dal fatto che la coagulazione del WB è estremamente sensibile alla manipolazione nei momenti precedenti e successivi all'inizio della coagulazione. Di particolare importanza è la selezione del tubo utilizzato durante la fase di formazione del coagulo nel ciclo di Chandler, poiché le interazioni tra la superficie del sangue possono influire sulla progressione della formazione del coagulo. I tubi devono essere di grado medico o chirurgico (non pirogeni e non emolitici) e presentare una bassa bioreattività. Come discusso nei nostri risultati, la variazione dei coaguli formati è prevista nelle fasi iniziali di apprendimento della tecnica, sviluppando il proprio flusso di lavoro ottimale basato su scala sperimentale e modifiche uniche del saggio. L'eventuale raggiungimento della riproducibilità è fondamentale dato l'impatto dell'architettura del coagulo sul comportamento di un coagulo durante la fibrinolisi. Infine, è prevedibile anche una variazione della coagulazione, anche tra volontari sani, che dovrebbe essere presa in considerazione durante il disegno sperimentale.
Saggio RT-FluFF
La quantificazione fluorometrica/spettrofotometrica della fibrinolisi con FITC-Fg come marcatore offre numerosi vantaggi rispetto alle tecniche classiche che si sono basate principalmente sulla valutazione della massa del coagulo endpoint. La capacità di monitorare, in tempo reale o quasi in tempo reale, le dinamiche della fibrinolisi in un ambiente che approssima i parametri di flusso fisiologici rappresenta un miglioramento significativo rispetto ai tradizionali saggi di screening dei farmaci fibrinolitici. Questo test è stato intenzionalmente progettato alla scala presentata per assomigliare più da vicino alle dimensioni del coagulo, al campo di flusso, alla portata volumetrica e al carico di massa del coagulo clinicamente rilevanti, piuttosto che adottare un approccio microfluidico completamente miniaturizzato. La riduzione delle apparecchiature RT-FluFF significherebbe l'utilizzo di tubi di diametro inferiore e/o distanze più brevi. Di conseguenza, il sistema inizierebbe a deviare dai modelli di flusso desiderati e dalla rilevanza fisiologica. Simile al circuito di Chandler, il sistema RT-FluFF consente il controllo di parametri come la velocità di taglio modulando le pressioni di flusso a flusso costante e il controllo su quale fluido viene utilizzato. Inoltre, il sistema RT-Fluff può anche ospitare il flusso pulsatile e le geometrie uniche di digestione dei coaguli, consentendo comunque il campionamento periodico della fase mobile durante il processo di digestione, cosa che non è possibile in un circuito Chandler a causa della sua configurazione di digestione chiusa rotante. L'impatto di questi parametri sulla lisi del coagulo è stato esplorato in modo approfondito nell'ambito di Zeng et al.14.
Presi insieme, i coaguli a forma di ansa di Chandler e il tubo del saggio RT-FluFF possono essere dello stesso diametro o variati sia nella fase di formazione del coagulo che in quella di digestione del coagulo per ottenere diversi livelli di occlusione, modellando l'occlusione del vaso quasi completo per imitare il tromboembolismo. Tutti i saggi qui descritti utilizzavano lo stesso diametro del tubo sia nel circuito Chandler che nel sistema RT-FluFF. Con l'aumento del diametro del tubo nel sistema RT-FluFF, potrebbe essere necessario aumentare il volume del serbatoio della fase mobile per accogliere il volume aggiuntivo necessario per riempire il sistema. L'aumento del volume del serbatoio può anche aumentare la quantità necessaria di trombolitico/farmaco da aggiungere al sistema e aumenterebbe anche le esigenze di plasma o fase mobile. Sebbene l'uso del plasma autologo sia l'ideale, richiederebbe il prelievo di quantità di sangue estremamente elevate dai singoli donatori per adattarsi alla formazione del coagulo dell'ansa di Chandler e ai volumi di fase mobile RT-FluFF in tutti i saggi e le repliche necessari per completare un intero esperimento. Per questo motivo, è stato comunemente impiegato il plasma aggregato di tipo corrispondente acquisito da un centro di donazione di sangue o acquistato da un fornitore commerciale. Sebbene il tubo complessivo del saggio RT-FluFF possa essere accorciato in una certa misura, ci sono limitazioni tali che tutti i componenti hanno spazio sufficiente per rimanere nel circuito per eseguire gli esperimenti di digestione. Di particolare importanza è la lunga porzione di tubo utilizzata a monte del coagulo stesso che deve superare una lunghezza minima, calcolata in base al diametro del tubo e alla portata, in modo tale che il flusso laminare sia raggiunto dal tempo in cui il flusso raggiunge il coagulo sospeso. Indipendentemente dalla selezione della dimensione del tubo, le stesse considerazioni dettagliate nella fase di formazione del coagulo del circuito Chandler devono essere applicate anche al tubo del sistema RT-FluFF. È importante ribadire che il tubo tra i sensori di pressione, dove il coagulo formato da ansa di Chandler è fissato in posizione tramite due aghi inseriti in uno schema a "X", deve essere sostituito dopo ogni test per evitare che si verifichino perdite nei siti di puntura dell'ago. L'uso di aghi per mantenere il coagulo in posizione durante la digestione in condizioni di flusso limita l'accumulo di coaguli e fornisce capacità di orientamento del coagulo rispetto alla direzione del flusso per migliorare la coerenza da test a test. Sebbene nel presente documento sia descritto un singolo studio rappresentativo di digestione del coagulo utilizzando il tPA, il ciclo Chandler e il test RT-FluFF forniscono un alto grado di personalizzazione per adattarsi a un'ampia varietà di strutture di coaguli, molecole reporter, velocità di taglio e condizioni di digestione per testare nuovi fibrinolitici.
Limitazioni
Come con tutte le attuali piattaforme o metodi utilizzati per lo screening dei farmaci fibrinolitici, anche il test RT-FluFF soffre di alcune debolezze che devono essere riconosciute. In primo luogo, i coaguli formati nel ciclo di Chandler, sebbene presentino motivi comunemente presenti nei coaguli in vivo , si formano ancora in un ambiente diverso rispetto ai coaguli in vivo , dove esiste il flusso pulsatile e l'interazione con l'endotelio17 Inoltre, anche se le concentrazioni di FITC-Fg sono state ottimizzate per minimizzare gli effetti sull'architettura del coagulo, l'aggiunta del fibrinogeno modificato rappresenta ancora un allontanamento dalle condizioni fisiologiche. La scelta del plasma del mezzo di fase mobile può influire sull'uso di un fluorimetro in quanto ci sarà una piccola quantità di segnale di fondo associato al contenuto proteico e lipidico del plasma che può variare da donatore a donatore. Una limitazione potenzialmente significativa della configurazione RT-FluFF è l'impatto negativo dei globuli rossi sulle letture fluorimetriche, che limita l'uso del WB come fase mobile quando si utilizza FITC come marcatore fluorescente per la digestione dei coaguli. Un metodo fattibile per mitigare questo problema consiste nell'introdurre una fase di centrifugazione nei globuli rossi in pellet prima della lettura di punti temporali discreti su uno spettrofotometro o nell'utilizzare un diverso tag reporter per la digestione del coagulo che è meno influenzato dalla presenza di globuli rossi18. È necessario prestare un'attenta considerazione in base al disegno del saggio per garantire che le variabili importanti siano controllate. Ad esempio, se il plasma è la fase mobile di scelta, allora è meglio raggruppare il plasma tra molti donatori per ridurre al minimo la coagulazione da donatore a donatore e la variabilità della fibrinolisi. Infine, come con qualsiasi proteina marcata in fluorescenza, il problema del quenching sorge naturalmente a causa della presenza del tag FITC in relativa vicinanza l'uno all'altro sulla superficie del fibrinogeno19.
Conclusioni e orientamenti futuri
Lo studio di un processo dinamico come la trombolisi richiede un ambiente altrettanto dinamico in cui le condizioni fisiologiche possono essere replicate e più parametri possono essere controllati contemporaneamente. Il sistema RT-FluFF ad alta fedeltà colma questa lacuna e fungerà da strumento importante per lo sviluppo e lo screening futuri di nuovi trombolitici prima della loro traduzione in modelli animali. RT-FluFF è una piattaforma altamente versatile, con molteplici capacità che non sono state discusse in questo articolo, ma che potrebbero certamente essere incorporate nei protocolli a seconda delle esigenze uniche di progettazione di farmaci farmaceutici, modalità d'azione o replicazione di diversi stati patologici della coagulazione. I vantaggi che abbiamo potuto apprezzare all'interno del sistema RT-FluFF sono i seguenti: (a) geometrie e configurazioni variabili dei tubi, (b) monitoraggio della pressione in tempo reale correlato al grado di occlusione del lume, (c) misure di fluorescenza in tempo reale che non richiedono alcun intervento da parte dell'utente, (d) durata del test e flessibilità della frequenza del campione, (e) uso di un serbatoio per imitare le condizioni in vivo , (f) modelli di flusso di taglio in vivo , (g) opzione per includere il flusso pulsatile, (h) significativa flessibilità nella formazione dell'ansa di Chandler di analoghi distinti del coagulo rappresentativi della malattia, (i) la capacità di testare gli impatti dei farmaci sulla formazione del coagulo o sulla digestione del coagulo e (j) imaging diretto del substrato del coagulo per monitorare la digestione del coagulo di massa attraverso il tubo trasparente consente inoltre la post-digestione, analisi video longitudinale.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
La ricerca riportata in questa pubblicazione è stata supportata dal National Heart, Lung, And Blood Institute del National Institutes of Health con il numero di premio R01HL167877. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 30 G Disposable Hypodermic Needles | Exel International | 26439 | Other Consumables |
| 6 mm HSS Lathe Bar Stock Tool 150 mm Long | uxcell | B07SXGSQ82 | Chandler loop, |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Other Consumables, Non-treated acrylic copolymer, non-sterile |
| Air-Tite Luer-lock Unsterile 60 mL Syringes | Air-Tite | MLB3 | RT-FluFF Apparatus , dampeners |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Calcium Chloride | Millipore Sigma | C5670 | Other Consumables |
| Disposable BP Transducers | AD Instruments | MLT0670 | RT-FluFF Apparatus |
| Drager Siemans HemoMed Pod | Drager | 5588822 | RT-FluFF Apparatus |
| Drager Siemans Patient Monitor | Drager | SC 7000 | RT-FluFF Apparatus |
| Drum (cylinder, diameter 120 mm, width 85 mm) | Chandler loop, | ||
| Face Shield | Moxe | SHIELDS10 | Chandler loop, |
| Fibrinogen From Human Plasma, Alexa Fluor 488 Conjugate | Thermo Scientific | F13191 | Other Consumables |
| Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile | Masterflex | 30600-04 | RT-FluFF Apparatus |
| Fluorescein (FITC) | Thermo Scientific | 119245000 | Other Consumables |
| General-Purpose Water Bath | Thermo Scientific | 2839 | Chandler loop, |
| Hotplate 4 × 4 | Fisher Scientific | 1152016H | RT-FluFF Apparatus |
| Human Source Plasma Fresh-Frozen | Zen-Bio | SER-SPL | Other Consumables, CPDA-1 anticoagulant |
| Human Whole Blood | Zen-Bio | SER-WB-SDS | Other Consumables, CPDA-1 anticoagulant |
| L/S Easy-Load II Pump Head for High-Performance Precision Tubing, PPS Housing, SS Rotor | Masterflex | 77200-62 | RT-FluFF Apparatus, Pump Head |
| L/S Variable-Speed Digital Drive Pump with Remote I/O, 6 to 600 rpm; 90 to 260 VAC | Masterflex | 7528-10 | RT-FluFF Apparatus, Pump |
| Motor Speed Controller | CoCocina | ZK-MG | Chandler loop, |
| Nalgene Tubing T-Type Connectors | Thermo Scientific | 6151-0312 | RT-FluFF Apparatus |
| Peristaltic pump tubing | Masterflex | 06424-15 | Other Consumables |
| Phosphate buffered saline | Millipore Sigma | P3813 | Other Consumables, Powder, pH 7.4, for preparing 1 L solutions |
| Switching Power Supply | SoulBay | UC03U | Chandler loop, |
| Thermo Scientific National Target All-Plastic Disposable Syringes 10 mL | Thermo Scientific | S751010 | Other Consumables |
| Tissue plasminogen activator, human | Millipore Sigma | T0831 | Other Consumables |
| Tubing ID 1/4'', OD 3/8'' | Fisher Scientific | AGL00017 | Other Consumables, cut into 1.5cm sections use to connect tubing to T-type connectors |
| Tubing ID 5/32", OD 7/32" | Tygon | ND-100-65, ADF 00009 | Other Consumables |
| V3 365 nm Mini - Black Light UV Flashlight | uvBeast | uvB-V3-365-MINI | Chandler loop, used to check completed clots |
| ZGA37RG ZYTD520 DC Motor, 12 V, 100 rpm | Pangyoo | ZGA37RG | Chandler loop, |
Riferimenti
- Ali, M. R., et al. Aspect of thrombolytic therapy: a review. Scientific World Journal. 2014, 586510 (2014).
- Bhogal, P., Andersson, T., Maus, V., Mpotsaris, A., Yeo, L. Mechanical thrombectomy-A brief review of a revolutionary new treatment for thromboembolic stroke. Clin Neuroradiol. 28 (3), 313-326 (2018).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Kaiser, E. E., West, F. D. Large animal ischemic stroke models: replicating human stroke pathophysiology. Neural Regen Res. 15 (8), 1377-1387 (2020).
- Elnager, A., et al. In vitro whole blood clot lysis for fibrinolytic activity study using d-dimer and confocal microscopy. Adv Hematol. 2014, 814684 (2014).
- Prasad, S., et al. Development of an in vitro model to study clot lysis activity of thrombolytic drugs. Thromb J. 4, 14 (2006).
- Robbie, L. A., Young, S. P., Bennett, B., Booth, N. A. Thrombi formed in a Chandler loop mimic human arterial thrombi in structure and RAI-1 content and distribution. Thromb Haemost. 77 (3), 510-515 (1997).
- Mutch, N. J., et al. Model thrombi formed under flow reveal the role of factor XIII-mediated cross-linking in resistance to fibrinolysis. J Thromb Haemost. 8 (9), 2017-2024 (2010).
- Blinc, A., Kennedy, S. D., Bryant, R. G., Marder, V. J., Francis, C. W. Flow through clots determines the rate and pattern of fibrinolysis. Thromb Haemost. 71 (2), 230-235 (1994).
- Mutch, N. J., et al. The use of the Chandler loop to examine the interaction potential of NXY-059 on the thrombolytic properties of rtPA on human thrombi in vitro. Br J Pharmacol. 153 (1), 124-131 (2008).
- Herbig, B. A., Yu, X., Diamond, S. L. Using microfluidic devices to study thrombosis in pathological blood flows. Biomicrofluidics. 12 (4), 042201 (2018).
- Jigar Panchal, H., Kent, N. J., Knox, A. J. S., Harris, L. F. Microfluidics in haemostasis: A review. Molecules. 25 (4), 833 (2020).
- Zeng, Z., et al. Fluorescently conjugated annular fibrin clot for multiplexed real-time digestion analysis. J Mater Chem B. 9 (45), 9295-9307 (2021).
- Zeng, Z., Christodoulides, A., Alves, N. J. Real-time tracking of fibrinolysis under constant wall shear and various pulsatile flows in an in-vitro thrombolysis model. Bioeng Transl Med. 8 (3), e10511 (2023).
- Christodoulides, A., Zeng, Z., Alves, N. J. In-vitro thromboelastographic characterization of reconstituted whole blood utilizing cryopreserved platelets. Blood Coagul Fibrinolysis. 32 (8), 556-563 (2021).
- Zeng, Z., Nallan Chakravarthula, T., Christodoulides, A., Hall, A., Alves, N. J. Effect of Chandler loop shear and tubing size on thrombus architecture. J Mater Sci Mater Med. 34 (5), 24 (2023).
- Touma, H., Sahin, I., Gaamangwe, T., Gorbet, M. B., Peterson, S. D. Numerical investigation of fluid flow in a chandler loop. J Biomech Eng. 136 (7), (2014).
- Wojdyla, M., Raj, S., Petrov, D. Absorption spectroscopy of single red blood cells in the presence of mechanical deformations induced by optical traps. J Biomed Opt. 17 (9), (2012).
- Wu, J. H., Diamond, S. L. A fluorescence quench and dequench assay of fibrinogen polymerization, fibrinogenolysis, or fibrinolysis. Anal Biochem. 224 (1), 83-91 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon