Method Article
Verfolgung der Fibrinolyse von Chandler-Schleifen-gebildeten Vollblutgerinnseln unter Scherströmung in einem In-vitro-Thrombolysemodell
In diesem Artikel
Zusammenfassung
In-vitro-Thrombolyse-Assays haben oft Schwierigkeiten, In-vivo-Bedingungen zu replizieren, sei es im Modellthrombus, der verdaut wird, oder in der Umgebung, in der die Thrombolyse stattfindet. Im Folgenden untersuchen wir, wie die Kopplung des Chandler-Loops und des Real-Time Fluorometric Flowing Fibrinolysis Assay (RT-FluFF) für eine hochgenaue Ex-vivo-Überwachung der Gerinnsellyse verwendet wird.
Zusammenfassung
Thromboembolien und damit verbundene Komplikationen sind weltweit eine der Hauptursachen für Morbidität und Mortalität, und es wurden verschiedene Assays entwickelt, um die Wirksamkeit thrombolytischer Arzneimittel sowohl in vitro als auch in vivo zu testen. Die Nachfrage nach physiologisch relevanteren In-vitro-Gerinnselmodellen für die Arzneimittelentwicklung steigt aufgrund der Komplexität und der Kosten, die mit Tiermodellen verbunden sind, sowie ihrer oft fehlenden Übertragbarkeit auf die Humanphysiologie. Strömung, Druck und Schergeschwindigkeit sind wichtige Eigenschaften des Kreislaufsystems, wobei Gerinnsel, die unter Fluss gebildet werden, eine andere Morphologie und Verdauungseigenschaften aufweisen als statisch gebildete Gerinnsel. Diese Faktoren sind in herkömmlichen In-vitro-Assays für den Gerinnselverdau oft nicht vertreten, was pharmakologische Implikationen haben kann, die sich auf die translationalen Erfolgsraten von Arzneimitteln auswirken.
Der Real-T ime Fluorometric Flowing Fibrinolysis (RT-FluFF) Assay wurde als High-Fidelity-Thrombolyse-Testplattform entwickelt, bei der fluoreszenzmarkierte Gerinnsel verwendet werden, die unter Scherfluss gebildet und dann mit zirkulierendem Plasma in Gegenwart oder Abwesenheit von fibrinolytischen pharmazeutischen Wirkstoffen verdaut werden. Die Modifikation der Flussraten sowohl der Gerinnselbildung als auch der Gerinnselverdauungsschritte ermöglicht es dem System, arterielle, pulmonale und venöse Erkrankungen in sehr unterschiedlichen Versuchsanordnungen zu imitieren. Die Messungen können kontinuierlich mit einem Inline-Fluorometer oder durch Messung diskreter Zeitpunkte sowie mit einer herkömmlichen Endpunkt-Gerinnselmassenmessung durchgeführt werden. Der RT-FluFF-Assay ist ein flexibles System, das die Echtzeit-Verfolgung des Gerinnselverdaus unter Flussbedingungen ermöglicht, die die physiologischen Bedingungen in vivo genauer darstellen und gleichzeitig die Kontrolle und Reproduzierbarkeit eines In-vitro-Testsystems beibehalten.
Einleitung
Krankheiten, die im Wesentlichen auf thromboembolische Ätiologien zurückzuführen sind, stellen in der heutigen Gesellschaft eine Hauptursache für Morbidität und Mortalität dar. Zu den Manifestationen der thromboembolischen Pathogenese gehören unter anderem Myokardinfarkte, ischämische Schlaganfälle, tiefe Venenthrombosen und Lungenembolien1. Ein enormer Teil der laufenden Forschung, die sich über mehrere Disziplinen erstreckt, dreht sich um die Entwicklung sicherer und wirksamer Methoden für den Umgang mit pathogenen Thrombosen. Unterschiedliche arterielle und venöse Manifestationen der Thrombose und unterschiedliche anatomische Lokalisationen haben zur Entwicklung unterschiedlicher Behandlungsansätze geführt. Die Akutbehandlung beruht jedoch im Allgemeinen auf dem Einsatz einer pharmakologischen Thrombolyse über Plasminogenaktivatoren, die unter bestimmten klinischen Umständen eine mechanische Thrombektomie ermöglichenkönnen 2.
Die Entwicklung neuartiger pharmakologischer Behandlungsstrategien stützt sich grundsätzlich sowohl auf In-vivo-Tiermodelle als auch auf In-vitro-Verdauungsmodelle für die präklinische Erprobung 3,4. In-vivo-Modelle profitieren natürlich von ihrer Fähigkeit, das komplexe Zusammenspiel verschiedener physiologischer Parameter auf die Wirksamkeit der Behandlung zu erfassen, einschließlich der Clearance von pharmazeutischen Wirkstoffen sowie zellulärer Wechselwirkungen mit Arzneimitteln. Dieselbe Komplexität macht solche Modelle jedoch oft recht kostspielig und führt zu zusätzlichen Problemen beim Versuch, die zugrunde liegende Pharmakodynamik/Kinetik bei Tieren zu isolieren, die sich erheblich von der menschlichen Physiologie unterscheidet. Die Entwicklung von In-vitro-Modellen hat dazu beigetragen, dass eine destillierte Testumgebung ermöglicht wurde, in der die Entwicklung und das Screening von Arzneimitteln durchgeführt werden können, die jedoch oft nicht die erforderliche Genauigkeit aufweisen, um den untersuchten Krankheitszustand zu rekapitulieren.
Häufig anzutreffende In-vitro-Protokolle zur Erprobung neuartiger Thrombolytika beruhen auf der Verwendung von Gerinnseln, die unter statischen Bedingungen gebildet und lysiert werden, wobei die verbleibende Gerinnselmasse als primärer Endpunkt dient 5,6. Leider berücksichtigen solche Techniken nicht die mechanischen Aspekte der Gerinnsellyse, wie z. B. turbulente Strömung und transthrombusische Druckabfälle, die die Pharmakodynamik von Testmedikamenten erheblich verändern können. Darüber hinaus enthalten Gerinnsel, die unter statischen Bedingungen gebildet werden, eine Mikroarchitektur, die sich von physiologischen Gerinnseln unterscheidet. Es wurde reproduzierbar gezeigt, dass das Vorhandensein von Scherung während der Gerinnselbildung die resultierenden Gerinnseleigenschaften wie Thrombozytenaktivierung und Fibrinvernetzung beeinflusst. Gerinnsel, die unter Scherströmung erzeugt werden, weisen eine komplexe Heterogenität von der Spitze bis zum Ende auf, die bei statisch gebildeten Gerinnseln nicht vorhanden ist 7,8. Solche Abweichungen von der physiologischen Gerinnselarchitektur können sich auf die Charakterisierung wichtiger Arzneimittelentwicklungen auswirken, die die Wirkstoffpenetration innerhalb eines Thrombus und die anschließende Lyseeffizienz umfassen9.
Um einige dieser Einschränkungen im Zusammenhang mit der Verwendung von statischen Gerinnungs-/Gerinnungslysemodellen zu beheben, hat die Einführung der Chandler-Schleife sowohl für die Gerinnselbildung als auch für die Gerinnsellyse in Gegenwart von Scherung ein Wiederaufleben erlebt10. Obwohl solche Systeme eine bessere Darstellung der Strömungsdynamik ermöglichen und Gerinnsel mit einer physiologisch relevanteren Architektur im Vergleich zu relativ statischen Assays erzeugen, stellen ihre vereinfachten Strömungsbedingungen immer noch eine Abweichung von den physiologischen Bedingungen dar. Schließlich wurden auch mikrofluidische Ansätze aufgrund ihrer einfachen Bildgebung und ihrer gleichmäßigen Strömungsmuster verfolgt. Sie bleiben jedoch eine signifikante Entfernung von den physiologischen Bedingungen, die bei den größeren Gefäßen erwartet werden, die hauptsächlich von den meisten klinisch relevanten thromboembolischen Erkrankungen betroffen sind11,12.
Vor dem Hintergrund der obigen Diskussion haben wir ein hochgenaues In-vitro-Thrombolysemodell für das präklinische Thrombolytik-Screening entwickelt. Das Modell zielt darauf ab, einige der oben beschriebenen aktuellen Fallstricke im Bereich des neuartigen thrombolytischen Therapie-Screenings zu beheben und wurde auf Reproduzierbarkeit und Sensitivität bei unterschiedlichen Konzentrationen von Gewebeplasminogenaktivator (tPA) validiert. Das hierin beschriebene System bietet physiologische Scherströmungen unter Verwendung einer Peristaltikpumpe, eines Druckdämpfers, eines beheizten Reservoirs, zweier Drucksensoren, eines Inline-Fluorometers und eines fluoreszenzmarkierten Chandler-Schleifen-schergebildeten Gerinnselanalogons, um die Echtzeitverfolgung der Fibrinolyse13 zu erleichtern. Zusammengenommen wird das Gesamtsystem als Real-Time Fluorometric Flowing Fibrinolysis Assay (RT-FluFF Assay)14 bezeichnet, und in diesem Manuskript werden die Feinheiten der erfolgreichen Einrichtung und Durchführung von Assays in diesem hochpräzisen In-vitro-Thrombolysemodell erörtert.
Protokoll
Alle unten genannten Methoden stehen in Übereinstimmung mit den Protokollen des Institutional Review Board (IRB) und der institutionellen Ethikkommission für die Humanforschung. Alle gesunden Freiwilligen gaben vor der Blutspende eine schriftliche und informierte Einverständniserklärung ab. Zu beachten ist, dass alle Materialien, auf die im Protokoll verwiesen wird, in der Materialtabelle zu finden sind. Während humaner WB und Plasma in diesem Protokoll diskutiert werden, kann die Verwendung von Forschungstierblut und faktorentleerten Blutprodukten gekauft und ersetzt werden.
1. Vollblutentnahme
- Entnehmen Sie venöses Vollblut (WB) von einwilligenden gesunden Freiwilligen unter Verwendung von Standard-Phlebotomietechniken.
VORSICHT: Stellen Sie sicher, dass universelle Vorsichtsmaßnahmen befolgt werden, um das Risiko des Kontakts mit Blut oder anderen potenziell infektiösen Materialien während dieses Protokolls zu verringern. Das Tragen von Handschuhen, einem Laborkittel und einem Gesichtsschutz ist erforderlich. - Sammeln Sie ~50 mL WB direkt in 3,2 % Natriumcitrat-Röhrchen und füllen Sie sie sofort in 50 mL Röhrchen zur späteren Verwendung.
HINWEIS: Vor der Blutentnahme in das Citratröhrchen ist eine Entsorgung des Röhrchens erforderlich, zusätzlich zur Sicherstellung, dass die Röhrchen auf das vom Hersteller empfohlene Volumen gefüllt sind. Frisch gesammelter WB rekapituliert am besten die Gerinnungsdynamik des Wirts. Eine kurzfristige Lagerung von WB bei Raumtemperatur (≤4 h vor der Verwendung) ist zulässig. WB wird nicht über Nacht gelagert, da sich bei der Untersuchung mittels Thromboelastographie gezeigt hat, dass dies die Gerinnungsdynamik beeinflusst15.
2. Bildung von Gerinnseln
- In 3 ml citriertes Vollblut wird fluoreszierendes (Fluorescein-Isothiocyanat [FITC]) markiertes Fibrinogen (FITC-Fg) bis zu einer Endkonzentration von 60 μg/ml gegeben (Verhältnis von 1:50 fluoreszierend markiertem Fibrinogen zu unmodifiziertem Fibrinogen unter der Annahme einer endogenen Plasmafibrinogenkonzentration von 3 mg/ml).
HINWEIS: Dieses Verhältnis kann auf bis zu 1:10 erhöht werden, mit minimalen Auswirkungen auf die Gerinnselmorphologie. 13,14 Fluoreszenzmarkiertes Fibrinogen kann gekauft oder durch Reaktion von Fibrinogen mit Fluoresceinisothiocyanat (FITC) erzeugt werden. Das Fibrinogen-Mischen sollte ≤5 Minuten vor Beginn des Laufs erfolgen.- Wenn Fibrinogen zuvor aliquotiert und eingefroren wurde, ist das aufgetaute FITC-Fg zu untersuchen, um sicherzustellen, dass die Polymerisation nicht vorzeitig begonnen hat und dadurch unbrauchbar wird (stellen Sie sicher, dass die Lösung keine Partikel oder Fasern enthält).
- Bereiten Sie das Chandler-Loop-Setup mit einer Trommel mit einem Durchmesser von 120 mm in einem 37 °C-Wasserbad vor (Abbildung 1). Stellen Sie sicher, dass sich die Chandler-Schlaufe während des gesamten Gerinnselbildungsprozesses mit einer festen Drehzahl von 0-90 U/min drehen kann.
HINWEIS: Weitere Einstellungen und Modifikationen der Chandler-Schleife finden Sie in Zeng et al.16. Urheberrecht - Schneiden Sie die Schläuche ab (Innendurchmesser 5/32", Außendurchmesser 7/32") und formen Sie Schlaufen, die fest, aber nicht fest um die Trommel passen. Schneiden Sie für die hier besprochene empfohlene Schlauchgröße ein Standard-PCR-Röhrchen mit 200 μl ab, das als Anschluss verwendet wird, um die Enden des Schlauchs zu verbinden, um den geschlossenen Kreislauf zu bilden.
HINWEIS: Unterschiedliche Schlauchgrößen können verwendet werden, um Klumpen unterschiedlicher Größezu erzeugen 16. - Initiieren Sie die Blutgerinnung, indem Sie 200 mM Calciumchloridlösung in einem Verhältnis von 1:17 Calciumlösung zum Vollblut hinzufügen. Laden Sie das Blut mit einer 3-ml-Spritze in den Schlauch (füllen Sie ~50% des Schlauchvolumens). Platzieren Sie die Schlaufe sofort auf der Chandler-Schlauftrommel, die die Enden verbindet, und beginnen Sie mit der Drehung.
- Stellen Sie sicher, dass das Mischen vor dem Laden ordnungsgemäß mit sanfter Inversion durchgeführt wird, um Probleme zu vermeiden, die sich aus dem Absetzen der WB-Komponenten ergeben.
- Stellen Sie sicher, dass jedem Röhrchen bei jedem Lauf die gleiche Menge Blut zugesetzt wird, da dies die Gerinnselgröße beeinflussen kann, wenn es nicht konstant gehalten wird.
- Da Blasen in der Blutsäule auch die Blutgerinnung beeinflussen können, entfernen Sie sie, indem Sie den Schlauch vorsichtig in einer "Wippe" bewegen, um das Entweichen der Blasen zu erleichtern, bevor Sie sie auf die Trommel laden.
- Drehen Sie die Trommel teilweise im Wasserbad mit einer Rotationsrate von 40 U/min, um eine berechnete Scherrate von ~450 s-1 zu erreichen.
HINWEIS: Informationen zu berechneten Scheren basierend auf der Schlauchgröße und der Drehzahl (20 bis 60 U/min) finden Sie unter Zeng et al.16. Typische venöse und arterielle Scherraten sind 20-200 s-1 bzw. 300-1.000 s-1, wobei ~400-500 s-1 repräsentativ für die Lungenarterie ist. - Lassen Sie die Gerinnsel 40-60 Minuten lang bei schlechten Lichtverhältnissen entstehen, um das Photobleichen des fluoreszenzmarkierten Fibrinogens zu minimieren.
- Nachdem die gewünschte Gerinnungszeit erreicht ist, entfernen Sie die Gerinnsel aus dem Schlauch und verwenden Sie sie sofort. Um eine sanfte Entfernung der Gerinnsel zu gewährleisten, ohne die Struktur zu beeinträchtigen, drehen Sie den Schlauch vorsichtig um, damit das Gerinnsel langsam aus dem Röhrchen in einen kleinen Behälter gleiten kann.
HINWEIS: Die Lagerung von gebildeten Gerinnseln in Citratplasma oder PBS über Nacht bei 4 °C kann sich auf die nachfolgende Analyse des Gerinnselverdaus im Fließkreislauf auswirken.
3. Einrichtung des RT-FluFF-Instruments
- Stellen Sie sicher, dass das Durchflussschleifengerät angeschlossen ist, wie in Abbildung 2 gezeigt, und dass alle Verbindungen sicher sind. Kurz gesagt, die Durchflussschleifenvorrichtung umfasst in der Reihenfolge der Strömungsrichtung: Pumpe > Dämpfer > Einlassdrucksensor > Gerinnsel- > Ausgangsdrucksensor > Fluorometer > beheizter Behälter > Pumpe. Passen Sie die Auswahl der Pumpenkapazität, der experimentellen Durchflussrate, des Schlauchdurchmessers und der Schlauchlänge, der Temperatur, des Reservoirvolumens und der Gerinnselgröße/-geometrie an die für jede Studie individuellen experimentellen Anforderungen an.
HINWEIS: In diesem Beispiel wurde für RT-FluFF der gleiche Schlauchdurchmesser verwendet, der in der Chandler-Schlaufe verwendet wurde. Die Schläuche können für mehrere Läufe am selben Tag verwendet werden, müssen jedoch auf Degradation oder Undichtigkeit überwacht und bei Bedarf gewechselt/gespült werden. Es wird empfohlen, zwischen den Durchläufen mit warmem destilliertem Wasser zu spülen. Je nach Versuchsaufbau kann es erforderlich sein, die Schläuche nach jedem Lauf auszutauschen. - Sobald alle Schläuche gesichert sind, schalten Sie das Druckwächter ein. Stellen Sie sicher, dass der Druckwächter 0 mmHg sowohl für den Einlass- als auch für den Auslasssensor anzeigt. Ist dies nicht der Fall, öffnen Sie die Ventile, um sicherzustellen, dass die Drucksensoren für den atmosphärischen Druck geöffnet sind, und stellen Sie die Sensoren auf Null.
- Schalten Sie den Heizblock oder das Wasserbad ein, das gerade verwendet wird, und überwachen Sie die Temperatur im Verlauf des Experiments. Halten Sie die Temperatur nahe 37 °C, um die physiologische Körpertemperatur des Menschen nachzuahmen.
- Schalten Sie die Pumpe auf die gewünschte Durchflussmenge ein, um nach Undichtigkeiten zu suchen und sicherzustellen, dass die Drucksensoren funktionieren.
HINWEIS: Eine Durchflussrate von ~160 ml/min in dieser Schlauchgröße entspricht einer Scherrate von ~500 s-1. - Schalten Sie die Pumpe aus, um das Laden der Gerinnsel zu erleichtern.
4. Laden des Gerinnsels in den Fließkreislauf
- Wenn ein zuvor hergestelltes Gerinnsel, das gelagert wurde, verwendet wird, stellen Sie sicher, dass das Gerinnsel auf Raumtemperatur gebracht wird, bevor Sie es in das Durchflusskreislaufsystem laden.
- Der Massenverlust von Gerinnseln ist eine wichtige Endpunktmessung für Thrombolyse-Assays. Es empfiehlt sich, die Gerinnselmasse zu messen, bevor sie in die Fließschleife geladen wird, anstatt sich auf vorherige Messungen zu verlassen.
- Die Messung der Gerinnselmasse sollte jedes Mal auf die gleiche Weise durchgeführt werden, um die Konsistenz über die Proben und über die Assay-Tage hinweg zu gewährleisten, da der Flüssigkeitsgehalt innerhalb und auf den Gerinnseln ihre Masse erheblich beeinflussen kann. Die beste Vorgehensweise besteht darin, Gerinnsel vorsichtig auf Labortüchern zu tupfen, bis sie keine signifikante Menge an Flüssigkeit mehr an das Tuch abgeben, wobei darauf zu achten ist, dass das Gerinnsel während des gesamten Messvorgangs nicht zusammengedrückt wird.
- Tauchen Sie das Gerinnsel in das Plasma (autologe oder typangepasste) oder eine andere mobile Phasenlösung, die im Durchflusskreislauf verwendet wird (z. B. PBS oder definierte Medien), in einen flachen Behälter, z. B. eine Waage. Die Lösung für die mobile Phase sollte direkt aus dem 50-ml-Systemreservoir entnommen werden, um das Gesamtsystemvolumen zu kontrollieren. Während der Phase der Gerinnselbeladung sollte kein thrombolytisches oder pharmazeutisches Prüfmittel vorhanden sein. Es wird empfohlen, das Gesamtvolumen der mobilen Phase für den Betrieb des Flusskreislaufs ≥50 ml zu betragen und sollte über alle Proben hinweg konsistent sein.
- Entfernen Sie den mittleren Teil des Durchflussschlauchs (zwischen Einlass- und Auslasssensoren) und befestigen Sie eine 10-ml-Spritze an einem Ende des Schlauchs.
- Legen Sie den Schlauch mit dem freien Ende in das Plasma (oder die mobile Phase) und nehmen Sie ein kleines Volumen der Lösung auf, um den Schlauch zu grundieren. Platzieren Sie dann den Schlaucheinlass in der Nähe des Gerinnsels und untersuchen Sie das Gerinnsel sorgfältig, um den Kopf (in der Regel das etwas dickere Ende des Gerinnsels) und den Schwanz (Ende gegenüber dem Kopf) zu identifizieren. Der Kopf des Gerinnsels sollte in Richtung des Einlassdrucksensors und vom Auslass weg positioniert werden. Platzieren Sie den Schlauch am "hinteren" Ende des Gerinnsels und saugen Sie ihn mit der Spritze in den Schlauch ab.
HINWEIS: In Fällen, in denen die Richtungsrichtung des Gerinnselkopfes/-schwanzes nicht visuell bestimmt werden kann, kann die Richtungsabhängigkeit am besten auf der Grundlage der Kenntnis der Drehrichtung aus der Chandler-Schlaufe zugewiesen werden - der Gerinnselkopf zeigt in die entgegengesetzte Richtung der Trommeldrehung. - Befestigen Sie den Schlauch wieder so am Hauptgerät, dass das Gerinnsel dem Ausgangsdrucksensor am nächsten ist (der Kopf des Gerinnsels sollte vom Auslasssensor weg zeigen). Sichern Sie das Gerinnsel in seiner Position, indem Sie den Schlauch und den Gerinnselkopf mit zwei 30-G-Nadeln in einem "X"-Muster punktieren. Lassen Sie diese Nadeln für die Dauer des Laufs drin.
HINWEIS: Abhängig von den Einstellungen des Dämpfers und der Pumpe können zusätzliche Nadeln erforderlich sein, um sicherzustellen, dass das Gerinnsel nicht vorzeitig fragmentiert. Bei Bedarf kann der Schlauch hinter dem Gerinnsel mit einem Sieb versehen werden, um zu verhindern, dass Gerinnselfragmente im System zirkulieren. Sobald eine festgelegte Anzahl von Nadeln festgelegt wurde, um das Gerinnsel zu halten, halten Sie diese unter allen Bedingungen konstant. - Nehmen Sie den Rest der Lösung für die mobile Phase und geben Sie ihn in ein 50-ml-Röhrchen als Reservoir.
- Stellen Sie den Behälter in das Wasserbad und setzen Sie den Einlass- und Auslassschlauch ein (der Auslass erfolgt vom Fluorometer und der Einlass geht in den Pumpenkopf).
- Überprüfen Sie, ob das verwendete Fluorometer angeschlossen und überwacht ist. Überprüfen Sie, ob der Anfangswert im Vergleich zu einem reinen Phasensystem für mobile Phasen zu Beginn des Experiments angemessen ist.
HINWEIS: Wenn kein Inline-Fluorometer verfügbar ist, kann eine serielle periodische Probenahme des Reservoirs in definierten Intervallen während des gesamten Analysezeitraums des Durchflusskreislaufs durchgeführt werden. Die gesammelten Fraktionen können unmittelbar nach Abschluss des Experiments mit einer 96-Well-Platte auf jedem kommerziell erhältlichen Spektralphotometer abgelesen werden. - Geben Sie 500 μl 100.000 ng/mL tPA direkt in das Reservoirvolumen, um eine endgültige Konzentration von 1.000 ng/mL tPA in 50 mL zu erreichen. Das Volumen, die Konzentration und das spezifische Medikament, das hinzugefügt wird, hängen von der gewünschten zirkulierenden Zielkonzentration und dem Volumen des Systemreservoirs ab.
- Überprüfen Sie vor dem Starten der Pumpe Folgendes:
- Alle Knotenpunkte sind gesichert.
- Die beiden Ventile oberhalb der Drucksensoren befinden sich in der entsprechenden geschlossenen Position.
- Jegliches restliche Plasma (oder Flüssigkeit) wurde in das Reservoir ersetzt.
- Das Thrombolytikum wurde in das Reservoir gegeben und ordnungsgemäß gemischt.
- Der Einlassschlauch befindet sich in der Nähe des Bodens des Behälters (dies sorgt für minimale Blasenbildung).
- Der Auslassschlauch ist sicher und in der richtigen Höhe für den gewünschten Druck (abhängig davon, welcher Behälterstandort modelliert wird).
- Die Drehrichtung der Pumpe ist korrekt (Durchflussreihenfolge: Pumpe > Dämpfer > Gerinnsel > Fluorometer > Reservoir > Pumpe).
- Wenn die Pumpendrehzahl sehr hoch eingestellt ist (>150 U/min), beginnen Sie mit einer langsameren Drehzahl und fahren Sie hoch, um sicherzustellen, dass die schnelle Druckänderung das Gerinnsel nicht fragmentiert oder zu Leckagen an den Schläuchen führt.
- Stellen Sie sicher, dass das System die Daten vom Fluorometer ordnungsgemäß aufzeichnet und/oder dass die Vorräte für die regelmäßige Probenahme der mobilen Phase für die Ablesung nach dem Experiment vorbereitet sind.
- Schalten Sie die Pumpe ein und stellen Sie sie so ein, dass sie den gewünschten Volumenstrom von 160 mL/min erreicht oder erhöhen Sie die Durchflussmenge, bis der gewünschte Druck erreicht ist. Das System füllt sich mit Flüssigkeit und Blasen. Die Blasen erhöhen die fluorometrischen Messwerte künstlich, also achte darauf, dass sich die Blasen klären. Sobald dies der Fall ist, schalten Sie das Licht aus und beginnen Sie mit der Datenerfassung.
- Lassen Sie die Pumpe laufen, bis das Gerinnsel deutlich abgebaut ist oder die gewünschte Versuchszeit (≥60 min) abgelaufen ist. Fügen Sie dem System während des gesamten Experiments nach Bedarf Reagenzien über das Reservoir hinzu, um einzigartige experimentelle Bedingungen zu schaffen, unter denen eine Vielzahl von thrombolytischen Variationen getestet werden kann.
HINWEIS: Die Versuchszeit hängt von der Fördermenge der Pumpe (Schergrad) und der Konzentration des Thrombolytikums ab. - Sobald der Assay abgeschlossen ist, reduzieren Sie den Volumenstrom und entfernen Sie die Einlassschläuche, während die Pumpe noch läuft, um den größten Teil der Flüssigkeit im System in das Reservoir zu drücken (eine bewegliche Phase verbleibt in den Schläuchen). Trennen Sie den gerinnselhaltigen Schlauchabschnitt an der Seite des Ausgangsdrucksensors vom Schlauch und senken Sie ihn in ein Wägeschiffchen ab.
- Entfernen Sie die Nadeln, die das Gerinnsel an Ort und Stelle halten, um die Restflüssigkeit aus dem System und die Gerinnsel-/Gerinnselfragmente aufzufangen. Verwenden Sie bei Bedarf eine Spritze, um das System zu reinigen.
- Wiegen und verarbeiten Sie das verbleibende Gerinnsel für zusätzliche Analysen, z. B. die Berechnung des prozentualen Massenverlusts oder für die Histologie.
5. Reinigen des Systems
- Spülen Sie das gesamte System zwischen den Proben mit warmem Wasser bei hoher Drehzahl (>150 U/min). Laden Sie das Wasser in den Behälter und lassen Sie es mindestens 2 Minuten lang durch das System laufen, leeren Sie es und lassen Sie es für zwei vollständige Systemspülungen erneut laufen. Wenn der Fluorometerwert nach diesen Spülungen nicht auf den Ausgangswert zurückkehrt, wiederholen Sie den Spülvorgang für einen weiteren Zyklus. Wenn es immer noch nicht zum Ausgangswert zurückgekehrt ist, wechseln Sie den Schlauch vollständig, bevor Sie die nächste Probe untersuchen.
HINWEIS: Während der Versuche können die Schläuche zwischen den Proben wiederverwendet werden. Aufgrund der Perforation mit Nadeln, mit denen das Gerinnsel an Ort und Stelle gehalten wird, sollte der Schlauchabschnitt zwischen den Einlass- und Ausgangsdrucksensoren jedoch nach jedem Lauf ausgetauscht werden. Unter bestimmten experimentellen Bedingungen kann es erforderlich sein, den gesamten Schlauchsatz nach jedem Lauf auszutauschen oder Clustering-Assays durchzuführen, um eine Kreuzkontamination der Probe zu vermeiden. - Nachdem alle Proben für die Experimente an diesem Tag durchgeführt wurden, entfernen Sie alle Schläuche und entsorgen Sie sie. Schrubben Sie die T-Übergänge mit heißem Wasser und einer Borstenbürste, bis sie sauber sind, lassen Sie sie trocknen und spülen Sie die Spritzenfeuchter mit heißem Wasser ab. Verwenden Sie 70% EtOH, um die Sterilität zu verbessern.
Ergebnisse
Bildung von Chandler-Schlingengerinnseln
Bei der Bildung von Gerinnseln strebten wir im Allgemeinen Vierfachpräparate an, um sicherzustellen, dass wir auch im Falle von Gerinnselausreißern (basierend auf der Bruttomorphologie und -masse) in der Lage waren, dreifache Thrombolysetests durchzuführen. Unter der Annahme optimaler Belastungsbedingungen sollten alle Gerinnsel in Länge (~3,3 cm), Gewicht (~100 mg) und Aussehen ziemlich einheitlich sein, wie in Abbildung 3 dargestellt. Bei der Verwendung von FITC-Fg zielten wir auch darauf ab, Gerinnsel unter UV-Licht zu untersuchen, um eine relativ gleichmäßige Dispersion der Fluoreszenz im Gegensatz zu unregelmäßigen Bereichen mit Hyperfluoreszenzmarkierung innerhalb des Gerinnsels zu gewährleisten. Die Variation des Grades von FITC-Fg im Vollblut sollte das Gewicht oder das Aussehen der Gerinnsel innerhalb der von uns untersuchten Konzentrationen nicht verändern. Die Mikrogerinnselarchitektur wurde jedoch bei den höchsten FITC-Fg-Konzentrationen (1:5 FITC-Fg zu unmodifiziertem Fg) beeinflusst. Frühere Arbeiten von Zeng et al. erfassen die breite Palette von Gerinnselphänotypen, die in der Chandler-Schleife in Abhängigkeit von der gewählten Scherstufe erwartet werden16.
Manchmal kann es zu Fehlgerinnungen kommen. Die häufigsten Probleme bei der Gerinnselbildung lassen sich in eine von zwei Kategorien einteilen: (i) vorzeitige Gerinnung und (ii) gestörte Gerinnung. Bei einer vorzeitigen Gerinnung verfestigt sich das gesamte Blutvolumen im Chandler-Schlaufenschlauch. Dies wird deutlich, wenn die Trommeldrehung eingeschaltet ist, da das Blut nicht "fließt", sondern an den Wänden des Schlauchs klebt und sich im Gleichklang dreht. Unter diesen Umständen sind diese Gerinnsel nicht verwendbar und müssen verworfen werden. Um dies zu vermeiden, stellen Sie sicher, dass nach Aktivierung der Gerinnung durch Zugabe von Calciumchlorid der Kreislauf sofort geschlossen und auf die rotierende Trommel gelegt wird, damit die Gerinnung erfolgen kann. Der zweite Umstand, die gestörte Gerinnung, tritt ein, wenn die Proben nicht ausreichend gemischt wurden oder wenn das Blut vor Beginn der Rotation zu gerinnen begonnen hat, aber nicht ganz so signifikant wie unter den Umständen (i). Gerinnsel mit den oben genannten Problemen neigen dazu, bei der Handhabung fadenziehend und fadenscheinig zu erscheinen und haben oft eine deutlich erhöhte Gerinnselmasse. Phänotypisch nähern sie sich Gerinnseln an, die bei sehr niedrigen venösen Scherungen zu sehen sind, da dies im Wesentlichen die Gerinnung im Rahmen der Stasis darstellt. Gelegentlich ist mit unregelmäßigen Gerinnseln zu rechnen und diese zu verwerfen.
RT-FluFF Fluorometer-Kalibrierung
Ein wichtiges Merkmal des RT-FluFF-Systems ist das Fluorometer oder Spektralphotometer, mit dem die Thrombolyse über die verstrichene Gerinnselverdauungsphase verfolgt wird. Vor der Durchführung von Experimenten ist es von entscheidender Bedeutung, dass das Fluorometer oder Spektralphotometer ordnungsgemäß funktioniert. Da wir unser Fluorometer speziell für das RT-FluFF-Gerät entwickelt haben, mussten wir für unsere Zwecke sicherstellen, dass es bei bekannten Mengen an FITC-Fg-Verdünnungen in einer statischen Lösung gut mit dem Spektralphotometer korreliert (Abbildung 4A). Nachdem wir in der Lage waren, den linearen Bereich unseres Fluorometers sicher zu bestimmen, wollten wir als Nächstes sehen, wie sich das Fluorometer bei Strömung verhalten würde. Wir überprüften die Funktionalität, indem wir Fluorescein inkrementell in die fließende Lösung injizierten, um einen schrittweisen Anstieg der Fluoreszenz zu überwachen, um die Reproduzierbarkeit der Fluorometermesswerte besser zu verstehen und zu bestimmen, wie schnell die Fluoreszenz innerhalb des fließenden Systems äquilibriert wurde (Abbildung 4B). Nachfolgende Experimente wurden durchgeführt, indem sowohl Fluorescein als auch FITC-Fg kontinuierlich in die Lösung injiziert wurden, um die von den Fibrinolyse-Experimenten erwartete kontinuierliche Fluoreszenzfreisetzung besser nachzuahmen (Abbildung 4C). Es wird angenommen, dass die Unterschiede in der Steigung, die zwischen FITC-Fg und FITC dargestellt werden, auf die Auswirkungen des Quenchings zurückzuführen sind, das auftritt, wenn FITC in der Nähe von sich selbst konjugiert wird, z. B. wenn viele FITC-Moleküle an ein einzelnes Protein (in diesem Fall Fibrinogen) konjugiert sind. Natürlich unterscheiden sich die schrittweisen Erhöhungen und Steigungen nicht nur aufgrund der verwendeten FITC/FITC-Fg-Konzentrationen, sondern auch aufgrund der Anzahl der FITC-Moleküle pro Fibrinogen. Im weiteren Sinne ist es von entscheidender Bedeutung, den Grad der FITC-Fibrinogen-Konjugation bei der Durchführung von Experimenten mit dem RT-FluFF zu kontrollieren, wenn die Daten über zahlreiche Gerinnselchargen hinweg verglichen werden sollen. Durch umfangreiche Experimente haben wir herausgefunden, dass ~14 FITC-Konjugationen pro Fibrinogen ein gutes Fluoreszenzsignal zur Verfolgung des Gerinnselverdaus liefern, während sie in Lösung stabil bleiben (begrenzte vorzeitige Aggregation) und mit minimalen Auswirkungen auf die resultierende Gerinnselmikrostruktur. Es ist wichtig zu beachten, dass jedes Mal, wenn reines, nicht geronnenes FITC-Fg durch die RT-FluFF-Apparatur geleitet wird, die Exposition von FITC-Fg gegenüber hoher Scherung seine Aggregation fördern kann. Dieses Phänomen wird am häufigsten an den Verbindungsstellen von Schlauchverbindungen und innerhalb der Pumpenkopfschläuche beobachtet und kann im Laufe der Zeit die verfügbare Fluoreszenz in Lösung beeinflussen.
Bei der Entnahme von Proben aus dem Durchflusskreislauf zu diskreten Zeitpunkten zum Ablesen der Fluoreszenz auf einem Spektralphotometer sind viele dieser Überlegungen im Zusammenhang mit der Fluorometerkalibrierung nicht erforderlich. Es ist jedoch immer noch notwendig, den Dynamikbereich des verwendeten spezifischen Spektralphotometers zu untersuchen, um sicherzustellen, dass die FITC-Fg-Markierung, die Menge an FITC-Fg in dem durch die Chandler-Schleife gebildeten Gerinnsel und die Größe des Gerinnsels in Ihrem System optimiert sind. Es wird empfohlen, die Proben entweder unmittelbar nach der Isolierung aus dem System abzulesen oder nach Abschluss des Experiments für Multiplex-Ablesungen in eine 96-Well-Platte zu legen. Bei Bedarf können die Proben direkt nach der Entnahme angesäuert werden, um weitere enzymatische Aktivität vor der Analyse zu eliminieren.
RT-FluFF-Gerinnsellyse
Um das RT-FluFF-System unter Verwendung von Gerinnseln, die unter arteriellen Scherungen in der Chandler-Schleife gebildet wurden, zu validieren, verwendeten wir humanes Plasma als mobile Phase in der Apparatur mit tPA (Alteplase) als fibrinolytischem Mittel. Die untersuchten Konzentrationen von tPA lagen zwischen 0 und 1.000 ng/ml. Um die menschlichen Lungenströmungsbedingungen nachzuahmen, wurde die Temperatur des Plasmareservoirs bei 37 °C gehalten und physikalisch auf 8 cm über dem Gerinnselspiegel angehoben, um einen durchschnittlichen Strömungsdruck von 12 mmHg zu erreichen, wobei die Pumprate so angepasst wurde, dass eine Scherströmung von ~500 s-1 in Abwesenheit von Gerinnseln erzeugt wurde. Das System wurde mit pulsierenden Strömungsdämpfern ausgestattet, um eine minimale Abweichung zwischen Spitzen- und Taldruck der Peristaltikpumpe zu gewährleisten und eine nahezu konstante Schergeschwindigkeit zu erreichen (Abbildung 4D). In Ermangelung eines Druckdämpfers schwankt der Ausgangsdruck der Schlauchpumpe aufgrund der Art und Weise, wie sie den Durchfluss erzeugt, erheblich, indem sie kleine Flüssigkeitspakete durch das System ausstößt, während sich der Pumpenkopf dreht. Die Gerinnsellyse wurde über einen Zeitraum von 60 Minuten beobachtet. Erwartungsgemäß führten steigende Konzentrationen von tPA zu einer erhöhten Gerinnsellyserate (RFU/Minute) und einem erhöhten Massenverlust im Vergleich zu Bedingungen mit weniger oder keinem tPA. Bei einer tPA-Konzentration von 1.000 ng/ml wurde eine ~85%ige Gerinnsellyse über einen 60-minütigen Aufschlusszeitraum erreicht. Wenn man sich grobe Bilder von Gerinnseln ansieht, die einer Lyse unterzogen werden, kann man erkennen, dass die Lyse hauptsächlich in den Schwanzregionen des Gerinnsels stattfindet, bevor sie sich auf den dichter strukturierten Kopf auswirkt, was sowohl durch die physikalische Degradation der Gerinnselarchitektur als auch durch den Verlust der Oberflächenfluoreszenz gesehen wird. Die erwartete Dehnung von Gerinnseln tritt auch aufgrund des Verlusts der mechanischen Integrität im Laufe der Zeit in Abhängigkeit von der Schergeschwindigkeit auf.
Obwohl signifikante Unterschiede in den Gerinnsellyseraten grob und basierend auf der Fluoreszenzfreisetzung festgestellt werden können, gibt es keine perfekt lineare Korrelation zwischen der Fluoreszenzfreisetzung und der Menge des vorhandenen Fibrinolytikums. Dies ist am besten in Abbildung 5 zu erkennen. Die Fibrinolyse in WB-basierten Gerinnseln führt auf natürliche Weise zur Freisetzung nicht nur von FITC-Fg-Fragmenten, sondern auch von roten Blutkörperchen (RBCs), die während der Gerinnselbildung in den Fibrinnetzwerken eingeschlossen sind. Die Freisetzung dieser Erythrozyten in den Kreislauf innerhalb des RT-FluFF-Apparats beginnt infolgedessen das zirkulierende Plasma merklich rot zu färben. Diese kolorimetrische Änderung des zirkulierenden Plasmas kann sich negativ auf die Fluoreszenzemission von zirkulierendem FITC-Fg auswirken, die vom Fluorometersensor gelesen wird. Wenn die fibrinolytischen Konzentrationen die oberen Grenzen erreichen, überwiegt der Grad der Freisetzung von FITC-Fg in die Lösung die Erythrozyteneffekte auf die Fluoreszenzemissionen.

Abbildung 1: Schematische Darstellung des Chandler Loop-Setups. Mit Blut gefüllte Röhrchen, die auf die Chandler-Schlaufentrommel geladen sind, werden während des gesamten Prozesses der Gerinnselbildung in ein 37 °C warmes Wasserbad getaucht, wobei die Beleuchtung gedimmt wird. Die Trommel wird über einen Gleichstrommotor, eine Antriebswelle und eine Steuerplatine mit einer konstanten Drehzahl gedreht. Diese Abbildung wurde von Zeng et al.14 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schematische Darstellung des RT-FluFF-Systems. Wichtige Komponenten des Systems sind auf dem Bild gekennzeichnet. Auf dem Bild ist ein einzelner großvolumiger Dämpfer abgebildet, um die Pulsationen in der Strömung zu minimieren, die mit dem Einsatz einer Schlauchpumpe verbunden sind. In Ermangelung eines Inline-Fluorometers gibt es zwei zusätzliche Optionen für die periodische Probenahme: 1) Probenahme direkt aus dem Reservoir; oder 2) mit einem Inline-Probenahmeanschluss zur Entnahme der mobilen Phase. Diese Abbildung wurde von Zeng et al.14 modifiziert. Abkürzung: RT-FluFF = Real-time Fluorometric Flowing Fibrinolysis Assay. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Eigenschaften von Grob-Chandler-Schleifen FITC-Fg-markierte WB-Gerinnsel, einschließlich Masse und physikalisches Erscheinungsbild unter Umgebungs- und UV-Licht. (A) Eine konsistente Gerinnselbildung unter verschiedenen Gerinnungsbedingungen ist durch Feinabstimmung des Protokolls zur Gerinnselbildung in der Chandler-Schleife möglich. Es ist wichtig zu beachten, dass die Gerinnselmassen und das Aussehen je nach Schlauchdurchmesser, Drehzahl und Länge der Gerinnselbildungszeit erheblich variieren. Die abgebildeten Gerinnsel wurden bei 37 °C für 1 h bei einer Scherrate von 506 s-1 gebildet. Maßstabsstäbe = 20 mm. (B) Massen von Gerinnseln, die in der Chandler-Schleife unter Verwendung des jeweiligen Verhältnisses von FITC-Fg gebildet werden. Die Daten stellen den Mittelwert ± Standardabweichung für mehr als oder gleich dreifache Datenpunkte dar. Diese Abbildung wurde von Zeng et al.14 modifiziert. Abkürzungen: FITC-Fg = Fluorescein-Isothiocyanat-markiertes Fibrinogen; WB = Vollblut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Charakterisierung des Fluorometers. (A) Vergleich des RT-FluFF Inline-Fluorometers mit einem Spektralphotometer im Zusammenhang mit bekannten Mengen an FITC-Fg-Verdünnungen. (B) Schrittweise Einführung von Fluorescein in das RT-FluFF-System zur Bestimmung der Reproduzierbarkeit von Fluorometern und der Fluoreszenzäquilibrierungszeit in fließendem menschlichem Plasma. (C) Kontinuierliche Infusionen zum Vergleich von Fluorescein und FITC-Fg in der RT-FluFF-Plattform. Die Unterschiede in der Steigung sind wahrscheinlich auf die Fluoreszenzlöschung in der FITC-Fg-Gruppe zurückzuführen. (D) Wellenformen des Ausgangsdrucksensors (nach dem Gerinnsel), die mit der Verwendung von Dämpfern unterschiedlicher Größe unter denselben Volumenstrombedingungen verbunden sind. Diese Abbildung wurde von Zeng et al.14 modifiziert. Abkürzungen: FITC-Fg = Fluorescein-Isothiocyanat-markiertes Fibrinogen; RT-FluFF = Echtzeit-fluorometrischer fließender Fibrinolyse-Assay. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
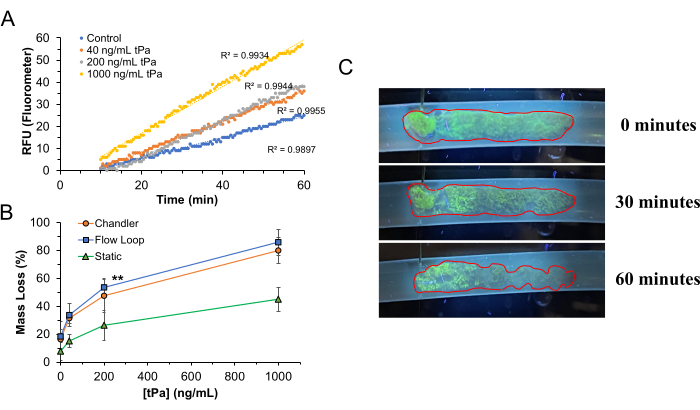
Abbildung 5: Thrombolyse in der RT-FluFF-Plattform. (A) Repräsentative Steigungen der Fluoreszenz steigen im Verlauf von 60 min Gerinnselverdau in Gegenwart von zirkulierendem tPA an. Beachten Sie die anfängliche Thrombolyseverzögerung, da die tPA-Aktivierung von Plasminogen und der Gerinnselverdauung nicht sofort erfolgt. (B) Prozentualer Verlust der Gerinnselmasse bei verschiedenen Konzentrationen von tPa und unterschiedlichen Thrombolysemodalitäten, darunter: das RT-FluFF-System, der Chandler-Loop-Gerinnselverdau unter konstanter Scherung und der statische Gerinnselverdau (ohne Scherung). Die Daten stellen den Mittelwert ± Standardabweichung für Datenpunkte dar, die größer oder gleich dreifach sind, wobei doppelte Sternchen einen p-Wert < 0,01 und dreifache Sternchen einen p-Wert < 0,001 angeben. (C) Bruttomerkmale der Thrombolyse bei 200 ng/ml tPA. Diese Abbildung wurde von Zeng et al.14 modifiziert. Abkürzungen: RT-FluFF = Real-time Fluorometric Flowing Fibrinolysis Assay; tPA = Gewebeplasminogen-Aktivator. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Gerinnselbildung und -kennzeichnung
Es wurde gezeigt, dass die Chandler-Schleife ein einfaches und effektives Mittel zur reproduzierbaren Erzeugung von Gerinnseln darstellt, die In-vivo-Thromben nachahmen 16. Die Feinabstimmung von Parametern wie Schlauchgröße, Drehzahlen, Trommeldurchmesser und Gerinnungszeit ermöglicht die schnelle Bildung von Gerinnseln unter unterschiedlichen Scherbedingungen, die architektonische Merkmale erfassen können, die bei einer Reihe von Thromben geschätzt werden, die sowohl arterielle als auch venöse Quellen nachahmen. Die zusätzliche Flexibilität, Marker wie FITC-Fg einführen zu können, erweitert die Einsatzmöglichkeiten dieser Thromben, wie wir im RT-FluFF-System gezeigt haben. So rudimentär die zugrundeliegenden Prinzipien der Chandler-Schleife auch sind, es bleibt eine steile anfängliche Lernkurve, die mit einer konsistenten Gerinnselbildung bei gleichzeitigem Umgang mit Blut und Blutprodukten während des gesamten Gerinnselbildungsprozesses verbunden ist. Dies ergibt sich aus der Tatsache, dass die Gerinnung von WB in den Momenten vor und nach Beginn der Gerinnung äußerst empfindlich auf die Handhabung reagiert. Von besonderer Bedeutung ist die Auswahl des Schlauchs, der während des Schritts der Gerinnselbildung in der Chandler-Schleife verwendet wird, da Wechselwirkungen auf der Blutoberfläche das Fortschreiten der Gerinnselbildung beeinflussen können. Die Schläuche sollten medizinischer oder chirurgischer Qualität (nicht pyrogen und nicht hämolytisch) sein und eine geringe Bioreaktivität aufweisen. Wie in unseren Ergebnissen diskutiert, wird eine Variation der gebildeten Gerinnsel in den ersten Lernphasen der Technik erwartet, während der optimale Arbeitsablauf auf der Grundlage des experimentellen Maßstabs und einzigartiger Assay-Modifikationen entwickelt wird. Das letztendliche Erreichen der Reproduzierbarkeit ist von entscheidender Bedeutung, da die Gerinnselarchitektur das Verhalten eines Gerinnsels bei der Fibrinolyse beeinflusst. Schließlich ist auch eine Variation der Gerinnung, auch bei gesunden Probanden, zu erwarten und sollte bei der Versuchsplanung berücksichtigt werden.
RT-FluFF-Assay
Die fluorometrische/spektrophotometrische Quantifizierung der Fibrinolyse mit FITC-Fg als Marker bietet zahlreiche Vorteile gegenüber klassischen Techniken, die sich in erster Linie auf die Bestimmung der Gerinnselmasse am Endpunkt verlassen haben. Die Möglichkeit, die Fibrinolysedynamik in Echtzeit oder nahezu in Echtzeit in einer Umgebung zu überwachen, die sich den physiologischen Flussparametern annähert, stellt eine deutliche Verbesserung gegenüber herkömmlichen fibrinolytischen Wirkstoff-Screening-Assays dar. Dieser Assay wurde absichtlich im vorgestellten Maßstab entwickelt, um den klinisch relevanten Gerinnselgrößen, dem Flussfeld, der volumetrischen Flussrate und der Gerinnselmassenbelastung näher zu kommen, anstatt einen vollständig miniaturisierten mikrofluidischen Ansatz zu verfolgen. Eine Verkleinerung der RT-FluFF-Apparatur würde bedeuten, dass entweder Schläuche mit kleinerem Durchmesser und/oder kürzere Rohrabstände verwendet werden müssten. Infolgedessen würde das System beginnen, von den gewünschten Strömungsmustern und der gewünschten physiologischen Relevanz abzuweichen. Ähnlich wie der Chandler-Kreislauf ermöglicht das RT-FluFF-System die Steuerung von Parametern wie der Schergeschwindigkeit durch Modulation des Strömungsdrucks bei konstantem Durchfluss und die Kontrolle darüber, welches strömende Medium verwendet wird. Darüber hinaus kann das RT-Fluff-System auch pulsierende Strömungen und einzigartige Gerinnselaufschlussgeometrien aufnehmen und ermöglicht gleichzeitig eine periodische Probenahme der mobilen Phase während des gesamten Aufschlussprozesses, was in einem Chandler-Loop aufgrund des rotierenden geschlossenen Aufschlusses nicht möglich ist. Der Einfluss dieser Parameter auf die Gerinnsellyse wurde im Rahmen von Zeng et al.14 eingehend untersucht.
Zusammengenommen können die Chandler-Schlingen-förmigen Gerinnsel und die RT-FluFF-Assay-Schläuche den gleichen Durchmesser haben oder sowohl bei der Gerinnselbildung als auch bei der Gerinnselverdauung variiert werden, um unterschiedliche Okklusionsgrade zu erreichen, die bis hin zum nahezu vollständigen Gefäßverschluss modelliert werden, um Thromboembolien nachzuahmen. Alle hier beschriebenen Untersuchungsergebnisse verwendeten den gleichen Schlauchdurchmesser sowohl im Chandler-Loop als auch im RT-FluFF-System. Mit zunehmendem Schlauchdurchmesser im RT-FluFF-System muss das Volumen des Reservoirs für die mobile Phase möglicherweise vergrößert werden, um das zusätzliche Volumen aufzunehmen, das zum Befüllen des Systems benötigt wird. Eine Erhöhung des Reservoirvolumens kann auch die notwendige Menge an Thrombolytikum/Arzneimittel erhöhen, die dem System zugesetzt werden muss, und würde auch den Bedarf an Plasma oder mobiler Phase erhöhen. Die Verwendung von autologem Plasma wäre zwar ideal, erfordert jedoch die außerordentlich großen Blutentnahme von einzelnen Spendern, um die Bildung von Chandler-Schleifengerinnseln und die RT-FluFF-Volumina der mobilen Phase über alle Assays und Replikate hinweg zu ermöglichen, die für den Abschluss eines gesamten Experiments erforderlich sind. Aus diesem Grund wurde häufig typangepasstes gepooltes Plasma verwendet, das entweder von einem Blutspendezentrum oder von einem kommerziellen Anbieter erworben wurde. Während die gesamten RT-FluFF-Assay-Schläuche bis zu einem gewissen Grad gekürzt werden können, gibt es Einschränkungen, so dass alle Komponenten genügend Platz haben, um in der Schleife zu bleiben, um die Aufschlussexperimente durchzuführen. Von besonderer Bedeutung ist der lange Teil des Schlauches, der stromaufwärts des Gerinnsels selbst verwendet wird, und der eine Mindestlänge überschreiten muss, die auf der Grundlage des Schlauchdurchmessers und der Durchflussrate berechnet wird, so dass eine laminare Strömung zu dem Zeitpunkt erreicht wird, zu dem der Fluss das suspendierte Gerinnsel erreicht. Unabhängig von der Auswahl der Schlauchgröße sollten die gleichen Überlegungen zur Schlauchherstellung, die im Schritt zur Bildung von Gerinnseln in der Chandler-Schleife beschrieben sind, auch auf die Schläuche des RT-FluFF-Systems angewendet werden. Es ist wichtig, noch einmal darauf hinzuweisen, dass der Schlauch zwischen den Drucksensoren, an dem das durch die Chandler-Schleife gebildete Gerinnsel über zwei eingeführte Nadeln in einem "X"-Muster fixiert wird, nach jedem Assay ausgetauscht werden muss, um zu verhindern, dass Lecks an den Nadelpunktionsstellen auftreten. Die Verwendung von Nadeln, um das Gerinnsel während des Aufschlusses bei der Strömung an Ort und Stelle zu halten, begrenzt die Gerinnselbildung und bietet die Möglichkeit, die Gerinnselausrichtung relativ zur Flussrichtung zu verbessern, um die Konsistenz von Assay zu Assay zu verbessern. Während hierin ein einzelner repräsentativer Gerinnselverdauversuch unter Verwendung von tPA beschrieben wird, bieten die Chandler-Schleife und der RT-FluFF-Assay ein hohes Maß an Anpassbarkeit, um eine Vielzahl von Gerinnselstrukturen, Reportermolekülen, Scherraten und Verdauungsbedingungen aufzunehmen, um neuartige Fibrinolytika zu testen.
Begrenzungen
Wie bei allen aktuellen Plattformen oder Methoden, die zum Screening von fibrinolytischen Arzneimitteln verwendet werden, leidet auch der RT-FluFF-Assay unter bestimmten Schwächen, die anerkannt werden müssen. Erstens werden Gerinnsel, die in der Chandler-Schleife gebildet werden, obwohl sie Motive aufweisen, die häufig in in-vivo-Gerinnseln vorhanden sind, immer noch in einer anderen Umgebung gebildet als in-vivo-Gerinnsel, in denen ein pulsierender Fluss und die Wechselwirkung mit dem Endothel vorhanden sind.17 Obwohl die FITC-Fg-Konzentrationen optimiert wurden, um die Auswirkungen auf die Gerinnselarchitektur zu minimieren, stellt die Zugabe des modifizierten Fibrinogens immer noch eine Abweichung von den physiologischen Bedingungen dar. Die Wahl des Plasmamediums in der mobilen Phase kann sich auf die Verwendung eines Fluorometers auswirken, da es eine kleine Menge an Hintergrundsignal gibt, die mit dem Protein- und Lipidgehalt des Plasmas verbunden ist und von Spender zu Spender variieren kann. Eine potenziell signifikante Einschränkung des RT-FluFF-Aufbaus ist der negative Einfluss von Erythrozyten auf fluorometrische Messwerte, der die Verwendung von WB als mobile Phase bei der Verwendung von FITC als fluoreszierender Gerinnselverdauungsmarker einschränkt. Eine praktikable Methode, um dies zu mildern, besteht darin, einen Zentrifugationsschritt einzuführen, um Erythrozyten vor dem Ablesen diskreter Zeitpunkte auf einem Spektralphotometer zu pelletieren, oder die Verwendung eines anderen Gerinnselaufschluss-Reportertags, der weniger durch das Vorhandensein von Erythrozyten beeinflusst wird18. Auf der Grundlage des Assay-Designs sollte eine sorgfältige Abwägung vorgenommen werden, um sicherzustellen, dass wichtige Variablen kontrolliert werden. Wenn beispielsweise Plasma die mobile Phase der Wahl ist, ist es am besten, Plasma über viele Spender hinweg zu bündeln, um die Gerinnung von Spender zu Spender und die Variabilität der Fibrinolyse zu minimieren. Wie bei jedem fluoreszenzmarkierten Protein stellt sich das Problem des Quenchings natürlicherweise daraus, da die FITC-Markierung in relativer Nähe zueinander auf der Oberfläche des Fibrinogens19 vorhanden ist.
Schlussfolgerungen und zukünftige Richtungen
Die Untersuchung eines dynamischen Prozesses wie der Thrombolyse erfordert eine ebenso dynamische Umgebung, in der physiologische Bedingungen repliziert und mehrere Parameter gleichzeitig gesteuert werden können. Das High-Fidelity-RT-FluFF-System schließt diese Lücke und wird als wichtiges Werkzeug bei der zukünftigen Entwicklung und dem Screening neuartiger Thrombolytika vor ihrer Translation in Tiermodelle dienen. RT-FluFF ist eine äußerst vielseitige Plattform mit mehreren Fähigkeiten, die hier nicht diskutiert wurden, aber sicherlich in Protokolle integriert werden könnten, abhängig von den einzigartigen Anforderungen des pharmazeutischen Arzneimitteldesigns, der Wirkungsweise oder der Replikation verschiedener Gerinnungskrankheitszustände. Die Vorteile, die wir mit dem RT-FluFF-System nutzen konnten, sind wie folgt: (a) variable Schlauchgeometrien und -konfigurationen, (b) Drucküberwachung in Echtzeit, die mit dem Grad der Lumenokklusion korreliert, (c) Fluoreszenzmessungen in Echtzeit, die keinen Benutzereingriff erfordern, (d) Flexibilität bei der Assay-Dauer und Probenfrequenz, (e) Verwendung eines Reservoirs zur Nachahmung von In-vivo-Bedingungen , (f) In-vivo-ähnliche Scherflussmuster, (g) Option zur Einbeziehung einer pulsierenden Strömung, (h) signifikante Flexibilität bei der Bildung unterschiedlicher krankheitsrepräsentativer Gerinnselanaloga in der Chandler-Schleife, (i) die Möglichkeit, die Auswirkungen des Arzneimittels auf die Gerinnselbildung oder den Gerinneverdau zu testen, und (j) die direkte Bildgebung des Gerinnselsubstrats zur Verfolgung des Gerinnselverdaus durch den durchsichtigen Schlauch ermöglicht zusätzlich den Nachaufschluss, Längsschnitt-Videoanalyse.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die in dieser Veröffentlichung berichtete Forschung wurde vom National Heart, Lung, And Blood Institute der National Institutes of Health unter der Preisnummer R01HL167877 unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und gibt nicht unbedingt die offizielle Meinung der National Institutes of Health wieder.
Materialien
| Name | Company | Catalog Number | Comments |
| 30 G Disposable Hypodermic Needles | Exel International | 26439 | Other Consumables |
| 6 mm HSS Lathe Bar Stock Tool 150 mm Long | uxcell | B07SXGSQ82 | Chandler loop, |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Other Consumables, Non-treated acrylic copolymer, non-sterile |
| Air-Tite Luer-lock Unsterile 60 mL Syringes | Air-Tite | MLB3 | RT-FluFF Apparatus , dampeners |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Calcium Chloride | Millipore Sigma | C5670 | Other Consumables |
| Disposable BP Transducers | AD Instruments | MLT0670 | RT-FluFF Apparatus |
| Drager Siemans HemoMed Pod | Drager | 5588822 | RT-FluFF Apparatus |
| Drager Siemans Patient Monitor | Drager | SC 7000 | RT-FluFF Apparatus |
| Drum (cylinder, diameter 120 mm, width 85 mm) | Chandler loop, | ||
| Face Shield | Moxe | SHIELDS10 | Chandler loop, |
| Fibrinogen From Human Plasma, Alexa Fluor 488 Conjugate | Thermo Scientific | F13191 | Other Consumables |
| Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile | Masterflex | 30600-04 | RT-FluFF Apparatus |
| Fluorescein (FITC) | Thermo Scientific | 119245000 | Other Consumables |
| General-Purpose Water Bath | Thermo Scientific | 2839 | Chandler loop, |
| Hotplate 4 × 4 | Fisher Scientific | 1152016H | RT-FluFF Apparatus |
| Human Source Plasma Fresh-Frozen | Zen-Bio | SER-SPL | Other Consumables, CPDA-1 anticoagulant |
| Human Whole Blood | Zen-Bio | SER-WB-SDS | Other Consumables, CPDA-1 anticoagulant |
| L/S Easy-Load II Pump Head for High-Performance Precision Tubing, PPS Housing, SS Rotor | Masterflex | 77200-62 | RT-FluFF Apparatus, Pump Head |
| L/S Variable-Speed Digital Drive Pump with Remote I/O, 6 to 600 rpm; 90 to 260 VAC | Masterflex | 7528-10 | RT-FluFF Apparatus, Pump |
| Motor Speed Controller | CoCocina | ZK-MG | Chandler loop, |
| Nalgene Tubing T-Type Connectors | Thermo Scientific | 6151-0312 | RT-FluFF Apparatus |
| Peristaltic pump tubing | Masterflex | 06424-15 | Other Consumables |
| Phosphate buffered saline | Millipore Sigma | P3813 | Other Consumables, Powder, pH 7.4, for preparing 1 L solutions |
| Switching Power Supply | SoulBay | UC03U | Chandler loop, |
| Thermo Scientific National Target All-Plastic Disposable Syringes 10 mL | Thermo Scientific | S751010 | Other Consumables |
| Tissue plasminogen activator, human | Millipore Sigma | T0831 | Other Consumables |
| Tubing ID 1/4'', OD 3/8'' | Fisher Scientific | AGL00017 | Other Consumables, cut into 1.5cm sections use to connect tubing to T-type connectors |
| Tubing ID 5/32", OD 7/32" | Tygon | ND-100-65, ADF 00009 | Other Consumables |
| V3 365 nm Mini - Black Light UV Flashlight | uvBeast | uvB-V3-365-MINI | Chandler loop, used to check completed clots |
| ZGA37RG ZYTD520 DC Motor, 12 V, 100 rpm | Pangyoo | ZGA37RG | Chandler loop, |
Referenzen
- Ali, M. R., et al. Aspect of thrombolytic therapy: a review. Scientific World Journal. 2014, 586510 (2014).
- Bhogal, P., Andersson, T., Maus, V., Mpotsaris, A., Yeo, L. Mechanical thrombectomy-A brief review of a revolutionary new treatment for thromboembolic stroke. Clin Neuroradiol. 28 (3), 313-326 (2018).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Des Devel Ther. 9, 3445-3454 (2015).
- Kaiser, E. E., West, F. D. Large animal ischemic stroke models: replicating human stroke pathophysiology. Neural Regen Res. 15 (8), 1377-1387 (2020).
- Elnager, A., et al. In vitro whole blood clot lysis for fibrinolytic activity study using d-dimer and confocal microscopy. Adv Hematol. 2014, 814684 (2014).
- Prasad, S., et al. Development of an in vitro model to study clot lysis activity of thrombolytic drugs. Thromb J. 4, 14 (2006).
- Robbie, L. A., Young, S. P., Bennett, B., Booth, N. A. Thrombi formed in a Chandler loop mimic human arterial thrombi in structure and RAI-1 content and distribution. Thromb Haemost. 77 (3), 510-515 (1997).
- Mutch, N. J., et al. Model thrombi formed under flow reveal the role of factor XIII-mediated cross-linking in resistance to fibrinolysis. J Thromb Haemost. 8 (9), 2017-2024 (2010).
- Blinc, A., Kennedy, S. D., Bryant, R. G., Marder, V. J., Francis, C. W. Flow through clots determines the rate and pattern of fibrinolysis. Thromb Haemost. 71 (2), 230-235 (1994).
- Mutch, N. J., et al. The use of the Chandler loop to examine the interaction potential of NXY-059 on the thrombolytic properties of rtPA on human thrombi in vitro. Br J Pharmacol. 153 (1), 124-131 (2008).
- Herbig, B. A., Yu, X., Diamond, S. L. Using microfluidic devices to study thrombosis in pathological blood flows. Biomicrofluidics. 12 (4), 042201 (2018).
- Jigar Panchal, H., Kent, N. J., Knox, A. J. S., Harris, L. F. Microfluidics in haemostasis: A review. Molecules. 25 (4), 833 (2020).
- Zeng, Z., et al. Fluorescently conjugated annular fibrin clot for multiplexed real-time digestion analysis. J Mater Chem B. 9 (45), 9295-9307 (2021).
- Zeng, Z., Christodoulides, A., Alves, N. J. Real-time tracking of fibrinolysis under constant wall shear and various pulsatile flows in an in-vitro thrombolysis model. Bioeng Transl Med. 8 (3), e10511 (2023).
- Christodoulides, A., Zeng, Z., Alves, N. J. In-vitro thromboelastographic characterization of reconstituted whole blood utilizing cryopreserved platelets. Blood Coagul Fibrinolysis. 32 (8), 556-563 (2021).
- Zeng, Z., Nallan Chakravarthula, T., Christodoulides, A., Hall, A., Alves, N. J. Effect of Chandler loop shear and tubing size on thrombus architecture. J Mater Sci Mater Med. 34 (5), 24 (2023).
- Touma, H., Sahin, I., Gaamangwe, T., Gorbet, M. B., Peterson, S. D. Numerical investigation of fluid flow in a chandler loop. J Biomech Eng. 136 (7), (2014).
- Wojdyla, M., Raj, S., Petrov, D. Absorption spectroscopy of single red blood cells in the presence of mechanical deformations induced by optical traps. J Biomed Opt. 17 (9), (2012).
- Wu, J. H., Diamond, S. L. A fluorescence quench and dequench assay of fibrinogen polymerization, fibrinogenolysis, or fibrinolysis. Anal Biochem. 224 (1), 83-91 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten