Method Article
Reconstrução da Barreira Hematoencefálica In Vitro para Modelar e Combater Terapeuticamente a Doença Neurológica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A barreira hematoencefálica (BHE) tem um papel crucial na manutenção de um ambiente cerebral estável e saudável. A disfunção da BHE está associada a muitas doenças neurológicas. Desenvolvemos um modelo 3D, derivado de células-tronco do BBB para investigar a patologia cerebrovascular, a integridade do BBB e como o BBB é alterado pela genética e pela doença.
Resumo
A barreira hematoencefálica (BHE) é um componente fisiológico chave do sistema nervoso central (SNC), mantendo nutrientes, limpando resíduos e protegendo o cérebro de patógenos. As propriedades de barreira inerentes à BHE representam um desafio para a liberação de fármacos terapêuticos no SNC para o tratamento de doenças neurológicas. A função BBB prejudicada tem sido relacionada à doença neurológica. A angiopatia amiloide cerebral (AAC), a deposição de amiloide na vasculatura cerebral levando a um comprometimento da BHE, é uma comorbidade na maioria dos casos de doença de Alzheimer (DA), sugerindo que a disfunção ou colapso da BHE pode estar envolvida na neurodegeneração. Devido ao acesso limitado ao tecido BBB humano, os mecanismos que contribuem para a função adequada da BBB e degeneração da BBB permanecem desconhecidos. Para resolver essas limitações, desenvolvemos uma BBB derivada de células-tronco pluripotentes humanas (iBBB) incorporando células endoteliais, pericitos e astrócitos em uma matriz 3D. O iBBB se auto-monta para recapitular a anatomia e as interações celulares presentes no BBB. A semeadura de iBBBs com amiloide captura os principais aspectos do CAA. Além disso, o iBBB oferece uma plataforma flexível para modular fatores genéticos e ambientais implicados na doença cerebrovascular e neurodegeneração, para investigar como a genética e o estilo de vida afetam o risco de doenças. Finalmente, o iBBB pode ser usado para triagem de drogas e estudos de química medicinal para otimizar a entrega terapêutica ao SNC. Neste protocolo, descrevemos a diferenciação dos três tipos de células (células endoteliais, pericitos e astrócitos) oriundas de células-tronco pluripotentes humanas, como montar as células diferenciadas no iBBB e como modelar CAA in vitro usando amiloide exógeno. Este modelo supera o desafio de estudar o tecido cerebral humano vivo com um sistema que tem fidelidade biológica e flexibilidade experimental, e permite a interrogação do BBB humano e seu papel na neurodegeneração.
Introdução
A barreira hematoencefálica (BHE) é uma rede microvascular chave que separa o sistema nervoso central (SNC) da periferia para manter um ambiente ideal para a função neuronal adequada. Tem papel fundamental na regulação do influxo e efluxo de substâncias para o SNC, mantendo a homeostase metabólica 1,2,3,4, eliminando resíduos 4,5,6 e protegendo o cérebro de patógenos e toxinas 7,8.
O tipo celular primário da BHE é a célula endotelial (CE). As células endoteliais, derivadas da linhagem mesodérmica, formam as paredes da vasculatura 1,9. As CE microvasculares formam tight junctions entre si para diminuir significativamente a permeabilidade de sua membrana 10,11,12,13,14 enquanto expressam transportadores para facilitar o movimento de nutrientes para dentro e para fora do SNC 1,4,12,14 . As CE microvasculares são circundadas por células murais de pericitos (PCs) que regulam a função microvascular e a homeostase e são fundamentais para regular a permeabilidade da BHE a moléculas e células imunes 15,16,17. O astrócito, um dos principais tipos de células gliais, é o tipo celular final que compreende a BHE. As extremidades dos astrócitos envolvem os tubos vasculares do PC-CE, enquanto os corpos celulares se estendem para o parênquima cerebral, formando uma conexão entre os neurônios e a vasculatura1. Distintos transportadores de solutos e substratos estão localizados nas extremidades dos astrócitos (por exemplo, aquaporina 4 [AQP-4]) que têm um papel crítico na função BBB 18,19,20,21.
A BHE é fundamental na manutenção da função adequada da saúde cerebral, e a disfunção da BHE tem sido relatada em muitas doenças neurológicas, incluindo doença de Alzheimer (DA)22,23,24,25, esclerose múltipla7,26,27,28, epilepsia29,30 e acidente vascular cerebral 31,32. É cada vez mais reconhecido que as anormalidades cerebrovasculares desempenham um papel central na neurodegeneração, contribuindo para o aumento da suscetibilidade a eventos isquêmicos e hemorrágicos. Por exemplo, mais de 90% dos pacientes com DA apresentam angiopatia amiloide cerebral (AAC), uma condição caracterizada pela deposição de β amiloide (Aβ) ao longo da vasculatura cerebral. O CAA aumenta a permeabilidade da BHE e diminui a função da BBB, deixando o SNC vulnerável à isquemia, eventos hemorrágicos e declínio cognitivo acelerado33.
Recentemente, desenvolvemos um modelo in vitro da BHE humana, derivado de células-tronco pluripotentes induzidas pelo paciente, que incorpora CEs, PCs e astrócitos encapsulados em uma matriz 3D (Figura 1A). O iBBB recapitula interações fisiologicamente relevantes, incluindo a formação do tubo vascular e a localização da extremidade dos pés dos astrócitos com a vasculatura24. Aplicou-se o iBBB para modelar a suscetibilidade da CAA mediada pela APOE4 (Figura 1B). Isso nos permitiu identificar os mecanismos celulares e moleculares causais pelos quais a APOE4 promove CAA e aproveitar esses insights para desenvolver estratégias terapêuticas que reduzam a patologia do CAA e melhorem o aprendizado e a memória in vivo em camundongos APOE424. Aqui, fornecemos um protocolo detalhado e um vídeo tutorial para reconstruir o BBB a partir de iPSCs humanas e modelar CAA in vitro.
Protocolo
1. Diferenciando iPSCs em células iBBB
NOTA: Estes protocolos de diferenciação foram previamente descritos em Mesentier-Louro et al.34.
- Revestimento de placas de cultura celular
- Descongelar a matriz de membrana do fator de crescimento reduzido (GF) durante a noite a 4 °C. Diluir 500 μL de matriz da membrana basal em 49,5 mL de DMEM. Manter esta solução fria para evitar a polimerização prematura da solução de revestimento.
- Adicionar 1-2 mL por poço de uma placa tratada com cultura de tecidos de 6 poços. Deixar a solução de revestimento acesa durante, pelo menos, 20 minutos a 37 °C antes de a substituir pelo meio de cultura aquecido adequado.
- Diferenciação de iPSCs humanas em células endoteliais induzíveis por ETV2
Tempo: 8 dias
NOTA: Este protocolo é adaptado de Blanchard et al.24 e Qian et al.35. Utilizamos a expressão induzível por doxiciclina do fator de transcrição ETV2, conforme descrito por Wang et al.36 para melhorar o rendimento. O ETV2 foi introduzido via plasmídeo PiggyBac e as células foram então transfectadas.- Cultura de iPSCs em placas revestidas com matriz de membrana basal GF reduzida em meio de células-tronco pluripotentes sem alimentador até que as células atinjam ~70% de confluência.
NOTA: Recomendamos que as iPSCs induzíveis sejam mantidas com seleção para o plasmídeo PiggyBac (ou seja, puromicina) - Dia 0: Dissociar as células com uma mistura de protease-colagenase por 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para o meio de células-tronco. Gire as células a 300 × g por 3 min. Ressuspender o pellet celular com meio de células-tronco e plaquear as células a 20.800 células/cm2 em placas revestidas com matriz de membrana basal GF reduzida em meio de células-tronco suplementado com 10 μM Y27632.
- Dia 1: Substitua o meio por DeSR1 [DMEM/F12 + suplemento de glutamina, 1x Minimum Essential Medium Non-Essential Aminoácidos (MEM-NEAA), 1% de penicilina-estreptomicina (P/S)], suplementado com 10 ng/mL de BMP4, 6 μM de CHIR99021 e 5 μg/mL de doxiciclina.
- Dia 3: Substitua o meio por DeSR2 [DMEM/F12 + suplemento de glutamina, 1x MEM-NEAA, 1x N-2, 1x B-27, 1% P/S] suplementado com 5 μg/mL de doxiciclina.
- Dia 5: Substitua o meio por hECSR [Human Endothelial Serum-Free Medium, 1x MEM-NEAA, 1x B-27, 1% P/S] suplementado com 50 ng/mL VEGF-A, 2 μM de forskolin e 5 μg/mL de doxiciclina.
- Dia 7: Substitua o meio por hECSR suplementado com 50 ng/mL VEGF-A, 2 μM de forskolin e 5 μg/mL de doxiciclina.
- Dia 8: Dividir as CEs 1:3 com uma mistura protease-colagenase e resemear em placas frescas revestidas com matriz de membrana basal de GF reduzido em hECSR suplementado com 50 ng/mL de VEGF-A e 5 μg/mL de doxiciclina.
NOTA: Este é o melhor momento para encapsular CEs em iBBBs para formação de vasculatura uniforme. - Dia 10+: Alimentar as células a cada 2-3 dias com hECSR suplementado com 50 ng/mL de VEGF-A e 5 μg/mL de doxiciclina. Continue a dividir as células 1:3 com uma mistura de protease e colagenase quando as placas estiverem confluentes.
NOTA: ECs derivadas de iPSC podem ser congeladas a qualquer momento a partir do Dia 8. Levante as células, como se fosse passar. Ressuspender o pellet em meio de congelamento EC [60% de reposição de soro nocaute (KSR), 30% hECSR, 10% DMSO, 50 ng/mL VEGF-A e 10 μM Y27632], dividindo as células 1:3, e congelar usando um recipiente de congelamento a -80 °C. Descongelar em placas reduzidas revestidas com matriz de membrana basal GF em hECSR suplementado com 50 ng/mL VEGF-A, 5 μg/mL de doxiciclina. - Confirmar a diferenciação das células endoteliais microvasculares cerebrais por imunocitoquímica usando anticorpos contra CD31/PECAM1 ou VE-caderina (Figura 2A).
- Cultura de iPSCs em placas revestidas com matriz de membrana basal GF reduzida em meio de células-tronco pluripotentes sem alimentador até que as células atinjam ~70% de confluência.
- Diferenciação de iPSCs humanas em pericitos
Tempo: 6 dias
OBS: Este protocolo foi adaptado de Patsch et al.36.- Cultura de iPSCs em placas revestidas com matriz de membrana basal GF reduzida em condições livres de alimentador em meio de células-tronco até que as células atinjam ~70% de confluência.
- Dia 0: Dissociar as células com uma mistura de protease-colagenase por 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para o meio de células-tronco. Gire as células a 300 × g por 3 min. Ressuspender o pellet celular com meio de células-tronco e plaquear as células a 37.000-40.000 células/cm2 (dependendo da linhagem celular) em placas revestidas com matriz de membrana basal GF reduzida em meio de células-tronco suplementado com 10 μM Y27632.
- Dia 1: Substitua o meio por N2B27 [50% DMEM/F12 + suplemento de glutamina, 50% Neurobasal, 1x MEM-NEAA, 0,5x, suplemento de glutamina, 1x N-2, 1x- B-27, 1% P/S] suplementado com 25 ng/mL BMP4 e 8 uM CHIR99021.
- Dias 3-4: Substitua o meio por N2B27 suplementado com 2 ng/mL de Activin A e 10 ng/mL PDGF-BB e alimente-se diariamente.
- Dia 5: Dividir CPs com uma mistura de protease-colagenase e semente em placas revestidas com gelatina a 0,1% a 35.000 células/cm2 em N2B27 suplementado com 10 ng/mL PDGF-BB.
Observação : somente dividir células uma vez confluente. Algumas linhas podem precisar de mais alguns dias antes de estarem prontas para se dividir; Continue a mudar a mídia diariamente até que as células sejam confluentes. - Expandir PCs em N2B27 suplementado com 10 ng/mL PDGF-BB, mudando de mídia a cada 2-3 dias. Retirar o PDGF-BB do meio após as células atingirem novamente a confluência e passarem por uma segunda passagem.
NOTA: Os pericitos estão prontos para serem usados em iBBBs após a segunda passagem. Uma vez expandidos, os PCs podem ser congelados. Levante as células como se fossem passar, ressuspenda o pellet de células em meio de congelamento [90% KSR e 10% DMSO] e congele usando um recipiente de congelamento a -80 °C. Descongelar em placas revestidas com gelatina a 0,1% a 35.000 células/cm2 em N2B27. - Confirmar a diferenciação dos pericitos por imunocitoquímica utilizando anticorpos contra PDGFRB e NG2 (Figura 2B).
- Diferenciação de iPSCs humanas em células progenitoras neurais (NPCs) e astrócitos
Tempo: 45 dias no total (15 dias para NPCs seguidos de 30 dias para astrócitos)
NOTA: O protocolo de diferenciação do NPC foi adaptado de Chambers et al.38, e a diferenciação astrócita é a descrita em TCW et al.39.- Cultura de iPSCs em placas revestidas com matriz de membrana basal GF reduzida em condições livres de alimentador em meio de células-tronco até que as células atinjam ~70% de confluência.
- Dissociar as células com uma mistura de protease-colagenase por 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para o meio de células-tronco. Gire as células a 300 × g por 3 min. Ressuspender o pellet celular com meio de células-tronco e plaquear as células a 100.000 células/cm2 em placas revestidas com matriz de membrana basal GF reduzida em meio de células-tronco suplementado com 10 μM Y27632.
- Substitua o meio de células-tronco no dia seguinte. Continue a alimentar as células a cada dois dias até que atinjam >95% de confluência (3-4 dias, dependendo da linhagem celular).
- NPC Dia 0: Substitua o meio por N2B27 [50% DMEM/F12 + suplemento de glutamina, 50% Neurobasal, 1x MEM-NEAA, 0,5x, suplemento de glutamina, 1x N-2, 1X- B-27, 1% P/S] suplementado com 10 μM SB43152 e 100 nM LDN193189.
- NPC Dias 1-9: Alimentar as células diariamente com N2B27 suplementado com 10 μM SB43152 e 100 nM LDN193189.
- NPC Dia 10: Dividir NPCs 1:3 com a mistura protease-colagenase e semente em placas frescas reduzidas de GF basal revestidas com matriz de membrana basal em N2B27 suplementado com 20 ng/mL de FGF-básico e 10 μM Y27632.
- NPC Dias 11 a 13: Alimentar NPCs diariamente com N2B27 suplementado com 20 ng/mL FGF-básico.
- NPC Dia 14: Dividir NPCs 1:3 com a mistura protease-colagenase e resemear em placas frescas reduzidas de GF revestidas com matriz de membrana basal em N2B27 suplementado com 20 ng/mL de FGF-básico e 10 μM Y27632.
- NPC Dia 15/Dia do Astrócito 0: Este é o Dia 0 da diferenciação astrócitos. Alimente as células com meio astrócito completo (MA).
NOTA: NPCs podem ser mantidos em N2B27 suplementado com 20 ng/mL FGF-básico e passado quando confluente. Para congelar NPCs, ressuspenda o pellet de células em meio de congelamento [90% KSR e 10% DMSO], divida as células 1:3 e congele usando um recipiente de congelamento a -80 °C. Descongelar em placas revestidas com matriz de membrana basal GF reduzida em N2B27 suplementado com 20 ng/mL de bFGF e 10 μM Y27632. - Astrócito Dias 1-30: Alimente as células a cada 2-3 dias com AM. Quando as células são >90% confluentes, a passagem usando a mistura protease-colagenase e placa a 15.000 células/cm2 em placas frescas reduzidas da membrana basal GF revestidas com matriz em MA.
NOTA: Os astrócitos devem ser totalmente diferenciados em 30 dias. Os astrócitos podem ser congelados em meio de congelamento [90% KSR e 10% DMSO] em um recipiente de congelamento a -80 °C. Descongelar em placas revestidas com matriz de membrana basal GF reduzida em AM a 25.000-35.000 células/cm2. - Confirmar a diferenciação do NPC por imunocitoquímica usando anticorpos contra Nestin e SOX2. Confirmar a diferenciação astrocitária por imunocitoquímica utilizando anticorpos contra S100B e CD44 (Figura 2C).
2. Montagem do iBBB
- Descongelar a matriz da membrana basal do fator de crescimento reduzido (GF) durante a noite a 4 °C. Não dilua esta matriz em DMEM, pois os iBBBs são encapsulados em matriz de membrana basal GF 100% reduzida. Cada iBBB requer 50 μL da matriz.
- Dissociar as CE diferenciadas com uma mistura de protease-colagenase a 37 °C por 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para hECSR (Human Endothelial Serum-Free Medium, 1x MEM-NEAA, 1x B-27, 1% P/S). Gire as células a 300 × g por 3 min. Ressuspender o pellet de célula em hECSR.
NOTA: Use um tubo cônico, de 15 mL ou 50 mL, que seja grande o suficiente para acomodar o volume de células dissociadas mais mídia. As células também podem ser divididas entre vários tubos e, em seguida, recombinadas após a ressuspensão. - Dissociar os CPs diferenciados com a mistura protease-colagenase a 37 °C por 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para N2B27 (50% DMEM/F12 + suplemento de glutamina, 50% Neurobasal, 1x MEM-NEAA, 0,5x suplemento de glutamina, 1x N-2, 1x B-27, 1% penicilina-estreptomicina [P/S]). Gire as células a 300 × g por 3 min. Ressuspenda o pellet de célula em N2B27.
- Dissociar os astrócitos diferenciados com a mistura protease-colagenase a 37 °C durante 5 min. Transferir as células dissociadas para um tubo cônico com uma proporção de 1:3 da mistura protease-colagenase para completar o Meio Astrócito (MA). Gire as células a 300 × g por 3 min. Ressuspenda a pastilha de célula em AM.
- Usando um hemocitômetro, conte cada tipo de célula. Diluir cada tipo de suspensão celular até uma concentração final de 1 × 106 células/ml no meio apropriado.
- Combine o número calculado de células para cada tipo de célula em um tubo cônico: 50 μL de iBBB requer 2,5 × 105 CEs, 5 × 104 PCs e 5 × 104 astrócitos. Inclua 10% a mais do que o número calculado de células para contabilizar erros de pipetagem. Gire a mistura celular a 300 × g por 3 min.
NOTA: É altamente recomendável plaquear algumas células remanescentes de cada tipo de célula em monoculturas 2D para fixar e manchar para controle de qualidade das células de entrada. Plaquear cada tipo celular a 35.000 células/cm2 em placas previamente preparadas revestidas com matriz reduzida da membrana basal de GF e fixar após 3-4 dias. Consulte a Tabela 1 para anticorpos específicos do tipo celular. - Aspirar meio da pastilha celular deixando aproximadamente 50 μL do sobrenadante acima da pastilha celular. Usando um P200, ressuspenda suavemente o pellet de célula em meio residual para criar uma pasta de célula única.
- Misturar a lama celular em matriz de membrana basal GF reduzida suficiente suplementada com 10 ng/mL de VEGF-A para o número desejado de iBBBs a 50 μL de matriz de membrana basal GF reduzida por iBBB, tomando o cuidado de misturar as células homogeneamente, sem introduzir bolhas de ar.
NOTA: É fundamental manter as células e a matriz da membrana basal GF reduzida no gelo nesta fase para evitar a polimerização prematura. - Pipetar 50 μL da mistura reduzida da matriz da membrana basal de GF para o poço de uma placa de cultura com fundo de vidro de 48 poços. Distribua o volume uniformemente por todo o fundo da placa (Figura 1C).
- Incubar os iBBBs a 37 °C por 30-40 min para permitir que a matriz reduzida da membrana basal GF se polimerize, encapsulando as células na matriz.
- Adicionar 500 μL de AM suplementado com 10 ng/mL VEGF-A, 5 μg/mL de doxiciclina e 10 μM Y27632.
- Trocar o meio no dia seguinte para AM suplementado com 10 ng/mL de VEGF-A. Continue a mudar o meio a cada 2-3 dias. Após 2 semanas, pare de suplementar com VEGF-A; Os iBBBs estão prontos para ensaios downstream após 2 semanas.
3. Indução de angiopatia amiloide cerebral (AAC) com fibrilas Aβ
- Preparar soluções-mãe de amiloide β1-40 e amiloide β1-42 a 200 μM em PBS.
- Adicionar Aβ ao meio iBBB em iBBBs de 2 semanas até uma concentração final de 20 nM. Incubar as células em meio Aβ-suplementado por 96 h (4 dias).
- Após 96 h, retire o meio e continue com a fixação (seção 4).
4. Fixação e coloração do iBBB
- Para fixar o iBBB, remova o meio, lave em 1 mL de PBS e incube em 500 μL de paraformaldeído a 4% durante a noite a 4 °C.
- Remova a solução de paraformaldeído a 4% e enxágue por 4 x (pelo menos) 15 minutos em 1 mL de PBS.
- Permeabilizar as amostras em PBST 0,3% (PBS com Triton X-100 a 0,3%) por 1 h à temperatura ambiente com agitação suave.
- Incubar as culturas em tampão de bloqueio (5% de soro normal em 0,3% de PBST) à temperatura ambiente por pelo menos 1 h com agitação suave.
NOTA: O tipo de soro utilizado depende da espécie hospedeira para os anticorpos secundários utilizados. Por exemplo, se a espécie hospedeira para os anticorpos secundários for cabra, use soro de cabra normal; Se a espécie hospedeira for burro, use soro de burro normal. Isso também pode ser feito durante a noite a 4 °C com agitação suave. - Diluir os anticorpos primários para a concentração recomendada ou determinada no tampão de bloqueio.
- Substitua a solução de bloqueio pela diluição primária de anticorpos. Certifique-se de que os iBBBs estejam totalmente submersos em solução de anticorpos para incubação uniforme; 100-150 μL é suficiente para cobrir um iBBB de 50 μL em um prato de cultura com fundo de vidro de 48 poços. Incubar durante a noite a 4 °C com agitação suave.
- Remova o anticorpo primário. Lave iBBBs por 3 x 10-20 min em PBS 0,3%.
- Diluir o anticorpo secundário na concentração recomendada ou determinada em tampão de bloqueio. Além disso, adicione uma coloração nuclear, como Hoechst, à solução de anticorpos secundários na concentração recomendada ou determinada.
- Substitua a última lavagem PBS pela diluição secundária de anticorpos. Certifique-se de que os iBBBs estejam totalmente submersos em solução de anticorpos para incubação uniforme; 100-150 μL é suficiente para cobrir um iBBB de 50 μL em um prato de cultura com fundo de vidro de 48 poços. Incubar à temperatura ambiente durante 2 h com agitação suave.
NOTA: Isso também pode ser feito durante a noite a 4 °C com agitação suave. - Lave iBBBs 4-5x por pelo menos 1 h por lavagem em PBS. Conservar em PBS ou em meio de montagem anti-desbotamento a 4 °C até que as amostras sejam fotografadas.
- Para obter imagens em um microscópio invertido, mantenha os iBBBs em placas ou pratos com fundo de vidro. Coloque uma tampa de vidro sobre o poço de vidro para manter os iBBBs no lugar (Figura 1D).
Resultados
Um iBBB devidamente formado solidifica-se em um único disco translúcido (Figura 3A). É normal que o iBBB se desprenda da superfície em que foi pipetado pela primeira vez após alguns dias. Isso não pode ser evitado, mas não é uma grande preocupação para a formação adequada do iBBB se for tomado cuidado ao trocar de mídia para não aspirar acidentalmente o iBBB. Após 24 h, células únicas uniformemente distribuídas podem ser identificadas ao microscópio de campo claro (Figura 3B). Após 2 semanas, estruturas mais distintas podem ser visíveis, embora seja difícil de distinguir com definição (Figura 3C).
A qualidade do iBBB é altamente dependente da qualidade da diferenciação das células de entrada. É altamente recomendável plaquear algumas células remanescentes em monoculturas 2D para corrigir e manchar marcadores específicos do tipo celular. iBBBs formados a partir de células endoteliais com mais de 70% de positividade para PECAM1 ou VE-caderina (Figura 2A), pericitos acima de 95% positivos para PDGFRB (Figura 2B) e astrócitos com mais de 95% de positividade para S100B e CD44 (Figura 2C) são melhores para iBBBs bem-sucedidos. Os resultados desta verificação de qualidade são o primeiro indicador para iBBBs de alta qualidade.
Estruturas 3D fisiologicamente relevantes devem se formar após 2 semanas de automontagem. Na fixação e coloração, observam-se evidências de estruturas tubárias positivas para o marcador endotelial PECAM1, que é crítico para a formação de tight junction (Figura 4A). A maior variabilidade na formação de iBBB é a extensão da formação da microvasculatura. No "pior cenário", a rede de células endoteliais parece mais fragmentada ou não se estende por todo o iBBB, enquanto no "melhor cenário", a vasculatura é uniforme e ramifica-se por todo o iBBB. A diferenciação de células endoteliais acima de 70% positiva para PECAM1 forma redes mais consistentes. Além disso, a aquaporina-4, uma proteína expressa pelos astrócitos que se localiza nas extremidades dos astrócitos, alinha-se com a coloração PECAM1, indicando que os astrócitos estendem suas extremidades para entrar em contato com as células endoteliais (Figura 4B). Finalmente, espera-se ver pericitos ao redor da vasculatura (Figura 4C).
A leitura primária para angiopatia amiloide cerebral (CAA) em iBBBs é a presença de β amiloide (Aβ). A Aβ pode ser medida usando anticorpos direcionados ou semeadura fluorescente marcada com Aβ para induzir fenótipos de CAA (Figura 5). O tratamento de iBBBs com Aβ deve aumentar a intensidade e a área de coloração Aβ, pois as células da BBB não expressam muita proteína Aβ endógena. Alternativamente, amostras fixas podem ser coradas com Tioflavina T para detectar acúmulo de amiloide. Os níveis de Aβ são dependentes do genótipo das células-tronco usadas para gerar a iBBB, com alguns fatores de risco associados à doença de Alzheimer e CAA aumentando a quantidade de acúmulo e coloração de Aβ (Figura 5B, C)24.
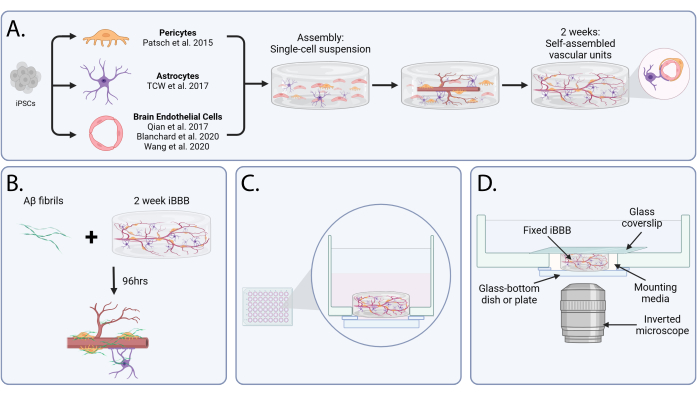
Figura 1: Barreira hematoencefálica in vitro para o modelo da angiopatia amiloide cerebral. (A) Representação esquemática da montagem e maturação do iBBB. Após a diferenciação de células endoteliais, astrócitos e pericitos de células-tronco pluripotentes induzidas, as células são encapsuladas em uma matriz de gel em suspensão unicelular. Ao longo de 2 semanas, as células se auto-agrupam em unidades vasculares, semelhantes às estruturas identificadas in vivo. (B) Esquema do ensaio de angiopatia amiloide cerebral. O β amiloide é adicionado aos iBBBs maturados por 96 h para induzir a agregação de Aβ. (C) Diagrama mostrando a visão lateral de um iBBB após a semeadura em um poço com fundo de vidro. (D) Um gráfico de um iBBB preparado para aquisição de imagens em um microscópio invertido. Abreviações: BBB = barreira hematoencefálica; iPSCs = células-tronco pluripotentes induzidas; iBBB = um modelo in vitro de BBB humano derivado de um modelo de BBB derivado de iPSC de pacientes, que incorpora células endoteliais, pericitos e astrócitos encapsulados em uma matriz 3D; Aβ = β amiloide. Clique aqui para ver uma versão maior desta figura.
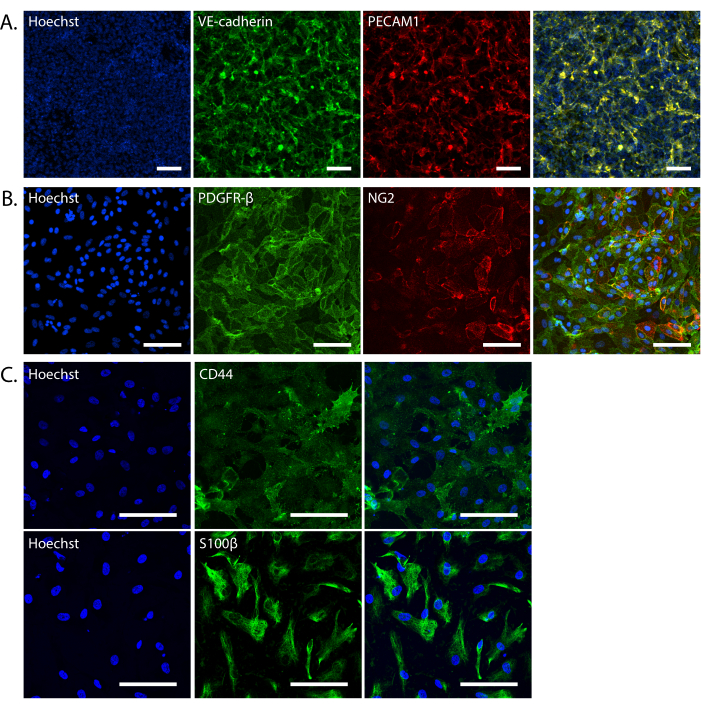
Figura 2: Validação de células iBBB derivadas de iPSC. (A) Projeção representativa de intensidade máxima de células endoteliais em monoculturas 2D coradas com VE-caderina (verde) e PECAM1 (vermelho). (B) Imagens representativas de pericitos em monoculturas 2D coradas com PDGFRB (verde) e NG2 (vermelho). (C) Imagens representativas de astrócitos em monoculturas 2D coradas com CD44 (superior; verde) e S100B (inferior; verde). Todos os núcleos são corados com Hoechst 33342. As imagens foram obtidas em Nikon Eclipse Ti2-E com aumento de 20x (A,B) ou Leica Stellaris 8 com aumento de 40x (C). Todas as barras de escala são de 100 μm. Abreviações: BBB = barreira hematoencefálica; iPSCs = células-tronco pluripotentes induzidas; iBBB = um modelo in vitro de BBB humano derivado de um modelo de BBB derivado de iPSC de pacientes, que incorpora células endoteliais, pericitos e astrócitos encapsulados em uma matriz 3D; VE-caderina = caderina endotelial vascular; PECAM1 = molécula de adesão plaquetária e celular endotelial 1; PDGFRB = receptor beta do fator de crescimento derivado de plaquetas; NG2 = antígeno glial do neurônio 2; S100B = S100 proteína ligadora de cálcio beta. Clique aqui para ver uma versão maior desta figura.
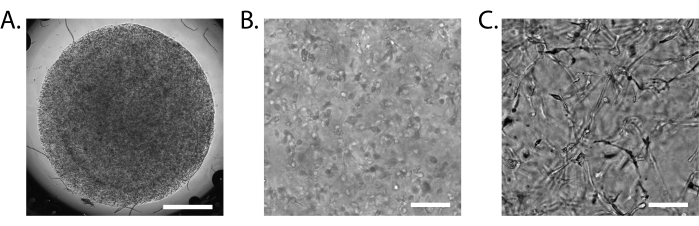
Figura 3: Montagem do iBBB. (A) Imagem de campo brilhante de um iBBB de 15 μL 24 h após o plaqueamento em aumento de 2x. (B) Imagem de campo claro de um iBBB 24 h após plaqueamento em aumento de 10x. (C) Imagem de campo brilhante de um iBBB 2 semanas após o plaqueamento em aumento de 10x. Barra de escala = 1 mm (A), 100 μm (B,C). Imagens tiradas em um Nikon Eclipse Ts2R-FL invertido. Abreviações: BBB = barreira hematoencefálica; iPSCs = células-tronco pluripotentes induzidas; iBBB = um modelo in vitro de BBB humano derivado de um modelo de BBB derivado de iPSC de pacientes, que incorpora células endoteliais, pericitos e astrócitos encapsulados em uma matriz 3D. Clique aqui para ver uma versão maior desta figura.

Figura 4: Interações celulares no iBBB. Imagens representativas de células endoteliais, pericitos e astrócitos no iBBB. (A) Células endoteliais (PECAM1) e astrócitos (S100β). (B) Co-localização de células endoteliais (PECAM1) e patas de astrócitos (AQP-4). (C) células endoteliais (PECAM1) e pericitos (NG2). Todos os núcleos são corados com Hoechst 33342. Imagens confocais Z-stack foram obtidas em uma Leica Stellaris 8 com aumento de 20x (A,B) ou em uma Nikon Eclipse Ti2-E em uma magnificação de 20x (C). Barras de escala = 200 μm (A), 100 μm (B,C). Abreviações: BBB = barreira hematoencefálica; iPSCs = células-tronco pluripotentes induzidas; iBBB = um modelo in vitro de BBB humano derivado de um modelo de BBB derivado de iPSC de pacientes, que incorpora células endoteliais, pericitos e astrócitos encapsulados em uma matriz 3D; PECAM1 = molécula de adesão plaquetária e celular endotelial 1; AQP-4 = aquaporina-4; NG2 = antígeno glial do neurônio 2. Clique aqui para ver uma versão maior desta figura.

Figura 5: Angiopatia amiloide cerebral in vitro. (A) IBBBs não-AD expostos a meios condicionados de neurônios de controle ou de superexpressão de Aβ. O anticorpo 6e10 reconhece Aβ. (B) Imagens representativas de iBBBs de linhagens celulares isogênicas de APOE3 e APOE4 tratadas com 20 nM Aβ-FITC1-42 por 96 h. (C) Quantificação de amiloide em iBBBs de linhagens celulares isogênicas APOE3 e APOE4 tratadas com 20 nM Aβ-FITC1-40 ou Aβ-FITC1-42. Barras de escala = 50 μm (A), 10 μm (B). Essa figura foi adaptada de Blanchard ecols.24. Abreviações: BBB = barreira hematoencefálica; iPSCs = células-tronco pluripotentes induzidas; iBBB = um modelo in vitro de BBB humano derivado de um modelo de BBB derivado de iPSC de pacientes, que incorpora células endoteliais, pericitos e astrócitos encapsulados em uma matriz 3D; Aβ = β amiloide. APOE = Apolipoproteína. Clique aqui para ver uma versão maior desta figura.
| Marcadores | Companhia | Número do catálogo | Diluição | |
| Células Endoteliais | PECAM1 (CD31) | Sistemas de P&D | AF806 | 1:500 |
| VE-caderina (CD144) | Sistemas de P&&D | AF938 | 1:500 | |
| ZO-1 | Invitrogen | MA3-39100-A488 | 1:500 | |
| Perícitos | PDGFRβ | Sistemas de P&D | AF385 | 1:500 |
| GN2 | Abcam | AB255811 | 1:500 | |
| Astrócitos | S100β | Sigma-Aldrich | S2532-100uL | 1:500 |
| CD44 | Tecnologia de Sinalização Celular | ANOS 3570 | 1:400 | |
| AQP-4 | Invitrogen | PA5-53234 | 1:300 | |
| GFAP | ||||
| ALDH1L1 | ||||
| EAAT1 | ||||
| EAAT2 | ||||
| β amiloide | 6e10 | Biolenda | SIG-39320 | 1:1,000 |
| Tioflavina T | Chem Impex | 22870 | 25 μM |
Tabela 1: Marcadores celulares recomendados para verificações de qualidade de diferenciação. Marcadores celulares para os diferentes tipos celulares da BBB que podem ser usados para verificar a qualidade das diferenciações e identificar as células na iBBB formada. Os marcadores utilizados neste artigo estão em negrito.
Discussão
A disfunção da BHE é uma comorbidade e, potencialmente, causa ou fator de exacerbação de inúmeras doenças neurológicas 7,40,41. No entanto, é quase impossível estudar a biologia molecular e celular subjacente à disfunção e degradação da BBB em humanos com doença neurovascular. O BBB induzível (iBBB) apresentado neste protocolo fornece um sistema in vitro que recapitula interações celulares importantes do BBB, incluindo a formação do tubo vascular e a localização das extremidades dos astrócitos com a vasculatura. O iBBB pode ser usado para estudar as vias moleculares envolvidas em qualquer estágio da disfunção BBB e pode modelar fenótipos de doenças neurovasculares, como a agregação amilóide-β, como visto na angiopatia amiloide cerebral.
A montagem do iBBB é simples, embora a qualidade dos iBBBs seja altamente dependente da qualidade das células derivadas do iPSC que são usadas. Enquanto o iBBB fornece um nicho multicelular que pode promover a maturação das células componentes, cada tipo de célula precisa ser adequadamente padronizado antes de ser encapsulado. É fundamental realizar verificações de qualidade em cada diferenciação, realizando a coloração por imunofluorescência para marcadores específicos do tipo celular nas monoculturas individuais (Tabela 1). Cada linha iPSC se comporta de forma diferente e algumas condições, como a densidade de semeadura ou o número de dias em cada meio de padronização, podem precisar ser determinadas empiricamente e ajustadas para otimizar a eficiência da diferenciação.
O protocolo descrito sugere um tamanho de 50 μL, mas o iBBB pode ser reduzido para tão pequeno quanto 5 μL, dependendo da disponibilidade celular, do número de iBBBs desejados e da aplicação a jusante. Os iBBBs maiores contêm mais células, tornando-os ideais para a coleta de proteínas, lipídios ou ácidos nucleicos. IBBBs menores podem facilitar exames de drogas ou outros ensaios escaláveis.
O iBBB é uma ferramenta muito versátil para estudar o BBB in vitro. Como cada tipo de célula é diferenciado independentemente, os iBBBs podem ser montados a partir de diferentes origens genéticas, permitindo-nos estudar como os fatores de risco genéticos afetam tipos celulares específicos para contribuir para a disfunção BBB. Essa estratégia foi aplicada para demonstrar que a APOE4, fator de risco mais comum para doença de Alzheimer e angiopatia amiloide cerebral, atua em parte por meio de um mecanismo patogênico especificamente nospericitos24. O uso adicional dessa ferramenta nos permitiria dissecar as contribuições individuais de CEs, PCs e astrócitos na manutenção da integridade da BHE e como cada tipo celular vacila durante o desenvolvimento da doença.
Atualmente, o método mais comum de modelagem da BHE in vitro é a utilização de um sistema transwell, semeado com CEs, e às vezes co-cultivado com pericitos e/ou astrócitos, para formar uma monocamada impermeável 42,43,44. A estrutura 3D do iBBB possibilita a automontagem da unidade vascular e permite a formação de estruturas tubulares que mais se assemelham à vasculatura fisiológica. Uma desvantagem de semear iBBBs em uma placa de poço, como descrito neste protocolo, é que eles não experimentam as tensões causadas pela vasculatura de fluxo constante em um sistema in vivo. Para superar isso, o iBBB pode ser semeado em um chip microfluídico que pode gerar um fluxo dinâmico 45,46,47. Este sistema também pode ser usado para testar a permeabilidade da vasculatura e a perfusão de pequenas moléculas.
Em conclusão, este método fornece um modelo flexível, 3D, derivado de iPSC da BBB que pode ser usado como uma plataforma para estudar inúmeros aspectos da BBB em nível celular, incluindo a capacidade de recapitular fenótipos de doenças neurovasculares e o potencial de rastrear a permeabilidade BBB da droga para uma ampla gama de aplicações.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho é apoiado pelo NIH 3-UG3-NS115064-01, R01NS14239, Cure Alzheimer's Fund, NASA 80ARCO22CA004, Chan-Zuckerberg Initiative, MJFF/ASAP Foundation e Brain Injury Association of America. C.G. é suportado pelo NIH F31NS130909. A Figura 1A foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 6e10 amyloid-β antibody | Biolegend | SIG-39320 | Used at 1:1000 |
| Accutase | Innovative Cell Technologies | AT104 | |
| Activin A | Peprotech | 20-14E | |
| Alexa Fluor 488, 555, 647 secondary antibodies | Invitrogen | Various | Used at 1:1000 |
| Amyloid-beta 40 fibril | AnaSpec | AS-24235 | |
| Amyloid-beta 42 fibril | AnaSpec | AS-20276 | |
| Aquaporin-4 antibody | Invitrogen | PA5-53234 | Used at 1:300 |
| Astrocyte basal media and supplements | ScienCell | 1801 | |
| B-27 serum-free supplement | Gibco | 17504044 | |
| BMP4 | Peprotech | 120-05ET | |
| CHIR99021 | Cyamn Chemical | 13112 | |
| DMEM/F12 with GlutaMAX medium | Gibco | 10565018 | |
| Doxycycline | Millipore-Sigma | D3072-1ML | |
| FGF-basic | Peprotech | 100-18B | |
| Fluoromount-G slide mounting medium | VWR | 100502-406 | |
| Forskolin | R&D Systems | 1099/10 | |
| GeltrexTM LDEV-Free hESC-qualified Reduced Growth Factor Basement | Gibco | A1413302 | |
| Glass Bottom 48-well Culture Dishes | Mattek Corporation | P48G-1.5-6-F | |
| GlutaMAX supplement | Gibco | 35050061 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| Human Endothelial Serum-free medium | Gibco | 11111044 | |
| LDN193189 | Tocris | 6053 | |
| Minimum Essential Medium Non-essential Amino Acid Solution (MEM-NEAA) | Gibco | 11140050 | |
| N-2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| Normal Donkey Serum | Millipore-Sigma | S30-100mL | Use serum to match secondary antibody host |
| Paraformaldehyde (PFA) | ThermoFisher | 28908 | |
| PDGF-BB | Peprotech | 100-14B | |
| PDGFRB (Platelet-derived growth factor receptor beta) antibody | R&D Systems | AF385 | Used at 1:500 |
| Phosphate Buffered Saline (PBS), pH 7.4 | Gibco | 10010031 | |
| Pecam1 (Platelet endothelial cell adhesion molecule 1) antibody | R&D Systems | AF806 | Used at 1:500 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PiggyBac plasmid (PB_iETV2_P2A_GFP_Puro) | AddGene | Catalog #168805 | |
| S100B antibody | Sigma-Aldrich | S2532-100uL | Used at 1:500 |
| SB43152 | Reprocell | 04-0010 | |
| Thioflavin T | Chem Impex | 22870 | Used at 25uM |
| Triton X-100 | Sigma-Aldrich | T8787-250mL | |
| VE-cadherin (CD144) antibody | R&D systems | AF938 | Used at 1:500 |
| VEGF-A | Peprotech | 100-20 | |
| Y27632 | R&D Systems | 1254/10 | |
| ZO-1 | Invitrogen | MA3-39100-A488 | Dilution = 1:500 |
Referências
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Segarra, M., Aburto, M. R., Acker-Palmer, A. Blood-brain barrier dynamics to maintain brain homeostasis. Trends in Neurosciences. 44 (5), 393-405 (2021).
- Campos-Bedolla, P., Walter, F. R., Veszelka, S., Deli, M. A. Role of the blood-brain barrier in the nutrition of the central nervous system. Archives of Medical Research. 45 (8), 610-638 (2014).
- Hladky, S. B., Barrand, M. A. Fluid and ion transfer across the blood-brain and blood-cerebrospinal fluid barriers; a comparative account of mechanisms and roles. Fluids and Barriers of the CNS. 13 (1), 19(2016).
- Kaur, J., et al. Waste clearance in the brain. Frontiers in Neuroanatomy. 15, 665803(2021).
- Verheggen, I. C. M., Van Boxtel, M. P. J., Verhey, F. R. J., Jansen, J. F. A., Backes, W. H. Interaction between blood-brain barrier and glymphatic system in solute clearance. Neuroscience and Biobehavioral Reviews. 90, 26-33 (2018).
- Weiss, N., Miller, F., Cazaubon, S., Couraud, P. O. The blood-brain barrier in brain homeostasis and neurological diseases. Biochimica et Biophysica Acta. 1788 (4), 842-857 (2009).
- Prinz, M., Priller, J. The role of peripheral immune cells in the cns in steady state and disease. Nature Neuroscience. 20 (2), 136-144 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. FASEB Journal. 19 (13), 1872-1874 (2005).
- Liu, W. Y., Wang, Z. B., Zhang, L. C., Wei, X., Li, L. Tight junction in blood-brain barrier: An overview of structure, regulation, and regulator substances. CNS Neuroscience & Therapeutics. 18 (8), 609-615 (2012).
- Siegenthaler, J. A., Sohet, F., Daneman, R. Sealing off the cns': Cellular and molecular regulation of blood-brain barriergenesis. Current Opinion in Neurobiology. 23 (6), 1057-1064 (2013).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Mahringer, A., Fricker, G. Abc transporters at the blood-brain barrier. Expert Opinion on Drug Metabolism & Toxicology. 12 (5), 499-508 (2016).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Daneman, R., Zhou, L., Kebede, A. A., Barres, B. A. Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature. 468 (7323), 562-566 (2010).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews. Neuroscience. 7 (1), 41-53 (2006).
- Heithoff, B. P., et al. Astrocytes are necessary for blood-brain barrier maintenance in the adult mouse brain. Glia. 69 (2), 436-472 (2021).
- Verkman, A. S. Aquaporin water channels and endothelial cell function. Journal of Anatomy. 200 (6), 617-627 (2002).
- Wolburg, H., Lippoldt, A. Tight junctions of the blood-brain barrier: Development, composition and regulation. Vascular Pharmacology. 38 (6), 323-337 (2002).
- Sagare, A. P., Bell, R. D., Zlokovic, B. V. Neurovascular dysfunction and faulty amyloid beta-peptide clearance in alzheimer disease. Cold Spring Harbor Perspectives in Medicine. 2 (10), a011452(2012).
- Kapasi, A., Schneider, J. A. Vascular contributions to cognitive impairment, clinical alzheimer's disease, and dementia in older persons. Biochimica et Biophysica Acta. 1862 (5), 878-886 (2016).
- Blanchard, J. W., et al. Reconstruction of the human blood-brain barrier in vitro reveals a pathogenic mechanism of apoe4 in pericytes. Nature Medicine. 26 (6), 952-963 (2020).
- Huang, Z., et al. Blood-brain barrier integrity in the pathogenesis of alzheimer's disease. Frontiers in Neuroendocrinology. 59, 100857(2020).
- Morgan, L., et al. Inflammation and dephosphorylation of the tight junction protein occludin in an experimental model of multiple sclerosis. Neuroscience. 147 (3), 664-673 (2007).
- Kirk, J., Plumb, J., Mirakhur, M., Mcquaid, S. Tight junctional abnormality in multiple sclerosis white matter affects all calibres of vessel and is associated with blood-brain barrier leakage and active demyelination. Journal of Pathology. 201 (2), 319-327 (2003).
- Balasa, R., Barcutean, L., Mosora, O., Manu, D. Reviewing the significance of blood-brain barrier disruption in multiple sclerosis pathology and treatment. International Journal of Molecular Sciences. 22 (16), 8370(2021).
- Marchi, N., Granata, T., Ghosh, C., Janigro, D. Blood-brain barrier dysfunction and epilepsy: Pathophysiologic role and therapeutic approaches. Epilepsia. 53 (11), 1877-1886 (2012).
- Kiani, L. Blood-brain barrier disruption following seizures. Nature Reviews. Neurology. 19 (4), 2023(2023).
- Knowland, D., et al. Stepwise recruitment of transcellular and paracellular pathways underlies blood-brain barrier breakdown in stroke. Neuron. 82 (3), 603-617 (2014).
- Okada, T., Suzuki, H., Travis, Z. D., Zhang, J. H. The stroke-induced blood-brain barrier disruption: Current progress of inspection technique, mechanism, and therapeutic target. Current Neuropharmacology. 18 (12), 1187-1212 (2020).
- Gireud-Goss, M., Mack, A. F., Mccullough, L. D., Urayama, A. Cerebral amyloid angiopathy and blood-brain barrier dysfunction. Neuroscientist. 27 (6), 668-684 (2021).
- Mesentier-Louro, L. A., Suhy, N., Broekaart, D., Bula, M., Pereira, A. C., Blanchard, J. W. Modeling the blood-brain barrier using human-induced pluripotent stem cells. Methods in Molecular Biology. 2683, 135-151 (2023).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679(2017).
- Wang, K., et al. Robust differentiation of human pluripotent stem cells into endothelial cells via temporal modulation of etv2 with modified mrna. Science Advances. 6 (30), eaba7606(2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and ips cells by dual inhibition of smad signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tcw, J., et al. An efficient platform for astrocyte differentiation from human induced pluripotent stem cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Zlokovic, B. V. The blood-brain barrier in health and chronic neurodegenerative disorders. Neuron. 57 (2), 178-201 (2008).
- Daneman, R. The blood-brain barrier in health and disease. Annals of Neurology. 72 (5), 648-672 (2012).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews. Drug Discovery. 6 (8), 650-661 (2007).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Erickson, M. A., Wilson, M. L., Banks, W. A. In vitro modeling of blood-brain barrier and interface functions in neuroimmune communication. Fluids Barriers CNS. 17 (1), 26(2020).
- Musafargani, S., et al. Blood brain barrier: A tissue engineered microfluidic chip. Journal of Neuroscience Methods. 331, 108525(2020).
- Hajal, C., et al. Engineered human blood-brain barrier microfluidic model for vascular permeability analyses. Nature Protocols. 17 (1), 95-128 (2022).
- Oddo, A., et al. Advances in microfluidic blood-brain barrier (bbb) models. Trends in Biotechnology. 37 (12), 1295-1314 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados