Method Article
神経疾患のモデル化と治療標的化のための血液脳関門の in vitro 再構築
* これらの著者は同等に貢献しました
要約
血液脳関門(BBB)は、安定した健康な脳環境を維持する上で重要な役割を果たしています。BBB機能障害は、多くの神経疾患と関連しています。私たちは、脳血管の病理学、BBBの完全性、およびBBBが遺伝学や疾患によってどのように変化するかを調べるために、BBBの3D幹細胞由来モデルを開発しました。
要約
血液脳関門(BBB)は、中枢神経系(CNS)の重要な生理学的構成要素であり、栄養素を維持し、老廃物を取り除き、病原体から脳を保護します。BBBの固有のバリア特性は、神経疾患を治療するための中枢神経系への治療薬送達に課題を提起します。BBB機能障害は神経疾患に関連しています。脳血管系にアミロイドが沈着してBBBが損なわれる脳アミロイド血管症(CAA)は、アルツハイマー病(AD)のほとんどの症例で併存疾患であり、BBBの機能不全または破壊が神経変性に関与している可能性があることを示唆しています。ヒトBBB組織へのアクセスが限られているため、適切なBBB機能とBBB変性に寄与するメカニズムは不明のままです。これらの限界に対処するために、私たちは、内皮細胞、周皮細胞、およびアストロサイトを3Dマトリックスに組み込むことにより、ヒト多能性幹細胞由来BBB(iBBB)を開発しました。iBBBは自己組織化して、BBBに存在する解剖学的構造と細胞相互作用を再現します。iBBBにアミロイドを播種することで、CAAの重要な側面を捉えることができます。さらに、iBBBは、脳血管疾患や神経変性に関与する遺伝的要因や環境要因を調節し、遺伝学や生活習慣が疾患リスクにどのように影響するかを調査するための柔軟なプラットフォームを提供します。最後に、iBBBは、中枢神経系への治療送達を最適化するための薬物スクリーニングおよび創薬化学研究に使用できます。このプロトコルでは、ヒト多能性幹細胞から生じる3種類の細胞(内皮細胞、周皮細胞、アストロサイト)の微分、iBBBに分化した細胞を組み立てる方法、および外因性アミロイドを使用して生体 外で CAAをモデル化する方法について説明します。このモデルは、生物学的忠実度と実験の柔軟性の両方を備えたシステムを使用して、生きたヒト脳組織を研究するという課題を克服し、ヒトBBBと神経変性におけるその役割の調査を可能にします。
概要
血液脳関門(BBB)は、中枢神経系(CNS)を末梢から分離し、適切な神経機能に理想的な環境を維持する重要な微小血管ネットワークです。代謝ホメオスタシスを維持し1,2,3,4、老廃物4,5,6を除去し、病原体や毒素から脳を保護することにより、中枢神経系への物質の流入と流出を調節する上で重要な役割を果たします7,8。
BBBの一次細胞型は内皮細胞(EC)です。中胚葉系統に由来する内皮細胞は、血管系の壁を形成します1,9。微小血管ECは互いにタイトジャンクションを形成して膜の透過性を大幅に低下させる一方で、トランスポーターを発現して中枢神経系への栄養素の出入りを促進する10,11,12,13,14.微小血管ECは、微小血管機能と恒常性を調節する周皮細胞(PC)壁細胞に囲まれており、分子および免疫細胞に対するBBBの透過性を調節するために重要です15,16,17。主要なグリア細胞型であるアストロサイトは、BBBを含む最後の細胞型です。アストロサイトの末端足はEC-PC血管管を包み込み、細胞体は脳実質に伸び、ニューロンと血管系の間の接続を形成します1。BBB機能に重要な役割を果たすアストロサイト末端(アクアポリン4[AQP-4]など)には、異なる溶質および基質トランスポーターが局在しています18,19,20,21。
BBBは脳の健康機能の維持に不可欠であり、アルツハイマー病(AD)22,23,24,25、多発性硬化症7,26,27,28、てんかん29,30、脳卒中31,32など、多くの神経疾患でBBBの機能不全が報告されています.脳血管の異常が神経変性において中心的な役割を果たし、虚血性および出血性イベントに対する感受性の増加に寄与していることがますます認識されています。例えば、AD患者の90%以上が、脳血管系に沿ってアミロイドβ(Aβ)が沈着することを特徴とする脳アミロイド血管障害(CAA)を患っています。CAAはBBBの透過性を高め、BBB機能を低下させ、中枢神経系を虚血、出血性イベント、および加速された認知機能低下に対して脆弱なままにします33。
私たちは最近、3Dマトリックスにカプセル化されたEC、PC、およびアストロサイトを組み込んだ、患者誘発多能性幹細胞に由来するヒトBBBの in vitro モデルを開発しました(図1A)。iBBBは、血管管の形成や血管系によるアストロサイトのエンドフットの局在化など、生理学的に関連する相互作用を再現します24。APOE4が媒介するCAAの感受性をモデル化するためにiBBBを適用しました(図1B)。これにより、APOE4がCAAを促進する原因となる細胞および分子メカニズムを特定し、これらの洞察を活用して、APOE4マウスのCAA病理を低減し、 in vivoでの 学習と記憶を改善する治療戦略を開発することができました24。ここでは、ヒトiPS細胞からBBBを再構築し、 in vitroでCAAをモデル化するための詳細なプロトコルとビデオチュートリアルを提供します。
プロトコル
1. iPS細胞からiBBB細胞への分化
注:これらの分化プロトコルは、Mesentier-Louro et al.34で以前に説明されています。
- 細胞培養プレートのコーティング
- 還元成長因子(GF)メンブレンマトリックスを4°Cで一晩融解します。 500 μL の基底膜マトリックスを 49.5 mL の DMEM で希釈します。コーティング液の早期重合を防ぐために、この溶液を冷たく保ちます。
- 6ウェル組織培養処理プレートのウェルあたり1〜2 mLを添加します。コーティング液を37°Cで20分以上放置してから、適切な加温培地と交換してください。
- ヒトiPS細胞のETV2誘導性内皮細胞への分化
タイミング:8日間
注:このプロトコルは、Blanchardら24 およびQianら35から採用されています。我々は、Wang et al.36 によって記述されているように、転写因子ETV2のドキシサイクリン誘導性発現を使用して収量を改善します。ETV2をPiggyBacプラスミドを介して導入し、細胞をトランスフェクションしました。- iPS細胞を、フィーダーフリーの多能性幹細胞培地で還元GF基底膜マトリックスコーティングプレート上で、細胞のコンフルエント度が~70%に達するまで培養します。
注:誘導性iPS細胞は、PiggyBacプラスミド(ピューロマイシン)を選択して維持することをお勧めします - 0日目: 細胞をプロテアーゼ-コラゲナーゼ混合物で5分間解離します。解離した細胞を、プロテアーゼとコラゲナーゼの混合物と幹細胞培地の比率が1:3の円錐形チューブに移します。細胞を300 × g で3分間スピンダウンします。細胞ペレットを幹細胞培地で再懸濁し、10 μM Y27632を添加した幹細胞培地の還元GF基底膜マトリックスコーティングプレートに細胞を20,800細胞/cm2 で播種します。
- 1日目: 培地をDeSR1 [DMEM/F12 + グルタミンサプリメント、1x Minimum Essential Medium Non-Essential Amino Acids (MEM-NEAA)、1% ペニシリン-ストレプトマイシン (P/S)]に置き換え、10 ng/mL BMP4、6 μM CHIR99021、5 μg/mL のドキシサイクリンを添加します。
- 3日目: 培地を、5 μg/mL のドキシサイクリンを添加した DeSR2 [DMEM/F12 + グルタミンサプリメント、1x MEM-NEAA、1x N-2、1x B-27、1% P/S] と交換します。
- 5日目: 培地を、50 ng/mL VEGF-A、2 μM フォルスコリン、5 μg/mL ドキシサイクリンを添加したhECSR [Human Endothelial Serum-Free Medium, 1x MEM-NEAA, 1x B-27, 1% P/S]に置き換えてください。
- 7日目: 培地を 50 ng/mL の VEGF-A、2 μM のフォルスコリン、5 μg/mL のドキシサイクリンを添加した hECSR と交換します。
- 8日目: プロテアーゼとコラゲナーゼの混合物でECを1:3に分割し、50 ng/mLのVEGF-Aと5 μg/mLのドキシサイクリンを添加したhECSRの還元GF基底膜マトリックスコーティングプレートに再播種します。
注:これは、均一な血管系形成のためにECをiBBBにカプセル化するための最良の時点です。 - 10日目+: 2〜3日ごとに、50 ng / mLのVEGF-Aと5 μg / mLのドキシサイクリンを添加したhECSRを細胞に与えます。プレートがコンフルエントになったら、プロテアーゼとコラゲナーゼの混合物で細胞を1:3に分割し続けます。
注:iPS細胞由来ECは、8日目からいつでも凍結できます。通過するかのように、細胞を持ち上げます。ペレットをEC凍結培地[60%ノックアウト血清置換(KSR)、30%hECSR、10%DMSO、50 ng/mL VEGF-A、および10 μM Y27632]に再懸濁し、細胞を1:3に分割し、-80°Cの凍結容器を使用して凍結します。 50 ng/mL の VEGF-A、5 μg/mL のドキシサイクリンを添加した hECSR の還元 GF 基底膜マトリックスコーティングプレートに融解します。 - CD31/PECAM1またはVE-カドヘリンに対する抗体を用いた免疫細胞化学により、脳微小血管内皮細胞の分化を確認します(図2A)。
- iPS細胞を、フィーダーフリーの多能性幹細胞培地で還元GF基底膜マトリックスコーティングプレート上で、細胞のコンフルエント度が~70%に達するまで培養します。
- ヒトiPS細胞の周皮細胞への分化
タイミング:6日間
注:このプロトコルは、Patsch et al.36から採用されました。- 細胞のコンフルエント度が~70%に達するまで、LF基底膜マトリックスコーティングプレート上で、幹細胞培地のフィーダーフリー条件でiPS細胞を培養します。
- 0日目: 細胞をプロテアーゼ-コラゲナーゼ混合物で5分間解離します。解離した細胞を、プロテアーゼとコラゲナーゼの混合物と幹細胞培地の比率が1:3の円錐形チューブに移します。細胞を300 × g で3分間スピンダウンします。細胞ペレットを幹細胞培地で再懸濁し、10 μM Y27632を添加した幹細胞培地の還元GF基底膜マトリックスコーティングプレートに37,000〜40,000細胞/cm2 (細胞株によって異なります)で細胞を播種します。
- 1日目: 培地を N2B27 [50% DMEM/F12 + グルタミンサプリメント、50% 神経基底剤、1x MEM-NEAA、0.5x、グルタミンサプリメント、1x N-2、1x- B-27、1% P/S] に交換し、25 ng/mL の BMP4 と 8 μM のCHIR99021を添加します。
- 3-4日目: 培地を N2B27 に 2 ng/mL のアクチビン A と 10 ng/mL PDGF-BB を添加し、毎日給餌します。
- 5日目: PCをプロテアーゼとコラゲナーゼの混合物で分割し、10 ng/mL PDGF-BBを添加したN2B27中の35,000細胞/cm2 で0.1%ゼラチンコーティングプレートに播種します。
注:セルは一度だけコンフルエントに分割してください。一部の行では、分割の準備が整うまでにさらに数日かかる場合があります。細胞がコンフルエントになるまで、培地を毎日交換し続けます。 - 10 ng/mL PDGF-BBを添加したN2B27でPCを増殖させ、2〜3日ごとに培地を交換します。PDGF-BBは、細胞が再びコンフルエントに達し、2回目の継代を受けた後に培地から除去します。
注:周皮細胞は、2回目の継代後にiBBBで使用する準備ができています。拡張すると、PCをフリーズできます。細胞を継代するように持ち上げ、細胞ペレットを凍結培地[90%KSRおよび10%DMSO]に再懸濁し、-80°Cの凍結容器を使用して凍結します。 0.1%ゼラチンでコーティングしたプレートをN2B27の35,000細胞/cm2 で解凍します。 - PDGFRBおよびNG2に対する抗体を用いた免疫細胞化学により周皮細胞分化を確認します(図2B)。
- ヒトiPS細胞の神経前駆細胞(NPC)とアストロサイトへの分化
タイミング:合計45日(NPCは15日、アストロサイトは30日)
注:NPC分化プロトコルはChambers et al.38から採用され、アストロサイトの分化はTCW et al.39に記載されているとおりです。- 細胞のコンフルエント度が~70%に達するまで、LF基底膜マトリックスコーティングプレート上で、幹細胞培地のフィーダーフリー条件でiPS細胞を培養します。
- 細胞をプロテアーゼ-コラゲナーゼ混合物で5分間解離します。解離した細胞を、プロテアーゼとコラゲナーゼの混合物と幹細胞培地の比率が1:3の円錐形チューブに移します。細胞を300 × g で3分間スピンダウンします。細胞ペレットを幹細胞培地で再懸濁し、10 μM Y27632を添加した幹細胞培地の還元GF基底膜マトリックスコーティングプレートに細胞を100,000細胞/cm2 で播種します。
- 翌日、幹細胞培地を交換します。細胞が>95%のコンフルエントに達するまで(細胞株に応じて3〜4日)、1日おきに細胞を給餌し続けます。
- NPC0日目: 培地を N2B27 [50% DMEM/F12 + グルタミンサプリメント、50% 神経基底剤、1x MEM-NEAA、0.5x、グルタミンサプリメント、1x N-2、1X- B-27、1% P/S] に交換し、10 μM SB43152 および 100 nM LDN193189を添加します。
- NPC1〜9日目: 10 μMのSB43152と100 nMのLDN193189を添加したN2B27を毎日細胞に与えます。
- NPC10日目: NPC をプロテアーゼ-コラゲナーゼ混合物で 1:3 に分割し、20 ng/mL の FGF-塩基性および10 μM の Y27632 を添加した N2B27 の新鮮な還元 GF 基底膜マトリックスコーティングプレートにシードします。
- NPC11日目から13日目: NPCには、20 ng/mLのFGF-basicを添加したN2B27を毎日給餌します。
- NPC14日目: NPC をプロテアーゼとコラゲナーゼの混合物で 1:3 に分割し、20 ng/mL の FGF-塩基性および10 μM の Y27632 を添加した N2B27 の還元 GF 基底膜マトリックスコーティングプレートに再播種します。
- NPC15日目/アストロサイト0日目: これはアストロサイトの分化の0日目です。細胞に完全なアストロサイト培地(AM)を投与します。
注:NPC は、20 ng/mL の FGF-塩基性を添加した N2B27 で維持し、コンフルエント時に継代することができます。NPCを凍結するには、細胞ペレットを凍結培地(90%KSRおよび10%DMSO)に再懸濁し、細胞を1:3に分割し、凍結容器を使用して-80°Cで凍結します。 20 ng/mL の bFGF と 10 μM の Y27632 を添加した N2B27 の還元 GF 基底膜マトリックスコーティングプレートで融解します。 - アストロサイト1〜30日目: 2〜3日ごとにAMを細胞に与えます。細胞が>90%コンフルエントになったら、プロテアーゼ-コラゲナーゼ混合物を使用して継代し、AM中の新鮮な還元GF基底膜マトリックスコーティングプレートに15,000細胞/cm2 でプレートします。
注:アストロサイトは30日で完全に分化する必要があります。アストロサイトは、-80°Cの凍結容器内の凍結培地(90%KSRおよび10%DMSO)で凍結できます。 AM中の還元GF基底膜マトリックスコーティングプレートに25,000〜35,000細胞/cm2で融解します。 - NestinおよびSOX2に対する抗体を用いた免疫細胞化学によりNPCの分化を確認します。S100BおよびCD44に対する抗体を用いた免疫細胞化学により、アストロサイトの分化を確認します(図2C)。
2. iBBBの組み立て
- 還元成長因子(GF)基底膜マトリックスを4°Cで一晩融解します。 iBBBは100%還元GF基底膜マトリックスにカプセル化されているため、このマトリックスをDMEMで希釈しないでください。各iBBBには50 μLのマトリックスが必要です。
- 分化したECをプロテアーゼ-コラゲナーゼ混合物で37°Cで5分間解離します。解離した細胞を、プロテアーゼとコラゲナーゼの混合物とhECSRの比率が1:3の円錐形チューブに移します(ヒト内皮血清フリー培地、1x MEM-NEAA、1x B-27、1%P/S)。細胞を300 × g で3分間スピンダウンします。細胞ペレットをhECSRに再懸濁します。
注:15 mLまたは50 mLのコニカルチューブは、解離した細胞と培地の容量を収容するのに十分な大きさのものを使用してください。また、細胞を複数のチューブに分け、再懸濁時に再結合させることもできます。 - 分化したPCをプロテアーゼ-コラゲナーゼ混合物と37°Cで5分間解離します。解離した細胞を、プロテアーゼ-コラゲナーゼ混合物とN2B27の比率が1:3の円錐形チューブに移します(50%DMEM/F12 +グルタミンサプリメント、50%ニューロバサル、1x MEM-NEAA、0.5xグルタミンサプリメント、1x N-2、1x B-27、1%ペニシリン-ストレプトマイシン[P / S])。細胞を300 × g で3分間スピンダウンします。細胞ペレットをN2B27に再懸濁します。
- 分化したアストロサイトをプロテアーゼ-コラゲナーゼ混合物と37°Cで5分間解離します。解離した細胞をプロテアーゼとコラゲナーゼの混合物を1:3の比率でコニカルチューブに移し、アストロサイト培地(AM)を完成させます。細胞を300 × g で3分間スピンダウンします。細胞ペレットをAMに再懸濁します。
- 血球計算盤を使用して、各細胞タイプをカウントします。各タイプの細胞懸濁液を適切な培地で×1〜106 細胞/mLの最終濃度に希釈します。
- 50 μLのiBBBには、2.5 × 105 EC、 5 × 10 4 PC、5 × 104 アストロサイトが必要です。ピペッティングエラーを考慮して、計算されたセル数より10%多く含めます。細胞混合物を300 × g で3分間スピンダウンします。
注:インプット細胞の品質管理のために、各細胞タイプの残った細胞を2Dモノカルチャーで播種し、固定および染色することを強くお勧めします。還元GF基底膜マトリックスでコーティングした事前に調製したプレートに、各細胞タイプを35,000細胞/cm2 でプレーティングし、3〜4日後に固定します。細胞型特異的抗体については、 表1 を参照してください。 - 細胞ペレットから培地を吸引し、細胞ペレットの上に約50μLの上清を残します。P200を使用して、細胞ペレットを残留培地に静かに再懸濁し、単一細胞スラリーを作製します。
- 細胞スラリーを、気泡を混入させず、細胞を均一に混合するように注意しながら、iBBBあたり50 μLの還元GF基底膜マトリックスで、所望のiBBB数に対して10 ng/mLのVEGF-Aを添加した十分な還元GF基底膜マトリックスで混合します。
注:この段階では、細胞と還元GF基底膜マトリックスを氷上に保持して、早期重合を防ぐことが重要です。 - 還元GF基底膜マトリックス混合物50 μLを48ウェルガラス底培養皿のウェルにピペットで移します。皿の底全体に体積を均等に分配します(図1C)。
- iBBBを37°Cで30〜40分間インキュベートして、還元GF基底膜マトリックスを重合させ、細胞をマトリックスにカプセル化します。
- 10 ng/mL の VEGF-A、5 μg/mL のドキシサイクリン、10 μM の Y27632 を添加した AM 500 μL を加えます。
- 翌日、培地を10 ng/mL VEGF-Aを添加したAMに変更します。2〜3日ごとに培地を交換し続けます。2週間後、VEGF-Aの補給を中止します。iBBBは、2週間後にダウンストリームアッセイの準備が整います。
3. Aβ線維による脳アミロイド血管障害(CAA)の誘導
- アミロイドβ1-40 およびアミロイドβ1-42 の原液をPBS中で200μMで調製します。
- 2週間のiBBBでiBBB培地にAβを添加し、最終濃度を20 nMにします。細胞をAβ添加培地中で96時間(4日間)インキュベートします。
- 96時間後、培地を取り除き、固定を続けます(セクション4)。
4. iBBBの固定と染色
- iBBBを固定するには、培地を除去し、1 mLのPBSで洗浄し、500 μLの4%パラホルムアルデヒド中で4°Cで一晩インキュベートします。
- 4%パラホルムアルデヒド溶液を除去し、1 mLのPBSで4回(少なくとも)15分間すすぎます。
- サンプルを 0.3% PBST(0.3% Triton X-100 を含む PBS)で室温で 1 時間、穏やかに振とうしながら透過処理します。
- 培養物をブロッキングバッファー(5% Normal Serum in 0.3% PBST)中で室温で1時間以上、穏やかに振とうしながらインキュベートします。
注:使用する血清の種類は、使用する二次抗体の宿主種によって異なります。例えば、二次抗体の宿主種がヤギの場合、正常なヤギ血清を使用します。宿主種がロバの場合は、通常のロバ血清を使用してください。これは、穏やかに振とうしながら4°Cで一晩行うこともできます。 - 一次抗体をブロッキングバッファーで推奨濃度または決定濃度に希釈します。
- ブロッキング溶液を一次抗体希釈液と交換します。iBBBが抗体溶液に完全に浸され、均一にインキュベーションされていることを確認してください。100〜150 μLは、48ウェルガラス底培養皿で50 μLのiBBBを覆うのに十分です。穏やかに振とうしながら4°Cで一晩インキュベートします。
- 一次抗体を除去します。iBBBを0.3%PBSで3 x 10〜20分間洗浄します。
- 二次抗体をブロッキングバッファーで推奨濃度または決定濃度に希釈します。さらに、Hoechstなどの核染色剤を、推奨濃度または決定濃度で二次抗体溶液に添加します。
- 最後のPBS洗浄を二次抗体希釈液に置き換えてください。iBBBが抗体溶液に完全に浸され、均一にインキュベーションされていることを確認してください。100〜150 μLは、48ウェルガラス底培養皿で50 μLのiBBBを覆うのに十分です。室温で2時間、穏やかに振とうしながらインキュベートします。
注意: これは、穏やかに振とうしながら4°Cで一晩行うこともできます。 - PBSでiBBBを4〜5回、1回の洗浄に少なくとも1時間洗浄します。サンプルが画像化されるまで、PBSまたは退色防止封入剤で4°Cで保存します。
- 倒立顕微鏡で画像化するには、iBBBをガラス底のプレートまたは皿に保管してください。ガラスウェルの上にガラスカバーガラスを置き、iBBBを所定の位置に保ちます(図1D)。
結果
適切に形成されたiBBBは、1つの半透明のディスクに固化します(図3A)。iBBBは、数日後に最初にピペットで固定した表面から剥がれるのが普通です。これは避けることはできませんが、培地を交換する際に誤ってiBBBを吸引しないように注意すれば、iBBBの適切な形成にとって大きな懸念事項ではありません。24時間後、明視野顕微鏡で均一に分布した単一細胞を同定できます(図3B)。2週間後、より明瞭な構造が見えるようになるが、定義で判断することは困難である(図3C)。
iBBBの品質は、インプット細胞の分化の質に大きく依存します。残った細胞を2D単培養で播種し、細胞タイプ特異的なマーカーを固定および染色することを強くお勧めします。PECAM1またはVE-カドヘリンが70%以上陽性の内皮細胞(図2A)、PDGFRBが95%以上陽性の周皮細胞(図2B)、S100BおよびCD44が95%以上陽性のアストロサイト(図2C)から形成されたiBBBは、iBBBの成功に最適です。この品質チェックの結果は、高品質のiBBBの最も初期の指標です。
生理学的に関連する3D構造は、自己組織化の2週間後に形成されるはずです。固定して染色すると、タイトジャンクション形成に重要な内皮マーカーPECAM1を陽性で染色するチューブ状構造の証拠が見られます(図4A)。iBBB形成における最大の変動は、微小血管形成の程度である。「最悪のケース」のシナリオでは、内皮細胞ネットワークはより断片化されているか、iBBB全体に広がっていないように見えますが、「最良のシナリオ」では、血管系は均一であり、iBBB全体に分岐しています。PECAM1陽性の内皮細胞分化が70%を超えると、より一貫性のあるネットワークが形成されます。さらに、アストロサイトが発現するタンパク質で、アストロサイトの末端に局在するアクアポリン-4は、PECAM1染色と整合しており、アストロサイトが末端を伸ばして内皮細胞に接触していることを示しています(図4B)。最後に、血管系の周囲に周皮細胞が見られると予想されます(図4C)。
iBBBにおける脳アミロイド血管障害(CAA)の主な読み出しは、アミロイドβ(Aβ)の存在です。Aβは、標的抗体を使用するか、蛍光標識されたAβを播種してCAA表現型を誘導することで測定できます(図5)。iBBBをAβで処理すると、BBBの細胞は内因性Aβタンパク質をあまり発現しないため、Aβ染色の強度と面積が増加するはずです。あるいは、固定サンプルをチオフラビンTで染色して、アミロイドの蓄積を検出することもできます。Aβレベルは、iBBBの生成に使用された幹細胞の遺伝子型に依存し、一部のアルツハイマー病およびCAA関連の危険因子は、Aβの蓄積と染色の量を増加させます(図5B、C)24。
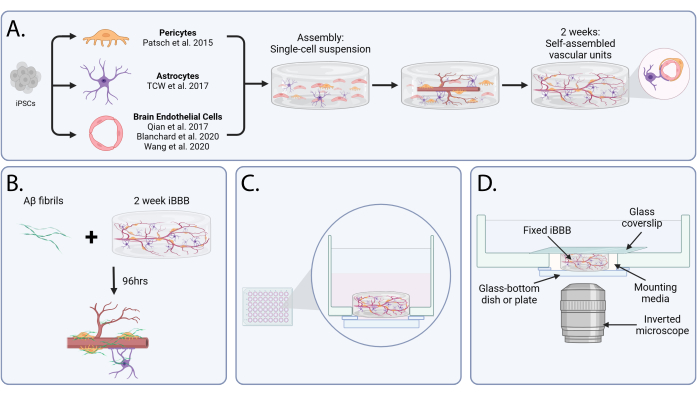
図1:脳アミロイド血管障害をモデル化するための in vitro 血液脳関門。 (A)iBBBの組み立てと成熟の模式図。人工多能性幹細胞から内皮細胞、アストロサイト、ペリサイトを分化させた後、細胞を単一細胞懸濁液中のゲルマトリックスにカプセル化します。2週間の間に、細胞はin vivoで同定された構造と同様に、血管単位に自己組織化します。(B)脳アミロイド血管障害アッセイの概略図。アミロイドβを成熟iBBBに96時間添加し、Aβ凝集を誘導します。(C)ガラス底ウェルに播種した後のiBBBの側面図を示す図。(D)倒立顕微鏡でイメージングするために準備されたiBBBのグラフィック。略語:BBB =血液脳関門;iPS細胞=人工多能性幹細胞;iBBB = 患者iPS細胞由来のBBBモデルから得られたヒトBBBの in vitro モデルで、内皮細胞、周皮細胞、およびアストロサイトを3Dマトリックスにカプセル化しています。Aβ=アミロイドβ。 この図の拡大版をご覧になるには、ここをクリックしてください。
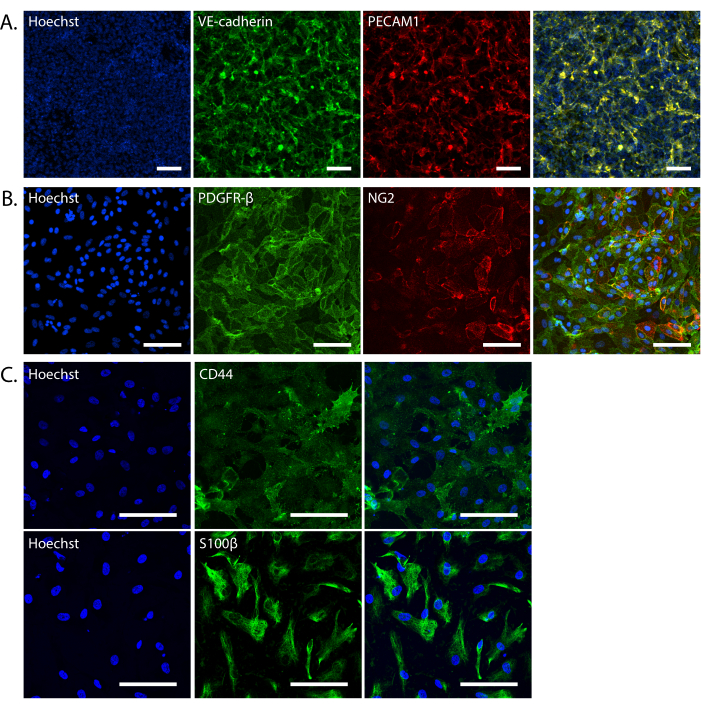
図2:iPS細胞由来iBBB細胞のバリデーション。 (A)VE-カドヘリン(緑)およびPECAM1(赤)で染色した2D単培養における内皮細胞の代表的な最大強度投影。(B)PDGFRB(緑)とNG2(赤)で染色した2D単培養の周皮細胞の代表画像。(C)CD44(上;緑)およびS100B(下;緑)で染色した2D単培養におけるアストロサイトの代表的な画像。すべての核はHoechst 33342で染色されています。画像は、Nikon Eclipse Ti2-Eで20倍の倍率(A、B)またはLeica Stellaris 8で40倍の倍率(C)で撮影しました。すべてのスケールバーは100μmです。略語:BBB =血液脳関門;iPS細胞=人工多能性幹細胞;iBBB = 患者iPS細胞由来のBBBモデルから得られたヒトBBBの in vitro モデルで、内皮細胞、周皮細胞、およびアストロサイトを3Dマトリックスにカプセル化しています。VE-カドヘリン=血管内皮カドヘリン;PECAM1 = 血小板および内皮細胞接着分子1;PDGFRB = 血小板由来成長因子受容体ベータ;NG2 = ニューロングリア抗原 2;S100B = S100カルシウム結合タンパク質ベータ。 この図の拡大版をご覧になるには、ここをクリックしてください。
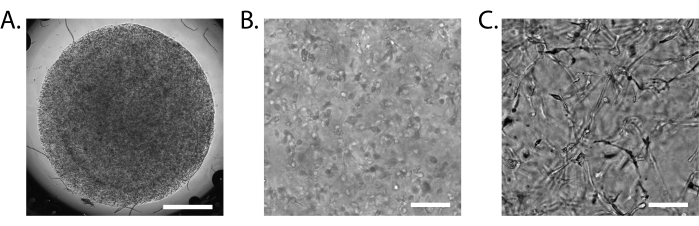
図3:iBBBの組み立て。 (A)めっき後24時間後の15 μL iBBBの明視野画像(倍率2倍)。(B)めっき後24時間後のiBBBを10倍の倍率で撮影した明視野画像。(C)めっき2週間後のiBBBの明視野画像(倍率10倍)。スケールバー = 1 mm (A)、100 μm (B、C)。ニコンエクリプスTs2R-FLを倒立させた画像。 略語:BBB = 血液脳関門;iPS細胞=人工多能性幹細胞;iBBB = 内皮細胞、周皮細胞、アストロサイトを3Dマトリックスに封入した患者iPS細胞由来のBBBモデルから得られたヒトBBBの in vitro モデル。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:iBBBにおける細胞間相互作用。 iBBBにおける内皮細胞、周皮細胞、アストロサイトの代表的な画像。(A)内皮細胞(PECAM1)およびアストロサイト(S100β)。(B)内皮細胞(PECAM1)とアストロサイト末足(AQP-4)の共局在。(C)内皮細胞(PECAM1)および周皮細胞(NG2)。すべての核はHoechst 33342で染色されています。共焦点Zスタック画像は、Leica Stellaris 8で20倍の倍率(A、B)またはNikon Eclipse Ti2-Eで20倍の倍率(C)で撮影されました。スケールバー = 200 μm (A)、100 μm (B、C)。略語:BBB =血液脳関門;iPS細胞=人工多能性幹細胞;iBBB = 患者iPS細胞由来のBBBモデルから得られたヒトBBBの in vitro モデルで、内皮細胞、周皮細胞、およびアストロサイトを3Dマトリックスにカプセル化しています。PECAM1 = 血小板および内皮細胞接着分子1;AQP-4 = アクアポリン-4;NG2 = ニューロングリア抗原 2. この図の拡大版をご覧になるには、ここをクリックしてください。

図5: in vitroでの脳アミロイド血管障害。 (A)コントロールニューロンまたはAβ過剰発現ニューロンからの条件付け培地に曝露された非AD iBBB。6e10抗体はAβを認識します。(B)20 nM Aβ-FITC1-42 で96時間処理した同質APOE3およびAPOE4細胞株のiBBBの代表的な画像。 (C)20 nM Aβ-FITC1-40 またはAβ-FITC1-42で処理した同原性APOE3およびAPOE4細胞株のiBBB中のアミロイドの定量。スケールバー = 50 μm (A)、10 μm (B)。この図は、Blanchard et al24 から引用したものです。略語:BBB =血液脳関門;iPS細胞=人工多能性幹細胞;iBBB = 患者iPS細胞由来のBBBモデルから得られたヒトBBBの in vitro モデルで、内皮細胞、周皮細胞、およびアストロサイトを3Dマトリックスにカプセル化しています。Aβ=アミロイドβ。APOE = アポリポタンパク質E。 この図の拡大版をご覧になるには、ここをクリックしてください。
| マーカー | 会社 | カタログ番号 | 希釈 | |
| 内皮細胞 | PECAM1(CD31) | R&Dシステム | AF806型 | 1:500 |
| VE-カドヘリン(CD144) | R&Dシステム | AF938型 | 1:500 | |
| ZO-1 (ゾワン) | インビトロジェン | MA3-39100-A488 | 1:500 | |
| 周皮細胞 | PDGFRβ | R&Dシステム | AF385型 | 1:500 |
| NG2の | アブカム | AB255811 | 1:500 | |
| アストロサイト | S100β | シグマ・アルドリッチ | S2532-100uL | 1:500 |
| CD44の | 細胞シグナル伝達技術 | 3570S型 | 1:400 | |
| AQP-4型 | インビトロジェン | PA5-53234 | 1:300 | |
| GFAPの | ||||
| ALDH1L1 | ||||
| EAAT1の | ||||
| EAAT2(イーアット2) | ||||
| アミロイドβ | 6e10の | バイオレジェンド | SIG-39320 (英語) | 1:1,000 |
| チオフラビンT | ケムインペックス | 22870 | 25 μM |
表1:分化品質チェックに推奨される細胞マーカー。 分化の質をチェックし、形成されたiBBBの細胞を同定するために使用できるBBBのさまざまな細胞タイプの細胞マーカー。このホワイトペーパーで使用されているマーカーは太字で示しています。
ディスカッション
BBB機能障害は併存疾患であり、多くの神経疾患の原因または悪化因子である可能性があります7,40,41。しかし、神経血管疾患のヒトにおけるBBBの機能不全と破壊の根底にある分子生物学および細胞生物学を研究することはほぼ不可能です。このプロトコルで示される誘導性BBB (iBBB)は管管の形成および血管系のastrocyte端フィートの局在化を含むBBBの重要なセル相互作用を、要約する生体外のシステムを提供する。iBBBは、BBB機能障害のあらゆる段階に関与する分子経路の研究に使用でき、脳アミロイド血管障害に見られるアミロイドβ凝集などの神経血管疾患の表現型をモデル化できます。
iBBBの組み立ては簡単ですが、iBBBの品質は、使用するiPS細胞由来細胞の品質に大きく依存します。iBBBは、構成細胞の成熟を促進することができる多細胞ニッチを提供しますが、各細胞タイプはカプセル化する前に適切にパターン化する必要があります。個々のモノカルチャーで細胞型特異的マーカーの免疫蛍光染色を行うことにより、各分化の品質チェックを行うことが重要です(表1)。iPS細胞株はそれぞれ異なる挙動を示すため、シード密度や各パターニング培地の日数などの条件を経験的に決定し、分化効率を最適化するために調整する必要がある場合があります。
記載されているプロトコールでは50 μLのサイズが推奨されていますが、iBBBは、細胞の入手可能性、目的のiBBBの数、およびダウンストリームアプリケーションに応じて、5 μLまでスケールダウンできます。iBBBが大きいほど細胞数が多いため、タンパク質、脂質、核酸の収集に最適です。iBBBを小型にすることで、薬物スクリーニングやその他のスケーラブルなアッセイを容易にすることができます。
iBBBは、 in vitroでBBBを研究するための非常に汎用性の高いツールです。各細胞タイプは独立して分化するため、iBBBは異なる遺伝的背景から組み立てることができ、遺伝的危険因子が特定の細胞タイプにどのように影響し、BBB機能障害に寄与するかを研究することができます。この戦略は、アルツハイマー病と脳アミロイド血管障害の最も一般的な危険因子であるAPOE4が、特に周皮細胞における病原性メカニズムを介して部分的に作用することを示すために適用されました24。このツールをさらに使用することで、BBBの完全性を維持する上でのEC、PC、およびアストロサイトの個々の寄与と、疾患の発症中に各細胞タイプがどのように衰えるかを解剖することができます。
現在、in vitroでBBBをモデル化する最も一般的な方法は、ECを播種し、時には周皮細胞および/またはアストロサイトと共培養して、不浸透性の単層を形成するトランズウェルシステムを使用することです42,43,44。iBBBの3D構造は、血管ユニットの自己組織化を可能にし、より生理学的血管系に似た管状構造の形成を可能にします。このプロトコルで説明されているように、ウェルプレートにiBBBを播種することの欠点は、in vivoシステムで一定の流量の血管系によって引き起こされる薄いストレスを経験しないことです。これを克服するために、iBBBは、動的流れ45、46、47を生成することができるマイクロ流体チップに播種することができる。このシステムは、血管系透過性および低分子の灌流試験にも使用できます。
結論として、この手法は、神経血管疾患の表現型を再現する能力や、幅広い用途で薬物のBBB透過性をスクリーニングする可能性など、細胞レベルでBBBの無数の側面を研究するためのプラットフォームとして使用できる、柔軟な3DiPS細胞由来のBBBモデルを提供します。
開示事項
著者らは利益相反を報告していない。
謝辞
この研究は、NIH 3-UG3-NS115064-01、R01NS14239、Cure Alzheimer's Fund、NASA 80ARCO22CA004、Chan-Zuckerberg Initiative、MJFF/ASAP Foundation、Brain Injury Association of Americaの支援を受けています。C.G.はNIH F31NS130909によってサポートされています。 図 1A は BioRender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 6e10 amyloid-β antibody | Biolegend | SIG-39320 | Used at 1:1000 |
| Accutase | Innovative Cell Technologies | AT104 | |
| Activin A | Peprotech | 20-14E | |
| Alexa Fluor 488, 555, 647 secondary antibodies | Invitrogen | Various | Used at 1:1000 |
| Amyloid-beta 40 fibril | AnaSpec | AS-24235 | |
| Amyloid-beta 42 fibril | AnaSpec | AS-20276 | |
| Aquaporin-4 antibody | Invitrogen | PA5-53234 | Used at 1:300 |
| Astrocyte basal media and supplements | ScienCell | 1801 | |
| B-27 serum-free supplement | Gibco | 17504044 | |
| BMP4 | Peprotech | 120-05ET | |
| CHIR99021 | Cyamn Chemical | 13112 | |
| DMEM/F12 with GlutaMAX medium | Gibco | 10565018 | |
| Doxycycline | Millipore-Sigma | D3072-1ML | |
| FGF-basic | Peprotech | 100-18B | |
| Fluoromount-G slide mounting medium | VWR | 100502-406 | |
| Forskolin | R&D Systems | 1099/10 | |
| GeltrexTM LDEV-Free hESC-qualified Reduced Growth Factor Basement | Gibco | A1413302 | |
| Glass Bottom 48-well Culture Dishes | Mattek Corporation | P48G-1.5-6-F | |
| GlutaMAX supplement | Gibco | 35050061 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| Human Endothelial Serum-free medium | Gibco | 11111044 | |
| LDN193189 | Tocris | 6053 | |
| Minimum Essential Medium Non-essential Amino Acid Solution (MEM-NEAA) | Gibco | 11140050 | |
| N-2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| Normal Donkey Serum | Millipore-Sigma | S30-100mL | Use serum to match secondary antibody host |
| Paraformaldehyde (PFA) | ThermoFisher | 28908 | |
| PDGF-BB | Peprotech | 100-14B | |
| PDGFRB (Platelet-derived growth factor receptor beta) antibody | R&D Systems | AF385 | Used at 1:500 |
| Phosphate Buffered Saline (PBS), pH 7.4 | Gibco | 10010031 | |
| Pecam1 (Platelet endothelial cell adhesion molecule 1) antibody | R&D Systems | AF806 | Used at 1:500 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PiggyBac plasmid (PB_iETV2_P2A_GFP_Puro) | AddGene | Catalog #168805 | |
| S100B antibody | Sigma-Aldrich | S2532-100uL | Used at 1:500 |
| SB43152 | Reprocell | 04-0010 | |
| Thioflavin T | Chem Impex | 22870 | Used at 25uM |
| Triton X-100 | Sigma-Aldrich | T8787-250mL | |
| VE-cadherin (CD144) antibody | R&D systems | AF938 | Used at 1:500 |
| VEGF-A | Peprotech | 100-20 | |
| Y27632 | R&D Systems | 1254/10 | |
| ZO-1 | Invitrogen | MA3-39100-A488 | Dilution = 1:500 |
参考文献
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Segarra, M., Aburto, M. R., Acker-Palmer, A. Blood-brain barrier dynamics to maintain brain homeostasis. Trends in Neurosciences. 44 (5), 393-405 (2021).
- Campos-Bedolla, P., Walter, F. R., Veszelka, S., Deli, M. A. Role of the blood-brain barrier in the nutrition of the central nervous system. Archives of Medical Research. 45 (8), 610-638 (2014).
- Hladky, S. B., Barrand, M. A. Fluid and ion transfer across the blood-brain and blood-cerebrospinal fluid barriers; a comparative account of mechanisms and roles. Fluids and Barriers of the CNS. 13 (1), 19(2016).
- Kaur, J., et al. Waste clearance in the brain. Frontiers in Neuroanatomy. 15, 665803(2021).
- Verheggen, I. C. M., Van Boxtel, M. P. J., Verhey, F. R. J., Jansen, J. F. A., Backes, W. H. Interaction between blood-brain barrier and glymphatic system in solute clearance. Neuroscience and Biobehavioral Reviews. 90, 26-33 (2018).
- Weiss, N., Miller, F., Cazaubon, S., Couraud, P. O. The blood-brain barrier in brain homeostasis and neurological diseases. Biochimica et Biophysica Acta. 1788 (4), 842-857 (2009).
- Prinz, M., Priller, J. The role of peripheral immune cells in the cns in steady state and disease. Nature Neuroscience. 20 (2), 136-144 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. FASEB Journal. 19 (13), 1872-1874 (2005).
- Liu, W. Y., Wang, Z. B., Zhang, L. C., Wei, X., Li, L. Tight junction in blood-brain barrier: An overview of structure, regulation, and regulator substances. CNS Neuroscience & Therapeutics. 18 (8), 609-615 (2012).
- Siegenthaler, J. A., Sohet, F., Daneman, R. Sealing off the cns': Cellular and molecular regulation of blood-brain barriergenesis. Current Opinion in Neurobiology. 23 (6), 1057-1064 (2013).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Mahringer, A., Fricker, G. Abc transporters at the blood-brain barrier. Expert Opinion on Drug Metabolism & Toxicology. 12 (5), 499-508 (2016).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Daneman, R., Zhou, L., Kebede, A. A., Barres, B. A. Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature. 468 (7323), 562-566 (2010).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews. Neuroscience. 7 (1), 41-53 (2006).
- Heithoff, B. P., et al. Astrocytes are necessary for blood-brain barrier maintenance in the adult mouse brain. Glia. 69 (2), 436-472 (2021).
- Verkman, A. S. Aquaporin water channels and endothelial cell function. Journal of Anatomy. 200 (6), 617-627 (2002).
- Wolburg, H., Lippoldt, A. Tight junctions of the blood-brain barrier: Development, composition and regulation. Vascular Pharmacology. 38 (6), 323-337 (2002).
- Sagare, A. P., Bell, R. D., Zlokovic, B. V. Neurovascular dysfunction and faulty amyloid beta-peptide clearance in alzheimer disease. Cold Spring Harbor Perspectives in Medicine. 2 (10), a011452(2012).
- Kapasi, A., Schneider, J. A. Vascular contributions to cognitive impairment, clinical alzheimer's disease, and dementia in older persons. Biochimica et Biophysica Acta. 1862 (5), 878-886 (2016).
- Blanchard, J. W., et al. Reconstruction of the human blood-brain barrier in vitro reveals a pathogenic mechanism of apoe4 in pericytes. Nature Medicine. 26 (6), 952-963 (2020).
- Huang, Z., et al. Blood-brain barrier integrity in the pathogenesis of alzheimer's disease. Frontiers in Neuroendocrinology. 59, 100857(2020).
- Morgan, L., et al. Inflammation and dephosphorylation of the tight junction protein occludin in an experimental model of multiple sclerosis. Neuroscience. 147 (3), 664-673 (2007).
- Kirk, J., Plumb, J., Mirakhur, M., Mcquaid, S. Tight junctional abnormality in multiple sclerosis white matter affects all calibres of vessel and is associated with blood-brain barrier leakage and active demyelination. Journal of Pathology. 201 (2), 319-327 (2003).
- Balasa, R., Barcutean, L., Mosora, O., Manu, D. Reviewing the significance of blood-brain barrier disruption in multiple sclerosis pathology and treatment. International Journal of Molecular Sciences. 22 (16), 8370(2021).
- Marchi, N., Granata, T., Ghosh, C., Janigro, D. Blood-brain barrier dysfunction and epilepsy: Pathophysiologic role and therapeutic approaches. Epilepsia. 53 (11), 1877-1886 (2012).
- Kiani, L. Blood-brain barrier disruption following seizures. Nature Reviews. Neurology. 19 (4), 2023(2023).
- Knowland, D., et al. Stepwise recruitment of transcellular and paracellular pathways underlies blood-brain barrier breakdown in stroke. Neuron. 82 (3), 603-617 (2014).
- Okada, T., Suzuki, H., Travis, Z. D., Zhang, J. H. The stroke-induced blood-brain barrier disruption: Current progress of inspection technique, mechanism, and therapeutic target. Current Neuropharmacology. 18 (12), 1187-1212 (2020).
- Gireud-Goss, M., Mack, A. F., Mccullough, L. D., Urayama, A. Cerebral amyloid angiopathy and blood-brain barrier dysfunction. Neuroscientist. 27 (6), 668-684 (2021).
- Mesentier-Louro, L. A., Suhy, N., Broekaart, D., Bula, M., Pereira, A. C., Blanchard, J. W. Modeling the blood-brain barrier using human-induced pluripotent stem cells. Methods in Molecular Biology. 2683, 135-151 (2023).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679(2017).
- Wang, K., et al. Robust differentiation of human pluripotent stem cells into endothelial cells via temporal modulation of etv2 with modified mrna. Science Advances. 6 (30), eaba7606(2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and ips cells by dual inhibition of smad signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tcw, J., et al. An efficient platform for astrocyte differentiation from human induced pluripotent stem cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Zlokovic, B. V. The blood-brain barrier in health and chronic neurodegenerative disorders. Neuron. 57 (2), 178-201 (2008).
- Daneman, R. The blood-brain barrier in health and disease. Annals of Neurology. 72 (5), 648-672 (2012).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews. Drug Discovery. 6 (8), 650-661 (2007).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Erickson, M. A., Wilson, M. L., Banks, W. A. In vitro modeling of blood-brain barrier and interface functions in neuroimmune communication. Fluids Barriers CNS. 17 (1), 26(2020).
- Musafargani, S., et al. Blood brain barrier: A tissue engineered microfluidic chip. Journal of Neuroscience Methods. 331, 108525(2020).
- Hajal, C., et al. Engineered human blood-brain barrier microfluidic model for vascular permeability analyses. Nature Protocols. 17 (1), 95-128 (2022).
- Oddo, A., et al. Advances in microfluidic blood-brain barrier (bbb) models. Trends in Biotechnology. 37 (12), 1295-1314 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved