Method Article
Geração e Cultivo de Organoides Derivados de Pacientes com Câncer de Ovário Seroso de Alto Grau
Neste Artigo
Resumo
Os organoides derivados do paciente (DOP) são uma cultura tridimensional (3D) que pode imitar o ambiente tumoral in vitro. No câncer de ovário seroso de alto grau, as DOPs representam um modelo para estudar novos biomarcadores e terapias.
Resumo
Os organoides são modelos de tumores dinâmicos 3D que podem ser cultivados com sucesso a partir de tecido tumoral de ovário derivado do paciente, ascite ou líquido pleural e ajudam na descoberta de novas terapêuticas e biomarcadores preditivos para o câncer de ovário. Esses modelos recapitulam a heterogeneidade clonal, o microambiente tumoral e as interações célula-célula e célula-matriz. Além disso, eles demonstraram corresponder ao tumor primário morfologicamente, citologicamente, imuno-histoquimicamente e geneticamente. Assim, os organoides facilitam a pesquisa sobre as células tumorais e o microambiente tumoral e são superiores às linhagens celulares. O presente protocolo descreve métodos distintos para gerar organoides de câncer de ovário derivados de pacientes a partir de tumores, ascite e amostras de líquido pleural com uma taxa de sucesso superior a 97%. As amostras do paciente são separadas em suspensões celulares por digestão mecânica e enzimática. As células são então banhadas utilizando um extrato de membrana basal (BME) e são suportadas com meios de crescimento otimizados contendo suplementos específicos para a cultura de câncer de ovário seroso de alto grau (HGSOC). Depois de formar organoides iniciais, as DOP podem sustentar a cultura a longo prazo, incluindo a passagem para expansão para experimentos subsequentes.
Introdução
Em 2021, aproximadamente 21.410 mulheres nos Estados Unidos foram recém-diagnosticadas com câncer de ovário epitelial, e 12.940 mulheres morreram dessa doença1. Embora avanços suficientes tenham sido feitos na cirurgia e na quimioterapia, mais de 70% dos pacientes com doença avançada desenvolvem resistência quimioterápica e morrem dentro de 5 anos após o diagnóstico 2,3. Assim, novas estratégias para tratar esta doença mortal e modelos representativos e confiáveis para a pesquisa pré-clínica são urgentemente necessários.
Linhagens celulares de câncer e xenoenxertos derivados de pacientes (PDX) criados a partir de tumores primários de ovário são os principais instrumentos utilizados na pesquisa do câncer de ovário. Uma grande vantagem das linhagens celulares de câncer é a sua rápida expansão. No entanto, sua cultura contínua resulta em alterações fenotípicas e genotípicas que fazem com que as linhagens celulares cancerígenas se desviem da amostra original de tumor primário de câncer. Devido às diferenças existentes entre a linhagem celular cancerígena e o tumor primário, os ensaios de drogas que têm efeitos positivos em linhagens celulares não conseguem ter esses mesmos efeitos em ensaios clínicos2. Para superar essas limitações, os modelos PDX são usados. Esses modelos são criados pela implantação de tecido fresco de câncer de ovário em camundongos imunodeficientes. Como são modelos in vivo , eles se assemelham com mais precisão às características biológicas humanas e, por sua vez, são mais preditivos dos resultados das drogas. No entanto, esses modelos também apresentam limitações significativas, incluindo o custo, o tempo e os recursos necessários para gerá-los4.
As DOP oferecem um modelo alternativo para pesquisa pré-clínica que supera as limitações de ambas as linhagens celulares de câncer e modelos PDX. As DOP recapitulam o tumor e o microambiente tumoral de um paciente e, assim, fornecem um modelo tratável in vitro ideal para a pesquisa pré-clínica 2,3,5. Esses modelos 3D têm capacidades de auto-organização que modelam o tumor primário, que é uma característica que suas contrapartes de linhagem celular bidimensional (2D) não possuem. Além disso, esses modelos demonstraram representar geneticamente e funcionalmente seus tumores pais e, portanto, são modelos confiáveis para o estudo de novas terapêuticas e processos biológicos. Em suma, oferecem capacidades de expansão e armazenamento a longo prazo semelhantes às linhagens celulares, mas também abrangem o microambiente e as interações célula-célula inerentes aos modelos de camundongos 4,6.
O presente protocolo descreve a criação de DOP a partir de tumores derivados de pacientes, ascite e amostras de líquido pleural com uma taxa de sucesso superior a 97%. As culturas de DOP podem então ser expandidas por várias gerações e usadas para testar a sensibilidade à terapia medicamentosa e biomarcadores preditivos. Este método representa uma técnica que poderia ser utilizada para personalizar tratamentos com base nas respostas terapêuticas das DOP.
Protocolo
Todos os espécimes de tecido humano coletados para pesquisa foram obtidos de acordo com o protocolo aprovado pelo Institutional Review Board (IRB). Os protocolos descritos abaixo foram realizados em um ambiente estéril de cultura de tecidos humanos. O termo de consentimento livre e esclarecido foi obtido de seres humanos. As pacientes elegíveis tinham que ter um diagnóstico ou diagnóstico presumido de câncer de ovário, estar dispostas e capazes de assinar o consentimento informado e ter pelo menos 18 anos de idade. Tecido tumoral (tumor primário maligno ou sítios metastáticos), ascite e líquido pleural foram obtidos de pacientes consensuais no momento do procedimento. Esses espécimes foram imediatamente transportados para o laboratório e processados para geração de organoides usando os métodos descritos abaixo.
1. Preparação para a mídia
- Preparação completa do meio organoide
- Preparar o meio condicionado R-spondin 1/Noggin seguindo um relatório publicado anteriormente7.
NOTA: O meio condicionado R-spondin-1/Noggin é uma alternativa mais acessível às proteínas recombinantes comercialmente disponíveis. As células HEK293T secretando de forma estável R-spondin-1 e Noggin via transdução mediada por lentivírus foram um presente generoso de Ron Bose, da Escola de Medicina da Universidade de Washington, em St. Louis, e de Anil Rustgi, do Centro Médico Irving da Universidade Presbiteriana de Nova York/Columbia 8,9,10. O meio condicionado comercial pode ser usado como substituto (ver Tabela de Materiais).
- Preparar o meio condicionado R-spondin 1/Noggin seguindo um relatório publicado anteriormente7.
- Para fazer o meio organoide completo, combine 10% de R-espondina 1/Noggin em meio condicionado, 50 ng/mL de EGF, 10 ng/mL de FGF-10, 10 ng/mL de FGF2, 1x B27, 10 mmol/L de nicotinamida, 1,25 mmol/L de N-acetilcisteína, 1 μmol/L de prostaglandina E2, 10 μmol/L SB202190, 500 nmol/L A83-01 e inibidor de ROCK de 10 μM (ver Tabela de Materiais).
NOTA: O meio pode ser conservado a 4 °C durante um período máximo de 3 meses. Esse meio foi adaptado de Hill et al.11. As concentrações e ingredientes do meio são os mesmos, com a adição de um inibidor de ROCK. - Prepare o meio de base organoide combinando 500 mL de uma formulação avançada de DMEM/F12 com 1% de penicilina-estreptomicina, 1x dipeptídeo, L-alanil-L-glutamina e 1x HEPES (10 mM) (ver Tabela de Materiais).
2. Colheita de organoides da ascite e do líquido pleural
NOTA: A ascite e o líquido pleural devem ser processados o mais rapidamente possível para obter o melhor rendimento dos organoides. Descongele previamente o tampão de reação BME, DNase I e DNase I (ver Tabela de Materiais) colocando-o no gelo até que o conteúdo seja liquefeito.
- Obter ascite e líquido pleural de pacientes consensuais no momento de cirurgias ou procedimentos de cuidados padrão e transportá-los à temperatura ambiente em um recipiente de viagem para o laboratório.
NOTA: Toda ascite ou processamento de líquido pleural deve ser realizado em um ambiente estéril. - Transfira 50 mL de ascite ou líquido pleural para 50 mL de tubos cônicos (o número de tubos depende do volume de ascite obtido). Centrífuga a 1,650 x g durante 5 min a 4 °C. Após a centrifugação, use uma pipeta Pasteur de vidro para aspirar cuidadosamente o sobrenadante.
- Continue adicionando 50 mL de ascite ou líquido pleural ao pellet previamente centrifugado e centrifugar novamente a 1.650 x g por 5 min a 4 °C. Aspirar cuidadosamente o sobrenadante usando uma pipeta Pasteur de vidro. Repita esta etapa até que toda a ascite ou líquido pleural tenha sido processada.
- Preparar uma solução de DNase I de 100 μg/ml combinando 1.000 μL de água isenta de nuclease, 100 μL de tampão de reação DNase I e 10 μL de DNase I.
NOTA: O tratamento com DNase I aplicado é suficiente para fazer uma suspensão unicelular, independentemente da presença de agregados celulares em algumas amostras de pacientes12. - Ressuspender cada pellet celular em 1 mL de 100 μg/mL de solução de DNase I. Adicione suavemente a solução de DNase I gota a gota e deixe o tubo incubar durante 15 minutos à temperatura ambiente.
NOTA: Adicionar um mínimo de 1 ml de solução de DNase I. Se 1 mL não for suficiente para perturbar o pellet, adicione mais 1 mL. - Após a incubação, adicionar 25 mL de meio de base organoide (etapa 1.3) às células e inverter suavemente para misturar. Em seguida, centrifugar a 1.650 x g durante 5 min a 4 °C. Após a centrifugação, aspirar cuidadosamente o sobrenadante utilizando uma pipeta Pasteur de vidro.
- Ressuspeite os pellets de células recém-formados em 5 mL pré-aquecidos de 1x tampão de lise de glóbulos vermelhos (RBC) (consulte Tabela de Materiais). Ajuste o vórtice para 458 x g e vortex as soluções em cada tubo cônico. Uma vez que as soluções sejam homogêneas, use uma pipeta sorológica para combinar o conteúdo de todos os tubos cônicos em um único tubo cônico de 50 mL.
- Incubar o tubo cónico que contém a solução vórtice à temperatura ambiente durante 5 min. Uma vez concluída a incubação, centrifugar a 1.650 x g durante 5 min a 4 °C.
NOTA: Examine o pellet. Um pellet rosa/vermelho indica a presença de hemácias, o que exigiria que a etapa do tampão de lise dos eritrócitos fosse repetida até que a pelota não estivesse mais vermelha. - Após a centrifugação, aspirar cuidadosamente o sobrenadante utilizando uma pipeta Pasteur de vidro. Em seguida, lavar o pellet com 10 mL de PBS, vórtice da solução a 458 x g e centrifugar a 1.650 x g por 5 min a 4 °C.
- Se um pellet de células grandes for formado, aspirar o PBS usando uma pipeta Pasteur de vidro e adicionar 1 mL de meio de base organoide (passo 1.3) em cima do pellet. Vórtice da solução a 458 x g e transfira 300-400 μL para um tubo de microcentrífuga. Centrifugar o tubo de microcentrífuga a 1,650 x g durante 5 min a 4 °C.
NOTA: A porção do pellet celular não colocada no tubo de microcentrífuga pode ser congelada para uso futuro (500 μL de células a 1 mL de 10% de DMSO na FBS). O pellet de células congeladas pode ser armazenado por semanas a -80 °C e por anos se colocado em nitrogênio líquido13. - Aspirar cuidadosamente o meio de base organoide (passo 1.3) utilizando uma pipeta Pasteur de vidro e ressuspender em BME (ver Tabela de Materiais) utilizando pontas frias.
NOTA: A quantidade de BME é baseada no tamanho do pellet. Recomenda-se o uso de meio de base organoide a 25% (etapa 1.3) com células ressuspensas a 75% de EMB. - Alíquotas de 40 μL da solução de células ressuspensas sobre uma placa de 6 poços. Placa até cinco alíquotas por poço (Figura 1).
- Colocar imediatamente a placa numa incubadora de 37 °C durante 20 minutos para permitir que a BME se solidifique. Após a incubação, adicione suavemente 2 mL de meio organoide completo (etapa 1.2) em cada poço.
Figura 1: Revestimento de organoides de câncer de ovário derivados de pacientes. Imagem representativa do revestimento organoide. As alíquotas da mistura organoide são cuidadosamente chapeadas, garantindo que nenhuma bolha seja formada. Por favor, clique aqui para ver uma versão maior desta figura.
3. Colheita de organoides do tecido
NOTA: O tecido deve ser processado o mais rapidamente possível para obter o melhor rendimento de organoides.
- Coletar e transportar o tumor no gelo em um recipiente de viagem contendo PBS.
- Colocar a amostra em um prato de cultura de tecidos de 10 cm (Figura 2). Usando um bisturi descartável, pice o tecido. Em seguida, usando a extremidade opaca de uma seringa descartável, esmague o tecido até que uma mistura homogênea tenha sido criada.
- Usando fórceps, coloque a mistura de tecido homogênea em um tubo de dissociação. Para cada 1-2 ml de tecido homogeneizado, adicionar 7-8 ml de solução de colagenase tipo II de 1 mg/ml (ver Tabela de Materiais) em meio de base organoide (passo 1.3) e 1 ml de solução de DNase I. Vórtice a solução a 458 x g.
NOTA: A quantidade de tecido determinará a quantidade de solução de colagenase e o número de tubos necessários. - Use a máquina de dissociação (ver Tabela de Materiais) para liquefazer o tecido enquanto ele estiver na solução de colagenase. Execute o programa 37C_h_TDK3 (1 h) até que seja uma suspensão de célula única.
NOTA: O programa precisará ser executado novamente se a mistura resultante não for homogênea (ou seja, se os pedaços de tecido ainda estiverem presentes na mistura). Se o tecido for digerido mas a solução for viscosa, diluir utilizando um meio de base organoide (passo 1.3). - Transfira a mistura homogeneizada para um novo tubo cônico de 50 mL e adicione 20-40 mL de meio de base organoide (etapa 1.3). Em seguida, filtre a solução através de um filtro de células de 100 μm em um tubo cônico de 50 mL recém-marcado.
- Centrifugar a mistura filtrada a 1,650 x g durante 5 min a 4 °C. Em seguida, aspirar cuidadosamente o sobrenadante usando uma pipeta Pasteur de vidro.
- Preparar uma solução de DNase I de 100 μg/ml combinando 1.000 μL de água isenta de nuclease, 100 μL de tampão de reação DNase I e 10 μL de DNase I.
NOTA: O tratamento com DNase I aplicado é suficiente para fazer uma suspensão unicelular, independentemente da presença de agregados celulares em algumas amostras de pacientes12. - Ressuspender as células em 1 ml de 100 ug/ml de solução de DNase I. Adicione suavemente a solução de DNase I gota a gota e deixe o tubo incubar durante 15 minutos à temperatura ambiente.
- Após a incubação, adicionar 25 mL de meio de base organoide (etapa 1.3) às células e inverter suavemente para misturar. Em seguida, centrifugar a 1.650 x g durante 5 min a 4 °C. Após a centrifugação, aspirar cuidadosamente o sobrenadante utilizando uma pipeta Pasteur de vidro.
- Ressuspeite o pellet celular recém-formado em 5 mL de tampão de lise pré-aquecido 1x hemácias. Vórtice as soluções em cada tubo cônico a 458 x g.
- Incubar o tubo cônico contendo o pellet celular ressuspenso no tampão de lise RBC por 5 min. Uma vez concluída a incubação, centrifugar a 1.650 x g durante 5 min a 4 °C.
NOTA: Examine o pellet. Um pellet rosa/vermelho indica a presença de hemácias, o que exigiria que a etapa do tampão de lise dos eritrócitos fosse repetida até que a pelota parecesse branca. - Após a centrifugação, aspirar cuidadosamente o sobrenadante utilizando uma pipeta Pasteur de vidro. Em seguida, lavar o pellet com 10 mL de PBS, vórtice da solução a 458 x g e centrifugar a 1.650 x g por 5 min a 4 °C.
- Se um pellet de células grandes for formado, aspirar o PBS usando uma pipeta Pasteur de vidro e adicionar 1 mL de meio de base organoide (passo 1.3) em cima do pellet. Vórtice da solução a 458 x g e transfira 300-400 μL para um tubo de microcentrífuga. Centrífuga a 1,650 x g durante 5 min a 4 °C.
NOTA: A porção do pellet celular não colocada no tubo de microcentrífuga pode ser congelada para uso futuro (500 μL de células a 1 mL de 10% de DMSO na FBS) (etapa 5.1). O pellet de células congeladas pode ser armazenado por semanas a -80 °C e por anos se colocado em nitrogênio líquido13. - Aspirar cuidadosamente o meio de base organoide utilizando uma pipeta Pasteur de vidro e ressuspender em BME utilizando pontas frias.
NOTA: A quantidade de BME é baseada no tamanho do pellet. Recomenda-se a adição de 25% de meio de base organoide (passo 1.3) com células ressuspensas a 75% de EMB. - Colocar a solução de células ressuspensas numa placa de 6 poços em alíquotas de 40 μL. Placa até cinco alíquotas por poço.
- Coloque imediatamente a placa do poço na incubadora por 20 min. Após a incubação, adicione suavemente 2 mL de meio organoide completo (etapa 1.2) em cada poço.

Figura 2: Tecido tumoral antes da dissecção. Imagem representativa do tecido tumoral obtida para geração de organoides. Por favor, clique aqui para ver uma versão maior desta figura.
4. Passaging de organoides
NOTA: Se a amostra for confluente, cada poço organoide pode ser passado semanalmente para dois novos poços.
- Utilizando uma pipeta de 1 mL, adicione 1 mL de meio de base organoide (etapa 1.3) a cada poço e pipete o meio para cima e para baixo diretamente nas abas organoides para dissociá-lo. Recolher todo o meio que contém os pellets ressuspensos num tubo cónico de 15 ml.
- Centrifugar o tubo cónico de 15 ml contendo a mistura a 1.650 x g durante 5 min a 4 °C. Em seguida, aspirar cuidadosamente o sobrenadante usando uma pipeta Pasteur de vidro.
- Adicionar 1 ml de enzima recombinante isenta de origem animal (ver Tabela de Materiais) ao pellet celular, vortex da solução a 458 x g e transferir para um tubo de microcentrífuga de 1,5 ml. Deixar o tubo incubar durante 15 minutos num banho de água a 37 °C.
- Após incubação, centrifugar a 1,650 x g durante 5 min a 4 °C. Em seguida, aspirar cuidadosamente o sobrenadante usando uma pipeta Pasteur de vidro.
- Ressuscite o pellet no BME.
NOTA: A quantidade de BME é baseada no tamanho do pellet. Recomenda-se a adição de 25% de meios de base organoides (etapa 1.3) com células ressuspensas a 75% de EMB. - Chapear a solução de células ressuspensas numa placa de 6 poços em alíquotas de 40 μL. Placa até cinco alíquotas por poço. Uma vez que todas as alíquotas tenham sido chapeadas, coloque imediatamente a placa do poço na incubadora por 20 min. Após a incubação, adicione suavemente 2 mL de meio organoide completo (etapa 1.2) em cada poço.
5. Congelamento e descongelamento de organoides
- Congelamento de organoides
- Comece com as etapas 4.1-4.4.
- Ressuspeite o pellet celular em 0,5-1 mL de meio de congelamento de cultura celular de recuperação (ver Tabela de Materiais) e transfira 1 mL para cada criovial.
- Em seguida, coloque os crioviais em um recipiente cheio de isopropanol a -80 °C por até 2 semanas antes de transferi-los para um tanque de nitrogênio líquido para armazenamento a longo prazo13.
- Descongelamento de organoides
- Retirar as amostras do reservatório de azoto líquido e descongelar a 37 °C em banho-maria.
- Uma vez descongelado, transferir para um tubo cônico de 15 mL e centrifugar a 1.650 x g por 5 min a 4 °C. Após a centrifugação, aspirar cuidadosamente o sobrenadante utilizando uma pipeta Pasteur de vidro.
- Ressuscite o pellet no BME.
NOTA: A quantidade de BME é baseada no tamanho do pellet. Recomenda-se a adição de 25% de meios de base organoides (etapa 1.3) com células ressuspensas a 75% de EMB. - Colocar a solução de células ressuspensas numa placa de 6 poços em alíquotas de 40 μL. Coloque até cinco alíquotas por poço.
- Coloque imediatamente a placa na incubadora por 20 min. Após a incubação, adicionar suavemente 2 mL de meio organoide completo (etapa 1.2) aos poços.
6. Incorporação e geração de lâminas embutidas em parafina fixada em formalina (FFPE) para avaliar a composição organoide
- Após a cultura de organoides por pelo menos 10 dias para garantir o tamanho adequado, remova o meio organoide completo dos poços e adicione 1 mL de fixador de paraformaldeído a 2% (PFA). Incubar à temperatura ambiente por 5-10 min.
- Após a incubação, lavar as alíquotas organoides cultivadas 3x por 5 min de cada vez com 1 mL de PBS.
- Retire o PBS de cada poço e adicione 1 mL de ágar quente a 2% em H2O deionizado a cada poço. Ao adicionar o ágar, levante as alíquotas organoides cultivadas da placa usando uma espátula.
NOTA: É importante não deixar o ágar endurecer antes de levantar as alíquotas organoides cultivadas.- Deixe o ágar solidificar no poço à temperatura ambiente.
- Usando uma espátula pequena, liberte o ágar solidificado do poço e armazene-o em por até 48 h (ver Tabela de Materiais) a 4 °C em etanol a 70% até o processamento14.
- Incorpore as amostras em parafina 15, corte as lâminas até uma espessura de 5 μm e core as lâminas com coloração de hematoxilina e eosina (H & E, ver Tabela de Materiais) usando um protocolo padrão15.
Resultados
Para gerar DOPs, as amostras foram digeridas mecanicamente e enzimaticamente em suspensões unicelulares. As células foram então ressuspensas em BME e suplementadas com meios especificamente modificados (Figura 3). Os organoides são tipicamente estabelecidos ao longo de um período de tempo de 10 dias, após o qual demonstram organoides discretos em cultura (Figura 4).

Figura 3: Esquema das coleções de pacientes formadas em organoides. O tecido do paciente, a ascite ou o líquido pleural são digeridos mecanicamente ou enzimaticamente. A suspensão de célula única é então banhada em BME, onde a cultura prolifera com a ajuda de meios de crescimento especializados adaptados ao HGSOC. Por favor, clique aqui para ver uma versão maior desta figura.
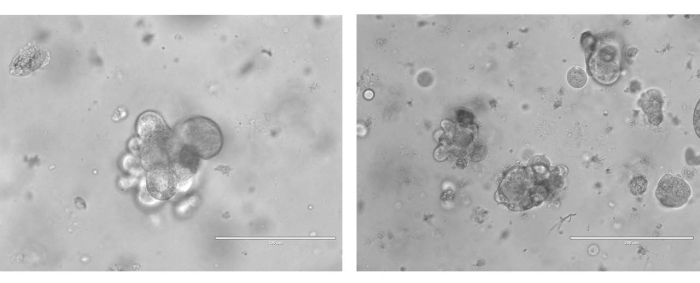
Figura 4: Imagens representativas de dois organoides exclusivos de câncer de ovário derivados de pacientes após 7 dias de crescimento. As imagens organoides foram obtidas a 40x. A barra de escala de campo brilhante na imagem esquerda é de 100 μm e na imagem à direita é de 200 μm. Clique aqui para ver uma versão maior desta figura.
A partir do protocolo apresentado, um biobanco de 23 organoides foi produzido e cultivado por mais de 5 meses com passe regular. As características clínicas dos tumores de origem estão apresentadas na Tabela 1. A maioria dos tumores era de estágio avançado (100%), carcinoma seroso de alto grau (92,9%) e tratamento ingênuo (85,7%).
| N = 23 | |
| Idade (anos) | 63,5 ± 9,7 |
| Etapa FIGO III IV Pendente | 13 (56.5) 9 (39.2) 1 (4.3) |
| Histologia Seroso de alto grau Carcinossarcoma Seroso de baixo grau | 21 (92.9) 1 (7.1) 1 (4.3) |
| Mutação BRCA Sim Não | 1 (4.3) 22 (95.7) |
| Linhas Prévias de Quimioterapia 0 1-5 ≥5 | 20 (85.7) 0 2 (14.2) |
Tabela 1: Características do biobanco DOP. A tabela contém as características específicas dos organoides gerados usando o presente protocolo. Essas características incluem idade, estágio FIGO (Federação Internacional de Ginecologia e Obstetrícia), histologia, status de mutação BRCA (BReast CAncer gene) e linhas anteriores de quimioterapia.
As culturas organoides podem ser avaliadas por incorporação em agarose e avaliação com H&E (Figura 5).
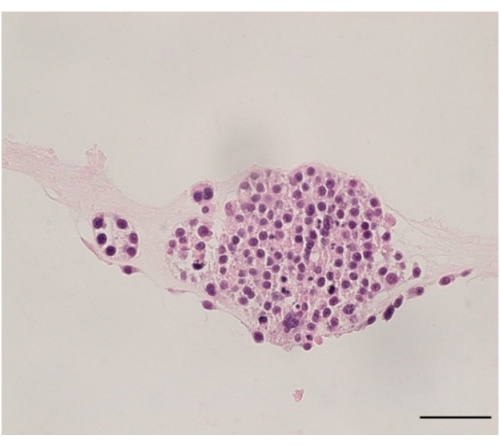
Figura 5: Coloração de hematoxilina e eosina da DOP. Imagem representativa da coloração H&E de um organoide de câncer de ovário gerado a partir de uma amostra de paciente. A imagem foi tirada a 40x, e a barra de escala é de 50 μm. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
O câncer de ovário é extremamente mortal devido ao seu estágio avançado no diagnóstico, bem como ao desenvolvimento comum de resistência à quimioterapia. Muitos avanços na pesquisa do câncer de ovário foram feitos utilizando linhas celulares de câncer e modelos PDX; no entanto, há uma necessidade evidente de um modelo in vitro mais representativo e acessível. As DOP têm demonstrado representar com precisão a heterogeneidade tumoral, o microambiente tumoral e as características genômicas e transcriptômicas de seus tumores primários e, portanto, são modelos pré-clínicos ideais para diversas abordagens de pesquisa, como a implementação de modelos organoides na terapia medicamentosa16.
O protocolo descrito aqui é muito eficaz e confiável, como indicado pela taxa de sucesso de 97%. É importante destacar que o presente protocolo tem etapas críticas às quais se deve prestar muita atenção. Primeiro, ao colher organoides do tecido, é essencial garantir que a amostra seja completamente homogeneizada. Isso pode exigir a execução do programa de dissociação mais de uma vez, se necessário. Se a amostra não for homogênea, os pedaços restantes de tecido podem comprometer o crescimento organoide. Em segundo lugar, como a temperatura de trabalho do BME é de 2-8 °C, é importante realizar todas as etapas que envolvem este reagente no gelo para evitar a polimerização. Além disso, ao ressuspender e revestir com BME, é crucial evitar bolhas, pois isso torna as alíquotas organoides banhadas instáveis, fazendo com que elas se desloquem da placa. Por fim, a EMB utilizada neste protocolo foi gerada a partir do tumor Engelbreth-Holm-Swarm (EHS) e, portanto, tem o potencial de composição inconsistente entre os lotes. Essas diferenças podem afetar a geração e o crescimento de organoides. Não há uma maneira específica de superar essa limitação, pois os autores desconhecem opções alternativas deEMB 17. Pesquisas futuras são necessárias para estabelecer materiais alternativos para BME ou andaime 3D. Dadas todas as considerações acima, é importante enfatizar que esses métodos devem ser adaptados e testados para diferentes ambientes e equipamentos de laboratório.
Apesar dos avanços que os organoides podem fornecer à pesquisa do câncer de ovário, existem limitações para a implementação de modelos organoides. A geração e a manutenção de organoides são processos demorados e caros. A quantidade de tempo necessária para o crescimento organoide permite a introdução de contaminação. Além disso, a variabilidade do crescimento requer supervisão constante para garantir que a quantidade de meios disponíveis seja suficiente para o desenvolvimento de organoides e que a contaminação não esteja presente. Além disso, a composição celular dos organoides é variável. As células imunes estão presentes inicialmente, mas geralmente não persistem após a segunda passagem. Isso pode ser superado com a suplementação de citocinas na mídia, mas está fora do escopo de nosso trabalho atual. As células estromais parecem persistir através da passagem, mas os componentes dependem muito da amostra inicial18,19. Mais trabalhos são necessários para entender melhor os componentes celulares exatos e a persistência de cada tipo de célula. A geração de organoides de pacientes submetidos a várias linhas de quimioterapia é desafiadora e problemática. Mais estudos são necessários para compreender o impacto da quimioterapia na geração e desenvolvimento de organoides. Por fim, em nossa experiência, o número de organoides gerados a partir de uma quantidade específica de tecido, ascite ou líquido pleural é imprevisível. Por exemplo, a mesma quantidade de tumor, ascite ou líquido pleural coletado de dois pacientes diferentes resultará em quantidades diferentes de organoides. Mais pesquisas estão sendo realizadas para obter informações sobre os melhores tipos de células para sobrevivência e viabilidade organoides.
No entanto, as DOP oferecem oportunidades únicas para a pesquisa pré-clínica em comparação com linhagens celulares e modelos PDX. Embora tenham sido feitos progressos em relação ao diagnóstico e tratamento do câncer de ovário, ainda há um trabalho significativo a ser feito, e as DOP são uma ferramenta especial necessária para o avanço da pesquisa sobre o câncer de ovário.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Somos gratos pela orientação de Ron Bose, MD, PhD, e pela assistência de Barbara Blachut, MD, no estabelecimento deste protocolo. Também gostaríamos de agradecer à Escola de Medicina da Universidade de Washington no Departamento de Obstetrícia e Ginecologia e Divisão de Oncologia Ginecológica da Universidade de Washington, ao Programa Acadêmico do Decano da Universidade de Washington e ao Programa de Desenvolvimento de Cientistas Reprodutivos por seu apoio a este projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| 1% HEPES | Life Technologies | 15630080 | |
| 1% Penicillin-Streptomycin | Fisher Scientific | 30002CI | |
| 1.5 mL Eppendorf Tubes | Genesee Scientific | 14125 | |
| 10 cm Tissue Culture Dish | TPP | 93100 | |
| 10 mL Serological Pipet | |||
| 100 µm Cell Filter | MidSci | 100ICS | |
| 15 mL centrifuge tubes | Corning | 430052 | |
| 2 mL Cryovial | Simport Scientific | T301-2 | |
| 2% Paraformaldehyde Fixative | Sigma-Aldrich | ||
| 37 °C water bath | NEST | 602052 | |
| 3dGRO R-Spondin-1 Conditioned Media Supplement | Millipore Sigma | SCM104 | |
| 6 well plates | TPP | 92006 | |
| 70% Ethanol | Sigma-Aldrich | R31541GA | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM/F12 | ThermoFisher | 12634028 | |
| Agar | Lamda Biotech | C121 | |
| B-27 | Life Technologies | 17504044 | |
| Centrifuge | |||
| Cultrex Type 2 | R&D Systems | 3533-010-02 | basement membrane extract |
| DNase I | New England Bio Labs | M0303S | |
| DNase I Reaction Buffer | New England Bio Labs | M0303S | |
| EGF | PeproTech | AF-100-15 | |
| FBS | Sigma-Aldrich | F2442 | |
| FGF-10 | PeproTech | 100-26 | |
| FGF2 | PeproTech | 100-18B | |
| gentleMACS C Tubes | Miltenyi BioTech | 130-096-334 | |
| gentleMACS Octo Dissociator with Heaters | Miltenyi BioTech | 130-096-427 | We use the manufacturers protocol. |
| GlutaMAX | Life Technologies | 35050061 | dipeptide, L-alanyl-L-glutamine |
| Hematoxylin and Eosin Staining Kit | Fisher Scientific | NC1470670 | |
| Histoplast Paraffin Wax | Fisher Scientific | 22900700 | |
| Microcentrifuge | |||
| Mr. Frosty Freezing Container | Fisher Scientific | 07202363S | |
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| p1000 Pipette with Tips | |||
| p200 Pipette with Tips | |||
| Pasteur Pipettes 9" | Fisher Scientific | 1367820D | |
| PBS | Fisher Scientific | MT21031CM | |
| Pipet Controller | |||
| Prostaglandin E2 | R&D Systems | 2296 | |
| Puromycin | ThermoFisher | A1113802 | |
| Recombinant Murine Noggin | PeproTech | 250-38 | |
| Recovery Cell Culture Freezing Medium | Invitrogen | 12648010 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | |
| ROCK Inhibitor (Y-27632) | R&D Systems | 1254/1 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| T75 Flask | MidSci | TP90076 | |
| Tissue Culture Hood | |||
| Tissue Embedding Cassette | |||
| TrypLE Express | Invitrogen | 12604013 | animal origin-free, recombinant enzyme |
| Type II Collagenase | Life Technologies | 17101015 | |
| Vortex |
Referências
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Fujii, E., Kato, A., Suzuki, M. Patient-derived xenograft (PDX) models: Characteristics and points to consider for the process of establishment. Journal of Toxicologic Pathology. 33 (3), 153-160 (2020).
- Yang, J., et al. Application of ovarian cancer organoids in precision medicine: Key challenges and current opportunities. Frontiers in Cell and Developmental Biology. 9, 701429 (2021).
- Yang, H., et al. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Madison, B. B., et al. Let-7 represses carcinogenesis and a stem cell phenotype in the intestine via regulation of Hmga2. PLoS Genetics. 11 (8), 1005408 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Murray, E., et al. HER2 and APC mutations promote altered crypt-villus morphology and marked hyperplasia in the intestinal epithelium. Cellular and Molecular Gastroenterology and Hepatology. 12 (3), 1105-1120 (2021).
- Hill, S. J., et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids. Cancer Discovery. 8 (11), 1404-1421 (2018).
- Passarelli, M. C., et al. Leucyl-tRNA synthetase is a tumour suppressor in breast cancer and regulates codon-dependent translation dynamics. Nature Cell Biology. 24 (3), 307-315 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Stumm, M. M., et al. Validation of a postfixation tissue storage and transport medium to preserve histopathology and molecular pathology analyses (total and phosphoactivated proteins, and FISH). American Journal of Clinical Pathology. 137 (3), 429-436 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nanki, Y., et al. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing. Scientific Reports. 10, 12581 (2020).
- Mead, B. E., et al. Screening for modulators of the cellular composition of gut epithelia via organoid models of intestinal stem cell differentiation. Nature Biomedical Engineering. 6 (4), 476-494 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados