Method Article
高悪性度漿液性卵巣癌患者由来オルガノイドの作製と培養
要約
患者由来オルガノイド(PDO)は、 in vitroで腫瘍環境を模倣できる3次元(3D)培養です。高悪性度漿液性卵巣がんにおいて、PDOは新しいバイオマーカーと治療法を研究するためのモデルです。
要約
オルガノイドは、患者由来の卵巣腫瘍組織、腹水、または胸水から正常に増殖できる3D動的腫瘍モデルであり、卵巣癌の新しい治療法と予測バイオマーカーの発見に役立ちます。 これらのモデルは、クローンの不均一性、腫瘍微小環境、および細胞間および細胞-マトリックス相互作用を再現しています。さらに、それらは形態学的、細胞学的、免疫組織化学的、および遺伝的に原発腫瘍と一致することが示されています。したがって、オルガノイドは腫瘍細胞および腫瘍微小環境に関する研究を容易にし、細胞株よりも優れています。本プロトコルは、97%を超える成功率で患者の腫瘍、腹水、および胸水サンプルから患者由来の卵巣癌オルガノイドを生成するための異なる方法について説明しています。患者サンプルは、機械的消化と酵素消化の両方によって細胞懸濁液に分離されます。次に、基底膜抽出物(BME)を利用して細胞を播種し、高悪性度漿液性卵巣癌(HGSOC)の培養に特異的なサプリメントを含む最適化された増殖培地でサポートします。最初のオルガノイドを形成した後、PDOは、その後の実験のための増殖のための継代を含む、長期間の培養を維持することができる。
概要
2021年には、米国で約21,410人の女性が新たに上皮性卵巣がんと診断され、12,940人の女性がこの病気で死亡しました1。手術と化学療法は十分に進歩していますが、進行性疾患の患者の70%以上が化学療法耐性を発症し、診断から5年以内に死亡します2,3。したがって、この致命的な病気を治療するための新しい戦略と、前臨床研究のための代表的な信頼できるモデルが緊急に必要とされています。
原発性卵巣腫瘍から作製されたがん細胞株および患者由来異種移植片(PDX)は、卵巣がん研究で使用される主要な機器です。がん細胞株の主な利点は、その急速な拡大です。しかし、それらの継続的な培養は、表現型および遺伝子型の変化をもたらし、癌細胞株を元の原発癌腫瘍サンプルから逸脱させる。がん細胞株と原発腫瘍の間には既存の違いがあるため、細胞株でプラスの効果がある薬物アッセイは、臨床試験でこれらの同じ効果をもたらすことができません2。これらの制限を克服するために、PDXモデルが使用されます。これらのモデルは、免疫不全マウスに新鮮な卵巣癌組織を移植することによって作成されます。それらは in vivo モデルであるため、ヒトの生物学的特性により正確に似ており、薬物の結果をより予測します。ただし、これらのモデルには、モデルの生成に必要なコスト、時間、リソースなど、大きな制限もあります4。
PDOは、がん細胞株とPDXモデルの両方の限界を克服する前臨床研究の代替モデルを提供します。PDOは、患者の腫瘍および腫瘍微小環境を再現し、したがって、前臨床研究に理想的なin vitro扱い可能なモデルを提供します2,3,5。これらの3Dモデルは、原発腫瘍をモデル化する自己組織化機能を有しており、これはそれらの2次元(2D)細胞株の対応物にはない特徴である。さらに、これらのモデルは、それらの親腫瘍を遺伝的および機能的に表すことが示されており、したがって、新しい治療法および生物学的プロセスを研究するための信頼できるモデルである。要するに、それらは細胞株と同様の長期的な増殖および保存能力を提供するだけでなく、マウスモデルに固有の微小環境および細胞間相互作用も包含する4,6。
本プロトコルは、97%を超える成功率を有する患者由来の腫瘍、腹水、および胸水サンプルからのPDOの作成について説明しています。その後、PDO培養を複数世代にわたって拡張し、薬物療法の感受性と予測バイオマーカーをテストするために使用できます。この方法は、PDOの治療反応に基づいて治療をパーソナライズするために使用できる技術を表しています。
プロトコル
研究のために収集されたすべてのヒト組織標本は、治験審査委員会(IRB)が承認したプロトコルに従って取得されました。以下に概説するプロトコルは、無菌ヒト組織培養環境で実施した。インフォームド書面による同意は、ヒト被験者から得られた。適格な患者は、卵巣がんの診断または推定診断を受け、インフォームドコンセントに署名する意思と能力があり、18歳以上でなければなりませんでした。腫瘍組織(悪性原発腫瘍または転移部位)、腹水、および胸水は、処置時に同意した患者から入手しました。これらの標本は直ちに実験室に輸送され、以下に概説する方法を使用してオルガノイド生成のために処理されました。
1. メディアの準備
- 完全なオルガノイド培地調製
- R-スポンジン1/ノギン馴化培地を調製し、以前に発表された第7報告書に続いて調製する。
注:R-spondin-1/Noggin馴化培地は、市販の組換えタンパク質に代わるより手頃な代替品です。レンチウイルスを介した形質導入を介してR-スポンジン-1とノギンを安定して分泌するHEK293T細胞は、セントルイスのワシントン大学医学部のロン・ボーズとニューヨーク長老派/コロンビア大学アーヴィング医療センターのアニル・ラストギからの寛大な贈り物でした8,9,10。市販の馴化培地を代替として使用することができる(材料表を参照)。
- R-スポンジン1/ノギン馴化培地を調製し、以前に発表された第7報告書に続いて調製する。
- 完全なオルガノイド培地を作るには、10%R-スポンジン1/ノギン馴化培地、50 ng/mL EGF、10 ng/mL FGF-10、10 ng/mL FGF2、1x B27、10 mmol/Lニコチンアミド、1.25 mmol/L N-アセチルシステイン、1 μmol/LプロスタグランジンE2、10 μmol/L SB202190、500 nmol/L A83-01、および10 μM ROCK阻害剤( 材料の表を参照)を組み合わせます。
注:培地は4°Cで最大3か月間保存できます。この培地は、Hillら11から適応された。培地の濃度と成分は同じですが、ROCK阻害剤が添加されています。 - 500 mLのDMEM/F12の高度な製剤と1%ペニシリン-ストレプトマイシン、1xジペプチド、L-アラニル-L-グルタミン、および1xHEPES(10 mM)を組み合わせて、オルガノイドベース培地を調製します( 材料の表を参照)。
2. 腹水および胸水からのオルガノイドの採取
注:腹水と胸水は、オルガノイドの最良の収量を得るためにできるだけ早く処理する必要があります。以前に分注したBME、DNase I、およびDNase I反応バッファー( 材料の表を参照)を、内容物が液化するまで氷上に置いて解凍します。
- 標準治療の手術や処置時に同意した患者から腹水や胸水を入手し、トラベルコンテナに入れて室温で検査室に輸送します。
注:すべての腹水または胸水処理は、無菌環境で実行する必要があります。 - 50 mLの腹水または胸水を50 mLの円錐管に移します(チューブの数は得られる腹水の量によって異なります)。1,650 x g で4°Cで5分間遠心分離します。 遠心分離後、ガラス製のパスツールピペットを使用して上清を注意深く吸引します。
- 先に遠心分離したペレットに50 mLの腹水または胸水を加えて続け、4°Cで5分間1,650 x g で再び遠心分離します。 ガラス製パスツールピペットを使用して上清を注意深く吸引します。すべての腹水または胸水が処理されるまで、この手順を繰り返します。
- 1,000 μLのヌクレアーゼフリー水、100 μLのDNase I反応バッファー、および10 μLのDNase Iを組み合わせて、100 μg/mLのDNase I溶液を調製します。
注:適用されるDNase I処理は、一部の患者サンプル中の細胞凝集体の存在に関係なく、単一細胞懸濁液を作るのに十分です12。 - 各細胞ペレットを1 mLの100 μg/mL DNase I溶液に再懸濁します。DNase I溶液を静かに滴下し、チューブを室温で15分間インキュベートします。
注:最低1mLのDNase I溶液を追加します。1 mLではペレットを乱すのに十分でない場合は、さらに1 mLを追加します。 - インキュベーション後、25 mLのオルガノイドベース培地を細胞に加え(ステップ1.3)、穏やかに転倒させて混合します。その後、1,650 x g で4°Cで5分間遠心分離します。 遠心分離後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- 新しく形成された細胞ペレットを、事前に温めた5 mLの1x赤血球(RBC)溶解バッファーに再懸濁します( 材料の表を参照)。渦を458 x gに設定し、各円錐管内の溶液を渦巻きします。溶液が均一になったら、血清学的ピペットを使用して、すべてのコニカルチューブの内容物を単一の50 mLコニカルチューブに結合します。
- ボルテックス溶液を含む円錐管を室温で5分間インキュベートします。インキュベーションが完了したら、1,650 x g で4°Cで5分間遠心分離します。
注意: ペレットを調べます。ピンク/赤のペレットは赤血球の存在を示しており、ペレットが赤くなくなるまで赤血球溶解バッファーステップを繰り返す必要があります。 - 遠心分離後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。次に、ペレットを10 mLのPBSで洗浄し、溶液を458 x gでボルテックスし、1,650 x gで4°Cで5分間遠心分離します。
- 大きな細胞ペレットが形成された場合は、ガラスパスツールピペットを使用してPBSを吸引し、ペレットの上に1 mLのオルガノイドベース培地を加えます(ステップ1.3)。溶液を458 x gでボルテックスし、300〜400 μLをマイクロ遠心チューブに移します。マイクロ遠心チューブを1,650 x g で4°Cで5分間遠心分離します。
注:マイクロ遠心チューブに入れられていない細胞ペレットの部分は、将来の使用のために凍結することができます(FBS中の10%DMSOの1mLに対して500μLの細胞)。凍結気泡ペレットは、-80°Cで数週間、液体窒素13に入れた場合は数年間保存できます。 - ガラス製パスツールピペットを使用してオルガノイドベース培地を注意深く吸引し(ステップ1.3)、コールドチップを使用してBME( 材料表を参照)に再懸濁します。
注:BMEの量はペレットのサイズに基づいています。細胞を再懸濁して75%BMEに25%オルガノイドベース培地(ステップ1.3)を使用することをお勧めします。 - 再懸濁した細胞溶液の40 μLアリコートを6ウェルプレートにプレートします。ウェルあたり最大5つのアリコートをプレートします(図1)。
- 直ちにプレートを37°Cのインキュベーターに20分間入れ、BMEを固化させます。インキュベーション後、2 mLの完全オルガノイド培地を各ウェルに穏やかに加えます(ステップ1.2)。
図1:患者由来の卵巣癌オルガノイドのめっき。 オルガノイドめっきの代表的な画像。オルガノイド混合物のアリコートは慎重にメッキされ、気泡が形成されないようにします。 この図の拡大版を表示するには、ここをクリックしてください。
3. 組織からのオルガノイドの採取
注:オルガノイドの最良の収量を得るには、できるだけ早く組織を処理する必要があります。
- 腫瘍を収集し、PBSを含むトラベルコンテナで氷上に輸送します。
- サンプルを10 cmの組織培養皿に置きます(図2)。使い捨てメスを使用して、ティッシュを細かく刻みます。次に、使い捨て注射器の鈍い端を使用して、均質な混合物が作成されるまで組織を粉砕します。
- 鉗子を使用して、均質な組織混合物を解離チューブに入れる。均質化された組織1〜2 mLごとに、オルガノイドベース培地に7〜8 mLの1 mg / mLタイプIIコラゲナーゼ溶液( 材料の表を参照)と1 mLのDNase I溶液を追加します。溶液を458 x gでボルテックスします。
注意: 組織の量は、コラゲナーゼ溶液の量と必要なチューブの数を決定します。 - 解離機( 材料表を参照)を使用して、組織がコラゲナーゼ溶液中にある間に液化します。単一細胞懸濁液になるまでプログラムを37C_h_TDK3(1時間)実行します。
注:得られた混合物が均質でない場合(つまり、組織片が混合物にまだ存在する場合)は、プログラムを再実行する必要があります。組織が消化されるが溶液が粘性である場合は、オルガノイドベース培地を使用して希釈します(ステップ1.3)。 - ホモジナイズした混合物を新しい50 mLコニカルチューブに移し、20〜40 mLのオルガノイドベース培地を加えます(ステップ1.3)。次に、溶液を100 μmのセルストレーナーを通してろ過し、新しくラベル付けされた50 mLコニカルチューブに入れます。
- ろ過した混合物を1,650 x g で4°Cで5分間遠心分離します。 その後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- 1,000 μLのヌクレアーゼフリー水、100 μLのDNase I反応バッファー、および10 μLのDNase Iを組み合わせて、100 μg/mLのDNase I溶液を調製します。
注:適用されるDNase I処理は、一部の患者サンプル中の細胞凝集体の存在に関係なく、単一細胞懸濁液を作るのに十分です12。 - 細胞を1 mLの100 ug/mL DNase I溶液に再懸濁します。DNase I溶液を静かに滴下し、チューブを室温で15分間インキュベートします。
- インキュベーション後、25 mLのオルガノイドベース培地を細胞に加え(ステップ1.3)、穏やかに転倒させて混合します。その後、1,650 x g で4°Cで5分間遠心分離します。 遠心分離後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- 新しく形成された細胞ペレットを、予め温めた5 mLの1x RBC溶解バッファーに再懸濁します。各円錐管の溶液を458 x gで渦巻きます。
- 細胞ペレットを含むコニカルチューブをRBC溶解バッファーに再懸濁して5分間インキュベートします。インキュベーションが完了したら、1,650 x g で4°Cで5分間遠心分離します。
注意: ペレットを調べます。ピンク/赤のペレットは赤血球の存在を示しており、ペレットが白くなるまでRBC溶解バッファーステップを繰り返す必要があります。 - 遠心分離後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。次に、ペレットを10 mLのPBSで洗浄し、溶液を458 x gでボルテックスし、1,650 x gで4°Cで5分間遠心分離します。
- 大きな細胞ペレットが形成された場合は、ガラスパスツールピペットを使用してPBSを吸引し、ペレットの上に1 mLのオルガノイドベース培地を加えます(ステップ1.3)。溶液を458 x gでボルテックスし、300〜400 μLをマイクロ遠心チューブに移します。1,650 x g で4°Cで5分間遠心分離します。
注:マイクロ遠心チューブに入れられていない細胞ペレットの部分は、将来の使用のために凍結することができます(FBS中の10%DMSOの1mLに対して500μLの細胞)(ステップ5.1)。凍結気泡ペレットは、-80°Cで数週間、液体窒素13に入れた場合は数年間保存できます。 - ガラス製パスツールピペットを使用してオルガノイドベース培地を注意深く吸引し、コールドチップを使用してBMEに再懸濁します。
注:BMEの量はペレットのサイズに基づいています。細胞を再懸濁した25%オルガノイドベース培地(ステップ1.3)を75%BMEに加えることをお勧めします。 - 再懸濁した細胞溶液を40 μLアリコートで6ウェルプレートにプレートします。ウェルあたり最大5つのアリコートをプレートします。
- すぐにウェルプレートをインキュベーターに20分間入れます。インキュベーション後、2 mLの完全オルガノイド培地を各ウェルに穏やかに加えます(ステップ1.2)。

図2:解剖前の腫瘍組織。 オルガノイド生成のために得られた腫瘍組織の代表像。 この図の拡大版を表示するには、ここをクリックしてください。
4. オルガノイドの継代
注:サンプルがコンフルエントである場合、各オルガノイドウェルは毎週2つの新しいウェルに継代することができます。
- 1 mLピペットを使用して、1 mLのオルガノイドベース培地を各ウェルに加え(ステップ1.3)、培地をオルガノイドタブに直接上下にピペットで動かして解離させます。再懸濁したペレットを含むすべての培地を15 mLコニカルチューブに回収します。
- 混合物を入れた15 mLコニカルチューブを1,650 x g で4°Cで5分間遠心分離します。 その後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- 1 mLの動物由来を含まない組換え酵素( 材料の表を参照)を細胞ペレットに加え、溶液を458 x gでボルテックスし、1.5 mLの微量遠心チューブに移します。チューブを37°Cの水浴中で15分間インキュベートします。
- インキュベーション後、1,650 x g で4°Cで5分間遠心分離します。 その後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- ペレットをBMEに再懸濁します。
注:BMEの量はペレットのサイズに基づいています。再懸濁した細胞を含む25%オルガノイドベース培地(ステップ1.3)を75%BMEに加えることをお勧めします。 - 再懸濁した細胞溶液を40 μLアリコートの6ウェルプレートにプレートします。ウェルあたり最大5つのアリコートをプレートします。すべてのアリコートがメッキされたら、すぐにウェルプレートをインキュベーターに20分間置きます。インキュベーション後、2 mLの完全オルガノイド培地を各ウェルに穏やかに加えます(ステップ1.2)。
5. オルガノイドの凍結融解
- オルガノイドの凍結
- 手順4.1〜4.4から始めます。
- 細胞ペレットを0.5〜1 mLの回収細胞培養凍結培地( 材料の表を参照)に再懸濁し、1 mLを各クライオバイアルに移します。
- 次に、クライオバイアルを-80°Cのイソプロパノール充填容器に最大2週間入れてから、長期保存のために液体窒素タンクに移します13。
- オルガノイドの解凍
- 液体窒素タンクから試料を取り出し、37°Cの水浴で解凍する。
- 解凍したら、15 mLのコニカルチューブに移し、1,650 x g で4°Cで5分間遠心分離します。 遠心分離後、ガラス製パスツールピペットを用いて上清を注意深く吸引する。
- ペレットをBMEに再懸濁します。
注:BMEの量はペレットのサイズに基づいています。再懸濁した細胞を含む25%オルガノイドベース培地(ステップ1.3)を75%BMEに加えることをお勧めします。 - 再懸濁した細胞溶液を40 μLアリコートで6ウェルプレートにプレートします。ウェルごとに最大5つのアリコートを配置します。
- すぐにプレートをインキュベーターに20分間置きます。インキュベーション後、2 mLの完全オルガノイド培地をウェルに穏やかに加えます(ステップ1.2)。
6.オルガノイド組成を評価するためのホルマリン固定パラフィン包埋(FFPE)スライドの埋め込みと生成
- 適切なサイズを確保するためにオルガノイドを少なくとも10日間培養した後、ウェルから完全なオルガノイド培地を取り出し、1 mLの2%パラホルムアルデヒド固定液(PFA)を追加します。室温で5〜10分間インキュベートします。
- インキュベーション後、培養したオルガノイドアリコートを1 mLのPBSで毎回5分間3回洗浄します。
- 各ウェルからPBSを除去し、脱イオンH2O中の温かい2%寒天1mLを各ウェルに加える。寒天を添加するときは、スパチュラを使用して培養オルガノイドアリコートをプレートから持ち上げます。
注:培養オルガノイドアリコートを持ち上げる前に、寒天を硬化させないことが重要です。- 寒天を室温でウェル内で固化させます。
- 小さなへらを使用して、固化した寒天をウェルから解放し、処理14まで70%エタノール中で4°Cで最大48時間カセットに保管します(材料の表を参照)。
- サンプルをパラフィン15に包埋し、スライドを5 μmの厚さに切断し、標準プロトコル15を使用してヘマトキシリンおよびエオジン(H&E、材料表を参照)染色でスライドを染色します。
結果
PDOを生成するために、サンプルを機械的および酵素的に単一細胞懸濁液に消化しました。次に、細胞をBMEに再懸濁し、特別に操作された培地を添加しました(図3)。オルガノイドは通常、10日間の時間枠で樹立され、その後、培養中に個別のオルガノイドを示します(図4)。

図3:オルガノイドに形成された患者コレクションの概略図。患者の組織、腹水、または胸水は、機械的または酵素的に消化されます。次に、単一細胞懸濁液をBMEに播種し、HGSOCに合わせた特殊な増殖培地を使用して培養液を増殖させます。この図の拡大版を表示するには、ここをクリックしてください。
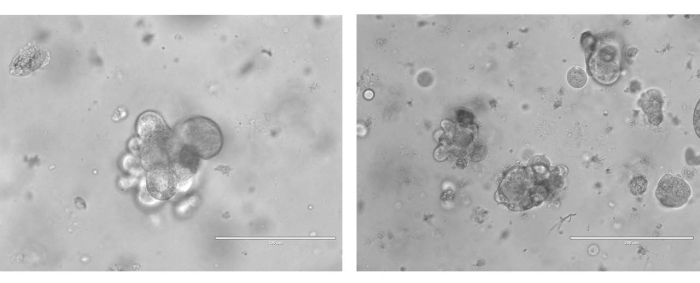
図4:7日間の増殖後の2つのユニークな患者由来の卵巣癌オルガノイドの代表的な画像。 オルガノイド画像は40倍で撮影した。左の画像の明視野スケールバーは100μm、右の画像の明視野スケールバーは200μmです。 この図の拡大版を表示するには、ここをクリックしてください。
提示されたプロトコルから、23のオルガノイドのバイオバンクが産生され、定期的な継代で5か月以上培養されました。起源の腫瘍の臨床的特徴を 表1に示す。腫瘍の大部分は進行期(100%)、高悪性度漿液性癌(92.9%)、および治療ナイーブ(85.7%)でした。
| N = 23 | |
| 年齢(年) | 63.5 ± 9.7 |
| フィグステージ 三 四 ペンディング | 13 (56.5) 9 (39.2) 1 (4.3) |
| 組織学 高悪性度漿液性 癌肉腫 低悪性度漿液性 | 21 (92.9) 1 (7.1) 1 (4.3) |
| BRCA変異 はい いいえ | 1 (4.3) 22 (95.7) |
| 化学療法の以前のライン 0 1-5 ≥5 | 20 (85.7) 0 2 (14.2) |
表1:PDOバイオバンクの特性。 この表には、本プロトコルを使用して生成されたオルガノイドの特定の特性が含まれています。これらの特徴には、年齢、FIGO(国際婦人科産科連盟)の病期、組織学、BRCA(BReast CAncer遺伝子)の突然変異状態、および化学療法の以前のラインが含まれます。
オルガノイド培養は、アガロースに包埋し、H&Eで評価することで評価できます(図5)。
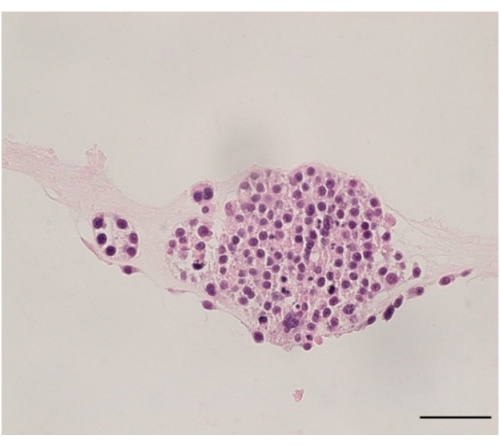
図5:PDOのヘマトキシリンおよびエオジン染色。 患者サンプルから生成された卵巣癌オルガノイドのH&E染色の代表的な画像。画像は40倍で撮影され、スケールバーは50μmです。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
卵巣癌は、診断時の進行段階、および化学療法耐性の一般的な発達のために非常に致命的です。卵巣がん研究における多くの進歩は、がん細胞株とPDXモデルを利用することによってなされてきました。ただし、より代表的で手頃な価格の in vitro モデルが明らかに必要です。PDOは、腫瘍の不均一性、腫瘍微小環境、および原発腫瘍のゲノムおよびトランスクリプトームの特徴を正確に表すことが証明されているため、薬物療法におけるオルガノイドモデルの実装など、さまざまな研究アプローチに理想的な前臨床モデルです16。
ここで説明するプロトコルは、97%の成功率で示されているように、非常に効果的で信頼性があります。現在の議定書には、慎重な注意を払うべき重要なステップがあることを強調することが重要です。まず、組織からオルガノイドを採取する場合、サンプルが完全に均質化されていることを確認することが不可欠です。これには、必要に応じて解離プログラムを複数回実行する必要があります。サンプルが均質でない場合、残りの組織片がオルガノイドの成長を損なう可能性があります。第二に、BMEの作動温度は2〜8°Cであるため、重合を避けるために、この試薬を含むすべてのステップを氷上で実行することが重要です。さらに、BMEで再懸濁してメッキする場合、メッキされたオルガノイドアリコートが不安定になり、プレートから外れるため、気泡を避けることが重要です。最後に、このプロトコルで使用されるBMEは、エンゲルブレス-ホルム-スウォーム(EHS)腫瘍から生成されたため、バッチ間で一貫性のない組成が発生する可能性があります。これらの違いは、オルガノイドの生成と成長に影響を与える可能性があります。著者は代替のBMEオプション17を認識していないため、この制限を克服する具体的な方法はありません。BMEや3D足場の代替材料を確立するには、今後の研究が必要です。上記のすべての考慮事項を考慮すると、これらの方法は、さまざまな実験室の設定や機器に適合させてテストする必要があることを強調することが重要です。
オルガノイドが卵巣がん研究に提供できる進歩にもかかわらず、オルガノイドモデルへの実装には限界があります。オルガノイドの生成と維持は、時間と費用のかかるプロセスです。オルガノイドの成長に必要な時間は、汚染の導入を可能にします。さらに、増殖の変動性は、利用可能な培地の量がオルガノイドの発達に十分であり、汚染が存在しないことを保証するために、絶え間ない監視を必要とします。さらに、オルガノイドの細胞組成は可変である。免疫細胞は最初に存在しますが、通常は2回目の継代を過ぎても持続しません。これは、培地でのサイトカイン補給で克服できるかもしれませんが、現在の研究の範囲外です。間質細胞は継代を通して持続するように見えるが、成分は初期サンプルに大きく依存する18,19。各細胞タイプの正確な細胞成分と持続性をよりよく理解するには、さらなる研究が必要です。複数の化学療法を受けている患者からオルガノイドを生成することは困難であり、問題があります。オルガノイドの生成と発生に対する化学療法の影響を理解するには、さらなる研究が必要である。最後に、私たちの経験では、指定された量の組織、腹水、または胸水から生成されるオルガノイドの数は予測できません。たとえば、2人の異なる患者から収集された同じ量の腫瘍、腹水、または胸水は、異なる量のオルガノイドをもたらします。オルガノイドの生存と生存率に最適な細胞タイプについての洞察を得るために、さらなる研究が行われています。
それにもかかわらず、PDOは、細胞株やPDXモデルと比較して、前臨床研究のためのユニークな機会を提供します。卵巣がんの診断と治療に関しては進歩が見られましたが、まだやるべき重要な作業があり、PDOは卵巣がん研究を進めるために必要な特別なツールです。
開示事項
著者は開示するものは何もありません。
謝辞
このプロトコルを確立する上で、ロン・ボーズ医学博士の指導とバーバラ・ブラクート医学博士の支援に感謝しています。また、セントルイスの産婦人科および婦人科腫瘍学部門のワシントン大学医学部、ワシントン大学の学部長の奨学生プログラム、および生殖科学者開発プログラムに、このプロジェクトを支援してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1% HEPES | Life Technologies | 15630080 | |
| 1% Penicillin-Streptomycin | Fisher Scientific | 30002CI | |
| 1.5 mL Eppendorf Tubes | Genesee Scientific | 14125 | |
| 10 cm Tissue Culture Dish | TPP | 93100 | |
| 10 mL Serological Pipet | |||
| 100 µm Cell Filter | MidSci | 100ICS | |
| 15 mL centrifuge tubes | Corning | 430052 | |
| 2 mL Cryovial | Simport Scientific | T301-2 | |
| 2% Paraformaldehyde Fixative | Sigma-Aldrich | ||
| 37 °C water bath | NEST | 602052 | |
| 3dGRO R-Spondin-1 Conditioned Media Supplement | Millipore Sigma | SCM104 | |
| 6 well plates | TPP | 92006 | |
| 70% Ethanol | Sigma-Aldrich | R31541GA | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM/F12 | ThermoFisher | 12634028 | |
| Agar | Lamda Biotech | C121 | |
| B-27 | Life Technologies | 17504044 | |
| Centrifuge | |||
| Cultrex Type 2 | R&D Systems | 3533-010-02 | basement membrane extract |
| DNase I | New England Bio Labs | M0303S | |
| DNase I Reaction Buffer | New England Bio Labs | M0303S | |
| EGF | PeproTech | AF-100-15 | |
| FBS | Sigma-Aldrich | F2442 | |
| FGF-10 | PeproTech | 100-26 | |
| FGF2 | PeproTech | 100-18B | |
| gentleMACS C Tubes | Miltenyi BioTech | 130-096-334 | |
| gentleMACS Octo Dissociator with Heaters | Miltenyi BioTech | 130-096-427 | We use the manufacturers protocol. |
| GlutaMAX | Life Technologies | 35050061 | dipeptide, L-alanyl-L-glutamine |
| Hematoxylin and Eosin Staining Kit | Fisher Scientific | NC1470670 | |
| Histoplast Paraffin Wax | Fisher Scientific | 22900700 | |
| Microcentrifuge | |||
| Mr. Frosty Freezing Container | Fisher Scientific | 07202363S | |
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| p1000 Pipette with Tips | |||
| p200 Pipette with Tips | |||
| Pasteur Pipettes 9" | Fisher Scientific | 1367820D | |
| PBS | Fisher Scientific | MT21031CM | |
| Pipet Controller | |||
| Prostaglandin E2 | R&D Systems | 2296 | |
| Puromycin | ThermoFisher | A1113802 | |
| Recombinant Murine Noggin | PeproTech | 250-38 | |
| Recovery Cell Culture Freezing Medium | Invitrogen | 12648010 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | |
| ROCK Inhibitor (Y-27632) | R&D Systems | 1254/1 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| T75 Flask | MidSci | TP90076 | |
| Tissue Culture Hood | |||
| Tissue Embedding Cassette | |||
| TrypLE Express | Invitrogen | 12604013 | animal origin-free, recombinant enzyme |
| Type II Collagenase | Life Technologies | 17101015 | |
| Vortex |
参考文献
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Fujii, E., Kato, A., Suzuki, M. Patient-derived xenograft (PDX) models: Characteristics and points to consider for the process of establishment. Journal of Toxicologic Pathology. 33 (3), 153-160 (2020).
- Yang, J., et al. Application of ovarian cancer organoids in precision medicine: Key challenges and current opportunities. Frontiers in Cell and Developmental Biology. 9, 701429 (2021).
- Yang, H., et al. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Madison, B. B., et al. Let-7 represses carcinogenesis and a stem cell phenotype in the intestine via regulation of Hmga2. PLoS Genetics. 11 (8), 1005408 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Murray, E., et al. HER2 and APC mutations promote altered crypt-villus morphology and marked hyperplasia in the intestinal epithelium. Cellular and Molecular Gastroenterology and Hepatology. 12 (3), 1105-1120 (2021).
- Hill, S. J., et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids. Cancer Discovery. 8 (11), 1404-1421 (2018).
- Passarelli, M. C., et al. Leucyl-tRNA synthetase is a tumour suppressor in breast cancer and regulates codon-dependent translation dynamics. Nature Cell Biology. 24 (3), 307-315 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Stumm, M. M., et al. Validation of a postfixation tissue storage and transport medium to preserve histopathology and molecular pathology analyses (total and phosphoactivated proteins, and FISH). American Journal of Clinical Pathology. 137 (3), 429-436 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nanki, Y., et al. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing. Scientific Reports. 10, 12581 (2020).
- Mead, B. E., et al. Screening for modulators of the cellular composition of gut epithelia via organoid models of intestinal stem cell differentiation. Nature Biomedical Engineering. 6 (4), 476-494 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved